-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMultisystémový zánětlivý syndrom u dětí spojený s COVID-19: etiologie, patofyziologie a příznaky
Vyšlo v časopise: Svět praktické medicíny, 3, 2022, č. 2, s. 42-45
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Infekce virem SARS-CoV-2 může u dětí vyústit v multisystémový zánětlivý syndrom. Tento multisystémový zánětlivý syndrom spojený s COVID-19 u dětí a dospívajících se označuje jako PIMS-TS – paediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 (pediatrický zánětlivý multisystémový syndrom časově spojený se SARS-CoV-2) nebo MIS-C – multisystem inflammatory syndrome in children associated with COVID-19 (multisystémový zánětlivý syndrom u dětí související s COVID-19). Jedná se o závažné akutní onemocnění vyskytující se v dětském věku, které se projeví zhruba 2–6 týdnů po expozici novému koronaviru SARS-CoV-2.
Virus SARS-CoV-2 je obalený β-koronavirus s genomem velmi podobným SARS-CoV-1 (80 %) a netopýřímu koronaviru RaTG13 (96,2 %).1 Součástí obalu viru jsou spike (S) glykoprotein, obalové (E) a membránové (M) proteiny. Vazba a vstup do hostitelské buňky jsou zprostředkovány S proteinem. Podjednotka S1 proteinu S obsahuje doménu, která se váže na peptidázovou doménu receptoru angiotenzin konvertujícího enzymu 2 (ACE2)2 (Obr. 1).
Obr. 1. Části koronaviru a vazba na buňku, pyroptóza (inspirováno schématem: Jiang L, Tang K, Levin M, Irfan O, Morris SK, Wilson K, Klein JD, Bhutta ZA. COVID-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis 2020;20(11):e276–e288). 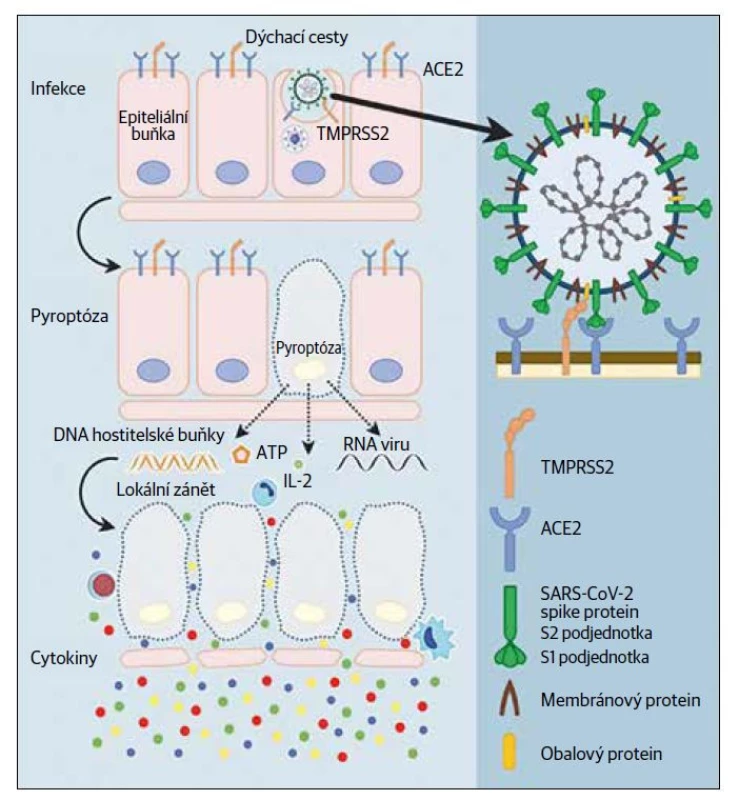
SARS-CoV-2 má oproti příbuzným koronavirům rozdílnou strukturu povrchových proteinů, která umožňuje silnější vazbu na ACE2 receptor,3 a v důsledku toho vyšší účinnost při napadání hostitelských buněk.4 Stejně jako u ostatních koronavirů jsou primárním mechanismem přenosu SARS-CoV-2 infikované respirační kapénky, přičemž k virové infekci dochází přímým nebo nepřímým kontaktem s nosní, spojivkovou nebo ústní sliznicí.5
Etiologie – MIS-C
Epidemiologické studie ukazují SARS-CoV-2 jako pravděpodobnou příčinu nově rozpoznaného MIS-C, ačkoli kauzalita dosud nebyla prokázána. Výskyt většího počtu případů v lokalitách, které byly silně zasaženy COVID-19, jako je Itálie, Spojené království a New York City, podporuje souvislost s infekcí SARS - -CoV-2.6,7 Případy MIS-C se v těchto oblastech v největší míře vyskytovaly přibližně jeden měsíc po nejvyšší incidenci případů COVID-19 u dospělých osob, což úzce souvisí s pravděpodobnou patofyziologií tohoto syndromu. Většina publikovaných případů měla pozitivní sérologické testy na SARS-CoV-2 a méně často pozitivní testy RT-PCR z nazofaryngeálního stěru, což naznačuje spíše postinfekční charakter tohoto syndromu.8
Skutečnost, že MIS-C nebyl dříve popsán v Číně a dalších asijských zemích postižených COVID-19, napovídá, že se mohla v postižených oblastech vyskytovat odlišná varianta viru nebo že některé populace jsou k rozvoji tohoto syndromu náchylnější či geneticky predisponované. 8
Patofyziologie COVID-19 a MIS-C
Patogeneze COVID-19 se stále studuje a mnoho aspektů zůstává nevyjasněných. Z dosud publikovaných studií vyplývá, že se SARS-CoV-2 váže na ACE2 receptor na cílových hostitelských buňkách a k usnadnění této interakce musí být virový spike (S) protein aktivován transmembránovou proteázou 2 (TMPRSS2).9 Aktivní replikace a uvolňování viru v buňkách (především v plicích) poté vede k nespecifickým symptomům. V experimentálním modelu křečka virus způsoboval přechodné poškození buněk v čichovém epitelu vedoucí k čichové dysfunkci, což vysvětluje dočasnou ztrátu chuti a čichu běžně pozorovanou u COVID-19.10
Rozdílná distribuce ACE2 receptorů v různých lidských tkáních může zase vysvětlit typické symptomy pacientů s COVID-19. ACE2 receptory jsou vysoce exprimovány na epiteliálních buňkách orgánů, jako je střevo, plíce, na srdečních kardiomyocytech a na endotelových buňkách krevních cév, což může vysvětlovat gastrointestinální symptomy a kardiovaskulární komplikace. 11–16 Tento receptor byl nalezen také u hematopoetických kmenových buněk – hematopoietic stem cells (HSCs) a endoteliálních progenitorových buněk – endothelial progenitor cells (EPCs), což by mohlo znamenat, že virus může infikovat a poškodit kompartment kmenových buněk.9 ACE2 receptor byl autory studie popsán také u specifické populace velmi malých kmenových buněk, ze kterých se mohou právě HSCs a EPCs diferencovat. V kostní dřeni jsou známy heterogenní populace kmenových buněk mimo HSCs, jež jsou mobilním zdrojem kmenových buněk, ze kterých pochází také tissue-committed stem cells (TCSC), tedy tkáňově vázané (resp. specifické) buňky.17 Ty by mohly být virem SARS - -CoV-2 poškozeny, což by se mohlo v delším časovém horizontu odrazit na regeneraci tkání a orgánů.9
Vazba na ACE2 receptor vede k membránové fúzi a uvolnění virového genomu do hostitelské cytoplazmy. Následně dochází k virové replikaci, vedoucí k sestavení viru, jeho dozrávání a následnému uvolnění.2
Kromě této jednoznačné cesty, kdy virus SARS-CoV-2 přímo infikuje lidské buňky a vede k jejich lýze či poškození, může virus up-regulovat mediátory systému renin-angiotenzin-aldosteron (RAAS), který může následně vést k hyperaktivaci zánětu prostřednictvím inflamazomového komplexu NLRP3 a následně k indukci pyroptózy.9 Pyroptóza představuje programovanou buněčnou smrt, která se liší od apoptózy např. aktivací kaspázy-1 – byla popsána u monocytů, makrofágů a dendritických buněk, jež byly infikovány patogeny. Právě tvorba cytokinů a lýza buňky jsou typické pro pyroptózu18 (viz Obr. 1).
Onemocnění COVID-19 probíhá až ve třech fázích. Časná infekce (fáze I) SARS-CoV-2 se u dětí jeví nejčastěji jako asymptomatická nebo mírně symptomatická. Plicní fáze (fáze II) je závažná u dospělých, ale i ta u mnoha dětí probíhá mírně nebo zcela chybí. Jedno z možných vysvětlení mírnějšího až asymptomatického průběhu je, že děti mají nižší genovou expresi receptoru pro angiotenzin konvertující enzym (ACE2).19,20 Komplexní aktivace imunitního systému (včetně aktivace T-lymfocytů, makrofágů, neutrofilů a plazmatických buněk produkujících mnoho protilátek) ovšem vede u části dětí k imunitní deregulaci a rozvoji zánětlivého syndromu – MIS-C (fáze III – hyperimunní stadium)8 (Obr. 2).
Obr. 2. Třífázový vývoj onemocnění COVID-19 u dětí (inspirováno schématem: Nakra, Natasha & Blumberg, Dean & Herrera-Guerra, Angel & Lakshminrusimha, Satyan. (2020). Multi-system inflammatory syndrome in children (MIS-C) following SARS-CoV-2 infection: Review of clinical presentation, hypothetical pathogenesis, and proposed management. Children. 7. 69. 10.3390/children7070069). 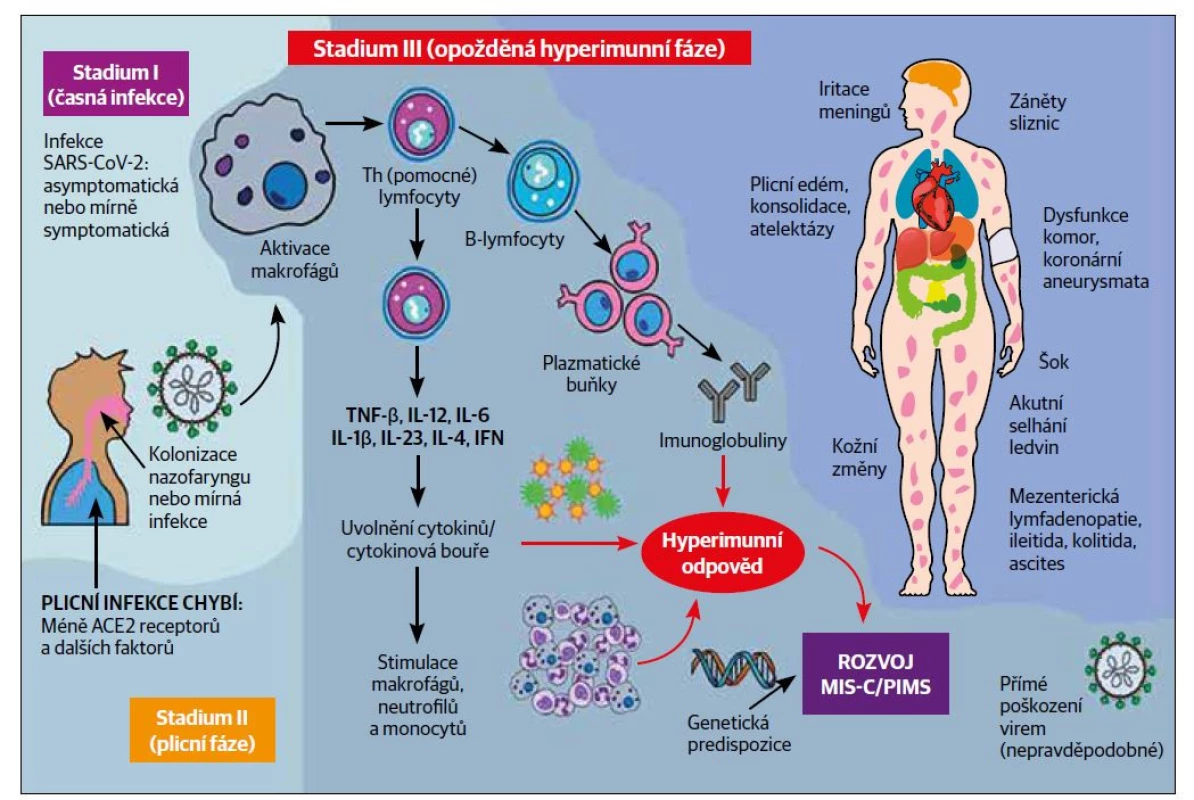
Patofyziologie MIS-C je stále nejasná a potenciálních mechanismů, které se mohou na rozvoji podílet, je mnoho. Do rozvoje se zapojují jak mechanismy specifických, tak nespecifických složek imunitního systému. K významným procesům, které se v různé míře podílí na rozvoji MIS-C, patří tvorba autoprotilátek (příčinou jsou molekulární mimikry viru), produkce imunokomplexů posilujících zánět či aktivace cytotoxických T-lymfocytů.21 Ve studii Gruber a kol.22 byly u pacientů s MIS-C nalezeny neutralizační protilátky proti SARS-CoV-2, které se spojují s aktivací interleukinu 18 (IL-18) a IL-16, myeloidní chemotaxí a aktivací lymfocytů, monocytů a NK-buněk. Ve stejné studii22 také u těchto pacientů uvádějí přítomnost autoprotilátek proti endotelovým, gastrointestinálním a imunitním buňkám.
V rámci aktivace vrozeného imunitního systému hrají klíčovou roli neutrofily. Jedním z jejich funkčních mechanismů je tvorba neutrofilních extracelulárních pastí (NET – neutrophil traps).23 NET vytvářejí mřížkovitou síť z bezbuněčné DNA, histonů a látek uvolněných z neutrofilních granul včetně mikrobicidních proteinů a enzymů. NET se podílejí na rozvoji široké škály zánětlivých a protrombotických stavů, jako je sepse, trombóza a respirační selhání. Tvorba NET neutrofily, nazývaná NETóza, může být stimulována mnoha viry. Ačkoli jejich hlavní funkcí je zachytit virus, virem indukované NET mohou nekontrolovaným způsobem spouštět zánětlivé a imunologické reakce, což vede k přehnané systémové zánětlivé reakci24 podobné zánětlivému stavu pozorovanému u MIS-C. Zvýšené hladiny NET byly prokázány v plazmě pacientů infikovaných SARS-CoV-2 a vyšší koncentrace byla pozorována u pacientů s respiračním selháním.25 Přestože může být NETóza důležitým mechanismem v patofyziologii MIS-C,26 dosud není dostatek studií a podkladů, které by její podíl v patofyziologii tohoto syndromu prokázaly.
Kdy pomýšlet na možný MIS-C v prvním kontaktu?
Na možnost MIS-C můžeme pomýšlet v případě, že se u dítěte ve věkovém rozmezí 0–19 let s nejasnými febriliemi trvajícími tři a více dní přidají alespoň dva z následujících příznaků:
a) Akutní gastrointestinální obtíže (bolest břicha, nauzea, zvracení, průjem).
b) Polymorfní kožní exantém.
c) Otoky dlaní nebo plosek.
d) Deskvamace dlaní nebo plosek.
e) Bilaterální nehnisavá konjunktivitida.
f) Slizniční projevy (cheilitida, malinový jazyk, faryngitida).
g) Lymfadenopatie.
h) Oběhová nestabilita, která může přes tachykardii a hypotenzi přejít až v šokový stav.
i) Známky dysfunkce myokardu, perikarditidy, valvulitidy nebo koronárních abnormalit ve smyslu dilatací nebo aneurysmat, které jsou diagnostikovány podle echokardiografického nálezu nebo laboratorně zvýšenou hladinou troponinu, popř. NT-proBNP, event. MR srdce.
j) Možná koagulopatie při elevaci D-dimerů a prodloužení APTT.
k) Respirační obtíže charakteru kašle, někde vedoucí k desaturaci při rozvoji akutní respirační insuficience.
l) Renální symptomatologie se může projevit oligurií, popř. anurií až po akutní poškození ledvin.
m) Možné jsou neurologické symptomy, které se projevují bolestmi hlavy, poruchami vědomí, křečemi, meningismem.
n) Muskuloskeletální symptomy typu bolestí kloubů a svalů.
Obr. 3. Exantém na vnitřních plochách stehen u pacienta s diagnostikovaným MIS-C. [Foto: archiv autorů]. ![Exantém na vnitřních plochách stehen u pacienta s diagnostikovaným MIS-C. [Foto: archiv
autorů].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b3d36265999258452646c530b332e418.jpg)
K výše uvedeným kritériím se dále přidává elevace zánětlivých parametrů (FW, CRP, prokalcitonin). Zároveň nejsme schopni prokázat zjevnou infekční příčinu. Někdy zjišťujeme COVID-19 v anamnéze, popř. kontakt s COVID-19, ale s ohledem na možný asymptomatický průběh akutního onemocnění a absenci tvorby prokazatelných protilátek nemusí být toto kritérium vždy splněno.
Závěr
V případě podezření na MIS-C je nutné dítě hospitalizovat na pracovišti s pediatrickou jednotkou intenzivní a resuscitační péče.
Poděkování, finanční podpora:
Tento výstup vznikl v rámci projektu Specifického vysokoškolského výzkumu 2020-2022 č. 260 536, v rámci programu Cooperatio, vědní oblasti MED/DIAG. Byl podpořen projektem CZ.02.1.01/0.0 /0.0/16_019/0000787, Centrum výzkumu infekčních onemocnění, uděleným MŠMT ČR, financovaným z EFRR.
MUDr. Jiří Bufka
Ordinace praktického lékaře pro děti a dorost,
Strážnická 36, 323 00 Plzeň 1
MUDr. Lenka Vaňková
Ústav histologie a embryologie, Lékařská fakulta
v Plzni, Univerzita Karlova v Praze
MUDr. Alena Šebková
Ordinace praktického lékaře pro děti a dorost,
Strážnická 36, 323 00 Plzeň 1
MUDr. Věra Křížková, Ph.D.
Ústav histologie a embryologie, Lékařská fakulta
v Plzni, Univerzita Karlova v Praze
Zdroje
1. Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science 2020;367 : 1444–8.
2. Cevik M, Kuppalli K, Kindrachuk J, Peiris M. Virology, transmission, and pathogenesis of SARS-CoV-2. BMJ 2020;371:m3862.
3. Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020;367 : 1260–3.
4. Cevik M, Bamford CGG, Ho A. COVID-19 pandemic-a focused review for clinicians. Clin Microbiol Infect 2020;26 : 842–7.
5. Hui KPY, Cheung MC, Perera RAPM, et al. Tropism, replication competence, and ikate immune responses of the coronavirus SARS-CoV-2 in human respiratory tract and conjunctiva: ananalysis in ex-vivo and in-vitro cultures. Lancet Respir Med 2020;8 : 687–95.
6. Verdoni L, Mazza, A, Gervasoni A, Martelli L, Ruggeri M, Ciuffreda M, Bonanomi E, D’Antiga L. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: An observational cohort study. Lancet 2020;395(10239): 1771–1778.
7. Son MBF, Friedman K. Covid-19: Multisystem inflammatory syndrome in children (MIS-C) clinical features, evalution, and diagnosis. https://www.uptodate.com/ contents/covid-19-multisystem-inflammatory-syndrome-in-children-mis-c-clinical-features-evaluation-and-diagnosis.
8. Nakra NA, Blumberg DA, Herrera-Guerra A, Lakshminrusimha S. Multi-system inflammatory syndrome in children (MIS-C) following SARS-CoV-2 infection: review of clinical presentation, hypothetical pathogenesis, and proposed management. Children (Basel) 2020;7(7):69.
9. Ratajczak MZ, Bujko K, Ciechanowicz A, Sielatycka K, Cymer M, Marlicz W, Kucia M. SARS-CoV-2 entry receptor ACE 2 is expressed on very small CD45 - precursors of hematopoietic and endothelial cells and in response to virus spike protein activates the Nlrp3 inflammasome. Stem Cell Rev Rep 2021;17(1):266–277.
10. Sia SF, Yan LM, Chin AWH, etal. Pathogenesis and transmission of SARS-CoV-2 in golden hamsters. Nature 2020;583 : 834–8.
11. Monteil V, Kwon H, Prado P, et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell 2020;181 : 905–913.e7.
12. Hamming I, Timens W, Bulthuis M, Lely A, Navis GJ, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004;203 : 631–37.
13. de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol 2016;14 : 523–34.
14. Prompetchara E, Ketloy C, Palaga T. Immune responses in COVID-19 and potential vaccines: lessons learned from SARS and MERS epidemic. Asian Pac J Allergy Immunol 2020;39 : 10.
15. Lu R, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 2020;395 : 565–74.
16. Huang C, Wang Y, Li X, et al. Clinical features of patiens infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395 : 497–506.
17. Kucia M, Ratajczak J, Ratajczak MZ. Are bone marrow stem cells plastic or heterogenous – That is the question. Experimental Hematology 2005;33 : 613–623.
18. Juráň S. Mechanizmy buněčné smrti a možnosti jejího studia. 2010. PřF MU Brno, Ústav experimentální biologie, Oddělení genetiky a molekulární biologie. Dostupné z https://is.muni.cz/th/qia26/Mechanizmy_bunecne_smrti.txt.
19. Rawat M, Chandrasekharan P, Hicar MD, Lakshminrusimha S. COVID-19 in newborns and infants-low risk of severe disease: Silver lining or dark cloud? Am J Perinatol 2020;37(8):845–849.
20. Bunyavanich S, Do A, Vicencio A. Nasal gene expression of angiotensin-converting enzyme 2 in children and adults. JAMA 2020;323(23):2427–2429.
21. Jiang L, Tang K, Levin M, Irfan O, Morris SK, Wilson K, Klein JD, Bhutta ZA. COVID-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis 2020;20(11):e276–e288.
22. Gruber C, Patel R, Trachman R, et al. Mapping systemic inflammation and antipody responses in multisystem inflammatory syndrome in children (MIS-C). medRxiv 2020; published online July 6.
23. Fuchs TA, Abed U, Goosmann C, et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol 2007;176 : 231–41.
24. Mozzini C, Girelli D. The role of neutrophil extracellular traps in Covid-19: only a hypothesis or a potential new field of research? Thromb Res 2020;191 : 26–27.
25. Zuo Y, Yalavarthi S, Shi H, et al. Neutrophil extracellular traps in COVID-19. JCI Insight 2020;5 : 138999.
26. Boribong BP, LaSalle TJ, Bartsch YC, et al. Neutrophil profiles of pediatric COVID-19 and multisystem inflammatory syndrome in children. Cell 2020;183(4):968–981.doi: 10.1016/j.cell.2020.09.016.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek Nové registrace v EvropěČlánek Lékový profil: ApexxnarČlánek Léčba úzkosti v první linii
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2022 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Trazodon pohledem praktického lékaře
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Úvodní slovo
- Nové registrace v Evropě
- Horečky nejasného původu u dospělých
- Komentář k článku Horečky nejasného původu u dospělých
- Terminální stadium selhání ledvin: lékařská péče
- Komentář k článku Terminální stadium selhání ledvin: lékařská péče
- Novinky v očkování v ordinaci všeobecného praktického lékaře
- Zapomínáme na prevenci chřipky?
- Lékový profil: Apexxnar
- Multisystémový zánětlivý syndrom u dětí spojený s COVID-19: etiologie, patofyziologie a příznaky
- Úzkostná porucha „všedního dne“ a moderní léčebné strategie
- Diagnostika a terapie demencí – stručný praktický návod
- Červené oko v ordinaci praktického lékaře
- „Bez ordinování bych nebyl pro studenty ani kolegy dostatečně přesvědčivý“
- Nové možnosti v diagnostice a léčbě polyneuropatií
- Kdy odeslat hypertonika do centra pro hypertenzi?
- Moderní možnosti v léčbě plicní hypertenze
- Transthyretinová amyloidóza srdce: mysleme na ni!
- Aterosklerotické postižení karotických tepen – diagnostika a léčba symptomatických a asymptomatických stenóz
- Probiotika v prevenci a léčbě onemocnění u dětí v roce 2022
- Diagnosticky užitečné artefakty v bedside sonografii
- Léčba úzkosti v první linii
- Terapie budoucnosti – základní principy a možnosti využití genové terapie
- Znalostní test: 2 kredity ČLK
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aterosklerotické postižení karotických tepen – diagnostika a léčba symptomatických a asymptomatických stenóz
- Nové možnosti v diagnostice a léčbě polyneuropatií
- Terminální stadium selhání ledvin: lékařská péče
- Červené oko v ordinaci praktického lékaře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



