-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDěláme maximum pro snížení kardiovaskulárního rizika našich pacientů?
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 3, s. 57-62
Kategorie: PR sdělení s kazuistikou
Souhrn
Terapie dyslipidemií a snaha o dosažení cílových hodnot především hladiny LDL-cholesterolu jsou jedním z klíčových kroků v prevenci vzniku a progrese ateromového plátu a následného rozvoje KV příhod. Známé heslo „čím níže, tím lépe“ a ev. novější heslo „čím dříve a níže, tím lépe“ by měl mít na paměti každý lékař, především pokud se jedná o primární prevenci, ještě před rozvojem KVO. Revoluční objev statinů v 80. letech 20. století vnesl do farmakoterapie dyslipidemií zcela nové možnosti – je nutné si uvědomit, že do té doby prakticky nebylo možno dyslipidemii účinně intervenovat. Zavedení statinů (dále inhibitorů ACE a dalších léků) lze svým významem přirovnat k objevu a rozšíření antibiotik – přispělo k podstatnému prodloužení průměrné délky života. Podle platných doporučení Evropské kardiologické společnosti a Evropské společnosti pro aterosklerózu jsou však cílové hodnoty LDL-cholesterolu definovány velmi striktně (podle individuálního rizika), takže k jejich dosažení je třeba kombinační léčby. Na kombinační léčbě dochází ke snižování hladiny LDL-cholesterolu na hodnoty pod 1 mmol/l, což bylo ještě před několika lety nepředstavitelné. Předkládané sdělení obsahuje stručný souhrn nejdůležitějších doporučení k terapii dyslipidemie a je doplněno autentickou kazuistikou.
Jedním z nejdůležitějších rizikových faktorů kardiovaskulárních chorob je cholesterol, zejména LDL-cholesterol (LDL-C). Čím nižší je koncentrace LDL-C, tím nižší je riziko infarktu. Neexistuje žádný nejnižší koncentrační limit LDL-C, pod kterým by kardiovaskulární riziko dále neklesalo. Kromě úrovně hladiny LDL-C je také důležité trvání expozice: vrozená hypercholesterolemie je spojena s vyšším rizikem, než je riziko získané v pozdějším životě. Analogicky k „pack years“ pro kvantifikaci kuřácké anamnézy je proto někdy navrhován termín „LDL cholesterol years“. V důsledku toho, pokud jde o snižování cholesterolu, platí nejen „čím níže, tím lépe“, ale také „čím dříve a níže, tím lépe“. Příčinná souvislost mezi LDL-C a aterosklerotickým kardiovaskulárním onemocněním byla potvrzena prostřednictvím randomizovaných kontrolovaných intervenčních studií, genetických asociačních studií a experimentů na zvířatech.
Od zveřejnění doporučení Evropské kardiologické společnosti (ESC) a Evropské společnosti pro aterosklerózu (EAS) pro léčbu dyslipidemie v roce 2016 se nashromáždilo velké množství nových poznatků, které si vyžádaly aktualizaci těchto doporučení. Stejně jako dříve pracují doporučení s úrovní důkazů (I, IIa, IIb a III) a se silou doporučení (A, B, C).
Co nového přinášejí doporučení z roku 2019?
Ve srovnání s doporučeními z roku 2016 bylo upraveno nebo doplněno mnoho bodů. V terapii mají velký praktický význam nové cílové hodnoty LDL-C (Tab. 1) a nová kritéria pro stratifikaci rizika, například podle věku, přítomnosti diabetu a poruchy renální funkce, jakož i větší zohlednění zobrazovacích metod a lipoproteinů (a) – Lp(a).
Tab. 1. Cílové hodnoty LDL-cholesterolu podle doporučení z roku 2019 
Kategorie rizika
I v nových doporučeních ESC je kardiovaskulární riziko kategorizováno jako nízké, střední, vysoké a velmi vysoké.
• Nízké riziko: běžná, „zdravá“ populace.
• Středně zvýšené riziko: např. mladší pacienti s DM bez dalších rizikových faktorů.
• Vysoké riziko: osoby s vysokými hodnotami cholesterolu nebo krevního tlaku, pacienti s anamnézou DM delší než deset let, osoby s poruchou funkce ledvin.
• Velmi vysoké riziko: pacienti po IM, CMP nebo s komplikacemi diabetu, pokročilá renální insuficience stadia CKD G4 a G5 (eGFR pod 30 ml/min).
• Extrémní riziko: pacienti s opakovanými IM navzdory léčebným opatřením.
Kalkulátory a modifikátory rizik
Prediktivní hodnota kalkulátorů rizik (např. SCORE) je omezená. Z tohoto důvodu by u pacientů s nízkým, a především středním rizikem měla být použita další kritéria pro hodnocení rizika – tzv. modifikátory rizik. Mohou vést k úpravě odhadu rizika, tj. k přeřazení pacientů do vyšší rizikové kategorie. Mezi tyto faktory patří: sociální deprivace (původ mnoha příčin kardiovaskulárních onemocnění); obezita a centrální obezita vyjádřená pomocí indexu tělesné hmotnosti [BMI] nebo měřením obvodu pasu; fyzická nečinnost; psychosociální stres, pozitivní rodinná anamnéza časných KVO (muži < 55 let, ženy < 60 let); chronické imunitně zprostředkované zánětlivé onemocnění; těžké psychiatrické onemocnění; léčba infekce HIV; fibrilace síní; hypertrofie levé komory; chronické selhání ledvin; syndrom obstrukční spánkové apnoe; nealkoholické ztučnění jater (NAFLD); kalciové skóre získané při vyšetření CT koronarografií (Agatsonovo skóre); Lp (a).
Zobrazovací metody
Neinvazivní zobrazování může prokázat přítomnost aterosklerotického vaskulárního poškození. Metodou volby je počítačová tomografie pro detekci koronárních kalcifikací (kalciové – Agatsonovo skóre), jejichž rozsah dobře odpovídá celkovému aterosklerotickému postižení a koreluje s kardiovaskulárními příhodami. Je třeba poznamenat, že kalciové skóre se zvyšuje s dlouhodobou léčbou statiny. To je interpretováno jako známka reparačních procesů v plaku, mj. protože riziko koronárních příhod při léčbě statiny se nezvyšuje, ale klesá. U těchto pacientů je proto výpovědní hodnota kalciového skóre omezená. Sonografie femorálních a karotických tepen pro detekci plaků poskytuje srovnatelně vysokou predikční hodnotu pro kardiovaskulární příhody.
Cílové hodnoty markerů kardiovaskulárního rizika
Nová doporučení ESC jdou nad rámec dřívějších guidelines, pokud jde o cíl snížení LDL-C, neboť důkazy potvrzují, že nízké hodnoty LDL-C jsou spojeny s menším počtem kardiovaskulárních příhod. LDL-C by proto měl být snížen na co nejnižší možnou míru, alespoň u pacientů s velmi vysokým a vysokým rizikem. Geneticky podmíněné nízké hodnoty LDL chrání před kardiovaskulárními příhodami a nejsou spojeny s žádnými dalšími riziky. Dalšími možnými sekundárními cíli jsou non-HDL cholesterol a ApoB. Pro HDL-C a TG neexistují žádné cílové hodnoty odvozené z klinických studií. U HDL-C bylo prokázáno, že nízké hodnoty – i při současně nízkém LDL-C – jsou spojeny se zvýšenou koronární morbiditou. Naproti tomu zvýšení HDL-C nesnižuje progresi aterosklerózy.
Výživa a výživové doplňky
Výživové zvyklosti v prevenci kardiovaskulárních onemocnění hrají zásadní roli. Epidemiologické studie ukazují, že zvýšená konzumace ovoce, zeleniny s nízkým obsahem škrobu, ořechů, luštěnin, ryb, rostlinných olejů, jogurtů a celozrnných cereálií v kombinaci se sníženou konzumací červeného a zpracovaného masa, rafinovaných sacharidů a soli je spojena s nižším výskytem kardiovaskulárních chorob. Náhrada živočišných tuků a pravděpodobně také mléčných výrobků rostlinnými tuky a oleji také snižuje riziko.
Zdravá výživa by měla být preferována od dětství, aby se snížilo celoživotní riziko aterosklerotických kardiovaskulárních onemocnění (ASKVO). Pokud jde o LDL-C, je významné, že i malé snížení (o 10 %) po delší dobu vede k obdobně silnému snížení rizika jako farmakologické snížení LDL-C ve vyšším věku.
Efekty funkčních potravin nebyly dostatečně zdokumentovány, protože příslušné intervenční studie byly příliš krátké na to, aby byly relevantní pro průběh dyslipidemie a oběhových onemocnění. Fytosteroly a ve vodě rozpustná vláknina obsahující beta-glukan (oves, ječmen) inhibují absorpci cholesterolu ve střevě, takže plazmatické hladiny celkového cholesterolu a LDL-C mírně klesají. Červená rýže blokuje HMG-CoA reduktázu (podobně jako statiny), což způsobuje pokles hladiny LDL-C.
Podle observačních studií konzumace ryb a některých rostlinných potravin snižuje kardiovaskulární úmrtnost díky obsahu omega-3 mastných kyselin, ale nemá žádný vliv na lipidový profil v plazmě. Farmakologické dávky omega-3 mastných kyselin s dlouhým řetězcem, 2–3 g/den, snižují hladinu TG o 30 %, ještě vyšší dávky však zvyšují hladinu LDL-C. V poslední době bylo také u pacientů se zvýšenými hodnotami TG prokázáno významné snížení ischemických příhod při použití vysokých dávek kyseliny eikosapentaenové (ikosapent-ethyl).
Farmakoterapie
Ke snížení LDL-C existují tři třídy látek: statiny, látky blokující absorpci cholesterolu a inhibitory PCSK9.
K dosažení terapeutického cíle podle kategorie rizika se používá vysoce účinný statin v nejvyšší tolerované dávce (třída důkazů I, úroveň doporučení A). Není-li terapeutického cíle dosaženo i přes maximální dávku statinu, doporučuje se kombinace s ezetimibem, který blokuje absorpci cholesterolu ve střevě (třída důkazů I, síla doporučení B).
Pokud není cíl léčby splněn v primární prevenci u pacientů s velmi vysokým rizikem – ale bez familiární hypercholesterolemie – navzdory maximální dávce statinu plus ezetimibu, lze uvažovat o kombinaci s inhibitorem PCSK9 (třída důkazů IIb, úroveň doporučení C).
Pokud při sekundární prevenci nedojde k dosažení terapeutického cíle u pacientů s velmi vysokým rizikem navzdory maximální dávce statinu plus ezetimibu, je indikována kombinace s inhibitorem PCSK9 (třída důkazů I, úroveň doporučení A).
Pokud není dosaženo cílových hodnot u pacientů s familární hypercholesterolemií s velmi vysokým rizikem (tj. existujícím kardiovaskulárním onemocněním nebo jiným hlavním rizikovým faktorem) navzdory maximální dávce statinu plus ezetimibu, je indikována kombinace s PCSK9 inhibitorem (třída důkazů I, úroveň doporučení C).
V případě nesnášenlivosti statinu v jakékoli dávce (i po opakovaném podání) je třeba zvážit ezetimib (třída důkazů IIa, úroveň doporučení C). Kromě ezetimibu lze uvažovat o inhibitoru PCSK9 (třída důkazů IIb, úroveň doporučení C).
Statiny
Statiny snižují LDL-C v závislosti na dávce. Při intenzivní statinové terapii je dosaženo snížení LDL-C o 50 %, zatímco méně intenzivní léčba vede k 30–50% snížení LDL-C. Špatná odpověď může být způsobena horší compliance a také genetickou predispozicí.
Statiny snižují TG o 10–20 % a HDL-C zvyšují jen mírně (1–10 %). Podle metaanalýz snižuje pokles LDL-C o 1 mmol/l riziko aterosklerotických kardiovaskulárních chorob přibližně o 22 % během pěti let.
Statiny mohou zvyšovat riziko hyperglykemie a manifestace DM 2. typu. Je to účinek závislý na dávce. Je více vyjádřen u silných statinů a u starších pacientů, zejména pokud již mají rizikové faktory pro DM, jako jsou obezita a inzulinová rezistence. Statiny však snižují riziko ASKVO u diabetických pacientů ve stejném rozsahu jako u nediabetických pacientů. Celkově převažuje benefit ze snížení LDL-C nad malým zvýšením rizika DM.
Protože většina statinů je metabolizována prostřednictvím různých jaterních cytochromů, lze očekávat interakce s léky, které podléhají stejnému metabolismu. Klinicky významné jsou např. interakce atorvastatinu s klaritromycinem. V současnosti je k dispozici více kombinací statinu s ezetimibem, což vede ke zvýšení compliance nemocných.
Inhibitory absorpce cholesterolu
Ezetimib působí tak, že blokuje absorpci cholesterolu z trávicího traktu, což snižuje hladinu LDL-C v plazmě. Ezetimib v dávce 10 mg/den snižuje LDL-C o 18 % ve srovnání s placebem. HDL-C je mírně zvýšen (3 %) a TG je snížen o 8 %. Pokud je k probíhající léčbě statiny přidán ezetimib dochází k synergnímu účinku. Tato duální inhibice cholesterolu je účinnější než monoterapie jednotlivými léky (Obr. 1). Studie IMPROVE-IT ukázala, že kombinace ezetimibu se statiny snížila četnost příhod více než monoterapie statiny, aniž by zvýšila četnost nežádoucích účinků. Minimalizovat počet tablet je důležité – u pacientů s KV onemocněním nebo jeho vysokým rizikem lze při použití fixní kombinace zlepšit adherenci proti obvyklé péči o 44 %!
Obr. 1. Duální inhibice cholesterolu ezetimibem a statinem ukázaná na příkladu rosuvastatinu.
EZE – ezetimib; LDL-C – low density lipoprotein cholesterol; RSV – rosuvastatin
Ezetimib v monoterapii snižuje LDL-C o 18 %, rosuvastatin v monoterapii o 43 %, oba léky podané současně o 60 %.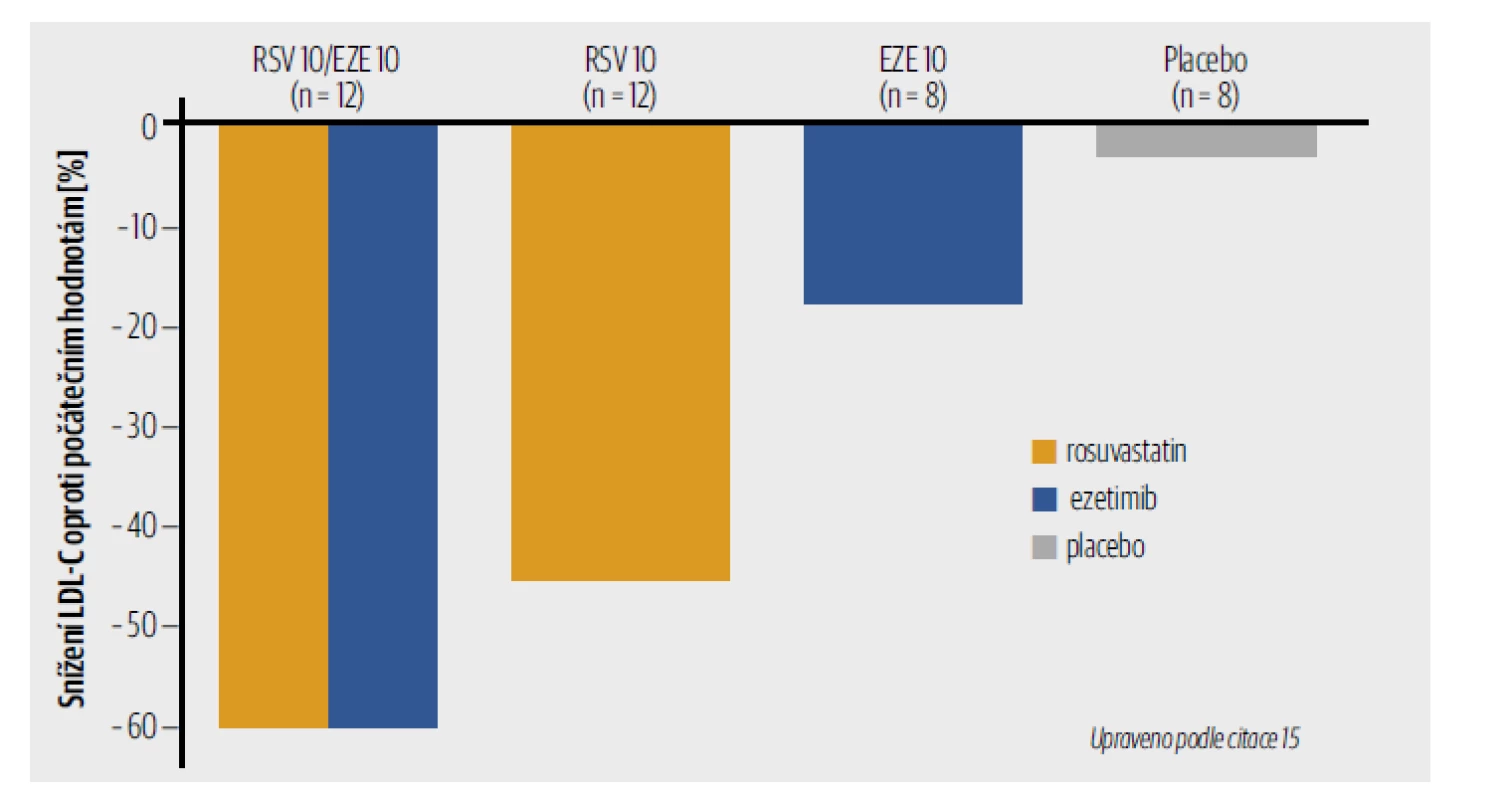
Inhibitory PCSK9
Evolokumab a alirokumab jsou lidské monoklonální protilátky, které inhibují proprotein konvertázu subtilisin/kexin typu 9 (PCSK9). Zvýšené koncentrace PCSK9 snižují expresi LDL receptorů, což vede ke zvýšení LDL-C v plazmě v důsledku snížené vazby a absorpce v jaterních buňkách. Naopak pokles PCSK9 vede ke snížení hladiny LDL-C. Statiny zvyšují koncentraci PCSK9 a tím omezují hladinu LDL-C.
Oba anti-PCSK9 inhibitory způsobují významné snížení počáteční hodnoty LDL-C v průměru o 60 % – jako monoterapie nebo kombinovaná léčba se statiny či jinými léky snižujícími lipidy. V kombinaci s maximálně dávkovanými statiny snížily inhibitory PCSK9 LDL-C o 46–73 % více než placebo a o 30 % více než ezetimib. U pacientů, kterým nelze předepsat statiny, snižuje inhibice PCSK9 koncentrace LDL-C společně s ezetimibem. Inhibitory PCSK9 také účinně snižují LDL-C u pacientů s vysokým kardiovaskulárním rizikem, včetně pacientů s diabetem.
TG jsou také snižovány inhibitory PCSK9 (o 26 %) a HDL a ApoA-I jsou mírně zvýšeny (o 9 a 4 %). Na rozdíl od statinů inhibitory PCSK9 také snižují koncentraci Lp (a) přibližně o 25 %. Je zajímavé, že post-hoc analýzy studií sledovaných parametrů zjistily, že pacienti se zvýšeným Lp (a) mají z léčby inhibitory PCSK9 prospěch. Není však jasné, zda je tento účinek způsoben snížením Lp (a), nebo vyšším rizikem pacientů s vysokým Lp (a).
Dvě velké cílové studie ukazují účinek inhibitorů PCSK9 na kardiovaskulární riziko: U studijních pacientů (studie FOURIER: stabilní onemocnění koronárních tepen, ICHDK, cévní mozková příhoda; studie ODYSSEY OUTCOMES: nedávný akutní koronární syndrom) bylo riziko sníženo o 15–20 %, a to navzdory relativně krátkému sledování s mediánem 2 roky, respektive 3 roky.
Inhibitory PCSK9 se pravidelně podávají subkutánně dva nebo čtyři týdny. Pacienti někdy udávají svědění v místě vpichu a příznaky podobné chřipce. Počáteční zprávy o neurokognitivních účincích byly vyvráceny ve speciálně navržené studii. Podobně jako statiny mohou i inhibitory PCSK9 zvyšovat riziko DM. Jsou však nutné další dlouhodobé studie o inhibitorech PCSK9.
Další léčiva
Kromě těchto tří tříd látek uvedených v nejnovějších doporučeních ESC se používají další léčiva.
Fibráty jsou agonisty receptoru α (PPAR-α) aktivovaného proliferátorem peroxisomu. Umožní snížit hodnoty TG přibližně o 50 %; LDL-C se sníží o ≥ 20 %, HDL-C se zvýší o ≤ 20 %. V přítomnosti DM 2. typu se sníží nárůst HDL a pokles TG (přibližně 5 %, respektive přibližně 20 %). V kombinaci se statiny nevykazoval fenofibrát žádný další přínos. Post-hoc analýzy zjistily, že pacienti s HDL-C < 0,9 mmol/l a TG > 2,3 mmol/l profitují z léčby fibrátem, a to jak v monoterapii, tak v kombinaci se statiny.
Omega-3 mastné kyseliny jsou schopné snižovat sérové lipidy a lipoproteiny – zejména VLDL. TG jsou sníženy až o 45 % v závislosti na dávce. Výsledky studií, které zkoumaly vliv na kardiovaskulární onemocnění, nejsou jednoznačné. Ikosapent-ethyl (kyselina eikosapentaenová v čisté formě s vysokým dávkováním) dokázal v rozsáhlé studii snížit kardiovaskulární příhody.
Kazuistika
Čtyřiapadesátiletý pacient, kuřák, hypertonik, diabetik 2. typu (léčba perorálními antidiabetiky) s kombinovanou hyperlipidemií, byl přijat na naše oddělení překladem ze spádového kardiocentra k poinfarktové rehabilitaci po rozsáhlém infarktu myokardu (STEMI) přední stěny léčeném primární perkutánní koronární intervencí (pPCI) kmene a ramus interventricularis anterior (RIA). U nemocného byla zjištěna snížená funkce levé komory s ejekční frakcí (EF) pod 30 %, mnohočetným postižením věnčitých tepen (MVD) se stenózou kmene a RIA při chronickém uzávěru arteria coronaria dextra (ACD). Farmakologická anamnéza před STEMI zahrnovala metformin, fenofibrát a losartan. Pro nemocného byl rozsah nálezu značným překvapením, protože byl přesvědčen, že „má cholesterol pod kontrolou“, hypolipidemika (fenofibrát) užíval již asi 16 let. Při poslední preventivní prohlídce u praktického lékaře byl zjištěn LDL-cholesterol 3,1 mmol/l, TG 1,7 mmol/l, HbA1C 72 mmol/mol, eGFR 62 ml/min, další hodnoty byly bez podstatných pozoruhodností. Při propuštění z našeho pracoviště byla upravena hypolipidemická te ra pie – rosuvastatin 40 mg s vizí další titrace a zároveň byla podstatně revidována další medikace (mj. přidán dapagliflozin, sakubitril/valsartan aj.). Při kontrole za tři měsíce ve specializované ambulanci byl přidán ezetimib – oba přípravky byly v dalším průběhu nahrazeny fixní kombinací rosuvastatin/ezetimib 40/10 mg, na níž se podařilo dosáhnout LDL-cholesterolu 1,4 mmol/l.
Jak by měl být tento pacient nyní léčen podle doporučení ESC?
U pacientů s akutním koronárním syndromem (ACS) je zvýšené riziko opakujících se kardiovaskulárních příhod. U těchto pacientů je úprava lipidogramu součástí souboru opatření k ovlivnění celkového rizika. Hladiny LDL-C mají tendenci klesat v prvních několika dnech po akutní koronární příhodě, proto by měla být hladina stanovena co nejdříve, nejlépe v počátečním vzorku krve, ve kterém je stanoven troponin. Toto vyšetření by se mělo opakovat o 4–6 týdnů později ke kontrole, zda bylo cíle dosaženo.
Důraz je kladen na rychlé snížení LDL-C: ESC doporučuje zahájit léčbu statiny s vysokou intenzitou co nejdříve po události u všech pacientů s ACS dosud neléčených statiny bez kontraindikací k jejich podávání, bez ohledu na počáteční hodnotu LDL-C. I zde má být cílem 50% snížení LDL-C a současně hodnota nižší než 1,4 mmol/l. Pokud dojde k recidivě infarktu myokardu do dvou let, mělo by se zvážit dokonce snížení LDL-C pod 1 mmol/l.
Pokud cíle léčby s maximální tolerovanou dávkou statinu nebude dosaženo během 4–6 týdnů, měla by být použita kombinace s ezetimibem. Pokud cílových hodnot nebude dosaženo ani po dalších 4–6 týdnech, a to ani v kombinaci, doporučuje se přidání inhibitoru PCSK9.
Poučení pro praxi
Uvedená kazuistika je autentická a nakonec nemá právní dohru, nicméně lze očekávat, že poučení nemocní se budou stále častěji domáhat přezkoumání dosavadní léčby s forenzními důsledky z toho vyplývajícími.
Lze předpokládat, že pokud by u nemocného bylo reálně zhodnoceno kardiovaskulární riziko při preventivních prohlídkách a na jednotlivé parametry bylo správně reagováno (např. nahrazením fibrátu statinem a při nedostatečné efektivitě třeba nakonec použitou kombinací rosuvastatin/ezetimib, která u nemocného vedla k dosažení cílových hodnot LDL), byl by vývoj jeho stonání zcela jiný.
MUDr. Markéta Votavová
Interní oddělení, Klatovská nemocnice a.s.
MUDr. Jan Vachek
Klinika nefrologie 1. LF UK a VFN v Praze
Interní oddělení Klatovské nemocnice a.s.
Zdroje
1. Baber U, Mehran R, Sartori S, Schoos MM, Sillesen H, Muntendam P, et al. Prevalence, impact, and predictive value of detecting subclinical coronary and carotid atherosclerosis in asymptomatic adults: the BioImage study. J Am Coll Cardiol. 2015;65(11):1065–74. doi: https://doi.org/10.1016/j.jacc.2015.01.017.
2. Baca AM, Warnick GR. Estimation of LDL-associated apolipoprotein B from measurements of triglycerides and total apolipoprotein B. Clin Chem 2008;54(5):907–10. doi: https://doi.org/10.1373/clinchem.2007.100941. PubMed.
3. Castellano JM, et al. A polypill strategy to improve global secondary cardiovascular prevention: from concept to reality. J Am Coll Cardiol 2014;64 : 613–621.
4. Collins R, Reith C, Emberson J, Armitage J, Baigent C, Blackwell L, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016 19;388(10059):2532–61.
5. Franssen R, Vergeer M, Stroes ES, Kastelein JJ. Combination statin-fibrate therapy: safety aspects. Diabetes Obes Metab 2009;11(2):89–94. doi: https://doi.org/10.1111/j.1463-1326.2008.00917.x.
6. Garg PK, Jorgensen NW, McClelland RL, Leigh JA, Greenland P, Blaha MJ, et al. Use of coronary artery calcium testing to improve coronary heart disease risk assessment in a lung cancer screening population: The Multi-Ethnic Study of Atherosclerosis (MESA). J Cardiovasc Comput Tomogr 2018;12(6):493–9. doi: https://doi.org/10.1016/j.jcct.2018.10.001.
7. Ginsberg HN, Elam MB, Lovato LC, Crouse JR, 3rd, Leiter LA, Linz P, et al., ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010;362(17):1563–74. doi: https://doi.org/10.1056/NEJMoa1001282.
8. Henein M, Granåsen G, Wiklund U, Schmermund A, Guerci A, Erbel R, et al. High dose and long-term statin therapy accelerate coronary artery calcification. Int J Cardiol 2015;184(184):581–6. doi: https://doi.org/10.1016/j.ijcard.2015.02.072. PubMed.
9. https://www.escardio.org/static_file/Escardio/Subspecialty/EACPR/Documents/score-charts.pdf.
10. https://www.heartscore.org.
11. Huffman MD. The polypill: from promise to pragmatism. PLOS Med. 2015;12(8):e1001862.
12. Chapman MJ, Ginsberg HN, Amarenco P, Andreotti F, Borén J, Catapano AL, et al.; European Atherosclerosis Society Consensus Panel. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J 2011;32(11):1345–61. doi: https://doi.org/10.1093/eurheartj/ehr112. PubMed.
13. Jørgensen AB, Frikke-Schmidt R, West AS, Grande P, Nordestgaard BG, Tybjærg-Hansen A. Genetically elevated non-fasting triglycerides and calculated remnant cholesterol as causal risk factors for myocardial infarction. Eur Heart J 2013;34(24):1826–33. doi: https://doi.org/10.1093/eurheartj/ehs431. PubMed.
14. Kolovou GD, Mikhailidis DP, Kovar J, Lairon D, Nordestgaard BG, Ooi TC, et al. Asse ssment and clinical relevance of non-fasting and postprandial triglycerides: an expert panel statement. Curr Vasc Pharmacol 2011;9(3):258–70. doi: https://doi.org/10.2174/157016111795495549.
15. Kosoglou T, Statkevich P, Yang B, et al. Pharmacodynamic interaction between ezetimibe and rosuvastatin. Curr Med Res Opin 2004;20 : 1185–1195.
16. Langlois MR, Chapman MJ, Cobbaert C, Mora S, Remaley AT, Ros E, et al.; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) Joint Consensus Initiative. Quantifying Atherogenic Lipoproteins: Current and future challenges in the era of personalized medicine and very low concentrations of LDL cholesterol. A Consensus Statement from EAS and EFLM. Clin Chem 2018;64(7):1006–33. doi: https://doi.org/10.1373/clinchem.2018.287037. PubMed.
17. Manson JE, Cook NR, Lee IM, Christen W, Bassuk SS, Mora S, et al. Marine n-3 fatty acids and prevention of cardiovascular disease and cancer. ESPE, 2019.
18. Mihaylova B, Emberson J, Blackwell L, Keech A, Simes J, Barnes EH, et al., Cholesterol Treatment Trialists’ (CTT) Collaborators. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012;380(9841):581–90. doi: https://doi.org/10.1016/S0140-6736(12)60367-5.
19. Mortensen MB, Falk E, Li D, Nasir K, Blaha MJ, Sandfort V, et al. Statin trials, cardiovascular events, and coronary artery calcification: implications for a trial-based approach to statin therapy in MESA. JACC Cardiovasc Imaging 2018;11(2 Pt 1):221–30. doi: https://doi.org/10.1016/j.jcmg.2017.01.029. PubMed.
20. Nielsen SF, Nordestgaard BG. Statin use before diabetes diagnosis and risk of microvascular disease: a nationwide nested matched study. Lancet Diabetes Endocrinol 2014;2(11):894–900. doi: https://doi.org/10.1016/S2213-8587(14)70173-1. PubMed.
21. Pandor A, Ara RM, Tumur I, Wilkinson AJ, Paisley S, Duenas A, et al. Ezetimibe monotherapy for cholesterol lowering in 2,722 people: systematic review and meta-analysis of randomized controlled trials. J Intern Med 2009;265(5):568–80. doi: https://doi.org/10.1111/j.1365-2796.2008.02062.x.
22. Raal FJ, Giugliano RP, Sabatine MS, Koren MJ, Langslet G, Bays H, et al. Reduction in lipoprotein(a) with PCSK9 monoclonal antibody evolocumab (AMG 145): a pooled analysis of more than 1,300 patients in 4 phase II trials. J Am Coll Cardiol 2014;63(13):1278–88. doi: https://doi.org/10.1016/j.jacc.2014.01.006.
23. Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, et al.; FOURIER Steering Committee and Investigators. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017;376(18):1713–22. doi: https://doi.org/10.1056/NEJMoa1615664.
24. Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J, et al.; Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372(16):1500–9. doi: https://doi.org/10.1056/NEJMoa1500858.
25. Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, et al.; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med 2018;379(22):2097–107. doi: https://doi.org/10.1056/NEJMoa1801174.
26. Waters DD, Ho JE, Boekholdt SM, DeMicco DA, Kastelein JJ, Messig M, et al. Cardiovascular event reduction versus new-onset diabetes during atorvastatin therapy: effect of baseline risk factors for diabetes. J Am Coll Cardiol 2013;61(2):148–52. doi: https://doi.org/10.1016/j.jacc.2012.09.042. PubMed.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2021 Číslo 3- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
-
Všechny články tohoto čísla
- Úvodní slovo
- Profesor Eduard Zvěřina: Chováme se jako viry
- MUDr. Milan Černek: Viatris vstupuje na český trh: naším cílem jsou dostupná a kvalitní léčiva
- Horké aktuality v registracích EMA
- Telemedicína – vyšetření muskuloskeletálních problémů
- Komentář k článku Telemedicína – vyšetření muskuloskeletálních problémů
- Glosa k problematice telemedicíny V některých oborech je osobní kontakt s pacientem nenahraditelný
- Refeeding syndrom u pacientů vyššího věku
- Komentář k článku Refeeding syndrom u pacientů vyššího věku
- Kardiovaskulární riziko u geriatrických pacientů: jak ho stanovit správně?
- Adherence a perzistence k léčbě
- Léčba hypertenze komplikované srdečním selháním
- Úskalí a přínosy měření krevního tlaku v ordinaci a mimo ordinaci
- Profesorka Hana Rosolová: Největším rivalem cholesterolu je metabolický syndrom
- Fixní kombinace v léčbě hypertenze a dyslipidemie – schůdná cesta k redukci kardiovaskulárního rizika u diabetu
- Děláme maximum pro snížení kardiovaskulárního rizika našich pacientů?
- Inklisiran: inovativní přístup v léčbě dyslipidemie
- Kardiovaskulární riziko u onemocnění ledvin – pohled nefrologa
- Hepatorenální syndrom
- Aktuální pohled na potravinovou pyramidu
- Humánní biometeorologie v každodenní praxi
- Diferenciální diagnostika nejčastějších změn v krevním obraze
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika nejčastějších změn v krevním obraze
- MUDr. Milan Černek: Viatris vstupuje na český trh: naším cílem jsou dostupná a kvalitní léčiva
- Inklisiran: inovativní přístup v léčbě dyslipidemie
- Aktuální pohled na potravinovou pyramidu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



