-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRefeeding syndrom u pacientů vyššího věku
Autoři: Prof. Wirth Rainer; Dr. Pourhassan Maryam; Dr. Janssen Gregor
Působiště autorů: Bochum, Herne ; Marien-Hospital Herne ; Universitätsklinikum der Ruhr-Universität ; Klinik für Altersmedizin und Frührehabilitation
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 3, s. 28-31
Kategorie: Medicína ve světě: překladový článek s komentáři
Souhrn
Za článkem následuje komentář
Pojem refeeding syndrom popisuje vážnou metabolickou abnormalitu vznikající v důsledku přesunu elektrolytů a mikroživin po realimentaci podvyživených pacientů. Tato situace může nastat i po období postu či hladovění. Příčinou vzniku tohoto syndromu je nedostatek převážně intracelulárních iontů jako fosfátů, kalia a magnezia, způsobený hlavně jejich transcelulárním přesunem. Dominující bývá zejména nedostatek fosfátu. Obrazem refeeding syndromu může být také nedostatek thiaminu, a to buď samostatně, nebo ve spojení právě s poruchami elektrolytové rovnováhy.
Syndrom se může projevit jak po zahájení orální, enterální, tak i parenterální výživy. To znamená, že se neobjevuje jen při zavádění umělé výživy. Syndrom se typicky objevuje několik málo dní po zahájení výživové terapie a může zapříčinit závažné až smrtelné poškození orgánů a poruchy srdečního rytmu.
Vinou časté neznalosti tohoto syndromu a kvůli nespecifické symptomatologii bývá bohužel poddiagnostikován.1 U pacientů vyššího věku je vysoká prevalence malnutrice. Z tohoto důvodu se u nich projevuje refeeding syndrom celkem často. A právě na pozadí jejich polymorbidity bývá těžké syndrom rozpoznat. Pokud budeme mít syndrom neustále na paměti, budeme znát jeho rizikové faktory a patofyziologii, pak je nejen terapeuticky zvládnutelný, ale správnými postupy mu můžeme dokonce i předejít. Jsou sice dostupná data 2, 3 o prevalenci rizikových faktorů u hospitalizovaných pacientů vyššího věku, ale bohužel nemáme žádná spolehlivá data o výskytu refeeding syndromu u pacientů této věkové skupiny.
Patofyziologie
Při nedostatečném příjmu potravy klesá glykemie, snižuje se sekrece inzul inu a stoupá produkce antagonisty inzulinu – glukagonu, katecholaminů a kortizolu. Tyto mechanismy podporují glykogenolýzu. Zásoby glykogenu se však rychle vyčerpají a tělo zahájí glukoneogenezi z glykogenních aminokyselin. Tím je aktivován katabolismus bílkovin. Díky spuštěné lipolýze v těle proudí mastné kyseliny, které se přeměňují na ketolátky a ty umí mozek a svaly využít jako další zdroj energie. Kromě toho v rámci úspory energie tělo snižuje termogenezi a bazální metabolismus (Obr. 1).
Obr. 1. Patofyziologie refeeding syndromu. 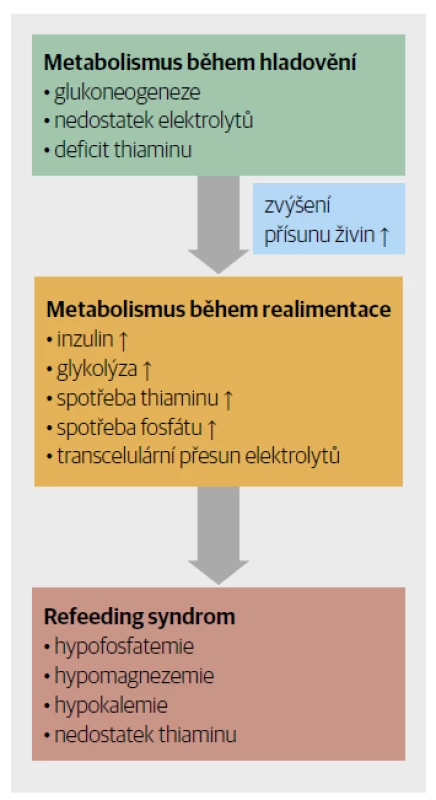
I přes snížený příjem a neustálé ztráty jsou sérové hladiny draslíku, hořčíku a fosfátů udržovány v normě dlouhou dobu. A to díky homeostatickým mechanismům na úkor snižování koncentrace iontů intracelulárně. Již v tento okamžik je v organismu nedostatek minerálů, ale jelikož jsou hladiny v séru stále normální, nelze jej detekovat. Okultní intracelulární nedostatek elektrolytů však po obnovení jejich přísunu do plazmy vede k jejich rychlému přesunu do buněk, který je navíc umocněn kvůli zvýšené hladině inzulinu. Proto náhle dojde k poklesu sérových (extracelulárních) hodnot mineralogramu. Hlavně v této redistribuční fázi realimentace je nutné nedostatek elektrolytů v séru monitorovat a suplementovat.
Fenomén refeeding syndromu se svými fatálními následky je znám přibližně od druhé světové války. U lidí, kteří byli v zajetí a byl u nich po propuštění obnoven příjem potravy, byla stále o 20 % vyšší letalita.4 Patofyziologie refeeding syndromu byla však dobře pochopena až v posledních letech. Hlavním dobře zdokumentovaným příkladem rozvoje refeeding syndromu je 44denní půst umělce Davida Blaineho.5
Klinický význam
I při nedostatečném příjmu jsou sérové hladiny kalia, magnezia a fosfátů díky homeostatickým mechanismům dlouho udržovány v normě na úkor jejich intracelulárních koncentrací. Okultní pokles intracelulární koncentrace iontů se projeví po obnovení příjmu výživy, kdy dojde, kvůli vyššímu množství iontů v séru v kombinaci se zvýšeným vyplavováním inzulinu, k prudkému přesunu elektrolytů do buňky, a tedy ke snížení jejich extracelulárních hladin a tomu odpovídající symptomatologii.
Rizikové faktory
Díky znalosti patofyziologie syndromu lze snadno odvodit hlavní rizikový faktor vzniku refeeding syndromu, a to podvýživu s úbytkem váhy. Podle Crooka a kol. mají pacienti, kteří během několika málo měsíců ztratili více než 10 % svojí váhy nebo nejedli 7–10 dní, významně vyšší riziko vzniku refeeding syndromu.6 Dalšími rizikovými faktory jsou nízká tělesná hmotnost, alkoholismus, chemoterapie nebo dlouhodobá terapie diuretiky či antacidy. Na základě těchto rizikových faktorů můžeme vytipovat rizikové skupiny pacientů. Vedle geriatrických pacientů byl syndrom pozorován i u pacientů obézních po masivním váhovém úbytku například po bariatrické operaci, u pacientů s mentální anorexií, onkologických či jinak vážně nemocných (např. pacienti na jednotkách intenzivní péče) nebo též u pacientů po chirurgických zákrocích.
Pourhassan a kol. zkoumali prevalenci rizikových faktorů3 u hospitalizovaných geriatrických pacientů a zjistili, že až 70 % geriatrických pacientů je podvyživených.2
Z patofyziologie lze také odvodit, že dalšími rizikovými faktory mohou být preexistující hypofosfatemie, hypomagnezemie a hypokalemie. V poslední zmíněné studii byly tyto deficity iontů nalezeny u 15 %, 17 % a 11 % geriatrických pacientů již při přijetí do nemocnice.
Pro hypofosfatemii vzniklou po zahájení realimentace se používá termín refeeding hypofosfatemie. Tento termín se však nepoužívá pouze ve spojení se samotným refeeding syndromem a jeho symptomatikou. Rychlý pokles sérové hladiny fosfátů je popisován například i u onkologických pacientů, a to až u 25 % z těch, kteří byli zařazeni do studie.7
Klinický význam
Mezi hlavní rizikové faktory patří úbytek váhy, nedostatečná výživa, nízká tělesná hmotnost, alkoholismus, chemoterapie a léčba diuretiky či antacidy.
Epidemiologie
Nemáme k dispozici reprezentativní data o prevalenci refeeding syndromu. Důvodem je malý počet studií, které se tímto tématem zabývaly. Ti, kteří o refeeding syndromu vědí, mu předcházejí anebo ho začnou včas léčit. Dalším důvodem nedostatku dat o prevalenci může být i to, že dosud nemáme konzistentní definici tohoto syndromu. Někteří autoři popisují pouze hypofosfatemii jako takovou bez spojitosti s refeeding syndromem. Jiní autoři považují za refeeding syndrom pouze situaci, kdy k dysbalanci elektrolytů přistupuje i odpovídající symptomatologie. Tato definice se autorům článků zdá rozumná, jelikož jinak popisujeme pouze laboratorní nálezy. Bez klinických symptomů bychom neměli mluvit o refeeding syndromu, ale o refeeding hypofosfatemii. Zveřejněno bylo pouze několik kazuistik. Převažují však případy dětí, pacientů s mentální anorexií, pacientů na jednotkách intenzivní péče, geriatrických pacientů a též pacientů s kachexií související s maligním onemocněním či alkoholismem.4 V jedné studii, která se zabývala realimentací geriatrických pacientů, se prokázala signifikantní hypofosfatemie, která by mohla vést k refeeding syndromu, u 25 % pacientů.8 V jiné studii byla hypofosfatemie jako indikátor počínajícího refeeding syndromu pozorována u 14 % pacientů z 2307 hospitalizovaných na geriatrii.9 Pacienti s hypofosfatemií vykazovali signifikantně delší dobu hospitalizace a třikrát vyšší úmrtnost. Další studie prováděná u interních pacientů odhalila, že u 54 % pacientů ze 178 byly přítomny rizikové faktory vzniku refeeding syndromu a 14 % z této rizikové skupiny a 8 % z celkového počtu pacientů do studie zařazených syndrom opravdu vyvi nulo.10 Ve velké multicentrické studii sledující výživovou terapii převážně interních pacientů vyššího věku mělo asi 8 % těchto hospitalizovaných pacientů hypofosfatemii s odpovídající klinickou symptomatologií, tedy refeeding syndrom.11
Klinický význam
Přibližně u 8 % hospitalizovaných pacientů vyššího věku se po zahájení realimentace či po zvýšení příjmu potravy vyvine refeeding syndrom.
Význam jednotlivých živin
Fosfor
Asi 85 % tělesného fosforu z celkových 700 g se nachází v kostech ve formě fosforečnanu vápenatého. Pouze 1 % fosforu se nachází v extracelulární tekutině. Fosfor najdeme také ve fosfolipidech, enzymech a DNA. Slouží též jako zásoba energie ve formě ATP a jako buněčný přenašeč (cAMP).
Sloučeniny fosforu slouží také jako pufry k udržení hodnot pH. Hospodaření s fosforem je úzce spojené s vápníkem. Denní doporučená dávka fosforu je 700 mg. Skutečný příjem je však v průmyslových zemích mnohem vyšší. U podvyživených pacientů dochází kvůli sníženému příjmu a nezměněným ztrátám k vyčerpání tělesných zásob fosforu. Hypofosforemii lze tedy též chápat jako známku malnutrice.12 Při glykolýze se makroergní sloučeniny fosforu využívají jako nosič energie, proto se při zvýšené glykolýze spuštěné po realimentaci spotřebovává velké množství fosforu.
Draslík
V lidském organismu se nachází asi 100–150 g draslíku. Jeho potřebu nelze přesně stanovit. Minimální doporučený denní příjem jsou 2 g. Po zahájení výživové terapie dochází díky reaktivaci metabolismu glukózy k přesunu draslíku do buněk. Dochází k hypokalemii s odpovídajícími příznaky. Nastává pokles nervosvalové dráždivosti a tato situace může v extrémních případech vyústit až ve svalovou paralýzu a smrt.4 Současně většinou dochází i k hypokalemii a hypomagnezemii. Důležitá je paralelní substituce obou elektrolytů.
Hořčík
Naše tělo obsahuje asi 24 g hořčíku, z nichž se 65 % vyskytuje v kostech. V extracelulárním prostoru je pouze 1 % hořčíku. Doporučený denní příjem dospělého je 300–350 mg. Avšak v průmyslových zemích je skutečný denní příjem hořčíku nižší. Diagnostika hypomagnezemie není jednoduchá, jelikož sérové hodnoty magnezia nevypovídají nic o jeho množství intracelulárně. Magnezium je součástí asi 300 enzymových systémů a účastní se všech procesů závisejících na ATP. Společně s fosfolipidy stabilizuje buněčné membrány a jako kofaktor Na-K-ATPázy řídí excitaci nervových a svalových buněk. Hořčík je důležitý i pro udržení membránového potenciálu a společně s vápníkem reguluje aktivitu svalových vláken a uvolňování neurotransmiterů.
Thiamin
Thiamin (vitamin B1) je v těle využíván jako koenzym. Pyruvát, konečný produkt glykolýzy, je přes pyruvátdehydrogenázu, která využívá thiamin, přeměněn v citrátovém cyklu na acetyl-CoA. Denní potřeba thiaminu je proto závislá na výdeji energie. Doporučený denní příjem je 1,3 mg pro muže a 1,0 mg pro ženy. V kontextu dostatečného příjmu racionální stravy je dodávka zajištěna. Příjem, aktuální potřebu či vylučování může ovlivnit spousta faktorů. Při nedostatečném příjmu stravy dojde k vyčerpání zásob thiaminu celkem rychle, jelikož v těle máme zásobu tak na měsíc. Spotřeba thiaminu se zvyšuje při stresu a nadměrné konzumaci alkoholu. Léčbou kličkovými diuretiky se zvyšují ztráty thiaminu. Jelikož má thiamin důležitou roli v cyklu aerobní glykolýzy, zvyšuje se při jeho nedostatku tvorba laktátu.13 Pokud podvyživenému pacientovi podáme glukózu, zásoby thiaminu se rychle vyčerpají. Nedostatek thiaminu se může klinicky projevit jako polyneuropatie, dezorientace, Wernickeho encefalopatie či srdeční selhání.
Klinický význam
Při refeeding syndromu se kromě nedostatku fosfátu, hořčíku a draslíku musí myslet i na thiamin.
Klinický obraz
Příznaky refeeding syndromu mohou být velmi různorodé a celkově spíše nespecifické. Orgánové projevy závisí na tom, jakého minerálu či vitaminu je ne dostatek a jak moc velký deficit je (Tab. 1). Záleží též na vulnerabilitě konkrétního pacienta. Klinický obraz syndromu u geriatrických pacientů často připomíná delirium. Charakteristický je spíše časový průběh vzniku obtíží, které se rozvíjí několik dní po zahájení nutriční terapie. Minerálová dysbalance vede k retenci sodíku a vody a tím k objemovému přetížení a ev. k srdečnímu selhávání. Transcelulární přesuny iontů mohou vést ke zmatenosti, křečím, svalové slabosti a sr dečním arytmiím. Snížená produkce ATP vede často ke svalové slabosti a vzácně i k rabdomyolýze.4
Tab. 1. Spektrum klinických příznaků refeeding syndromu 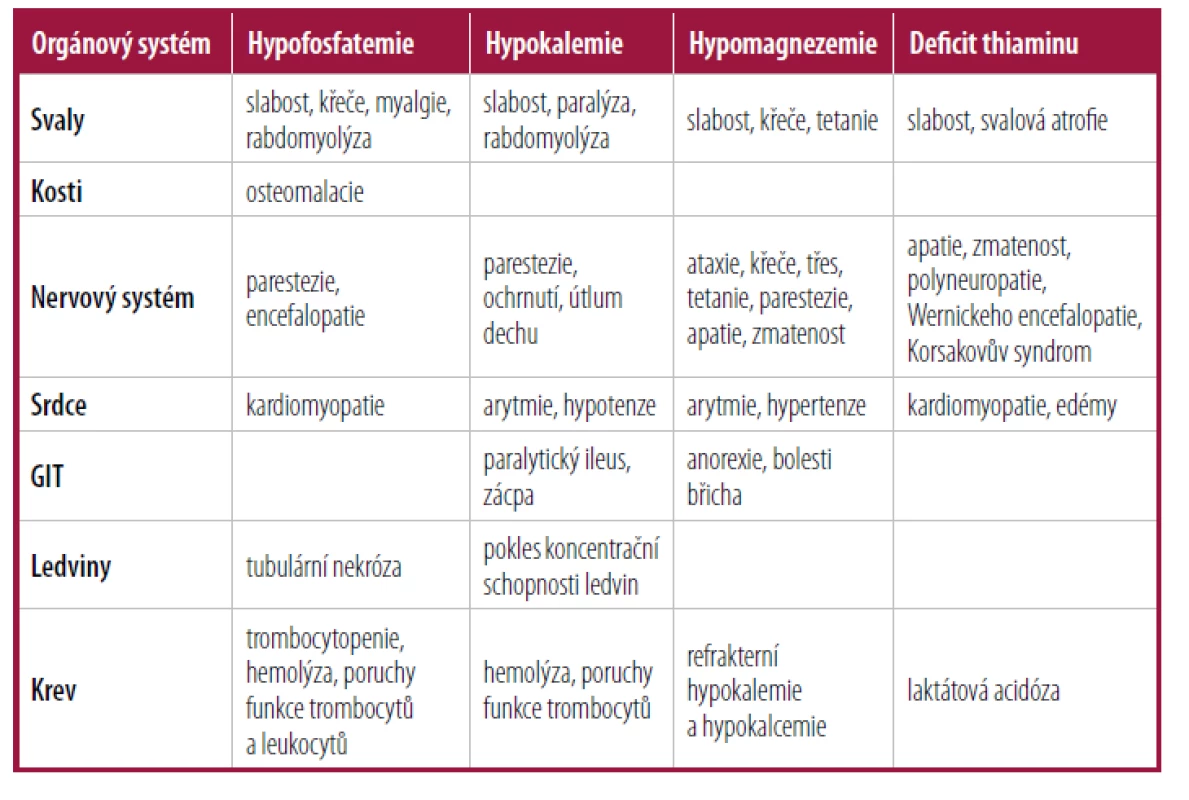
Klinický význam
Klinické příznaky refeeding syndromu jsou nespecifické a různorodé. Pokud se včas neléčí, může být smrtelný. Pokud dojde ke zhoršení stavu pacienta několik dní po zahájení výživové terapie, neměli bychom refeeding syndrom v rámci diferenciální diagnostiky opomenout.
Prevence a léčba
Pokud jsou u pacienta přítomny rizikové faktory, měla by se výživa podávat opatrně a pomalu minimálně během prvních 4–7 dní. Zároveň bychom měli sledovat hladiny výše zmíněných nutrientů. Podrobná doporučení lze nalézt v článku autora Aubryho a kol.14 Je třeba mít neustále na paměti, že hodnoty v séru plně nereflektují celkové množství látek v těle, a proto je třeba hodnoty neustále sledovat a včas substituovat. Kromě počátečního denního stanovování hladin sodíku, draslíku, hořčíku, vápníku a fosfátu bychom měli znát i výchozí hladinu thiaminu a sledovat pravidelně vitální funkce. Stanovení hladiny thiaminu je na většině pracovišť dostupné až za několik dní od náběru. Proto je důležité jej substituovat ihned zpočátku ve vysokých dávkách. Také se doporučuje podání multivitaminových přípravků. Pokud dojde k poklesu sérových hladin iontů či k rozvoji příznaků refeeding syndromu, je nutné v úvodu podávat hypokalorickou výživu, dokud nedojde k normalizaci hladiny sledovaných iontů a příznaky syndromu se nezlepší. Význam tohoto opatření prokázala multicentrická studie u pacientů hospitalizovaných na jednotkách intenzivní péče, u kterých došlo k rozvoji refeeding hypofosfatemie. Pokud u nich kromě pomalé substituce fosfátů došlo i k redukci příjmu výživy, byla jejich úmrtnost signifikantně nižší.15
Klinický význam
Prevence a léčba refeeding syndromu je velmi jednoduchá. U všech pacientů je nutné před zavedením a během zavedení nutriční terapie sledovat hladiny iontů v séru, včetně fosfátů a hořčíku, a substituovat jejich případný nedostatek. Na počátku bychom měli podávat též vysoké dávky thiaminu. Postupná realimentace probíhající minimálně 4–7 dní je stejně účinná jako omezení příjmu výživy po manifestaci syndromu.
Článek v původním znění:
doi: https://doi.org/10.1055/a-0955-0094
Dtsch Med Wochenschr 2020;145 : 436–441.
Překlad: MUDr. Tereza Tauerová
© Georg Thieme Verlag KG, Stuttgart
New York ISSN 0012-0472
Publikováno se souhlasem Thieme Gruppe. Chráněno autorským právem.
Zdroje
1. Janssen G, Pourhassan M, Lenzen-Grossimlinghaus R, et al. The refeeding syndrome revisited: you can only diagnose what you know. Eur J Clin Nutr 2019;73 : 1458–1463. doi:10.1038/s41430-019-0441-x.
2. Pourhassan M, Cuvelier I, Gehrke I, et al. Risk factors of refeeding syndrome in malnourished older hospitalized patients. Clin Nutr 2018;37 1354–1359. doi:10.1016/j.clnu.2017.06.008.
3. Pourhassan M, Cuvelier I, Gehrke I, et al. Prevalence of risk factors for the refeeding syndrome in older hospitalized patients. J Nutr Health Aging 2018;22 : 321–327. doi:10.1007/s12603-017-0917-0.
4. Friedli N, Stanga Z, Sobotka L, et al. Revisiting the refeeding syndrome: Results of a systematic review. Nutrition 2017;35 : 151–160. doi:10.1016/j.nut.2016.05.016.
5. Korbonits M, Blaine D, Elia M, et al. Refeeding David Blaine – studies after a 44-day fast. N Engl J Med 2005;353 : 2306–2307. doi:10.1056/NEJM200511243532124.
6. Crook MA, Hally V, Panteli JV. The importance of the refeeding syndrome. Nutrition 2001;17 : 632–637.
7. Gonzalez Avila G, Fajardo Rodriguez A, Gonzalez Figueroa E. The incidence of the refeeding syndrome in cancer patients who receive artificial nutritional treatment. Nutricion hospitalaria 1996;11 : 98–101.
8. Lubart E, Leibovitz A, Dror Y, et al. Mortality after nasogastric tube feeding initiation in long-term care elderly with oropharyngeal dysphagia – the contribution of refeeding syndrome. Gerontology 2009;55 : 393–397. doi:10.1159/000218162.
19. Kagansky N, Levy S, Koren-Morag N, et al. Hypophosphataemia in old patients is associated with the refeeding syndrome and reduced survival. J Intern Med 2005;257 : 461–468. doi:10.1111/j.1365-2796.2005.01457.x.
10. Kraaijenbrink BV, Lambers WM, Mathus-Vliegen EM, et al. Incidence of refeeding syndrome in internal medicine patients. Neth J Med 2016;74 : 116–121.
11. Schuetz P, et al. Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial. Lancet 2019;393 : 2312–2321.
12. Pourhassan M, Muller MJ, Volkert D, et al. Hypophosphatemia as a sign of malnutrition in older hospitalized patients. Eur J Clin Nutr 2019;73 : 634–636. doi:10.1038/s41430-018-0251-6.
13. Romanski SA, McMahon MM. Metabolic acidosis and thiamine deficiency. Mayo Clin Proc 1999;74 : 259–263. doi:10.4065/74.3.259
14. Aubry E, Friedli N, Schuetz P, et al. Refeeding syndrome in the frail elderly population: prevention, diagnosis and management. Clin Exp Gastroenterol 2018;11 : 255–264. doi:10.2147/CEG.S136429.
15. Doig GS, Simpson F, Heighes PT, et al. Restricted versus continued standard caloric intake during the management of refeeding syndrome in critically ill adults: a randomised, parallel group, multicentre, single-blind controlled trial. Lancet Respir Med 2015;3 : 943–952. doi:10.1016/S2213-2600(15)00418-X.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2021 Číslo 3- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Úvodní slovo
- Profesor Eduard Zvěřina: Chováme se jako viry
- MUDr. Milan Černek: Viatris vstupuje na český trh: naším cílem jsou dostupná a kvalitní léčiva
- Horké aktuality v registracích EMA
- Telemedicína – vyšetření muskuloskeletálních problémů
- Komentář k článku Telemedicína – vyšetření muskuloskeletálních problémů
- Glosa k problematice telemedicíny V některých oborech je osobní kontakt s pacientem nenahraditelný
- Refeeding syndrom u pacientů vyššího věku
- Komentář k článku Refeeding syndrom u pacientů vyššího věku
- Kardiovaskulární riziko u geriatrických pacientů: jak ho stanovit správně?
- Adherence a perzistence k léčbě
- Léčba hypertenze komplikované srdečním selháním
- Úskalí a přínosy měření krevního tlaku v ordinaci a mimo ordinaci
- Profesorka Hana Rosolová: Největším rivalem cholesterolu je metabolický syndrom
- Fixní kombinace v léčbě hypertenze a dyslipidemie – schůdná cesta k redukci kardiovaskulárního rizika u diabetu
- Děláme maximum pro snížení kardiovaskulárního rizika našich pacientů?
- Inklisiran: inovativní přístup v léčbě dyslipidemie
- Kardiovaskulární riziko u onemocnění ledvin – pohled nefrologa
- Hepatorenální syndrom
- Aktuální pohled na potravinovou pyramidu
- Humánní biometeorologie v každodenní praxi
- Diferenciální diagnostika nejčastějších změn v krevním obraze
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika nejčastějších změn v krevním obraze
- MUDr. Milan Černek: Viatris vstupuje na český trh: naším cílem jsou dostupná a kvalitní léčiva
- Inklisiran: inovativní přístup v léčbě dyslipidemie
- Aktuální pohled na potravinovou pyramidu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





