-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTirzepatid v léčbě obezity a nadváhy v praxi
26. 5. 2025
Tirzepatid je první schválený duální agonista receptorů pro glukagonu podobný peptid 1 (GLP-1) a glukózo-dependentní inzulinotropní polypeptid (GIP). Je indikovaný ke kontrole tělesné hmotnosti u osob s obezitou nebo nadváhou komplikovanou komorbiditami a k léčbě diabetu mellitu 2. typu (DM2). Předepisovat jej může každý lékař bez ohledu na specializaci. Jak léčbu tirzepatidem v klinické praxi řádně vést, aby bylo dosaženo maximálního přínosu s minimálními riziky?
Indikace
Tirzepatid je indikovaný:
- k léčbě dospělých s nedostatečně kompenzovaným DM2 jako doplněk ke stravě a cvičení, a to v monoterapii, pokud není podávání metforminu vhodné z důvodu nesnášenlivosti či kontraindikací, nebo v kombinaci s dalšími antidiabetiky;
- pro kontrolu tělesné hmotnosti jako doplněk k nízkokalorické stravě a zvýšené fyzické aktivitě, včetně snížení a udržení tělesné hmotnosti u dospělých s počátečním BMI:
- ≥ 30 kg/m2 (obezita) nebo
- ≥ 27 kg/m2 až < 30 kg/m2 (nadváha) za přítomnosti ≥ 1 komorbidity související s tělesnou hmotností (např. obstrukční spánková apnoe, dyslipidémie, hypertenze a další kardiovaskulární onemocnění, prediabetes či DM2).
Důkazy o účinnosti a bezpečnosti
Tirzepatid byl v těchto indikacích schválen na základě výsledků programu klinických studií SURMOUNT v léčbě nadváhy/obezity a SURPASS v léčbě DM2.
InzerceVe studiích SURPASS vedla terapie tirzepatidem v dávkách 5, 10 nebo 15 mg 1× týdně k poklesu hladiny glykovaného hemoglobinu (HbA1c) o 1,9–2,6 procentního bodu během až 104 týdnů a k poklesu tělesné hmotnosti až o 11,7–12,9 kg během 52 týdnů.
Ve studiích SURMOUNT bylo při léčbě osob s nadváhou/obezitou bez DM2 tirzepatidem v dávkách 5, 10 a 15 mg dosaženo poklesu tělesné hmotnosti o 16–26,6 %, u nemocných s nadváhou/obezitou a současně DM2 bylo s tirzepatidem v dávce 10 a 15 g dosaženo snížení tělesné hmotnosti až o 15,7 % v porovnání s 3,3 % při podávání placeba. Při podávání tirzepatidu bylo pozorováno také snížení krevního tlaku, zlepšení lipidového profilu, glykémie, zmenšení obvodu pasu a zlepšení poměru tukové a netukové hmoty.
Účinek tirzepatidu na snížení tělesné hmotnosti není ovlivněn věkem, pohlavím, etnickým původem, vstupní hodnotou BMI ani přítomností prediabetu či diabetu.
Tirzepatid je dobře tolerovaný a jeho bezpečnostní profil je podobný léčivům ze skupiny GLP-1RA. Nejčastější nežádoucí účinky jsou gastrointestinální (GI) a mírného rázu: nauzea, průjem, zvracení, zácpa či bolest břicha.
Tirzepatid v praxi
Dávkování a způsob podávání
Tirzepatid se podává s.c. injekcí 1× týdně. Počáteční dávka činí 2,5 mg, po 4 týdnech má být zvýšena na 5 mg a v případě potřeby je možné další postupné zvyšování o 2,5 mg za ≥ 4 týdny. Doporučené udržovací dávky jsou 5 mg, 10 mg a 15 mg. Maximální dávka je 15 mg/týden. Aplikace se provádí do oblasti břicha stehna nebo horní části paže. Místo podání se má střídat (případné injekce inzulinu je třeba podat do jiného místa). Dávku lze podávat v kteroukoliv denní dobu.
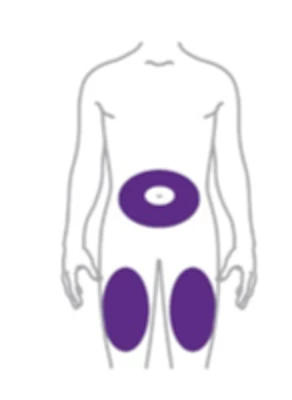
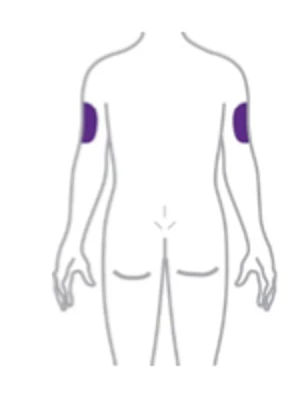
Větším úkolem může být titrace dávky pro pacienty, kteří potřebují nejvyšší dávku tirzepatidu 15 mg. Je třeba vzít v potaz, že tato titrace probíhá v 6 krocích po dobu 5 měsíců.
V případě vynechání dávky je třeba ji podat co nejdříve během 4 dní, později se již vynechaná dávka nepodává a následuje podání pravidelné dávky. Den podávání týdenní dávky lze změnit, ovšem mezi 2 dávkami musejí uplynout ≥ 3 dny.
U osob s poruchou funkce ledvin nebo jater není nutná úprava dávky tirzepatidu, ovšem u těžkého renálního a jaterního selhání není k dispozici dostatek dat, podobně jako u osob starších 85 let.
Kontraindikace a upozornění
Tirzepatid je kontraindikovaný pouze v případě hypersenzitivity na léčivou látku nebo na kteroukoliv pomocnou látku.
S opatrností je třeba podávat tirzepatid u jedinců s pankreatitidou v anamnéze nebo s těžkou gastroparézou, protože tito pacienti nebyli do studií zařazeni.
Při užívání tirzepatidu v kombinaci se sulfonylureou nebo s inzulinem je zvýšené riziko hypoglykémie.
Obavy z jeho podávání se můžou týkat rizika sarkopenie, protože kromě snížení množství tukové tkáně vede tirzepatid i k poklesu množství svalové hmoty. Tyto obavy dosud nejsou podloženy klinickými daty. Přesto je vhodná opatrnost zejména u starších křehčích pacientů a osob s chronickým onemocněním ledvin. Vzhledem k tomu, že sarkopenie často provází obezitu, je třeba při léčbě tirzepatidem pacientům doporučit dostatečný příjem bílkovin a posilování, zejména ve fázi rychlého poklesu tělesné hmotnosti s cílem zachování svalové hmoty.
Bezpečnost léčby
Pacienty je třeba poučit o možnosti výskytu GI nežádoucích vedlejších účinků (nauzea, průjem, zvracení, zácpa, dyspepsie, bolest břicha) i o tom, že jsou většinou mírné, nejvýše střední intenzity a objevují se převážně na začátku léčby. V klinických studiích se u pacientů bez DM2 objevily (dle dávky) u 55,6–60,8 % léčených v porovnání se 30,3 % účastníků dostávajících placebo. Důležité je pacientům doporučit dostatečnou hydrataci. GI nežádoucí příhody se řeší nejprve úpravou stravy a symptomatickou léčbou volně prodejnými léky, a teprve pokud nedojde ke zmírnění, doporučuje se vynechat dávku tirzepatidu. Další možností je přechodná deeskalace dávky s následnou reeskalací, případně trvalé snížení dávky. Dávkování tirzepatidu je pro tento postup dostatečně flexibilní. Úplné vysazení léčby bylo v klinických studiích nutné jen u 1,9–4,1 % pacientů v porovnání s 0,5 % účastníků s placebem.
Dále je pacienty třeba informovat možnosti akutních nežádoucích účinků souvisejících se žlučníkem, které mohou být zčásti dány i větším snížením tělesné hmotnosti. Rovněž je při léčbě tirzepatidem možné zjistit zvýšení pankreatické amylázy průměrně o 23–24,6 % a pankreatické lipázy o 34–39 %.
Při léčbě tirzepatidem bylo popsáno zvýšení srdeční frekvence, maximálně průměrně o 3–5/min v porovnání s nárůstem o 1/min u placeba. Podíl pacientů se změnou výchozí srdeční frekvence o > 20/min byl dle dávky tirzepatidu 2,1–3,8 % a s placebem 2,1 %.
Se subkutánním podáním souvisí i možnost reakce v místě vpichu. V klinických studiích jejich výskyt dosahoval 8,0–8,6 % v porovnání s 1,8–2,6 % u placeba. Nejčastěji se jednalo o zarudnutí a svědění, žádné reakce nebyly těžké.
Současné podávání dalších léků
Zpomalené vyprazdňování žaludku při léčbě tirzepatidem může ovlivnit absorpci současně podávané medikace. Pečlivější monitorování je zapotřebí u pacientů léčených warfarinem či digoxinem, zejména během eskalace dávky tirzepatidu. U žen, které užívají perorální antikoncepci, je na dobu 4 týdnů po nasazení tirzepatidu a po každém zvýšení dávky třeba přidat bariérovou metodu antikoncepce nebo přejít na jinou než perorální formu antikoncepce.
Těhotenství a laktace
Tirzepatid není určen pro podávání v těhotenství. Animální studie prokázaly reprodukční toxicitu. Ženám ve fertilním věku léčeným tirzepatidem se doporučuje používat antikoncepci. Ženy, jež plánují těhotenství, mají vysadit tirzepatid ≥ 4 týdny před plánovaným početím. Není známo, zda se tirzepatid vylučuje do lidského mateřského mléka. Riziko pro novorozence/kojence nelze vyloučit.
Preskripce, balení a cena
Preskripce tirzepatidu není omezena specializací. Léčba zatím není hrazena z prostředků veřejného zdravotního pojištění. V Česku je k dispozici ve vícedávkovém předplněném peru pro opakované použití (4 dávky = 1 měsíc léčby), kdy jedna dávka obsahuje 2,5 mg, 5 mg, 7,5 mg nebo 10 mg. Uchovává se v chladničce (2–8 °C), nesmí se zmrazit a mimo chladničku může být uchováván při teplotě do 30 °C nejvýše 21 dní. Příbalová informace obsahuje návod k použití pera.

(zza)
Zdroje:
1. SPC Mounjaro. Dostupné na: www.ema.europa.eu/cs/documents/product-information/mounjaro-epar-product-information_cs.pdf
2. Hamza M., Papamargaritis D., Davies M. J. Tirzepatide for overweight and obesity management. Expert Opin Pharmacother 2025 Jan; 26 (1): 31−49, doi: 10.1080/14656566.2024.2436595.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Diabetologie Gynekologie a porodnictví Kardiologie Obezitologie Praktické lékařství pro dospělé Psychiatrie Psychologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




