-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Psoriatická artritida –
současné možnosti diagnostiky a léčby
Autoři: doc. MUDr. Němec Petr, Ph.D.
Působiště autorů: II. interní klinika FN u sv. Anny v Brně ; Revmatologická ambulance
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 2, s. 45-52
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Psoriatická artritida je chronické zánětlivé onemocnění s heterogenními projevy a potenciálním rizikem závažného průběhu spojeným se strukturální progresí, s omezením fyzických a pracovních schopností a s poklesem kvality života. Nesprávná nebo pozdě stanovená diagnóza psoriatické artritidy může mít dramatický dopad na průběh onemocnění. Dermatologové a revmatologové mají nezastupitelnou roli v časné diagnostice onemocnění. Za léčbu psoriatické artritidy jsou však zodpovědní především revmatologové. Okamžitě po stanovení diagnózy musí být zahájena adekvátní terapie zohledňující všechny projevy onemocnění, závažnost kožního postižení, prognózu pacienta, riziko nežádoucích účinků i přítomnost komorbidit. Cílem moderní léčby psoriatické artritidy by mělo být dosažení a dlouhodobé udržení remise nebo nízké aktivity onemocnění, prevence strukturálního postižení, normalizace funkčních schopností a kvality života všech pacientů s touto chorobou. V letošním roce byla publikována aktualizovaná doporučení Evropské ligy proti revmatismu k farmakologické léčbě psoriatické artritidy, která představuje tento článek.
Psoriatická artritida (PsA) je chronické zánětlivé, autoimunitní revmatické onemocnění provázející psoriázu. Postihuje přibližně 30 % pacientů s psoriázou, nicméně epidemiologická data udávají výskyt PsA v širokém rozmezí mezi 6–42 %.1 Roční incidence je přibližně 6 případů na 100 000 obyvatel. Onemocnění se vyskytuje celosvětově, ale jeho prevalence v populaci kolísá od 0,1 případu na 100 000 obyvatel v Japonsku až po 23 případů na 100 000 obyvatel ve Finsku.2 Prevalence PsA v Evropě a Americe se pohybuje mezi 0,02 % a 0,42 %. Onemocnění postihuje obě pohlaví, poměr postižených žen a mužů se udává v poměru od 0,7 : 1 do 2,1 : 1, axiální postižení je pozorováno častěji u mužů. PsA se nejčastěji manifestuje mezi 30. až 55. rokem života, ale může postihnout i děti nebo starší osoby.
PsA je díky společným etiopatogenetickým a klinickým rysům řazena mezi spondyloartritidy, spolu s ankylozující spondylitidou, reaktivní artritidou, nediferencovanou spondyloartritidou a spondyloartritidou asociovanou s nespecifickými střevními záněty. V rámci této skupiny patří mezi choroby s vyšší tendencí k postižení periferního pohybového aparátu na rozdíl například od ankylozující spondylitidy, u které dominuje postižení axiálního skeletu. Nicméně projevy PsA jsou značně heterogenní s různými skeletálními, kožními i mimoskeletálními manifestacemi. Dříve bylo onemocnění považováno za méně závažné, ale v posledních dekádách se zdůrazňuje jeho progresivní charakter. K destruktivním změnám pohybového aparátu dochází až u 40–60 % pacientů.3
Přesná etiopatogeneze PsA není známa. Předpokládá se, že PsA sdílí společné etiopatogenetické mechanismy s psoriázou. U geneticky vnímavých jedinců může v důsledku aktivace vrozených a adaptivních imunitních procesů dojít k poškození struktur pohybového aparátu, jako jsou enteze, klouby, šlachy a páteř, chronickým zánětem.4 Spouštěčem tohoto imunopatologického procesu může být mechanický stres, trauma nebo infekce. Mechanický stres působící v místě úponů šlach, vazů a kloubních pouzder na kost (enteze) může stát za rozvojem primární zánětlivé léze – entezitidy, která je charakteristická pro celou skupinu spondyloartritid. Dermatologové znají situaci, kdy k výsevu psoriázy dochází v místě traumatizace kůže (Ko ebnerův fenomén). Rozvoj PsA jako následek traumatizace pohybového aparátu může být ekvivalentem tohoto fenoménu. V místě zánětlivého procesu dochází ke kumulaci imunokompetentních buněk, například T-lymfocytů, které mimo jiné produkují prozánětlivé cytokiny, především interleukin-12 (IL-12), IL-23, IL - 17 a tumor nekrotizující faktor α (TNFα), které spouští a udržují chronický zánět vedoucí k destrukci a deformaci struktur pohybového aparátu. Tento proces je spojen s poklesem fyzických a pracovních schopností, narušením sociálních vazeb, psychickými poruchami a celkově se snížením kvality života.3 Vlivem PsA na fyzické funkce, kvalitu života a pracovní disabilitu se zabývala rozsáhlá populační studie Multinational Assessment of Psoriasis and Psoriatic Ar tri tis (MAPP), které se zúčastnilo celkem 3426 pacientů, z nichž 712 (21 %) trpělo PsA. Pacienti s PsA uváděli podstatný dopad onemocnění na své fyzické schopnosti.5 Třetina pacientů uvedla, že ztratili práci z důvodu onemocnění nebo že PsA ovlivnila jejich schopnost pracovat na plný úvazek. Více než polovina pacientů s PsA (58 %) uvedla, že nebyli léčení vůbec nebo pouze lokální léčbou psoriázy. Adherence k léčbě byla obecně nízká zejména z důvodu obav z nedostatečného efektu léčby a rizika nežádoucích účinků. Omezení fyzických funkcí rostlo a pracovní produktivita klesala se závažností průběhu onemocnění a s přítomností daktylitidy a entezitidy.
PsA je u pacientů s psoriázou často diagnostikována nedostatečně nebo pozdě, což může mít významný dopad na závažnost jejího průběhu. Až 15 % pacientů s psoriázou a současnými muskuloskeletálními symptomy uniká diagnostice onemocnění.6 Kromě zpoždění v diagnóze delší než 1 rok byly jako faktory spojené s horším funkčním postižením identifikovány kouření, věk nad 50 roků při stanovení diagnózy nebo ženské pohlaví. 7
Klinické projevy
Nejběžnějším typem psoriázy asociovaným s rizikem rozvoje PsA je psoriasis vulgaris.8 Menší část případů PsA (4–5 %) souvisí s gutátní nebo vzácněji pustulózní formou psoriázy;9 1–2 % případů PsA jsou spojena pouze s nehtovou psoriázou bez postižení kůže.10 Až u 75 % pacientů předchází rozvoji PsA psoriáza, u 10–37 % případu se oba projevy manifestují současně a u 6–18 % pacientů se PsA může manifestovat před rozvojem psoriázy.11 Vyšší riziko rozvoje PsA je u pacientů s těžším kožním postižením, psoriázou ve kštici, s postižením nehtů, s vyšší tělesnou hmotností nebo s pozitivitou genu HLA-B27.12–14 Riziko rozvoje choroby u prvostupňových příbuzných pacientů s PsA je proti obecné populaci zvýšeno až 30x.14
Klinické projevy PsA nejčastěji zahrnují postižení periferních kloubů artritidou. Na základě klasifikace Molla a Wrightové, vytvořené v roce 1973, rozlišujeme pět základních typů kloubního postižení: oligoartritidu, symetrickou polyartritidu, artritidu preferenčně postihující distální interfalangeální klouby, mutilující artritidu a spondylitidu. Klinické projevy PsA jsou značně heterogenní, protože jednotlivé typy kloubního postižení se mezi sebou mohou vzájemně překrývat. V úvodu onemocnění se častěji můžeme setkat s mírnějšími projevy, zejména s monoartritidou nebo oligoartritidou. V dalším průběhu se onemocnění často stává více agresivním a dominujícím kloubním projevem je polyartritida. Až u 5–20 % pacientů může dojít k rozvoji mutilující artritidy. 15 Další skeletální projevy PsA zahrnují daktylitidu (~ 40 %), entezitidu (25–53 %), spondylitidu (18–46 %). Z extraskeletálních projevů je nejčastější psoriáza (~ 90 %), časté je postižení nehtů (> 80 %), k méně častým projevům patří nespecifický střevní zánět (< 1 %) nebo akutní přední uveitida (7 %), která je častější u pacientů se spondylitidou. 16, 17 V případě nepřítomnosti zjevné psoriázy je nutné aktivně pátrat po skrytých ložiscích například v pupku, v intergluteální rýze nebo ve kštici. PsA je často doprovázena komorbiditami, jako je metabolický syndrom, kardiovaskulární choroby, rozvíjející se v důsledku akcelerace aterosklerózy chronickým systémovým zánětem, a zvýšenou mortalitou.18, 19 Z důvodu komplexnosti klinických projevů onemocnění často hovoříme o tzv. psoriatické nemoci.
Diagnóza psoriatické artritidy
Diagnózu PsA lze stanovit na základě anamnézy, klinického, zobrazovacího a laboratorního vyšetření. K diagnostice lze využit klasifikační kritéria CASPAR (ClASsification criteria for the study of Psoriatic ARThritis) vytvořená v roce 2006. Jejich specificita je 98,7 % a senzitivita 91,4 % (Tab. 1).20
Tab. 1. Klasifikační kritéria CASPAR pro psoriatickou artritidu 
V minulosti bylo vytvořeno několik screeningových nástrojů, které mají dermatologům, případně lékařům s jinou specializací pomoci časně identifikovat pacienty s PsA a odeslat je k revmatologickému vyšetření. V roce 2009 byl vytvořen screeningový dotazník PEST (Psoriasis Epidemiology Screening Tool) obsahující pět jednoduchých otázek.21 Každá kladná odpověď je hodnocena jedním bodem. Zisk tří a více bodů znamená pravděpodobnou PsA. Jeho senzitivita dosahuje hodnoty 97 %, specificita 79 % (Tab. 2). Studie CONTEST, publikovaná v roce 2013, prokázala srovnatelnou výpovědní hodnotu tří různých screeningových dotazníků ve schopnosti identifikovat pacienty s PsA. Kromě dotazníku PEST byly hodnoceny dotazníky PASE (Psoriatic Arthritis Screening Evaluation) a ToPAS (Toronto Psoriatic Arthritis Screen).22 Jejich senzitivita, specificita a prediktivní hodnota byla téměř srovnatelná. V roce 2018 byl vytvořen a validizován další screeningový nástroj sloužící k časné identifikaci pacientů s PsA, Simple Psoriatic Arthritis Screening (SiPAS), se senzitivitou 79 % a specificitou 87 %.23
Tab. 2. Dotazník PEST
(Psoriasis Epidemiology Screening Tool)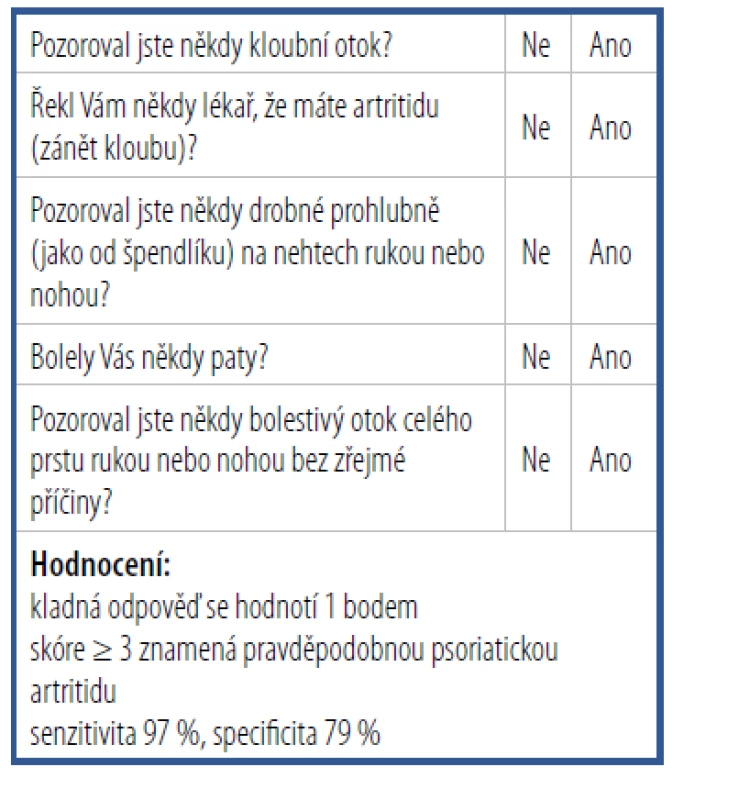
V současnosti zatím nemáme k dispozici specifické laboratorní diagnostické ani prognostické testy pro PsA použitelné v klinické praxi. Zvýšené hodnoty CRP nebo FW jsou prokazovány přibližně u 50 % pacientů a mohou být známkou závažnějšího onemocnění. Jejich zvýšené hodnoty mohou být asociovány také s psoriázou. Hyperurikemie bývá častá u pacientů s psoriázou, ale také u pacientů s komorbiditami, jako je obezita a metabolický syndrom.24 U části nemocných může být přítomna anemie chronických onemocnění. U více než 50 % pacientů s PsA zařazených do mezinárodní studie ASAS-COMOSPA byly prokázány snížené hladiny vitaminu D3.25 V roce 2018 byly publikovány výsledky analýzy, která si kladla za cíl najít nové sérové markery schopné odlišit pacienty s PsA od pacientů s psoriázou bez PsA. Kromě CRP identifikovali autoři pět dalších sérových markerů schopných detekovat pacienty s PsA: Mac-2-binding protein (M2BP), CD 5-like protein (CD5L), myeloperoxidázu (MPO), integrin β5 (ITGβ5) a matrix metalloproteinázu - 3 (MMP-3).26 Kombinace hladin ITGβ5, M2BP a CRP lépe diferencovaly pacienty s psoriázou s PsA a bez PsA než samotný CRP. Asociace spondyloartritid s genem HLA-B27 byla prokázána již v 70. letech minulého století.27 Častěji bývá prokazován u pacientů s PsA s axiálním postižením. PsA nebývá provázena pozitivitou autoprotilátek, přesto se nízké hladiny revmatoidních faktorů (RF) prokazují až u 10 % pacientů s PsA a pozitivita anticitrulinových autoprotilátek (ACPA) u přibližně 7 % pacientů, což nevylučuje diagnózu tohoto onemocnění. Pokud se artrocentézou podaří získat synoviální výpotek, mívá zánětlivý charakter, obvykle bez průkazu krystalů.
Ze zobrazovacích technik se k diagnostice a sledování progrese standardně využívá rentgenové vyšetření periferních kloubů. PsA obvykle charakterizuje kombinace destruktivních a osteoproduktivních změn: akroosteolýza (resorpce akrálních částí distálních falang), juxtaartikulární periostitida, ankylóza, kostní novotvorba v oblasti interfalangeálních kloubů a deformity pencil-in-cup.28 U pacientů s axiálním postižením bývá prokazována často asymetrická sakroiliitida, osteoproduktivní změny obratlů v podobě parasyndesmofytů, syndesmofytů, kalcifikací předních a interspinózních ligament a ankylóza.29 Častější může být izolované postižení krční páteře ankylózou projevující se atlantoaxiální fúzí nebo subluxací. 30
Ultrasonografie se využívá k detekci subklinické entezitidy, případně artritidy a k potvrzení diagnózy u symptomatických pacientů s PsA.31 Průkaz edému peritendinózní tkáně v místě úponu šlachy flexoru prstů, spolu se zvýšeným dopplerovským signálem může pomoci odlišit pacienty s PsA od pacientů s revmatoidní artritidou.32 Moya Alvarado se svými spolupracovníky hodnotili ultrasonografický nález u pacientů s nehtovou psoriázou.33 Prokázali asociaci mezi průkazem subklinické tendinitidy šlachy extenzoru prstu a závažností nehtové psoriázy a tloušťkou kůže u pacientů s psoriázou. Americká odborná společnost GRAPPA (Group for Research and Assessment of Psoriasis and PsA) vytvořila a následně validovala ultrasonografický entezitický skórovací systém určený pro pacienty s PsA, který zpřesňuje klinické hodnocení entezitid.34
Vyšetření magnetickou rezonancí (MR) může být využito k průkazu subklinické artritidy a entezitidy u pacientů v časné fázi onemocnění.35 Průkaz extrasynoviálních změn, spolu se sekundární synovitidou může pomoci odlišit PsA od revmatoidní artritidy.36 MR je dále využívána k průkazu aktivní sakroiliitidy a spondylitidy u pacientů s axiálním postižením.
K hodnocení aktivity PsA a odpovědi na léčbu je možné použít některé z vytvořených a validizovaných kompozitních skórovacích systémů, jako je Minimal Disease Activity score (MDA), Disease Activity for PSoriatic Arthritis (DAPSA) nebo Psoriatic ArthritiS Disease Activity Score (PASDAS)37–39 (Tab. 3). Mezi hodnocené domény onemocnění patří počet oteklých a bolestivých kloubů, entezitidy, daktylitidy, hodnocení aktivity onemocnění pacientem a zdravotníkem, hodnocení bolesti pacientem, laboratorní parametry zánětu, hodnocení funkčního stavu a kvality života nebo kožního postižení. Jednotlivé kompozitní indexy ale vždy nezahrnují všechny z těchto hodnocených domén, např. MDA nehodnotí laboratorní známky zánětu, funkční omezení nebo kvalitu života.
Tab. 3. Hodnocení aktivity onemocnění a odpovědi na léčbu pomocí kompozitních indexů Minimal Disease Activity (MDA), Disease Activity for PSoriatic Arthritis (DAPSA) a Psoriatic ArthritiS Disease Activity Score (PASDAS) 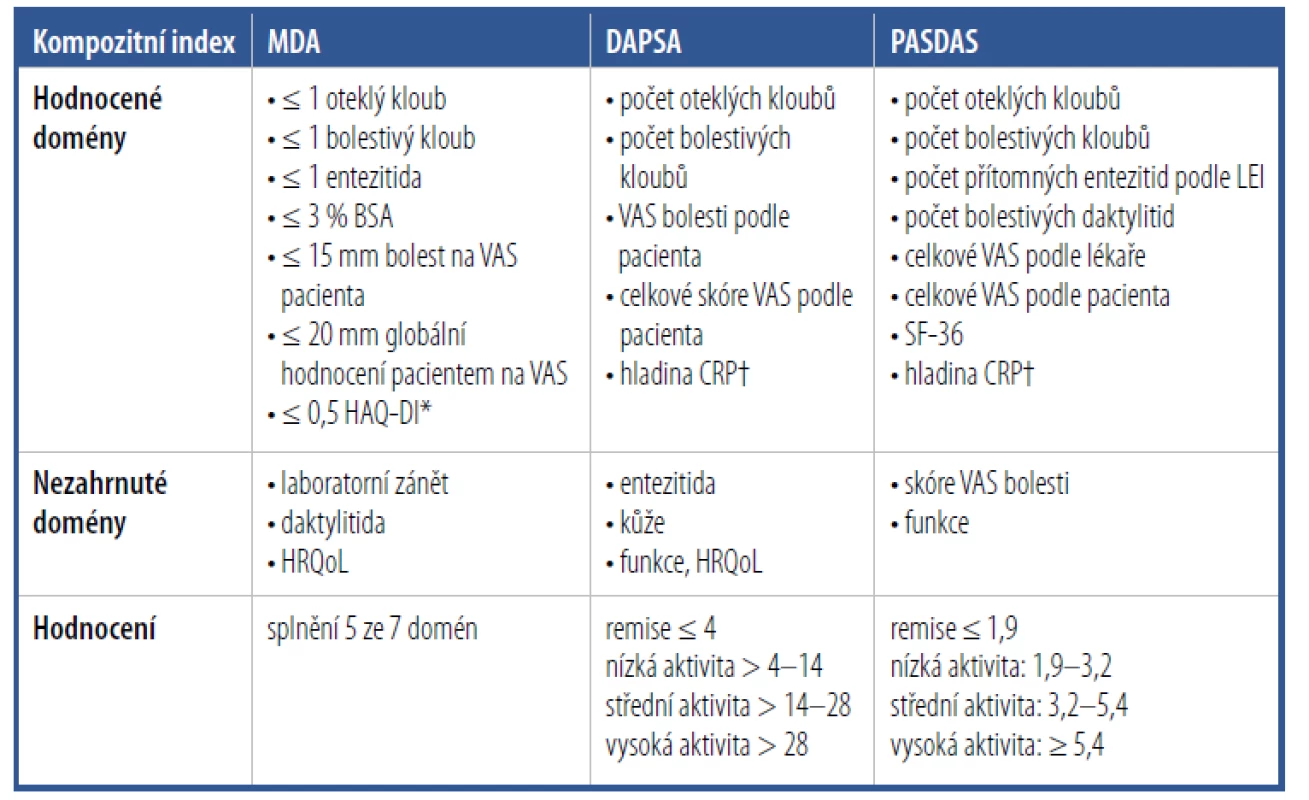
*Hodnocení funkčních schopností.
†Hodnocení zánětu.
BSA: plocha povrchu těla; CRP: C-reaktivní protein; DAPSA: index aktivity psoriatické artritidy; HAQ-DI: index postižení v dotazníku hodnocení zdravotního stavu; HRQoL: kvalita života související se zdravím;
MDA: minimální aktivita onemocnění; PASDAS: skóre aktivity PsA; PASI: index plochy postižení a závažnosti psoriázy; SF-36: dotazník kvality života – celkové fyzické zdraví; PsA: psoriatická artritida; VAS: vizuální analogová škálaTerapie psoriatické artritidy
Současná strategie farmakologické léčby PsA se opírá zejména o aktualizovaná Doporučení Evropské ligy proti revmatismu (EULAR) k farmakologické léčbě PsA, která byla novelizována v loňském roce a publikována v letošním červnovém čísle časopisu Annals of the Rheumatic Diseases.40 Národní doporučení k léčbě PsA byla vydána v roce 2017 a vycházela z předchozí verze doporučení EULAR z roku 2015.41 Americká společnost GRAPPA vydala svoje doporučení k léčbě PsA v roce 2016.42 Aktuální evropská doporučení obsahují 6 obecných principů léčby PsA a 12 specifických doporučení.
Léčba pacientů s PsA zahrnuje jak nefarmakologickou, tak především farmakologickou intervenci. Počet tzv. chorobu modifikujících léků (DMARD) indikovaných pro léčbu PsA se za poslední desetiletí významně zvýšil. Léčebné armamentarium nyní zahrnuje nejen konvenční syntetické DMARD (csDMARD), jako je metotrexát (MTX), sulfasalazin a leflunomid, inhibitory TNFα (TNFi), ale nově i další zástupce skupiny biologických DMARD (bD MARD) cílící na další prozánětlivé cytokiny, jako IL-12/23 a IL-17. Novou lékovou skupinou jsou tzv. cílené syntetické DMARD (tsDMARD), které inhibují fosfodiesterázu-4 (PDE4i) nebo Janusovy kinázy (JAKi). Přehled jednotlivých lékových skupin používaných v léčbě PsA, včetně údajů o jejich účinku na kloubní a kožní projevy onemocnění a o jejich vlivu na strukturální progresi PsA, je uveden v tabulce 4.
Tab. 4. Přehled lékových skupin používaných k farmakologické léčbě psoriatické artritidy včetně evidence o jejich účinku na kloubní, strukturální a kožní projevy onemocnění. 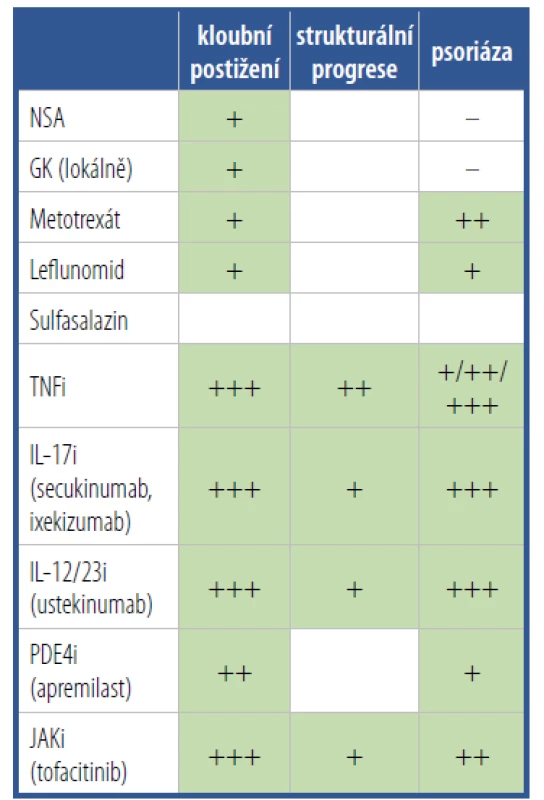
Upraveno podle Ritchlin CT, et al. NEJM 2017;376(10):9 Obecné principy léčby PsA
Obecné principy léčby zdůrazňují, že PsA je heterogenní a potenciálně závažné onemocnění vyžadující péči revmatologa, často dermatologa a vzhledem k možným mimoskeletálním projevům i spolupráci s dalšími odbornostmi, jako je oftalmolog, kardiolog nebo gastroenterolog. Při zvažování léčebné strategie by měly být zohledněny všechny skeletální i mimoskeletální projevy choroby, přání pacienta, bezpečnost použité léčby, ale také její cena. Farmakologická léčba by měla směřovat k maximálnímu zlepšení kvality života nemocných, a to prostřednictvím kontroly symptomů, prevence strukturálního postižení, normalizace funkčních schopností a sociální aktivity pacientů s PsA (Tab. 5).
Tab. 5. Obecné principy léčby psoriatické artritidy podle Doporučení EULAR k farmakologické léčbě PsA z roku 2019 
Specifická doporučení k léčbě psoriatické artritidy
Doporučení č. 1
Toto doporučení zdůrazňuje princip léčby onemocnění ke konkrétnímu cíli (treat-to-target). Cílem léčby by mělo být dosažení a dlouhodobé udržení remise, alternativně stavu nízké aktivity onemocnění. Prostředkem k dosažení těchto cílů je pravidelné monitorování aktivity onemocnění v intervalů 1–3 měsíce a adekvátní úprava léčebné strategie. Definovat remisi onemocnění je obtížné. Remise by měla být chápána jako stav bez přítomnosti zánětu. K hodnocení aktivity onemocnění lze použít výše zmíněné kompozitní skórovací systémy.
Doporučení č. 2
Stejně jako v předchozích verzích doporučení pracovní skupina i nadále doporučuje použití nesteroidních antiflogistik (NSA) ke zmírnění příznaků onemocnění. Zdůrazňuje však, že je nutné pečlivě zvážit poměr jejich přínosů a rizik, a to zejména v populaci pacientů s kardiovaskulárním nemocněním. NSA mohou být účinná při kontrole symptomů PsA především u pacientů s mírným průběhem nebo u pacientů s axiálním postižením, a to zejména je-li současně použita lokální léčba depotními glukokortikoidy. U pacientů s periferní artritidou by maximální délka monoterapie NSA bez použití DMARD neměla překročit jeden měsíc. Pokud přetrvává aktivita onemocnění, měly by být zváženy další možnosti léčby. Existuje jen málo důkazů o účinnosti NSA při entezitidě a žádné důkazy o jejich efektu na kožní psoriázu. Pokud v klinickém obrazu dominuje axiální postižení nebo entezitida, může léčba NSA pokračovat až po dobu 12 týdnů, pokud je spojena s klinickým efektem.
Doporučení č. 3
Třetí doporučení se zabývá možností zvážit lokální aplikaci depotních glukokortikoidů jako adjuvantní léčby zejména u pacientů s mono - a oligoartritidou, daktylitidou nebo entezitidou. S opatrností mohou být použity i systémové glukokortikoidy v nejnižší účinné dávce a jen po nezbytně nutnou dobu. Jejich použití se nedoporučuje u pacientů s PsA a axiálním postižením.
Doporučení č. 4
U pacientů s polyartritidou by měla být co nejdříve, nejlépe do dvou týdnů, zahájena léčba csDMARD. Aktuální doporučení oproti předchozí verzi rozlišují mezi polyartikulárním a oligoartikulár ním postižením, aby se tak zdůraznil horší prognostický význam polyartritidy. Ta je definována jako postižení pěti a více kloubů. Pacienti s polyartikulárním onemocněním by tedy měli dostat csD MARD buď jako lék první volby, nebo po krátkém cyklu NSA. Použití MTX je preferováno především u pacientů s relevantním kožním onemocněním. To je definováno jako postižení více než 10 % povrchu těla psoriázou, případně menší rozsah postižení s významnějším dopadem na kvalitu života (psoriáza obličeje, rukou, nohou, genitálu). Alternativními léky ze skupiny csDMARD jsou leflunomid a sulfasalazin, u kterých lze ale očekávat slabší efekt na psoriázu. Aktuálně již není doporučeno používat v léčbě PsA cyklosporin.
I když je MTX preferovaným lékem, existuje jen málo důkazů o jeho účinnosti u PsA. Ty zahrnují pouze malé nebo observační studie a nepřímé důkazy ze studie TICOPA.43–45 Přesto je MTX široce používán v běžné klinické praxi, je vhodným lékem pro dlouhodobou léčbu a jeho účinnost, pokud je používán v klinických testech jako srovnávací lék, se zdá být uspokojivá. Léčba csDMARD by měla vést k alespoň 50% zlepšení klinických parametrů onemocnění (měřeno pomocí kompozitních indexů) po 3 měsících léčby a ke splnění cílů léčby po 6 měsících. Pokud těchto cílů není dosaženo, je nezbytné změnit léčebnou strategii. Na rozdíl od léčby revmatoidní artritidy nemáme dostatek důkazů o účinnosti kom binované léčby více léky ze skupiny csD MARD.
Doporučení č. 5
Léky ze skupiny csDMARD by měly být rovněž použity u pacientů s monoartritidou nebo oligoartritidou zejména při přítomnosti negativních prognostických faktorů. Ty zahrnují přítomnost strukturálního poškození kloubů, elevaci zánětlivých markerů, daktylitidu nebo postižení nehtů. Nedávné studie ukazují na určitý efekt MTX u pacientů s daktylitidou. 46, 47 Za zmínku stojí i to, že nebyl prokázán efekt NSA u daktylitid.
Doporučení č. 6
U pacientů s artritidou periferních kloubů, u kterých selhala léčba alespoň jedním csDMARD z důvodu nedostatečného efektu nebo toxicity, by měla být zahájena léčba bDMARD. Přesto u některých pacientů, zejména bez přítomnosti negativních prognostických markerů, může být před zahájením biologické léčby použit jiný lék ze skupiny csDMARD. U pacientů s relevantním kožním postižením je preferováno použití inhibitorů IL - 17 nebo IL-12/23. Důvodem je fakt, že při přímém srovnání s TNFi v klinických studiích vykazovaly inhibitory IL-17 a IL-12/23 lepší efekt na kožní onemocnění.48–50 Skupina inhibitorů IL - 17 zahrnuje dva zástupce, secukinumab a novější ixekizumab, které mají srovnatelnou účinnost a bezpečnostní profil.51 V přímém srovnání ixekizumabu se zástupcem TNFi adalimumabem měly oba léky srovnatelný efekt na muskuloskeletální projevy PsA.52
V klinických studiích byl efekt inhibitoru IL-12/23 ustekinumabu na kloubní postižení numericky slabší, observační studie však prokázaly, že jeho efekt na muskuloskeletální projevy PsA je srovnatelný s TNFi, ale přímé srovnání obou lékových skupin chybí.53 Inhibitory IL - 12/23 nefungují na axiální projevy onemocnění a jejich použití se u takových pacientů nedoporučuje. Použití TNFi je naopak upřednostňováno u pacientů s PsA a akutní přední uveitidou.
Až na určitá specifika je účinnost všech skupin bDMARD, tedy inhibitorů TNFα, IL-17 a IL-12/23, srovnatelná. Autoři nových doporučení tak nevidí důvod, aby byla při léčbě PsA upřednostňována některá z těchto lékových skupin.
Bezpečnostní profil jednotlivých bD MARD se zdá být srovnatelný, ale existují určité výjimky, jako například zvýšené riziko lokalizované kandidózy nebo riziko rozvoje nespecifického střevního zánětu (IBD) u pacientů léčených inhibitory IL-17. Jejich použití tedy není vhodné u pacientů s konkomitantním IBD.
Diskutuje se rovněž použití bDMARD v monoterapii nebo kombinaci s csD MARD, zejména s MTX. Chybí ale důkazy o lepší účinnosti kombinované léčby.54 Pokud po zahájení léčby bD MARD léčba MTX pokračuje a pacient ho toleruje, je doporučeno, aby poté, co je dosažen cíl léčby, byla dávka MTX redukována, obzvláště při obavách o bezpečnost léčby, případně byla léčba MTX ukončena.
Doporučení č. 7
U pacientů s artritidou periferních kloubů a s nedostatečnou odpovědí na alespoň jeden csDMARD a alespoň jeden bDMARD nebo u pacientů, u kterých není vhodné použít bDMARD, je doporučeno zahájit léčbu JAKi. V současnosti je v této indikaci schválen pouze tofacitinib, který je možné použít v kombinaci s MTX k léčbě dospělých pacientů s PsA, u kterých nebyla předchozí léčba DMARD účinná nebo ji netolerovali. Tofacitinib měl v klinických studiích srovnatelný efekt na kloubní projevy onemocnění jako TNFi, ale slabší efekt na kožní onemocnění.55 Velmi nadějné jsou výsledky klinických studií III. fáze, ve kterých jsou pacienti s PsA léčeni selektivním JAK1 inhibitorem upadacitinibem v dávkách 15 a 30 mg denně.56, 57 Studie SELECT-PsA1 zahrnuje pacienty s PsA po selhání předchozí léčby alespoň jedním csDMARD, studie SELECT-PsA2 pak pacienty po selhání alespoň jednoho bDMARD. Upadacitinib v dávkách 15 a 30 mg denně byl v obou výše citovaných studiích významně efektivnější než placebo a ve studii SELECT-PsA1 noninferiorní ve srovnání s TNFi adalimumabem. V této studii navíc významně zpomaloval rentgenovou progresi onemocnění.
Doporučení č. 8
U pacientů s mírnějším onemocněním a s neadekvátní odpovědí na alespoň jeden csDMARD, u kterých není vhodné zahájit léčbu bDMARD nebo JAKi, by měla být zvážena léčba PDE4i apremilastem. Mírnějším onemocněním se myslí zejména oligoartritida, nižší hodnoty aktivity podle kompozitních indexů a limitované kožní postižení. Efekt apremilastu v klinických studiích jen málo převyšoval efekt placeba a zatím zcela chybí důkazy o jeho pozitivním vlivu na strukturální progresi.58 Zdůrazňuje se ale jeho příznivý bezpečnostní profil.
Doporučení č. 9
U pacientů s jednoznačnou entezitidou neodpovídající na terapii NSA a lokální terapii glukokortikoidy by měla být zahájena léčba bDMARD (TNFi, inhibitory IL-17 nebo IL-12/23). K průkazu entezitidy by mělo stačit klinické vyšetření, při nejistotě ale musí být doplněno o vyšetření ultrazvukem nebo magnetickou rezonanci. Efekt csDMARD u entezitid nebyl prokázán.
Doporučení č. 10
U pacientů s dominujícím axiálním postižením, které je aktivní, a s nedostatečnou odpovědí na NSA by měla být zvážena terapie bDMARD. Současnou praxí je použití TNFi, ale v případě relevant ního kožního postižení jsou preferovány inhibitory IL-17.58 TNFi jsou rovněž preferovány u pacientů se současným IBD.
Doporučení č. 11
U pacientů s neadekvátní odpovědí na léčbu bDMARD nebo při jeho intoleranci by měla být zvážena změna na jiný bDMARD nebo tsDMARD, a to včetně jedné změny v rámci jedné lékové skupiny (například TNFi).
Doporučení č. 12
U pacientů s dlouhodobou remisí onemocnění trvající alespoň 6 měsíců může být zvážena opatrná redukce dávky bD MARD. Předčasné ukončení léčby bDMARD však může znamenat zvýšené riziko relapsu onemocnění.59
Závěr
PsA je chronické zánětlivé onemocnění s heterogenními projevy a potenciálním rizikem závažného průběhu spojeným se strukturální progresí, s omezením fyzických a pracovních schopností a s poklesem kvality života. Mezi pestré klinické projevy onemocnění patří postižení kloubů artritidou, daktylitida, entezitida, postižení kůže a nehtů psoriázou, extraskeletální manifestace onemocnění, jako je akutní přední uveitida nebo IBD. K přidruženým onemocněním, zvyšujícím morbiditu a mortalitu pacientů s PsA, patří především metabolický syndrom a kardiovaskulární onemocnění. Nesprávná nebo pozdě stanovená diagnóza PsA může mít dramatický dopad na její průběh a může vést k nekontrolované strukturální progresi. Dermatologové mají nezastupitelnou roli v časném rozpoznání choroby, nicméně za definitivní potvrzení diagnózy a následnou léčbu je zodpovědný přede vším revmatolog. K diagnostice PsA je možné použít klasifikační kritéria CASPAR, vybrané laboratorní markery a moderní zobrazovací techniky.
K hodnocení aktivity onemocnění a odpovědi na léčbu se používají kompozitní skórovací systémy. Důležité je hodnocení dopadu onemocnění na strukturální progresi, fyzické a pracovní schopnosti a kvalitu života. Adekvátní léčba onemocnění musí být zahájena včas. Měla by zohledňovat všechny muskulokeletální projevy, závažnosti kožního postižení, prognózu pacienta, riziko nežádoucích účinků, přítomnost komorbidit, ale i cenu léčby. Cílem moderní léčby PsA by mělo být dosažení a dlouhodobé udržení remise nebo alternativně nízké aktivity onemocnění. Při rozhodování o léčebné strategii je nutné brát v potaz i přání a názory pacienta a zvolená léčebná strategie by měla být výsledkem sdíleného rozhodnutí mezi pacientem a lékařem. Primárním cílem léčby pacienta s PsA je maximální zlepšení zdravím podmíněné kvality života prostřednictvím kontroly symptomů onemocnění, prevence strukturálního postižení, normalizace funkčních schopností a sociálních aktivit. Důležitým prostředkem k dosažení těchto cílů je adekvátní potlačení chronické zánětlivé odpovědi.
Zdroje
1. Gladman D, Antoni C, Mease P, et al. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann Rheum Dis 2005;64(Suppl 2):ii14–ii17.
2. Liu JT, Yeh HM, Liu SY, et al. Psoriatic arthritis: Epidemiology, diagnosis, and treatment. World J Orthop 2014;5(4):537–543.
3. Slobodin G, Rosner I, Rozenbaum M, et al. Psoriatic arthropathy: where now? Isr Med Assoc J 2009;11 : 430–434.
4. de Vlam K, Gottlieb AB, Mease PJ. Current concepts in psoriatic arthritis: pathogenesis and management. Acta Derm Venereol 2014;94(6):627–34.
5. Kavanaugh A, Philip Helliwell P, Ritchlin CT. Psoriatic arthritis and burden of disease: patient perspectives from the population-based multinational assessment of psoriasis and psoriatic arthritis (MAPP). Survey Rheumatol Ther 2016;3(1):91–102.
6. Ritchlin C, Colbert RA, Gladman D. Psoriatic arthritis. New Engl J Med 2017;376(10):957–970.
7. Tillett W, Jadon D, Shaddick G, et al. Smoking and delay to diagnosis are associated with poorer functional outcome in psoriatic arthritis. Ann Rheum Dis 2013;72(8): 1358–1.
8. Jones SM, Armas JB, Cohen MG, et al. Psoriatic arthritis: outcome of disease subsets and relationship of joint disease to nail and skin disease. Br J Rheumatol 1994;33 : 834–839.
9. Rajendran CP, Ledge SG, Rani KP, et al. Psoriatic arthritis. J Assoc Physicians India 2003;51 : 1065–1068.
10. Torre Alonso JC, Rodriguez Perez A, Arribas Castrillo JM, et al. Psoriatic arthritis (PA): a clinical, immunological and radiological study of 180 patients. Br J Rheumatol 1991;30 : 245–250.
11. Madland TM, Apalset EM, Johannessen AE, et al. Prevalence, disease manifestations, and treatment of psoriatic arthritis in Western Norway. J Rheumatol 2005;32 : 1918–1922.
12. Ash ZR, Tinazzi I, Gallego CC, et al. Psoriasis patients with nail disease have a greater magnitude of underlying systemic subclinical enthesopathy than those with normal nails. Ann Rheum Dis 2012;71(4):553–6.
13. Li W, Han J, Qureshi AA. Obesity and risk of incident psoriatic arthritis in US women. Ann Rheum Dis 2012;71(8):1267–72.
14. Chandran V, Schentag CT, Brockbank JE, et al. Familial aggregation of psoriatic arthritis. Ann Rheum Dis 2009;68(5):664–7.
15. Acosta Felquer ML, FitzGerald O. Peripheral joint involvement in psoriatic arthritis patients. Clin Exp Rheumatol 2015;33(5 Suppl 93):S26–30.
16. Veale D, Rogers S, Fitzgerald O. Classification of clinical subsets in psoriatic arthritis. Br J Rheumatol 1994;33 : 133–138.
17. Charlton R, Amelia Green A, Shaddick G, et al. Risk of uveitis and inflammatory bowel disease in people with psoriatic arthritis: a population-based cohort study. Ann Rheum Dis 2018;77(2):277–280.
18. Caso F, Del Puente A, Oliviero F, et al. Metabolic syndrome in psoriatic arthritis: the interplay with cutaneous involvement. Evidences from literature and a recent cross - -sectional study. Clin Rheumatol 2018;37(3):579–586.
19. Liew JW, Ramiro S, Gensler LS. Cardiovascular morbidity and mortality in ankylosing spondylitis and psoriaticarthritis. Best Pract Res Clin Rheumatol 2018;32(3):369–389.
20. Taylor W, Gladman D, Helliwell P, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006;54 : 2665–2673.
21. Ibrahim GH, Buch MH, Lawson C, et al. Evaluation of an existing screening tool for psoriatic arthritis in people with psoriasis and the development of a new instrument: the Psoriasis Epidemiology Screening Tool (PEST) questionnaire. Clin Exp Rheumatol 2009;27 : 469–74.
22. Coates LC T Aslam T, Al Balushi F, et al. Comparison of three screening tools to detect psoriatic arthritis in patients with psoriasis (CONTEST study). Br J Dermatol 2013;168(4):802–7.
23. Salaffi F, DiI Carlo M, Luchetti MM, et al. A validation study of the Simple Psoriatic Arthritis Screening (SiPAS) questionnaire to screen psoriasis patients for psoriatic arthritis. Clin Exp Rheumatol 2018;36 : 127–35.
24. Lai TL, Yim CW, Wong PY, et al. Hyperuricemia in Asian psoriatic arthritis patients. Int J Rheum Dis. 2018;21(4):843–9.
25. Fernandes S, Etcheto A, van der Heijde D, et al. Vitamin D status in spondyloarthritis: results of the ASAS-COMOSPA international study. Clin Exp Rheumatol 2018;36 : 210–4.
26. Cretu D, Gao L, Liang K, et al. Differentiating psoriatic arthritis from psoriasis without psoriatic arthritis using novel serum biomarkers. Arthritis Care Res 2018;70 : 454–61.
27. Brewerton DA, Hart FD, Nicholls A, et al. Ankylosing spondylitis and HL-A 27. Lancet 1973;1 : 904–7.
28. Dhir V, Aggarwal A. Psoriatic arthritis: a critical review. Clin Rev Allergy Immunol 2013;44 : 141–148.
29. Möller B, Bonel H, Rotzetter M, et al. Measuring finger joint cartilage by ultrasound as a promising alternative to conventional radiograph imaging. Arthritis Rheum 2009;61 : 435–441.
30. Porter GG. Psoriatic arthritis. Plain radiology and other imaging techniques. Baillieres Clin Rheumatol 1994;8 : 465–482.
31. De Simone C, Guerriero C, Giampetruzzi AR, et al. Achilles tendinitis in psoriasis: clinical and sonographic findings. J Am Acad Dermatol 2003;49 : 217–222.
32. Tinazzi I, McGonagle D, Zabotti A, et al. Comprehensive evaluation of finger flexor tendon entheseal soft tissue and bone changes by ultrasound can differentiate psoriatic arthritis and rheumatoid arthritis. Clin Exp Rheumatol 2018;36 : 785–90.
33. Moya Alvarado P, Roe Crespo E, Munozgarza FZ, et al. Subclinical enthesopathy of extensor digitorum tendon is highly prevalent and associated with clinical and ultrasound alterations of the adjacent fingernails in patients with psoriatic disease. J Eur Acad Dermatol Venereol 2018;32 : 1728–36.
34. Eder L, Aydin SZ, Kaeley GS, et al. Options for assessing joints and entheses in psoriatic arthritis by ultrasonography and magnetic resonance imaging: how to move forward. J Rheumatol Suppl 2018;94 : 44–7.
35. Runarsdottir EE, Gunnarsdottir AI, Love TJ, et al. The majority of patients with psoriatic arthritis are not eligible for randomised clinical trials. Clin Exp Rheumatol 2018;36 : 1068–73.
36. Schoellnast H, Deutschmann HA, Hermann J, et al. Psoriatic arthritis and rheumatoid arthritis: findings in contrast-enhanced MRI. AJR Am J Roentgenol 2006;187 : 351–357.
37. Gossec L, McGonagle D, Korotaeva T, et al. Minimal disease activity as a treatment target in psoriatic arthritis: a review of the literature. J Rheumatol 2018;45(1):6–13.
38. Shoels M, Aletaha D, Funovits J, et al. Application of the DAREA/DAPSA score for assessment of disease activity in psoriatic arthritis. Ann Rheum Dis 2010;69(8):1441–1447.
39. Helliwell PS, FitzGerald O, Fransen J, et al. The development of candidate composite disease activity and responder indices for psoriatic arthritis (GRACE project). Ann Rheum Dis 2013;72(2):986–991.
40. Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020;79 : 700–12.
41. Štofla J, Vencovský J, Pavelka K. Doporučené léčebné postupy pro psoriatickou artritidu. Čes Revmatol 2017;24(4):142–52.
42. Coates LC, Kavanaugh A, Mease PJ, et al.; Group for Research and Assessment of Psoriasis and Psoriatic Arthritis. 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol. 2016;68(5):1060–71.
43. Kingsley GH, Kowalczyk A, Taylor H, et al. A randomized placebo-controlled trial of methotrexate in psoriatic arthritis. Rheumatology 2012;51 : 1368–77.
44. Coates LC, Moverley AR, McParland L, et al. Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): a UK multicentre, open-label, randomised controlled trial. Lancet 2015;386 : 2489–98.
45. Heiberg MS, Kaufmann C, Rødevand E, et al. The comparative effectiveness of anti - -TNF therapy and methotrexate in patients with psoriatic arthritis: 6 month results from a longitudinal, observational, multicentre study. Ann Rheum Dis 2007;66 : 1038–42.
46. Lie E, van der Heijde D, Uhlig T, et al. Effectiveness and retention rates of methotrexate in psoriatic arthritis in comparison with methotrexate-treated patients with rheumatoid arthritis. Ann Rheum Dis 2010;69 : 671–6.
47. Mease PJ, Gladman DD, Collier DH, et al. Etanercept and methotrexate as monotherapy or in combination for psoriatic arthritis: primary results from a randomized, controlled phase III trial. Arthritis Rheumatol 2019;71 : 1112–24.
48. Reich K, Armstrong AW, Foley P, et al. Efficacy and safety of guselkumab, an anti-interleukin - 23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: results from the phase III, double-blind, placebo - and active comparator - -controlled voyage 2 trial. J Am Acad Dermatol 2017;76 : 418–31.
49. Blauvelt A, Reich K, Tsai T-F, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate-to-severe plaque psoriasis up to 1 year: Results from the CLEAR study. J Am Acad Dermatol 2017;76:e69 : 60–9.
50. Papp KA, Blauvelt A, Bukhalo M, et al. Risankizumab versus ustekinumab for moderate - to-severe plaque psoriasis. N Engl J Med 2017;376 : 1551–60.
51. Nash P, Kirkham B, Okada M, et al. Ixekizumab for the treatment of patients with active psoriatic arthritis and an inadequate response to tumour necrosis factor inhibitors: results from the 24-week randomised, double-blind, placebo-controlled period of the SPIRIT-P2 phase 3 trial. The Lancet 2017;389 : 2317–27.
52. Mease PJ, Smolen JS, Behrens F, et al. A head-to-head comparison of the efficacy and safety of ixekizumab and adalimumab in biological-naïve patients with active psoriatic arthritis: 24-week results of a randomised, open-label, blinded-assessor trial. Ann Rheum Dis 2020;79 : 123–31.
53. McInnes IB, Kavanaugh A, Gottlieb AB, et al. Efficacy and safety of ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. Lancet 2013;382 : 780–9.
54. Behrens F, Cañete JD, Olivieri I, et al. Tumour necrosis factor inhibitor monotherapy vs combination with MTX in the treatment of PSA: a systematic review of the literature. Rheumatology 2015;54 : 915–26.
55. Mease P, Hall S, FitzGerald O, et al. Tofacitinib or adalimumab versus placebo for psoriatic arthritis. N Engl J Med. 2017; 377 : 1537–50.
56. McInnes IB, Anderson J, Magrey M, et al. Efficacy and safety of upadacitinib versus placebo and adalimumab in patients with active psoriatic arthritis and inadequate response to non-biologic disease-modifying anti-rheumatic drugs (SELECT-PsA 1): a double-blind, randomized controlled phase 3 trial. Eular 2020 e-congress: abstract LB0001.
57. Mease PJ, Lertratanakul A, Anderson JK, et al. Upadacitinib for psoriatic arthritis refractory to biologics: SELECT-PsA 2. Ann Rheum Dis 2020;0 : 1–9.
58. Edwards CJ, Blanco FJ, Crowley J, et al. Apremilast, an oral phosphodiesterase 4 inhibitor, in patients with psoriatic arthritis and current skin involvement: a phase III, randomised, controlled trial (PALACE 3). Ann Rheum Dis 2016;75 : 1065–73.
59. Mease P. Is reduction or discontinuation of therapy an acceptable possibility in psoriatic arthritis? Clin Exp Rheumatol 2013;31:S59–62.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek COVID-19: aktuální přehled
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
-
COVID-19:
aktuální přehled - Časté bolesti hlavy: hodnocení a léčba
-
Komentář k článku
Časté bolesti hlavy:
hodnocení a léčba -
Farmakoterapie neuropatické bolesti
pohledem diabetologa -
Prediabetes:
včasnou léčbou lze výrazně ovlivnit prognózu pacienta -
Cíle kompenzace
a farmakologické možnosti léčby diabetu
u starších pacientů -
Profesor Štěpán Svačina:
Technika umí hodně, ale setkání s pacientem nenahradí -
Psoriatická artritida –
současné možnosti diagnostiky a léčby -
Onemocnění příštítných tělísek –
nenápadný, ale často závažný stav
Co je třeba znát v praxi? Pohled nefrologa -
Léčba osteoporózy v roce 2021 –
zaměřeno na denosumab -
Jaký diagnostický ultrazvuk
do ordinace praktického lékaře? -
Horké aktuality
v registracích EMA -
Farmakoterapie srdečního selhání
se sníženou ejekční frakcí:
novější léčebné postupy -
Komplexní terapie
chronických bércových ulcerací venózní etiologie -
Infekce močového traktu:
jak správně diagnostikovat a léčit? -
Sebevražedné jednání:
motivy, rizika, prevence, pandemie -
Specifika komunikace a nové výzvy
při sdělování závažných zpráv během pandemie COVID-19
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Onemocnění příštítných tělísek –
nenápadný, ale často závažný stav
Co je třeba znát v praxi? Pohled nefrologa -
Psoriatická artritida –
současné možnosti diagnostiky a léčby -
Infekce močového traktu:
jak správně diagnostikovat a léčit? -
Farmakoterapie srdečního selhání
se sníženou ejekční frakcí:
novější léčebné postupy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



