-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba osteoporózy v roce 2021 –
zaměřeno na denosumab
Autoři: MUDr. Oulehle Kateřina; MUDr. Novák Vladimír
Působiště autorů: Klatovská nemocnice a. s. ; Diabetologická a endokrinologická ambulance ; Interní oddělení a hemodialyzační středisko
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 2, s. 59-65
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Osteoporóza je chronické multifaktoriální onemocnění, charakterizované úbytkem kostní hmoty a poklesem její kvality následkem strukturálních změn. Vede ke křehkosti kostí a je spojena s rizikem osteoporotických zlomenin proximálních femurů, obratlů, zápěstí a dalších lokalizací. Osteoporóza typicky postihuje ženy po menopauze v důsledku pro kost nepříznivých hormonálních změn (Obr. 1). Ve vyšších věkových skupinách (nad 70 let) bývají častěji postiženi i muži. U mladších jedinců je nutné zvážit riziko osteoporózy při kumulaci rizikových faktorů. Česká republika bohužel patří mezi země s vysokou podléčeností osteoporózy. Vázne zejména primární prevence osteoporózy, kdy efektivně nevyhledáváme a neléčíme nemocné s vysokým rizikem fraktury, což má za následek vysokou incidenci osteoporotických fraktur.
Přibližně 1 žena ze 3 ve věku nad 70 let si zlomí kost v důsledku osteoporózy. Až 1 ze 4 pacientů po operaci proximálního femuru do 12 měsíců zemře, z toho 9 z 10 pacientů potřebuje v prvním roce po operaci pomoc druhé osoby v každodenním životě. Je třeba si uvědomit, že první osteoporotickou frakturou se až pětkrát zvyšuje riziko další zlomeniny, a to již v prvním roce po prodělané první fraktuře. V této rizikové populaci je odhadem léčen pouze 1 pacient ze 4, což indukuje i nemalé finanční náklady nutné na léčbu zlomenin a následnou péči v porovnání s prostředky, které by bylo nutné vynaložit na primární prevenci. V ní mají nezastupitelnou úlohu zejména všeobecní praktičtí lékaři – právě oni jsou ti, kteří v rámci primární prevence odesílají rizikové pacienty k osteologickému vyšetření, aby jim mohla být následně poskytnuta adekvátní péče.
Obr. 1. Incidence zlomenin obratlů stoupá brzy po menopauze, což odpovídá časné ztrátě trabekulární kosti. [Upraveno podle: Harvey N, et al. In: Rosen CJ, ed. Primer on the metabolic bone diseases and disorders of mineral metabolism. 7th ed. Washington, DC: American Society for Bone and Mineral Research 2008:198–203.] ![Incidence zlomenin obratlů stoupá brzy po menopauze, což odpovídá časné ztrátě trabekulární
kosti. [Upraveno podle: Harvey N, et al. In: Rosen CJ, ed. Primer on the metabolic bone diseases and
disorders of mineral metabolism. 7th ed. Washington, DC: American Society for Bone and Mineral
Research 2008:198–203.]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/996c7144b28e1c61db93e9b2ba6e9316.png)
Vzhledem k prodlužující se délce života se osteoporóza a její léčba stává stále častěji diskutovaným medicínským a socioekonomickým problémem. Osteoporotické fraktury mnohdy snižují kvalitu života, způsobují pacientovi bolest, činí ho závislým na svém okolí a v neposlední řadě značně zhoršují life expectancy (naděje dožití). Se stárnutím populace je vzhledem k dalším koexistujícím onemocněním kladen stále větší důraz na potřebu individualizace terapie. Současné farmakoterapeutické možnosti zahrnují hormonální substituční léčbu a poměrně širokou rodinu antiresorpčních léků, kterou tvoří bisfosfonáty a humánní monoklonální protilátka proti ligandu receptoru RANK/RANKL (receptor activator for nuclear factor kappa B ligand) denosumab.
Článek se věnuje zejména denosumabu, který je asi nejzajímavějším a nejvíce diskutovaným lékem na osteoporózu v dnešní době. Podrobněji jsou popsány mechanismus jeho účinku a výsledky tříleté placebem kontrolované studie FREE DOM, v níž byla sledována účinnost a bezpečnost denosumabu, a její otevřené extenze FREEDOM Extension Trial, kde byli pacienti sledováni po dobu 10 let. V neposlední řadě je zmíněn i management terapie bisfosfonáty-denosumab.
Diagnostika osteoporózy
Možnost diagnózy osteoporózy u pacientů často nebývá zvažována, protože jde o onemocnění zcela asymptomatické až do první zlomeniny, přitom prevalence osteoporózy je podle zahraničních zdrojů odhadována na 5–8 % populace. Diagnóza osteoporózy je velmi často stanovena až při první zlomenině. Tato událost však již znamená pro pacienta ve většině případů zhoršení fyzického i psychického stavu, často vede k významnému zhoršení mobility a soběstačnosti a je také hlavním rizikovým faktorem dalších zlomenin. Osteoporotickou zlomeninou se rozumí taková zlomenina, která je způsobena nepřiměřeně malou energií, malým násilím. Typickou osteoporotickou zlomeninou je kompresivní zlomenina obratlového těla a zlomenina proximální části stehenní kosti; bývá k nim přiřazována také zlomenina distálního předloktí. Z pacientů se zlomeninou proximální části stehenní kosti je více než polovina odkázána po jednom roce od úrazu na užití pohybových pomůcek nebo pomoc druhé osoby, mortalita v prvním roce po zlomenině dosahuje 20 %. Nutno dodat, že zlomeninu proximálního femuru v České republice prodělá téměř 20 000 lidí ročně.
Vlastní diagnostika osteoporózy v kostce: lékař prvního kontaktu vyhodnotí rizikové faktory osteoporotické zlomeniny. Těmi zásadními jsou věk, dále pohlaví, známky malnutrice (BMI pod 19), již prodělaná nízkotraumatická zlomenina, dlouhodobá kortikoterapie, nikotinismus, abúzus alkoholu a další sekundární příčiny osteoporózy. Takto rizikového pacienta poté odešle do osteologického centra, kde diagnostika sestává z laboratorního a zobrazovacího vyšetření.
Zlatým standardem zůstává kostní denzitometrie (DXA) fungující na principu absorpce rentgenového záření při průniku kostí. DXA stanovuje dvě kvality ve vyšetřovaném úseku kosti – obsah minerálu (BMC – bone mineral content) a denzitu kostního minerálu (bone mineral density – BMD). Vyšetřovanými oblastmi jsou oblast lumbální páteře, proximální femur včetně krčku a oblast distálního předloktí. Stupeň řídnutí kostí se interpretuje pomocí tzv. T-skóre na základě směrodatné odchylky (SD) od průměru populace mladých dospělých žen (více viz box). Normální T-skóre je −1,0 a vyšší, T-skóre −1,0 až −2,5 je pásmo osteopenie a T-skóre nižší než −2,5 značí osteoporózu.
Laboratorní vyšetření vždy zahrnuje základní biochemická vyšetření, tj. kompletní mineralogram, ledvinové parametry, jaterní testy včetně ALP, ELFO bílkovin, hladinu 25-(OH)-D3 vitaminu, osteoresorpční marker sCTX (C terminální telopeptid kolegenu I), marker kostní novotvorby PINP (prokolagen typu IN) a odpad vápníku močí. Odběry dále rozšiřujeme na základě diferenciální diagnostiky. Je důležité zmínit, že neexistují žádná jasná doporučení hodnot kostních markerů, od kterých je nutno zahájit farmakologickou intervenci. Výše markerů kostního obratu sice koreluje se závažností osteoporózy, ale používá se spíše jako ukazatel účinnosti antiresorpční terapie a adherence pacienta k léčbě.

Léčba osteoporózy
Terapeutický přístup k pacientovi s osteoporózou musí být komplexní. Léčba sestává z řady nefarmakologických opatření a vlastní farmakoterapie.
Nefarmakologická opatření
Nefarmakologická opatření kladou důraz zejména na pravidelnou pohybovou aktivitu. Každodenní středně intenzivní pohyb trvající alespoň 30 minut, především chůze nebo jízda na rotopedu, aktivuje osteoblasty, brání atrofování svalstva, zvyšuje svalovou sílu a zlepšuje celkovou stabilitu těla. Neméně důležitá je prevence pádů, kdy rizikové pacienty edukujeme o nutnosti eliminovat nástrahy v bytě v podobě koberečků, nešikovně rozestavěného nábytku či předmětů, o které by mohl pacient snadno zakopnout. Častou příčinou pádů jsou závrativé stavy a nedostatečná či žádná korekce zraku. S těmito opatřeními by měl lékař prvního kontaktu seznámit i pacientovy blízké, kteří jej mohou např. motivovat k pohybové aktivitě nebo pomoci s uspořádáním zařízení bytu.
Kvalitní a dostačující výživa je další důležitou součástí nefarmakologické terapie. Velkým problémem je zejména proteinokalorická malnutrice v nejvyšší věkové kategorii, která významně přispívá ke křehkosti, morbiditě, zhoršené schopnosti pooperační rekonvalescence a inklinaci k infekčním komplikacím.
Vitamin D a vápník
Dalším důležitým krokem k prevenci osteoporózy je zajištění adekvátního příjmu vápníku a vitaminu D. Vitamin D zajišťuje adekvátní střevní resorpci vápníku a jeho nedostatek vyúsťuje v negativní vápníkovou bilanci a tím následně vede ke zvýšené kostní resorpci. U postmenopauzálních žen a starších mužů je obecně doporučován optimální příjem vápníku kolem 1200 mg a vitaminu D kolem 800 IU denně. Optimálního příjmu lze dosáhnout kombinací stravy a doplňků.
Vápník. Zda je příjem vápníku ve st ravě dostatečný, můžeme odhadnout na základě pohovoru s pacientem, kdy např. sklenice mléka, jogurt či 30 gramů tvrdého sýra obsahují po 300 mg vápníku; ostatní nutričně vyvážená strava (zelená zelenina, ořechy, cereálie) poskytnou přibližně dalších 200 mg vápníku denně. V případě, že není možné dosáhnout požadovaného množství vápníku ve stravě, zahájíme jeho suplementaci. Obecně se nedoporučuje přesahovat celkový denní příjem vápníku přes 2000 mg/den, neboť se zvyšuje riziko vzniku nežádoucích účinků. Z výsledku randomizovaných studií vyplývá, že postmenopauzální ženy užívající suplementa vápníku jsou ve vyšším riziku vzniku nefrolitiázy nežli ženy užívající placebo. Riziko kardiovaskulárních komplikací při suplementaci vápníku je diskutabilní a kontroverzní téma, nutno dodat, že dosavadní studie neprokázaly zvýšené riziko aterosklerózy při příjmu vápníku ze stravy. Při substituci vápníku je potřeba pacienta upozornit na možný nežádoucí účinek v podobě zácpy a nutnost jeho užívání v jiném čase nežli tyreoidální hormony a železo, jejichž vstřebávání tak může být ovlivněno. Nejčastěji užívanou formou vápníkového doplňku je kalcium karbonát nebo kalcium citrát. Výhodou kalcium citrátu je jeho dobré vstřebávání nalačno a bez přítomnosti žaludeční kyseliny oproti kalcium karbonátu, který je podmíněn užíváním s jídlem a jehož vstřebávání je významně omezeno při současném užívání IPP a H2-blokátorů.
Vitamin D. Jedna sklenice mléka obsahuje odhadem 100 IU vitaminu D, syntéza vitaminu D při solární expozici je účinně blokována krémy s ochranným faktorem a je známo, že lidé nad 70 let nedokážou tímto způsobem vitamin D účinně syntetizovat. Nejčastěji se podává cholekalciferol. Kalcitriol jakožto nejaktivnější forma vitaminu D není pro vyšší riziko vzniku hyperkalcemie a hyperkalciurie při léčbě osteoporózy obecně doporučován, své místo nachází při terapii sekundárního hyperparatyreoidismu v rámci CKD. Aktuálně vitamin D zažívá svoji renesanci v souvislosti s pandemií onemocnění CO VID-19, kdy výsledky studií naznačují jeho úlohu v redukci rizika vzniku respiračního onemocnění a souvislost zvýšeného rizika vzniku syndromu dechové tísně s deficitem vitaminu D.
Stejná doporučení týkající se příjmu vápníku a vitaminu D platí pro pacienty s chronickým onemocněním ledvin, kteří mají eGFR vyšší nežli 30 ml/min a u nichž není známa existence přidružené MBD (mineral and bone disorder), která se vyvíjí ve spojení se sekundární hyperparatyreózou a v důsledku akumulace fosforu. Odlišný přístup je u pacientů s pokročilou chronickou renální insuficiencí, u nichž je eGFR nižší než 30 ml/min, a tudíž u nich existuje vyšší riziko vzniku kardiovaskulárních komplikací v souvislosti se zvýšeným příjmem vápníku.
Farmakoterapie osteoporózy
Medikamentózní léčbu osteoporózy představuje v první linii léčba antiresorpční, tedy bisfosfonáty a denosumab, na který je zaměřena další stať.
K zahájení specifické medikamentózní léčby osteoporózy je vyžadováno splnění alespoň jednoho z kritérií:
• Prvním z nich je T-skóre ≤ −2,5. Jde o výsledek měření BMD (bone mineral density), získaný celotělovým denzitometrem (dvouenergiová absorpční fotometrie), který se porovnává s tabulkovými hodnotami mladých zdravých žen – T-skóre je výsledkem tohoto porovnání, udává počet směrodatných odchylek.
• Druhým kritériem je přítomnost osteoporotické zlomeniny.
Denosumab
Denosumab je monoklonální protilátka, specificky se vázající na RANKL a zabraňující jeho vazbě na RANK receptor. Systém RANKL/RANK/OPG hraje klíčovou roli ve formaci a aktivaci osteoklastů. RANKL (receptor activator of nuclear factor-kappa B ligand), cytokin produkovaný osteoblasty a aktivovanými T buňkami v kostní dřeni, se váže na receptor RANK (receptor activator of nuclear factor-kappa B) na povrchu osteoklastů, potažmo jejich prekurzorů, a je schopen vyvolat jejich aktivaci, resp. maturaci. Další cytokin OPG (osteoprotegerin) svou vazbou na RANK aktivační cestu osteoklastů blokuje; regulace systému je dána mírou exprese jednotlivých cytokinů. Podpora exprese RANKL je hlavním etiopatogenetickým mechanismem hlavních osteoresorpčních činitelů, včetně glukokortikoidů a PTH.
Zásadní odlišností denosumabu proti bisfosfonátům je jeho farmakokinetika. Jako u jiných imunoglobulinů nedochází k jeho extravaskulární distribuci a je eliminován prostřednictvím buněk retikuloendoteliálního systému, kterými je fagocytován a následně rozložen na malé molekuly a aminokyseliny. Po jednorázovém podkožním podání denosumabu bylo dosa ženo maximální sérové koncentrace za 10 dní a následně jeho koncentrace klesala s poločasem 26 dní; u 53 % pacientů nebyla jeho hladina po 6 měsících od podání měřitelná. Farmakokinetika denosumabu není ovlivněna jaterní ani renální funkcí.
Denosumab je v současné době indikován v dávce 60 mg 1× za 6 měsíců v následujících případech:
• Léčba osteoporózy u postmenopauzálních žen a u mužů se zvýšeným rizikem zlomenin.
• Léčba úbytku kostní hmoty vzniklého následkem hormonální ablace u mužů trpících karcinomem prostaty, u kterých je riziko vzniku zlomenin zvýšené.
• Léčba úbytku kostní hmoty spojeného s dlouhodobou systémovou léčbou glukokortikoidy u dospělých pacientů se zvýšeným rizikem zlomenin.
Pro úhradu z veřejného zdravotního pojištění je nutné splnění dvou podmínek:
1. denzitometrické kritérium osteoporózy,
2. věk pacienta nad 70 let nebo osteoporotická zlomenina nebo ve zdravotnické dokumentaci prokázaná neúčinnost, kontraindikace nebo nesnášenlivost jiných antiresorpčních léků – v současné době tedy především bisfosfonátů, a to bývá zejména při jejich gastrointestinální nesnášenlivosti nebo při těžké renální insuficienci.
Účinnost denosumabu u postmenopauzálních žen s osteoporózou byla prokázána v rozsáhlé, dvojitě zaslepené, placebem kontrolované studii FREE DOM, do které bylo zařazeno 7868 žen ve věku 60–90 let a kterou dokončilo 82 % z nich. Ve 36. měsíci sledování bylo relativní riziko vertebrálních fraktur v léčené skupině proti placebové nižší o 68 %, riziko zlomenin proximální části stehenní kosti bylo sníženo o 40 % a jakýchkoliv dalších zlomenin o 20 %. Většina pacientek zařazených ve studii pokračovala v její extenzi až na 10 let, kde byla prokázána dlouhodobá bezpečnost denosumabu a přetrvávající efektivita s pokračujícím útlumem kostní resorpce a redukcí rizika zlomenin (Obr. 2).
Obr. 2. Denosumab má reverzibilní účinek na resorpci kostí. [Upraveno podle: Bone HG, et al. Effects of denosumab treatment and discontinuation on bone mineral density and bone turnover markers in postmenopausal women with low bone mass. J Clin Endocrinol Metab 2011;96:972–80.] ![Denosumab má reverzibilní účinek na resorpci kostí. [Upraveno podle: Bone HG, et al. Effects of denosumab treatment and discontinuation on bone
mineral density and bone turnover markers in postmenopausal women with low bone mass. J Clin Endocrinol Metab 2011;96:972–80.]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f38c5465e5d3b1e5ce3002fadabd3529.png)
Pro porovnání s bisfosfonáty, při léčbě alendronátem ve studii FIT bylo prokázáno snížení relativního rizika fraktury vertebrálního obratle o 47–50 % a snížení relativního rizika fraktury proximální části stehenní kosti o 51–56 %; ve studiích s risedronátem bylo během 3 let u postmenopauzálních žen s 1–2 předchozími vertebrálními frakturami prokázáno snížení relativního rizika vertebrální fraktury o 41–49 % a riziko zlomeniny proximální části stehenní kosti o 46 %; podle post hoc analýzy podskupin studie HORIZON - -PFT a HORIZON-RFT byl po 3 letech ve skupině po jedné infuzi 5 mg zoledronátu o 32 % redukován počet všech zlomenin a o 68 % počet vertebrálních zlomenin proti skupině, které bylo aplikováno placebo. Obecné srovnání denosumabu s bisfosfonáty je uvedeno v tabulce 1.
Tab. 1. Srovnání denosumabu s ostatními antiresorpčními léky 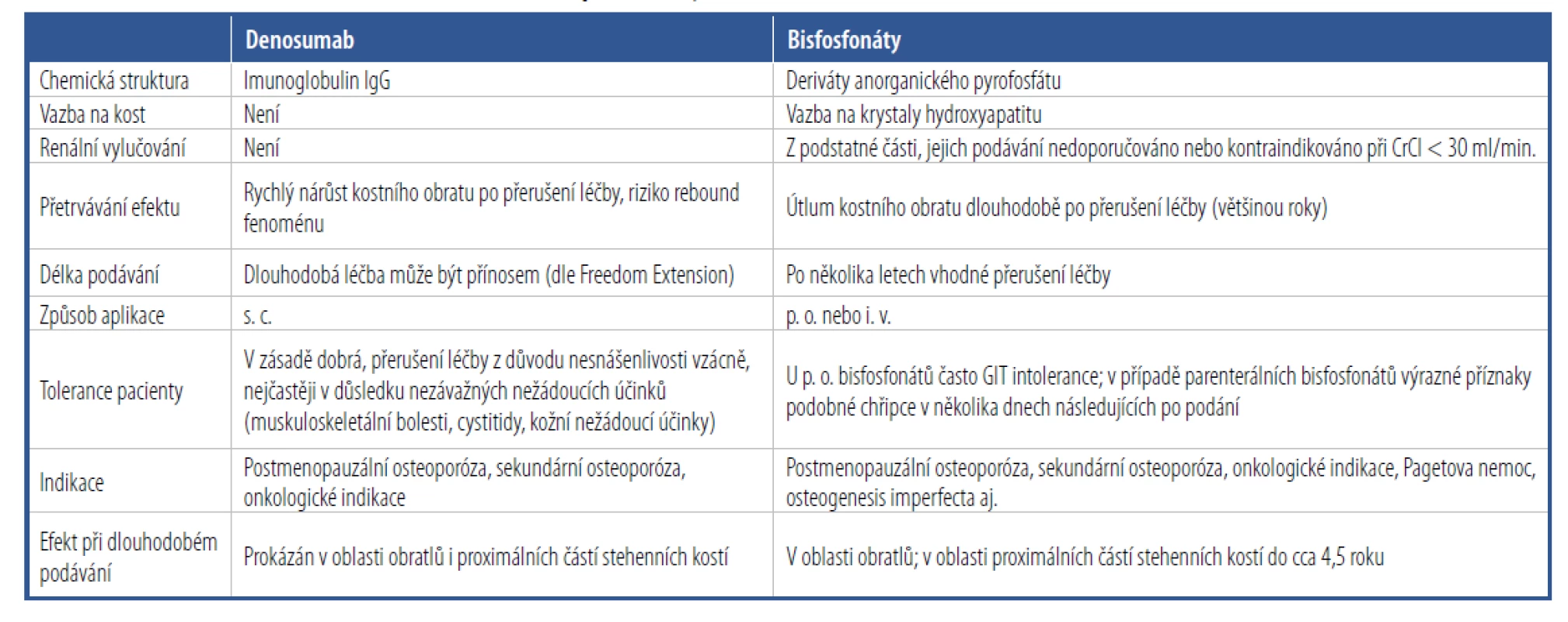
Denosumab má doložen kontinuální nárůst kostní denzity v oblasti proximálních femurů, což je rozdíl proti bisfosfonátům, kde dochází k nárůstu BMD v této oblasti jen po dobu asi 4,5 roku a v dalším období BMD stagnuje nebo klesá na výchozí úroveň. Nárůst BMD v oblasti proximální části stehenní kosti je nejvyšší ze všech antiresorpčních léků právě u denosumabu. Tento jeho efekt je připisován mimo jiné jeho celkově výraznějšímu antiresorpčnímu efektu a výraznějšímu působení na kortikální kost.
Kromě indikací osteologických je denosumab používán také onkology jako prevence kostních příhod při léčbě pokročilých malignit postihujících kosti a k léčbě neresekabilního velkobuněčného kostního nádoru. Zde je ovšem výrazně vyšší dávkování denosumabu – 120 mg 1× za 4 týdny. V klinických studiích byl denosumab srovnáván se zoledronátem u pacientů se solidními metastatickými tumory a u pacientů s mnohočetným myelomem. Progrese onemocnění a celkové přežití, stejně tak efekt na bolest byly u obou preparátů obdobné, u solidních nádorů měl denosumab proti zoledronátu mírně delší dobu do první kostní příhody.
Základní klinickou otázkou u antiresorpčních léčiv je vedle správné indikace délka trvání jejich medikace. U bisfosfonátů, které jsou dlouhodobě deponovány ve skeletu a jejichž účinek po vysazení léku přetrvává ještě několik let a úroveň kostního obratu se po jejich vysazení velmi pozvolna navrací k úrovni před léčbou, je běžné léčbu po 5–6 letech na několik dalších let přerušit. Pro tento postup existují dva hlavní důvody: jednak klesá jejich účinnost (po 4,5 letech léčby nebyl ve studiích zaznamenán další nárůst BMD v oblasti proximálních femurů), jednak se s délkou léčby zvyšuje incidence nežádoucích účinků (atypické zlomeniny femuru a osteonekrózy čelisti).
Délka medikace denosumabem je diskutovaným tématem. Dlouhodobá léčba u něj má proti bisfosfonátům více výhod a jeho vysazení je komplikováno tzv. rebound fenoménem. První výhodou je výše popisovaný přetrvávající nárůst BMD v oblasti obratlů i proximálních femurů, druhou příznivý bezpečnostní profil. Ve studii FREEDOM byl v prvním roce výskyt nežádoucích účinků 165,3 na 100 pacientských roků, v 7. roce extenze této studie to bylo 95,9 na 100 pacientských roků, počet závažných nežádoucích účinků byl v těchto fázích studie stacionární (11,5, resp. 14,4 na 100 pacientských roků). Mírně zvyšující se incidence v posledních letech studie byla zaznamenána u osteonekrózy čelisti, absolutní riziko ale bylo i zde velmi malé (celkem 13 případů na 4550 žen během 10 let).
Podrobnější analýza dat ze studie FREEDOM, zaměřená na skupinu pacientek po předčasném vysazení denosumabu, svědčí pro existenci tzv. rebound fenoménu. Hladiny markerů kostního obratu po ukončení léčby denosumabem stoupají výrazně nad vstupní úroveň, kulminují po 12 měsících a ke vstupní úrovni se vracejí po dalších 12 měsících, BMD klesá během 12 měsíců po ukončení léčby na vstupní úroveň. Riziko zlomenin rychle stoupá po vysazení denosumabu na úroveň neléčené populace a riziko vícečetných vertebrálních zlomenin je signifikantně vyšší. Nejrizikovější populací jsou pacienti s předchozí prodělanou vertebrální zlomeninou.
Bylo zjištěno, že několikaletá léčba bisfosfonáty, předcházející léčbu denosumabem, může rebound fenomén utlumit, stejně tak nasazení bisfosfonátů po vysazení denosumabu. Podávání bisfosfonátů po vysazení denosumabu nazýváme konsolidační antiresorpční léčbou. SMOS ČLS JEP (Společnost pro metabolická onemocnění skeletu) doporučuje navázat po 6 měsících od poslední aplikace denosumabu léčbou perorálními bisfosfonáty nebo intravenózním ibandronátem nebo po 9 měsících zoledronátem a navazující léčba bisfosfonáty by měla trvat alespoň 2 roky.
Denosumab je obecně dobře tolerovaným léčivem. Většina nežádoucích účinků léku je mírných a nevyžaduje přerušení léčby, nejčastěji jde o bolesti zad, končetin, muskuloskeletální bolesti, cystitidy, infekce horních dýchacích cest, zácpu a břišní obtíže, kožní projevy (vyrážka, ekzém, alopecie).
Ze závažnějších nežádoucích účinků hrozí především v prvních týdnech léčby vývoj hypokalcemie. Pacienty je nutno během léčby substituovat kalciem a vitaminem D, ve většině studií s denosumabem bylo pacientům podáváno alespoň 1000 mg kalcia a 800 j. vitaminu D denně. Je nutné identifikovat rizikové pacienty, zejména s nedostatečností ledvin, malabsorpcí nebo hypoparatyreózou. Hypokalcemie je kontraindikací zahájení léčby. Nutno podotknout, že část vyšetřovaných pacientů má sníženou hladinu albuminu, proto je potřeba k diagnóze hypokalcemie využívat hodnotu kalcemie korigovanou na albumin.
U pacientů léčených denosumabem bylo zjištěno mírně zvýšené riziko závažných infekcí, a to především kožních (celulitid). Metaanalýza 33 randomizovaných kontrolovaných studií provedených s denosumabem, v nichž bylo zahrnuto celkem 22 253 pacientů, které proběhly do 27. května 2019, ukázala zvýšené riziko závažných infekcí ORL a gastrointestinální oblasti, relativní riziko všech infekcí a úmrtí z infekčních příčin ale nebylo významnější než u porovnávané populace neléčené denosumabem.
Vzácně byla u pacientů léčených denosumabem hlášena osteonekróza čelisti. Léčba nemá být zahajována u pacientů s lézemi měkkých tkání dutiny ústní a u pacientů s rizikovými faktory (špatná hygiena dutiny ústní, zákroky v dutině ústní, různé formy imunosuprese apod.) je vhodné zubní vyšetření a individuální posouzení rizika a přínosu. Samotnou osteonekrózu řeší osteolog ve spolupráci se stomatologem. Zubní výkony během léčby musí být pečlivě plánovány a zajištěny.
Na vzácnou, ale závažnou atypickou frakturu femuru je třeba myslet a aktivně po ní pátrat, vzhledem k častému bilaterálnímu výskytu vyšetřit i kontralaterální končetinu.
Osteoporóza a koexistující chronické onemocnění ledvin
S postupujícím věkem se zvyšuje frekvence koexistujícího chronického onemocnění ledvin a osteoporózy. Vzhledem k rychle stárnoucí populaci a nárůstu civilizačních onemocnění vedoucích často k CKD se počet těchto pacientů každoročně zvyšuje. Je známo, že u pacientů ve stadiu G5 CKD je riziko zlomeniny 4,4× vyšší než u běžné populace. Již od stadia G3 CKD dochází k rozvoji sekundární hyperparatyreózy a zrychlenému kostnímu obratu. Podávání vitaminů D a vápníku je základem terapie zaměřené na úpravu sérového vápníku, fosforu a PTH. U pacientů s CKD existuje při zatížení vápníkem zvýšené riziko vzniku cévních a jiných měkkotkáňových kalcifikací se všemi důsledky a vyšší riziko hyperkalcemie, spolu s následným potlačením kostního obratu za vzniku adynamické kostní choroby. Podávání aktivních metabolitů vitaminu D u těžších poškození funkce ledvin musí být pečlivě monitorováno, kritická hyperkalcemie se může dostavit již měsíc po zahájení terapie vitaminem D. Bisfosfonáty a denosumab stále zůstávají nejúčinnější terapií zvyšující kostní denzitu a snižující riziko vzniku zlomeniny.
O zahájení farmakoterapie osteoporózy u pacientů s CKD se rozhodujeme obdobně jako u pacientů bez renální insuficience. Rozhodování je založeno na stanovení rizika vzniku zlomeniny, anamnézy nízkotraumatické zlomeniny, provedení denzitometrie a konečně na základě přítomnosti či nepřítomnosti CKD-MBD. U pacienta s pokročilou CKD a nízkou kostní denzitou či anamnézou nízkotraumatické zlomeniny musíme před zahájením antiresorpční terapie vyloučit CKD-MBD jakožto jejich příčinu, a to obvykle na základě biochemických vyšetření (hyperfosfatemie, hypokalcemie, sekundární hyperparatyreóza), kostní biopsie se v ČR provádí výjimečně. Riziko CKD-MBD se významně zvyšuje s poklesem eGFR pod 15 ml/min.
U pacientů s eGFR více než 30 ml/min bez známé CKD-MBD se rozhodujeme o farmakoterapii stejným způsobem jako u pacientů bez CKD podle obecně platných doporučení a lze je léčit stejným způsobem jako pacienty bez CKD.
Pacienti ve vysokém riziku vzniku osteoporotické zlomeniny s těžkou poruchou funkce ledvin bez prokázané koexistence CKD-MBD jsou kandidáty na antiresorpční terapii. U pacientů s eGFR méně než 30 ml/min však dochází k významné změně farmakokinetiky některých léků a je přinejmenším nutná úprava jejich dávky nebo jsou již kontraindikovány. Problematickou skupinou léků na osteoporózu u pacientů s CKD jsou bisfosfonáty. Všechny bisfosfonáty napříč skupinou, ať už podávané formou p. o. či i. v., jsou vylučovány ledvinami a existuje riziko zvýšené kumulace těchto látek v kostech u pacientů s pokročilou CKD za vzniku adynamické kostní choroby. Obecně se bisfosfonáty u pokročilé renální insuficience nedoporučují, ačkoli post hoc analýzy studií ukázaly efektivnost i bezpečnost u krátkodobého podávání orálních bisfosfonátů ve stadiu CKD G4, v literatuře je obvykle doporučováno podávání každý druhý týden.
Denosumab je velmi efektivní v redukci rizika vzniku fraktury a jeho účinek není ovlivněn funkcí ledvin. Je však nutné mít na mysli riziko vzniku hypokalcemie u pacientů s renální insuficiencí. Vzniklá hypokalcemie může znamenat vážný problém, a pokud k ní dojde, je to obvykle jeden týden od podání denosumabu. U pacientů s CKD G3 a výše je kladen důraz na substituci vitaminu D aktivními metabolity a normalizaci hladiny vápníku před zahájením podávání denosumabu. Od eGFR pod 30 ml/min hladina 1,25-vitaminu D lineárně klesá s poklesem renální funkce při současném vzestupu PTH. Je doporučeno 10 dní od zahájení podávání denosumabu zkontrolovat hladinu sérového vápníku, fosforu, 25-hydroxyvitaminu D a PTH. V prodloužení studie FREEDOM podle stratifikace úrovně funkce ledvin vedla pětiletá terapie denosumabem k normalizaci kvality kostí bez zaznamenání zvýšeného výskytu vedlejších účinků včetně zhoršení funkce ledvin.
Závěr
Denosumab je lék se silným antiresorpčním účinkem a příznivým bezpečnostním profilem. S bisfosfonáty tvoří doplňující se dvojici. Předléčení bisfosfonáty je vhodné například při obavách ze špatné compliance pacienta, podání bisfosfonátů má své odůvodnění po ukončení léčby denosumabem. Má své místo zejména u pacientů s vysokým rizikem zlomenin, pokud je vyhlídka na dlouhodobou léčbu, při intoleranci perorálních antiresorpčních preparátů, při pokročilé renální insuficienci. Během léčby je nutné dbát na dostatečnou suplementaci kalcia, včas eliminovat infekční fokusy, zejména pokud jsou v dutině ústní.
Zdroje
1. Bayer M, Horák P, Palička V, Pavelka K, Pikner R, Rosa J, Šenk F, Vyskočil V, Zikán V. Dlouhodobá léčba osteoporózy denosumabem a její přerušení: odborné stanovisko pracovní skupiny Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně. Clin Osteol 2018;23(1):32–7.
2. Bone HG, et al. Effects of denosumab treatment and discontinuation on bone mineral density and bone turnover markers in postmenopausal women with low bone mass. J Clin Endocrinol Metab 2011;96 : 972–80.
3. Broulík P. Osteoporóza a její léčba. 2. vydání. Praha: Maxdorf, 2009.
4. Diker-Cohen T, Rosenberg D, Avni T, Shepshelovich D, Tsvetov G, Gafter-Gvili A. Risk for infections during treatment with denosumab for osteoporosis: a systematic review and meta-analysis. J Clin Endocrinol Metab 2020;1;105(5):dgz322 doi: 10.1210/clinem/ dgz322.
5. Džupa V, Jenšovský J, (eds.). Diagnostika a léčba osteoporózy a dalších onemocnění skeletu. Praha: Karolinum, 2018.
6. Harvey N, et al. The epidemiology of osteoporotic fractures. In: Rosen CJ, ed. Primer on the metabolic bone diseases and disorders of mineral metabolism. 7th ed. Washin gton, DC: American Society for Bone and Mineral Research, 2008 : 198–203.
7. Holstead DJ, Kong YY, Penninger JM. Role of RANKL and RANK in bone loss and arthritis. Ann Rheum Dis 2002;61(Suppl II):ii32–ii39. doi: http://dx.doi.org/10.1136/ ard.61.suppl_2.ii32.
8. https://reference.medscape.com/drug/xgeva-prolia-denosumab-999566#10.
9. Lau AN, Wong-Pack M, Rodjanapiches R, et al. Occurrence of serious infection in patients with rheumatoid arthritis treated with biologics and denosumab observed in a clinical setting. J Rheumatol 2018,45 : 170–176 DOI: https://doi.org/10.3899/jrheum.161270.
10. Miller DP. Osteoporosis in patients with chronic kidney disease: Management. https:// www.uptodate.com/contents/osteoporosis-in-patients-with-chronic-kidneydisease - management.
11. Reid IR, Black DM, Eastell R, et al. Reduction in the risk of clinical fractures after a single dose of zoledronic acid 5 milligrams. J Clin Endocrinol Metab 2013;98(2):557–563. doi: https://doi.org/10.1210/jc.2012-2868.
12. Rosen HN. Calcium and vitamin D supplementation in osteoporosis. https://www. uptodate.com/contents/calcium-and-vitamin-d-supplementation-in-osteoporosis.
13. Rosen HN. Denosumab for osteoporosis. https://www.uptodate.com/contents/ denosumab-for-osteoporosis.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek COVID-19: aktuální přehled
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Úvodní slovo
-
COVID-19:
aktuální přehled - Časté bolesti hlavy: hodnocení a léčba
-
Komentář k článku
Časté bolesti hlavy:
hodnocení a léčba -
Farmakoterapie neuropatické bolesti
pohledem diabetologa -
Prediabetes:
včasnou léčbou lze výrazně ovlivnit prognózu pacienta -
Cíle kompenzace
a farmakologické možnosti léčby diabetu
u starších pacientů -
Profesor Štěpán Svačina:
Technika umí hodně, ale setkání s pacientem nenahradí -
Psoriatická artritida –
současné možnosti diagnostiky a léčby -
Onemocnění příštítných tělísek –
nenápadný, ale často závažný stav
Co je třeba znát v praxi? Pohled nefrologa -
Léčba osteoporózy v roce 2021 –
zaměřeno na denosumab -
Jaký diagnostický ultrazvuk
do ordinace praktického lékaře? -
Horké aktuality
v registracích EMA -
Farmakoterapie srdečního selhání
se sníženou ejekční frakcí:
novější léčebné postupy -
Komplexní terapie
chronických bércových ulcerací venózní etiologie -
Infekce močového traktu:
jak správně diagnostikovat a léčit? -
Sebevražedné jednání:
motivy, rizika, prevence, pandemie -
Specifika komunikace a nové výzvy
při sdělování závažných zpráv během pandemie COVID-19
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Onemocnění příštítných tělísek –
nenápadný, ale často závažný stav
Co je třeba znát v praxi? Pohled nefrologa -
Psoriatická artritida –
současné možnosti diagnostiky a léčby -
Infekce močového traktu:
jak správně diagnostikovat a léčit? -
Farmakoterapie srdečního selhání
se sníženou ejekční frakcí:
novější léčebné postupy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



