-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAntiangiogenní léčba karcinomu ovaria
Antiangiogenic therapy for ovarian cancer
Epithelial tumours of the ovary, fallopian tube or peritoneum (epithelial ovarian cancer – EOC) manifest similar behavioral characteristics. An important condition for their development is the provision of blood supply through the tumour bloodstream. The main growth factor controlling the tumour angiogenesis is the vascular endothelial growth factor (VEGF). Angiogenesis plays an essential role within the normal ovarian physiology, pathogenesis of epithelial ovarian cancer (EOC), progression of tumour mass and arising of ascites also in metastatic dispersal. VEGF and its receptor VEGFR are expressed in the EOC cells and their concentration increases within the development of the malign ascites. This is the reason why VEGF and its receptor should be considered as the potential treatment targets in relation to the EOC [1].
Key words:
bevacizumab – epithelial ovarian cancer – ovarian carcinoma – vascular endothelial growth factor – VEGF – VEGFR – PGF
Autoři: Petra Tesařová
Působiště autorů: Onkologická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. Luboš Petruželka, CSc.
Vyšlo v časopise: Prakt Gyn 2013; 17(1): 40-46
Kategorie: Onkogynekologie: Přehledový článek
Souhrn
Epiteliální nádory ovaria, tuby nebo peritonea (epithelial ovarian cancer – EOC) vykazují podobné charakteristiky chování. Významnou podmínkou pro jejich vývoj je zajištění přísunu krve pomocí nádorového krevního řečiště. Hlavním růstovým faktorem kontrolujícím nádorovou angiogenezi je vaskulární endotelový růstový faktor (VEGF). Angiogeneze hraje zásadní roli v rámci normální ovariální fyziologie, v patogenezi epiteliálních ovariálních nádorů (EOC), progresi nádorové masy a vzniku ascitu i v metastatickém rozsevu. VEGF a jeho receptor VEGFR jsou exprimovány v buňkách EOC a jejich koncentrace se zvyšuje v rámci vzniku maligního ascitu. To je důvodem uvažovat o VEGF a jeho receptoru jako potenciálních cílech léčby u EOC [1].
Klíčová slova:
bevacizumab – epiteliální ovariální nádor – karcinom ovaria – vaskulární endotelový růstový faktor – VEGF – VEGFR – PGFÚvod
Karcinom ovaria je gynekologické nádorové onemocnění s vysokou úmrtností. Prognóza je nepříznivá – více než polovina žen, u nichž byla nemoc diagnostikována, umírá do 5 let (tab. 1). Příznaky karcinomu bývají nejasné a často mylně vykládané jako příznaky méně závažných nemocí, nejčastěji jako žaludeční a střevní potíže. V současnosti neexistuje rutinní test, který by dokázal tento karcinom přesně odhalit. U většiny pacientek je tak nemoc zjištěna až v pokročilém stadiu.
Tab. 1. Vývoj 5letého přežití pacientek s karcinomem ovaria (stadium III–IV) v letech 1958–2001 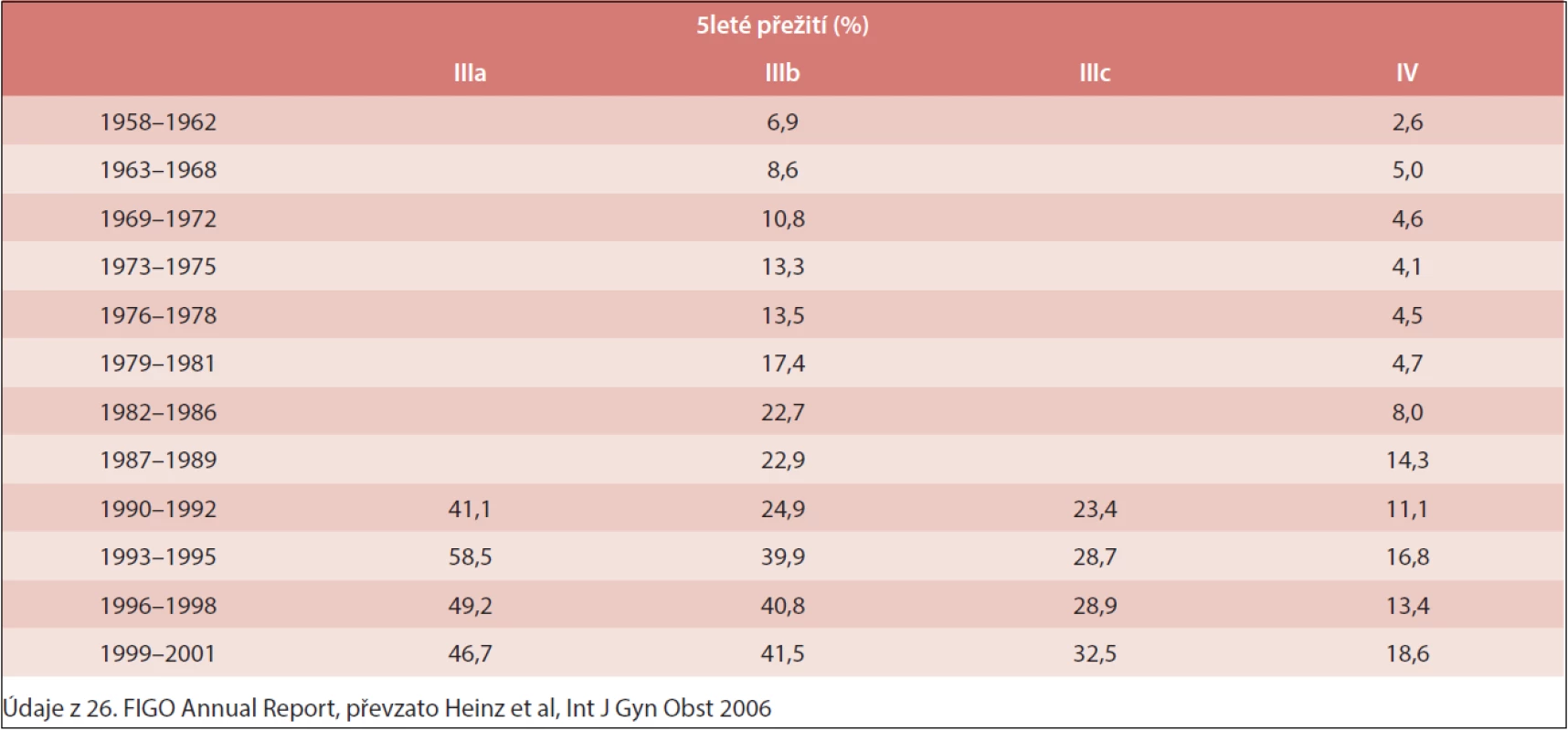
Graf 1. Incidence a mortalita u karcinomu ovaria (C56) 
Léčba
Léčba karcinomu ovaria zahrnuje operační řešení, chemoterapii a biologickou léčbu. Ve většině případů pokročilých stadií však léčba 1. linie (operace a chemoterapie) nezabraňuje recidivě onemocnění. Obvykle k ní dochází do 15 měsíců od určení diagnózy [2].
Léčebné výsledky
Pětileté přežití nemocných s karcinomem ovaria se v posledních letech příliš nezlepšovalo (tab. 1).
Bevacizumab
Léčba adjuvantní chemoterapií je integrální součástí léčebného schématu u většiny žen s nově diagnostikovaným EOC. Přes naši snahu podat adjuvantní léčbu s kurativním záměrem, stále vysoké procento nemocných relabuje. To je důvod proč přidat k adjuvantní chemoterapii bevacizumab. Bevacizumab prodlužuje dobu do progrese (PFS – Progression Free Survival), ale neovlivňuje, bohužel, celkové přežití ani kvalitu života. Až do studií zaměřených na léčbu bevacizumabem však nebyl žádný režim lepší než karboplatina/paklitaxel. Většina studií neprokázala významný benefit ve srovnání s existujícím standardem (režimy se 3 léky, nové kombinace 2 léků, udržovací chemoterapie). Prospěchu bylo často dosaženo za cenu významné toxicity nebo neschopnosti nemocné pokračovat v léčbě (intraperitoneální léčba) [3].
V případě návratu nemoci je nutné léčbu stratifikovat podle délky bezpříznakového období po ukončení platinového režimu v adjuvanci, tzv. platinum free intervalu (PFI). Pacientky s intervalem delším než 6 měsíců považujeme za k platině senzitivní, nemocné s kratším návalem za k platině rezistentní.
Ve studii GOG 170D dostávalo 62 nemocných s relabujícím EOC bevacizumab (15 mg/kg 3krát týdně) do progrese nebo toxicity, 42 % z nich bylo k platině rezistentních. Celková léčebná odezva (ORR – Overall Response Rate) byla 21% a doba do progrese (PFS) 6 měsíců 40%. Nejzávažnější nežádoucí účinky byly 1 případ plicní embolie, zvracení, zácpa a proteinurie [4].
V další studii se souborem 70 žen s recidivujícím EOC, které byly předléčeny více než 2 předchozími režimy, byl podáván bevacizumab (10 mg/kg 2krát týdně) a metronomický cyklofosfamid 50 mg 1krát denně ve 28denním cyklu. Celková odezva ORR byla 24% a PFS 6 měsíců dosáhlo 56 % pacientek. U 4 nemocných byla terapie komplikována perforací gastrointestinálního traktu (GIT) a v souvislosti s léčbou bevacizumabem byla hlášena 3 úmrtí [5].
Ve třetí studii fáze II, 13 nemocných s recidivujícím EOC a nejméně dvěma liniemi paliativní chemoterapie dostávalo bevacizumab (15mg/kg 3krát týdně) s inhibitorem epidermálního růstového faktoru (EGFR – Epidermal Growth Factor Receptor) erlotinibem (v dávce 150 mg denně), ORR bylo 15% a PFS 6 měsíců dosáhlo 38 % nemocných. Léčba byla u 2 nemocných komplikována závažnou perforaci GIT. Studie byla ukončena dříve pro podezření, že kombinace nemá žádnou výhodu oproti monoterapii bevacizumabem [6].
Bevacizumab u pacientek s rekurentním EOC senzitivním k platině
Bevacizumab byl studován i u pacientek s rekurentním EOC senzitivním k platině.
Studie fáze III OCEANS sledovala soubor 484 žen s EOC citlivým k platině. Pacientky byly randomizovány k léčbě karboplatinou (AUC 4 den 1) a gemcitabinem (1 000 mg/m2 den 1 a 8), každých 21 dní s bevacizumabem (15 mg/kg den 1), nebo bez něj. Došlo ke zlepšení PFS (12 měsíců vs 8 měsíců: HR 0,48; 95% CI 0,39–0,61), zvýšení objektivní odezvy (79 % vs 57 %; p < 0,001), ale také častějšímu přerušení léčby pro nežádoucí účinky (23 % vs 5 %), včetně zvýšeného počtu vážných případů hypertenze (17 % vs < 1 %), proteinurie > grade 3 (9 % vs 1 %) a krvácení, mimo CNS (6 % vs 1 %). V průběhu studie se neobjevil případ perforace gastrointestinálního traktu. Medián celkového přežití byl 35 měsíců bez statistické signifikance (33 měsíců vs 35 měsíců) [7].
Další studie s bevacizumabem u pacientek s EOC citlivým k platině je studie GOG 213 s karboplatinou a paklitaxelem v kombinaci s bevacizumabem, nebo bez něj. Primárním cílem je sledování celkového přežití. Výsledky studie dají nejspíše odpověď na otázku správné indikace bevacizumabu u EOC citlivého k platině.
Tab. 2. Studie s bevacizumabem u EOC citlivého k platině 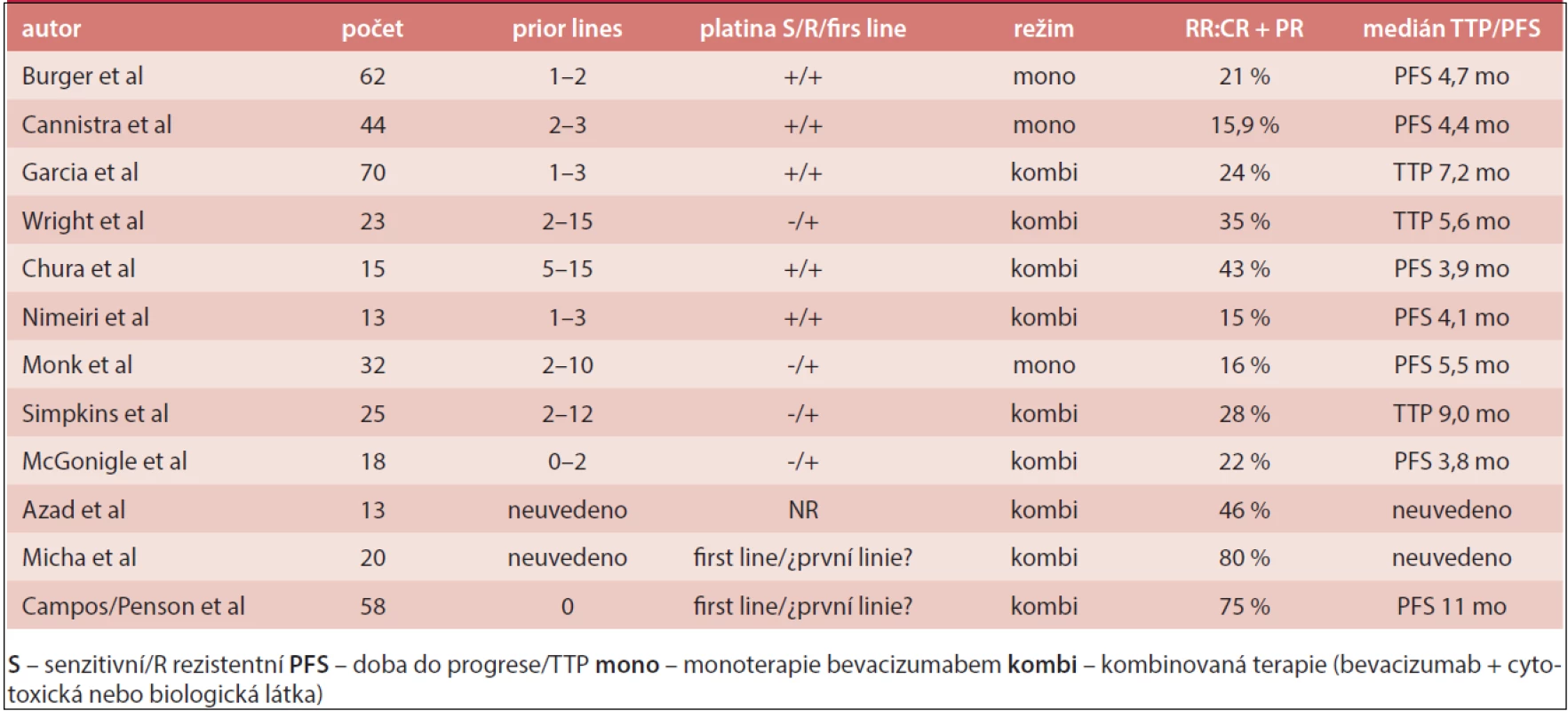
Bevacizumab u pacientek s rekurentním EOC rezistentním k platině
U EOC rezistentního k platině proběhla studie AURELIA, do níž bylo zařazeno 361 pacientek s progresí EOC ≤ 6 měsíců a po ≥ 4 platinových režimech. Nemocné byly randomizovány do ramene s chemoterapií nebo s chemoterapií kombinovanou s bevacizumabem (15 mg/kg každé 3 týdny). Volba chemoterapie závisela na rozhodnutí výzkumníka (paklitaxel 80 mg/m2 1krát týdně, topotekan 4 mg/m2 1krát týdně, pegylovaný lipozomální doxorubicin 40 mg/m2 1krát za 4 týdny).
Při mediánu sledování 13,5 měsíce způsobilo přidání bevacizumabu statisticky významné zvýšení celkové odezvy ORR (31 % vs 13 %), redukci rizika progrese onemocnění (HR 0,48; 95% CI 0,38–0,60; medián trvání 7 měsíců vs 3 měsíce), také ale zvýšení nežádoucích účinků, především hypertenze (20 % vs 7 %), proteinurie (0,6 %vs 11 %). Komplikace léčby pro perforaci GIT se vyskytla u 4 pacientek (2,2 %) [8].
Podrobná subanalýza studie AURELIA byla prezentovaná na ESMO 2012. Přidání bevacizumabu konzistentně zlepšuje výsledky léčby.
U pacientek léčených paklitaxelem byla celková odezva (ORR 52 % vs 29 %) medián PFS (10 % měsíců vs 4 měsíce (HR 0,46; 95% CI 0,30–0,71). Nemocné léčené topotekanem měly ORR 23 % vs 3 % medián PFS byl 6 měsíce vs 2 měsíce (HR 0,32; 95% CI 0,21–0,49), a ty, které měly pegylovaný lipozomální doxorubicin, ORR byl 18 % vs 8 % medián PFS potom 5 měsíců vs 4 měsíce (HR 0,57; 95% 0,39–0,83).
Tato data podporují užití kombinace chemoterapie s bevacizumabem v léčbě EOC rezistentního k platině. Očekávána jsou data týkající se celkového přežití [9].
Marker Ca125
Marker Ca125 není u antiangiogenní léčby přesným prediktorem odezvy na léčbu. V retrospektivní analýze souboru 15 žen léčených kombinovanou biologickou léčbou sorafenibem s bevacizumabem pro recidivující EOC mělo 5 ze 7 nemocných reagujících na léčbu podle výsledku zobrazovacích vyšetření také odezvu v poklesu markerů, ale 3 nemocné, které měly kontrolovány jen markery, ukončily léčbu předčasně, přestože jejich klinická odezva byla dlouhodobá (20, 22 a 24 měsíců) [10].
Graf. Účinnost cílené léčby u EOC 
Profil nežádoucích účinků
Profil nežádoucích účinků bevacizumabu se neliší u EOC od jiných indikací: zhoršení hypertenze, proteinurie, trombóza, krvácení, zhoršené hojení ran a perforace gastrointestinálního traktu. Perforace se častěji objevuje u žen s peritoneální diseminací nádoru.
Riziko gastrointestinální perforace je dobré předvídat. Každá nevysvětlená bolest břicha by měla být urgentně vyšetřena pomocí odběru anamnézy, fyzikálním vyšetřením i zobrazovacími a laboratorními metodami. Pacientka s naléhavým podezřením na GIT perforaci je indikována k urgentnímu chirurgickému výkonu. Nemocné, které jsou stabilizované, mohou absolvovat méně invazivní léčbu v podobě omezení příjmu per os, antibiotické terapie s perkutánní drenáží abscesu. Perforace zažívacího taktu se vyskytuje u širokého spektra nádorů. V metaanalýze 12 294 pacientek, které participovaly na 17 studiích s léčbou bevacizumabem, se perforace GIT vyskytovala v 0,9 % (95% CI, 0,7–1,2) a byla spojena ve 22 % případů s úmrtím nemocného. Patofyziologický mechanizmus souvisí nejčastěji přímo s anti-VEGF účinkem omezujícím perfuzi střeva, nebo vedoucím k nekróze nádoru, porušení hojení, poranění střeva nebo trombózou v. mesenterica a vazokonstrikcí. Incidence perforace GIT je u EOC ne zcela jasná a může dosahovat 10 % v závislosti na výsledcích klinických studií [10].
Ve studii se souborem 160 nemocných trpících EOC léčených bevacizumabem, s průměrným počtem 11 cyklů léčby bevacizumabem (2–20), se perforace GIT vyskytla u 4 % z nich (6 pacientů). Z těchto pacientek byly 4 operovány a 2 léčeny konzervativně, mortalita byla 50%. V jiné skupině 112 nemocných léčených pro EOC bevacizumabem bylo postiženo perforací GIT 12 pacientek. Do 1 měsíce zemřelo 50 % nemocných, 30 % dokonce do 1 týdne [11].
Indikace bevacizumabu
Významným problémem indikace bevacizumabu v 1. linii léčby EOC je nekompatibilita s plánovanou operací rezidua nádoru. Od velikosti rezidua se přitom odvíjí prognóza nemocných. V případech pravděpodobné operability rezidua by bylo racionální bevacizumab použít v rámci 2. linie léčby.
Dle současného doporučení je bevacizumab v kombinaci s karboplatinou a paklitaxelem indikován k úvodní léčbě dospělých pacientů s pokročilým (stadia IIIb, IIIc a IV dle klasifikace Mezinárodní federace gynekologie a porodnictví/International Federation of Gynecology and Obstetrics – FIGO) epitelovým nádorem vaječníků, vejcovodů nebo primárním nádorem pobřišnice.
Bevacizumab v kombinaci s karboplatinou a gemcitabinem je indikován také k léčbě dospělých pacientek s první rekurencí epitelového nádoru vaječníků, vejcovodů nebo primárního nádoru pobřišnice citlivého na platinu, které nebyly dosud léčeny bevacizumabem nebo jiným inhibitorem růstového faktoru cévního endotelu (VEGF) nebo receptoru VEGF. Bevacizumab se podává spolu s karboplatinou a paklitaxelem, a to až po 6 léčebných cyklů, a následně se pokračuje v samostatné léčbě do progrese nemoci nebo maximálně po dobu 15 měsíců nebo do nepřijatelné toxicity dle toho, co nastane nejdříve. Doporučená dávka přípravku Avastin (bevacizumab) je 15 mg na kilogram tělesné hmotnosti podaná 1krát za 3 týdny ve formě intravenózní infuze.
U rekurentního onemocnění se bevacizumab podává v kombinaci s karboplatinou a gemcitabinem v 6 až 10 cyklech a následně se pokračuje v podávání přípravku Avastin samotného až do progrese nemoci. Doporučená dávka přípravku Avastin je také 15 mg na kilogram tělesné hmotnosti podaná 1krát za 3 týdny ve formě intravenózní infuze.
Další cílená léčba a karcinom ovaria
Kromě VEGF hraje v patogenezi EOC jistě významnou roli i PDGF (Platelet-Derived Growth Factor) a FGF (Fibroblast Growth Factor). Vysoká hladina PDGF je spojena se špatnou prognózou nemocných. Kompletní blokáda VEGF, PDGF a FGF by mohla být u EOC nejúčinnější protinádorovou léčbou [12].
Aflibercept
(VEGF-Trap) je fúzní protein, který se váže na oba VEGF-receptory (VEGFR1,2).
V rámci studií fáze I/II zaměřené na EOC rezistentní k platině bylo 46 velmi předléčených nemocných trpících EOC léčeno afliberceptem v dávce 6 mg/kg a docetaxelem v dávce 75 mg/m2 každých 21 dní. Celková odezva (ORR) byla 54%. Medián PFS a OS byl 6 a 27 měsíců. Vážné nežádoucí účinky zahrnovaly neutropenii, únavu, dušnost nebo stomatitidu [13].
AMG 386
AMG-386 je antagonista fúzního angiopoetinového proteinu, který inhibuje angiopetin I a II vazbou na jejich tyrozinkinázový receptor. V randomizované studii fáze II se souborem 161 žen s rekurentním EOC byly nemocné léčeny v týdenním cyklu paklitaxelem s placebem nebo AMG 386 (3 mg/kg). Medián PFS byl 5, 6 a 7 měsíců, celková odezva 27, 19 a 37 %. Odezva CA 125 byla 28 %, 58 % a 71 % [14].
BIBF 1120
BIBF 1120 je perorální angiokinázový inhibitor, který je zacílen na VEGFR1,2, PDGFRα/β, FGFR1,2 a 3, tyrozinkinázový receptor SRC a a FMS like tyrosin kinázy 3 (FLT3). Ve studii fáze II se souborem 84 žen s recidivujícím EOC, které reagovaly na léčbu druhé nebo vyšší linie chemoterapie, bylo podáváno BIVF 1120 jako udržovací léčba oproti placebu. Podávání účinné látky vykázalo větší počet pacientů, u nichž se v nejbližších 6 měsících neobjevila progrese (16 % vs 5 %). Incidence vážných nežádoucích účinků se neodlišovala v obou ramenech statisticky významně (35 % vs 28 %). BIBF 1120 výrazněji zvyšoval hladinu jaterních enzymů (52 % vs 8 %). Ve studii fáze I byl porovnáváno podávání BIBF 1120 (100 a 250 mg) se standardní chemoterapií karboplatinou s paklitaxelem oproti chemoterapii samotné u souboru 22 žen s rezistentním EOC. Všechny nemocné měly gastrointestinální obtíže, nejčastěji grade 1/2, průjmy, elevaci ALT, v menší míře elevaci AST nebo leukopenii. Na kombinovanou léčbu zareagovalo 5 ze 7 hodnotitelných nemocných. Na léčbu s BIBF 1120 sérologicky zareagovalo 10 nemocných, u nichž bylo sledováno CA 125. Všechny nemocné, u nichž onemocnění při léčbě neprogredovalo, byly zařazeny do studie s udržovací léčbou BIBF 1120. Ze 16 pacientek měla jen jediná takovou elevaci ALT, že musela léčbu ukončit. Nyní probíhá studie fáze III v první linii léčby EOC s podáváním BIBF 1120 s karboplatinou a paklitaxelem [15].
Sorafenib
Sorafenib je multikinázový inhibitor zacílený na VEGF a PDGFβ a c-Kit (proto-oncogene nebo tyrosine-protein kinase Kit nebo CD117). Do studie Gynecologic Oncology Group 170 F (GOG 170F) bylo zařazeno 170 pacientek s recidivujícím EOC předléčených méně než 3 liniemi paliativní léčby. Při sledované terapii sorafenibem (400 mg 2krát denně) byl 6měsíční PFS 24% (90% CI 15–35 %), s mediánem PFS 2 měsíce a OS 16 měsíců. Nejčastějšími nežádoucími účinky stupně 3/4, byl hand-foot syndrom, kožní vyrážka a metabolické změny. Ve studii fáze II s kombinací sorafenibu (2krát 400 mg denně) s gemcitabinem 1krát týdně nedosáhl primárního cíle, totiž celkové léčebné odezvy ≥ 35 %. Německá studie ukázala, že přidání sorafenibu (2krát denně 400 mg) ke karboplatině s paklitaxelem v neoadjuvanci u pokročilého stadia EOC (IIIc/IV) má tak vysokou toxicitu, že byla studie předčasně ukončena. Nyní je sorafenib pověřován jako udržovací terapie ve studii fáze II u pokročilého EOC (III-IV), u nemocných, které dosáhly kompletní remise po adjuvantní léčbě platinou s taxany po chirurgickém debulkingu [16].
Pazopanib
Pazopanib se váže na VEGFR1/2, PDGFRα/β, FGFR1/3 a c-Kit. Ve studii fáze II byl podáván pazopanib v dávce 800 mg 1krát denně 36 nemocným s EOC předléčeným chemoterapií, ale nikoliv cílenou léčbou s kompletní odezvou Ca125 po iniciální chemoterapii s platinou. CA125 pokleslo u 31 % léčených s mediánem 113 dní. Kritéria stabilizované nemoci s mediánem 80 dní splňovalo 56 % nemocných. U pacientek s měřitelnou nemocí byla celková odezva 18%. Nečastějším závažnějším nežádoucím účinkem byla únava a vzestup GMT (11 %), průjem a elevace ALT (8 %) Ve studii fáze III je porovnáván pazopanib s placebem v rámci 52týdenní udržovací léčby u pacientů s EOC ve stadiu II-III s odezvou nebo stabilizací nemoci po chirurgickém debulkingu s nejméně 5 cykly první linie chemoterapie (AGO-OVAR16) [17].
Cediranib
Cediranib je zaměřen na VEGFR1/2/3, PDGFRα/β, FGF1 a c-Kit (proto-oncogene nebo tyrosine-protein kinase Kit nebo CD117). Ve studii fáze II zaměřené na recidivující EOC, jak rezistentního k platině, tak citlivého, prokázal slibné účinky. Ve studii se 46 nemocnými léčenými cediranibem v dávce 45 mg denně perorálně, přestože musela být dávka pro toxicitu u prvních 22 nemocných redukována na 30 mg denně, 30 % nemocných vykázalo léčebnou odezvu nebo stabilizaci nemoci delší než 16 týdnů. Vážné nežádoucí účinky představovala hypertenze (46 %), únava (24 %) a průjem (13 %). Medián PFS byl 5 měsíců a medián OS nebyl po 11 měsících dosažen. Ve studii fáze II se souborem 60 žen léčenými pro EOC, předléčenými pouze jednou řadou předchozí systémové léčby, byl cediranib podáván v dávce 45 mg a při toxicitě 30 mg 1krát denně až do progrese. Nejzávažnějšími nežádoucími účinky (G3) byla hypertenze (33 %) a únava (20 %). V souboru mělo 70 % léčených prokázanou klinickou nebo laboratorní odezvu nebo stabilizaci trvající déle než 16 týdnů (49 % k platině senzitivních a 29 % k platině rezistentních). Medián doby do progrese byl 4 měsíce a celkové přežití 12 měsíců. Ve fázi III studie s cediranibem (ICON6) je posuzovaná účinnost a bezpečnost léčby cediranibem s chemoterapií platinou a paklitaxelem oproti chemoterapii samotné a při progresi udržovací léčba cediranibem proti chemoterapii s cediranibem [18].
Závěr
Epiteliální nádory ovaria, tuby a peritonea vyžadují primárně operační řešení a adjuvantní chemoterapii. Pro ty nemocné, které relabují, je chemoterapie v první linii obvyklým standardem s možností, u vybraných nemocných, opakovat chirurgický zákrok. Angiogeneze hraje zásadní roli ve vývoji i fyziologických změnách zdravého ovaria a také v patogenezi EOC, od růstu a progrese nádoru až po vznik ascitu a metastatický rozsev. VEGF a VEGFR jsou v tkáni EOC exprimovány a jejich zvýšená exprese je spojena s vývojem maligního ascitu.
Doplnění chemoterapie první linie o bevacizumab statisticky významně prodlužuje PFS, zatím ale neovlivňuje celkové přežití ani kvalitu života. Bevacizumab prokázal svoji účinnost u recidivujícího EOC v kombinaci s platinovou chemoterapií nebo samotný. Očekávají se výsledky dalších klinických studií, které by měly odpovědět na otázky ohledně optimálního výběru nemocných, dávky a trvání léčby bevacizumabem. Ca125 není dostatečně přesným prediktorem odezvy na antiangiogenní léčbu a měl by se používat opatrně. Všechny pacientky léčené bevacizumabem musí být sledovány z hlediska rizika perforace GIT, jejíž časné odhalení snižuje morbiditu i mortalitu a umožňuje urgentní chirurgické řešení či konzervativní postup.
Nové antiangiogenní léky jsou v současné době prověřovány v řadě klinických studií. Účast nemocných s pokročilým EOC v těchto studiích může rozšířit jejich léčebné možnosti s nadějí na prodloužení života.
Doručeno do redakce dne 10. února 2013
Přijato po recenzi dne 28. února 2013
doc. MUDr. Petra Tesařová, CSc.
petra.tesarova@lf1.cuni.cz
Onkologická klinika 1. LF UK a VFN v Praze
www.onkologie.1fl.cuni.cz
Zdroje
1. Brown MR, Blanchette JO, Kohn EC. Angiogenesis in ovarian cancer. Baillieres Best Pract Res Clin Obstet Gynaecol 2000; 14(6): 901–918.
2. Ramakrishnan S, Subramanian IV, Yokoyama Y et al. Angiogenesis in normal and neoplastic ovaries. Angiogenesis 2005; 8(2): 169–182.
3. Burger RA. Overview of anti-angiogenic agents in development for ovarian cancer. Gynecol Oncol 2011; 121(1): 230–238.
4. Burger RA, Sill MW, Monk BJ et al. Phase II trial of bevacizumab in persistent or recurrent epithelial ovarian cancer or primary peritoneal cancer: a Gynecologic Oncology Group Study. J Clin Oncol 2007; 25(33): 5165–5171.
5. Garcia AA, Hirte H, Fleming G et al. Phase II clinical trial of bevacizumab and low-dose metronomic oral cyclophosphamide in recurrent ovarian cancer: a trial of the California, Chicago, and Princess Margaret Hospital phase II consortia. J Clin Oncol 2008; 26(1):76–82.
6. Nimeiri HS, Oza AM, Morgan RJ et al. Efficacy and safety of bevacizumab plus erlotinib for patients with recurrent ovarian, primary peritoneal, and fallopian tube cancer: a trial of the Chicago, PMH, and California Phase II Consortia. Gynecol Oncol 2008; 110(1):49–55.
7. Aghajanian C, Blank SV, Goff BA et al. OCEANS: A Randomized, Double-Blind, Placebo-ControlledPhase III Trial of Chemotherapy With or Without Bevacizumab in Patients With Platinum-Sensitive Recurrent Epithelial Ovarian, Primary Peritoneal, or Fallopian Tube Cancer. J Clin Oncol 2012; 30(17): 2039–2045. Dostupné z doi: 10.1200/JCO.2012.42.0505.
8. Pujade-Lauraine E, Hilpert F and AURELIA Investigators: A randomized phase III trial evaluating bevacizumab (BEV) plus chemotherapy (CT) for platinum (PT)-resistant recurrent ovarian cancer (OC). J Clin Oncol 2012; 30(18: Suppl 2012 ASCO Annual Meeting Abstracts): abstr LBA5002.
9. Poveda AM, Selle F, Hilpert F et al. Weekly paclitaxel (PAC), pegylated liposomal doxorubicin (PLD) or topotecan (TOP) ± bevacizumab (BEV) in platinum (PT)-resistant recurrent ovarian cancer (OC): analysis by chemotherapy (CT) cohort in the GCIG AURELIA randomised phase III trial. Program and abstracts of the 2012 Annual Congress of the European Society for Medical Oncology; September 28-October 2, 2012; Vienna, Austria. Abstract LBA26.
10. Azad NS, Annunziata CM, Steinberg SM et al. Lack of reliability of CA125 response criteria with anti-VEGF molecularly targeted therapy. Cancer 2008; 112(8):1726–1732.
11. Diaz JP, Tew WP, Zivanovic O et al. Incidence and management of bevacizumab-associated gastrointestinal perforations in patients with recurrent ovarian carcinoma. Gynecol Oncol 2010; 116(3): 335–339.
12. Richardson DL, Backes FJ, Hurt JD et al. Which factors predict bowel complications in patients with recurrent epithelial ovarian cancer being treated with bevacizumab? Gynecol Oncol 2010; 118(1):47–51.
13. Coleman RL, Duska LR, Ramirez PT et al. Phase 1–2 study of docetaxel plus aflibercept in patients with recurrent ovarian, primary peritoneal, or fallopian tube cancer. Lancet Oncol 2011; 12(12): 1109–1117.
14. Karlan BY, Oza AM, Richardson GE et al. Randomized, double-blind, placebo-controlled phase II study of AMG 386 combined with weekly paclitaxel in patients with recurrent ovarian cancer. J Clin Oncol 2012; 30(4): 362–371.
15. Ledermann JA, Hackshaw A, Kaye S, et al. Randomized phase II placebo-controlled trial of maintenance therapy using the oral triple angiokinase inhibitor BIBF 1120 after chemotherapy for relapsed ovarian cancer. J Clin Oncol 2011; 29(28): 3798–3804.
16. Matei D, Sill MW, Lankes HA et al. Activity of sorafenib in recurrent ovarian cancer and primary peritoneal carcinomatosis: a gynecologic oncology group trial. J Clin Oncol 2011; 29(1): 69–75.
17. Friedlander M, Hancock KC, Rischin D et al. A Phase II, open-label study evaluating pazopanib in patients with recurrent ovarian cancer. Gynecol Oncol 2010; 119(1): 32–37.
18. Matulonis UA, Berlin S, Ivy P et al. Cediranib, an oral inhibitor of vascular endothelial growth factor receptor kinases, is an active drug in recurrent epithelial ovarian, fallopian tube, and peritoneal cancer. J Clin Oncol 2009; 27(33): 5601–5606.
19. Schilder RJ, Sill MW, Chen X et al. Phase II study of gefitinib in patients with relapsed or persistent ovarian or primary peritoneal carcinoma and evaluation of epidermal growth factor receptor mutations and immunohistochemical expression: a Gynecologic Oncology Group study. Clin Cancer Res 2005; 11(15): 5539–5548
20. Schilder R, Sill M, Lee R et al. Phase II evaluation of imatinib mesylate in the treatment of recurrent or persistent epithelial ovarian or primary peritoneal carcinoma: a Gynecologic Oncology Group study. J Clin Oncol 2008; 26(20): 3418–3425.
21. Modesitt SC, Sill M, Hoffman JS, Bender DP. A phase II study of vorinostat in the treatment of persistent or recurrent epithelial ovarian or primary peritoneal carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 2008; 109(2): 182–186.
22. Behbakht K, Sill MW, Darcy KM et al. Phase II trial of the mTOR inhibitor, temsirolimus and evaluation of circulating tumor cells and tumor biomarkers in persistent and recurrent epithelial ovarian and primary peritoneal malignancies: A Gynecologic Oncology Group study. Gynecol Oncol 2011; 123(1): 19–26.
23. Usha L, Sill MW, Darcy KM et al. A Gynecologic Oncology Group Phase II trial of the protein kinase C-beta inhibitor, enzastaurin and evaluation of markers with potential predictive and prognostic value in persistent or recurrent epithelial ovarian and primary peritoneal malignancies. Gynecol Oncol 2011; 121(3): 455–461.
24. Rocereto TF, Brady WE, Shahin MS et al. A phase II evaluation of mifepristone in the treatment of recurrent or persistent epithelial ovarian, fallopian or primary peritoneal cancer: a gynecologic oncology group study. Gynecol Oncol 2010; 116(3): 332–334.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2013 Číslo 1- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Magnosolv a jeho využití v neurologii
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- Epigenetika v individualizované péči o ženy se zhoubným nádorem
- Broadening the Clinical and Real World Experience of the Quadrivalent HPV Vaccine
- Česká urogynekologie: Mělník 1992 – Praha 2012 aneb Krátké pozastavení nad cestou „Mělníka“ do Prahy
- Grafické formáty: krátký průvodce nakládáním se snímky
- Autorský rejstřík, ročník 16 (2012)
- Rejstřík klíčových slov, ročník 16 (2012)
- Epidemiologie nádorů prsu mladých žen do 35 let
- Zjišťování klinických příznaků karcinomu prsu – rutinní součást gynekologického vyšetření
- Hormonální rizika vzniku karcinomu prsu
- Význam správného odběru rodinné anamnézy u onkologicky nemocných
- Indikace mamografie, ultrasonografie a vyšetření prsu magnetickou rezonancí u mladých žen
- Souběh těhotenství, kojení a karcinom prsu
- Slova úvodem
- Vývoj epidemiologie zhoubných nádorů prsu u žen dle nových dat Národního onkologického registru ČR a dalších datových zdrojů
- Antiangiogenní léčba karcinomu ovaria
- Bolesti při pokročilých gynekologických malignitách a jejich léčba
- Molekulární cytogenetika v diagnostice genetických abnormalit u karcinomu děložního hrdla
-
Nejčastější gynekologické malignity: průvodce onemocněním
Edukační DVD - Screening tyreopatií v těhotenství
- Negynekologické kontraindikace „office“ hysteroskopie prováděné v ambulanci
- Časný záchyt karcinomu prsu mladých žen – klíčem je gynekolog
- Vliv některých anestetik a sedativ na sexuální halucinace pacienta: podceňované forenzní riziko pro lékaře
- Raritní komplikace děložní myomatózy: kazuistiky
- PROJEKT 35: možná cesta ke zlepšení přežití žen ve věku do 35 let postižených karcinomem prsu
- Behaviorální determinanty osteoporózy: je třeba edukovat ženy v prevenci osteoporózy?
- Problematika rozsáhlého porodního poranění a komplikace s ním spojené
- Právní aspekty autonomie pacienta a poskytování zdravotní péče
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv některých anestetik a sedativ na sexuální halucinace pacienta: podceňované forenzní riziko pro lékaře
- Problematika rozsáhlého porodního poranění a komplikace s ním spojené
- Raritní komplikace děložní myomatózy: kazuistiky
- Indikace mamografie, ultrasonografie a vyšetření prsu magnetickou rezonancí u mladých žen
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



