-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaÚčinnost a bezpečnost tirzepatidu v léčbě nadváhy či obezity u osob bez diabetu
20. 5. 2025
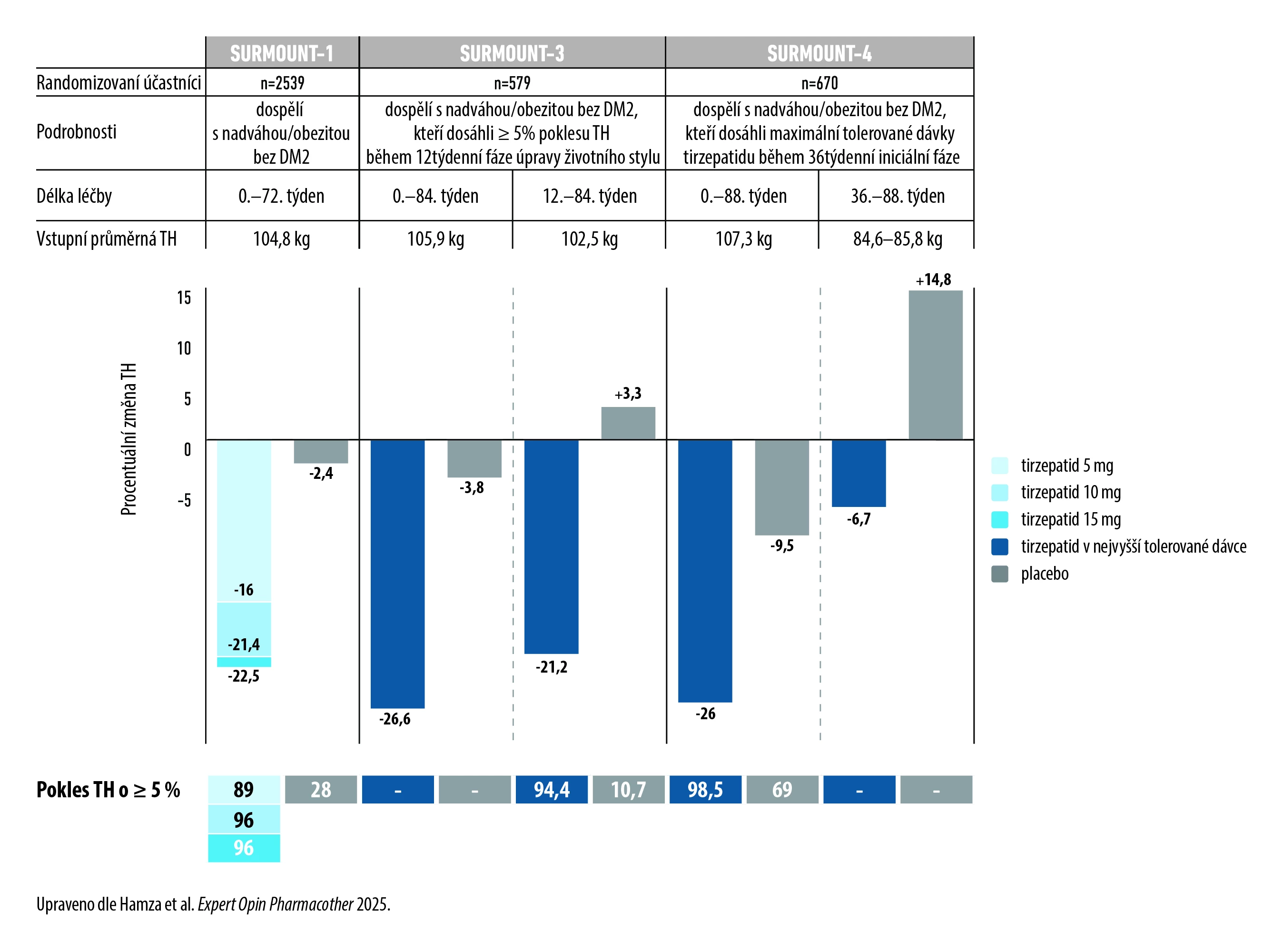
Bezpečnost a účinnost tirzepatidu při dlouhodobé kontrole tělesné hmotnosti (TH) u osob s nadváhou/obezitou byla hodnocena v programu klinických studií fáze III SURMOUNT. U osob bez diabetu mellitu 2. typu (DM2) vedl ve studii SURMOUNT-1 tirzepatid v dávce 5, 10 či 15 mg/týden k poklesu TH průměrně o 15–21 %, ve studiích SURMOUNT-3 a 4 v maximální tolerované dávce k poklesu TH o 26 %. Přinášíme nástin designu a přehled výsledků těchto studií.
Design studií
Studie SURMOUNT-1, 3 a 4 byly randomizované dvojitě zaslepené placebem kontrolované studie. Hodnotily účinnost a bezpečnost tirzepatidu v léčbě komplikované nadváhy (BMI ≥ 27 kg/m2 a ≥ 1 komorbidita související s obezitou kromě DM2) nebo obezity (BMI ≥ 30 kg/m2) u osob bez DM2.
Ve studii SURMOUNT-1 bylo randomizováno 2539 pacientů k podávání tirzepatidu v dávce 5, 10 či 15 mg nebo placeba 1× týdně po dobu 72 týdnů. Současně byla doporučena úprava životního stylu (snížení energetického příjmu o 500 kcal/den a 150 minut fyzické aktivity týdně). Jedinci s prediabetem byli sledování 176 týdnů. Koprimárním sledovaným parametrem byla procentuální změna TH od vstupu do studie a podíl pacientů s nejméně 5% redukcí TH.1, 2
InzerceSURMOUNT-3 byla 84týdenní studie s 579 jedinci s nadváhou/obezitou, kteří během 12týdenního programu intenzivní úpravy životního stylu (1200 kcal/den u žen a 1500 kcal/den u mužů a 150 minut pohybové aktivity za týden) dosáhli poklesu TH nejméně o 5 %. Byli randomizováni k podávání tirzepatidu v nejvyšší tolerované dávce nebo placeba po dobu 72 týdnů. Koprimární sledovaný parametr byl stejný jako ve studii SURMOUNT-1, zde se jednalo o pokles TH od nasazení randomizované léčby.1, 3
SURMOUNT-4 hodnotila udržení poklesu TH při pokračující léčbě tirzepatidem v maximální tolerované dávce 10 či 15 mg/týden. Ze 783 pacientů v otevřené 36týdenní fázi s podáváním tirzepatidu bylo 670 randomizováno k pokračující léčbě tirzepatidem nebo k podávání placeba po dobu 52 týdnů. Během studie měli pacienti k dispozici konzultace k úpravě životního stylu. Primárním sledovaným parametrem byla průměrná procentuální změna TH v 88. týdnu. Hlavním sekundárním sledovaným parametrem byl podíl účastníků, kteří si do 88. týdne udrželi nejméně 80 % úbytku TH dosaženého v iniciální otevřené fázi studie.1, 4
Ve všech studiích bylo použito stejné schéma eskalace dávky. Počáteční dávka 2,5 mg/týden byla zvyšována každé 4 týdny o 2,5 mg až do dosažení randomizované nebo maximální tolerované dávky. Terapeutický efekt byl hodnocen nezávisle na adherenci k léčbě.1
Hodnocená populace pacientů
Vstupní charakteristiky pacientů byly ve všech 3 uvedených studiích podobné. Průměrný věk činil 45–48 let, 63–70 % tvořily ženy, vstupní průměrný BMI se pohyboval okolo 38,0–38,6 kg/m2 a 63–69 % zařazených mělo komplikace související s obezitou.1
Výsledky
Snížení tělesné hmotnosti
Ve studii SURMOUNT-1 bylo po 72 týdnech dosaženo průměrného snížení TH o 16 % s tirzepatidem v dávce 5 mg, o 21,4 % v dávce 10 mg a o 22,5 % v dávce 15 mg v porovnání s poklesem o 2,4 % s placebem. Podíl pacientů se snížením TH o ≥ 5 % činil 89–96 % s tirzepatidem a 29 % s placebem. S tirzepatidem v dávce 15 mg dosáhlo 90 % léčených poklesu hmotnosti o ≥ 10 %, 78 % poklesu o ≥ 15 % a 63 % o ≥ 20 %. U pacientů s prediabetem přetrvával pokles tělesné hmotnosti i po 176 týdnech, přičemž k rozvoji DM2 došlo u 13,3 % pacientů s placebem a jen u 1,3 % s tirzepatidem (snížení relativního rizika o 93 %).1, 2, 5
Ve studii SURMOUNT-3 byl průměrný pokles TH během iniciální fáze úpravy životního stylu 6,9 %. Ve fázi randomizované farmakoterapie došlo s tirzepatidem k průměrnému poklesu TH o dalších 21,1 %, zatímco s placebem se TH zvýšila průměrně o 3,3 %. S tirzepatidem dosáhlo ≥ 5% poklesu TH 94,4 % pacientů, s placebem jen 10,7 %. Při léčbě tirzepatidem byl zjištěn nejméně 10% pokles TH u 88 %, nejméně 15% pokles u 74 % a nejméně 20% pokles u 55 % pacientů.1, 3
Studie SURMOUNT-4 ukázala celkový průměrný pokles TH během 88 týdnů o 26 % s tirzepatidem a o 9,5 % ve skupině s převedením na placebo. Nejméně 5% pokles TH byl zjištěn u 98,5 % účastníků s pokračující léčbou tirzepatidem a u 69 % převedených na placebo. Během randomizované fáze došlo k poklesu TH o 6,7 % s tirzepatidem a k nárůstu o 14,8 % s placebem.1, 4
Obr. Průměrný pokles TH při léčbě tirzepatidem nebo placebem u pacientů s komplikovanou nadváhou/obezitou bez DM2 ve studiích SURMOUNT-1, 3, 4
Změny tělesného složení a obvodu pasu
Změny tělesného složení byly hodnoceny pomocí denzitometrického vyšetření dvouenergiovou rentgenovou absorpciometrií (DEXA) u podskupiny 160 pacientů ve studii SURMOUNT-1. Léčba tirzepatidem vedla po 72 týdnech ke snížení tukové hmoty průměrně o 33,9 % v porovnání s poklesem o 8,2 % s placebem. Větší byl i pokles netukové hmoty (10,9 vs. 2,6 %). Pokles poměru mezi tukovou a netukovou hmotou byl výraznější s tirzepatidem (z 0,93 na 0,70 vs. z 0,95 na 0,88). Zjištěno bylo rovněž klinicky významné zmenšení obvodu pasu o 14,6–19,9 cm s tirzepatidem v porovnání s 3,4 cm u placeba.1, 2
Změny kardiovaskulárních rizikových faktorů
Ve studiích SURMOUNT bylo při léčbě tirzepatidem doloženo také snížení systolického krevního tlaku (sTK) o 5,9–10,5 mmHg (vs. pokles o 0,9–2,4 mmHg s placebem) a diastolického krevního tlaku (dTK) o 2,1–6,2 mmHg (vs. pokles o 0,3–1,7 mmHg s placebem) a zlepšení lipidového profilu (zejména pokles triglyceridů). Post hoc analýza studie SURMOUNT-1 ukázala také pokles 10letého rizika KV aterosklerotických onemocnění o 16,4–23,5 %.1, 6, 7
Fyzické fungování a kvalita života
Z parametrů hodnocených samotnými pacienty bylo při léčbě tirzepatidem ve studii SURMOUNT - 1 zjištěno zlepšení domény fyzického fungování dle dotazníku kvality života související se zdravím SF-36v2 a zlepšení složeného parametru kvality života a fyzického fungování dle dotazníku IWQoL-Lite-CT, který hodnotí kvalitu života související se zdravím specificky s ohledem na TH. Ve studii SURMOUNT-3 zlepšil tirzepatid v porovnání s placebem domény vitality, sociálního fungování, emočních rolí a duševního zdraví dle dotazníku SF-36v2 a psychosociální doménu dle dotazníku WQoL-Lite-CT. Podobně ve studii SURMOUNT-4 zlepšil domény fyzických i emočních parametrů a duševního zdraví dle SF-36v2.1
Bezpečnostní profil léčby
Podobně jako u agonistů receptoru pro glukagonu podobný peptid 1 (GLP-1RA) byly v klinických studiích s tirzepatidem nejčastější nežádoucí účinky gastrointestinální. V naprosté většině byly mírné až středně závažné a vyskytovaly se převážně během eskalace dávky. Nauzea byla hlášena u 25–40 % účastníků (vs. 9,5–14 % s placebem), průjem u 19–31 % (vs. 7,3–9,2 % s placebem), zvracení u 8,3–18,1 % (vs. 1,4–1,7 % s placebem), vždy s nižším výskytem při udržovací léčbě ve studii SURMOUNT-4 (nauzea i průjem u 8,1 %, zvracení u 5,7 %). K vysazení léčby vedly nežádoucí příhody u 4,3 % pacientů s dávkou tirzepatidu 5 mg, u 7,1 % s dávkou 10 mg, u 6,2 % s dávkou 15 mg a u 2,6 % s placebem.1, 8
Závěr
Tirzepatid přináší novou éru do léčby nadváhy a obezity a pomáhá pacientům snížit TH průměrně o 20 %. Vykazuje i další kardiometabolické příznivé účinky, udržovací efekt z hlediska poklesu TH a je dobře tolerován.
(zza)
Zdroje:
1. Hamza M., Papamargaritis D., Davies M. J. Tirzepatide for overweight and obesity management. Expert Opin Pharmacother 2025 Jan; 26 (1): 31−49, doi: 10.1080/14656566.2024.2436595.
2. Jastreboff A. M., Aronne L. J., Ahmad N. N. et al.; SURMOUNT-1 Investigators. Tirzepatide once weekly for the treatment of obesity. N Engl J Med 2022; 387 (3): 205−216, doi: 10.1056/NEJMoa2206038.
3. Wadden T. A., Chao A. M., Machineni S. et al. Tirzepatide after intensive lifestyle intervention in adults with overweight or obesity: the SURMOUNT-3 phase 3 trial. Nat Med 2023; 29 (11): 2909−2918, doi: 10.1038/s41591-023-02597-w.
4. Aronne L. J., Sattar N., Horn D. B. et al.; SURMOUNT-4 Investigators. Continued treatment with tirzepatide for maintenance of weight reduction in adults with obesity: the SURMOUNT-4 randomized clinical trial. JAMA 2024 Jan 2; 331 (1): 38−48, doi: 10.1001/jama.2023.24945.
5. Jastreboff A. M., le Roux C. W., Stefanski A. et al.; SURMOUNT-1 Investigators. Tirzepatide for obesity treatment and diabetes prevention. N Engl J Med 2025 Mar 6; 392 (10): 958–971, doi: 10.1056/NEJMoa2410819.
6. de Lemos J. A., Linetzky B., le Roux C. W. et al. Tirzepatide reduces 24-hour ambulatory blood pressure in adults with body mass index ≥ 27 kg/m2: SURMOUNT-1 ambulatory blood pressure monitoring substudy. Hypertension 2024 Apr; 81 (4): e41–e43, doi: 10.1161/HYPERTENSIONAHA.123.22022.
7. Hankosky E. R., Wang H., Neff L. M. et al.Tirzepatide reduces the predicted risk of atherosclerotic cardiovascular disease and improves cardiometabolic risk factors in adults with obesity or overweight: SURMOUNT-1 post hoc analysis. Diabetes Obes Metab 2024 Jan; 26 (1): 319–328, doi: 10.1111/dom.15318.
8. SPC Mounjaro. Dostupné na: www.ema.europa.eu/cs/documents/product-information/mounjaro-epar-product-information_cs.pdf
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Diabetologie Gynekologie a porodnictví Kardiologie Obezitologie Praktické lékařství pro dospělé Psychiatrie Psychologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




