-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSekvenování nové generace a jeho aplikace v diagnostice neuromuskulárních onemocnění
Next generation sequencing and its application in the diagnostics of neuromuscular diseases
Neuromuscular diseases (NMDs) are a clinically and genetically heterogeneous group of diseases. Currently, 608 genes associated with different types of NMD have been identified. Most of these diseases are rare with a very low prevalence. Advance in the identification of genes associated with NMD can be attributed to technological development in an area of next generation sequencing (NGS) and the affordability of this methodical approach. NGS applications can be divided into analysis of (a) a selected set of genes, (b) an exom, and (c) a genome. The identification of pathogenic variants leads to a significant shift in the understanding of the etiopathogenesis of the disease, allows the prediction of the course of the disease, or its targeted treatment, which may be specific for individual types of NMD or even for particular pathogenic sequence variants.
Keywords:
neuromuscular diseases – NGS – diagnostics
Autoři: Jana Zídková 1; Jana Haberlová 2; Tereza Kramářová 1; Lenka Fajkusová 1
Působiště autorů: Centrum molekulární biologie a genetiky, Fakultní nemocnice Brno 1; Klinika dětské neurologie, Fakultní nemocnice Motol, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 57, 2021, No. 3, p. 150-153
Kategorie: Přehledový článek
Souhrn
Neuromuskulární onemocnění (NMD) jsou klinicky a geneticky heterogenní skupinou onemocnění. V současné době je identifikováno 608 genů asociovaných s různými typy NMD. Většina těchto onemocnění se řadí mezi vzácná s velmi nízkou prevalencí. Pokrok v identifikaci genů asociovaných s NMD lze připsat technologickému vývoji v oblasti sekvenování nové generace (NGS) a cenové dostupnosti tohoto metodického přístupu. Z hlediska šíře analyzované DNA je možné aplikace NGS rozdělit na analýzu (a) vybraného souboru genů, (b) exomu a (c) genomu. Identifikace patogenních variant vede k výraznému posunu v chápání etiopatogeneze onemocnění, umožňuje predikci průběhu onemocnění, event. jeho cílenou léčbu, která může být specifická pro jednotlivé typy NMD nebo dokonce pro jednotlivé patogenní sekvenční varianty.
Klíčová slova:
neuromuskulární onemocnění – NGS – diagnostika
Neuromuskulární onemocnění (NMD) jsou klinicky a geneticky heterogenní skupinou onemocnění rozvíjející se v důsledku poruchy některé ze struktur motorické jednotky, kterou tvoří motoneuron, periferní nerv, nervosvalová ploténka a sval. Neuromuskulární onemocnění postihují všechny věkové skupiny, některá jsou typicky kongenitální, jiná začínají v dětství nebo až v dospělosti. Neuromuskulární onemocnění mohou být získaná v důsledku zánětu, ischemie, úrazu nebo geneticky podmíněná. V současné době je identifikováno 608 genů asociovaných s různými typy NMD (www.musclegenetable.fr). Většina těchto onemocnění se řadí mezi vzácná s velmi nízkou prevalencí.
Pokrok v identifikaci genů asociovaných s NMD lze připsat technologickému vývoji v oblasti sekvenování nové generace (NGS) a cenové dostupnosti tohoto metodického přístupu. NGS je založena na masivní paralelní sekvenaci mnoha fragmentů DNA v jednom sekvenačním běhu. Z hlediska šíře analyzované DNA je možné aplikace NGS rozdělit na analýzu (a) vybraného souboru genů, (b) exomu a (c) genomu.
Vybraný soubor genů - tzv. panel, se zaměřuje na skupinu genů asociovanou se specifickým fenotypem. Panel může zahrnovat několik desítek ale i stovek analyzovaných genů. Panely jsou rychlou metodou pro hledání genových variant spojených se specifickými onemocněními. Výhodou panelu oproti sekvenaci exomu nebo genomu je vyšší pokrytí analyzované sekvence, což umožňuje i jednoznačnější identifikaci variant, zvláště pak rozsáhlých delecí a duplikací.
Sekvenace exomu (WES, whole exome sequencing) analyzuje kódující oblast genomu, tedy přibližně 2 % z jeho celkové DNA. Nicméně přibližně 85 % patogenních sekvenčních variant způsobujících onemocnění se nachází právě v kódujících oblastech. WES analyzuje přibližně 22 000 genů kódujících proteiny a kromě genů s popsanou asociací s lidskými chorobami zahrnuje i geny, u kterých tato asociace doposud popsána nebyla.
Sekvenace genomu (WGS, whole genome sequencing) je necílená analýza kódujících i nekódujících oblastí DNA. WGS generuje velké množství sekvenačních dat, což klade vysoké nároky na bioinformatické zpracování a následnou interpretaci identifikovaných variant. WGS má na rozdíl od sekvenace exomu spolehlivější pokrytí sekvence s větší uniformitou i když nižším počtem čtení. V současné době není WGS používán v rutinní diagnostické praxi. S poklesem nákladů na sekvenování a s identifikací populačně specifických variant pro tzv. filtrování představuje ale WGS budoucí „standard“, tj. jediný genetický test nahrazující jakékoliv další genetické analýzy (1,2).
Pro kvalitu NGS je důležité pokrytí analyzované sekvence, tzn. počet čtení daného nukleotidu, které je obvykle u panelu řádově vyšší než u WES. Pokrytí však v praxi nebývá rovnoměrné. Tato nerovnoměrnost může být způsobena mnoha různými faktory, například zastoupením jednotlivých bází v daném úseku DNA. NGS umožňuje identifikaci jak variant malého rozsahu, tak rozsáhlých delecí a duplikací. Rozsáhlé delece/duplikace jsou detekovány na základě bioinformatického zpracování sekvenčních dat tzv. analýzou copy number variations (CNV), která provádí relativní porovnání pokrytí mezi zvolenou kontrolou a vzorkem.
MOLEKULÁRNĚ GENETICKÁ DIAGNOSTIKA NEUROMUSKULÁRNÍCH ONEMOCNĚNÍ V CMBG
Hlavním metodickým přístupem v molekulárně genetické diagnostice NMD v CMBG (Centrum molekulární biologie a genetiky, FN Brno) je NGS panelu, který v současné době zahrnuje geny ze skupiny svalové dystrofie, kongenitální svalové dystrofie, kongenitální myopatie, distální myopatie, další myopatie, myotonické syndromy, svalová onemocnění spojená s iontovými kanály, maligní hypertermie, kongenitální myastenické syndromy, onemocnění motorického neuronu, dědičné kardiomyopatie (www.musclegenetable.fr) a geny asociované s artrogrypózou.
Prvním krokem NGS je příprava sekvenační knihovny, tj. cílových úseků DNA. V tomto kroku je DNA fragmentována a na konce fragmentů jsou navázány adaptorové sekvence, které umožňují amplifikaci a sekvenaci daného fragmentu a rozlišení DNA jednotlivých pacientů v jednom sekvenačním běhu. Následuje sequence capture, tj. hybridizace fragmentované DNA s biotinylovanými oligonukleotidovými sondami, které jsou navrženy tak, aby hybridizovaly pouze s cílovou DNA. Komplexy sonda – navázaná cílová DNA jsou odděleny magnetickými kuličkami s navázaným streptavidinem, následuje amplifikace cílových fragmentů DNA a masivní paralelní sekvenace technologií společnosti Illumina.
Po provedení NGS následuje bioinformatické zpracování dat. Základním postupem je mapování všech sekvenačních čtení na referenční sekvenci. V dalším kroku je pak potřeba nalézt rozdíly mezi jednotlivými čteními mapovanými na referenční sekvenci a touto referenční sekvencí - tzv. sekvenční varianty. Výsledkem masivní paralelní sekvenace je identifikace velkého množství sekvenčních variant, které je třeba vyhodnotit z pohledu jejich možné patogenity. V prvním kroku jsou identifikované varianty filtrovány a pro další analýzu jsou vybrány varianty, jejichž výskyt v populaci by mohl odpovídat frekvenci výskytu daného onemocnění a typu dědičnosti. Obecně jsou pro další analýzu vybírány varianty s frekvencí výskytu menší než 1 % v databázích jako je například gnomAD (Genome Aggregation Database; https://gnomad.broadinstitute.org). V současné době většina laboratoří vychází při interpretaci sekvenčních variant z doporučení vydaných American College of Medical Genetics and Genomics (ACMG). Toto ACMG doporučení rozděluje sekvenční varianty do pěti kategorií – patogenní, pravděpodobně patogenní, pravděpodobně benigní, benigní a nejasného významu (3). Pro popis identifikovaných sekvenčních variant existují standardy vydané Human Genome Variation Society (HGVS; http://varnomen. hgvs.org). Detekované patogenní sekvenční varianty jsou shromažďovány v různých databázích např. v databázi LOVD (Leiden Open Variation Database; https://www.lovd.nl) nebo v databázi HGMD (Human Gene Mutation Database; http:// www.hgmd.cf.ac.uk).
V genech spojených s NMD mohou být identifikovány patogenní varianty různého typu – od bodových mutací až po rozsáhlé delece a duplikace. Některé geny spojené s NMD mají složitou strukturu, což komplikuje jejich genetickou analýzu. Příkladem mohou být geny kódující sarkomerické proteiny nebulin (NEB) a titin (TTN). Gen NEB je dle OMIM asociován s autosomálně recesivní nemalinovou myopatií. Gen NEB má 183 exonů a délku kódující sekvence 25,7 kb. Osm exonů je v genu NEB opakováno třikrát (v exonech 82–89, 90–97 a 98–105) (4). Tato skutečnost komplikuje identifikaci variant v uvedených exonech a pro spolehlivou analýzu tohoto genu je pak nutné doplnit NGS provedením specifické přímé sekvenace uvedených repetitivních oblastí. Patogenní varianty v genu TTN mohou mít dědičnost autosomálně recesivní i dominantní a dle OMIM jsou spojeny s dilatační kardiomyopatií, hypertrofickou kardiomyopatií, distální myopatií, myofibrilární myopatií a pletencovou svalovou dystrofií. TTN má 363 exonů, délka kódující sekvence je 108 kb. U genu TTN je situace podobná jako u genu NEB, devět exonů je opakováno třikrát (v exonech 173-181, 182 - 190 a 191-199). Titin se skládá ze čtyř strukturních a funkčních domén. Pro jednotlivá onemocnění je charakteristická lokalizace variant v odlišných doménách. Titin má také několik izoforem se specifickou expresí buď ve svalech, nebo v srdci, proto je potřeba posoudit u detekovaných variant jejich funkční dopad na jednotlivé izoformy (5).
NGS genů spojených s neuromuskulárními onemocněními provádíme v CMBG od roku 2012. Počet analyzovaných genů se v průběhu let měnil. Začínali jsme panelem s 42 geny asociovanými se svalovými dystrofiemi a myopatiemi (6), v současné době má panel 450 genů a zahrnuje i další skupiny NMD. Za celou dobu aplikace tohoto metodického přístupu jsme analyzovali 1419 nepříbuzných pacientů, patogenní nebo pravděpodobně patogenní varianty byly identifikovány u 520 z nich, což je 37 %. Kromě identifikace variant malého rozsahu provádíme od roku 2020 i analýzu CNV pro identifikaci rozsáhlých delecí/ duplikací a postupně tuto bioinformatickou analýzu doplňujeme i u starších vzorků. U vybraných pacientů s negativním výsledkem panelu provádíme od roku 2019 WES.
KAZUISTIKA PACIENTA
Jedním z pacientů, u kterých analýza CNV přinesla pozitivní záchyt patogenní varianty, byl pacient zaslaný ke genetické analýze ve 3 letech věku s podezřením na diagnózu kongenitální myopatie. Nyní 10letý chlapec má pozitivní perinatální anamnézu. Porod byl vyvolávaný měsíc před termínem pro patologické ozvy. Při porodu byla nutná vakuoextrakce, chlapec měl poporodní parézu brachiálního plexu. Od narození byly patrné kontraktury aker horních i dolních končetin, skolióza, hypotonie, později byla diagnostikována subluxace kyčlí. Motorický vývoj byl od počátku vývoje opožděný, chlapec se přetočil ze zad na břicho od roku věku, nikdy se sám neposadil ani nepostavil. Veškerá interní vyšetření byla a jsou opakovaně v normě. Svalové enzymy byly vždy v normě. Chlapec byl zpočátku sledován pod diagnózou kongenitální myopatie, v 7 letech byla tato přehodnocena na artrogrypózu. V klinickém obraze dominuje dystrofický habitus s významnou generalizovanou svalovou slabostí, četnými kontrakturami, skoliózou s rotací, subluxací pravé kyčle, dyslalií, je patrná lehká faciální stigmatizace (obr. 1). Byla doplněna magnetická rezonance svalů a popsána povšechná hypotrofie svalstva (obr. 2). V 8 letech byla provedena stabilizace páteře. Chlapec navštěvuje normální základní školu s asistentem, prospěch má výborný.
Obr. 1. Chlapec ve věku 8 let na elektrickém vozíku. Objektivně patrná lehká faciální stigmatizace, dystrofický habitus, četné kontraktury horních i dolních končetin. 
Obr. 2. Magnetická rezonance (MR) svalů stehen a lýtek. A, B: MR pacienta ve věku 7 let, patrná povšechná hypotrofizace svalstva. C, D: Normální nález. 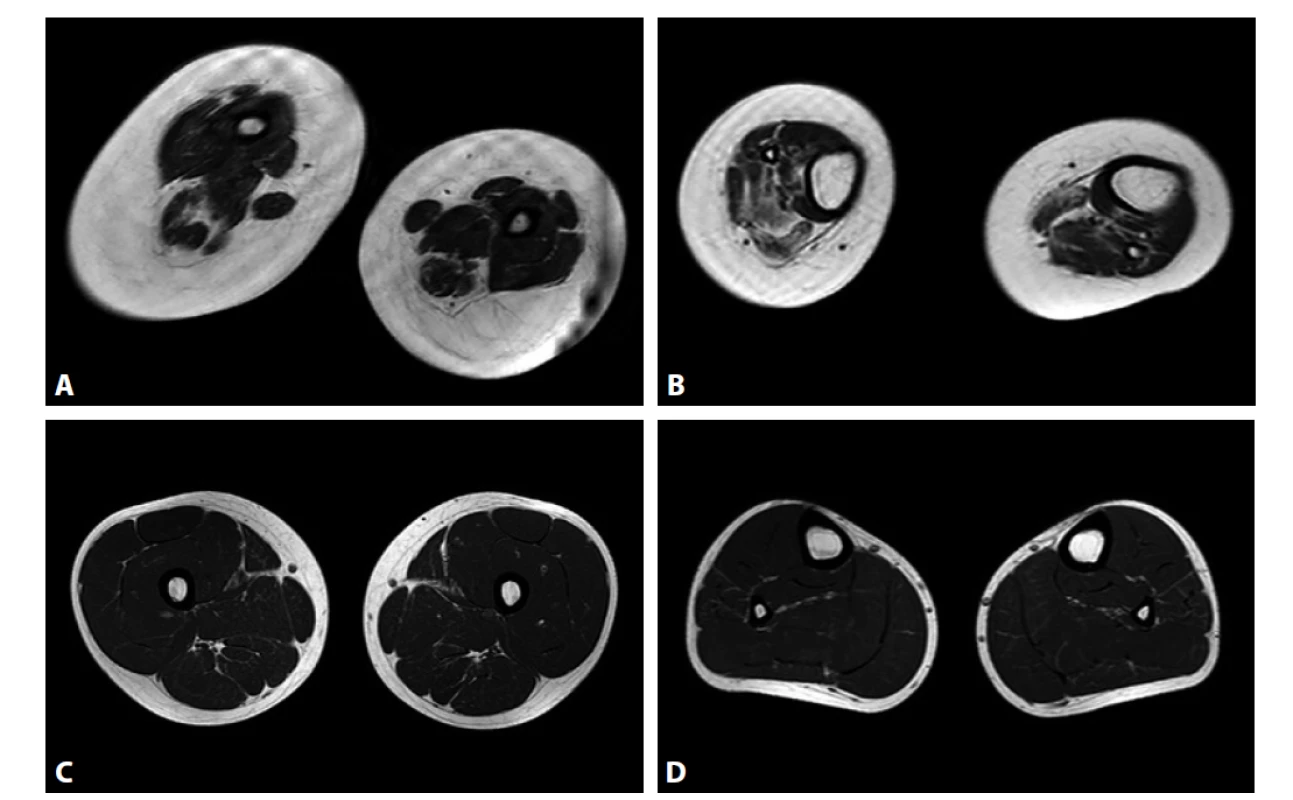
Analýza 42 genů spojených se svalovými dystrofiemi a myopatiemi provedená v roce 2013 (ve 3 letech věku) nepřinesla výsledky v podobě záchytu patogenní varianty. Další NGS bylo provedeno v roce 2017 (v 7 letech věku). V tuto dobu již panel zahrnoval další skupiny NMD včetně genů pro artrogrypózy, ale ani tato analýza nestanovila genetickou diagnózu. Teprve nové bioinformatické zpracování sekvenačních dat zavedené v roce 2020 a identifikující CNV vedlo k identifikaci patogenní varianty – homozygotní duplikace 10.–16. exonu genu PLOD1. Patogenní varianty v tomto genu jsou dle OMIM spojeny s kyfoskoliotickým typem Ehlers-Danlosova syndromu.
Z uvedeného případu je zřejmé, že v diagnostické praxi je nutné vracet se k nedořešeným pacientům a dříve provedené analýzy doplňovat analýzami novými jak na úrovni experimentální (nový rozšířený panel nebo WES), tak na úrovni bioinformatické (doplnění analýzy CNV, nové interpretace variant na základě aktuálních publikovaných údajů). V případě použití panelu u heterogenních onemocnění je důležité myslet na diferenciální diagnostiku a do panelu zahrnout co nejvíce (nejlépe všechny) geny, které mohou souviset s daným fenotypem. Právě příkladem může být uvedený pacient, u kterého bylo na začátku podezření na kongenitální myopatii, ale nakonec stanovena diagnóza Ehlers-Danlosova syndromu tzv. onemocnění, jehož asociované geny nejsou standardně začleňovány do skupiny neuromuskulárních genů.
ZÁVĚR
Molekulárně genetická diagnostika NMD je vzhledem ke klinické a genetické heterogenitě těchto onemocnění náročná a situaci komplikuje i to, že některá onemocnění jsou spojena s expanzí event. delecí repetitivní sekvence. Tento typ mutace není možné běžně používanými technologiemi NGS identifikovat a diagnostika je prováděna různými modifikacemi PCR nebo Southern blotem s hybridizací. U většiny pacientů s podezřením na NMD je ale provedení NGS prvním krokem genetické analýzy. V případě identifikace patogenních sekvenčních variant většinou následuje jejich ověření přímou sekvenční analýzou jak u pacienta, tak i u jeho rodičů event. dalších rodinných příslušníků. V případě identifikace sekvenčních variant nejasného významu musí být zvážena pravděpodobnost jejich podílu na fenotypu pacienta.
Jednotlivé formy neuromuskulárních onemocnění jsou často velmi vzácné a jejich diagnostika musí být soustředěna do vysoce specializovaných center, která mají diagnostické zkušenosti a interpretují ve vzájemné vazbě nálezy klinické, biochemické, nálezy zobrazovacích metod event. další s nálezy molekulárně genetické analýzy. Zavedení NGS do značné míry eliminovalo nutnost provedení svalové biopsie pro cílení genetické analýzy. K tomuto diagnostickému kroku se v současné době přistupuje až po provedení NGS, které neodhalí patogenní nebo pravděpodobně patogenní varianty. Patologická analýza svalové tkáně v těchto případech může sloužit k upřesnění diagnózy pacienta (např. k potvrzení podezření na svalovou dystrofii nebo strukturální myopatii), event. může pomoci s interpretací varianty nejasného významu (např. identifikací deficitu proteinu kódovaného genem s výskytem varianty). Zásadní význam má pak patologická analýza svalové tkáně ve spojení s WES, event. WGS, a to v případě identifikace nových genů, které doposud nebyly s NMD asociovány. Příkladem vhodného propojení uvedených analýz může být studie (7), která identifikovala další gen spojený s autosomálně recesivní pletencovou svalovou dystrofií. Studie vycházela z analýzy 1500 pacientů s blíže neklasifikovaným oslabením ramenního a pánevního pletence a pacientů s vysokou hodnotou kreatinkinázy. U těchto pacientů byl proveden WES a u 3 rodin byly identifikovány homozygotní missense varianty v genu POPDC3. U pacientů s variantami v genu POPDC3 byla provedena magnetická rezonance svalu, vyšetření srdce a svalová biopsie, která mimo jiné zahrnovala i imunohistochemickou detekci proteinu POPDC3 pomocí western blotu. Následovala i funkční analýza identifikovaných variant v genu POPDC3 v tkáňové kultuře (oocyty Xenopus laevis) a zvířecím modelu (Zebrafish). Všechny uvedené přístupy se pak společně podílely na prokázání patogenity identifikovaných variant v genu POPDC3.
Významné místo v molekulárně genetické diagnostice NMD má i analýza NGS na úrovni mRNA (RNA sequencing). Hlavní přínos této metody je v identifikaci změn exprese a postranskripčních úprav mRNA, které mohou vznikat v důsledku přítomnosti variant v kódujících i nekódujících oblastech genomu. Příkladem diagnostické aplikace toho přístupu může být studie (8), ve které byla provedena RNA sekvenace 25 probandů s neuromuskulárním onemocněním negativních po provedení panelu a/nebo WES. Patogenní varianty byly identifikovány u 9 z nich (36 %). Jako vhodný zdrojový materiál pro tuto analýzu byla použita svalová tkáň a myotuby generované transdiferenciací fibroblastů.
Identifikace patogenních variant vede k výraznému posunu v chápání etiopatogeneze onemocnění, umožňuje predikci průběhu onemocnění, event. jeho cílenou léčbu, která může být specifická pro jednotlivé typy NMD nebo dokonce pro jednotlivé patogenní sekvenční varianty. Příkladem této specifické terapie může být ataluren podávaný pacientům s Duchennovou svalovou dystrofií, u kterých byla identifikována patogenní varianta typu nonsense (tj. varianta způsobující vznik předčasného terminačního kodonu v místě mutace) (9). Identifikace nových asociovaných genů a problematika genetických variant nejasného významu jsou dvě výzvy současné molekulárně genetické diagnostiky a to nejen v oblasti NMD. Metodický přístup jejich řešení je primárně založen na technikách NGS a na interpretaci identifikovaných variant se znalostí klinických nálezů a všech dalších potřebných vyšetření pacienta. Doplnění výše uvedeného funkční analýzou variant na úrovni in vitro a in vivo je velmi žádoucí, ale bohužel většinou nemožné v rámci běžné diagnostické praxe. Dá se předpokládat, že rozvoj tzv. translační medicíny, která je založena na přenosu výsledků základního výzkumu do klinického výzkumu a do klinické praxe, přispěje k většímu objasnění patofyziologického působení jednotlivých variant.
PODĚKOVÁNÍ
Práce byla podpořena projektem Ministerstva zdravotnictví ČR – RVO (FNB, 65269705).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Mgr. Jana Zídková, Ph.D.
Centrum molekulární biologie a genetiky
Fakultní nemocnice Brno
Jihlavská 20, 625 00 Brno
tel: +420 532 234 624
e-mail: zidkova.jana@fnbrno.cz
Zdroje
1. Adams DR, Eng CM. Next-Generation Sequencing to Diagnose Suspected Genetic Disorders. N Engl J Med 2018; 379(14): 1353 - 1362.
2. Thompson R, Spendiff S, Roos A, et al. Advances in the diagnosis of inherited neuromuscular diseases and implications for therapy development. Lancet Neurol 2020; 19(6): 522-532.
3. Richards S, Aziz N, Bale S, et al. Standards and Guidelines for the Interpretation of Sequence Variants: A Joint Consensus Recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 2015; 17(5): 405–424.
4. Yuen M, Ottenheijm CAC. Nebulin: big protein with big responsibilities. J Muscle Res Cell Motil 2020; 41(1): 103-124.
5. Linke WA, Hamdani N. Gigantic business: titin properties and function through thick and thin. Circ Res 2014; 114(6): 1052-1068.
6. Stehlíková K, Skálová D, Zídková J, et al. Muscular dystrophies and myopathies: the spectrum of mutated genes in the Czech Republic. Clin Genet 2017; 91(3): 463-469.
7. Vissing J, Johnson K, Töpf A, et al. POPDC3 Gene Variants Associate with a New Form of Limb Girdle Muscular Dystrophy. Ann Neurol 2019; 86(6): 832-843.
8. Gonorazky HD, Naumenko S, Ramani AK, et al. Expanding the Boundaries of RNA Sequencing as a Diagnostic Tool for Rare Mendelian Disease. Am J Hum Genet 2019; 104(3): 466-483.
9. Mercuri E, Muntoni F, Osorio AN, et al. Safety and effectiveness of ataluren: comparison of results from the STRIDE Registry and CINRG DMD Natural History Study. J Comp Eff Res 2020; 9(5): 341-360.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Next-Generation PathologyČlánek 'PATOLOGIE MĚKKÝCH TKÁNÍČlánek 'PATOLOGIE ORL OBLASTIČlánek 'UROPATOLOGIEČlánek 'GYNEKOPATOLOGIEČlánek 'NEFROPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek 'PATOLOGIE MĚKKÝCH TKÁNÍČlánek 'PATOLOGIE GITČlánek 'CYTODIAGNOSTIKAČlánek 'LABORATORNÍ METODYČlánek 'PULMOPATOLOGIEČlánek Sekvenování nové generace a molekulární onkologický multidisciplinární tým z pohledu onkologa
Článek vyšel v časopiseČesko-slovenská patologie

2021 Číslo 3-
Všechny články tohoto čísla
- Next-Generation Pathology
- Cesta k cíli vede přes spolupráci
- 'PATOLOGIE MĚKKÝCH TKÁNÍ
- 'PATOLOGIE ORL OBLASTI
- 'UROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'NEFROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'PATOLOGIE MĚKKÝCH TKÁNÍ
- 'PATOLOGIE GIT
- 'CYTODIAGNOSTIKA
- 'LABORATORNÍ METODY
- Sekvenování nové generace – nástroj vědy či rutinní patologie?
- 'PULMOPATOLOGIE
- Sekvenování nové generace a molekulární onkologický multidisciplinární tým z pohledu onkologa
- Možnosti molekulárního testování somatických aberací v nádorové tkáni metodou NGS v rutinní praxi - aktuální situace v České republice
- Sekvenování nové generace a jeho aplikace v diagnostice neuromuskulárních onemocnění
- Využití metylačního profilu v diagnostice a prognostice nádorových onemocnění CNS
- Přehled problematiky hodnocení tumor infiltrujících lymfocytů u karcinomu prsu v rutinní diagnostické praxi
- Nediagnostikovaná kryptokoková meningoencefalitída s rozsiahlymi hypoxickoischemickými zmenami mozgu charakteru tretieho stupňa difúzneho axonálneho poškodenia
- Obrovskobuněčná myokarditida u mladé ženy odhalená při pitvě: kazuistika
- Doporučení pro testování PD-L1: metodika testování a reportování výsledků Verze_1 (17. 5. 2021)
- Molekulární testování u karcinomu endometria (společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP)
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení pro testování PD-L1: metodika testování a reportování výsledků Verze_1 (17. 5. 2021)
- Sekvenování nové generace – nástroj vědy či rutinní patologie?
- Molekulární testování u karcinomu endometria (společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP)
- Využití metylačního profilu v diagnostice a prognostice nádorových onemocnění CNS
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



