-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaXV. Nádory kůže a maligní melanom
Vyšlo v časopise: Klin Onkol 2017; 30(Supplementum1): 78-81
Kategorie: Nádory kůže a maligní melanom
XV/ 130. Předpoklady úspěchu imunoterapie, aneb máme prediktory na úrovni celého organizmu?
Lakomý R.1, Poprach A.1, Zdražilová Dubská L.2,3, Vyzula R.1
1 Klinika komplexní onkologické péče, MOÚ, Brno, 2 Oddělení laboratorní medicíny, MOÚ, Brno 3 RECAMO, MOÚ, Brno
Východiska: Léčba založená na reaktivaci protinádorové imunity je dnes považována za jednu z nejperspektivnějších cest v onkologii. Kromě maligního melanomu slaví protinádorová imunoterapie úspěchy také u nádorů ledvin, močového měchýře a plic, výzkum běží napříč všemi onkologickými diagnózami. Pro dosažení vyšší účinnosti je stále více požadována lepší predikce léčebné odpovědi. Samotná exprese ligandu PD-L1 je jako prediktor léčebné odpovědi u anti-PD-1 protilátek přijímána s určitými výhradami. Půjde pravděpodobně o jeden z možných prediktorů, důležitá bude korelace s dalšími faktory. Svoji roli budou hrát velikost nádorové masy, její mutační nálož, schopnost vyvolat reakci imunitního systému, nádorové mikroprostředí se svými supresními faktory či vlastní kondice imunitního systému. I přes získané poznatky je situace stále hodně nejasná a jasný prediktor nemáme. Regulační mechanizmy a vztah mezi nádorem a imunitním systémem pacienta jsou příliš složité, aby je byl schopen rozklíčovat jeden faktor. Cíl: Shrnutí základních poznatků z retrospektivních analýz souborů pacientů léčených anti-CTLA-4 a anti-PD-1 protilátkami. Prezentace vlastních zkušeností s běžnými laboratorními parametry (LDH, CRP, relativní počet lymfocytů, eozinofilů) jako prediktory úspěchu imunoterapie s ipilimumabem. Závěr: Personalizovaná medicína bude hrát i vzhledem k nákladnosti léčby stále větší roli. Aktuálně nemáme v rukou silný prediktor léčebné odpovědi. Dle retrospektivních analýz se ale můžeme opřít o řadu faktorů, které nám mohou pomoci při hrubém odhadu potenciálního úspěchu imunoterapie.
XV/ 133. Imunoterapie u maligního melanomu
Krajsová I.
Dermatovenerologická klinika 1. LF UK a VFN v Praze
Incidence melanomu se v ČR meziročně zvyšuje přibližně o 4 %, v roce 2014 bylo diagnostikováno 2 409 nových případů. Díky zvýšené informovanosti laické i odborné veřejnosti sice převažují časné formy nádoru s příznivou prognózou, ale přesto stále přetrvává přibližně třetina nemocných, kteří přicházejí na první vyšetření až s pokročilým melanomem s vysokým rizikem vzniku metastáz. Odhaduje se, že asi 3 % těchto nemocných má již v době záchytu primárního nádoru i vzdálené metastázy. Metastazující melanom je velmi agresivní nádor s vysokou mortalitou a až do roku 2011 neexistoval lék, který by byl schopný významně ovlivnit celkový průběh onemocnění. Zásadní pokrok v terapii melanomu způsobil až objev klíčových molekul regulujících buněčné imunitní reakce, tzv. checkpoints, mezi které patří cytotoxický T lymfocytární antigen 4 (CTLA-4), programmed death-1 (PD-1) receptory a ligand PD-1 receptoru programmed death ligand-1 (PD-L1). Vývoj monoklonálních protilátek blokujících tyto inhibiční molekuly zahájil zcela novou éru v terapii melanomu. Hlavní představitel inhibice CTLA-4 ipilimumab, prokázal již v prvních klinických studiích schopnost vyvolat dlouhodobé léčebné odpovědi vč. prodloužení celkového přežití pacientů s metastazujícím melanomem. Rozvoj imunoterapie ale pokračoval a výsledky klinických studií s anti-PD-1 protilátkami nivolumabem a pembrolizumabem potvrdily nejen jejich významně vyšší účinnost proti chemoterapii, ale též proti ipilimumabu. Četnější léčebné odpovědi i prodloužení doby do progrese (PFS) a celkového přežití (OS) je navíc podpořeno velmi dobrou snášenlivostí a nízkou toxicitou. Anti-PD-1 protilátky je tak možné využívat i v kombinované léčbě. Kombinace nivolumabu s ipilimumabem již prokázala vysokou léčebnou účinnost, bohužel ale provázenou i vyšší toxicitou. Zkouší se však i další kombinace anti-PD-1 protilátek, např. s BRAF a MEK inhibitory nebo s onkolytickou T-VEC vakcínou. Tyto kombinace, propojení cílené léčby imunoterapií nebo spojení intralezionální a systémové aplikace imunoterapie, naznačuje jednu z dalších možných cest léčby melanomu.
XV/ 141. Možný abskopální efekt indukovaný kryoterapií u pacienta s metastatickým melanomem, který progredoval na léčbě anti-CTLA-4
Kodet O.1, Lacina L.1, Důra M.1, Šuková T.1, Šťastný M.2, Krajsová I.1
1 Dermatovenerologická klinika 1. LF UK a VFN v Praze, 2 Bristol-Myers Squibb spol. s s.r.o., Praha
Východiska: Imunoterapeutické přístupy využívající anti-CTLA-4 či anti-PD-1 protilátky představují od roku 2010 nedílnou součást léčebných postupů u pokročilého melanomu. Imunoterapie však funguje jen u části pacientů s pokročilým melanomem, a proto se hledají způsoby, jak pomoci imunitním buňkám v rozpoznání nádorových antigenů. Radioterapie je jeden ze způsobů, jak zvýšit množství nádorových antigenů, které jsou uvolněny do prostředí a mohou být pohlceny a vystaveny APC buňkami T lymfocytům. Tento mechanizmus může být za tzv. abskopálním efektem (abskopální = mimo cíl). Tento efekt zvýšeného rozpadu nádorových buněk může být posilován i chemoterapií, ale dosud nebyla u melanomu publikována žádná data, která by naznačovala abskopální efekt po kryoterapii. Popis případu: Pacient s recidivujícím metastatickým postižením melanomu v jizvě po předchozí excizi superficiálně se šířícího melanomu Breslow 1,5 mm v roce 2009 na zádech vlevo byl léčen podáním anti-CTLA-4 terapie bez efektu. Dva měsíce po terapii anti-CTLA-4 došlo k progresi jak kožních a podkožních metastáz v oblasti původní jizvy, tak k rozvoji metastatického postižení axilárních uzlin vlevo a jater dle CT vyšetření. Vzhledem k již předchozí neúspěšné aktinoterapii (aplikovaná ještě před touto terapií) postižené oblasti kůže zad byla použita paliativní kryoterapie kožních metastáz ve snaze alespoň částečně redukovat nádorovou masu. Po kryodestrukci části kožních metastáz byl patrný překvapivý efekt nejen na kožní a podkožní metastázy zad, ale došlo i k vymizení postižení axilárních lymfatických uzlin a suspektního jaterního postižení. Pacient je k dnešnímu dni bez další terapie a bez recidivy onemocnění 10 měsíců od ukončené terapie ipilimumabem a 8 měsíců po ukončené kryoterapie. Aktivaci imunitního systému a terapeutickou odpověď po kryalizaci naznačují i laboratorní data týkající se hladin ALC, LDH a hladina S100 proteinu (obr. 1, 2). Závěr: Přestože existuje řada preklinických dat, která ukazují na možnou synergii mezi aplikací kryoterapie a aktivací imunitního systému, podle nám dostupných informací se zřejmě jedná o první případ možného abskopálního efektu kryoterapie u pacienta s melanomem. Kryoterapie aplikovaná na kožní metastázy mohla vyvolat zvýšený rozpad nádorových antigenů s následnou aktivací imunitního systému a systémovým efektem na úrovni lymfatických uzlin a jaterního postižení, přestože pacient na předchozí léčbě ipilimumabem progredoval.
Obr. 1. Stav ke dni 9. 11. 2015. 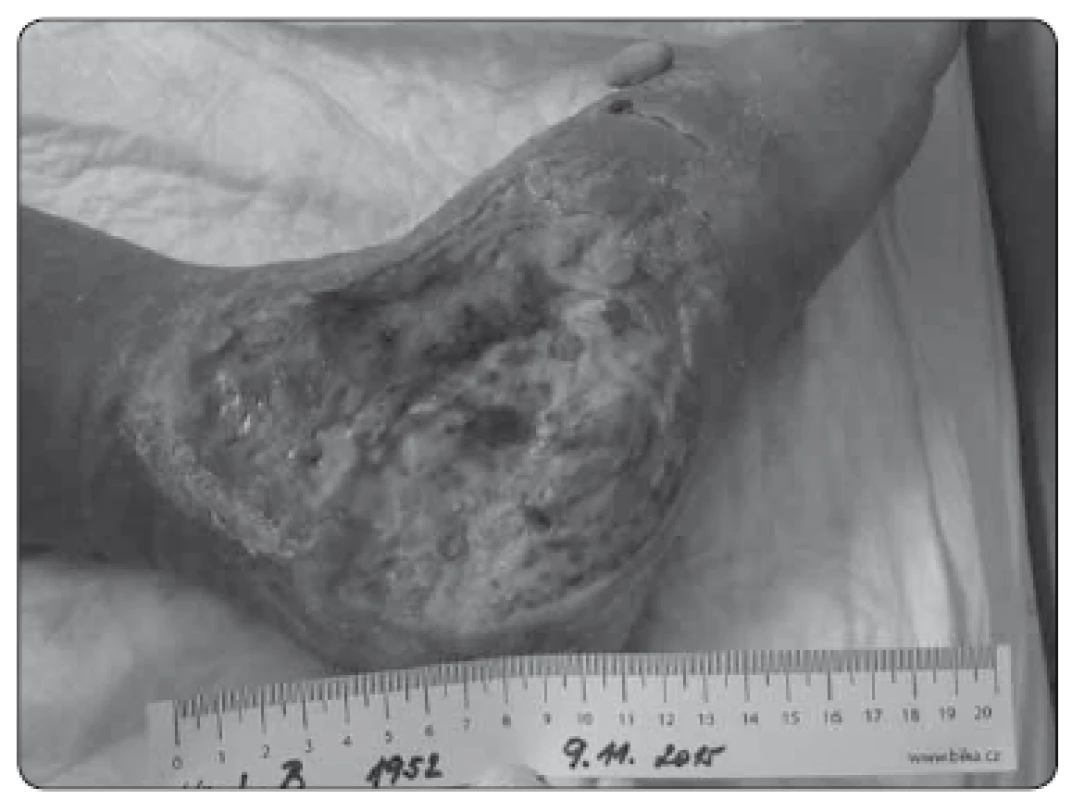
Obr. 2. Stav ke dni 20. 7. 2016. 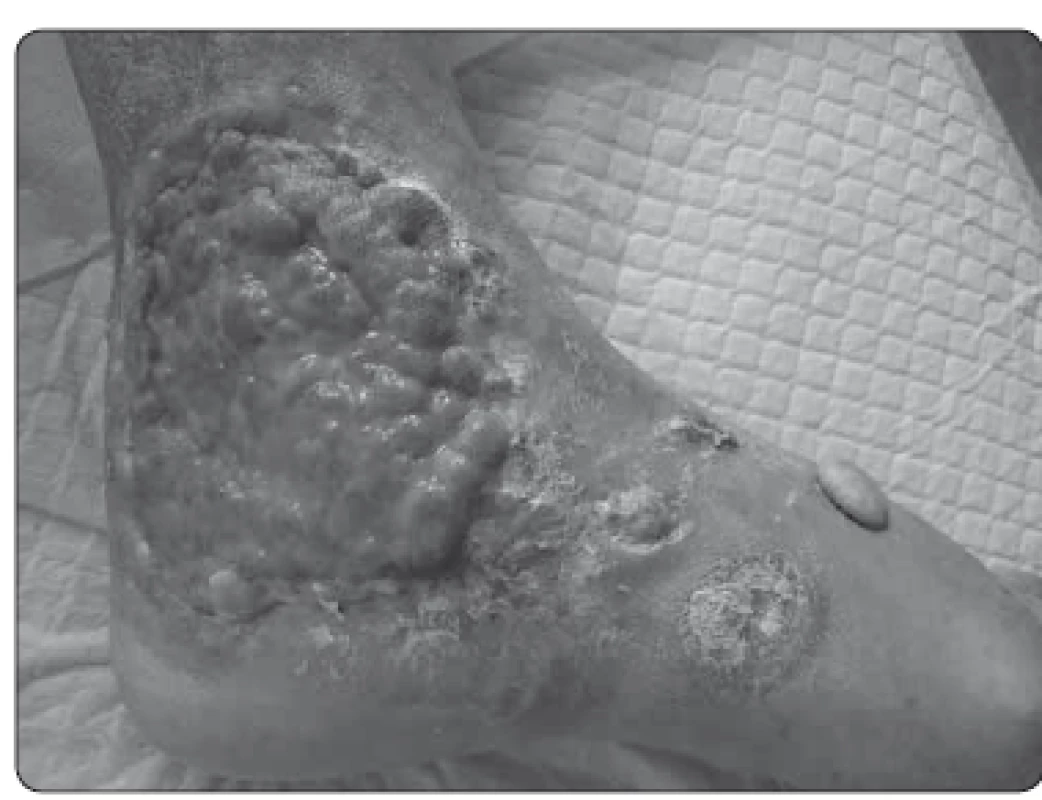
XV/ 178. Imunoterapie v léčbě pokročilého maligního melanomu
Lakomý R.1, Poprach A.1, Koukalová R.2, Kazda T.3
1 Klinika komplexní onkologické péče, MOÚ, Brno, 2 Oddělení nukleární medicíny, MOÚ, Brno, 3 Klinika radiační onkologie, MOÚ, Brno
Východiska: Standardní léčba se u pokročilého maligního melanomu zásadně změnila. Používaná chemoterapie a imunoterapie před rokem 2011 nebyla schopna významně prodloužit život našich pacientů. Ke změně dochází po příchodu cílené léčby (BRAF a MEK inhibitory) a moderní imunoterapie. Z moderní imunoterapie již standardně používáme monoklonální protilátky – ipilimumab (anti-CTLA-4 protilátka), nivolumab a v brzké době bude k dispozici i pembrolizumab (anti-PD-1 protilátky). Anti-PD-1 protilátky prokázaly v randomizovaných klinických studiích svoji superioritu nad chemoterapií i ipilimumabem. Pro dosažení vyšší účinnosti je stále více požadována lepší predikce léčebné odpovědi. I vzhledem k nákladnosti léčby bude hrát personalizovaná medicína stále větší roli. Podobně jako každá protinádorová léčba, tak i imunoterapie má své vedlejší účinky. K nejvíce obávaným patří autoimunitně podmíněné nežádoucí účinky. Vzhledem k jejich vysoké četnosti s rizikem rozvoje život ohrožujících komplikací je nezbytná dostatečná edukace nejen pacienta a rodinných příslušníků, ale i středního zdravotnického personálu. Cíl: Shrnutí základních poznatků o moderní imunoterapii u pokročilého maligního melanomu. Budou prezentovány vlastní zkušenosti s ipilimumabem, nivolumabem a pembrolizumabem, vč. nejčastějších nežádoucích účinků a jejich řešení. Závěr: Léčba založená na reaktivaci protinádorové imunity je dnes považována za jednu z nejperspektivnějších cest v onkologii. Kromě maligního melanomu protinádorová imunoterapie slaví úspěchy také u nádorů ledvin, močového měchýře a plic, výzkum běží napříč všemi onkologickými diagnózami. Při rozvoji vedlejších účinků je nezbytná multioborová spolupráce.
XV/ 287. Komplexní léčba metastatického maligního melanomu – kazuistika
Zycháčková K., Kohoutek M.
Komplexní onkologické centrum, Krajská nemocnice T. Bati, a. s., Zlín
Východiska: Maligní melanom kůže patří mezi časně metastazující zhoubné nádory, metastázy postihují zejména kůži, uzliny, játra, plíce a mozek. Jeho incidence má vzrůstající tendenci, nyní činí 13/ 100 000 obyvatel. Rozlišujeme čtyři základní typy kožního maligního melanomu – lentigo maligna, nodulární melanom, povrchově se šířící melanom a akrolentiginozní melanom. Léčbou volby všech stadií je vždy chirurgická intervence. Pokročilá stadia nemoci často vyžadují komplexní léčbu. Popis případu: Uvádíme kazuistiku 74leté pacientky s diagnózou duplicitního maligního melanomu v oblasti III. prstu PDK a levého lýtka. Dne 17. 5. 2007 byla provedena amputace prstu a excize névu na levém lýtku. Histologicky se jednalo o vřetenobuněčný maligní melanom a akrolentiginozní melanom, Breslow 0,3 – oba pT1 N0 M0. Po excizi pacientka dispenzarizována. V březnu 2010 prokázána recidiva a provedena excize metastázy v podkoží nártu PDK. Restaging nalézá metastáze uzlin pravého třísla a pod kolenem. Od července do listopadu 2010 podána 1. linie chemoimunoterapie DTIC se sekvenční aplikací proleukinu perilezionálně a subkutánně v dávce 9 MIU + interferon alfa 3× týdně 3 MIU s.c. Po pěti cyklech dosaženo PR. V prosinci 2010 exstirpace podkožních metastáz nártu PDK – dosaženo CR. Během následujících 2 let 4× reoperace podkožních metastáz na nártu PDK, poslední v červenci 2012. Možnosti chirurgické léčby v této lokalitě vyčerpány s výjimkou možné amputace PDK v bérci – toto řešení pacientka odmítla. V listopadu 2012 aplikace Proleukinu perilezionálně na oblast ulcerující metastázy v podkoží nártu PDK a paliativní RTG terapie na tuto oblast do celkové dávky 44 Gy/ 11 fr. Lokálně i celkově CR. V říjnu 2015 relaps nemoci v lymfatických uzlinách třísla vpravo, na nártu a stehně PDK. Od 12/ 2015 do 2/ 2016 2. linie paliativní léčby – imunoterapie Yervoy – čtyři aplikace bez komplikací. Dosaženo SD se zhojením ulcerace v nártu a ohraničením lézí v podkoží stehna. V červnu 2016 na zobrazovacích metodách stabilizace nálezu na nártu, náznak růstu ložiska na stehně, které však dále ohraničeno a operabilní, proto indikována exstirpace, která byla provedena v srpnu 2016. Dále dispenzarizace. V lednu 2017 prokázána progrese nemoci – nová podkožní meta PDK na bérci. Zažádáno o nivolumab, pacientka ve výborném výkonnostním stavu, chodící bez hole, končetina zcela funkční. Závěr: Naše kazuistika demonstruje pozitivní efekt komplexní onkologické léčby volící sekvenčně chirurgickou resekci, chemoterapii a imunoterapii v několika liniích vedoucí k udržení kvality života a k prodloužení přežití.
XV/ 288. Efekt radioterapie v léčbě slizničního maligního melanomu – kazuistiky
Proroková M., Dvorská J., Pospíšková M., Kohoutek M.
Komplexní onkologické centrum, Krajská nemocnice T. Bati, a. s., Zlín
Úvod: Slizniční melanom je vzácné onemocnění, které tvoří přibližně 1 – 3 % všech melanomů. Polovina slizničních melanomů připadá na oblast hlavy a krku. Obecně je preferován radikální chirurgický přístup, který však pro lokalizaci nádorů nese velké riziko mutilací. Úloha radioterapie není zcela jasná. Nádor je obecně považován za radiorezistentní, ale některé studie dokládají efekt radioterapie. Systémová léčba se zatím ukázala jako málo účinná. Prognóza slizničních melanomů je špatná, 5leté přežití se pohybuje kolem 10 – 25 %. Popis případu: Kazuistika 1: žena, 82 let, KI 90 %, bez komorbidit, vyšetřována pro nosní obstrukci. 1/ 2015 na CT tumorózní expanze maxilární dutiny vlevo cT4 N0 M0. 2/ 15 histologická verifikace maligního melanomu. Nález radikálně inoperabilní. Při velký rozsah tumoru radioterapie primárně neindikována (riziko ztráty vizu). Do 7/ 2015 aplikováno 5 sérií chemoterapie DTIC s efektem PR. Pro pozitivitu CD117 (c-kit) žádáno o schválení úhrady léčby imatinibem, ta zamítnuta, doporučena paliativní RT. 9/ 2015 SRT Cyber Knife Ostrava 45 Gy/ 3 fr. s efektem PR, dále dispenzarizována. Po roce dle MRI a ORL progrese primárního tumoru, žádost o imatinib opět zamítnuta, indikována reindukční paliativní CHT DTIC, po 4 sériích PR dle MRI. Nyní pacientka 25 měsíců od diagnózy, bez symptomů nemoci a toxicity chemoterapie, bez generalizace. Kazuistika 2: žena, 64 let, KI 90 %, bez komorbidit, od 6/ 2014 vyšetřována pro bolesti v horní čelisti po extrakci zubu a opakované epistaxe tmavé krve. Při stomatochirurgickém vyšetření nalezena granulační tkáň v místě po extrakci zubu, histologicky potvrzen melanom. PET/ CT s nálezem akumulace FDG v ložisku podél defektu spodiny pravého maxilárního sinu, s osteolýzou maxily zasahující do orbity cT4a N0 M0. Primárně zvažována operace s exenterací orbity, tuto pacientka odmítla. Od 9/ 2014 chemoterapie režimem DTIC, aplikovány 2 cykly, při třetím alergická reakce s hypotenzí, chemoterapie ukončena, dosaženo PR. Následně kurativní radioterapie na oblast tumoru Elekta Synergy 6MV, VMAT 54 Gy/ 15 fr. RT se slizniční toxicitou grade 3. 1/ 2015 MRI, PET/ CT bez známek tumoru. Pacientka nyní 32 měsíců od diagnózy v remisi. Závěr: I přes nedostatek klinických dat se jeví radioterapie v kombinaci s chemoterapií jako účinná léčebná metoda, díky které se nám podařilo navodit dlouhodobou stabilizaci onemocnění.
XV/ 289. Onkologická duplicita – agresivní lymfom v neobvyklé lokalizaci a recidivující maligní melanom
Mazúr R.1, Šmardová L.1, Poprach A.2, Lakomý R.2, Kalodová Hadačová J.1, Mayer J.1
1 Interní hematologická a onkologická klinika LF MU a FN Brno, 2 Klinika komplexní onkologické péče, MOÚ, Brno
Východiska: Kazustika popisuje případ 63letého pacienta po léčbě maligního melanomu v týlní oblasti dg. 04/ 2012 v dlouhodobé remisi od 06/ 2012. Pacient podstoupil totální resekci (histologicky Clark III, Breslow 5,6 mm) s histologicky verifikovanou negativitou sentinelové uzliny a od té doby byl pouze sledován na MOÚ v Brně, poslední kontrola (USG krku a břicha, RTG hrudníku) proběhla v 03/ 2015. Popis případu: Přibližně od 04/ 2015 pacient pozoruje progredující otok v oblasti levého hlezna, pro který postupně navštěvuje specialisty různých oborů. Otok nejdříve nebolestivý, po čase je však narušen povrch kůže, mění se na vřed a silně zapáchá. Nejednoznačnost příčiny obtíží jej nakonec přivede na chirurgii MOÚ v Brně, kde provedená MRI hlezna nalézá objemnou měkkotkáňovou tumorózní expanzi. Z výsledku punkční biopsie předběžně uzavřena jako maligní lymfom a pacient odeslán k došetření na pracoviště IHOK FN Brno. Pro nutnost bližší subtypace byla exstirpovaná patologická uzlina v oblasti levého třísla, definitivně se jedná o difuzní velkobuněčný B lymfom, dle CT stagingu klinické stadium IVB se současným postižením tříselných a pánevních uzlin a ložisky v plicích. Indikovaná byla chemoimunoterapie 6× R-CHOP a 1× HD AraC, podána od 10/ 2015 do 03/ 2016. Průběh léčby byl komplikován recidivující infekcí hlezenní oblasti, která byla do značné míry dána její rozsáhlou vstupní infiltrací. Vykultivováno bylo až devět různých bakteriálních kmenů, vše se daří postupně zvládat díky kombinované ATB terapii a pečlivé práci ošetřovatelského personálu (viz obrazová dokumentace). Klinicky rozsah maligní infiltrace hlezna ustupuje, dle PET/ CT restagingu dochází k regresi regionální lymfadenopatie v oblasti třísla a pánve, ale zcela překvapivě nacházíme významnou početní a velikostní progresi ložisek v plicích a nově též vícečetné patologické kumulace v játrech a ve skeletu. Pro smíšenou odpověd na léčbu (a též vzhledem k anamnéze nádorové duplicity) indikujeme bronchoskopickou verifikaci plicních ložisek. Histologicky jde o metastázy maligního melanomu a pacient se vrací zpět na pracoviště MOÚ. Následuje podání čtyř sérií paliativní chemoterapie HD DTIC pouze s dočasným efektem. U pacienta se rozvíjejí opakované epiparoxyzmy a CT mozku bohužel potvrzuje mnohočetné metastázy. Pacient v 08/ 2016 umírá, 4 roky a 4 měsíce po vstupní diagnostice. Závěr: Našim cílem bylo upozornit na nutnost došetření i zdánlivě nesuspektních nálezů u pacientů v dispenzarizaci pro onkologické onemocnění. Taktéž nejasná léčebná odpověď je u těchto pacientů indikací k histologickému ověření.
XV/ 461. Epidermolysis bullosa congenita – prekanceróza spinocelulárního karcinomu
Vokurková J.1, Bučková H.2, Košková O.3
1 EB centrum, FN Brno, 2 Oddělení dětské plastické chirurgie, Klinika dětské chirurgie, ortopedie a traumatologie LF MU a FN Brno, 3 Dětské kožní oddělení PeK, FN Brno
Epidermolysis bullosa congenita je vzácné, geneticky podmíněných onemocnění, které má širokou škálu projevů. Společným znakem je snížená mechanická odolností kůže a sliznic i po minimálním tlaku nebo i spontánní tvorbou puchýřů. Příčinou onemocnění jsou mutace genů pro vazebné proteiny v oblasti epidermis nebo dermoepidermální junkce. V ČR je evidováno v centralizovaném EB centru FN Brno přes 250 pacientů, několik desítek s nejtěžšími formami. U pacientů s recesivní dystrofickou formou, junkční formou a Kindlerovým syndromem je zvýšené riziko vzniku chronických defektů, které jsou prekancerózou pro spinocelulární karcinom s možností generalizace metastáz cévní a lymfatickou cestou. Prevencí vzniku karcinomu je léčba chronických defektů, jejich pravidelné sledování klinicky a histopatologicky opakovaně, nejlépe v rozmezí několika měsíců. Při pozitivní diagnóze je stěžejní včasné chirurgické odstranění ložiska, ostatní onkologická léčba je stále dubiózní. Léčba je řídí u každého pacienta přísně individuálně multidisciplinárním týmem.
XV/ 462. Hodnocený léčivý přípravek pro léčbu epidermolysis bullosa založený na MSC – pilotní data z výroby LP a charakterizace MSC
Gospošová E.1, Zdražilová Dubská L.1, Pilátová K.1, Vidláková P.1, Vokurková J.2, Bučková H.3, Flajšarová L.1, Demlová R.1, Merhautová J.1, Valík D.4
1 Farmakologický ústav, LF MU, Brno, 2 Klinika popálenin a rekonstrukční chirurgie LF MU a FN Brno, 3 Pediatrická klinika LF MU a FN Brno, 4 Klinika dětské onkologie LF MU a FN Brno
Epidermolysis bullosa congenita (EB) je skupina vzácných vrozených dědičných onemocnění pojivové tkáně způsobující puchýře na kůži a sliznicích. Příčinou onemocnění je mutace některého z genů podílejících se na stavbě pokožky a vazby epiteliálních buněk na bazální laminu, jako jsou geny pro keratin, plektin, laminin, kolagen či integrin. Navzdory velkému pokroku v molekulárním pochopení nemoci a testování nových metod léčby pro toto onemocnění neexistuje efektivní léčba. Předmětem preklinického a klinického výzkumu jsou především postupy genové terapie, náhrady proteinu, transplantace kostní dřeně a buněčné terapie, např. alogenními fibroblasty, mezenchymálními stromálními/ kmenovými buňkami (MSC), keratinocyty atd. Připravujeme 1. akademické klinické hodnocení fáze I/ II hodnotící bezpečnost a účinnost léčby allogenními MSC derivovanými z tukové tkáně u pacientů s epidermolysis bullosa a 2. proces výroby hodnoceného léčivého přípravku založeného na MSC. MSC jsme izolovali z lipoaspirátu a následně kultivovali v kultivačních lahvích a uzavřeném automatickém bioreaktoru (Quantum cell expansion system). Získané MSC byly pozitivní na CD105, CD73, CD90 a MHC I (slabě), a negativní pro CD45, CD34, CD14, CD19 a MHC II. Kultivací v diferenciačních médiích a barvením jsme prokázali schopnost trilineární diferenciace do osteogenní, adipogenní a chondrogenní linie. V allo-MLR jsme prokázali, že MSC 1. nestimulují aktivaci allogeních T lymfocytů, 2. v závislosti na dávce inhibují aktivaci T lymfocytů stimulovaných fytohemaglutininem a 3. inhibují aktivaci T lymfocytů stimulovaných dendritickými buňkami. Naše pilotní výsledky ukazují, že jsme schopni pro klinické použití získat z tukové tkáně a kultivovat vysoké množství MSC s imunomodulačními vlastnostmi.
XV/ 466. Stanovení BRAF mutované volné nádorové DNA jako nástroj pro monitoring pacientů léčených pro metastazující melanom
Putzová M., Šedivcová M., Vaněček T., Michal M.
Bioptická laboratoř s.r.o., Plzeň
Přes narůstající preventivní opatření a povědomí o maligním melanomu incidence tohoto onemocnění celosvětově stoupá. Raná stadia lze velice efektivně léčit chirurgicky, ale ve fázi generalizace se melanom řadí mezi nejobtížněji léčitelné diagnózy. Tento tradiční pohled se s přibývajícími znalostmi o patogenezi melanomu na molekulárně biologické úrovni začíná měnit příznivým směrem. Pacientům s BRAF mutací je nabízena cílená léčba pomocí BRAF inhibitorů, která prodlužuje jak bezpříznakové období, tak i celkové přežívání pacientů. BRAF mutace se stanovuje z nádorové tkáně, která je fixována formolem a zalita do parafinových bločků. Včasné vyšetření je základem pro úspěch léčby. I přesto se někdy nepodaří z technických důvodů obstarat archivovanou nádorovou tkáň nebo je nádorová DNA nekvalitní z důvodu degradace formolem a nebo jsou metastázy tumoru nepřístupné odběru. Dalším problémem je, že stav mutace v metastázách, které chceme primárně léčbou zasáhnout, se liší od stavu mutace ve vyšetřovaném primárním tumoru. Z tohoto důvodu se snažíme verifikovat metodu stanovení BRAF mutované volné nádorové DNA za použití plně automatického real-time PCR diagnostického systému Idylla (Biocartis). Tento přístup je dobře dostupný pro klinika, málo invazivní pro pacienta a výsledek analýzy odpovídá aktuálnímu genotypu pacienta. V pilotních studiích byla prokázána vysoká senzitivita i specifita u pacientů s pokročilým maligním melanomem. Cílem naší studie je ověřit využití analýzy BRAF mutované volné DNA jako biomarkeru léčebné odpovědi u BRAF pozitivních pacientů s melanomem léčených imunoterapií. Dále pak ověřit senzitivitu a specificitu metody plně automatického real-time PCR na přístroji Idylla (Biocartis). Posluchače seznámíme s našimi dosavadními výsledky monitoringu pacientů.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek XII. Psychosociální péčeČlánek EditorialČlánek XIV. Nádory prsuČlánek XXIII. UroonkologieČlánek XXV. HematoonkologieČlánek Využití metody PLA pro detekci komplexů p53/p63/p73 in situ v nádorových buňkách a nádorové tkániČlánek Jmenný rejstříkČlánek XVI. Nádory jícnu a žaludkuČlánek XX. Nádory hlavy a krku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo Supplementum1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- XXI. Nádory plic, průdušek a pleury
- XXII. Gynekologická onkologie
- XXIII. Uroonkologie
- XXIV. Nádory nervového systému
- XXV. Hematoonkologie
- XXVI. Nádory dětí, adolescentů a mladých dospělých
-
XXVII. Varia
(ostatní, jinde nezařaditelné příspěvky) - XXVIII. Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
- XXIX. Základní a aplikovaný výzkum v onkologii
- Stanovení DNA metylace v BRCA2 genu na elektrodových biočipech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Využití metody PLA pro detekci komplexů p53/p63/p73 in situ v nádorových buňkách a nádorové tkáni
- Význam deregulace mikroRNA v molekulární patogenezi a histologické transformaci folikulárního lymfomu
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
- Je možné pozorovat etnickou diferenci v základních krevních testech? Údaje z programu onkologické prevence v komplexním onkologickém centru v České republice
- Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
- Fullerenový nanotransportér doxorubicinu pro cílenou interakci s mutovaným genem BRCA2
- Analýza mikroRNA u epiteliálního karcinomu vaječníku
- Využití porózního hydrogelu jako 3D scaffoldu pro růst leukemických B lymfocytů
- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Diagnostický a terapeutický potenciál membránového HSP90
- Everolimus v denní klinické praxi se zaměřením na problematiku postižení sliznice dutiny ústní – zkušenost onkologického centra v průběhu roku 2016
- Jmenný rejstřík
- I. Onkologická prevence a screening
- II. Organizace a financování zdravotní péče
- III. Epidemiologie nádorů, klinické registry, zdravotnická informatika
- IV. Vzdělávání, kvalita, bezpečnost a právní otázky v onkologické praxi
- V. Diagnostické metody v onkologii
- VI. Onkochirurgie, lokální aplikace protinádorových léčiv
- VII. Radioterapeutické metody
- VIII. Nežádoucí účinky protinádorové léčby
- IX. Paliativní péče, podpůrná a symptomatická léčba
- X. Nutriční podpora v onkologii
- XI. Ošetřovatelská péče a rehabilitace
- XII. Psychosociální péče
- XIII. Hereditární nádorové syndromy
- Editorial
- XIV. Nádory prsu
- XV. Nádory kůže a maligní melanom
- XVI. Nádory jícnu a žaludku
- XVII. Nádory tlustého střeva a konečníku
- Organizační a programový výbor BOD a KNZP v roce 2017
- XVIII. Nádory slinivky, jater a žlučových cest
- XIX. Nádory skeletu a sarkomy
- XX. Nádory hlavy a krku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- VIII. Nežádoucí účinky protinádorové léčby
- XVII. Nádory tlustého střeva a konečníku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



