-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLéčba chronické virové hepatitidy C simeprevirem
Therapy of chronic hepatitis C with simeprevir
This review presents all essential information on simeprevir and its use in the therapy of chronic hepatitis C. The review is focused on the curent role of simeprevir in IFN‑based regimens as well as its role in IFN‑free regimens.
Key words:
viral hepatitis C – simeprevir – pegylated interferon
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Autoři: P. Urbánek
Působiště autorů: Interní klinika 1. LF UK a ÚVN Praha
Vyšlo v časopise: Gastroent Hepatol 2015; 69(2): 103-108
Kategorie: Hepatologie: přehledová práce
doi: https://doi.org/10.14735/amgh2015103Souhrn
Přehlednou formou jsou prezentovány základní informace o simepreviru a jeho užití v terapii chronické virové hepatitidy C. Pozornost je věnována jeho aktuální pozici v interferonových režimech léčby, ale prezentovány jsou i základní klinická data ze studií s tzv. bezinterferonovými režimy léčby.
Klíčová slova:
virová hepatitida C – simeprevir – pegylovaný interferonÚvod
Během posledních dvou let došlo k dramatické revoluci ve vývoji léčby chronické virové hepatitidy C. Základní součástí léčby se stávají přímo působící virostatika (DAA), která přímo blokují replikační cyklus viru. V současné době existují vedle sebe kombinace DAA s interferonem a ribavirinem, tzv. IFN‑based režimy, a léčebné kombinace bez IFN (IFN‑free), někdy i bez ribavirinu. Vzhledem k vývoji situace na trhu a stávajícím pravidlům úhrady jednotlivých preparátů platných v ČR se v následujícím textu soustředíme na klinické použití simepreviru v kombinaci s pegylovaným interferonem a ribavirinem, IFN‑free režimy budou zmíněny pouze okrajově. Kombinace simepreviru s interferonem a ribavirinem je v současnosti považována za režim první volby pro pacienta s chronickou HCV infekcí.
Charakteristika simepreviru
Simeprevir (SMV) je inhibitorem virové NS3/ 4A proteázy druhé generace, je následovníkem první generace, do které je řazen boceprevir a telaprevir. S ostatními zástupci třídy inhibitorů NS3/ 4A proteázy má celu řadu společných vlastností:
jeho protivirová účinnost je prokazatelná pouze u genotypu HCV 1;
- je potřeba jej kombinovat s ostatními preparáty užívanými v léčbě chronické HCV infekce, v monoterapii podáván být nesmí;
- má vysoký potenciál pro vznik nežádoucích lékových interakcí;
- má široké spektrum nežádoucích účinků, i když ve srovnání s ostatními zástupci této třidy je jejich počet významně nižší.
Jeho nespornou výhodou je, že je účinný i v kombinacích bez interferonu alfa, tj. může být součástí tzv. IFN‑free režimů, což neplatí pro boceprevir ani telaprevir. Hlavní nevýhodou jeho použití je naopak významné snížení jeho protivirové účinnosti u pacientů infikovaných genotypem HCV 1a s rezistenční variantou (RAV) v Q80K v oblasti NS3.
Lékové interakce
Primární enzym, který se účastní biotransformace SMV, je CYP3A4 a další léčivé přípravky mohou mít klinicky významné účinky na farmakokinetiku SMV prostřednictvím CYP3A4. Současné podávání SMV se středně silnými nebo silnými inhibitory CYP3A4 může významně zvýšit plazmatickou expozici SMV, zatímco současné podávání se středně silnými nebo silnými induktory CYP3A4 může významně snížit plazmatickou expozici SMV a vést ke ztrátě účinnosti. Proto se nedoporučuje současné podávání SMV s látkami, které jsou středními nebo silnými inhibitory nebo induktory CYP3A4. Jaterní vychytávání SMV je zprostředkováno OATP1B1. Inhibitory OATP1B1, jako je eltrombopag nebo gemfibrozil, mohou vyvolat mírné zvýšení plazmatických koncentrací SMV. SMV mírně inhibuje aktivitu CYP1A2 a aktivitu intestinálního CYP3A4, zatímco neovlivňuje aktivitu hepatálního CYP3A4. Současné podávání SMV s léčivými přípravky, které jsou primárně metabolizovány enzymatickým systémem CYP3A4, může vést ke zvýšeným plazmatickým koncentracím takových léčivých. SMV neovlivňuje CYP2C9, CYP2C19 nebo CYP2D6 in vivo. SMV inhibuje transportéry OATP1B1 a P ‑ gp. Současné podávání SMV s léčivými přípravky, které jsou substráty pro transport OATP1B1 a P ‑ gp, může vést ke zvýšeným plazmatickým koncentracím takových léčivých přípravků.
Účinnost léčby
Měřítkem účinnosti protivirové léčby je tzv. setrvalá virologická odpověď ve 12. týdnu po skončení léčby, SVR12. Tato je definována tak, že ve 12. týdnu po skončení protivirové léčby je sérová HCV RNA nedetekovatelná, tj. pod detekčním limitem použité kvalitativní metody detekce. Je‑li toto kritérium naplněno, je riziko relapsu (znovuobjevení se sérové HCV RNA) prakticky 0 %.
Režimy s pegylovaným interferonem (PEG‑ IFN) a ribavirinem (RBV)
Dosud neléčené osoby, HCV GT 1
Účinnost režimu PEG‑ IFN + RBV + SMV byla zkoumána ve studiích QUEST‑1 a QUEST‑2 [1,2]. Obě studie byly studie randomizované, multicentrické, dvojitě zaslepené studie fáze III. Primárním cílem obou studií bylo zjistit podíl pacientů, kteří dosáhnou SVR12. Sekundárním cílem studií bylo zjistit podíl pacientů, kteří a) selhali během léčby nebo b) vyvinuli relaps infekce. Relaps infekce byl přitom definován jako znovuobjevení se sérové HCV RNA po skončení léčby po dosažení negativity během léčby. Uspořádání obou studií ukazuje schéma 1.
Schéma 1. Uspořádání studií QUEST. Scheme 1. Design of QUEST studies. 
Legenda: RGT = HCV RNA < 25 IU/mL: detekovatelná či nedetekovatelná v týdnu 4 a HCV RNA < 25 IU/mL: nedetekovatelná v týdnu 12 PR = PEG-IFN + RBV Léčba vedená podle odpovědi (RGT) je princip, který umožňuje u přesně definované skupiny osob s dobrou a rychlou virologickou odpovědí zkrátit dobu léčby na co nejkratší tak, aby nedošlo ke snížení celkové SVR12. Z obrázku je vidět, že u osob, které dosáhly negativní sérové HCV RNA ve 4. týdnu a tato negativita pokračovala i ve 12. týdnu, byla léčba všemi třemi preparáty ukončena v týdnu 24. V ostatních případech pokračovala po 24. týdnu léčba pouze dvojkombinací PEG ‑ IFN + RBV. V obou studiích byly vytvořeny dvě kohorty nemocných: 1. kohorta pacientů zařazených na území USA a 2. kohorta pacientů zařazených na území EU. Většina analýz pak byla provedena v každé kohortě samostatně. Kumulované výsledky léčby v obou studiích ukazuje graf 1. Je vidět, že ve větvích obsahujících SMV bylo dosaženo vysoce statisticky významně vyšší SVR12 (87 % v evropské kohortě) proti kontrolní skupině léčené PEG ‑ IFN + RBV (53 %). Významným zjištěním byla i skutečnost, že 92 % pacientů splnilo kritérium pro RGT, tj. byli léčeni pouze 24 týdnů. V této skupině pacientů s RGT byla SVR12 92 %. Ve skupině, která byla léčena plnou délku léčby (48 týdnů, 7 %), byla přitom SVR12 pouze 39 %. Tento výsledek nicméně není důvodem k tomu, aby nenaplnění podmínek RGT bylo užito jako kritérium pro (předčasné) ukončení léčby.
Graf 1. SVR12 ve studiích QUEST-1 a QUEST-2. Graph 1. SVR12 in the QUEST‐1 and QUEST‐2 studies. 
Významného rozdílu v SVR12 bylo mezi oběma větvemi studie dosaženo také při hodnocení SVR12 podle stupně jaterní fibrózy. SVR12 v závislosti na stupni fíbrózy hodnocené systémem METAVIR ukazuje graf 2. SVR12 71 % u pacientů s jaterní cirhózou je opravdu vysoké číslo.
Graf 2. SVR12 u evropských pacientů podle skóre METAVIR. Graph 2. SVR12 among European patients according to the METAVIR score. 
Graf 3. SVR12 podle subtypu a přítomnosti NS3 Q80K polymorfizmu u evropských pacientů (ITT). Graph 3. SVR12 according to the subtype and the presence of NS3 Q80K polymorphism among European patients. 
adj diff = korigovaná diference N/A = nehodnotitelné (< 10 pacientů v jednom z ramen) Jedno z nejdůležitějších zjištění, které se odrazilo i v indikačním omezení SMV, ukazuje graf 4. Jednak je patrna rozděleně účinnost u genotypu 1b a 1a, u 1a je vidět i rozdíl v účinnosti podle přítomnosti či absence genetické varianty oblasti NS3 asociované s rezistencí (RAV) označované jako Q80K. Je dobře vidět, že účinnost u genotypu 1a je celkově 80 %, u 1b 90 %. SVR12 u 1a s přítomnou RAV Q80K je 64 %, bez RAV je 82 %. Rovněž je pro srovnání vidět, že podobné rozdíly nejsou v kontrolní větvi léčené kombinací PEG ‑ IFN + RBV, takže tyto rozdíly lze jednoznačně přisoudit podání SMV.
Graf 4. RVR, ETR a SVR12 ve studii PROMISE. Graph 4. RVR, ETR and SVR12 in the PROMISE study. 
Bezpečnost léčby se SMV
Přehled nežádoucích reakcí a vedlejších účinků zaznamenaných ve studiích řady Quest ukazuje tab. 1. Je třeba upozornit na dva momenty:
- Podání SMV s sebou přináší vyšší riziko kožních reakcí. Tyto reakce jsou vázány pouze na jeho podání, proto se vyskytují pouze v prvních 12 týdnech léčby. V dalším období jsou vedlejší reakce plně srovnatelné s kombinací PEG ‑ IFN + RBV.
- Výskyt kožních reakcí je významně nižší při podání SMV ve srovnání s telaprevirem (TVR, virostatikum 1. vlny 1. generace). Incidence kožních reakcí u TVR je až 55 %, zatímco u SMV je kolem 25 %. Na rozdíl od TVR rovněž zatím nebyly popsány závažné kožní reakce typu SCAR (severe cutaneous adverse reaction), kam patří např. toxická epidermolýza, syndrom DRESS, či Stevens ‑ Johnsonův syndrom.
Tab. 1. Nežádoucí účinky (NÚ) u evropských pacientů (ITT). Tab. 1. Adverse effects among European patients. 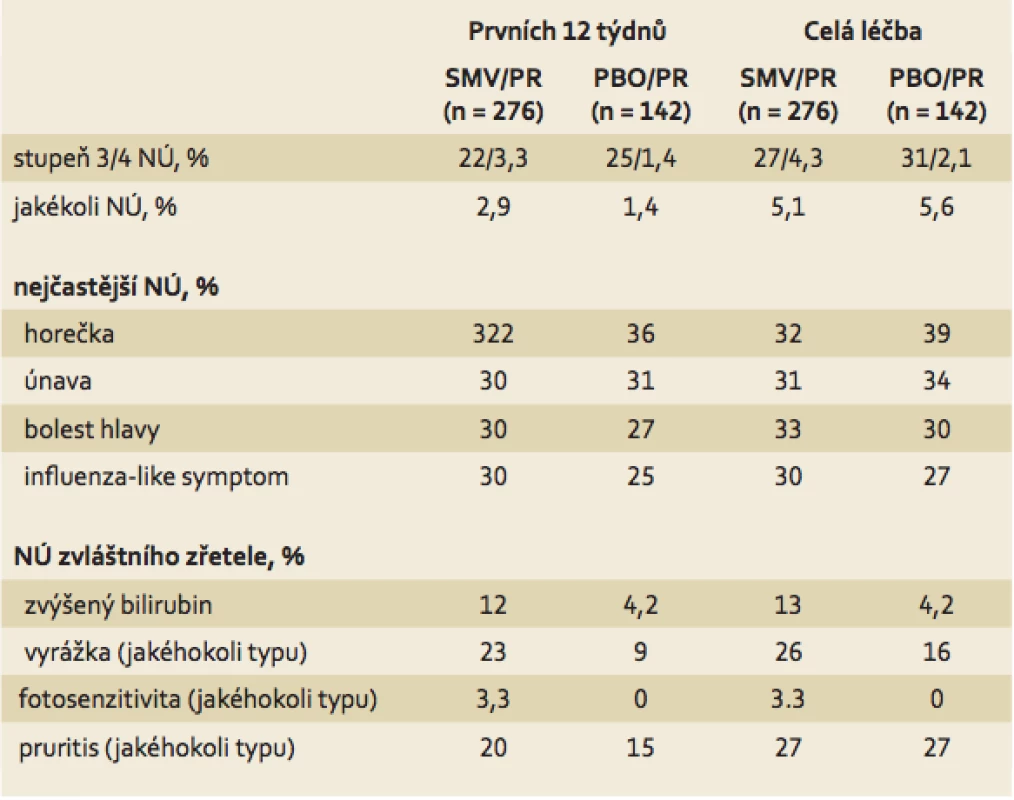
Osoby opakovaně léčené, HCV GT 1
SMV byl zkoumán jako postup druhé linie ve studii PROMISE [3]. Studie PROMISE je studie randomizovaná, multicentrická, dvojitě zaslepená, fáze III.Posuzovala klinickou účinnost kombinace SMV + PEG ‑ IFN + RBV vs placebo + PEG ‑ IFN + RBV u pacientů, kteří byli hodnoceni jako relapseři na předchozí standardní léčbu kombinací PEG ‑ IFN + RBV. Jde tedy vlastně o srovnání moderní trojkombinace s opakováním stejného dvojkombinačního režimu (postup doporučovaný před rokem 2012, před érou DAA). Primární cíl studie byl zjistit podíl pacientů se SVR12. Sekundárním cílem pak byl průkaz bezpečnosti podání SMV v této kombinaci a indikaci. Uspořádání studie ukazuje schéma 2. I v této indikaci byl použit princip RGT.
Schéma 2. Uspořádání studie PROMISE. Scheme 2. Design of the PROMISE study. 
pacienti (n = 393) byli stratifikováni podle HCV 1 subtypu a IL28B genotypu RGT: HCV RNA < LLQ v týdnu 4 a < LOD v týdnu 12 Účinnost léčby ukazuje graf 4. RVR je definována jako sérová HCV RNA < 25 IU/ ml ve 4. týdnu léčby. Při naplnění tohoto kritéria bylo dosaženo SVR12 v 87 % případů. ETR je odpověď na konci léčby, tj. sérová HCV RNA < 25 IU/ ml v okamžiku ukončení léčby. SVR12 (definice viz výše) bylo při celkovém hodnocení dosaženo ve skupině léčené SMV v 79 % případů. Účinnost opakování stejného režimu jako při první léčbě, tj. PEG ‑ IFN + RBV, je u relapserů v této studii pouze 37 %.
Vztah SVR12 ke genotypu 1a a 1b a přítomnosti RAV Q80K u genotypu 1a je podobný, jaký byl popsán ve studiích QUEST. I v této indikaci SMV je existence RAV v okamžiku zahájení protivirové léčby významným faktorem, který negativně ovlivňuje pravděpodobnost dosažení SVR12.
Ve studii PROMISE bylo dosaženo vysoké SVR12 u pacientů bez jaterní cirhózy (F0 – F3), a sice 88 %. Pozoruhodné je, že podobně vysoké SVR12 (85 %) bylo dosaženo ve skupině pacientů s jaterní cirhózou. Z pohledu pacienta a nákladů na jednotlivou léčbu je důležité i zjištění, že 93 % pacientů s F4 splnilo kritérium pro RGT a z těchto pacientů dosáhlo SVR12 celých 92 %.
Bezpečnost léčby se SMV
Při hodnocení bezpečnostních dat ze studie PROMISE bylo dosaženo analogických výsledků jako ve studiích QUEST, proto je zde nebudeme dále rozebírat [4].
Režimy bez PEG‑ IFN (IFN‑free)
IFN‑free režimy se SMV byly zkoumány v rámci studie COSMOS. Studie COSMOS byla otevřená, randomizovaná, multicentrická studie fáze II zkoumající režim SMV + sofosbuvir (SOF) s ribavirinem, či bez ribavirinu (RBV) u pacientů s chronickou HCV infekcí vyvolanou genotypem 1 dosud neléčených nebo u tzv. null ‑ responderů. Null ‑ response byla definována jako pokles hladiny sérové HCV RNA ≤ 2log ve 12. týdnu předchozí léčby kombinací PEG ‑ IFN + RBV. Primárním cílem byl znovu podíl SVR, sekundárním cílem bezpečnost podání celého režimu. Pacienti zařazení do studie byli rozděleni na dvě kohorty:
- kohorta 1: METAVIR F0 – F2, předchozí null - respondéři na terapii PEG ‑ IFN + RBV (stratifikace podle IL28B a HCV GT 1 subtypu),
- kohorta 2: METAVIR F3–F4, předchozí null -respondéři na terapii PEG ‑ IFN + RBV nebo naivní pacienti.
Účinnost léčby v kohortě 1 ukazuje graf 5. I zde je ve skupině pacientů infikovaných genotypem 1a s přítomnou RAV Q80K patrna nižší SVR12. Negativní ovlivnění je však vyrovnáno prodloužením léčby na 24 týdnů. V ostatních podskupinách je účinnost léčby 12 ‑ a 24týdenní srovnatelná. Stejný princip v obou ohledech je popsán i při hodnocení účinnosti obou režimů v kohortě 2. Účinnost léčby mezi cirhotiky (METAVIR 4), null ‑ respondéry a cirhoticky dosud neléčenými ukazuje graf 6. I tato čísla v rozmezí cca 90 – 100 % lze považovat za převratná. Výhodou je, že v řadě režimů nevede podání RBV k navýšení SVR12, což při asociaci podání RBV s množstvím vedlejších účinků je další pozitivní rys použití SMV v kombinaci se SOF.
Graf 5. SVR12 podle HCV GT1 subtypu a NS3 Q80K polymorfizmu, kohorta 1. Graph 5. SVR12 according to the HCV GT1 subtype and NS3 Q80K polymorphism, cohort 1. 
Graf 6. SVR12 podle odpovědi na předchozí léčbu – METAVIR F4 pacienti, kohorta 2. Graph 6. SVR12 according to the response to the previous treatment – METAVIR F4 patients, cohort 2. 
Závěr
Od 1. 3. 2015 má SMV plnou úhradu pro dosud neléčené a opakovaně léčené pacienty s chronickou HCV infekcí vyvolanou genotypem 1 s výjimkou pacientů s genotypem 1a a prokázanou RAV Q80K. Tato indikace je plně v souladu s platným SPC přípravku Olysio a rovněž je v souladu se zněním aktuálních doporučených postupů vydaných ČHS ČLS JEP a SIL ČLS JEP v roce 2014 [5]. Ze standardů, k jejichž vypracování sloužily také všechny výše probrané klinické studie, a ze stanovené úhrady SMV vyplývá několik skutečností:
- kombinace SMV + PEG ‑ IFN + RBV je jednoznačně postupem první volby pro pacienty s chronickou HCV infekci vyvolanou genotypem 1b,
- osoby infikované genotypem 1a nelze v tuto chvíli v ČR testovat na přítomnost RAV Q80K, proto by tyto osoby měly být léčeny jiným dostupným virostatikem (boceprevir nebo telaprevir) v kombinaci s PEG ‑ IFN a RBV,
- kombinace PEG ‑ IFN + RBV má pouze zcela okrajový význam. Použít ji lze pouze v případech, kdy je kumulace pozitivních prediktivních faktorů efektu léčby PEG ‑ IFN + RBV.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MU Dr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200, 160 00 Praha
petr.urbanek@uvn.cz
Zdroje
1. Jacobson IM, Dore GJ, Foster GR et al. Simeprevir with pegylated interferon alfa 2a plus ribavirin in treatment ‑ naive patients with chronic hepatitis C virus genotype 1 infection (QUEST‑1): a phase 3, randomised, double‑blind, placebo ‑ controlled trial. Lancet 2014; 384(9941): 403 – 413. doi: 10.1016/ S0140 ‑ 6736(14)60494 ‑ 3.
2. Manns M, Marcellin P, Poordad F et al. Simeprevir with pegylated interferon alfa 2a or 2b plus ribavirin in treatment ‑ naive patients with chronic hepatitis C virus genotype 1 infection (QUEST‑2): a randomised, double‑blind, placebo ‑ controlled phase 3 trial. Lancet 2014; 384(9941): 414 – 426. doi: 10.1016/ S0140 ‑ 6736(14)60538 ‑ 9.
3. Forns X, Lawitz E, Zeuzem S et al. Simeprevir with peginterferon and ribavirin leads to high rates of SVR in patients with HCV genotype 1 who relapsed after previous therapy: a phase 3 trial. Gastroenterology 2014; 146(7): 1669 – 1679. doi: 10.1053/ j.gastro.2014.02.051.
4. Scott J, Gilles L, Fu M et al. Simeprevir added to peginterferon and ribavirin lessens time with fatigue, depressive symptoms and functional limitations in patients with chronic hepatitis C compared with peginterferon and ribavirin: results from 1161 patients in the QUEST‑1, QUEST‑2 and PROMISE studies. J Viral Hepat 2014. doi: 10.1111/ jvh.12365.
5. Urbánek P, Husa P, Šperl J et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Gastroent Hepatol 2014; 68(6): 499 – 512.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2015 Číslo 2- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Nejen o hepatitidách
- Komplikace perkutánní endoskopické gastrostomie
- Léčba chronické virové hepatitidy C simeprevirem
- Možnosti neinvazivní diagnostiky u NAFLD
- Funkční varianty genů pro metaloproteinázy MMP‑ 1 a MMP‑ 7 nesouvisejí se závažností portální hypertenze u pacientů s cirhózou
- Autochtónny prípad vírusovej hepatitídy E na Slovensku
- Dvacet let urgentního ERCP ve FN v Motole
- Poruchy motility pažeráka – Chicagska klasifikácia, v3.0
- Atypický obraz infiltrace tračníku lymfomem u pacienta s chronickou lymfatickou leukemií
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Vedolizumab v léčbě Crohnovy choroby
-
Správná odpověď na kvíz
Syndrom zanořeného disku – buried bumper syndrom (BBS) - Nová perorální antikoagulancia – přednosti a úskalí léčby
- Report of XXth Gastroforum
- ECCO – Inflammatory Bowel Diseases 2015
- IBD pracovní dny 2015, Hořovice
- Nová platforma webu časopisu Gastroenterologie a hepatologie a spolupráce s Národní lékařskou knihovnou
- Zprávy z redakce
- Maltofer®
- Autodidaktický test: hepatologie
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Maltofer®
- Atypický obraz infiltrace tračníku lymfomem u pacienta s chronickou lymfatickou leukemií
- Nová perorální antikoagulancia – přednosti a úskalí léčby
- Poruchy motility pažeráka – Chicagska klasifikácia, v3.0
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



