-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Minulost, současnost a budoucnost neuroprotekce
Past, present and future of neuroprotection
The aim of neuroprotection is to rescue ischemic tissue and improve functional outcome by intervention on ischemic cascade. A lot of experimental trials demonstrated that neuroprotection is effective in infarction volume reduction. Unfortunately most of the effective agents in preclinical studies failed in clinical trials. None of tested neuroprotective agents have shown to improve outcome in clinical trial phase III up to now. The main reasons that may have caused the failure of past clinical trials are: extended therapeutic window, heterogeneous population of stroke patients, low dose administration, inadequate endpoints, discrepancies on outcome assessments in experimental and clinical trials, irregular study design and inadequate statistical evaluation. Future of neuroprotection is seen in concentration on the subgroup with existing penumbra, the combination of neuroprotection and thrombolysis and in prophylactic neuroprotection. The unification of the design in experimental and clinical trials is the main prerequisite for potential success in the clinical testing.
Key words:
neuroprotection, stroke, ischemia, penumbra, therapeutic window, clinical trials.
Autoři: Jan Mraček
Působiště autorů: Univerzita Karlova v Plzni, Lékařská fakulta, Neurochirurgické oddělení FN
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 586-590
Kategorie: Přehledový článek
Souhrn
Cílem neuroprotektivní terapie je záchrana ischémií postižené tkáně a zlepšení funkčního klinického stavu prostřednictvím ovlivnění ischemické kaskády. Mnoho experimentálních studií prokázalo pozitivní vliv neuroprotekce na redukci objemu infarktového ložiska. Bohužel drtivá většina látek úspěšných v preklinickém testování selhala ve studiích klinických. Dosud nebyl u žádného neuroprotektiva prokázán signifikantní léčebný efekt ve fázi III klinického testování. Za hlavní důvody neúspěchu klinického výzkumu je považováno použití dlouhého terapeutického okna, hodnocení heterogenní populace, podávání nízké dávky, neadekvátní výběr sledovaných cílů, rozdílný způsob hodnocení efektu léčby u experimentálních a klinických studií, chybný design studií a špatné statistické zpracování. Blízkou budoucnost neuroprotekce lze vidět v koncentraci na podskupinu se zachovanou penumbrou, použití kombinace neuroprotekce a trombolýzy a v konceptu profylaktické neuroprotekce. Kardinální podmínkou potenciálního úspěchu klinického testování je sjednocení designu experimentálních a klinických studií.
Klíčová slova:
neuroprotekce, cévní mozková příhoda, mozkový infarkt, ischemický polostín, terapeutické okno, klinické studie.Úvod
Fokální ischemická cévní mozková příhoda (iCMP) bývá nejčastěji způsobena zástavou krevního průtoku při uzávěru mozkové tepny trombem nebo embolem. Porucha perfuze mozkové tkáně vede k nastartování patofyziologických dějů vedoucích k ireverzibilnímu poškození mozkové tkáně – mozkovému infarktu (obr. 1). Z pohledu terapeutického lze patofyziologii mozkové ischémie rozdělit do dvou oblastí zájmu: na cévní řečiště a vlastní mozkovou tkáň. Cílem reperfuzní léčby je prostřednictvím trombolýzy nebo mechanické rekanalizace zprůchodnit obliterovanou cévu a včas obnovit průtok do postižené oblasti mozku. Jedná se o protektivní zásah na úrovni mozkového cévního řečiště. Ochrana hypoperfundované nervové tkáně ovlivněním ischemické kaskády (metabolismu neuronů) je cílem neuroprotektivní léčby. Neuroprotekce se počítá za specifickou léčbu iCMP.
Obr. 1. Patofyziologická kaskáda ischemického mozkového poškození NMDA – N-methyl-D-aspartate, AMPA – alfa-amino-3-hydroxy-5-methyl-4-isoxazol, DNA – deoxyribonucleotid acid, HEB – hematoencefalická bariéra 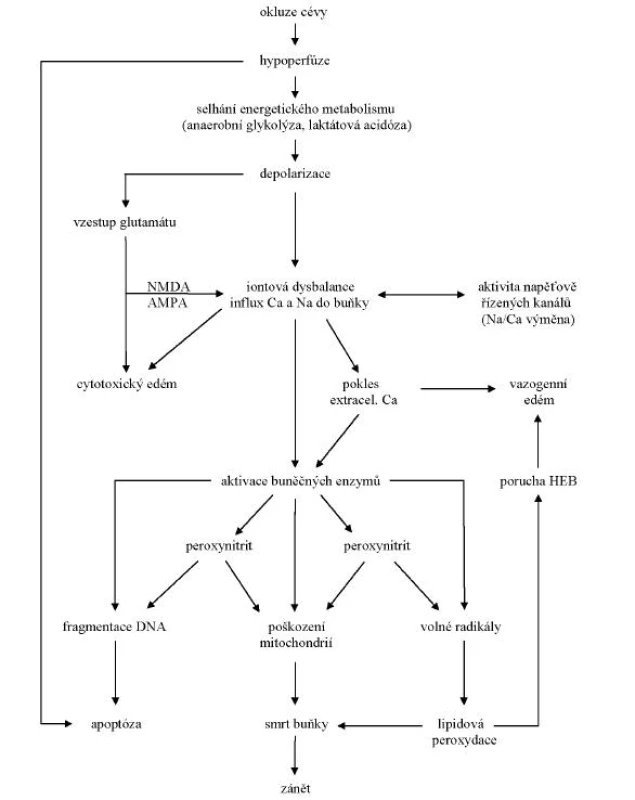
Neuroprotekce je definována jako strategie nebo kombinace strategií, která antagonizuje, přerušuje nebo zpomaluje škodlivé biochemické a molekulární děje, které, pokud zůstanou neovlivněny, vedou k ireverzibilnímu ischemickému poškození mozku (1). Složitost patofyziologické kaskády ischemického poškození umožňuje zásah na mnoha úrovních (viz obr. 1) (2–4). Možné léčebné strategie jsou dány různými mechanismy působení neuroprotektiv na ischemickou kaskádu (tab. 1). Fundamentální podmínkou potenciální úspěšnosti neuroprotektivní terapie je existence ischemické tkáně, která je aspoň částečně perfundována a není tak ireverzibilně poškozena. Reziduální průtok umožní dodání neuroprotektiva do cílové oblasti, která tak může být zachráněna i bez časné reperfuze (5).
Tab. 1. Přehled neuroprotektiv dle mechanismu účinku. 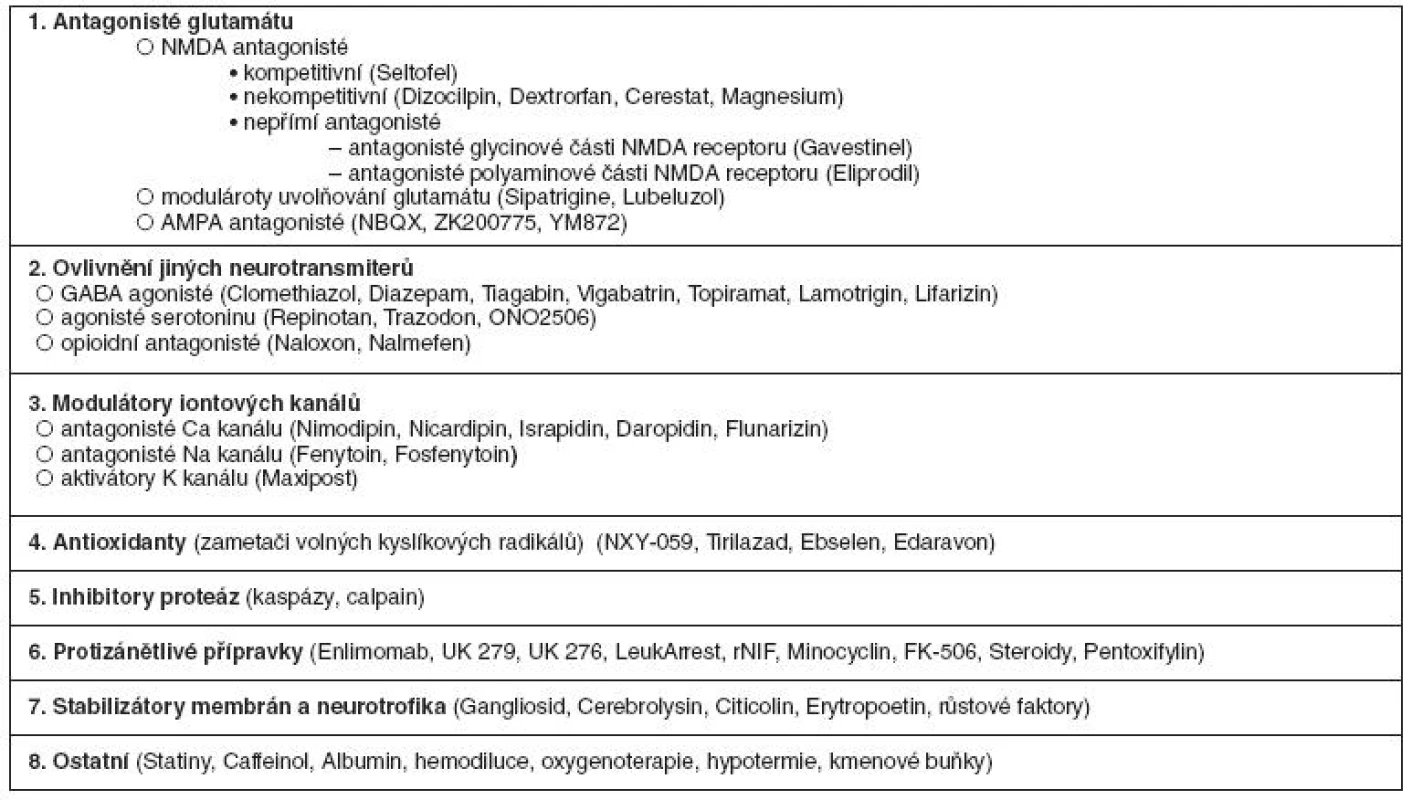
NMDA – N-methyl-D-aspartate, AMPA – alfa-amino-3-hydroxy-5-methyl-4-isoxazol propionate, GABA – gama-aminobutyric acid, rNIF – recombinant neutrophil inhibitory factor Minulost a současnost neuroprotekce („Everything works in animals but nothing in humans“)
Vznik zájmu o neuroprotektivní léčebnou strategii je datován do doby, kdy byla pochopena patofyziologie mozkové ischémie. Do konce osmdesátých let 20. století se vyskytují pouze sporadické informace o neuroprotekci. Exponenciální nárůst zájmu o tuto problematiku je patrný od počátku devadesátých let, od té doby bylo publikováno téměř 9000 odborných sdělení.
Experimentální studie na zvířecích modelech předložily jednoznačné důkazy, že při časném podání neuroprotektivních přípravků lze dosáhnout významné redukce objemu infarktového ložiska (až o 85 %) (1, 6). Bohužel drtivá většina látek úspěšných v preklinickém testování selhala ve studiích klinických (7). „Everything works in animals but nothing in humans“ je často užívaný slogan charakterizující propast mezi úspěšným preklinickým a neúspěšným klinickým výzkumem (7, 8). V roce 2006 byly publikovány výsledky klinické studie SAINT, která testovala antioxidant NXY-059. Jednalo se o první klinickou studii fáze III, která prokázala statisticky signifikantní léčebný efekt neuroprotektiva (9). Počáteční euforie z historicky prvního úspěchu však byla vystřídána rozčarováním po publikaci SAINT II, která výsledky předchozí studie nepotvrdila. Studie nezjistila statisticky významné rozdíly v léčebných výsledcích mezi léčenou a kontrolní skupinou (10). NXY-059 bylo vyřazeno z dalšího testování. V následujícím období bylo patrné rozčarování, pesimismus a ústup zájmu o neuroprotekci. Postupně se však objevila snaha nalézt pro neuroprotekci nové uplatnění. Vzhledem k obrovské diskrepanci mezi úspěšným preklinickým a neúspěšným klinickým výzkumem je hlavním cílem analyzovat důvody existujícího rozporu.
Chybný design studií
Přestože mnohé experimentální studie zaznamenaly výrazný úspěch, lze prapříčinu neúspěchu klinického testování nalézt právě v oblasti výzkumu preklinického. Jen málo experimentálních prací splňovalo STAIR kritéria (Stroke Therapy Academic Industry Roundtable) – doporučení mající zajistit správný design experimentálních studií (7). Ve studiích často nebylo rozlišováno, zda ischémie byla navozena dočasnou nebo permanentní okluzí tepny. Některé přípravky byly přeneseny do klinického výzkumu i přes malou nebo neprůkaznou účinnost, studie se lišily v kvalitě a hodnověrnosti. Navíc se ukázalo, že negativní experimentální výsledky často vůbec nebyly publikovány. Výsledky většiny klinických studií navíc byly neprůkazné, protože se jednalo o studie fáze I. Pouze 1/3 přípravků pokračovala do fáze II a III klinického testování. Více než polovina studií byla podporována farmaceutickým průmyslem, nejednalo se o nestranné, ale o komerčně zaměřené projekty často s chybným statistickým zpracováním (1, 7).
Dlouhé terapeutické okno
Přes jednoznačné zjištění experimentálních studií, že podmínkou úspěchu neuroprotekce je podání do šesti hodin od vzniku iktu, drtivá většina studií klinických doporučované terapeutické okno významně přesáhla. Přípravky tak byly testovány v období dokonané příhody, kdy již pravděpodobně nemohly být úspěšné (7). Ze 160 recentních klinických studií pouze dvě podávaly přípravek do 4–6 hodin od začátku ischémie. Je nepochybné, že klinické studie pracující s časovým oknem, ve kterém je neuroprotekce potenciálně efektivní, jsou mimořádně vzácné (6).
Rozdílný způsob hodnocení efektu léčby
Zatímco většina experimentálních studií hodnotila vliv podaných látek na redukci objemu infarktového ložiska, klinické studie posuzovaly neuroprotektivní efekt prostřednictvím neurologického obrazu (1, 7, 11). Využívány byly klinické skórovací stupnice NIHSS (National Institutes of Health Stroke Scale), mRS (modified Rankin scale) a BI (Barthel index). Objem infarktového ložiska však prokazatelně nekoreluje s hloubkou neurologické symptomatiky (11). Malé ložisko ve funkční krajině může být zodpovědné za významný deficit, a naopak velké ložisko v němé oblasti může být i asymptomatické.
Nehomogenní hodnocená populace
Zatímco u zvířecích modelů byla k vyvolání mozkové ischémie standardně využívána okluze střední mozkové tepny, studie klinické testovaly nehomogenní populaci. Zařazeni byli nemocní s infarkty různého stupně, typu i lokalizace (6, 7, 11). Nemocní s lehkým iktem mají přitom vysokou šanci na spontánní úpravu klinického stavu ve srovnání s nemocnými s těžkou příhodou, kde je spontánní úprava nepravděpodobná. Neuroprotektivní efekt se uplatňuje přednostně v oblasti mozkové kůry (nervové buňky), v oblasti bílé hmoty (nervové dráhy) je jeho účinek malý (7). Poměr bílé a šedé hmoty u mozku lidského a krysího se zásadně liší. Šedá hmota tvoří u hlodavců více než 90 %, u lidského mozku jen asi 50 % (12). Lokalizace ischemického ložiska (kortex, bílá hmota, bazální ganglia, přední/zadní povodí) má proto zásadní dopad na účinnost léčby. Dalším faktorem ovlivňujícím funkční výsledky je rozdílná celková kondice laboratorních zvířat a nemocných. V experimentech byla používána mladá a zdravá zvířata. Naproti tomu typickým postiženým mozkovou mrtvicí je starší člověk s mnoha komorbiditami, což má významný vliv na funkční výsledek (13).
Rozdílné dávkování
U preklinických a klinických studií byly použity různé dávky, koncentrace i způsoby aplikace přípravků. Aby bylo zabráněno vzniku nežádoucích účinků, byly v klinických studiích podávány nižší dávky, které tak pravděpodobně nemohly být účinné. Minimální účinná dávka nebyla často vůbec stanovena. Způsob podání látek v experimentu byl většinou krátkodobý a intravenózní. Klinické studie měly různá aplikační schémata pohybující se od jedné intravenózní dávky až po dlouhodobé orální podávání (6, 7, 11).
Neuroprotekce – budoucnost
Minulé dvě dekády nepřinesly přes intenzivní výzkum žádné účinné neuroprotektivum (3, 4, 6, 7). Ischemická kaskáda je nicméně natolik složitý a komplexní proces, že stále nabízí nepřeberné množství možných cílů zásahu pro další potenciální neuroprotektiva. Nalezení efektivní neuroprotektce u akutního mozkového infarktu je stále velmi žádoucí, zejména v prodloužení terapeutického okna pro trombolýzu (2–4). Za nejnadějnější strategie jsou paradoxně považovány známé a finančně dostupné léčebné postupy, které nebyly z důvodů nezájmu farmaceutického sektoru finančně podporovány a neprošly kvalitními studiemi (hypotermine, albumin, magnézium, tetracyklinová antibiotika, Caffeinol – kombinace etanolu s kofeinem) (1, 14). Stěžejní roli bude jistě hrát molekulární genetika. Optimálním řešením by byl dobře tolerovaný přípravek aktivovaný patologickým procesem, který má za úkol inhibovat (1). Z pohledu blízké budoucnosti je nezbytné zejména sjednotit design studií, soustředit se na nadějné neuroprotektivní strategie a podskupiny nemocných.
Sjednocení designu studií
Podmínkou testování přípravku v klinických studiích fáze III by měla být spolehlivě a opakovaně potvrzená úspěšnost u zvířecího modelu a úspěšné absolvování fází I a II klinického testování. Dodržení krátkého terapeutického okna použitého v preklinickém výzkumu je kardinálním předpokladem potenciální účinnosti neuroprotekce ve studiích klinických (6, 7, 11). Nevyhnutelné je ujednotit cíl (endpoint) experimentálních a klinických studií, který by měl zahrnovat jak hodnocení objemu infarktového ložiska, tak klinického obrazu prostřednictvím vhodné skórovací stupnice (6, 7, 11, 15).
Experimentální studie standardně využívají k navození mozkové ischémie okluzi střední mozkové tepny, proto i do klinických studí by měla být vybírána pouze homogenní skupina nemocných s mozkovým infarktem v povodí střední mozkové tepny (6, 7, 11). Zařazeni by měli být pouze nemocní se středně těžkým iktem (NIHSS 7–21), u kterých je největší šance prokázat účinek léčby (11).
Koncentrace na podskupinu s penumbrou
Další cestou jak sjednotit preklinický a klinický výzkum je soustředit se na podskupinu s existujícím ischemickým polostínem (penumbrou). Nemocní s mozkovým infarktem a prokázanou penumbrou by měli z léčby více profitovat podobně jako v případě trombolýzy (7, 11). Přítomnost penumbry je prokazatelná prostřednictvím difuzního (DWI) a perfuzního (PWI) vážení magnetické rezonance (MR). Penumbra odpovídá oblasti hypoperfuze na PWI s normálním nálezem na DWI (PWI/DWI mismatch). Experimentální studie prokázaly, že MR lze použít k průkazu penumbry i u zvířecího modelu (16). Existence ischemického polostínu by měla být podmínkou zařazení do klinické i experimentální studie, navíc by umožnila prodloužení terapeutického okna na 9 hodin (17).
Kombinovaná léčba
Větší šanci na úspěch mají multimodální přípravky působící na několika etážích ischemické kaskády nebo kombinace léčiv (koktejl) (7). Z pohledu průkazu úspěšnosti při testování je nejvhodnější použití monoterapie s multifaktoriálním mechanismem účinku (7).
Větší úspěšnost neuroprotekce byla prokázána při její kombinaci s trombolýzou (18). Synergické působení rekanalizační a neuroprotektivní léčby je očekávatelné. Trombolýzou rekanalizovaná tepna zajistí dodání neuroprotektiva do ischemické tkáně a na druhé straně neuroprotekce umožní oblasti s reziduální perfuzí dočkat se rekanalizace. Kombinovaná léčba má budoucnost, neboť by měla umožnit rychlejší a bezpečnější rekanalizaci a reperfuzi a prodloužit časové okno (19).
Koncept profylaktické neuroprotekce
Pozdní podání přípravku je hlavním důvodem selhání neuroprotekce v klinických studiích.
Studie na zvířatech potvrdily významně větší léčebný efekt při podání přípravku před vznikem ischémie (11). Toto zjištění není relevantní pro léčbu akutní iCMP, ale pro její prevenci a vedlo ke vzniku nového konceptu tzv. profylaktické neuroprotekce (20). Preventivní podání lze využít před rizikovými výkony, resp. u rizikových nemocných z pohledu vzniku mozkového infarktu. V současné době je prováděno mnoho invazivních výkonů, které jsou doprovázeny poměrně vysokou neurologickou morbiditou, za kterou zodpovídá zejména ischemické poškození mozku. Kardiologické a kardiochirurgické výkony, karotická endarterektomie a karotický stenting, mozkové cévní výkony (clipping a coiling aneuryzmat, embolizace arteriovenózní malformace), ale i samotná katetrizační angiografie jsou výkony, u kterých by použití krátkodobé profylaktické neuroprotekce mohlo přinést nemocným prospěch (20).
Ze střednědobého hlediska by vhodnými adepty preventivního podávání neuroprotekce byla podskupina nemocných po tranzitorní ischemické atace (TIA) s vysokým rizikem recidivy příhody. Využitím skórovacích systémů lze tyto nemocné poměrně spolehlivě označit (21–23).
Hovoří se i o podskupině, která by mohla profitovat s dlouhodobého podávání neuroprotektivních přípravků. Potenciálními kandidáty by byli nemocní s fibrilací síní, intrakraniální tepennou stenózou, symptomatickou stenózou krkavice konzervativně léčenou a nemocní s vysokým rizikem TIA. Dle přítomných rizikových faktorů lze rozpoznat nemocné s ročním rizikem iktu 5 % a více, u kterých by dlouhodobá neuroprotekce přinesla užitek. Hlavní podmínkou chronického užívání je, aby nežádoucí účinky léčby nepřevýšily její benefit (20). Pro dlouhodobou neuroprotekci jsou vhodné léky indikované pro léčbu jiného onemocnění, jejichž vedlejším účinkem je neuroprotektivní působení (beta blokátory III. generace, ACE inhibitory, antidiabetika, statiny). Očekávány jsou studie mající potvrdit efekt profylaktické neuroprotekce (20).
Závěr
Přes velké množství experimentálních prací prokazujících výrazně pozitivní efekt neuroprotekce u zvířecího modelu, klinické studie zatím selhávají. Dosud nebyl u žádného neuroprotektiva prokázán signifikantní léčebný efekt ve fázi III. klinického testování.
Velká část klinickch studií byla dokonce předčasně ukončena pro horší výsledky než u placeba nebo pro závažné nežádoucí účinky. Zarážející je, že všechny přípravky byly do klinických studií zařazeny na podkladě výrazně pozitivních výsledků preklinického testování. Přes panující pesimismus se objevují i některé slibné léčebné strategie. Optimální by byla kombinace přípravků, která by neměla vliv na účinnost trombolýzy a progresi eventuální hemoragie. Takový koktejl by bylo možné podat co nejdříve po vzniku potenciální mozkové ischémie ještě před přijetím do nemocnice a CT vyšetřením. Použití neuroprotekce v léčbě akutního mozkového infarktu dosud selhává, perspektivní se jeví její použití v oblasti prevence.
Zkratky
- ACE – angiotenzin konvertující enzym
- AMPA – alfa-amino-3-hydroxy-5-methyl-4-isoxazol propionate
- BI – Barthel index
- DNA – deoxyribonucleotid acid
- DWI – diffusion weighted imaging
- GABA – gama-aminobutyric acid
- HEB – hematoencefalická bariéra
- iCMP – ischemická cévní mozková příhoda
- MR – magnetická rezonance
- mRS – modified Rankin scale
- NIHSS – National Institutes of Health Stroke Scale
- NMDA – N-methyl-D-aspartate
- PWI – perfusion weighted imaging
- STAIR – Stroke Therapy Academic Industry Roundtable
- TIA – tranzitorní ischemická ataka
Adresa pro korespondenci:
MUDr. Jan Mraček
Neurochirurgické oddělení FN
Alej Svobody 80, 304 60 Plzeň
e-mail: mracek@fnplzen.cz
Zdroje
1. Ginsberg MD. Neuroprotection for ischemic stroke: past, present and future. Neuropharmacology 2008; 55(3): 363–389.
2. Ehler E. Cévní mozkové příhody – neuroprotektivní léčba. Neurol pro praxi 2001; 4 : 173–177.
3. Kalvach P, et al. Mozkové ischemie a hemoragie. Praha: Grada Publishing 2010.
4. Kalita Z, et al. Akutní cévní mozkové příhody. Praha: Maxdorf Jessenius 2006.
5. Fisher M. The ischemic penumbra: identification, evolution and treatment concepts. Cerebrovasc Dis 2004; 17(Suppl 1): 1–6.
6. Ginsberg MD. Current status of neuroprotection for cerebral ischemia: synoptic overview. Stroke 2009; 40 : 111–114.
7. Savitz SI, Fisher M. Future of neuroprotection for acute stroke: in the aftermath of the SAINT trials. Ann Neurol 2007; 61 : 396–402.
8. O’Collins VE, Macleod MR, Donnan GA, Horky LL, van der Worp BH, Howells DW. 1,026 experimental treatments in acute stroke. Ann Neurol 2006; 59 : 467–477.
9. Lees KR, Zivin JA, Ashwood T, Davalos A, Davis SM, Diener HC, et al. NXY–059 for acute ischemic stroke. N Engl J Med 2006; 354(6): 588–600.
10. Shuaib A, Lees KR, Lyden P, Grotta J, Davalos A, Davis SM, et al. NXY–059 for the treatment of acute ischemic stroke. N Engl J Med 2007; 357(6): 562–571.
11. Cheng YD, Al-Khoury L, Zivin JA. Neuroprotection for ischemic stroke: two decades of success and failure. NeuroRx 2004; 1 : 36–45.
12. Dewar D, Yam P, McCulloch J. Drug development for stroke: importance of protecting cerebral white matter. Eur J Pharmacol 1999; 375 : 47–50.
13. Demchuk AM, Buchan AM. Predictors of stroke outcome. Neurol Clin 2001; 18 : 455–473.
14. Labiche A, Grotta JC. Clinical trials for cytoprotection in stroke. NeuroRx 2004; 1 : 46–70.
15. Fisher M, Schaebitz W. An overview of acute stroke therapy. Arch Intern Med 2000; 27 : 3196–3205.
16. Ebisu T, Mori Y, Katsuta K. Neuroprotective effect of an immunosuppresant agent on diffusion/perfusion mismatch in transient focal ischemia. Magn Reson Med 2004; 51 : 1173–1180.
17. Furlan AJ, Eyding D, Albers WW. Dose escalation of Desmoteplase for Acute Ischemic Stroke (DEDAS): evidence of safety and efficacy 3 to 9 hours after stroke onset. Stroke 2006; 37 : 1227–1231.
18. Zivin JA, Mazzarella V. Tissue plasminogen activator plus glutamate antagonist improves outcome after embolic stroke. Arch Neurol 1991; 48 : 1235–1238.
19. Lyden PD, Lonzo L, Nunez S. Combination chemotherapy extends the therapeutic window to 60 after stroke. J Neurotrauma 1995; 12 : 223–230.
20. Savitz SI, Fisher M. Prophylactic neuroprotection. Current Drug Targets 2007; 8 : 846–849.
21. Wolf PA, D‘Agostino RB, Belanger AJ, Kannel WB. Stroke 1991; 22(3): 312–318. Probability of stroke: a risk profile from the Framingham Study.
22. Johnston SC, Gress DR, Browner WS, Sidney S. Short-term prognosis after emergency department diagnosis of TIA. JAMA 2000; 284(22): 2901–2906.
23. Rothwell PM, Giles MF, Flossmann E, Lovelock CE, Redgrave JN, Warlow CP, Mehta Z. A simple score (ABCD) to identify individuals at high early risk of stroke after transient ischaemic attack. Lancet 2005; 366(9479): 29–36.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Aktualizace doporučení GOLD pro farmakoterapii CHOPN z roku 2026
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
-
Všechny články tohoto čísla
- Lékaři primární zdravotní péče v České republice z pohledu demografie – současný stav jako základní kámen budoucího vývoje
- Buňky potní žlázy epidermis jen opravují nebo jsou konstatním zdrojem
- Úloha amfiregulinu
- Nádorové mikroprostředí ovlivňuje biologické vlastnosti nádorové buňky – nádor jako embryologický problém?
-
Vymětal J.
Úvod do psychoterapie. 3. aktualizované a doplněné vydání
Praha: Grada Publishing 2010, 287 s., cena 399 Kč. ISBN 978-80-247-2627-0. - Současný pohled na diagnostiku a léčbu nykturie
- Choroby obličiek a gravidita
- Minulost, současnost a budoucnost neuroprotekce
- Jak ovlivňuje kouření životní styl mladých mužů na počátku 21. století
- Alkohol u dětí a dospívajících – prevence a léčba
- MUDr. Celestýn Opitz
-
von Ungern-Sternberg BS, Boda K, Chambers NA, Rebmann C, Johnson C, Sly PD, Habre W.
Risk assessment for respiratory complications in paediatric anaesthesia: a prospective cohort study
Lancet 2010; 376(9743): 773–783. - Fuchsův večer – Těhotenství a porody za neobvyklých okolností
- Účinnost a riziko medikamentózní léčby otylosti
-
VIII. setkání zájemců o zobrazovací techniky
Český Krumlov, 3. a 4. září 2010 -
60. česko-slovenské Farmakologické dny
Hradec Králové, 15. až 17. září 2010 -
Podzimní konference nukleární medicíny
Praha, 30. září až 1. října 2010 -
3. svatoanenský laboratorní den – celostátní pracovní konference laboratorních oborů
Brno, 9. října 2010 -
XXII. kongres ČLS JEP
Brno, 20. októbra 2010 - VZPOMÍNKA na doc. MUDr. Václava Vlasáka, CSc.
- PLÁNOVANÉ AKCE ODBORNÝCH SLOŽEK ČLS JEP
- SLAVNOSTNÍ PŘEDÁNÍ CEN ZA NEJLEPŠÍ KNIŽNÍ A ČASOPISECKÉ PUBLIKACE za rok 2009
- Paulík K.: Psychologie lidské odolnosti
- Přemáháme bažení, zlepšujeme sebeovládání: informace těm, kteří překonávají návykovou nemoc
- FRANCIS PEYTON ROUS (1879–1970)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Choroby obličiek a gravidita
- Minulost, současnost a budoucnost neuroprotekce
- Alkohol u dětí a dospívajících – prevence a léčba
- Lékaři primární zdravotní péče v České republice z pohledu demografie – současný stav jako základní kámen budoucího vývoje
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



