-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAkutní diseminovaná encefalomyelitida
Acute disseminated encephalomyelitis (ADEM) – Case Report
Acute disseminated encephalomyelitis (ADEM) is an immune-mediated demyelinisation of the brain and spinal cord, precipitated by a infection or vaccination. In the past ADEM was a rare disease with higher incidence recently. Although history, clinical and radiological presentations are typical for this disease, the diagnosis is made per exclusionem. ADEM requiring ICU admission is a severe disease causing high mortality and persistent disability. Authors describe course of illness in one patient, diagnostic process a and therapy with corticosteroids, IVIG a plasmapheresis.
Key words:
acute disseminated encephalomyelitis – intensive care – corticoterapy – IVIG – plasmapheresis
Autoři: Dostálová Vlasta; Dostál Pavel; Černý Vladimír
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 4, s. 203-209
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Akutní diseminovaná encefalomyelitida (ADEM) je reaktivní autoimunní demyelinizace mozku a míchy po proběhlé infekci nebo po vakcinacích. Diagnóza je stanovena per exclusionem, ačkoli anamnestické, radiodiagnostické a klinické známky jsou pro toto onemocnění více či méně typické. Dosud byl výskyt ADEM raritní, v současné době se její incidence zvyšuje a ADEM s nutností přijetí na jednotky intenzivní péče je onemocnění s vysokou mortalitou a častou invalidizací pacientů.
Klíčová slova:
akutní diseminovaná encefalomyelitida – intenzivní péče – kortikoterapie – IVIG – plazmaferézaÚvod
Syndrom akutní diseminované encefalomyelitidy (ADEM) je akutně nebo subakutně probíhající autoimunní demyelinizace CNS, probíhající monofázicky. Podle IPMS (International pediatric multiple sclerosis study group) je definována jako multifokální, polysymptomatická a vždy s projevy encefalopatie [1]. Incidence je 0,4/100 000 a rok, u postvakcinační ADEM 0,1–0,2/100 000 a rok.
U varianty s relapsy hovoříme o multifázické diseminované encefalomyelitis (MDEM) [2].Procentuální zastoupení relapsu se pohybuje mezi 5–33 % pacientů (24 % [3]) u dospělé populace, zasahuje stejnou oblast CNS, jediným projevem však může být pouze psychiatrická symptomatologie [4]. Fatálně probíhající onemocnění je označováno jako akutní hemoragická leukoencefalomyelitida (AHLE – Weston-Hurst), ale dá se předpokládat, že se jedná o závažně probíhající ADEM (křeče, bezvědomí, nitrolební hypertenze, zvýšený počet lymfocytů, neutrofilů a erytrocytů v mozkomíšním moku) s vysokou mortalitou. Jako klinicky izolovaný syndrom (CIS) označujeme akutní zánětlivé onemocnění mozku, monofokální (izolovaná neuritida optiku) nebo multifokální bez encefalopatie [1]. ADEM historicky zahrnuje postinfekční, parainfekční encefalomyelitidu a postvakcinační encefalomyelitidu (tab. 1). V určitém procentu případů však nelze vlastní příčinu určit. ADEM se vyskytuje v každém věku, s maximem v dětství [4]; 80 % onemocnění se vyskytuje u dětí do 10 let, 20 % ve druhé dekádě života a 3 % nad 20 let života [5].
Tab. 1. Příčiny ADEM 
Vysvětlivky: HIV – human immunodeficiency virus, HTLV-1 – human T cell lymphotropic virus type 1, EBV – Ebstein-Barr virus, CMV – cytomegalovirus Postinfekční encefalitida má sezonní výskyt (maximum zima-jaro). Neurologické změny začínají s latencí 2–20 dnů od prvních příznaků akutního febrilního onemocnění typicky po zlepšení příznaků s ústupem horečky. U postinfekční ADEM byla definována maximální uvažovaná délka období latence na 30 dnů s ohledem na schopnost najít původce onemocnění. V dětském věku postihuje více muže, v dospělém naopak ženy. Infekční příčina je zjistitelná u 2/3 dětí, ale méně než 1/2 dospělých. U onemocnění s exantémem jsou klinické projevy ADEM do jednoho týdne od vyrážky. V současnosti je ADEM nejčastěji odpovědí na respirační nebo gastrointestinální infekční onemocnění.
Výskyt příznaků ADEM je typicky za 1–14 dnů po vakcinách neobsahujících neuronální tkáň a za 1–3 týdny nebo déle po očkování proti zarděnkám. Maximální perioda pro diagnostiku postvakcinační ADEM byla stanovena na 3 měsíce od vakcinace [7].
Provokace ADEM souvisí s genetickou nebo jiným způsobem imunitně podmíněnou predispozicí. Experimentální data považují přímou autoimunitní odpověď nebo sekundární imunitní odpověď na probíhající infekci za příčinu demyelinizace. Imunizace experimentálních zvířat podáním CNS homogenátu nebo peptidů myelinu vede k projevům monofázické nemoci s tetraplegií/parézou, hubnutím a inkontinencí. Histopatologicky jsou detekována ložiska demyelinizace v mozku a míše zvířat. Přímou inokulací virem myším je demyelinizace trigrována CD8+T buněčnou odpovědí proti virovému původci s tvorbou imunokomplexů. Za probíhající zánět je odpovědná CD4+T buněčná odpověď cílená na myelin. Některé typy postvakcinační ADEM jsou vyvolány kontaminací vakcín mozkovou tkání. Toto vysvětluje incidenci 0,15% výskytu ADEM po imunizaci proti vzteklině použitím Sempleovy vakcíny nebo po očkování proti japonské B encefalitidě [8]. U postvakcinační ADEM byly detekovány protilátky proti MBP (myelin basic protein).
Koncept přímého účinku neurotropního patogenu předpokládá tvorbu autoprotilátek nervovou tkání po přímé infekci CNS neurotropním patogenem ať již primárně, nebo sekundárně podmíněnou s následným zánětem, poškozením nervové tkáně a hematoencefalické bariéry a přechodem autoprotilátek do lymfatické tkáně s aktivací T buněčné odpovědi.
Koncept buněčných mimiker uvažuje podobnost sekvencí aminokyselin mezi inokulovaným patogenem a bílkovinou myelinu. Tato podobnost nedovolí rozlišit exogenního původce od vlastní tkáně imunotolerancí. Autoprotilátky tvořené B buňkami nebo mikroglií aktivují T buňky a po přechodu přes hematoencefalickou bariéru dochází k celkové imunitní odpovědi (T buňky-B buňky) s vcestováním do CNS a poškozením myelinu při nemožnosti detekovat rozdíl mezi patogenem a myelinem.
Klinický průběh
Rozlišujeme akutní (nástup neurologických příznaků do 24 hodin u 94 % onemocnění) a subakutní (neurologické projevy nastupují pozvolna, do 30 dnů) průběh ADEM. Jako typické příznaky jsou uváděny rychle nastupující (progrese v hodinách) bolest hlavy (45–65 %), horečka, klinické projevy encefalopatie, křeče (v 25 % případů) [5] a meningismus (20–30 %, vyskytuje se převážně u velmi malých dětí při závažném průběhu onemocnění). Vlastní neurologické projevy však souvisejí s lokalizací poškození CNS a mohou zahrnovat fokální nebo multifokální neurologické změny, symptomatologii poškození mozečku a až ve čtvrtině případů poruchy motoriky v důsledku poškození pyramidové dráhy s typickými projevy centrální neuropatie (bilaterální neuritida optiku – 10 až 30 %), porucha hlavových nervů (35–50 %), porucha hybnosti končetin typu monoparaparézy/plegie až kvadruparézy/plegie, kvalitativní a kvantitativní poruchy vědomí (porucha vědomí v 65–75 %) nebo projevy cervikální myelitidy. ADEM podmíněná transverzální myelitidou se projevuje jako zvýšení reflexů s výskytem klonu (někdy může dojít k náhlému a časově omezenému vymizení svalových reflexů jako důsledek transverzální myelitidy), retence moči, porušení funkce střev a močového měchýře. Psychiatrické změny zahrnují agitovanost, deprese, změny osobnosti a psychózu. Může být přítomna fatická porucha (10 %). Senzorická porucha se vyskytuje v 15–20 % případů více u dospělých pacientů (porucha zadních provazců míšních, hemisenzorická porucha čití). Až v 75 % případů je výrazná svalová slabost. Ataxie je přítomna v 35–60 % případů (nystagmus, generalizovaná ataxie), někdy mohou být přítomny extrapyramidové poruchy (choreoatetóza, dystonie). Prvními známkami ADEM je zvýšená dráždivost a letargie.
Většinu příznaků můžeme shrnout do sedmi klinických syndromů (tab. 2).
Tab. 2. Základní skupiny podle klinických syndromů 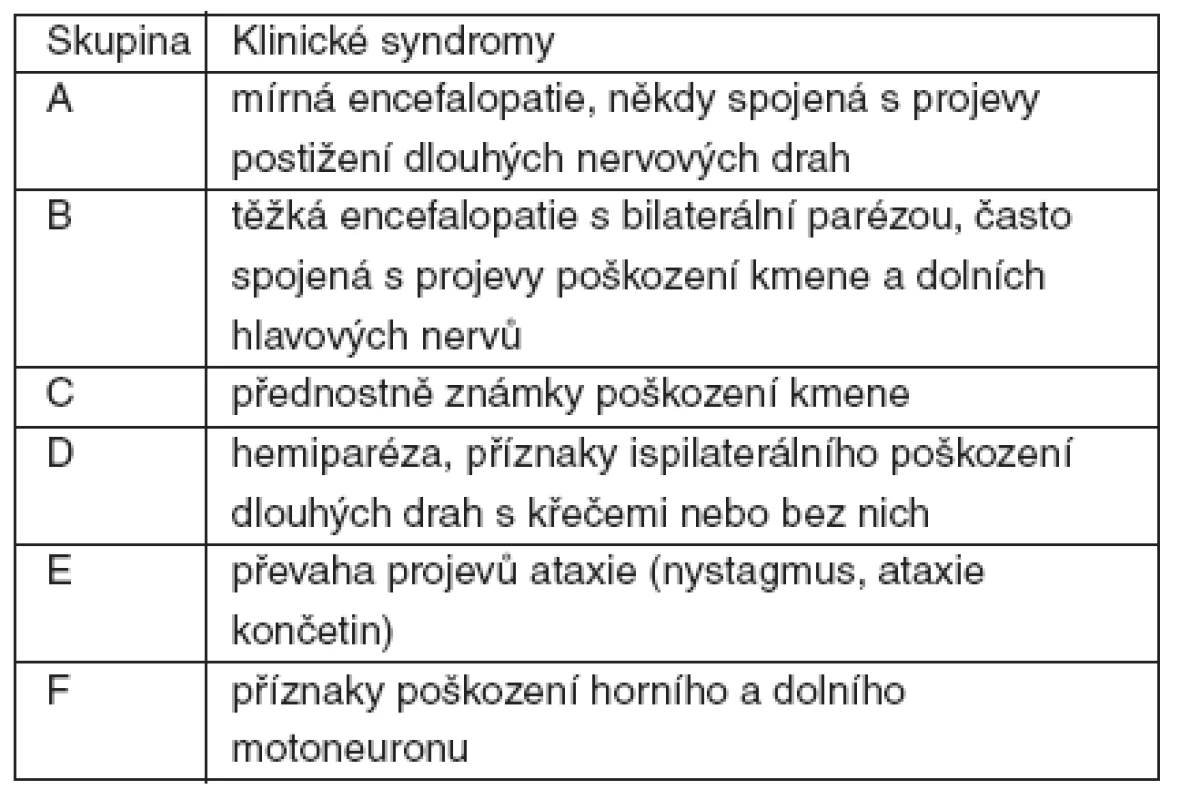
Některé onemocnění může probíhat fulminantně (častěji u dětí do 3 let) nebo atypicky, připomínající více akutní fázi MS. Některé nálezy na T2-vážených MRI mozku mohou být pokládány za akutní toxickou encefalopatii. Nález TU-like ložisek (skupina B) je nutno odlišit od abscesů nebo tumorů a metastáz CNS (zmenšení až vymizení ADEM ložisek při kortikoterapii).
Diagnostika
Diagnóza je stanovena na základě klinických polysymptomatických neurologických akutně nebo subakutně vzniklých deficitů, anamnézy proběhlé infekce nebo očkování a průkazu diseminovaných ložisek demyelinizace CNS na MRI, která se na rozdíl od MS v časovém průběhu nemění co do počtu a lokalizace, nerozšiřují co do rozsahu, ale naopak mizí. Vzhledem k tomu, že klinické a paraklinické testy nejsou úplně specifické pro diagnózu ADEM, konečná diagnóza je stanovena per exclusionem. K rozlišení MDEM od MS je vhodné použít Poserova nebo McDonaldova kritéria pro MS.
U dětí je často zvýšena hodnota trombocytů, je lehce zvýšená hodnota sedimentace, i když vysoké hodnoty sedimentace odpovídají častěji probíhající infekci nebo vaskulitidě. Hladina sérového albuminu je snížená u 87 % s ADEM, naopak hladina alfa-2 globulinu je zvýšená u 73 % pacientů s ADEM [9].
Lumbální punkce je významnou částí diagnostických metod k vyloučení dalších nemocí v rámci diferenciální diagnostiky (infekční meningoencefalitida). Pro ADEM je typická absence nálezu bakterií, virů nebo dalších patogenů. Z vyšetření mozkomíšního moku (MM) zjišťujeme zvýšenou hodnotu bílkoviny (albuminu), zejména prealbuminu [9], mírně zvýšenou hodnotu lymfocytů, u AHLE nález erytrocytů. Nález oligonálních IgG protilátek je většinou negativní (pozitivita u MS) nebo do 10 % případů (v dětství 0–29 % [15], v dospělosti 37–58 %[10]); pozitivita je však přechodná na rozdíl od MS nebo jiných neurodegenerativních a zánětlivých onemocnění. Zvýšená hodnota MBP a S-100 odpovídá probíhající demyelinizaci.
EEG prokazuje poruchy normálního spánkového rytmu, fokální nebo generalizovanou pomalou aktivitu, objevují se delta vlny nebo ostré vlny či hroty. Pomocí EMG může být prokázána v některých případech demyelinizační nebo axonální neuropatie (zpomalení rychlosti vedení a zvýšení latence distálně) [11].
CT vyšetření je většinou bez patologie nebo je popisován nález nespecifických drobných lézí v bílé hmotě subkortikálně, v případě akutní hemoragické leukoencefalomyelitidy je nález krvácení a edému mozku.
MRI patologický nález se objevuje obvykle za 5–14 dnů od prvních symptomů (počáteční MRI může být negativní) a zahrnuje výskyt multifokálních lézí v bílé hmotě mozku a mozečku (30–40 %), postihuje bazální ganglia (30–40 %), kmen (45–55 %), míchu, corpus calosum (20–25 %), thalamus (30–40 %) a hypothalamus. T1 vážené sekvence prokazují hypointenzity („černé díry“). V případě velkého rozsahu postižení je nezbytné vyloučit infekční komplikace CNS a malignitu (biopsií). T2 vážené sekvence prokazují hyperdenzní ložiska ve více než 80–90 % případů. ADC (apparent diffusion coefficient) mapy prokazují vazogenní nebo cytotoxický edém v místě zánětu. Kontrolní MRI je doporučován s odstupem 6 měsíců [7]. Kontrolní MRI prokazuje rezoluci lézí částečně nebo úplně a neprokazuje nové léze (na rozdíl od MS). Podle predilekce změn v CNS rozlišujeme 4 kategorie podle MRI (tab. 3).
Tab. 3. Klasifikace podle Tenembauma (2002) 
Biopsie mozku prokazuje typicky perivenulární zánět (B a T lymfocyty), probíhající v bílé i šedé hmotě mozku, s demyelinizací, perivenózním edémem, infiltrací makrofágy a lymfocyty a v časných stadiích vcestování polymorfonukleárních granulocytů, v případě akutní hemoragické leukoencefalomyelitidy s výskytem nekróz. Základem je postižení myelinové pochvy v místě extravazace bílých krvinek se zachováním axonu, dlouhodobý průběh onemocnění je typický nálezem hyperplazie astrocytů a perivaskulární gliózou [12]. Na rozdíl od MS jsou ložiska demyelinizace lokalizována pouze v perivaskulární oblasti, konfluentní demyelinizace tuto diagnózu vylučuje. Pro absenci histopatologické klasifikace řada odborníků však provedení diagnostické biopsie odmítá.
Terapie
Léčba s ohledem na nízkou incidenci onemocnění není standardizována a podložena řadou studií. Základní léčebná strategie je založena na podávání kortikoidů, při selhání této metody je zvažováno podání i. v. imunoglobulinů nebo plazmaferéza. Je doporučeno vynechat očkování po dobu minimálně 6 měsíců (vysoké riziko relapsu) [2]. Další léčba je symptomatická a zahrnuje orgánovou podporu a léčbu nitrolební hypertenze včetně neurochirurgické intervence [13]. Kortikosteroidy jsou léky první volby. I. v. metylprednisolon v dávce 10–20 mg . kg-1 denně, s maximální dávkou 1 g denně po dobu 3–5 dnů intravenózně, poté převedení na aplikaci per os (2 mg . kg-1, s maximální dávkou 80 mg denně), s postupným vysazováním kortikoterapie po dobu 3–5 (8) týdnů (někdy i déle v případě znovuobjevení se příznaků) k prevenci relapsu ADEM. Vysoké dávky kortikoidů (30–50 mg . kg-1) intravenózně lze teoreticky zvážit u pacientů s transverzální myelitidou a u těžkého průběhu ADEM u dětí pod 3 roky života. Plazmaferéza je zvažována při nízké odpovědi pacienta na kortikoterapii (7 plazmaferéz po dobu 14 dnů) a u fulminantní formy ADEM. Intravenózní imunoglobuliny (IVIG) jsou indikovány v případě nízké odpovědi na kortikoterapii u pacientů s motorickou dysfunkcí [14] a při kontraindikaci plazmaferézy v dávce 2 g . kg-1 intravenózně po dobu 2–5 dnů. Podání IVIG neutralizuje cirkulující protilátky proti myelinu, snižuje tvorbu prozánětlivých cytokinů, blokuje Fc receptory na povrchu makrofágů, reakci podmíněnou komplementem a může navodit remyelinizaci. Při zhoršování klinického stavu bez odezvy na výše uvedenou terapii je možno zvážit podání cyklofosfamidu nebo cyklosporinu. Při fulminantním průběhu bez reakce na kortikoidy je možno zvážit kombinaci kortikoterapie a IVIG (a cyklofosfamidu nebo cyklosporinu) nebo kombinaci kortikoterapie, IVIG a plazmaferézy [15]. Zda-li je zlepšování klinického stavu pacientů dáno použitou terapií nebo spontánní úpravou v čase, není dosud jednoznačně prokázáno.
Průběh
Relaps je definován jako zhoršení stávajícího neurologického deficitu nebo vznik nového symptomu nebo příznaku, trvajícího více než 24 hodin, a to za 2 měsíce od prvních projevů ADEM nebo v rozmezí 1 měsíc mezi recidivami. Symptomy a RDG nálezy odpovídají primární lokalizaci. Recidiva se může projevit izolovanými psychiatrickými (deprese, halucinace) nebo kognitivními symptomy. Po klinické i radiologické remisi zůstává postižená oblast „locus minoris resistentiae“ nebo místem subklinické aktivity s možností relapsu. K relapsu nejčastěji dochází v průběhu snižování dávky kortikosteroidů nebo krátce po ukončení kortikoterapie. V tomto případě hovoříme o multifázické diseminované encefalitidě (MDEM). Při recidivě onemocnění jsou lékem volby terapie kortikoidy v doporučené dávce jako při počátku onemocnění, vysazování kortikoidů je doporučeno po delší než doporučenou dobu. Déletrvající postupné vysazování kortikoidů je doporučeno také při závažném průběhu onemocnění. Pokud je současně s klinickými příznaky obraz nových ložisek v jiné než původní lokalizaci CNS v MRI obraze, je nutno pomýšlet na roztroušenou sklerózu (MS). Obdobně je pro MS typické výskyt relapsů za 6 měsíců od předchozích projevů nemoci, naopak u ADEM do 6 měsíců ve vazbě na vysazování/vysazení kortikoterapie.
Nejčastějšími komplikacemi ADEM jsou poruchy vidění, poruchy motorických funkcí (pyramidální, extrapyramidální, mozečkové poruchy) a poruchy vyprazdňování. Časté jsou změny nálady, osobnosti nebo jiné psychiatrické poruchy včetně psychóz. U pacientů s míšní lézí a bulbárním syndromem je vysoký předpoklad respiračního selhání s nutností umělé plicní ventilace. Časté jsou infekční komplikace (urosepse, pneumonie, katétrové sepse).
Onemocnění může probíhat týdny až měsíce. Akutní mortalita je nižší než 2% a postihuje především případy AHLE [5]. Výsledek pro proběhlé ADEM je závislý na tíži onemocnění a jeho průběhu. Průměrná doba do vyléčení je 6,5 měsíců, mortalita se liší v různých retrospektivních studiích, celková mortalita se udává do 5 % [7, 11]. V současné době se ukazuje častější výskyt ADEM v dětství po zavedení nových druhů očkovacích schémat [7] a ve vyšších věkových skupinách v důsledku cestování do oblastí, vynucujících si očkování proti tropickým onemocněním. Zároveň kazuistiky prokazují těžší průběh onemocnění u těchto skupin pacientů, s vyšší mortalitou než se předpokládalo, a to především u pacientů přijatých na jednotky intenzivní péče [6]. Mortalita na jednotkách intenzivní péče je udávána 25% [17]. Úplné vyléčení je u dětí v 83–90 % [18], úplného vyléčení u dospělých dosáhne pouze malé procento případů (15 %) [11], v ostatních případech je výsledkem onemocnění permanentní neurologický deficit (motorický, kognitivní, ztráta zraku, epilepsie, permanentní vegetativní stav). Horší prognóza je typická pro vyšší věk, souvisí přímo úměrně s hloubkou kvantitativní poruchy vědomí a výskytem křečí a absencí febrilií [16].Na druhou stranu může u dětí nastat úplná úprava stavu, i tehdy pokud bylo v počátku onemocnění přítomno bezvědomí, slepota a kvadruplegie. Různý stupeň poškození však přetrvává u dětí do 2 let věku, u pacientů s myelitidou a pacientů s edémem mozku nebo míchy; v těchto skupinách je i vysoká mortalita.
Predikce výsledku může být stanovena na základě provedené MRI s DWI (diffusion weighted imaging) a ADC (apparent diffusion coefficient) mapováním. Tato metoda umožňuje rozlišení mezi vazogenním (patologické vysoce signální intenzity) a cytotoxickým edémem (snížená hodnota ADC)nervových buněk. V případě průkazu cytotoxického edému neuronálních buněk je prognóza závažná [19].
Omezování rozsahu léčebné péče na jednotkách intenzivní péče u pacienta s ADEM v dlouhodobém bezvědomí je velmi diskutabilní při neznalosti prognózy konkrétního průběhu onemocnění. Následná péče zahrnuje rehabilitační léčbu při poruchách hybnosti, logopedickou léčbu při řečových poruchách, urologickou a gastroenterologickou péči při nedostatečné funkci močového měchýře a střeva.
Kazuistika
Předmětem kazuistiky je 26letý muž s několikaměsíční pracovní anamnézou expozice organickým rozpouštědlům (lepič parket), s anamnézou 6 měsíců trvající neléčené arteriální hypertenze, warfarinizovaná tromboflebitida dolních končetin po úrazu kolene. Dne 10. 2. 2008 u něj došlo k bolestivému otoku jazyka a výsevu bolestivých aftů v dutině ústní, provázenými mírnými dechovými obtížemi, později zimnice, třesavky a febrilie 38 °C. Pacient byl přijatý na interní oddělení pro podezření z alergické reakce na ovocný džus, stav byla uzavřen jako virová faryngitida a 11. 2. byl propuštěn do domácího ošetřování. Pro další nárůst teplot, bolest při polykání, mluvení a otvírání úst byl nasazen cefuroxim a 15. 2. byl přijat na ORL oddělení. Dne 18. 2. se nově objevily bolesti hlavy, závratě a opakované zvracení, levostranná neocerebelární symptomatika, pravostranná pyramidová iritace. CT vyšetření bylo negativní. Bylo zahájeno podávání cefotaximu a pro rozvoj neurologické symptomatologie při podezření na virovou herpetickou encefalitidu byl nasazen aciclovir. Pacient byl přeložen na infekční kliniku, kde progredoval neurologický nález – insuficience postranního smíšeného systému, dysartrie, porucha polykání, asymetrie očních štěrbin, pokles pravého koutku, vertikální nystagmus, léze n XII. vlevo a postranního smíšeného systému vpravo. Byl afebrilní, laboratorně byla zjištěna pouze mírná leukocytóza. Pro rozvoj akutní respirační insuficience byl pacient intubován a řízeně ventilován. Bylo provedeno MRI vyšetření s nálezem na T2 i FLAIR skenech mnohočetných hyperintenzních ložisek s maximem v bazálních gangliích, subkortikálně i intrakortikálně, objemné ložisko o velikosti 3 cm patrno v mozkovém kmeni (v oblongátě, pontu, při IV. komoře) a pedunkulech mozečku (obr. 1). Dne 19. 2. bylo zahájeno podávání i. v. imunoglobulinů v dávce 30 g denně (0,4 g . kg-1denně), od 21. 2 v kombinaci s kortikoidy 1 g denně po dobu 5 dnů, s postupným vysazováním 12 dnů, od 28. 2. pro trvající areflektorické kóma v kombinaci se sérií plazmaferéz (5krát). Dne 20. 2. provedena lumbální punkce s nálezem mírné pleocytózy (29 lymfocytů, 3 segmenty) a negativitou vyšetření mozkomíšního moku na infekci CNS HSV1,2, CMV, EBV, VZV, borelie, listerie, enterovirus (vše metodou PCR). Od 29. 2. dochází ke zlepšení kvantity vědomí (spontánní otevírání očí, pohyb na horních končetinách na algický podnět), neurologicky trvá vícečetné postižení hlavových nervů (n. VI, postranní smíšený systém), paraparéza na horních končetinách, paraplegie na dolních končetinách, nystagmus. Od 12. 3. se obnovuje spontánní dechová aktivita s možností zahájení odpojování od ventilátoru. Od 16. 3. dochází k vyhovění výzvě stiskem ruky. Dne 18. 3. je potvrzena mírná regrese nálezu na MRI bez nálezu nových ložisek. Postupně se objevuje třes končetin, zvýrazňující se při námaze, který ve spánku mizí. Pacient je trvale podpůrně ventilovaný, přetrvává absence polykacího a kašlacího reflexu, nystagmus, ataxie. Pacient je v současné době stále hospitalizován na anesteziologicko-resuscitačním oddělení.
Obr. 1. MRI mozku – flair skeny 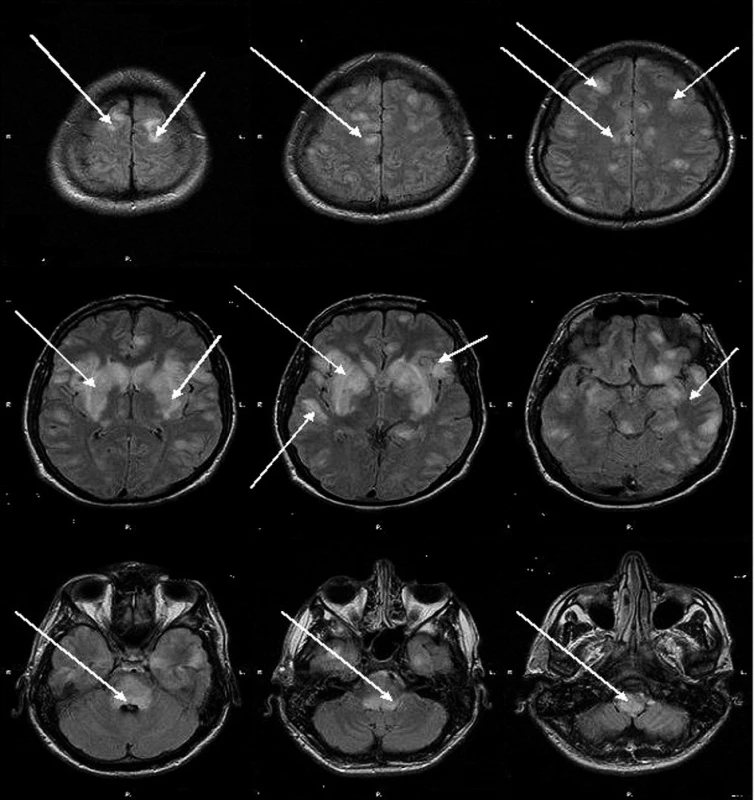
Prokázána mnohočetná hyperintenzní ložiska s maximem v bazálních gangliích, subkortikálně i intrakortikálně, objemné ložisko o velikosti 3 cm patrno v mozkovém kmeni (v oblongátě, pontu, při IV. komoře) a pedunkulech mozečku.
Diskuse
Diagnóza akutní diseminované encefalomyelitida je stanovena na základě anamnestických, klinických a radiografických vyšetření, ale především per exclusionem ostatních příčin akutní encefalitidy/encefalopatie (tab. 4). Infekční původ onemocnění byl vyloučen vyšetřením mozkomíšního moku metodou PCR, akutně probíhající vyšetření infekční etiologie nebylo podloženo nálezem zánětlivých markerů ani detekcí infekčního ložiska. Akutní vznik neurologické symptomatologie vyloučilo chronické neurodegenerativní onemocnění, CT vyšetření krvácení do CNS. Bylo vyloučeno onkologické onemocnění. Proti akutní MS svědčí opakovaný nález na MRI nálezu stejně starých ložisek s postupnou regresí v čase bez novotvoření jiných ložisek. V úvahu připadá toxická encefalitida z důvodu pracovní anamnézy s expozicí organickým rozpouštědlům po dobu několika měsíců bez použití ochranných pomůcek. V tomto případě expozice toxinům vede také k tvorbě protilátek proti CNS. Organická rozpouštědla jsou velmi rychle distribuována vstřebáním nosní sliznicí do mozku, kde se koncentrují v oblastech lipidových struktur, především myelinu. Hlavním místem destrukce je myelin a buněčné membrány neuronů. Významnou funkci hraje porucha detoxikační funkce s tvorbou volných radikálů, lipidových peroxidů. Výsledkem je apoptóza neuronů. Neurologický nález toxické encefalitidy je typický multifokální symptomatologií – poruchou vědomí, výskytem křečí, centrální symptomatologií podle lokalizace poškození, cerebelární ataxií, optickou neuropatií, encefalopatií a periferními neuropatiemi [20]. Akutní intoxikace organickým rozpouštědlům vedou k projevům akutní encefalopatie s poruchou vědomí, výskytem křečí, halucinacemi, zvýšenou dráždivostí, poruchou řeči, bolestí hlavy, paresteziemi, poruchou koncentrace a koordinace. Častá je ztráta sluchu a zraku. Porucha paměti a koordinace je vysvětlována poškozením neuronů s neurotransmitery acetylcholinem a dopaminem, kdy relativně malé množství destruovaných neuronů vyvolá výrazné neurologické změny. MRI nález je typický symetrickými periventrikulárně uloženými hyperintenzními ložisky na T2 MRI a hypointenzitami v bazálních gangliích [21, 22] a thalamu (v důsledku ukládání železa).
Tab. 4. Diferenciální diagnostika 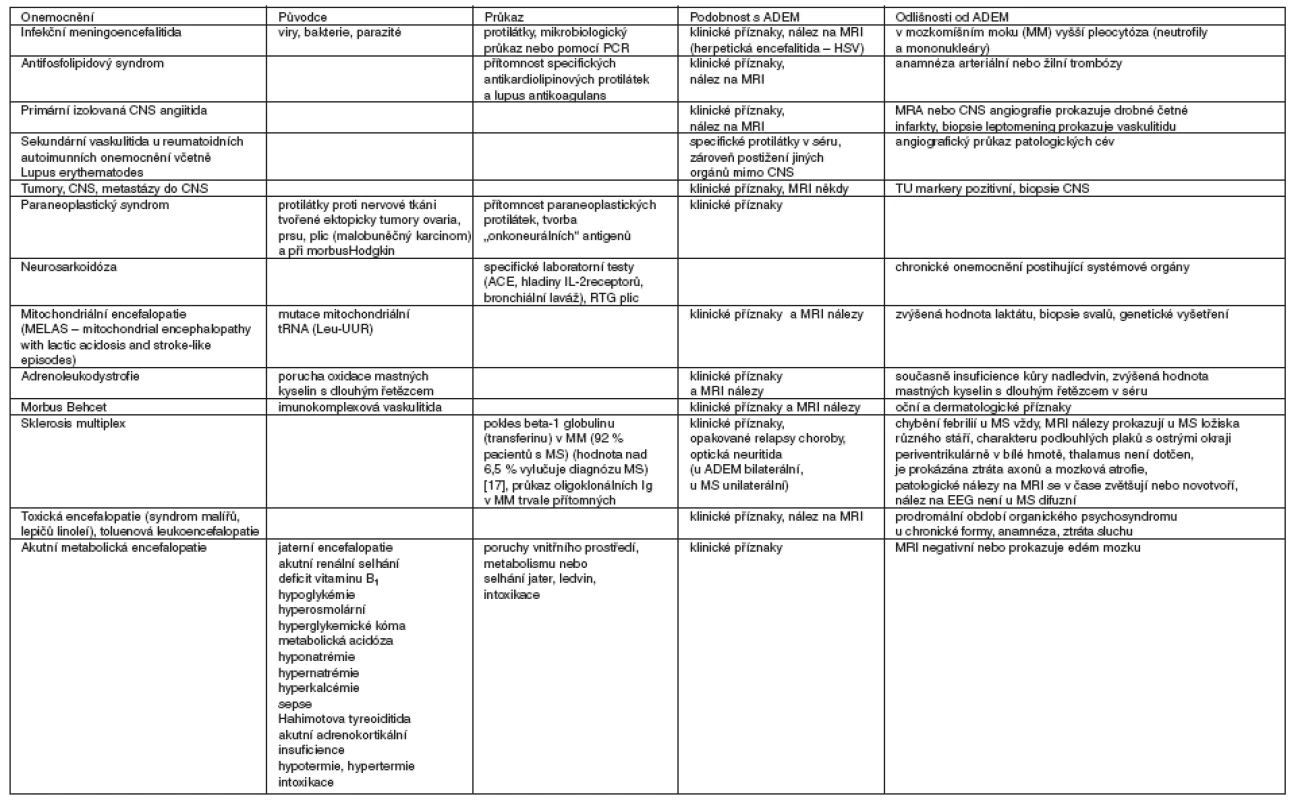
Vysvětlivky: MM – mozkomíšní mok, MS – sklerosis multiplex, HSV – herpes simplex virus, IL – interleukin, PCR – polymerase chain reaction, Leu (UUR) – mitochondriální gen pro tRNA (transfer ribonucleic acid), ACE – angiotensin konvertující enzym, MRA – MR angiografie, CNS – centrální nervový systém, MRI – magnetic resonance imaging Ačkoli je podobnost s postinfekční ADEM velmi výrazná, přesto odlišnost na MRI (nález hyperintenzních ložisek v bazálních gangliích) se velmi liší od typického nálezu hypointenzit bazálních ganglií u toxické encefalitidy. Domníváme se však, že expozice organickým rozpouštědlům by mohla být trigerujícím momentem pro vznik ADEM.
Průběh onemocnění, popsaný v naší kazuistice, se shoduje s literárními údaji o ADEM. Vznik v zimních-jarních měsících s latencí 2–20 dnů v případě postinfekční etiologie, respektive do týdne od výsevu exantému a poklesem febrilií v době vzniku neurologických příznaků je typický pro toto onemocnění. Akutní nástup neurologické symptomatologie s rychlou progresí a typický nález na MRI T2 vážených sekvencí podporuje diagnózu ADEM. Všechna ložiska vznikla ve stejném čase a při kontrolním MRI za měsíc od prvních neurologických příznaků je možno sledovat regresi nálezu na MRI. Neurologické projevy můžeme zahrnout do skupiny B – těžká encefalopatie s bilaterální parézou, spojená s projevy poškození kmene a dolními hlavovými nervy. V našem případě jde o fulminantně probíhající onemocnění s měsíc trvajícím hlubokým bezvědomím, areflexií a kvadrupostižením s nutností umělé plicní ventilace. Z tohoto důvodu byla použita kombinace léčby kortikoidy, IVIG a plazmaferézou při absenci odpovědi na doporučovanou kortikoterapii. Ačkoli dochází k postupnému lepšení klinického nálezu a kvantity vědomí, prognóza pacienta zůstává i nadále nejistá.
Závěr
Ačkoli je ADEM považováno stále za raritní onemocnění s nízkou incidencí v populaci, s ohledem na měnící se styl života (očkování, neléčená infekční onemocnění) a profesionální zátěž je nezbytné s touto diagnózou stále více počítat. Diagnostické a léčebné rozpaky při malém kontaktu s touto nozologickou jednotkou by měly vést k zavedení jednotných klasifikací a terapeutických schémat. Dlouhotrvající průběh onemocnění s přetrvávajícím bezvědomím a kvadrupostižením neumožňuje stanovit prognózu pacientů v časných fázích nemoci. Vysoké procento permanentního neurologického postižení varuje před optimismem, především při kontaktu s rodinnými příslušníky.
Došlo 12. 5. 2008.
Přijato 13. 6. 2008.
Adresa pro korespondenci:
MUDr. Vlasta Dostálová
Fakultní nemocnice Hradec Králové
Sokolská 581
Hradec Králové 500 05
e-mail: dostalova.vlasta@fnhk.cz
Zdroje
1. Tenembaum, S. et al. International Pediatric MS Study Group. Acute disseminated encephalomyelitis. Neurology, 2007, 68, 16, p. 23–36.
2. Dale, R. C. et al. Early relapse risk after a first CNS inflammatory demyelination episode: examining international consensus definitions. Dev. Med. Child Neurol., 2007, 49, 12, p. 887–893.
3. Cohen, O. et al. Recurrence of acute disseminated encephalomyelitis at the previously affected brain site. Arch. Neurol., 2001, 58, 5, p. 797–801.
4. Bennetto, L. et al. Encephalomyelitis inflammatory/post-infectious. J. Neurol. Neurosurg. Psychiatry, 2004, 75, p. 22–28. Dostupné na: http://jnnp.bmj.com/cgi/content/full/ 75/suppl_ 1/i22.
5. Menge, T. et al. Acute disseminated encephalomyelitis: an acute hit against the brain. Curr. Opin. Neurol., 2007, 20, 3, p. 247–254.
6. Robert, R. et al. Acute Disseminated Encephalomyelitis. Article Last Updated, 2007, 12 doi:10.1136/jnnp.2004.045500
7. Menge, T. et al. Acute Disseminated Encephalomyelitis. An Update. Arch. Neurol., 2005, 62, p. 1673–1680.
8. Plesner, A. M. et al. Neurological complications to vaccination against Japanese encephalitis. Eur. J. Neurol., 1998, 5, p. 479–485.
9. Chopra, B. et al. CSF Beta-1 Globulin – A Potential Marker in Differentiating Multiple Sclerosis and Acute Disseminated Encephalomyelitis: A Preliminary Study. Code Number: ni02011. Dostupné na: http://www.neurologyindia.com
10. Schwarz, S. et al. Acute disseminated encephalomyelitis: a follow-up study of 40 adult patients. Neurology, 2001, 56, p.1313–1318.
11. Maramattom, B. V. et al. Clinical features and outcome of acute disseminated encephalomyelitis (ADEM): An outlook from South India. Ann. Indian. Acad. Neurol., 2006, 9, p. 20–24. Dostupné na: http://www.annalsofian.org/text.asp? 2006/9/1/20/22817
12. Rossi, A. Imaging of acute disseminated encephalomyelitis. Neuroimaging Clin. N. Am., 2008, 18, 1, p. 149–161.
13. Sekula, R. F. et al. Central brain herniation secondary to fulminant acute disseminated encephalomyelitis: implications for neurosurgical management. Case report. J. Neurosurg., 2006, 105, 3, p. 472–474.
14. Ravaglia, S. et al. Severe steroid-resistant post-infectious encephalomyelitis: general features and effects of IVIg. J. Neurol., 2007, 254, 11, p. 1518–1523.
15. Lu, R. P. et al. Combination regimen of methylprednisolone, IV immunoglobulin, and plasmapheresis early in the treatment of acute disseminated encephalomyelitis. J. Clin. Apher., 2006, 21, 4, p. 260–265.
16. Lin, CH. et al. Acute disseminated encephalomyelitis: a follow-up study in Taiwan. J. Neurol. Neurosurg. Psychiatry, 2007, 78, 2, p. 162–167.
17. Sonneville, R. et al. Acute disseminated encephalomyelitis in the intensive care unit: clinical features and outcome of 20 adults. Intensive Care Med., 2008, 34, 3, p. 528–532.
18. Tenembaum, S. et al. Acute disseminated encephalomyelitis: a long-term follow-up study of 84 pediatric patients. Neurology, 2002, 59, p. 1224–31.
19. Axer, H. et al. Initial DWI and ADC imaging may predict outcome in acute disseminated encephalomyelitis: report of two cases of brain stem encephalitis. J. Neurol. Neurosurg. Psychiatry, 2005, 76, p. 996–998. Dostupné na: http://jnnp.bmj.com/cgi/content/full/76/7/996.
20. Rutchik, J. S. et al. Neurologic issues with solvents. Clin. Occup. Environ. Med., 2004, 4, 4, p. 621–656.
21. Matsuoka, M. Neurotoxicity of organic solvents—recent findings. Brain Nerve, 2007, 59, 6, p. 591–596.
22. Thuomas, K. A. et al. MR imaging in solvent-induced chronic toxic encephalopathy. Acta Radiol., 1996, 37, 2, p. 177–179.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Stala se chyba a jak dál?Článek Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermiíČlánek Vzdělávací akce IPVZČlánek Vzdělávací akce IPVZČlánek Konference a kongresyČlánek Zdroje na www.csarim.czČlánek Výborová schůze ČSARIMČlánek In memoriam Peter BaskettČlánek UEMS
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2008 Číslo 4- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Aceklofenak v léčbě muskuloskeletálních onemocnění – srovnání s dalšími NSAIDs z hlediska účinnosti a bezpečnosti
- Metamizol a jeho pozice v léčbě bolesti
- Prokalcitonin: marker vhodný pro diagnostiku sepse i hodnocení antimikrobiální léčby
- Neodolpasse − účinné kombinované analgetikum s velmi dobrým bezpečnostním profilem
-
Všechny články tohoto čísla
- Šance na postup do elitního klubu – nastal čas na změnu a co pro to musíme udělat?
- Déjà vu, mais pas en anglais aneb jak podpořit náš časopis a zachovat publikační etiku
- Stala se chyba a jak dál?
- Poslední halotanová hepatitida v České republice?
- Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermií
- Vzdělávací akce IPVZ
- Akútna intoxikácia teofylínom
- Vzdělávací akce IPVZ
- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Léčba akutního srdečního selhání – přehled
- Počátky anesteziologie na ORL klinice LF UK v Plzni
- Minářovy dny – MUDr. Jiří Minář, CSc.*
- Předběžná statistická data oboru Anesteziologie a resuscitace, Česká republika za rok 2007
- Konference a kongresy
- Nový výukový internetový portál www.akutne.cz
- Novinky v intenzivní medicíně 2007
- Identifikační a slevové karty pro všechny členy ČLS JEP
- Zdroje na www.csarim.cz
- Doporučené postupy a stanoviska ČSARIM na www.csarim.cz
- Výborová schůze ČSARIM
- Informace pro členy společnosti
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- In memoriam Peter Baskett
- Zápis z jednání výboru 2/2008
- Zápis z jednání výboru 3/2008
- European Board of Intensive Care Medicine Meeting Minutes
- UEMS
- Za prim. MUDr. Oldřichem Markem, Ph.D.
- MUDr. Oldřich Marek, Ph.D., in memoriam
- Poslední vzpomínka na prim. MUDr. Oldřicha Marka, Ph.D.
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- Akútna intoxikácia teofylínom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



