-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaFyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
Vitamin C and its physiological role with respect to the components of the immune system
Vitamin C is a water soluble micronutrient commonly found in our diet which orchestrates the function of both innate and adaptive immune system, influencing both cellular and humoral immune responses. Vitamin C inhibits excessive activation of the immune system to prevent tissue damage, but also supports antibacterial activity, stimulates NK cells and differentiation of Th0 subset into Th1 characterized by interferon γ production. In addition, vitamin C interferes with the synthesis of proinflammatory cytokines, or with the expression of adhesive molecules. Moreover, vitamin C as an antioxidat protects the immune cells against intracellular ROS (reactive oxygen species) formed in the inflammatory response. Vitamin C as an enzymatic cofactor is extremely important in maintaining tissue integrity, and plays a crucial role in formation of skin, epithelial and endothelial barriers.
Key words:
vitamin C – immune system – ROS (reactive oxygen species) – RNS (reactive nitrogen species)
Autoři: D. Holmannová; M. Koláčková; J. Krejsek
Působiště autorů: Ústav klinické imunologie a alergologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc.
Vyšlo v časopise: Vnitř Lék 2012; 58(10): 743-749
Kategorie: Přehledné referáty
Souhrn
Vitamin C je ve vodě rozpustný běžně se v potravě nalézající mikronutrient. Je schopen harmonizovat funkce vrozené i adaptivní imunity, a to jak buněčné, tak humorální složky. Vitamin C dokáže tlumit nadměrnou aktivaci imunitního systému, a tím ochránit tkáně před poškozením, ale také dokáže zajistit dostatečnou ochranu proti mikroorganizmům. Stimuluje funkce NK buněk i diferenciaci subsetu Th0 do subsetu Th1, který je významným producentem interferonu γ. Navíc zasahuje do syntézy prozánětových cytokinů a exprese adhezních molekul. Je antioxidantem ochraňujícím buňky imunitního systému proti intracelulárním ROS (volné kyslíkové radikály) tvořícím se v průběhu zánětu. Jako kofaktor mnoha enzymů se zásadně podílí na udržení kožní i epitelové integrity a podpoře bariérových funkcí.
Klíčová slova:
vitamin C – imunitní systém – ROS (volné kyslíkové radikály) – RNS (volné dusíkové radikály)Vitamin C a význam pro člověka
Vitamin C je ve vodě rozpustné jednoelektronové redukční činidlo, v literatuře je označován jako vychytávač – scavanger reaktivních volných radikálů kyslíkových i dusíkových. Vitamin C je multifunkční faktor, který je zapojen do mnoha biologických pochodů. Zlepšuje metabolizmus železa – jeho vstřebávání i mobilizaci ze zásob. Je kofaktor pro demetylaci histonů a nukleových kyselin, stejně tak je kofaktor mnoha enzymů zapojených např. do syntézy kolagenu. Hraje dominantní roli v prevenci lipoperoxidace, při níž dochází ke vzniku lipidových radikálů, lipoperoxidů a aldehydů, jež poškozují membránové struktury, tudíž i integritu buňky, a iniciují zánětlivé a degenerativní stavy. Podporuje správnou funkci mitochondrií a jejich energetický metabolizmus. Zasahuje do metabolizmu kyseliny listové, tyrozinu, cholesterolu, kdy napomáhá jeho eliminaci a transformaci na žlučové kyseliny. Má své místo i v kostním metabolizmu, ochraňuje spermie před oxidací, snižuje hladinu CRP, snižuje riziko vzniku makulární degenerace, glaukomu a dalších patologií. Tento článek se bude dále věnovat vitaminu C a imunitnímu systému.
Vitamin C a bariérové funkce
Vitamin C podporuje funkci imunitního systému jako celku, tedy jeho vrozenou i získanou část, a to jak buněčnou, tak protilátkovou [1,2]. Součástí vrozené imunity je i pokožka, která má bariérovou funkci. Je nepřetržitě vystavena vnějším vlivům chemickým, UV záření, poraněním, které urychlují stárnutí, atrofizaci kůže, a tím oslabují její ochrannou funkci. Vitamin C naopak zlepšuje stav pokožky, její odolnost, pružnost i regeneraci po zranění [3,4]. To je dáno hlavně vlivem vitaminu C na fibroblasty. Podporuje jejich aktivaci, proliferaci, migraci i funkci, stejně tak syntézu kolagenu IV a VII, elastinu, lamininu a jejich hydroxylaci, ale také chrání a reparuje jejich DNA při poškození ROS [5]. Objasnění významu vitaminu C na stav pokožky bylo zkoumáno na myších s vyřazeným genem kódujícím SOD –/– (Superoxide Dismutase). U nich se velmi snadno vyvine atrofie kožního krytu se ztrátou kolagenních a elastinových vláken. Po transdermálním podání vitaminu C došlo ke zlepšení stavu kůže, zvýšila se tvorba kolagenu i elastinu [6]. V případě poranění kůže je důležité zajistit migraci fibroblastů. Vitamin C zvyšuje adhezivitu fibroblastů ke složkám extracelulární matrix a jejich vycestování do místa poškození. Společně se zvýšením jejich aktivity tak urychlí hojení ran, jejich uzavření, kontrakci, což zabrání mikrobiální kontaminaci [7]. Další efekt vitaminu C na pokožku je podpora epidermální maturace, včetně posílení bazální membrány. Tím je zajištěna pevnost a odolnost kůže. Vitamin C ochraňuje i epitely a endotel, které také plní bariérové funkce. Jedním z ochranných mechanizmů je snížení buněčné exprese VEGF (Vascular Endothelial Growth Factor) po stimulaci cílových buněk, přičemž neovlivňuje jeho bazální expresi. Podobná situace je i u receptoru VEGF-R. Při oxidačním stresu je zesílena tvorba VEGF a exprese jeho receptoru. VEGF ovlivňuje mnoho pochodů, nejvíce je však odpovědný za novotvorbu cév, ale také zvyšuje cévní permeabilitu, čímž napomáhá prostupu leukocytů do extravaskulárního prostoru. Po suplementaci vitaminem C a E hladina VEGF nevzrůstá ani v přítomnosti faktorů, které jeho expresi zvyšují, např. hypoxie, IL-1β, a nedochází tak ke zvýšení propustnosti a endotel zůstává „kompaktní“ [8]. Ochrana povrchů, zvláště endotelu, zahrnuje i rovnováhu v tvorbě NO (Nitric Oxide). Vitamin C udržuje stabilní hladinu NO. NO je tvořen z L-argininu pomocí NOS (Nitric Oxide Synthase) a tetrahydrobiopterinu (BH4) [9]. Vitamin C stabilizuje BH4. Stabilitu BH4 narušují ROS, které aktivují NADPH oxidázu, což je provázeno zvýšenou tvorbou H2O2 a následnou oxidací BH4. Vitamin C vychytává singletový kyslík, čímž brání jeho reakci s NO. V případě, že by singletový kyslík reagoval s NO, došlo by k vytvoření nitritů, peroxynitritů, které se souhrnně nazývají dusíkovými radikály RNS (Reactive Nitrogen Species) a mají podobný poškozující efekt na tkáně jako ROS [10,11]. Důležitost rovnováhy v tvorbě NO je dána skutečností, že přítomnost NO reguluje vaskulární tonus a udržuje stěnu nepřilnavou pro v krvi cirkulující buňky. V jeho přítomnosti se nezvyšuje aktivita bazální eNOS, která je konstitučně exprimována endotelovými buňkami. eNOS je zvýšeně stimulována v přítomnosti zvýšené hladiny VEGF, H2O2 a zvýšené koncentrace Ca2+. Pokud je NO nedostatek, ať už z důvodu narušení jeho tvorby, alterací funkce BH4 nebo jeho přeměnou na RNS, je aktivována iNOS, jejíž expresi je možné detekovat v mnoha typech tělesných buněk – epitelových, myeloidních, chondrocytech, buňkách hladké svaloviny cévní stěny aj. Aktivita iNOS se zvyšuje také při stresových stavech, poškození, zánětu. V těchto případech je to hlavně zvýšená aktivita iNOS v imunokompetentních buňkách [12]. Zvýšená aktivita iNOS a hladina NO je často zachycena u psoriázy, kolorektálního karcinomu a dalších nemocí spojených se zánětovou reakcí. Vzrůstající hladina NO je provázena zvýšenou tvorbu peroxinitritů a ostatních RNS podílejících se na poškozující zánětové reakci [13].
Vitamin C a kolagen
Co se samotného kolagenu týká, je jeho syntéza závislá na vitaminu C. Syntéza kolagenu je nejvíce potencována TGF-β1, který je produkován mnoha typy buněk – fibroblasty, buňkami imunitního systému, endotelovými buňkami, trombocyty aj. [14].
Syntéza začíná na ribozomech navázaných na membráně drsného endoplazmatického retikula. V endoplazmatickém retikulu prochází posttranslační změnou, díky níž získává prostorové uspořádání v podobě triplhelixu. Té předchází i hydroxylace prolinových zbytků. Enzymem odpovědným za tuto hydroxylaci je prolyl 4-hydroxyláza a jejím kofaktorem je vitamin C. Hydroxylace umožní konformační změnu, zpevní molekulu, a zvýší tím i její termostabilitu. Pouze molekula, která prošla hydroxylací, je dále transportována do Golgiho aparátu a následně do extracelulárního prostoru [15]. Pokud chybí vitamin C, dochází k akumulaci prokolagenu v endoplazmatickém retikulu. Pokusy ukázaly, že pokud není buněčné kultuře dodáván vitamin C, sníží se sekrece kolagenu až o 75 % [16].
Extracelulární posttranslační modifikace molekuly kolagenu zahrnuje hydroxylaci lysylových zbytků za vzniku hydroxylysylu, který je potřebný k formaci a stabilizaci kolagenu, a oxidaci hydroxylysylu lysyl oxidázou, což zajišťuje tvorbu příčných můstků – zesíťování mezi kolagenem a elastinem.
Oba tyto enzymy vitamin C ovlivňuje. Lysyl hydroxylázovou aktivitu povzbuzuje a lysyl oxidázovou tlumí. Zvýšenou aktivitu lysyl oxidázy provází nadměrná tvorba příčných můstků mezi kolagenem a elastinem, tuhost vzniklého pojiva i patologickou fibrotizaci [17].
Vitamin C se neúčastní syntézy kolagenu jen v posttranslačních dějích, ale je prokázáno, že zvyšuje expresi mRNA pro kolagen [18].
Krom přímého účinku může vitamin C ovlivňovat imunitní systém přes kolagen. Imunitní buňky exprimují celou řadu kolagenních receptorů. Mezi nejznámější patří integrinové receptory VLA-1 (α1β1) a VLA-2 (α2β1), které napomáhají migraci buněk do místa poškození. Zvýšenou expresi VLA-1 zaznamenáváme u autoimunitních chorob – např. u T-lymfocytů infiltrujících synoviální membránu u revmatoidní artritidy. Vazba leukocytu na kolagenní strukturu pomocí VLA-1 může vést k poškození struktury nesoucí kolagen – epitelu, endotelu aj.
Další receptor, ale zdaleka ne ve výčtu kolagenových receptorů poslední, je inhibiční receptor LAIR-1 exprimovaný na leukocytech. Reguluje cytolytické funkce NK buněk, T-lymfocytů, moduluje cytokinovou produkci – snižuje IL-2 a IFN-γ produkci, naopak indukuje syntézu TGF-β1. Snižuje i syntézu IgG a IgE B-lymfocyty aj. Vazba LAIR-1 a kolagenu může zabránit i degranulaci bazofilů aktivovaných pomocí vazby IgE – FcεR. Blokováním tohoto receptoru dochází k rozvoji chronických zánětů a autoimunitních nemocí [19].
Vitamin C tedy kontroluje nejen syntézu kolagenu – zvyšuje aktivitu mRNA pro kolagen, posttranslační modifikaci, tlumí aktivitu lysyl hydroxylázy, ale prostřednictvím ní a vzniklého kolagenu i imunitní systém.
Vitamin C a dendritické buňky
Dendritické buňky (DC), které jsou modulátory vrozené i adaptivní imunity, jsou aktivovány hlavně signální cestou spojenou s aktivací transkripčního faktoru NF-κB (Nuclear Factor κ B) [20,21]. Výrazným spouštěčem této signalizační kaskády jsou ROS, jež jsou rozpoznávány jako endogenní nebezpečné vzory. Vitamin C blokuje jednotlivé komponenty signální kaskády, a zabraňuje tak aktivaci NF-κB. Ta je závislá na IKK (IκB kináza), která je aktivovaná především v přítomnosti TNFα a H2O2. NF-κB se nalézá v buněčném cytosolu a tvoří nefunkční komplex s IκBα. Podjednotka IκBα je fosforylována, uvolní se z vazby na NF-κB, který se již aktivovaný přesune do jádra. Vitamin C zasahuje to tohoto procesu částečnou inhibicí IKK. Nedojde tedy k oddělení NF-κB od IκBα a transportu NF-κB do jádra. Dávka 100 µM DHA (Dehydroascorbic Acid) dokáže snížit aktivitu IKKβ o 50 % a 500 µM DHA IKKα kinázu téměř celou utlumí (obr. 1) [22]. Dále vitamin C brání aktivaci kaspázy-1, jejímž působením jsou z latentních prekurzorů tvořeny potentní prozánětové cytokiny IL-1β a IL-18. Tlumena je také cesta vedoucí přes aktivaci p38MAPK (Mitogen-activated Protein Kinase). S inhibicí těchto signalizačních drah je spjata i snížená syntéza IL-12, INFγ i TNFα. Takto ovlivněné DC spíše setrvávají v nevyzrálém stavu, což se projeví sníženou schopností podporovat rozvoj imunitní odpovědi. Vitamin C tedy snižuje imunostimulační funkci dendritických buněk a to má za následek snížení indukce proliferace T-lymfocytů. Navíc T-lymfocyty stimulované dendritickými buňkami, které byly předtím inkubovány s vitaminem C, produkují hlavně IL-10, IL-4, IL-5 a IL-13. Tyto cytokiny odrážejí aktivitu subsetu Th2 T-lymfocytů. Tak snižují potenciálně poškozující reakce zprostředkované Th1 subsetem. IL-10 je navíc považován za obecně protizánětově působící cytokin. Vitamin C společně s vitaminem E jsou schopny převést dendritické buňky z aktivačních na tolerogenní. Ty následně po vzájemném kontaktu DC – T-lymfocyt generují anergizované T-lymfocyty. Pokud jsou dendritické buňky vystaveny vyšším dávkám vitaminu C, indukují ve větší míře T-lymfocyty exprimující transkripční faktor FoxP3, tedy subset Treg (regulačních) T-lymfocytů. Kromě již zmíněného má vitamin C vliv na expresi povrchových molekul. Jedná se převážně o kostimulační molekuly, jako jsou CD40, CD80, CD86 i MHC II na aktivovaných dendritických buňkách [23]. Vitamin C tak výrazně přispívá k navození homeostatických mechanizmů, které mají udržet optimální průběh zánětové odpovědi s maximem protekce a minimem poškození vlastních struktur.
Obr. 1. Vstřebávání vitaminu C a jeho intracelulární působení. 1. oxidoreduktáza plazmatické membrány 2. thioredoxin reduktáza 3. glutation reduktáza 4. glutamátový trasportér 5. SVCT – sodíkový transportér vitaminu C AFR – volný radikál vitaminu C, cJun, cFos – proonkogeny, DHA – dehydroaskorbová kyselina, Erk – kináza regulovaná extracelulárním signálem, Fln – flamin, GTH – glutation, IKK – I-kB kináza, Jnk – c-Jun terminální kináza, MLC – lehký řetězec myosinu, NF-κB – nukleární faktor kB, PLA<sub>2</sub> – fosfolipáza A<sub>2</sub>, PLC – fosfolipáza C, Ras, Rac – proonkogeny, ROS – reaktivní kyslíkové radikály, Ser/Thr – fosforylující kinázy 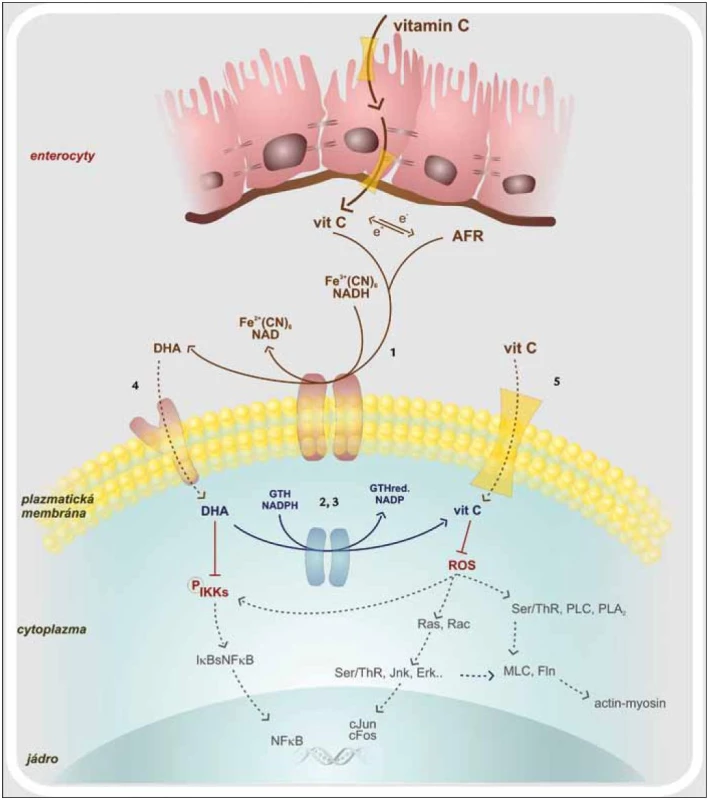
Vitamin C a fagocyty
Makrofágy jsou nezastupitelné v boji proti intracelulárním patogenům. Fagocytované mikroorganizmy jsou zabíjeny během oxidačního vzplanutí, kdy se sestaví membránový NADPH oxidázový komplex aktivovaný mikrobiální stimulací. NADPH oxidáza katalyzuje vznik superoxidového aniontu, který je prekurzorem pro formování hydroxylového radikálu, singletového kyslíku aj. Tyto volné radikály jsou silně cytotoxické. Podílejí se sice na usmrcení patogenů, ale také poškozují fagocytující buňku [20,24]. Ochranu proti intracelulárním ROS poskytují buněčné enzymy, superoxid dizmutáza, glutation peroxidáza, kataláza, cytochromoxidáza a molekuly s antioxidačním potenciálem, např. vitamin C, β karoten, GTH. Zánětová odpověď je doprovázena zvýšenou tvorbou ROS a RNS. Vzrůstá tak tělesná poptávka po antioxidantech. Je známa korelace mezi aktivitou leukocytů a hladinou vitaminu C a GTH uvnitř buněk. Vitamin C ochraňuje leukocyty nejen před ROS, ale zároveň působí protiapoptoticky. Aktivuje antiapoptotický gen Bcl-2 a snižuje aktivitu kaspáz 3 a 9 [25]. Protože je organizmus závislý na přísunu vitaminu C v potravě, je nutné s ním šetřit a umět jej beze zbytku využít. V leukocytech, podobně tak v mitochondriích, prodělává vitamin C recyklaci nebo lze také říci regeneraci. Po předání elektronu se vitamin C mění na askorbylový radikál, který je možné regenerovat dehydrogenázou na vitamin C a dehydroaskorbát. Následující krok potom zahrnuje aktivaci NADPH dependentní dehydroaskorbát reduktázy, jež společně s GTH redukuje DHA na vitamin C. Intracelulární hladina vitaminu C tak zůstává delší dobu normální i při snížené suplementaci. Ovšem při zánětové reakci spojené s infekcí, traumatem, nádorovými procesy se hladina vitaminu C rychle snižuje (obr. 2) [26]. Vliv vitaminu C na leukocyty se uplatňuje i skrz ovlivnění aktivity GM-CSF (Granulocyte-Macrophage Colony-Stimulating Factor), adhezní molekuly ICAM-1 (Intercellular Adhesion Molecule-1), receptoru endogenních nebezpečných vzorů RAGE (Receptor for Advanced Glycation Endproducts) či metabolizmu železa [27]. GM-CFS je růstovým faktorem podporujícím diferenciaci a proliferaci myeloidní buněčné linie. Zvýšení produkce GM-CSF indukují prozánětové faktory, jakými jsou TNFα, IL-1β, ROS aj. Receptor pro GM-CSF je heterodimer skládající se ze 2 podjednotek GMRα a GMRβ. Aktivace GMRα je funkčně spojená s aktivací MAPK a následně i NF-κB. U GMRβ se signální cesty ubírají směrem k aktivaci transkripčních faktorů STAT 5 (Signal Transducer and Activator of Transcription 5). Jeho vliv je tedy prozánětový. Naproti tomu stojí vitamin C, který neutralizuje ROS, čímž omezuje tvorbu GM-CSF. V dávce vyšší 500 µM DHA vitamin C inhibuje STAT 5 předtím aktivovaný působením GM-CSF, ruší tedy jeho účinky. Snižuje tak syntézu IL-2, IL-15 a v menší míře i IL-7 [28]. Exprese adhezních molekul ICAM-1 se zvyšuje v průběhu aktivace imunitního systému, kdy je nutné zajistit podmínky pro migraci leukocytů do místa poškození. Největší podíl na vzrůstu exprese ICAM-1 mají INFγ, IL-1, TNFα, ROS. Stimulace ICAM-1aktivuje buněčnou signální dráhu vedoucí k aktivaci NF-κB. Pokud je ovšem přítomen vitamin C v dávce alespoň 250 mg/den a vitamin D, nedochází ke zvýšení exprese ICAM-1 na aktivovaných monocytech a endotelu. Bazální expresi ICAM-1 vitamin C neovlivňuje, takže nenastává úplná inhibice migrace leukocytů, pouze snížení zánětové odpovědi [29]. Při oxidativním stresu se zvyšuje neenzymatická glykace lipidů, proteinů a nukleových kyselin, a vznikají tak produkty pokročilé glykace (Advanced Glycation Endproducts – AGE). Ty slouží jako ligandy pro RAGE receptor, jehož stimulace je mimo jiné odpovědná za aktivaci NF-κB. U SVCT2 –/– makrofágů (Sodium-de-pendent vitamin C transporter 2), je snížena exprese RAGE i mRNA pro něj. Ve výsledku je snížena syntéza IL-6, IL-1β, COX-2 aj., a to i po LPS stimulaci, kdy dochází ke snížení aktivity IKK, ale také Gadd45β (Growth Arrest and DNA Damage-inducible Protein 45β) a Itch (E3 Ubiquitin Ligase), jež mají antiapoptotickou funkci. Společně se zvýšenou senzitivitou k H2O2 tak makrofágy snáze podléhají apoptóze. Je to další mechanizmus vitaminu C, jak tlumit a ukončovat zánětovou odpověď [22]. Přestože jsme se výše zmínili o tlumivém účinku vitaminu C na aktivitu leukocytů, je nezbytný pro jejich funkčnost. Narušená funkce leukocytů při deficitu vitaminu C se vysvětluje porušeným metabolizmem železa, které se v buňce vyskytuje ve své trojmocné podobě. Aby nedocházelo k jeho intracelulární kumulaci, je sekvestrováno do lysozomů. To lze pouze s dvojmocným prvkem. Vitamin C redukuje Fe3+ na Fe2+, a tím umožní jeho transport do lysozomu. Jinak dochází ke kumulaci trojmocných iontů, které poškozují intracelulární struktury a narušují funkci leukocytů i jejich životaschopnost. Neutrofily také profitují z ochranné funkce vitaminu C, jenž neutralizuje volné radikály vznikající při buněčném zabíjení mikroorganizmů. Výzkumy ukázaly, že aktivita myeloperoxidázy (MPO) a intracelulární zvýšení koncentrace H2O2 neoxiduje vitamin C, který je tak šetřen. Ovšem v případě aktivity NADPH oxidázy je situace jiná [12]. Vitamin C reaguje se superoxidy, jež jsou pro buňku nebezpečnější, a neutralizuje je [30]. Neutrofily jsou do oběhu uvolňovány v proapoptotickém stavu, délka jejich života není dlouhá, pokud nejsou prozánětově aktivované a nemigrují do tkáně [31]. Dobu jejich přežití zvyšuje HIF-1α (Hypoxia Induced Factor), jehož tvorbou reagují buňky na hypoxii v místě zánětu. Při deficitu vitaminu C je zvýšená exprese HIF-1α, který má schopnost aktivovat NF-κB a prodlužovat přežití neutrofilů i v normoxickém stavu. V nepřítomnosti vitaminu C je tedy sníženo odstranění aktivovaných neutrofilů a prodloužena zánětová reakce. Při přidání vitaminu C dochází k reverzi do apoptotického stavu a zablokování NF-κB [32,33]. Zatímco na výše zmíněné buňky imunitního systému má vitamin C spíše negativně modulující efekt a snižuje jejich aktivitu a délku života, a působí protizánětově, u NK buněk (Natural Killer) se projeví jako aktivující prvek. Posiluje funkce NK, zvyšuje jejich proliferaci, reakci na mikrobiální podněty i schopnost zabíjet patogenní mikroorganizmy [34,35]. U monocytů snižuje expresi Fas a tlumí aktivaci kaspázy 8, ale její katalytickou funkci neovlivňuje. Tím je chrání před apoptózou [36].
Obr. 2. Vznik ROS a RNS, jejich neutralizace a regenerace antioxidantů. GSH – glutation, GSH-Px – glutation peroxidáza, GSH-R – glutation reduktáza, GS-SG – oxidovaný glutation (glutation disulfid), HOCl – kyselina chlorná, LOOH – lipidový hydroperoxid, LOO· – lipoperoxylový radikál, MPO – myeloperoxidáza, ·NO – oxid dusnatý, ·OH – hydroxylový radikál, ONOO<sup>–</sup> – peroxynitrit, PC – pentózový cyklus, R5P – ribulóza 5 fosfát, SOD – superoxid dismutáza, vit. C·– radikál vitaminu C, vit. E·– radikál vitaminu E, x·– radikál 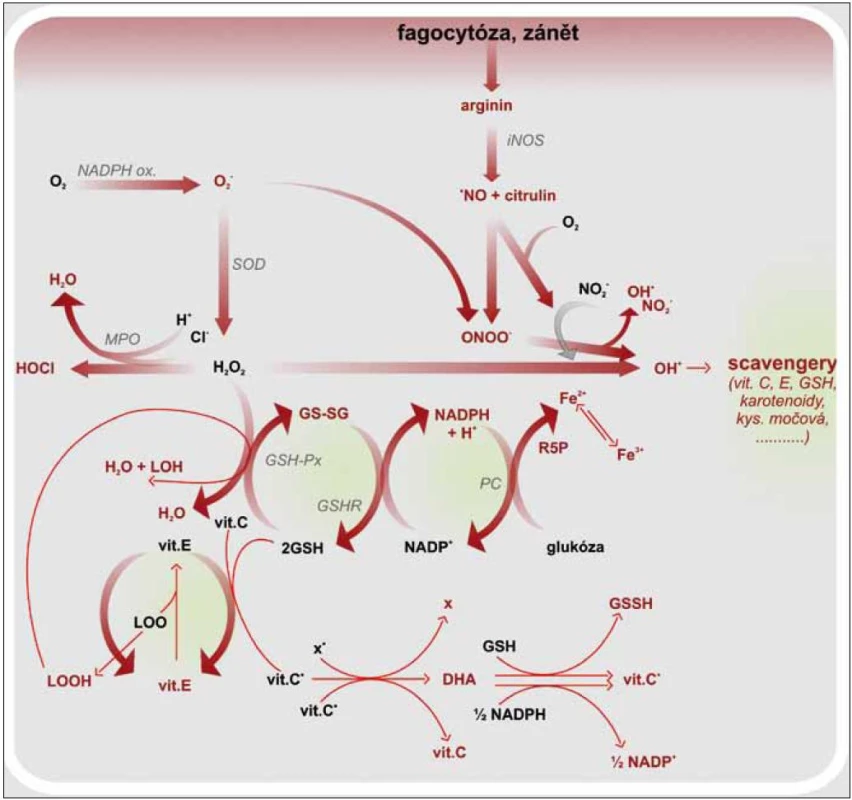
Vitamin C a adaptivní imunita
Vitamin C nepřímo zvyšuje proliferaci a diferenciaci lymfocytů pomocí aktivace a modulace vrozené imunity. Zlepšuje odpovídavost lymfocytů na antigenní podněty. Současně lymfocyty ochraňuje nejen před ROS a RNS, ale také před apoptózou, jak dokládají různé studie. Kultivace thymocytů v přítomnosti vitaminu C přinesly zajímavé výsledky. Zatímco v médiu bez přidání vitaminu C podlehlo apoptóze celých 58 % thymocytární populace, v médiu, do nějž byl přidán vitamin C v dávce 1 g/ml, podlehlo apoptóze pouze 32 % buněk [37]. Další významnou skutečností je, že vitamin C mění lymfocytární proteom (soubor proteinů, které jsou buňkou produkovány). T-lymfocyty kultivované v přítomnosti vitaminu C vykazují vyšší syntézu fosfatidylinositol transfer proteinu (PITP). PITP transportuje lipidy, jakými jsou fosfatidylinositol, fosfatidylcholin, které vznikají v endoplazmatickém retikulu, mezi membránami např. cytoplazmatickou a endoplazmaticko-retikulární, čímž se PIPT zapojuje do signalizačních regulačních cest a podporuje formování sekrečních granulí i jejich exocytózu [25]. Ke stejným závěrům dospěla i Grantová se svou výzkumnou skupinou, když kultivovala T-lymfocyty v médiích s různou koncentrací vitaminu C a následně analyzovala změny v syntéze proteinů takto kultivovaných buněk. Kromě transportního PIPT se zvýšila i hladina fosfolipidových transportérů z rodiny Sec14, které ovlivňují metabolizmus HDL. Zvýšila se hladina pyromucin senzitivní aminopeptidázy, která je odpovědná za proteolýzu mnoha peptidů, a tím za tvorbu substrátů potřebných např. ke zpracování antigenu cestou HLA I či za závěrečný sestřih N-terminálních konců receptorů T cytotoxických lymfocytů, tím i za tvorbu epitopů pro antigeny. Dochází i k posílení syntézy HLA-B. Naproti tomu syntéza a aktivace proapoptotické kaspázy 3 klesá, stejně tak signalizace přes cGMP fosfodiesterázu, při její inhibici nedochází k degradaci cGMP. Je tedy posílena relaxace hladkých svalů, a její inhibitory se proto hodí např. pro terapii bronchiálního astmatu. Funkce cGMP zahrnuje i ovlivnění leukocytární diferenciace, exprese povrchových markerů, syntézu cytokinů, ale také snížení leukocytární migrace a prozánětové aktivity Th1 subsetu [38]. Vitamin C chrání DNA periferních lymfocytů před oxidací etanolem [39]. B-lymfocyty, jako jiné buňky, ochraňuje vitamin C před volnými intracelulárními ROS. Jeho působením se snižuje syntéza antigen specifických protilátek IgG1 v závislosti na podané dávce. Snížení hladiny IgG1 je provázeno zvýšenou syntézou IgG2a, ale to až při dávce 250 mg a vyšší. Vitamin C podporuje i izotypové přepnutí od IgE právě k podtřídě IgG2. Dalo by se očekávat, že vitamin C ovlivňuje i proliferaci B-lymfocytů nebo expresi kostimulačních molekul CD80 a CD86, ale není tomu tak. Tyto parametry se nemění ani při vysokých dávkách vitaminu C [40].
Závěr
Vitamin C je nepostradatelnou složkou naší výživy, která ovlivňuje mnoho fyziologických pochodů. Snad nejvýraznější je jeho vliv na imunitní systém, adaptivní i vrozenou složku, a modulaci jeho odpovědí na endogenní i exogenní podněty, ale také posílením bariérových funkcí. Neutralizací ROS a RNS snižuje riziko poškození tělesných buněk, včetně imunitních. Vitamin C v dostatečně vysoké dávce je možné doporučit jako pomocný prvek v léčbě různých patologických stavů nebo jako prevenci vzniku civilizačních onemocnění a také jako faktor harmonizující imunitní systém.
Poděkování
Práce byla podpořena projektem specifického výzkumu SVV 262902 a programu PRVOUK P37/09 UK v Praze, LF UK v Hradci Králové.
Zkratky
- BH4 – tetrahydrobiopterin
- DC – dendritické buňky (Dendritic Cell)
- DHA – kyselina dehydroaskorbová (Dehydroascorbic Acid)
- HIF-1α – hypoxií indukovaný faktor 1α (Hypoxia Induced Factor 1α)
- GM - CSF – faktor stimulující granulocyto-makrofágové kolonie (Granulocyte-macrophage Colony-stimulating Factor)
- ICAM-1 – mezibuněčná adhezní molekula 1 (Intercellular Adhesion Molecule-1)
- IKK – IκB kináza
- MAPK – mitogenem aktivovaná protein kináza (Mitogen-activated Protein Kinase)
- MPO – myeloperoxidáza
- NF-κB – nukleární faktor κB (Nuclear factor κ B)
- NO – oxid dusnatý (Nitric Oxide)
- NOS – syntáza oxidu dusnatého (Nitric Oxide Synthase), iNOS – inducibilní, eNOS – endoteliální
- PITP – fosfatidylinositol transfer protein
- RNS – volné dusíkové radikály (Reactive Nitrogen Species)
- ROS – volné kyslíkové radikál (Reactive Oxygen Species)
- SOD – superoxid dizmutáza (Superoxide dismutase)
- SVCT2 – Na+/C-vitamin symportér 2 (Sodium-dependent vitamin C transporter 2)
- VEGF – vaskulární endoteliální růstový faktor (Vascular Endothelial Growth Factor)
MUDr. Drahomíra Holmannová
www.fnhk.cz
e-mail: holmannova@gmail.com
Doručeno do redakce: 21. 3. 2012
Přijato po recenzi: 13. 6. 2012
Zdroje
1. Mandl J, Szarka A, Bánhegyi G. Vitamin C: update on physiology and pharmacology. Br J Pharmacol 2009; 157 : 1097–1110.
2. Puertollano MA, Puertollano E, de Cienfuegos GÁ et al. Dietary antioxidants: immunity and host defense. Curr Top Med Chem 2011; 11 : 1752–1766.
3. Blass SC, Goost H, Tolba RH et al. Time to wound closure in trauma patients with disorders in wound healing is shortened by supplements containing antioxidant micronutrients and glutamine: A PRCT. Clin Nutr 2012; 31 : 469–475.
4. Firkle T, Resl V, Racek J et al. Antioxidants and protection of the skin against the effect of ultraviolet rays. Cas Lek Cesk 2000; 139 : 358–360.
5. Ma AG, Ge S, Zhang M et al. Antioxidant micronutrients improve intrinsic and UV-induced apoptosis of human lymphocytes particularly in elderly people. J Nutr Health Aging 2011; 15 : 912–917.
6. Murakami K, Inagaki J, Saito M et al. Skin atrophy in cytoplasmic SOD-deficient mice and its complete recovery using a vitamin C derivative. Biochem Biophys Res Commun 2009; 382 : 457–461.
7. Murakami K, Inagaki J, Saito M et al. Complete recovery of skin atrophy and collagen and elastin degeneration using a vitamin C derivative in CuZn-SOD-deficient mice. Biochem Biophys Res Commun 2009; 382 : 457–461.
8. Rodríguez JA, Nespereira B, Pérez-Ilzarbe M et al. Vitamins C and E prevent endothelial VEGF and VEGFR-2 overexpression induced by porcine hypercholesterolemic LDL. Cardiovasc Res 2005; 65 : 665–673.
9. Nakai K, Urushihara M, Kubota Y et al. Ascorbate enhances iNOS activity by increasing tetrahydrobiopterin in RAW 264.7 cells. Free Radic Biol Med 2003; 35 : 929–937.
10. Trachootham D, Lu W, Ogasawara MA et al. Redox regulation of cell survival. Antioxid Redox Signal 2008; 10 : 1343–1374.
11. Racek J, Holecek V, Trefil L. Antioxidative properties of ascorbic acid. Cas Lek Cesk 2000; 139 : 583–587.
12. Chatterjee M, Saluja R, Kumar V et al. Ascorbate sustains neutrophil NOS expression, catalysis, and oxidative burst. Free Radic Biol Med 2008; 45 : 1084–1093.
13. Doherty GH. Nitric oxide in neurodegeneration: potential benefits of non-steroidal anti-inflammatories. Neurosci Bull 2011; 27 : 366–382.
14. Chen CZ, Raghunath M. Focus on collagen: in vitro systems to study fibrogenesis and antifibrosis state of the art. Fibrogenesis Tissue Repair 2009; 2 : 7.
15. Canty EG, Kadler KE. Procollagen trafficking, processing and fibrillogenesis. J Cell Sci 2005; 118 : 1341–1353.
16. Graham MF, Willey A, Adams J et al. Role of ascorbic acid in procollagen expression and secretion by human intestinal smooth muscle cells. J Cell Physiol 1995; 162 : 225–233.
17. Kuroyanagi M, Shimamura E, Kim M et al. Effects of L-ascorbic acid on lysyl oxidase in the formation of collagen cross-links. Biosci Biotechnol Biochem 2002; 66 : 2077–2082.
18. Nusgens BV, Humbert P, Rougier A et al. Topically applied vitamin C enhances the mRNA level of collagens I and III, their processing enzymes and tissue inhibitor of matrix metalloproteinase 1 in the human dermis. J Invest Dermatol 2001; 116 : 853–859.
19. Heino J. The collagen family members as cell adhesion proteins. Bioessays 2007; 29 : 1001–1010.
20. Geissmann F, Manz MG, Jung S et al. Development of monocytes, macrophages, and dendritic cells. Science 2010; 327 : 656–661.
21. Liu K, Nussenzweig MC. Origin and development of dendritic cells. Immunol Rev 2010; 234 : 45–54.
22. Cárcamo JM, Pedraza A, Bórquez-Ojeda O et al. Vitamin C is a kinase inhibitor: dehydroascorbic acid inhibits IkappaBalpha kinase beta. Mol Cell Biol 2004; 24 : 6645–6652.
23. Tan PH, Sagoo P, Chan C et al. Inhibition of NF-kappa B and oxidative pathways in human dendritic cells by antioxidative vitamins generates regulatory T cells. J Immunol 2005; 174 : 7633–7644.
24. Racek J, Holecek V, Sedlacek D et al. Free radicals in immunology and infectious diseases. Epidemiol Mikrobiol Imunol 2001; 50 : 87–91.
25. Griffiths HR, Willetts RS, Grant MM et al. In vivo vitamin C supplementation increases phosphoinositol transfer protein expression in peripheral blood mononuclear cells from healthy individuals. Br J Nutr 2009; 101 : 1432–1439.
26. May JM, Huang J, Qu ZC. Macrophage uptake and recycling of ascorbic acid: response to activation by lipopolysaccharide. Free Radic Biol Med 2005; 39 : 1449–1459.
27. Racek J, Eiselt J, Opatrný K Jr. Transitional elements and free radicals. Cas Lek Cesk 2002; 141 : 479–482.
28. Cárcamo JM, Bórquez-Ojeda O, Golde DW. Vitamin C inhibits granulocyte macrophage-colony-stimulating factor-induced signaling pathways. Blood 2002; 99 : 3205–3212.
29. Rayment SJ, Shaw J, Woollard KJ et al. Vitamin C supplementation in normal subjects reduces constitutive ICAM-1 expression. Biochem Biophys Res Commun 2003; 308 : 339–345.
30. Parker A, Cuddihy SL, Son TG et al. Roles of superoxide and myeloperoxidase in ascorbate oxidation in stimulated neutrophils and H2O2--treated HL60 cells. Free Radic Biol Med 2011; 51 : 1399–1405.
31. Kumar V, Sharma A. Neutrophils: Cinderella of innate immune system. Int Immunopharmacol 2010; 10 : 1325–1334.
32. Kumar S, Patel S, Jyoti A et al. Nitric oxide-mediated augmentation of neutrophil reactive oxygen and nitrogen species formation: critical use of probes. Cytometry A 2010; 77 : 1038–1048.
33. Vissers MC, Wilkie RP. Ascorbate deficiency results in impaired neutrophil apoptosis and clearance and is associated with up-regulation of hypoxia-inducible factor 1alpha. J Leukoc Biol 2007; 81 : 1236–1244.
34. Atasever B, Ertan NZ, Erdem-Kuruca S et al. In vitro effects of vitamin C and selenium on NK activity of patients with beta-thalassemia major. Pediatr Hematol Oncol 2006; 23 : 187–197.
35. Wintergerst ES, Maggini S, Hornig DH. Immune-enhancing role of vitamin C and zinc and effect on clinical conditions. Ann Nutr Metab 2006; 50 : 85–94.
36. Perez-Cruz I, Carcamo JM, Golde DW. Vitamin C inhibits FAS-induced apoptosis in monocytes and U937 cells. Blood 2003; 102 : 336–343.
37. Pavlović V, Cekić S, Bojanić V et al. Ascorbic acid modulates spontaneous thymocyte apoptosis. Acta Medica Medianae 2005; 44 : 21–23.
38. Grant MM, Mistry N, Lunec J et al. Dose-dependent modulation of the T cell proteome by ascorbic acid. Br J Nutr 2007; 97 : 19–26.
39. Yan Y, Yang JY, Mou YH et al. Differences in the activities of resveratrol and ascorbic acid in protection of ethanol-induced oxidative DNA damage in human peripheral lymphocytes. Food Chem Toxicol 2012; 50 : 168–174.
40. Woo A, Kim JH, Jeong YJ et al. Vitamin C acts indirectly to modulate isotype switching in mouse B cells. Anat Cell Biol 2010; 43 : 25–35.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 10- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Akutní infarkt myokardu u mladých – stala se někde chyba? – editorial
- Méně invazivní kardiochirurgické přístupy pro léčbu ischemické choroby srdeční – editorial
- Viscerální leishmanióza – editorial
- Festina lente! – editorial
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Existuje vzťah medzi zápalovými markermi, oxidačným stresom a pooperačnou fibriláciou predsiení?
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Hypoglykemie – fenomén, nad kterým moderní diabetologie pomalu vítězí
- AII antagonisté (candesartan a irbesartan) v léčbě kardiovaskulárních onemocnění
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
- Vysoké podezření na ICHS získané anamnézou nesmí vyvrátit negativita některých objektivních vyšetřovacích metod – zkušenost ambulantního internisty
- Dabigatran-etexilát v klinické praxi pro prevenci tromboembolických příhod u nemocných s fibrilací síní
- Efekt ivabradinu na tepovou frekvenci, vývoj funkce levé komory a koncentraci NT-proBNP u pacientů se systolickým chronickým srdečním selháním – příklady z praxe
- Diagnostické a léčebné postupy u arteriální hypertenze – verze 2012. Doporučení České společnosti pro hypertenzi
- Vildagliptin v léčbě pacientů s diabetes mellitus 2. typu: co je nového?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



