-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Posttransplantační lymfoproliferace u nemocného s intenzivní imunosupresí: kazuistika
Post-transplantation lymphoproliferation in patients with intensive immunosuppression
Organ allograft recipients are at higher risk for malignancies development. This risk is known to be different in different types of tumours. Skin cancers and lymphoproliferative disorders have been described to be ones the most frequent (comprising 15-25 % of all malignancies). Here, we present the case of expansive formation localized near the renal allograft in patient, whose native kidneys failed as a consequence of long-term cyclosporine A therapy after orthotopic heart transplantation. The maintenance immunosuppression consisted of combination of cyclosporine A, mycophenolate mofetil and steroids. The expansion offside of transplanted kidney was detected by routine ultrasound examination. After indifferent neurological symptoms, sepsis, and then multiorgan failure occured. Shortly after acute surgery patient died. Autopsy and histopathology showed lymphoproliferative disorder - monomorphic type of posttransplant lymphoproliferative disorder (PTLD). Occurence of PTLD in organ transplantation is discussed.
Key words:
posttransplant malignancies - posttransplant lymphoproliferative disorder (PTLD) - immunosuppression
Autoři: H. Vavřinová 1; D. Viklický 1; J. Lácha 1; D. Housa 2; L. Hošková 3; V. Teplan 1
Působiště autorů: Klinika nefrologie, Transplantcentrum, IKEM, Praha, přednosta prof. MUDr. Vladimír Teplan, DrSc. 1; Patologicko-anatomické pracoviště, IKEM, Praha, přednostka prim. MUDr. Eva Honsová 2; Klinika kardiologie, IKEM, Praha, přednosta prof. MUDr. Jan Kautzner, CSc., FESC 3
Vyšlo v časopise: Vnitř Lék 2006; 52(6): 645-648
Kategorie: Kazuistiky
Souhrn
U pacientů po orgánových transplantacích se popisuje vyšší výskyt maligních onemocnění. Riziko vzniku nádorových onemocnění se liší u různých typů tumorů. Vedle kožních malignit jsou nejčastější lymfoproliferativní onemocnění (15-25 % ze všech nádorů). Prezentujeme výskyt expanzivního útvaru v blízkosti renálního štěpu u nemocného po transplantaci srdce a následné transplantaci ledviny, který byl léčen kombinací cyklosporinu A, mykofenolát mofetilu a steroidů. U nemocného bylo náhodně při sonografické kontrole objeveno ložisko v okolí ledvinného štěpu. Po manifestaci nespecifické neurologické symptomatologie došlo k rozvoji fatální sepse. Histopatologické vyšetření prokázalo lymfoproliferativní onemocnění - difuzní velkobuněčný B-lymfom (monomorfní formu posttransplantační lymfoproliferativní nemoci). Je diskutován výskyt lymfoproliferativních onemocnění po orgánových transplantacích.
Klíčová slova:
nádory po transplantacích orgánů - posttransplantační lymfoproliferativní onemocnění - imunosupresivní léčbaÚvod
Posttransplantační lymfoproliferativní onemocnění jsou u nemocných po orgánových transplantacích závažnou komplikací. Výskyt této nehomogenní skupiny onemocnění závisí na typu transplantovaného orgánu (u příjemců renálního štěpu činí 1-2 %) a na intenzitě a trvání imunosupresivní léčby. V tomto sdělení prezentujeme případ neobvyklé manifestace lymfoproliferativního onemocnění v blízkosti renálního štěpu u nemocného po transplantaci srdce a následné transplantaci ledviny.
Popis případu
59letý muž, 10 let po transplantaci srdce a 2,5 roku po transplantaci ledviny (od žijícího dárce) pro renální selhání způsobené dlouhodobou léčbou cyklosporinem A, byl hospitalizován na našem pracovišti začátkem prosince roku 2002 pro náhodný sonografický nález kulovitého ložiska v okolí renálního štěpu, připomínající tumor, a 14 dní trvající parestezie dolní čelisti.
Nemocný byl od 37 let léčen pro ischemickou chorobu srdeční (ICHS), která se manifestovala akutním infarktem myokardu spodní stěny. O rok později došlo u nemocného k recidivě infarktu přední stěny s rozvojem těžké dysfunkce levé komory. Proto v roce 1993 pacient podstoupil ortotopickou transplantaci srdce (OTS). Byl léčen trojkombinací imunosupresiv: cyklosporin A (terapeutické hladiny 300-400 ng/ml během úvodní léčby), azatioprin a prednison (0,5 mg/kg/den v sestupné dávce). Dvakrát byl léčen pro akutní rejekci pulzy metylprednisolonu do celkové dávky 3 gramy. Z přidružených onemocnění měl středně těžkou chronickou obstrukční plicní nemoc (CHOPN). Závažnými komplikacemi po OTS byly opakované infekce (v pooperačním období mykotická bronchopneumonie, herpes zoster v červenci roku 1996 a exacerbace CHOPN v březnu roku 2000). Nejzávažnější komplikací byl rozvoj renální insuficience na podkladě cyklosporinové toxicity od října roku 1994. Od roku 1998 byla změněna imunosupresivní léčba na kombinaci cyklosporinu A s cílovou hladinou 100-150 ng/ml, mykofenolát mofetil v dávce 2 g/den a steroidy 5 mg/den. I přes redukci dávky cyklosporinu A renální insuficience dále progredovala až do terminálního selhání ledvin. V červnu roku 2000 nemocný podstoupil transplantaci ledviny od 53leté zdravé manželky. 15. pooperační den byl léčen pro mírnou akutní rejekci pulzy metylprednisolonu (1,5 g) s dobrým efektem. Funkce ledvinného štěpu se poté rozvinula, hladina sérového kreatininu (S-Cr) byla 150 µmol/l při propuštění.
Čtyři měsíce po transplantaci ledviny u nemocného exacerbovala CHOPN. Ve stejné době byla zjištěna aktivní cytomegalovirová infekce (CMV), která byla léčena gancyklovirem.
V červenci roku 2002 byl nemocný znovu hospitalizován pro zhoršení funkce renálního štěpu (vzestup S-Cr ze 160 na 225 µmol/l během měsíce). Biopticky byla ověřena chronická transplantační nefropatie. Při vyšetření byla odhalena asymptomatická CMV infekce (pozitivita časného antigenu CMV, proteinu pp 65) a nemocný byl opět léčen gancyklovirem.
Další průběh léčby byl bez komplikací až do prosince roku 2002, kdy bylo při ambulantní sonografické kontrole náhodně zjištěno nejasné denzní ložisko v okolí ledvinného štěpu. Při příjmu nemocný udával palpační bolestivost v okolí renálního štěpu, cefaleu. Byl subfebrilní. Na RTG snímku hrudníku byla patrná zánětlivá infiltrace při bazi pravé plíce, laboratorně zjištěno vyšší CRP (67 mg/l), v krevním obraze nebyly výraznější odchylky od referenčních hodnot (leukocyty 7,7 × 109/l, erytrocyty 4,0 × 1012/l, hemoglobin 132 g/l, trombocyty 146 × 109/l). Na základě tohoto nálezu byla zahájena antibiotická terapie amoxycillinem/klavulanátem. Při ultrasonografickém vyšetření byl zobrazen kulovitý útvar o velikosti 7 cm vtlačující se do hilu renálního štěpu. Podle CT vyšetření pánve byl útvar popisován jako benigní - nejspíše absces či hematom. Cystoskopické, echokardiografické a oční vyšetření byla bez podstatných patologických změn. Několikrát jsme zvažovali perkutánní punkci suspektního ložiska, která však nebyla možná pro velké množství cévních struktur v okolí.
Týden od počátku hospitalizace nemocného jsme změnili jeho antibiotickou léčbu podle citlivosti na cefoperazon/sulbaktam (ve sputu Enterobacter aerogenes, E. coli) a flukonazol. U nemocného přesto přetrvávala teplota kolem 38 °C, navíc došlo k rozvoji poruchy okulomotoriky a parézy nervus facialis vpravo. Na CT snímku mozku byly znázorněny nevelké ischemické změny různého stáří periventrikulárně a atrofie mozkové tkáně. Několikrát jsme konzultovali neurologa, který indikoval MRI mozku a lumbální punkci s cílem diagnostikovat neuroinfekci. Na MRI byly patrné zánětlivé změny v bílé hmotě a diskrétní hemoragie v pontu vpravo bazálně - spíše staršího data. V mozkomíšním moku jen mírně zvýšené mononukleáry 14/3.
Během 3. týdne hospitalizace došlo u nemocného k výraznému zhoršení celkového stavu. Antibiotická terapie byla zcela bez efektu na zánětlivé parametry, došlo pouze k prohloubení sekundární anémie (CRP 200 mg/l, leukocyty 13,0 × 109/l, erytrocyty 2,9 × 1012/l, hemoglobin 95 g/l, trombocyty 92 × 109/l) a na RTG snímku srdce a plic byla spíše progrese nálezu. Na doporučení chirurgického konzilia jsme před explorací suspektního ložiska v okolí renálního štěpu indikovali CT hrudníku, na kterém byl nález oboustranného intersticiálního procesu zánětlivého charakteru s podílem fibrózy. Profylakticky jsme znovu zahájili léčbu gancyklovirem, z léčby vysadili mykofenolát mofetil. Pro zhoršující se funkci renálního štěpu (S-Cr 270 … 470 µmol/l) a hyperkalemii musel být nemocný hemodialyzován.
Protože jsme v diferenciální diagnostice pomýšleli na abscesové nebo maligní ložisko, indikovali jsme nemocného k chirurgické exploraci z vitální indikace. Pacient však pět hodin po revizi zemřel na multiorgánové selhání.
Histologické vyšetření peroperačního vzorku retroperitoneální lymfatické uzliny, částky retroperitonea a následně i vyšetření sekčního materiálu prokázalo lymfomovou infiltraci tkání. Lymfomová infiltrace byla nalezena v transplantované ledvině a okolních měkkých tkáních, vlastních ledvinách, perirenálním tuku a měkkých tkáních retroperitonea, srdečním štěpu, plicích, játrech, žlučníku, žaludku, štítné žláze, močovém měchýři a kostní dřeni (obr. 1-3). Jako bezprostřední příčina smrti byla shledána generalizace maligního tumoru, podle histopatologického vyšetření difuzního velkobuněčného B-lymfomu.
Obr. 1. Mikroskopický obraz infiltrace maligním lymfomem pod arteria renalis štěpu ledviny. 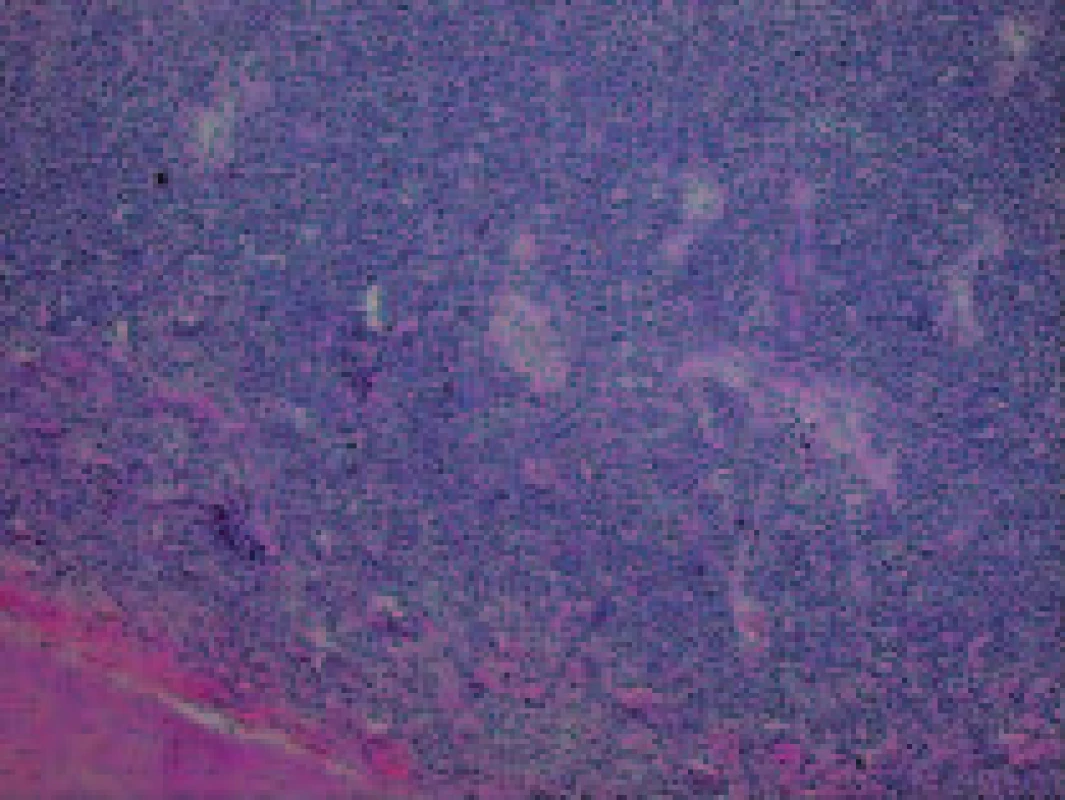
Obr. 2. Obdobný nález i v měkkých tkáních retroperitonea. 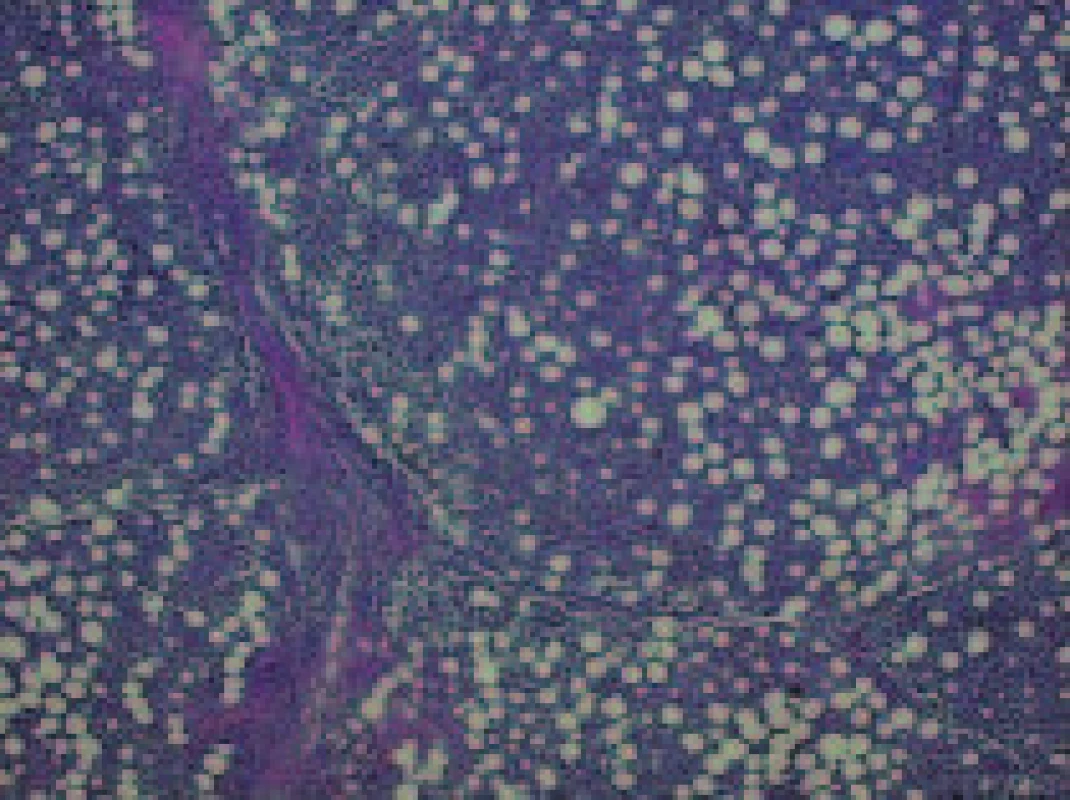
Obr. 3. Detail nádorových buněk. Infiltrát je tvořen středně velkými hyperchromními buňkami s nepravidelným jádrem často monstrózního tvaru. 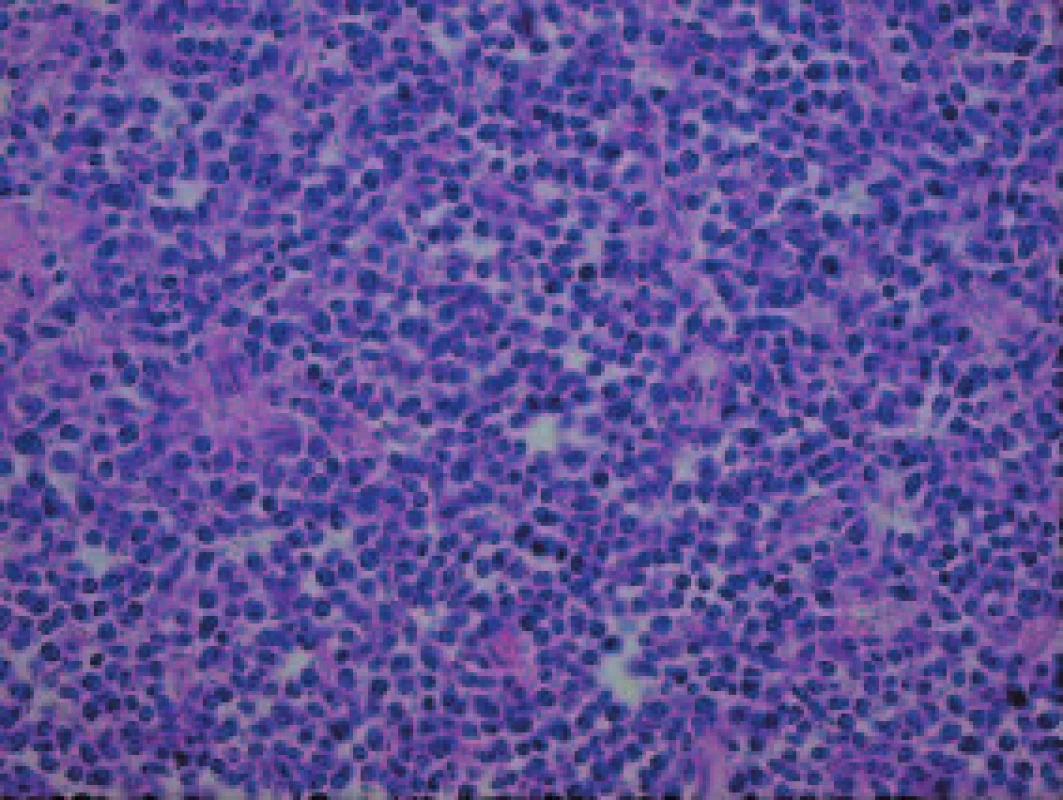
Rozbor případu
Lymfoproliferativní onemocnění jsou známou komplikací u nemocných léčených imunosupresí z nejrůznějších indikací, mezi které patří i transplantace solidních orgánů [1]. U pacientů po orgánových transplantacích je zvýšený výskyt nádorů a toto riziko je u některých nádorových onemocnění až 100násobně vyšší než v běžné populaci [2,3]. Vedle kožních malignit jsou nejčastější právě posttransplantační lymfoproliferativní onemocnění (PTLD), zahrnující 21-25 % ze všech nádorů [4]. Výskyt PTLD po transplantaci ledviny u dospělých příjemců činí 1-2 %. Po transplantaci ostatních orgánů se udává incidence u příjemců jater 2 %, po transplantaci srdce 2-10 %, srdce a plic 5-9 % a u příjemců střeva 19 %. Toto odráží nejen rozdíly používaných imunosupresivních režimů, ale také vnitřní biologické rozdíly mezi jednotlivými tkáněmi [5].
PTLD jsou heterogenní skupinou onemocnění, která mají odlišné histologické, cytologické, imunologické, genetické charakteristiky a které se liší svými projevy, stupněm malignity i odpovědí na léčbu. Diagnóza PTLD je spojena s 50-80% mortalitou u nemocných s monoklonální formou onemocnění [6]. Většina PTLD bývá odvozena od B-buněčné řady obsahující genom viru Epsteina-Barrové (EBV). Je všeobecně uznáváno, že EBV infekce nebo reaktivace infekce a intenzivní antilymfocytární léčba hrají hlavní úlohu v patogenezi PTLD [7]. Protože více než 90 % populace má vyvinutou imunitu k EBV ve věku 40 let, primární infekce a EBV asociovaná PTLD se nejvíce vyskytují po orgánových transplantacích u dětí [8]. Dalšími známými rizikovými faktory jsou CMV neshoda mezi dárcem a příjemcem v přítomnosti protilátek proti CMV [9], CMV nemoc [10], typ a intenzita imunosupresivní léčby [11,12].
Náš nemocný byl léčen 9 let kombinací imunosupresiv založenou na cyklosporinu A, a navíc byl 3krát léčen antirejekční terapií metylprednisolonem. Podávání kalcineurinových inhibitorů, cyklosporinu A a takrolimu bývá dáváno do souvislosti se vznikem chronické strukturální nefrotoxicity [13]. Po obou transplantacích se u něho vyskytly infekční komplikace (mykotická pneumonie, herpes zoster, exacerbace CHOPN a 2krát CMV infekce). Tento fakt svědčí o tom, že úroveň dlouhodobé imunosupresivní léčby byla více než dostatečná. Bohužel, stále ale neexistuje spolehlivý test, který by odhalil úroveň imunosuprese. V našem případě jsme vedle léčby předpokládané infekční komplikace v diferenciálně diagnostické rozvaze expanzivního útvaru v blízkosti renálního štěpu pomýšleli na nádorové onemocnění - zejména na lymfoproliferaci. Diagnózu hematomu či abscesu zpochybňovala negativní anamnéza instrumentálních výkonů. Močová píštěl nebo lymfokéla byla málo pravděpodobná vzhledem k dlouhému odstupu od transplantace. Definitivní diagnózu by bylo možné stanovit histologicky z exstirpované tkáně suspektního ložiska. Punkce ale nebyla možná pro velké množství cévních struktur v okolí. Proto jsme nemocného indikovali k chirurgické revizi z vitální indikace a plánovanou sternální punkci jsme vzhledem ke zhoršení stavu nemocného intra vitam již neprovedli.
Léčba posttransplantačních lymfoproliferací je založena především na redukci či úplném vysazení imunosupresiv. Imunosupresivní léčbu jsme redukovali (vysadili CellCept), ale vzhledem k tomu, že šlo o nemocného po transplantaci srdce, jsme ji nevysadili zcela. V případě EBV-pozitivního B-buněčného lymfomu je indikována antivirová léčba acyklovirem, valganciklovirem či ganciklovirem nejméně po dobu jednoho měsíce. U CD-20 pozitivních lymfomů se používá léčba rituximabem, chimerickou monoklonální protilátkou namířenou proti CD-20. U diseminovaných lymfomů či neúčinnosti předešlé terapie je metodou volby kombinovaná chemoterapie [14].
Jednou z teoretických možností jak umožnit současnou imunosupresivní a protinádorovou léčbu je užití m-TOR inhibitorů, sirolimu či everolimu. Tato skupina imunosupresiv má prokazatelné protinádorové účinky in vitro, in vivo byly dosud publikovány jen ojedinělé případy vyléčení Kaposiho sarkomu [15,16].
Tento případ ukazuje na vysoká rizika vyplývající z intenzivní dlouhodobé imunosuprese. Jednou ze závažných komplikací je chronická cyklosporinová nefrotoxicita. Ta u našeho nemocného vedla k nezvratnému selhání ledvin. Transplantace ledviny umožnila nemocnému vést kvalitní život, ale za dva a půl roku se vyskytla další komplikace dlouhodobé imunosuprese - lymfoproliferace. Podle histopatologického vyšetření se jednalo o difuzní velkobuněčný B-lymfom [17].
V našem případě jsme ale tuto diagnózu intra vitam již nestihli.
MUDr. Hana Vavřinová
www.ikem.cz
e-mail: hana.vavrinova@medicon.cz
Doručeno do redakce: 10. 1. 2006
Přijato po recenzi: 21. 2. 2006
Zdroje
1. Boudová L, Fakan F, Michal M et al. Lymfoproliferativní choroba po transplantaci. Čs Patol 2002; 38 : 24-32.
2. Lácha J, Jirka J, Nouza M et al. Nádorová onemocnění po transplantaci ledviny. Čas Lék Česk 1994; 133 : 562-565.
3. Gürlich R, Novotný J, Stříž I et al. Riziko vzniku malignity po orgánové transplantaci. Čas Lék Česk 2005; 144, 597-600.
4. Penn I. The changing pattern of posttransplant malignacies. Transplant Proc 1991; 1 : 1101-1103.
5. Penn I. Cancers complication organ transplantation. N Engl J Med 1990; 323 : 1767.
6. Boubenider S, Hiesse C, Goupy C et al. Incidence and consequences of post-transplant lymphoproliferative disorders. J Nephrol 1997; 10 : 136-145.
7. Jirava D, Fuchsová M, Fanta J et al. Nitrohrudní výskyt potransplantační lymfoproliferace. Rozhl Chir 1999; 78 : 191-195.
8. Ellis D, Jaffe R, Green M et al. EBV - related disorders in children undergoing renal transplantation with tacrolimus based immunosuppression. Transplantation 1999; 68 : 997-1003.
9. Walker RC, Marshall WF, Strickler J et al. Pretransplantation assessment of the risk of lymphoproliferative disorder. Clin Infect Dis 1995; 20 : 1346-1353.
10. Manez R, Breining MC, Linden P et al. PTLD in primary Epstein-Barr virus infection after liver transplantation: the role of CMV disease. J Infect Dis 1997; 176 : 1462-1467.
11. Bierber CP, Heberling RL, Jamieson SW et al. Lymphoma in cardiac transplant recipients associated with cyclosporine A, prednisone and anti-thymocyte globulin (ATG). In: Purtillo DI (ed). Immune deficiency and cancer. New York: Plenum 1984 : 309-320.
12. Swinnen LJ, Costanzo-Norden MR, Fisher SG et al. Increased incidence of lymphoproliferative disorder after immunosuppression with the monoclonal antibody OKT3 in cardiac-transplant recipients. N Engl J Med 1990; 323 : 1723-1728.
13. Guba M, Graeb Ch et al. Pro-and anti-cancer effects of immunosuppressive agents used in organ transplantation. Transplantation 2004; 77 : 1777-1782.
14. European best practise guidelines for renal transplantation. Section IV: Long-term management of transplant recipient. IV.6.1. Cancer risk after renal transplantation. Post - lymphoproliferative disease (PTLD): prevention and treatment. Nephrol Dial Transplant 2002; 17(Suppl 4): 31-3, 35-6.
15. Kauffman HM, Cherikh WS, McBride MA et al. TOR inhibitor maintenance immunossuppression is associated with a reduce incidence of post-transplant malignancies. Transplantation 2004; 78(Suppl 1): 30.
16. Kauffman HM, Cherikh WS, Cheng Z et al. Maintenance Immunossuppression with Target-of-Rapamycin Inhibitors is Associated with a Reduced Incidence of De novo Malignancies. Transplantation 2005; 80 : 883-889.
17. Harris NL et al. Post-transplant lymphoproliferative disorders. In: Jaffe ES. Tumours of haemopoetic and lymphoid tissues. Lyon: IARC Press 2001.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Katetrizační ablace komorových tachykardií provázejících strukturní onemocnění srdce: editorialČlánek Význam endokanabinoidního systému v modulaci kardiometabolických rizikových faktorů – editorialČlánek Jaderné receptory PPARα
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Katetrizační ablace komorových tachykardií provázejících strukturní onemocnění srdce: editorial
- Trimetazidin v léčbě stabilní anginy pectoris: editorial
- Trimetazidin - modulátor energetického metabolizmu myokardu: editorial
- Význam endokanabinoidního systému v modulaci kardiometabolických rizikových faktorů – editorial
- Biologická léčba revmatických onemocnění: editorial
- Srovnání plazmatických hladin B-natriuretického peptidu s echokardiografickými ukazateli funkce levé komory srdeční po léčbě doxorubicinem
- Obezita a progrese chronické renální insuficience: česká dlouhodobá prospektivní randomizovaná dvojitě slepá multicentrická studie
- Setrvalá monomorfní komorová tachykardie u pacientů se strukturálním postižením srdce. Různé arytmogenní substráty, různé možnosti paliativní nebo kurativní léčby katetrovou ablací v éře trojrozměrného mapování
- Ovlivnění úspěšnosti léčby chronické hepatitidy C hmotností a pohlavím pacienta a výší vstupní viremie
- Prevalence a příčiny refluxu v hlubokém žilním systému dolních končetin s insuficiencí povrchových žil
- Molekulovo-genetická diagnostika a skríning hereditárnej hemochromatózy
- Trimetazidin v léčbě stabilní anginy pectoris. TRIADA - (TRImetazidine in stable Angina twice DAily)
- Význam endokanabinoidního systému v modulaci kardiometabolických rizikových faktorů
-
Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob II.
Sumoylace a neddylace jako posttranslační modifikace proteinů podobné ubikvitinylaci a jejich význam - Jaderné receptory PPARα
- Biologická terapie revmatických onemocnění
- Chronické ochorenie obličiek a gravidita: kazuistika
- Posttransplantační lymfoproliferace u nemocného s intenzivní imunosupresí: kazuistika
-
Doporučený postup pro diagnostiku a léčbu hepatorenálního syndromu
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E.Purkyně - Teplan V et al. Praktická nefrologie. 2., zcela přepracované a doplněné vydání. Praha: Grada Publishing 2006. 496 stran. ISBN 80-247-1122-2.
- Benáková N. Ekzémy a dermatitidy. Praha: Maxdorf 2006. 125 stran. ISBN-80-7345-078-X.
- XXV. Dny mladých internistů v Martině
- XIII. medzinárodný kongres pre metabolizmus a výživu pri chorobách obličiek, 28. februára - 4. marca 2006, Mérida, Yucatán (Mexiko)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaderné receptory PPARα
- Prevalence a příčiny refluxu v hlubokém žilním systému dolních končetin s insuficiencí povrchových žil
- Setrvalá monomorfní komorová tachykardie u pacientů se strukturálním postižením srdce. Různé arytmogenní substráty, různé možnosti paliativní nebo kurativní léčby katetrovou ablací v éře trojrozměrného mapování
- Molekulovo-genetická diagnostika a skríning hereditárnej hemochromatózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



