-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulovo-genetická diagnostika a skríning hereditárnej hemochromatózy
Molecular genetic diagnostics and screening of hereditary hemochromatosis
Background:
Hereditary hemochromatosis is considered one of the most common hereditary diseases in population of Caucasian origin. In recent years, a candidate gene for HLA-linked hemochromatosis, HFE, has been cloned, and a single G-to-A mutation resulting in a cysteine-to-tyrosine substitution (C282Y) has been identified in up to 80 % of study patients with type 1 hereditary hemochromatosis. The purpose of the paper was to confirm the importance of genetic testing for HFE mutations in making the diagnosis of hemochromatosis and find out a suitable diagnostic algorithm for the indication of this form of diagnostics in patients suspected of hereditary hemochromatosis.Patients and methods:
The examination of C282Y mutation was conducted in 500 subjects. The most frequent indications for DNA analysis were hepatopathy of unknown ethiology, liver cirrhosis, diabetes mellitus, bronze skin pigmentation in connection with high serum iron concentration, elevated transferrin saturation and elevated serum ferritin levels.Results:
In our group of patients, 29 homozygotes and 75 heterozygotes for C282Y mutation were identified, 10 patients carried both C282Y and H63D mutations of HFE gene (compound heterozygotes), whereas in 386 subjects the mutation was not found. The genotype-phenotype correlation showed that 22 homozygotes had liver affection proved by imaging and/or histologic methods. Except the liver disorders, the most common symptoms of these patients were type 2 diabetes mellitus or glucose tolerance disorder (10 patients), arthritis or joint pain (9 patients) and cardiovascular disorders, such as cardiomyopathy (2 patients). Bronze skin pigmentation was present in 9 homozygotes. Transferin saturation values were significantly higher in homozygotes for C282Y mutation as compared to C282Y heterozygotes (p < 0.001), C282Y/H63D compound heterozygotes (p < 0.05) or wild type subjects (p < 0.001) respectively. Also serum ferritin levels were significantly higher in homozygotes for C282Y mutation as compared to C282Y heterozygotes (p < 0.001), C282Y/H63D compound heterozygotes (p < 0.001) and wild type subjects (p < 0.001) respectively.Conclusions:
Our observations confirm that DNA analysis significantly contributes to differential diagnostics of this severe, but in early recognition curable disease. Early detection and phlebotomy treatment prior to the onset of cirrhosis can reduce morbidity and normalize life expectancy. It is readily identified through biochemical testing for iron overload using serum transferrin saturation and genetic testing for C282Y homozygosity. DNA analysis is recommended in patients whose transferrin saturation is 45 % or more on a repeated test. General population screening has been waived in preference to targeting high-risk groups such as first-degree relatives of affected individuals and those with secondary iron overload, especially patients with chronic liver disorders and chronic anemia. This screening strategy is likely to continue until uncertainties regarding the natural history of the disease, age-related penetrance, and management of asymptomatic individuals are clarified.Key words:
hereditary hemochromatosis – diagnosis – DNA analysis – screening
Autoři: J. Zlocha 1; L. Kovács 1; S. Požgayová 1; V. Kupčová 2; S. Durínová 2
Působiště autorů: II. detská klinika Lekárskej fakulty UK a Detskej fakultnej nemocnice s poliklinikou, Bratislava, Slovenská republika, prednosta prof. MUDr. László Kovács, DrSc., MPH 1; III. interná klinika Lekárskej fakulty UK a FNsP akademika Dérera, Bratislava, Slovenská republika, prednosta prof. MUDr. Viliam Bada, CSc. 2
Vyšlo v časopise: Vnitř Lék 2006; 52(6): 602-608
Kategorie: Původní práce
Souhrn
Hereditárna hemochromatóza sa považuje za jedno z najčastejších dedičných ochorení v populáciách kaukazoidného pôvodu. Novšie sa ukázalo, že ochorenie je u viac ako u 80 % pacientov podmienené jedinou špecifickou mutáciou (mutácia C282Y génu HFE).
Cieľ práce:
Overiť význam určovania mutácie C282Y a H63D génu HFE metódou PCR v diagnostike hereditárnej hemochromatózy v klinickej praxi.Pacienti:
V období od januára roku 1999 do marca roku 2005 sme uskutočnili analýzu DNA u 500 pacientov s klinickými príznakmi, ktoré sa môžu vyskytovať v súvislosti s hereditárnou hemochromatózou (cirhóza pečene, hepatopatia nejasnej etiológie, diabetes mellitus, reumatologické problémy, bronzové sfarbenie kože, resp. laboratórne nálezy hypersiderémie, zvýšenej hladiny saturácie transferínu a hladiny sérového feritínu).Výsledky:
Homozygotný stav na mutáciu C282Y sa zistil u 29 pacientov, heterozygotný stav u 75 a 10 pacientov bolo dvojitých heterozygotov pre mutácie C282Y a H63D. U ostatných 386 osôb sme prítomnosť mutácie C282Y nezistili. U 22 homozygotov bolo zobrazovacími a/alebo histologickými metódami dokázané postihnutie pečene. Často sa vyskytoval diabetes mellitus 2. typu alebo porucha glukózovej tolerancie (10 pacienti), artropatia (9 pacienti), menej často kardiomyopatia (2 pacienti), bronzový kolorit kože sa zistil u 9 pacientov. U homozygotov pre mutáciu C282Y bola priemerná saturácia transferínu signifikantne vyššia v porovnaní s C282Y heterozygotmi (p < 0,001), ako aj C282Y/H63D dvojitými heterozygotmi (p < 0,05), resp. s pacientmi bez dokázanej mutácie (p < 0,001). Priemerná koncentrácia sérového feritínu bola u C282Y homozygotov signifikantne vyššia než u C282Y/H63D dvojitých heterozygotov (p < 0,001), u C282Y heterozygotov (p < 0,001) a pacientov bez prítomnosti mutácie (p < 0,001).Záver:
Naše pozorovania potvrdzujú, že analýza DNA indikovaná na základe fenotypických prejavov je významným prínosom pre diferenciálnu diagnostiku tejto závažnej choroby. Dôležitosť včasnej neinvazívnej diagnostiky hereditárnej hemochromatózy pomocou analýzy DNA podčiarkuje aj dostupnosť jej jednoduchej, lacnej a účinnej liečby, ktorá spočíva v opakovaných púšťaniach krvi (venesekciou alebo flebotómiou. Na základe našich výsledkov odporúčame genetický skríning hereditárnej hemochromatózy u jedincov s nálezom opakovane zvýšenej saturácie transferínu, a to aj pri predpokladanej sekundárnej etiológii hemochromatózy. Genetické vyšetrenie je plne indikované aj u prvostupňových príbuzných homozygotov na mutáciu C282Y génu HFE.Kľúčové slová:
hereditárna hemochromatóza - diagnóza - analýza DNA - skríningÚvod
Hemochromatóza je známa od roku 1865, kedy Trousseau popísal zvláštnu formu diabetu s hyperpigmentáciou kože („bronzový diabetes“). Názov „hemochromatóza“ použil ako prvý Recklinghausen v roku 1889 a ku klasickej klinickej triáde (cirhóza pečene, diabetes mellitus a bronzové sfarbenie kože) pridal Sheldon v roku 1935 ešte poškodenie myokardu a žliaz s vnútornou sekréciou a Schumacher v roku 1964 aj postihnutie kĺbov. Spoločnou príčinou týchto závažných zmien je dedičná porucha metabolizmu železa, ktorá sa klinicky prejavuje až v dospelosti, obyčajne po 40. - 50. roku života. V dobe klinickej manifestácie choroby je obsah železa v organizme už 15 - 20násobne zvýšený v porovnaní s jeho obsahom (3 - 5 g) u zdravého dospelého človeka [1,2].
Záujem o túto chorobu opäť výrazne stúpol po objavení génu HFE v roku 1996. Gén kóduje transmembránový proteín enterocytov duodéna, ktorý sa viaže na transferínový receptor a zvyšuje jeho afinitu k transferínu saturovanému železom. Zistenie, že viac ako 80 % pacientov s hereditárnou hemochromatózou sú homozygoti na mutáciu C282Y charakterizovanú zámenou cysteínu za tyrozín v 282. polohe génového produktu otvorila možnosť priamej molekulovej diagnostiky tohto stavu v klinickej praxi [2].
Zároveň sa ukázalo, že táto forma hereditárnej hemochromatózy (označená aj ako HH typ 1) nie je zriedkavá porucha metabolizmu železa, ako sa to v minulosti predpokladalo, ale naopak, je jednou z najčastejších dedičných chorôb u ľudí európskeho pôvodu. Platí to aj pre slovenskú populáciu, v ktorej je asi každý tisíci (1000. až 1200.) človek homozygotom na túto mutáciu a žije preto so zvýšeným rizikom hromadenia železa v organizme [3,4]. Ešte častejšie sa vyskytuje toto ochorenie v Českej republike, kde sa frekvencia C282Y homozygotov odhaduje na 0,11 - 0,15 % [5,6]. Zriedkavejšie môže byť choroba podmienená mutáciami iných génov včítane génu hemojuvelinu (HH typ 2A), hepcidínu (HH typ 2B), transferínového receptora (HH typ 3), feroportínu (HH typ 4), a H subjednotky feritínu (HH typ 5) [7].
Hereditárnu hemochromatózu je potrebné odlišovať od sekundárnych foriem hromadenia železa v organizme (označujú sa ako „hemosiderózy“), ktoré vznikajú najmä po opakovaných transfúziách krvi, pri chronických ochoreniach pečene alebo po dlhodobom podávaní preparátov železa.
Objavenie mutácií génu HFE a zavedenie molekulovej diagnostiky výrazne zmenilo pri tejto chorobe diagnostické postupy. Kým donedávna patrila biopsia pečene k štandardnému postupu pri diagnostike tohto stavu, jej diagnostický význam sa zavedením genetického testovania výrazne obmedzil [8]. Dôležitosť včasnej neinvazívnej molekulovej diagnostiky hereditárnej hemochromatózy podčiarkuje aj dostupnosť jednoduchej, lacnej a účinnej liečby tohto ochorenia, ktorá spočíva v opakovaných venesekciách. Napriek obrovskému nárastu nových informácii o tejto progresívnej a závažnej, no pri včasnej diagnostike plne liečiteľnej chorobe, sme pri rešerši slovenskej literatúry na MEDLINE našli o tejto problematike iba ojedinelé kazuistické správy. Preto považujeme za potrebné referovať o našich skúsenostiach v molekulovej diagnostike 29 prípadov ochorenia, zistených počas selektívneho skríningu na HH typ 1 a zároveň zhodnotiť indikačné kritériá na uskutočnenie tohto vyšetrenia.
Metódy a pacienti
Do štúdie sme zaradili 500 pacientov, ktorí boli v období od januára roku 1999 do marca roku 2005 svojimi ošetrujúcimi lekármi poukázaní na genetické testovanie pre hereditárnu hemochromatózu. U každého pacienta sa štandardnými metódami určovali parametre metabolizmu železa (sérová koncentrácia železa, saturácia transferínu, celková väzobná kapacita pre železo (TIBC), nesaturovaná väzobná kapacita pre železo (UIBC) a tiež koncentrácia feritínu v sére). Na analýzu DNA sa odobrala vzorka 3 - 5 ml periférnej krvi do 0,5 ml 0,5 M EDTA, genomová DNA bola izolovaná a skladovaná pri -20 °C až do vyšetrenia.
V priebehu 5-ročného obdobia sa vyšetrili vzorky krvi od 500 pacientov s rovnakým zastúpením oboch pohlaví, ktorí boli poukázaní svojimi ošetrujúcimi lekármi s podozrením na hereditárnu hemochromatózu. Analýza DNA bola u 212 z nich (42,2 %) indikovaná v rámci diferenciálnej diagnostiky ochorení pečene - najčastejšia pracovná diagnóza bola hepatopatia nejasnej etiológie (59 %) a cirhóza pečene (31,6 %), menej často sa vyskytovala diagnóza chronickej hepatitídy (9,4 %). V druhej podskupine 245 osôb (49,2 %) uviedli lekári pri indikovaní vyšetrenia na prvom mieste hematologickú diagnózu (najmä hypersiderémiu nejasnej etiológie).
V prvej časti referovaného obdobia sa analýza DNA uskutočňovala na základe klinických príznakov a jednorazového nálezu zvýšenej saturácie transferínu či feritínu. V nasledujúcom období sa použil modifikovaný diagnostický algoritmus, podľa ktorého sa na vykonanie analýzy DNA okrem klinického podozrenia vyžadovala aj opakovaným vyšetrením potvrdená zvýšená saturácia transferínu nad 45 %.
Analýza DNA sa uskutočnila v Laboratóriu klinickej a molekulovej genetiky 2. detskej kliniky LFUK a DFNsP metódou polymerázovej reťazovej reakcie (PCR) s následnou analýzou veľkosti reštrikčných fragmentov.
Vyšetrenie mutácie C282Y: z izolovanej DNA sa amplifikoval región cieľového úseku DNA metódou PCR pomocou primerov C282YF: 5´TGG CAA GGG TAA ACA GAT CC 3´ a C282YR: 5´CTC AGG CAC TCC TCT CAA CC3´ [2]. Amplifikovaný fragment s veľkosťou 393 párov báz (pb) sa štiepil reštriktázou RsaI a výsledok sa vyhodnotil elektroforetickou separáciou fragmentov DNA na agarózovom géle. Pri normálnom genotype sa zistili 2 fragmenty s veľkosťou 251 a 142 pb, u homozygotov na mutáciu boli prítomné 3 fragmenty s veľkosťou 251, 112 a 30 pb, kým prítomnosť všetkých štyroch fragmentov (251, 142, 112 a 30 pb) svedčila o heterozygotnom nosičstve mutácie.
Vyšetrenie mutácie H63D: región cieľového úseku sa amplifikoval metódou PCR pomocou primerov: H63DF: 5´ ACA TGG TTA AGG CCT GTT GC 3´ a H63DR: 5´ CTT GCT GTG GTT GTG ATT TTC C 3´ [2]. Amplifikovaný fragment s veľkosťou 294 pb sa štiepil reštriktázou Dpn II a výsledok sa vyhodnotil elektroforetickou separáciou fragmentov DNA na agarózovom géle. Pri normálnom genotype sa znázornili 3 fragmenty s veľkosťou 138, 99 a 57 pb, u homozygotov na mutáciu boli prítomné 2 fragmenty s veľkosťou 237 a 57 pb, kým prítomnosť všetkých štyroch fragmentov (237, 138, 99 a 57 pb) svedčila o heterozygotnom nosičstve mutácie.
Kvantitatívne premenné sa vyjadrili ako priemer ± SE a štatisticky sa hodnotili pomocou t-testu, resp. testu ANOVA. Kvalitatívne premenné sa vyjadrili v percentách a štatisticky sa hodnotili pomocou χ2-testu, resp. Fischerovho exaktného testu (pri menšom počte pozorovaní).
Všetky vyšetrenia boli v súlade s etickými predpismi a pred analýzou DNA boli pacienti oboznámení s cieľmi vyšetrenia a k jeho vykonaniu sa vyžiadal ich informovaný súhlas.
Výsledky
Celkovo sme molekulovo-genetickým vyšetrením zistili homozygotný stav na mutáciu C282Y u 29 (5,8 %) pacientov. Týchto 29 osôb s výraznou prevahou mužov tvorí doteraz najväčší súbor s danou chorobou v slovenskej literatúre. Heterozygotný stav sa zistil u 85 (17 %) osôb, z nich 10 pacientov bolo dvojitých heterozygotov pre mutácie C282Y a H63D génu HFE (2 %). U ostatných 386 osôb sme prítomnosť mutácie C282Y génu HFE nedokázali.
Priemerný vek homozygotov na mutáciu C282Y bol v čase diagnózy 49,3 roka (medián 51, rozsah 17 - 70 rokov), väčšinu pacientov tvorili muži (v pomere 22/7). Väčšina mala pokročilé orgánové postihnutie - zobrazovacími a/alebo histologickými metódami bolo dokázané poškodenie pečene u 22 pacientov, z toho 10 pacientov bolo vedených pod diagnózou hepatopatie nejasnej etiológie, 5 malo sonografický nález steatózy pečene, u 5 bola hlavnou diagnózou cirhóza pečene a 2 pacienti mali chronickú hepatitídu (1 pacient hepatitídu B a 1 hepatitídu C). Ďalej sa pomerne často sa vyskytoval diabetes mellitus alebo porucha glukózovej tolerancie (10 pacientov). Prejavy postihnutia kardiovaskulárneho systému (kardiomyopatia) boli prítomné u dvoch osôb, postihnutie kĺbov u 9 pacientov, bronzový kolorit kože sa zistil u 9 jednotlivcov. Ženy homozygotky mali miernejšie fenotypické prejavy ochorenia, čo u nich korelovalo s nižšími hladinami sérového železa a feritínu (tab. 1). Zo 7 žien bolo 42,9 % premenopauzálnych, z toho len 1 mala klinické príznaky hemochromatózy. Z postmenopauzálnych žien [4] mali 3 hemochromatózu s príznakmi hepatopatie.
Tab. 1. Parametre metabolizmu železa u 29 homozygotév pre mutáciu C282Y génu HFE. 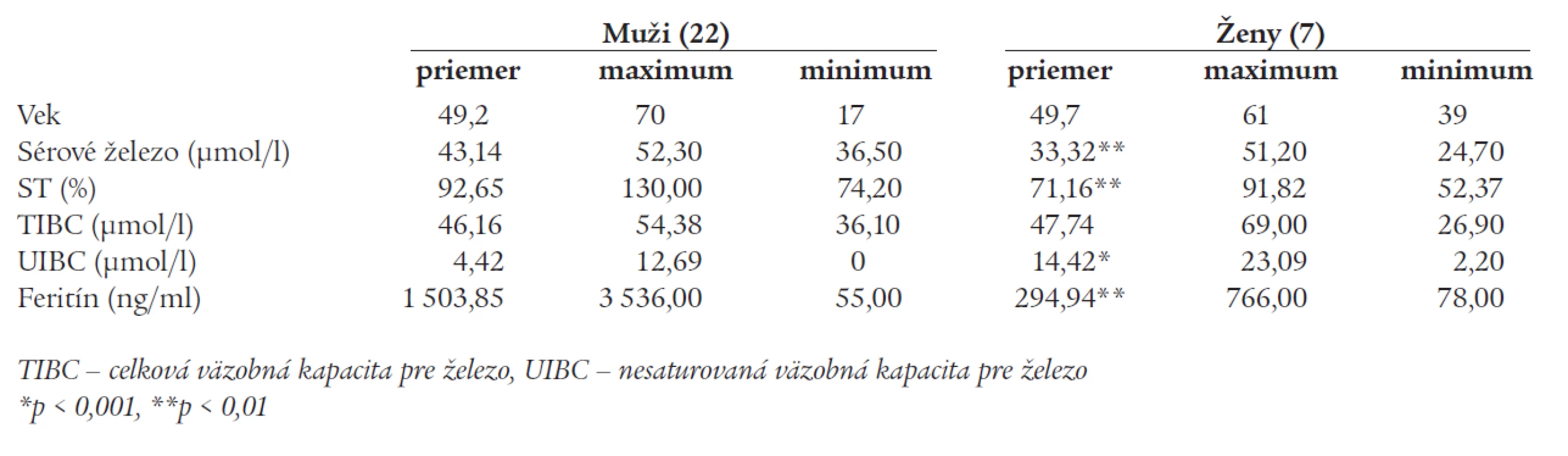
U 10 zmiešaných heterozygotov C282Y/H63D bol indikáciou ku genetickému vyšetreniu nález hypersiderémie, prípadne v kombinácii s hepatopatiou neznámej etiológie (6 pacienti), resp. artropatiou (2 pacienti).
Diagnostická efektivita analýzy DNA sa líšila signifikantne (p < 0,001) v závislosti od iniciálnej klinickej diagnózy. V skupine 212 pacientov poukázaných v rámci diferenciálnej diagnostiky ochorenia pečene bolo identifikovaných 22 homozygotov a 12 heterozygotov pre mutáciu C282Y a tiež 5 zmiešaní heterozygoti C282Y/H63D. V druhej podskupine 245 osôb, ktorí boli poukázaní ošetrujúcimi lekármi pre hematologickú diagnózu, sme identifikovali 5 homozygotov a 36 heterozygotov na mutáciu C282Y a tiež 5 zmiešaných heterozygotov C282Y/H63D. Genetickým skríningom rodinných príslušníkov C282Y homozygotov (n = 43) boli zachytení 2 homozygoti pre mutáciu C282Y, 10 heterozygotov pre túto mutáciu a jeden zmiešaný heterozygot C282Y/H63D.
Efektivita genetického vyšetrenia sa však menila v závislosti od použitých fenotypických kritérií na vykonanie analýzy DNA. V prvej časti referovaného obdobia, kedy sa analýza DNA uskutočňovala už na základe klinických príznakov a jednorazového nálezu zvýšenej saturácie transferínu či feritínu, sa homozygotný stav diagnostikoval v 10 z 369 prípadov. V nasledujúcom období sa použil modifikovaný diagnostický algoritmus, podľa ktorého sa na vykonanie analýzy DNA okrem klinického podozrenia vyžadovala aj opakovaným vyšetrením potvrdená zvýšená saturácia transferínu nad 45 % (schéma 1). Pri tomto postupe sa z 88 pacientov zachytilo 17 homozygotov, čo znamená viac ako 7-násobné zvýšenie výťažnosti analýzy DNA (p < 0,001).
Schéma. Skríningový algoritmus pre hereditárnu hemochromatózu. 
Parametre metabolizmu železa (saturácia transferínu, nesaturovaná väzobná kapacita pre železo a koncentrácia sérového feritínu) sa hodnotili v závislosti od genotypu a tiež od pohlavia vyšetrených osôb. Homozygoti pre mutáciu C282Y mali signifikantne vyššiu priemernú saturáciu transferínu v porovnaní s heterozygotmi na túto mutáciu (p < 0,001), s osobami s genotypom C282Y/H63D (p < 0,05), ako aj s pacientmi bez dokázanej mutácie (p < 0,001). Hodnoty voľnej väzobnej kapacity pre železo boli signifikantne nižšie u homozygotov pre mutáciu C282Y v porovnaní s ostatnými genotypovými skupinami. Aj priemerná koncentrácia sérového feritínu bola u C282Y homozygotov signifikantne vyššia, než u dvojitých heterozygotov C282Y/H63D (p < 0,001), u heterozygotov pre mutáciu C282Y (p < 0,001), resp. u pacientov bez prítomnosti mutácie (p < 0,001), tab. 2.
Tab. 2. Priemerné hodnoty saturácie transferínu (ST), nesaturovanej väzobnej kapacity pre železo (UIBC) a sérového feritínu podľa genotypu génu HFE. Údaje sú uvedené ako priemer ± SE. 
Diskusia
Cieľom danej práce bolo aplikovať cielený molekulovo-genetický skríning HH typ 1 v našej klinickej praxi a zároveň určiť indikačné kritériá pre jeho vykonávanie. V priebehu 5-ročného obdobia sme potvrdili homozygotný stav na mutáciu C282Y u 5,8 % z 500 osôb poukázaných ošetrujúcimi lekármi na genetické vyšetrenie v rámci diferenciálnej diagnostiky hepatopatie, resp. hypersiderémie nejasnej etiológie. Keďže ide o selektívnu skupinu pacientov, výskyt homozygotov je výrazne vyšší než je ich prevalencia v slovenskej populácii, ktorá sa odhaduje na 0,1 % [3].
Týchto nami diagnostikovaných 29 homozygotov tvorí doteraz najväčší súbor pacientov s danou chorobou v slovenskej literatúre. Prevaha mužov medzi identifikovanými homozygotmi je v súlade s literárnymi údajmi a môže svedčiť o zníženej penetrancii ochorenia u žien (pravdepodobne následkom strát železa v priebehu života menštruačnými krvácaniami, pri graviditách, pôrodoch a laktáciou) [9]. Priemerný vek homozygotov na mutáciu C282Y bol v čase diagnózy 49,3 roka a bol takmer rovnaký u mužov ako u žien (49,2 vs 49,7 roka). Rozdiel v penetrancii ochorenia medzi pohlaviami bol výrazne vyznačený, až 90,9 % homozygotných mužov malo klinické príznaky hemochromatózy, u žien bolo toto percento nižšie (57,1 %, p < 0,05). Manifestná hemochromatóza bola častejšia u postmenopauzálnych žien, čo súhlasí s údajmi o neskoršom nástupe ochorenia u tohto pohlavia. Najmladší pacient mal v čase diagnózy len 17 rokov a bol diagnostikovaný na základe opakovane zvýšenej saturácie transferínu, klinické príznaky ochorenia u neho ešte neboli prítomné. Pacienti boli v čase stanovenia diagnózy v rôznych štádiách ochorenia a mali variabilné klinické prejavy z akumulácie železa v organizme. Príznaky poškodenia pečene boli prítomné u viac ako 75 % homozygotov, menej často sa vyskytoval diabetes mellitus, resp. porucha glukózovej tolerancie bez porušenia exokrinnej funkcie pankreasu, artropatia a kardiomyopatia. Bronzové sfarbenie kože sa manifestovalo u menej než 50 % homozygotov.
Hereditárna hemochromatóza typ 1 spĺňa viaceré kritériá na zavedenie plošného skríningu: ide o časté ochorenie s dlhou presymptomatickou fázou a následným progresívnym orgánovým poškodením, existuje pomerne lacný neinvazívny diagnostický test v podobe analýzy DNA a je známa aj jednoduchá, lacná a efektívna liečba (púšťanie krvi, flebotómia), ktorá sa úspešne používa v terapii tohto stavu už vyše 50 rokov [10,11]. Napriek tomu v súčasnosti zastáva väčšina odborníkov zdržanlivý postoj k jeho zavedeniu [8,12,13]. Ako hlavný argument sa uvádza genetickými a pravdepodobne aj environmentálnymi faktormi podmienená relatívne nízka penetrancia ochorenia a z nej vyplývajúce potenciálne etické problémy. Skutočne, iba u asi 50 % mužov a 25 % žien homozygotných pre mutáciu C282Y génu HFE sa vyvinie klinicky manifestné ochorenie [14,15] a niektorí autori dokonca udávajú ešte nižšie percentá [16,17].
Preto sa skôr uprednostňuje cielený, selektívny skríning hereditárnej hemochromatózy typ 1 na základe fenotypových prejavov v skupinách pacientov, ktorí sú potencionálne ohrození akumuláciou železa v organizme, ako napr. osoby s chronickými chorobami pečene a chronickými anémiami. Najčastejšie používaným skríningovým testom je určenie saturácie sérového transferínu (ST). Senzitivita a špecificita saturácie ST pri určovaní homozygotnosti na mutáciu C282Y sa mení v závislosti od zvolených prahových hodnôt, ktoré sa pohybujú v rozsahu medzi 45 % a 70 % - pri vyšších hodnotách saturácie ST je špecificita vyššia, kým pri nižších hodnotách sa zase zvyšuje pravdepodobnosť, že sa zachytia aj pacienti vo včasných štádiách s menej pokročilým orgánovým poškodením [18,19,20]. Rovnako spoľahlivým markerom môže byť aj nesaturovaná väzobná kapacita pre železo (UIBC) v sére, avšak optimálna prahová hodnota nebola ani pre tento test doteraz určená [21]. Z druhej strany, koncentrácia sérového feritínu nie je spoľahlivým markerom ochorenia, ale v spojitosti so saturáciou transferínu môže byť užitočná pre hodnotenie účinnosti flebotomickej liečby [8].
Naše skúsenosti svedčia v prospech selektívneho genetického skríningu na základe hematologických fenotypových prejavov (najmä hodnôt saturácie transferínu). Efektivita relatívne nákladnej analýzy DNA sa až 7-násobné zvýšila po zavedení diagnostického algoritmu, podľa ktorého sa k vykonaniu analýzy DNA požadovala okrem klinického podozrenia aj opakovaným vyšetrením potvrdená zvýšená saturácia sérového transferínu (schéma 1). Zistili sme pritom signifikantný rozdiel (p < 0,001) pri porovnaní výťažnosti genetického vyšetrenia u pacientov s opakovane zvýšenou hodnotou saturácie sérového transferínu nad 45 % oproti tým, ktorí túto podmienku nemali splnenú. Zaujímavým zistením bolo, že rozdiel v saturácii ST medzi pohlaviami bol zistený v našom súbore len u pacientov homozygotných pre mutáciu C282Y a u zmiešaných heterozygotov C282Y/H63D. U pacientov heterozygotných pre mutáciu C282Y a u pacientov bez prítomnosti mutácie sme takýto jav nepozorovali. Vysvetľujeme to rozdielnym stupňom akumulácie železa pri primárnej a sekundárnej hemochromatóze, pričom rozdiel medzi pohlaviami v miere preťaženia železom je zreteľný len u primárnej (hereditárnej) formy hemochromatózy.
Existuje zhoda v tom, že selektívny genetický skríning je potrebné uskutočňovať aj u rodinných príslušníkov pacientov homozygotov na mutáciu C282Y, najmä u ich súrodencov, u ktorých je 25% pravdepodobnosť, že zdedia obidve mutované alely. Naopak, vyšetrenia pri ochoreniach, ktoré sa často vyskytujú aj u pacientov s hereditárnou hemochromatózou (napr. diabetes mellitus 2. typu, artropatie a kardiovaskulárne ochorenia) nedokázali výraznejší rozdiel v zastúpení mutácií C282Y a H63D génu HFE v porovnaní s kontrolnou populáciou, a preto sa selektívny skríning na hemochromatózu v uvedených skupinách ochorení v súčasnosti neodporúča [13,22].
Klinický význam heterozygotného nosičstva mutácie génu C282Y, ktoré sme dokázali u 75 osôb, nie je jednoznačne určený. Za normálnych okolností nie je nosičstvo mutácie C282Y rizikové pre vznik hemochromatózy, avšak klinicky manifestné ochorenie sa môže rozvinúť aj C282Y heterozygotov v koexistencii s výskytom iných ochorení, ako sú chronické ochorenia pečene, porphyria cutanea tarda a alkoholizmus, ktoré taktiež vedú k zvýšeniu množstva železa v pečeni [9]. Frekvencia heterozygotov pre mutáciu C282Y bola v našom súbore 17 %, čo je viac ako trojnásobok oproti bežnej populácii na Slovensku (5,5 %) [3]. Tento rozdiel poukazuje na vplyv mutácie na zvýšené vstrebávanie železa a jej nosičstvo je preto jedným z rizikových faktorov pre vznik hemochromatózy.
Niektoré práce zistili dvojnásobne zvýšené riziko infarktu myokardu u mužov heterozygotov a tiež zvýšené riziko exitu z kardiovaskulárnych príčin u žien heterozygotiek pre mutáciu C282Y [23,24]. Iné údaje však nedokázali potvrdiť podstatný zdravotný dopad nosičstva mutácie [23]. K nim môžeme zaradiť aj naše pozorovanie o identickom zastúpení heterozygotov C282Y v kontrolnej populácii mladších jednotlivcov a osôb starších ako 80 rokov [25]. V budúcnosti sú preto potrebné ďalšie práce na definitívne zhodnotenie možného negatívneho vplyvu heterozygotného stavu vo vývoji niektorých kardiovaskulárnych ochorení ako aj predpokladaného protektívneho pôsobenia tejto mutácie proti anemizácii, napr. u pacientov s celiakiou. Ďalšie práce si vyžaduje aj overenie efektu interakcie mutácie C282Y s inými genetickými faktormi v patogenéze niektorých multifaktorálnych stavov.
Mutácia H63D génu HFE nezabraňuje väzbe HFE proteínu na β2-mikroglobulín, a preto majú H63D homozygoti len mierne zvýšenú akumuláciu železa v organizme. V súčasnosti sa uvažuje o tom, že mutácia H63D má malý, ak vôbec nejaký klinický význam a samotná nemôže zapríčiniť nadmerné hromadenie železa v organizme [27,28]. Na základe týchto poznatkov sme mutáciu H63D v našom súbore vyšetrovali len u pacientov s dokázanou mutáciou C282Y v homozygotnom alebo heterozygotnom stave. Identifikovali sme 10 pacientov s týmto genotypom, pričom hypersiderémia nebola natoľko výrazná ako u pacientov homozygotných pre mutáciu C282Y génu HFE a klinické príznaky ochorenia boli miernejšie. Na základe našich výsledkov a literárnych údajov sa dá usudzovať, že genotyp C282Y/H63D je samotný v porovnaní s genotypom C282Y/C282Y menej rizikovým pre vznik hemochromatózy. Jeho význam pre vznik klinicky manifestného ochorenia z preťaženia železom sa môže prejaviť najmä u pacientov, ktorí sú ohrození sekundárnou hemochromatózou.
Včasná diagnostika predstavuje rozhodujúci moment pre prognózu pacienta. Názory odborníkov sa zhodujú v tom, že včasná diagnostika a primeraná liečba dedičnej hemochromatózy terapeutickými flebotómiami zabraňuje hromadeniu železa, a tým aj vzniku závažných komplikácií ochorenia a pacienti majú normálnu dĺžku prežívania. Flebotómie zlepšujú kvalitu života a môžu mať vplyv na jeho predĺženie aj u pacientov s ireverzibilnými komplikáciami, akými sú cirhóza pečene alebo diabetes mellitus [29,30,31,32].
Na základe našich výsledkov odporúčame genetický skríning hereditárnej hemochromatózy u jedincov s nálezom opakovane zvýšenej saturácie transferínu, a to aj pri predpokladanej sekundárnej etiológii hemochromatózy. Genetické vyšetrenie je plne indikované aj u prvostupňových príbuzných homozygotov na mutáciu C282Y génu HFE.
Poďakovanie: Autori ďakujú doc. MUDr. Hrušovskému, MUDr. Pavlíkovej, doc. MUDr. Szántovej, MUDr. Ďurovčíkovej, MUDr. Králikovi, MUDr. Lipšicovej, MUDr. Megovi, MUDr. Šaušovi, MUDr. Hlinšťákovej, MUDr. Valkovi (Bratislava), MUDr. Bačíkovej (Nové Mesto nad Váhom), MUDr. Tomusovi, MUDr. Cisárikovi (Žilina), MUDr. Harmatovej (Bojnice), MUDr. Feketemu (Dunajská Streda), MUDr. Kantarskej (Banská Bystrica), MUDr. Šimekovi (Nitra), MUDr. Ševčíkovi (Trenčín) a MUDr. Hirjakovi (Michalovce) za poskytnutie klinických a laboratórnych údajov svojich homozygotných pacientov.
Táto práca sa uskutočnila vďaka podpore grantu VEGA-1/0525/03.
MUDr. Jozef Zlocha
Laboratórium klinickej a molekulovej genetiky, 2. detská klinika LF UK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: zlocha@dfnsp.sk
Doručeno do redakce: 7. 1. 2006
Přijato po recenzi: 28. 2. 2006
Zdroje
1. Powwel LW, Jazwinska E, Halliay JW. Primary iron overload. In: Brock JH, Halliday JW, Pippard MJ et al (eds). Iron Metabolism in Health and Disease. Philadelphia: WB Saunders 1994 : 227-270.
2. Feder JN, Gnirke A, Thomas W et al. A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis. Nat Genet 1996; 13 : 399-408.
3. Kovács L, Kuba D, Phillips JA. Herditárna hemochromatóza a hereditárna trombofília - naše „európske dedičstvo“? Med Monitor 1998, 12-15.
4. Zlocha J, Pažgayová S, Zacharová B et al. Význam Analýzy DNA v diferenciálnej diagnostike hereditárnej hemochromatózy. Lek Obzor 2003; 2 : 40-44.
5. Cimburova M, Putova I, Provaznikova H et al. Hereditary hemochromatosis: detection of C282Y and H63D mutations in HFE gene by means of guthrie cards in population of Czech Republic. Genet Epidemiol 2002; 23 : 260-263.
6. Půtová I, Čimburová M, Jarošová K et al. Mutace v genu HFE u osob s revmatickým postižením. Čas Lék Čes 2005; 144 : 391-398.
7. Siah CW, Trinder D, Olynyk JK. Iron overload. Clin Chim Acta 2005; 358 : 24-36.
8. McCullen MA, Crawford DH, Hickman PE Screening for hemochromatosis. Clin Chim Acta 2002; 315 : 169-186.
9. Powell LW, George DK, McDonnell SM et al. Diagnosis of hemochromatosis. Ann Intern Med 1998; 129 : 925-931.
10. Barton JC, McDonnell SM, Adams PC et al (Hemochromatosis Management Working Group). Management of hemochromatosis. Ann Intern Med 1998; 129 : 932-939.
11. Davis WD, Arrowsmith WR. The effect of repeated phlebotomies in hemochromatosis: report of three cases. J Lab Clin Med 1952; 39 : 526-532.
12. Brandhagen DJ, Fairbanks VF, Baldus W Recognition and management of hereditary hemochromatosis. Am Fam Physician 2002; 65 : 853-860.
13. Hanson EH, Imperatore G, Burke W. HFE gene and hereditary hemochromatosis: a HuGE review. Human Genome Epidemiology. Am J Epidemiol 2001; 154 : 193-206.
14. Crawford DH, Jazwinska EC, Cullen LM et al. Expression of HLA-linked hemochromatosis in subjects homozygous or heterozygous for the C282Y mutation. Gastroenterology 1998; 114 : 1003-1008.
15. Niederau C, Niederau CM, Lange S et al. Screening for hemochromatosis and iron deficiency in employees and primary care patients in Western Germany. Ann Intern Med 1998; 128 : 337-345.
16. McCune CA, Al-Jader LN, May A et al. Hereditary hemochromatosis: only 1% of adult HFE C282Y homozygotes in South Wales have a clinical diagnosis of iron overload. Hum Genet 2002; 111 : 538-543.
17. David V, Moirand R, Le Gall JY et al. Preliminary studies before systematic screening of hemochromatosis: prevalence and penetrance of C282Y homozygosity. Am J Hum Genet 1999; 65: A213.
18. Phatak PD, Sham RL, Raubertas RF et al. Prevalence of hereditary hemochromatosis in 16031 primary care patients. Ann Intern Med 1998; 129 : 954-961.
19. Witte DL, Crosby WH, Edwards CQ et al. Practice guideline development task force of the College of American Pathologists. Hereditary hemochromatosis. Clin Chim Acta 1996; 245 : 139-200.
20. McDonnell SM, Phatak PD, Felitti V et al. Screening for hemochromatosis in primary care settings. Ann Intern Med 1998; 129 : 962-970.
21. Murtagh LJ, Whiley M, Wilson S et al. Unsaturated iron binding capacity and transferrin saturation are equally reliable in detection of HFE hemochromatosis. Am J Gastroenterol 2002; 97 : 2093-2099.
22. Worwood M. HFE mutations as risk factors in disease. Best Pract Res Clin Haematol 2002; 15 : 295-314.
23. Rasmussen ML, Folsom AR, Catellier DJ et al. A prospective study of coronary heart disease and the hemochromatosis gene (HFE) C282Y mutation: the Atherosclerosis Risk in Communities (ARIC) study. Atherosclerosis 2001; 154 : 739-746.
24. Tuomainen TP, Kontula K, Nyyssonen K et al. Increased risk of acute myocardial infarction in carriers of the hemochromatosis gene Cys282Tyr mutation: a prospective cohort study in men in eastern Finland. Circulation 1999; 100 : 1274-1279.
25. Hetet G, Elbaz A, Gariepy J et al. Association studies between haemochromatosis gene mutations and the risk of cardiovascular diseases. Eur J Clin Invest 2001; 31 : 382-388.
26. Dúbrava M, Kovács L, Zacharová B. Hereditárna hemochromatóza - fikcia alebo potrebná diferenciálna diagnostická alternatíva aj pre geriatrického pacienta? Geriatria 2000; 6 : 7-12.
27. Gochee PA, Powell LW, Cullen DJ et al. A population-based study of the biochemical and clinical expression of the H63D hemochromatosis mutation. Gastroenterology 2002; 122 : 646-651.
28. Galhenage SP, Vialla CH, Olynyk JK Screening for hemochromatosis: patients with liver disease, families and populations. Curr Gastroenterol Rep 2004; 6 : 44-51.
29. Adams PC, Speechley M, Kertesz A Long Term Survival Analysis in Hereditary Hemochromatosis. Gastroenterology 1991; 101 : 368-372.
30. Niederau C, Fischer R, Pürschel A et al. Long-term Survival in Patients with Hereditary Hemochromatosis. Gastroenterology 1996; 110 : 1107-1119.
31. Niederau C, Fischer R, Sonnenberg A et al. Survival and causes of death in cirrhotic and in noncirrhotic patients with primary hemochromatosis. N Engl J Med 1985; 313 : 1256-1262.
32. Powell LW. Hemochromatosis: precirrhotic therapy restores normal life expectancy. Hepatology 1986; 6 : 1423-1425.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Katetrizační ablace komorových tachykardií provázejících strukturní onemocnění srdce: editorialČlánek Význam endokanabinoidního systému v modulaci kardiometabolických rizikových faktorů – editorialČlánek Trimetazidin v léčbě stabilní anginy pectoris. TRIADA - (TRImetazidine in stable Angina twice DAily)Článek Jaderné receptory PPARα
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Katetrizační ablace komorových tachykardií provázejících strukturní onemocnění srdce: editorial
- Trimetazidin v léčbě stabilní anginy pectoris: editorial
- Trimetazidin - modulátor energetického metabolizmu myokardu: editorial
- Význam endokanabinoidního systému v modulaci kardiometabolických rizikových faktorů – editorial
- Biologická léčba revmatických onemocnění: editorial
- Srovnání plazmatických hladin B-natriuretického peptidu s echokardiografickými ukazateli funkce levé komory srdeční po léčbě doxorubicinem
- Obezita a progrese chronické renální insuficience: česká dlouhodobá prospektivní randomizovaná dvojitě slepá multicentrická studie
- Setrvalá monomorfní komorová tachykardie u pacientů se strukturálním postižením srdce. Různé arytmogenní substráty, různé možnosti paliativní nebo kurativní léčby katetrovou ablací v éře trojrozměrného mapování
- Ovlivnění úspěšnosti léčby chronické hepatitidy C hmotností a pohlavím pacienta a výší vstupní viremie
- Prevalence a příčiny refluxu v hlubokém žilním systému dolních končetin s insuficiencí povrchových žil
- Molekulovo-genetická diagnostika a skríning hereditárnej hemochromatózy
- Trimetazidin v léčbě stabilní anginy pectoris. TRIADA - (TRImetazidine in stable Angina twice DAily)
- Význam endokanabinoidního systému v modulaci kardiometabolických rizikových faktorů
-
Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob II.
Sumoylace a neddylace jako posttranslační modifikace proteinů podobné ubikvitinylaci a jejich význam - Jaderné receptory PPARα
- Biologická terapie revmatických onemocnění
- Chronické ochorenie obličiek a gravidita: kazuistika
- Posttransplantační lymfoproliferace u nemocného s intenzivní imunosupresí: kazuistika
-
Doporučený postup pro diagnostiku a léčbu hepatorenálního syndromu
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E.Purkyně - Teplan V et al. Praktická nefrologie. 2., zcela přepracované a doplněné vydání. Praha: Grada Publishing 2006. 496 stran. ISBN 80-247-1122-2.
- Benáková N. Ekzémy a dermatitidy. Praha: Maxdorf 2006. 125 stran. ISBN-80-7345-078-X.
- XXV. Dny mladých internistů v Martině
- XIII. medzinárodný kongres pre metabolizmus a výživu pri chorobách obličiek, 28. februára - 4. marca 2006, Mérida, Yucatán (Mexiko)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaderné receptory PPARα
- Prevalence a příčiny refluxu v hlubokém žilním systému dolních končetin s insuficiencí povrchových žil
- Setrvalá monomorfní komorová tachykardie u pacientů se strukturálním postižením srdce. Různé arytmogenní substráty, různé možnosti paliativní nebo kurativní léčby katetrovou ablací v éře trojrozměrného mapování
- Molekulovo-genetická diagnostika a skríning hereditárnej hemochromatózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



