-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: II. Léčba
Hyperphosphataemia as an important complication of chronic renal insufficiency and chronic renal failure, part 2 – treatment
Hyperphosphataemia is a commonly found complication of severe renal insufficiency. However, minor disturbances of calcium-phosphate metabolism are encountered in mild to moderate renal insufficiency and, as a result, can be found in up to 5% of population. They lead not only to renal bone disease but also to extraosseal calcifications (including the vascular ones) and increase in mortality rate. Their impact on the patients’ quality of life is very significant, too. The treatment of hyperphosphataemia is closely associated with the therapy of renal bone disease. It consists in dietary restrictions, the use of a constantly widening range of phosphate binders, active metabolites of vitamin D and their analogues, therapy of metabolic acidosis, customising dialysis regimen in dialysed patients and surgical treatment atadvanced stages of secondary hyperparathyreoidism. This represents a long-term treatment that should be conducted by nephrologists in patients with moderate to severe renal insufficiency and by internists in patients with mild renal insufficiency. This paper gives details pertaining to all the kinds of hyperphosphataemia treatment including the concrete medication available. Finally, therapeutic recommendations for all the types of calcium-phosphate metabolism disturbances are given. These recommendations are based on the up-to-date treatment standards as well as the author’s own clinical experience.
Key words:
hyperphosphataemia – renal bone disease – hyperparathyroidism – renal insufficiency – haemodialysis – phosphate binders
Autoři: J. Smržová
Působiště autorů: Dialyzační a nefrologické oddělení Interní gastroenterologické kliniky Lékařské fakulty MU a FN Brno, pracoviště Bohunice přednosta prof. MUDr. Petr Dítě, DrSc.
Vyšlo v časopise: Vnitř Lék 2005; 51(3): 337-344
Kategorie: Přehledné referáty
Souhrn
Hyperfosfatemie je pravidelně se vyskytující komplikací pokročilé renální insuficience. Méně závažné poruchy fosfátového metabolizmu však začínají již při lehčím poklesu glomerulární filtrace a postihují tak až 5 % populace. Ve svém důsledku vedou nejen k renální osteopatii, ale i ke vzniku extraoseálních kalcifikací včetně kalcifikací cévních a ke zvýšení mortality. Závažný je i dopad na kvalitu života pacientů. Léčba hyperfosfatemie je úzce spjata s léčbou renální osteopatie. Zahrnuje dietní opatření, stále se rozšiřující škálu vazačů fosfátů, aktivní metabolity vitaminu D a jeho analoga, léčbu metabolické acidózy, u ialyzovaných úpravy dialyzačního režimu a v pokročilých stadiích sekundární hyperparatyreózy pak i chirurgické výkony na příštítných tělíscích. Léčba je dlouhodobá a má být u nemocných se střední až těžkou ledvinnou nedostatečností vedena nefrologem. Pacienti s lehkou ledvinnou nedostatečností jsou většinou léčeni internisty. Sdělení shrnuje všechny současné možnosti léčby hyperfosfatemie a uvádí i dostupné preparáty. V závěru je navržen doporučený terapeutický postup v závislosti na typu poruchy kalciofosfátového metabolizmu. Toto doporučení vychází ze současných standardů léčby a vlastních klinických zkušeností.
Klíčová slova:
hyperfosfatemie – renální osteopatie – hyperparatyreóza – renální insuficience – hemodialýza – vazače fosfátůÚvod
Hyperfosfatemie patří k nejčastěji se vyskytujícím fenoménům u pacientů se selháním funkce ledvin, ale setkáváme se s ní již při méně významné ledvinné nedostatečnosti. Hladina fosforu neoddělitelně souvisí nejen smetabolizmem kalcia a vitaminu D a s ledvinnou kostní chorobou, ale i s účinností dialyzačního léčení a řadou dalších faktorů. Zájem o tuto problematiku v posledních letech výrazně stoupá, neboť se ukazuje, že hyperfosfatemie má velký dopad nejen na morbiditu, ale podle novějších prací i na mortalitu dialyzovaných pacientů. Zatím můžeme pouze spekulovat, že podobné důsledky může mít hyperfosfatemie u skupiny nemocných s renální nedostatečností.
Poruchy metabolizmu fosforu se rozvíjejí již při malém poklesu glomerulární filtrace pod 1 ml/s (středně závažné snížení glomerulární filtrace až selhání ledvin). Podle epidemiologických studií tvoří takoví nemocní kolem 5 % populace, přičemž ve vyšších věkových skupinách je jejich zastoupení výrazně vyšší [19,42]. Řada z těchto pacientů není, a ani nemůže být v péči nefrologa, a proto je nezbytné zvýšit povědomí internistů a všeobecných lékařů o této problematice.
Patofyziologicky jsou poruchy metabolizmu fosforu při ledvinné nedostatečnosti značně komplikované. Při poklesu glomerulární filtrace (GF) pod 1 ml/s dochází k poklesu filtrace fosfátů, což je zprvu kompenzováno snížením jeho zpětné resorpce pod vlivem zvýšené hladiny parathormonu (PTH). Další snižování glomerulární filtrace vede k dalšímu zvyšování sekrece parathormonu, a to nejprve hyperfunkcí a později hyperplazií příštítných tělísek. V této době při GF kolem 1,0–0,8 ml/s dochází snížením aktivity 1α-hydroxylázy k poruše tvorby kalcitriolu v ledvinách, což s sebou přináší pokles absorpce kalcia v zažívacím traktu s následnou hypokalcemií, zvýšení sekrece PTH (přímým působením i nepřímo přes hypokalcemii) a snížení množství receptorů pro kalcitriol (VDR = vitamine D receptor) s dalším omezením účinku kalcitriolu. Zhruba při GF 0,4 ml/s již nedostačuje vylučování fosfátů z těla a rozvíjí se hyperfosfatemie. Hyperparatyreóza navíc uvolňuje fosfor a vápník ze skeletu, a přispívá tak ke zvyšování jejich hladiny. Hyperfosfatemie dále sama tlumí aktivitu 1α-hydroxylázy a stimuluje příštítná tělíska k uvolňování parathormonu a k buněčné proliferaci, čímž se circulus vitiosus uzavírá. Při dalším poklesu glomerulární filtrace se rozvíjí i metabolická acidóza, což výše zmíněné metabolické poruchy zhoršuje. Menší vliv má hypervitaminóza A a retence aluminia, stroncia a fluoridů.
U dialyzovaných nemocných je problémem obtížné odstraňování fosforu jak hemodialýzou, tak peritoneální dialýzou. U obou metod je velmi obtížné dosáhnout vyrovnané bilance fosforu. Po transplantaci ledviny pak případná porucha metabolizmu fosforu závisí mj na úrovni renálních funkcí a na eventuální přítomnosti terciární hyperparatyreózy, ovšem poruchy kostního metabolizmu jsou u těchto nemocných velmi komplexní.
Při hyperfosfatemii se fosfor s vápníkem sráží a usazuje se v cévách, na endotelu srdečních chlopní, v orgánech včetně kůže a v okolí kloubů nemocného, a způsobuje tak cévní kalcifikace, chlopenní vady, extraoseální kalcifikace, svědivku, syndrom červených očí a další. Těmto problémům je lépe předcházet, než je léčit. Léčba pokročilých forem hyperfosfatemie a jejích následků je obtížná a nákladná a její výsledky nejsou uspokojivé.
Zásadní je kontrola přísunu fosforu do organizmu ještě v době mírně snížené funkce ledvin při úrovni glomerulární filtrace kolem 1 ml/s, což může výrazně oddálit rozvoj hyperparatyreózy. Jedná se tedy o dlouhodobou a s výjimkou úspěšné transplantace ledviny prakticky doživotní léčbu. Pacient navíc měsíce či léta nepociťuje žádné obtíže, takže pokud nejsou rozvinuty komplikace, bývá často obtížné ho přimět ke spolupráci. Bez jeho spolupráce jsou však terapeutické možnosti výrazně omezené – na nemocném totiž závisí dodržování diety, užívání léků i jejich správné časování.
Možnosti prevence a léčby hyperfosfatemie
Při prevenci a léčbě hyperfosfatemie se uplatňují dietní opatření, vazače fosfátů, aktivní formy vitaminu D, léčba acidózy, léčba renální osteopatie, úprava dialyzačního režimu a některé další specifické postupy.
Dietní opatření
První krokem v prevenci i léčbě sekundární hyperparatyreózy je restrikce fosfátů v dietě [30]. U pacientů v predialýze zahrnuje toto opatření omezení příjmu bílkovin na 0,6–0,8 g/kg/den podle pokročilosti renální insuficience (výjimečně nebo krátkodobě se uplatňují i přísnější diety) a omezení nebo vynechání látek bohatých na fosfor. Příjem bílkovin je většinou vázán na současný příjem fosfátů. Průměrně přijme pacient na 1 g bílkovin 15 mg (0,5 mmol) fosforu, toto množství ale výrazně kolísá, např. v hovězím mase je 7,3 mg fosforu na 1 g bílkovin, v libovém vepřovém mase 10,1 mg, v telecí kýtě 7,3 mg, v játrech 18,0 mg, v mléce 31,6 mg, v tvarohu 18,5 mg a ve vejcích 16,9 mg (přepočtem z nutričních údajů v [28]).
Účinnost dietních opatření u pacientů v dialyzačním programu je omezená. Vzhledem ke ztrátám proteinů hemodialýzou a především peritoneální dialýzou většinou nelze doporučit přísnější omezení proteinů než na 1,0 g/kg/den. Tím spíše by se proto pacienti měli vystříhat potravin zvláště bohatých na fosfor. Sem patří:
- mléko a mléčné výrobky, ze sýrů především tavené a tvrdé, méně čerstvé sýry typu lučina;
- z masných výrobků játra, paštiky, uzené maso a uzeniny včetně šunky (pro obsah „rychlosoli“), mořské ryby;
- vejce;
- luštěniny včetně sóji a sójového masa, výrobky z celozrnné mouky;
- kakao, čokoláda, ořechy;
- Coca-Cola a některé další sycené nápoje, pivo;
- instantní výrobky – polévky, sušená smetana do kávy, nápoje včetně nápojů z automatu (pro obsah stabilizátorů obsahujících velké množství fosfátů).
Dodržování všech těchto omezení je pro pacienty často mimořádně náročné, a proto je potřebné opakovaně zdůrazňovat jejich důležitost, aby nemocní neztratili motivaci. Nezbytný je opakovaný pohovor s dietní sestrou, nejlépe v přítomnosti člena rodiny, který doma vaří. Současně s dodržováním těchto omezení je totiž nutné zajistit dostatečný energetický příjem a sladit doporučenou dietu s dalšími dietními doporučeními (diabetická dieta, šetřící dieta, dieta se sníženým obsahem tuků). Snaha pacienta vyhovět všem doporučením může někdy vést k těžkému katabolizmu, když nemocný nejí sladké, protože to zakázal diabetolog, tučné a slané, protože to zakázal kardiolog, maso a vejce kvůli bílkovinám a ovoce a zeleninu kvůli draslíku na příkaz nefrologa.
Vazače fosfátů
Dieta s omezením příjmu fosforu může být dostatečná při renální insuficienci lehkého stupně. Při větším poklesu renální funkce je nutné omezit absorpci v potravě přijatého fosforu tzv. vazači fosfátů. Jedná se o sloučeniny, které v gastrointestinálním traktu váží fosfáty do sloučenin nebo komplexů, které jsou nevstřebatelné, a odcházejí proto společně se stolicí. Kalciové vazače fosfátů ovlivňují hyperparatyreózu též mechanizmem zvýšení kalcemie, což
ovšem může vést i k přetížení organizmu vápníkem. K zajištění účinnosti léků je vždy potřebná dobrá spolupráce ze strany pacienta při užívání tablet v průběhu jídla („timing“). Pokud pacient užije lék mezi jídly, vyváže se pouze fosfát přítomný v sekretech gastrointestinálního traktu [27].
K dispozici je několik typů vazačů fosfátů:
1. Vazače fosfátů s obsahem hliníku jsou nejstarší a velmi účinné. V současné době se používají minimálně z důvodu toxicity hliníku, který se u selhání ledvin kumuluje a vede k demenci s myoklony, hypochromní mikrocytární anémii a kostní osteopatii s nízkým obratem. Snad je přípustné krátkodobé použití, bezpečná dávka však neexistuje [25,34]. Tyto preparáty občas bohužel bez znalosti ledvinné funkce předepisují gastroenterologové.
Preparáty: Venter tbl 1 g, grn, Ulcogant susp, grn; v kombinaci s Ca2+ a Mg2+: Gastrogel tbl., Maalox susp., Anacid susp.
2. Kalciové vazače fosfátů jsou nejrozšířenější a nejdostupnější [18]. K dispozici máme calcium carbonicum a calcium aceticum, které je lépe rozpustné a o něco (25 %) účinnější než calcium carbonicum a také hyperkalcemie se při jeho užívání vyskytuje méně často (o 25 %). 1 g kalciumkarbonátu obsahuje 400 mg Ca2+, 1 g kalciumacetátu 253 mg Ca2+. Výhodou kalciumkarbonátu je částečná korekce metabolické acidózy. Kalciumcitrát je kontraindikován pro svou schopnost zvyšovat absorpci aluminia [22].
K uspokojivé kontrole fosfatemie je někdy potřeba vysokých dávek (3–12 g/den CaCO3 nebo 1,5–9 g/den kalciumacetátu), což bývá pacienty špatně snášeno pro zácpu nebo pro velký počet tablet. Vážným nežádoucím účinkem je hyperkalcemie nebo alespoň pozitivní kalciová bilance způsobená částečným vstřebáváním kalcia, proto je bezpodmínečně nutné úzkostlivé monitorování kalcemie, a to zejména při současné léčbě aktivními metabolity vitaminu D [9,31]. Podle novějších studií [4,24] podporují kalciové vazače fosfátů ukládání vápníku extraoseálně – v cévách, orgánech včetně srdce, nebo periartikulárně. U dialyzovaných je možné vyrovnanou bilanci vápníku zajistit používáním dialyzačního roztoku s nižším obsahem Ca2+.
Preparáty: calcium carbonicum: Tbl. calcii carbonici praecipitati 0,5 g, Vitacalcin tbl. 0,25 g, Vitacalcin plv. 3 g, Calcium Nycomed tbl. 0,5 g; calcium aceticum: Calcium-acetate 500 mg Salmon Pharma, Calcium aceticum Pro Renal.
3. Vazače fosfátů na bázi hořčíku, zejména magnesium carbonicum MgCO3, se u nás nepoužívají. Nemocné v predialýze ohrožuje hypermagnezemií, problémem je i laxativní účinek MgCO3. Lze ho kombinovat a kalciovými vazači fosfátů a snižovat tak riziko hyperkalcemie.
4. Vazače fosfátů na bázi lanthanu, konkrétně lanthanum carbonicum zatím u nás nejsou k dispozici, používají se v některých zemích Evropy a v USA. Podle prvních studií se jeví jako dobře snášená bezpečná alternativa kalciových vazačů fosfátů nevyvolávající hyperkalcemii a omezující vznik adynamické kostní nemoci [7,14].
Preparát: Fosrenol tbl.
5. Vazače fosfátů na bázi soli železa Fe3+ se zatím běžně nepoužívají, dosud proběhly pouze krátkodobé studie na malých skupinách pacientů [20]. Tyto sloučeniny by neměly představovat žádné riziko stran kumulace některých prvků nebo sloučenin v organizmu, a naopak by mohly být přínosné při léčbě renální anémie.
6. Vazače fosfátů na bázi pryskyřice – sevelamer hydrochlorid je u nás dostupný od roku 2002. V gastrointestinálním traktu se z něj neuvolňují žádné látky, a je tedy velmi bezpečný [16,29]. Při jeho použití nedochází dle EBCT (electron beam computed tomography) k progresi vaskulárních kalcifikací v koronárních tepnách a předpokládáme, že ani v jiných tepnách [4,24], je signifikantně nižší výskyt hyperkalcemie, což umožní dostatečně agresivní léčbu hyperfosfatemie, regredují též extraoseální kalcifikace. Příznivým vedlejším účinkem sevelameru je pokles celkového cholesterolu a LDL-cholesterolu a zvýšení HDL-cholesterolu. Hladiny triglyceridů nejsou ovlivněny.
I tento vazač fosfátů se musí užívat v dosti vysokých dávkách (2,4 až 9,6 g/den). Nevýhodou je jeho vysoká cena, kdy už při dávce 2,4 g/den se náklady na měsíční léčbu vyšplhají na asi 4 500 Kč. Z tohoto důvodu je možnost jeho preskripce u nás zatím omezená, kritéria se však postupně rozvolňují. Podle sazebníku pojišťovny je léčba hrazena u pacientů, kteří mají:
- hyperfosfatemii > 2,5 mmol/l a hyperkalcemii > 2,7 mmol/l při terapii kalciumkarbonátem i přes použití dialyzačního roztoku s obsahem kalcia 1,25 mmol/l;
- hyperfosfatemii > 3,2 mmol/l či opakovaně > 2,5 mmol/l při nízkofosfátové dietě a adekvátní dialýze s Kt/V > 1,2;
- těžkou hyperparatyreózu indikovanou k paratyreoidektomii a čekají na operaci;
- fosfokalciový produkt > 6,0 mmol2/l2;
- extraoseální kalcifikace a u kterých se při zavedené léčbě bude fosfatemie pohybovat do 2,5 mmol/l.
Kombinace sevelameru s jiným (především kalciovým) vazačem fosfátů může zlepšit kontrolu hyperfosfatemie při sníženém riziku hyperkalcemie a nižších nákladech [26].
Podle nových doporučení K/DOQI (Kidney Disease Outcome Quality Initiative) je podávání sevelameru indikováno u pacientů s fosfatemií > 1,78 mmol/l a kalcemií > 2,55 mmol/l, při extraoseálních kalcifikacích včetně vaskulárních kalcifikací a při hladinách PTH < 15,8 pmol/l (150 pg/ml).
V literatuře se objevují též zmínky o použití colestimidu jako vazače fosfátů [8]. Tento lék se jinak uplatňuje při léčbě hypercholesterolemie. Jeho cena je výrazně nižší než u sevelameru, ovšem horší je jeho tolerance. Účinnost teprve bude muset být posouzena.
Preparát: Renagel cps 800 mg.
Korekce metabolické acidózy
Těžší acidózu je nutno korigovat podáváním natrium bikarbonátu, dávkování léku je velmi individuální. Podle doporučení K/DOQI je cílem léčby dosažení hodnoty aktuálních bikarbonátů > 22 mmol/l, tedy plná korekce metabolické acidózy. Dřívější doporučení byla méně přísná s tolerancí aktuálních bikarbonátů > 19–20 mmol/l, resp. BE < –5 mmol/l [17]. Nicméně je třeba pamatovat na to, že acidóza ovlivňuje kromě kostního metabolizmu i anabolické děje, snižuje srdeční inotropii, prohlubuje hyperkalemii, dlouhodobě se negativně projevuje na anémii atd. [11].
Preparát: Vitar soda 0,5 g tbl.
Optimalizace dialyzačního režimu
Vzhledem k tomu, že fosfor je nejrychleji odstraňován během prvních 2 hodin dialýzy, je výhodnější její častější provedení. U nás bývá problém s úhradou výkonu pojišťovnou častěji než 3krát týdně. Prodloužení dialýzy má význam z důvodu multikompartmentové distribuce fosforu v těle [41]. Nezbytný je kvalitní žilní přístup, nejlépe arteriovenózní fistule s dostatečným krevním průtokem – to je podmínkou dosažení dostatečné účinnosti dialýzy (hodnoceno pomocí Kt/V). Malý krevní průtok fistulí nebo její stenóza s následnou recirkulací krve při dialýze může být i izolovanou příčinou hyperfosfatemie. Proto je u všech pacientů s hyperfosfatemií nezbytné kontrolovat funkčnost fistule nejen klinicky, ale i některou z těchto metod: sonografie a dopplerovské měření průtoku fistulí, měření recirkulace a průtoku pomocí přístroje Crit-line nebo některou z dilučních metod, pravidelným hodnocením URR (urea reduction ratio) a Kt/V (index účinnosti hemodialýzy), v indikovaných případech pak fistulograficky.
K typu dialyzační membrány a typu procedury (hemodialýza versus hemodiafiltrace) nejsou jednoznačná doporučení. Hemodiafiltrace s převažující konvekcí se podle některých jeví k odstranění fosforu o něco výhodnější než hemodialýza [40]. Clearance dialyzátoru pro fosfor (in vitro) se podle údajů výrobců liší, ale in vivo jsou rozdíly nepatrné [15]. K ovlivnění kalcemie můžeme manipulovat i s koncentrací kalcia v dialyzačním roztoku v rozmezí 1,0–1,75 mmol/l.
Léčba zvýšeného uvolňování fosforu z buněk
Důležité je zabránění katabolizmu, který jinak chronicky zvyšuje hyperfosfatemii.
U hyperfosfatemie nádorového původu se podávají protinádorové léky, jejich indikace však spadá do rukou onkologa, a nikoliv nefrologa. Hyperfosfatemie také nepatří ke kritériím, která mají vliv na indikaci a výběr protinádorové léčby.
Léčba sekundární hyperparatyreózy
V prevenci i v léčbě sekundární hyperparatyreózy se uplatňuje především restrikce fosfátů v dietě, zabránění vzniku hypokalcemie a používání aktivních metabolitů vitaminu D. Při pokročilé sekundární hyperparatyreóze má své místo paratyreoidektomie či sklerotizace příštítných tělísek.
Suplementace kalcia
Při hypokalcemii je nezbytné kalcium substituovat, neboť hypokalcemie stimuluje sekreci PTH. Používají se kalciumkarbonát, kalciumacetát a kalciumglukonát; nevhodný je kalciumcitrát (pro riziko zvýšení resorpce aluminia) a kaliumchlorid (zvyšuje sklon k acidóze).
Preparáty: viz výše.
Aktivní metabolity vitaminu D a jejich prekurzory
Nedostatek kalcitriolu přispívá k rozvoji hyperparatyreózy několika mechanizmy – snižuje absorpci kalcia a vede tak k hypokalcemii a následně zvýšené produkci PTH i hyperplazii příštítných tělísek, snižuje citlivost kostí na působení PTH a snižuje množství receptorů pro sebe sama na buňkách příštítných tělísek.
Vzhledem k nedostatečné funkci 1α-hydroxylázy je neúčinné podávání prostého cholekalciferolu (vitamínu D3), resp. ergokalciferolu (vitaminu D2). Je nutné podávání aktivní, 1-hydroxylované formy – kalcitriolu nebo jeho analog, které vede k potlačení uvolňování PTH [1,33] a zmírnění kostní choroby vyvolané hyperparatyreózou [1,6] až na velmi pokročilé případy, kdy v tkáni příštítných tělísek již není dostatek receptorů pro vitamin D a supresibilita jejich funkce kalcitriolem je minimální. Je tedy důležité včasné zahájení terapie ještě při lehce až středně snížené funkci ledvin, ovšem až po zvládnutí hyperfosfatemie a za pravidelných kontrol kalcemie, fosfatemie, kalciurie a hladiny PTH. Kalcitriol totiž zvyšuje střevní resorpci fosfátů i kalcia, a tím kalcemii i fosfatemii. Hyperkalcemie sama zrychluje progresi renální nedostatečnosti. Dalším rizikem při podávání příliš vysokých dávek je zpomalení kostního obratu až rozvoj adynamické kostní nemoci. Běžně podávaná substituční dávka 0,25–0,5 μg/den p.o. bývá bezpečná. Výhodné, avšak bohužel aktuálně finančně ani časově nedostupné by bylo dávkování kalcitriolu, resp. jeho analog podle jeho sérové koncentrace [41].
Kalcitriol nebo jeho analoga můžeme podávat kontinuálně, tedy denně, nebo pulzně, tedy 2–3krát za týden. Kontinuální léčba je především léčba substituční, lék se podává perorálně. Na rozdíl od toho je pulzní léčba cílená primárně na supresi sekrece PTH. Může být jak perorální, tak intravenózní. Je založena na poznatku, že supresivní účinek kalcitriolu na příštítná tělíska trvá po dobu nejméně 96 hodin, zatímco jeho efekt na resorpci kalcia a fosforu ve střevě je kratší (pravděpodobně totiž souvisí s biologickým poločasem kalcitriolu, který je 4–6 hodin). Pulzní léčba by tedy měla způsobovat méně hyperkalcemických epizod [1].
Kromě kalcitriolu je k dispozici i jeho prekurzor 1α-OH-D3 (alfakacidiol), který se v játrech hydroxyluje na aktivní hormon. Udává se jeho nižší hyperkalcemizující a hyperfosfatemizující efekt, zčásti jistě i proto, že na kalcitriol není metabolizován všechen.
K syntetickým analogům vitaminu D patří 22-oxakalcitriol a 19-nor - 1α,25-(OH)2-D2 (parikalcitol) a dále 1α-OH-D2 (doxerkalciferol), který podléhá hydroxylaci v játrech. Mají výhodu v tom, že při jejich podávání je sníženo riziko hyperkalcemie a hyperfosfatemie, přitom mají zachován svůj účinek na supresi sekrece PTH [13,21,32,43]. Toho je docíleno jejich rozdílnou vazbou na jaderný VDR amembránový receptor mVDR, na sérový protein vázající vitamin D a k 24-hydroxyláze vitaminu D.
Preparáty: Rocaltrol cps 0,25, 0,5 μg, OsteoD cps 0,25, 0,5 μg, Calcijex amp 1 a 2 μg (kalcitriol), Zemplar (parikalcitol), Alpha D3 cps 0,25, 1,0 μg (kalcidiol), u nás zatím nedostupné jsou OCT (2-oxakalcitriol), Hectorol (doxerkalciferol).
Kalcimimetika
Kalcimimetika jsou agonisté kalciových receptorů. Při jejich navázání dochází k influxu kalcia do buňky příštítného tělíska, což vede k poklesu sekrece PTH. Pod jejich vlivem je stimulována sekrece kalcitoninu a snížena reabsorpce kalcia v ledvinných tubulech. Nově byla publikována dvojitě zaslepená randomizovaná klinická studie dokumentující výborný účinek látky cinacalcet hydrochlorid [3]. V současné době se kalcimimetika začínají používat i v klinické praxi.
Preparáty: Sensipar, Mimpara inj (u nás zatím nedostupné).
Paratyreoidektomie a sklerotizace příštítných tělísek
Při velikosti příštítných tělísek přes 1 cm (0,5 ml) je velká pravděpodobnost, že se jedná o tělísko s nodulární hyperplazií, při níž sekrece PTH již není suprimovatelná kalcitriolem pro nízký počet VDR a podávání kalcitriolu může naopak být nebezpečné zrušením rezistence skeletu na PTH a zhoršením hyperfosfatemie a hyperkalcemie zvýšením jejich střevní resorpce. S narůstajícími hodnotami intaktního parathormonu (iPTH) se pravděpodobnost supresibility jeho sekrece snižuje a je pouze 50% při hodnotách iPTH 80 pmol/l a 20% při iPTH 120 pmol/l. V této chvíli, zejména při současné hyperfosfatemii a hyperkalcemii nebo extraoseálních kalcifikacích, je indikováno odstranění příštítných tělísek.
Chirurgická paratyreoidektomie (PTE) je v tomto případě metodou volby. Provádí se pokud možno totální PTE s reimplantací části některého z tělísek na předloktí, eventuelně do oblasti m. Sternocleidomastoideus. Výhodné je zamražení tkáně příštítných tělísek pro případ pooperační hypoparatyreózy [35,36,37,39].
Pokud je chirurgické řešení kontraindikované, je možné provést tzv. sklerotizaci zvětšeného tělíska nebo tělísek. Té se dosahuje instilací etanolu, případně kalcitriolu do oblasti tělíska. Účinek je mnohdy jen přechodný, a pokud je posléze prováděna operace, je orientace v celé oblasti výrazně snížená. Výhodou je možnost ověření přítomnosti adenomu probatorní punkcí s odběrem PTH, ambulantní provedení výkonu a realizovatelnost i u těžce nemocných.
Další preparáty používané v léčbě renální osteopatie
Při prokázaném poklesu kostní denzity mají své místo bifosfonáty (alendronát, risedronát), při bolestivém kostním syndromu s poklesem denzity se uplatňuje lososí kalcitonin. U postmenopauzálních žen lze zvážit hormonální substituční terapii a v případě její kontraindikace preparáty SERM působící na estrogenové receptory kosti (raloxifen).
Léčba nízkoobratové osteopatie
Vzhledem k tomu, že příliš nerozumíme patogenetickým mechanizmům uplatňujícím se u nízkoobratové osteopatie, jsou i naše terapeutické možnosti velmi omezené. Snažíme se o zvýšení kostního obratu dialýzou proti roztoku s nízkým obsahem kalcia, vysazujeme kalcium, vitamin D a bifosfonáty. Hyperfosfatemii léčíme agresivně pomocí nekalciového vazače fosfátů. Pátráme po přetížení hliníkem v případě jeho průkazu stav léčíme chelátem (Desferal). Pokud k nízkoobratové osteopatii došlo po PTE, metodou volby je reimplantace kryokonzervovaného tělíska. V budoucnosti snad bude možná allotransplantace celého příštítného tělíska nebo jeho buněk, nebo podávání parathormonu.
Cíle léčby
Donedávna byla doporučená fosfatemie u dialyzovaných do 2,1 mmol/l, kalcemie do 2,65 mmol/l, podle některých dokonce do 2,70 mmol/l. Mělo se totiž za to, že kalcemie při horní hranici normy bude suprimovat sekreci PTH. Dnes ale víme, že vyšší kalcemie vede ke vzniku extraoseálních kalcifikací včetně kalcifylaxe [4,10,12,24] a že vyšší fosfatemie je nezávislým rizikovým faktorem mortality.
Kritická hladina kalciofosfátového produktu (součinu) byla považována podle různých pramenů 5,4 až 5,8 mmol2/l2 (dříve i více), nejčastěji 5,6 mmol2/l2. Nověji některé studie nalezly korelaci mezi mortalitou a hodnotou kalciofosfátového součinu (Ca × P) i hluboko pod těmito hodnotami, při hodnotách Ca × P do 4,2 mmol2/l2 [2] s tím, že mortalita je závislá na hodnotě fosfatemie. Podle jiných dokonce neexistuje kritická hodnota kalciofosfátového součinu.
Co se týče hladin iPTH, u pacientů s pokročilým renálním selháním se doporučovaly 2–3krát vyšší hodnoty než jsou fyziologické hladiny u zdravých osob. Důvodem je jednak rezistence skeletu vůči působení PTH a jednak to, že při stanovování intaktního parathormonu (1–84 aminokyselin) se zčásti stanovují i velké fragmenty celé molekuly s nižším či žádným biologickým účinkem [5,41]. Pro pacienty s lehčím poklesem renálních funkcí neexistují jednoznačná doporučení, zatím se dá pouze předpokládat, že cílové hodnoty iPTH se budou pohybovat mezi hodnotami u zdravých a u hodnotami u pacientů s chronickým selháním ledvin. Podobně i u nemocných, kteří byli léčeni časně, mohou být cílové hodnoty iPTH nižší.
Nová doporučení podle K/DOQI (Kidney Disease Outcome Quality Initiative) jsou mnohem přísnější co se kalcemie a fosfatemie týče, naopak cílové hladiny iPTH jsou podle nich ještě vyšší [23]. Pro pacienty ve fázi chronického renálního selhání jsou cílové hodnoty uvedeny v tab. 1.
Tab. 1. Doporučené hodnoty parametrů kalciofosfátového metabolizmu. 
PTH – parathormon, S-Ca – sérová koncentrace kalcia, S-P – sérová koncentrace fosforu Je ovšem pravda, že tyto léčebné cíle aktuálně splňuje pouze malé procento pacientů, např. v USA je to podle DOPPS (Dialysis Outcomes and Practice Patterns Study) pouze 4,6 %. Zbylých 95,4 % nemocných (!) by tedy mělo být léčeno intenzivněji.
Rozhodovací schéma terapie renální osteopatie
Na základě výše uvedených doporučení a vlastních zkušeností lze formulovat rozhodovací schéma léčby renální osteopatie, které zahrnuje jak nízkoobratovou, tak vysokoobratovou formu onemocnění, které je uvedeno v tab. 2 (tabulka je inspirována [40] a upravena dle [23] a vlastních zkušeností).
Tab. 2. Doporučený terapeutický postup podle hodnot parametrů kalciofosfátového metabolizmu. 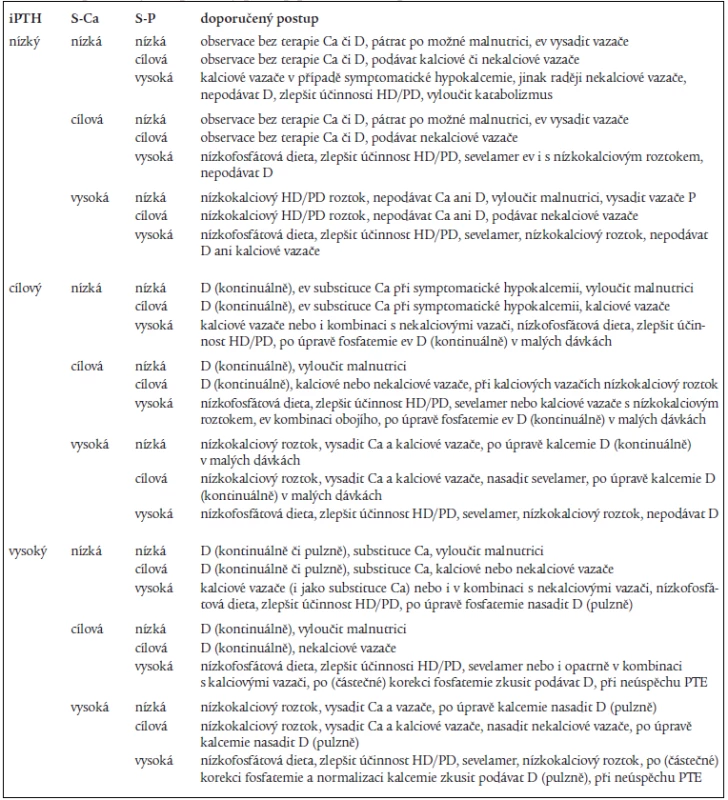
Pojmy „nízká“, „cílová“, „vysoká“ koncentrace/hladina se vztahují k doporučením podle K/DOQI uvedeným v tab. 1; PTH – parathormon, S-Ca – sérová koncentrace kalcia, S-P – sérová koncentrace fosforu, D – aktivní metabolity vitaminu D, PD – peritoneální dialýza, HD hemodialýza, PTE – paratyreoidektomie Doporučený postup se vztahuje k aktuálním hodnotám u pacienta, při terapii samozřejmě pacienti přecházejí z jedné skupiny do druhé. Doporučené postupy nejsou a nemohou být rigidní, protože ke stejným hodnotám pacient může dospět při různé léčbě. Při rozhodování o další léčbě musíme brát v úvahu i dynamiku změn a předchozí odpověď na léčbu. V budoucnu, s dostupností dalších léčiv, se tato doporučení budou samozřejmě měnit.
Závěr
Hyperfosfatemie a renální osteopatie zvyšují morbiditu a mortalitu pacientů a vzhledem k relativně častému výskytu středně závažného snížení glomerulární filtrace ohrožují až 5 % veškeré populace. Léčba těchto poruch je dlouhodobá a náročná. Při dobré spolupráci nemocného a lékaře jsou však současné terapeutické možnosti značně široké a umožňují prevenci či alespoň výrazné oddálení závažných komplikací.
MUDr. Jana Smržová, Ph.D.
www.fnbrno.cz
e-mail:jsmrzova@fnbrno.cz
Doručeno do redakce: 10. 3. 2004
Přijato po recenzi: 19. 5. 2004
Zdroje
1. Andress DL, Norris KC, Coburn JW et al. Intravenous calcitriol in the treatment of refractory osteitis fibrosa of chronic renal failure. N Engl J Med 1989; 321 : 274–279.
2. Block GA, Hulbert-Shearon TE, Levin NW et al. Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic haemodialysis patients. A national study. Am J Kidney Dis 1998; 31 : 607–617.
3. Block GS, Martin KJ, de Francisco AL et al. Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis. NEJM 2004; 350 : 1565–1567.
4. Braun J, Oldendorf M, Moshage W et al. Electron beam computed tomograpy in the evaluation of cardiac calcification in chronic dialysis patients. Am J Kidney Dis 1996; 27 : 394–401.
5. Broulík P. Poruchy kalciofosfátového metabolismu. Praha: Grada 2003.
6. Coburn JW. Use of oral and parenteral calcitriol in the treatment of renal osteodystrophy. Kidney Int 1990; 38(Suppl): S54.
7. D’Haese PC, Spasovski GB, Sikole A et al. A multicenter study on the effects of lanthanum carbonate (Fosrenol) and calcium carbonate on renal bone disease in dialysis patients. Kidney Int 2003; 85 (Suppl): S73–S78.
8. Date T, ShigematsuT, Kawashita Y et al. Colestimide can be used as a phosphate binder to treat uraemia in end-stage renal disease patients. Nephrol Dial Transplant 2003; 18(Suppl 3): iii90–93.
9. Delmez JA, Tindira CA, Windus DW et al. Calcium acetate as a phosphorus binder in hemodialysis patients. J Am Soc Nephrol 1992; 3 : 96–102.
10. Don BR, Chin AI. A strategy for the treatment of calcific uremic arteriolopathy (calciphylaxis) employing a combination of therapies. Clin Nephrol 2003; 6 : 463–470.
11. Dzúrik R, Spustová V. Nefrogénna metabolická acidóza. Vnitř Lék 2003; 49(5): 370–373.
12. Fine A, Zacharias J. Calciphylaxis is usually non-ulcerating: Risk factors, outcome and therapy. Kidney Int 2002; 61 : 2210.
13. Finch JL, Brown AJ, Kubodera N et al. Differential effects of 1.25-(OH)2D3 and 22-oxacalcitriol on phosphate and calcium metabolism. Kidney Int 1993; 43 : 561.
14. Finn WF, Joy MS, Webster I et al. A long term (2-year) assessment of the safety and efficacy of lanthanum carbonate, a non-calcium, non-aluminium phosphate binder, for the treatment of hyperphosphataemia. Poster at the 40th ERA-EDTA World Congress of Nephrology, Berlin, Germany, 8–12 June, 2003.
15. Chauveau P et al. Phosphate removal rate: a comparative study of five high-flux dialysers. Nephrol Dial Transplant 1992; 2(Suppl): 114–115.
16. Chertow GM, Dillon M, Burke SK et al A randomized trial of sevelamer hydrochloride (RenaGel) with and without supplemental calcium. Strategies for the control of hyperphosphatemia and hyperparathyroidism in hemodialysis patients. Clin Nephrol 1999; 51 : 18–26.
17. Lefebvre A, de Vernejoul MC, Gueris J et al. Optimal correction of acidosis changes progression of dialysis osteodystrophy. Kidney Int 1989; 36 : 1112–1118.
18. Locatelli F, Cannata-Andia JB, Drueke T et al. Management of disturbancies of calcium and phosphate metabolism in chronic renal insufficiency, with emphasis on the control of hyperphosphataemia. Nephrol Dial Transplant 2002; 17 : 723–731.
19. Locatelli F, Del Vecchio I, Pozzoni P. The importance of early detection of chronic kidney disease. Nephrol Dial Transplant 2002; 17(Suppl 1): 2–7.
20. Loghman-Adham M. Safety of new phosphate binders for chronic renal failure. Drug Saf 2003; 26 : 1093–1115.
21. Martin KJ, Gonzalez E, Gellens M et al. 19-Nor-1-alpha-25-dihydroxyvitamin D2 (Paricalcitol) safely and effectively reduces the levels of intact parathyroid hormone in patients on hemodialysis. J Am Soc Nephrol 1998; 9 : 1427–1432.
22. Molitoris BA, Froment DH, Mackenzie TA et al. Citrate: A major factor in the toxicity of orally administered aluminum compounds. Kidney Int 1989; 36 : 949–953.
23. National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003; 42 (Suppl 3): S1–201.
24. Raggi P, Boulay A, Chasan-Taber S et al. Cardiac calcification in adult hemodialysis patients. A link between end/stage renal disease and cardiovascular disease? J Am Coll Cardiol 2002; 39(4): 695–701.
25. Salusky IB, Foley J, Nelson P et al. Aluminum accumulation during treatment with aluminum hydroxide and dialysis in children and young adults with chronic renal disease. N Engl J Med 1991; 324 : 527–531.
26. Sellarez LV, Ramirez TA. Management of hyperphosphataemia in dialysis patients: role of phosphate binders in the elderly. Drugs Aging 2004; 21 : 153–165.
27. Schiller LR, Santa Ana CA, Sheikh MS et al. Effect of the time of administration of calcium acetate on phosphorus binding. N Engl J Med 1989; 320 : 1110–1113.
28. Schück O, Tesař V, Teplan V et al. Konzervativní léčení chronického selhání ledvin. In: Schück O. Klinická nefrologie. Praha: Medprint 1995 : 179–198.
29. Slatopolsky E, Burke SK, Dillon MA. RenaGel, a nonabsorbed calcium – and aluminum–free phosphate binder, lowers serum phosphorus and parathyroid hormone. The RenaGel study group. Kidney Int 1999; 55 : 299–307.
30. Slatopolsky E, Finch J, Denda M et al. Phosphorus restriction prevents parathyroid gland growth. High phosphorus directly stimulates PTH secretion in vitro. J Clin Invest 1996; 97 : 2534–2540.
31. Slatopolsky E, Weerts C, Lopez-Hilker S et al. Calcium carbonate as a phosphate binder in patients with chronic renal failure undergoing dialysis. N Engl J Med 1986; 315 : 157–161.
32. Slatopolsky E, Berkoben M, Kelber J et al. Effects of calcitriol and non–calcemic vitamin D analogs on secondary hyperparathyroidism. Kidney Int 1992; 38(Suppl): S43–49.
33. Slatopolsky E, Weerts C, Thielan J et al. Marked suppression of secondary hyperparathyroidism by intravenous administration of 1.25-dihydroxycholecalciferol in uremic patients. J Clin Invest 1984; 74 : 2136–2143.
34. Slatopolsky E. The interaction of parathyroid hormone and aluminum on renal osteodystrophy. Kidney Int 1987; 31 : 842–854.
35. Sotorník I et al. Kostní choroba při nezvratném selhání ledvin. Praha: Scientia Medica 1994.
36. Sotorník I, Bubeníček P, Adamec M et al. Poruchy funkce příštítných tělísek u nemocných v pravidelném dialyzačním léčení a po transplantaci ledviny. Čas Lék Čes 2003; 4 : 229–234.
37. Sotorník I, Bubeníček P. Kostní choroba u nemocných s chronickým selháním ledvin II. část: Diagnostika a léčení kostní choroby. Osteol Bul 2000; 4 : 114–122.
38. Sotorník I, Petrásek R, Schück O et al. Nárazové dávky kalcitriolu při léčení sekundární hyperparatyreózy u hemodialyzovaných nemocných. Vnitř Lék 1997; 43(9): 584–591.
39. Stracke S, Jehle PM, Sturm D et al. Clinical course after total parathyroidectomy without autotransplantation in patients with end-stage renal failure. Am J Kidney Dis 1999; 33 : 304–311.
40. Sulková S et al. Renální osteopatie. In: Sulková S. Hemodialýza. Praha: Maxdorf 2000.
41. Sulková S, Fořtová M, Válek M et al. Renální kostní choroba. Vnitř Lék 2003; 49(5): 403–408.
42. Sulková S. Epidemiologie funkčního postižení ledvin. Vnitř Lék 2003; 49(5): 358–361.
43. Tan AU, Levine BS, Mazess RB et al. Effective suppression of parathyroid hormone by 1-alpha-hydroxy-vitamin D2 in hemodialysis patients with moderate to severe secondary hyperparathyroidism. Kidney Int 1997; 51 : 317–323.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2005 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- Předpokládané náklady na terapii diabetes mellitus a jeho pozdních komplikací v ČR
- Diabetické srdce či srdce diabetika?
- Multikomponentní automatizované odběry – nový trend v dárcovství krve
- Od odběrů plné krve k multikomponentnímu dárcovství
- Problematika hyperfosfatemie a jejích důsledků pro pacienty léčené dialýzou pro chronické selhání ledvin
- Železo v organizmu – nutný pomocník a skrytý nepřítel. Jaký význam mají nové poznatky o metabolizmu železa pro klinika
- Současná infekce viry hepatitidy B a C – terapeutický problém nejen u starších pacientů
- Kuřácké návyky lékařů a lékařek v porovnání s kouřením v populaci ČR. Porovnání se stavem v roce 1991
- Chronická kritická končetinová ischemie: distální revaskularizace vs distální revaskularizace s volným svalovým přenosem
- Příčiny akutních intoxikací v průběhu jednoho roku na jednotce intenzivní metabolické péče
- Předpokládané náklady na terapii diabetes mellitus a jeho pozdních komplikací v ČR – předbě
- Diabetická kardiomyopatia
- Multikomponentní automatizované odběry – nový trend v dárcovství krve
- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: I. Etiopatogeneze, důsledky a diagnostika
- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: II. Léčba
- Nové poznatky o metabolizmu železa
- Léčba starších pacientů s koinfekcí virů hepatitidy B a C
- Úvaha o studiu na lékařské fakultě
- Rostoucí nároky na výuku sociálního lékařství a výuka některých navazujících oborů
- Prof. MUDr. Jiří Widimský, DrSc., FESC, FAHA, člen České lékařské akademie, se dožívá 80 let
- Teplan V, Horáčková M, Bébrová E, Janda J et al. Infekce ledvin a močových cest v dospělém a dětském věku. Praha: Grada 2004. 252 stran. ISBN 80−247−0566−4.
- Hendl J. Přehled statistických metod zpracování dat. Praha: Portál 2004. 584 stran. ISBN 80−7178−820−1.
- Kaňovský P, Bareš M, Dufek J et al. Spasticita, mechanismy, diagnostika, léčba. Praha: Maxdorf 2004. 423 stran. ISBN 80−7345−042−0.
- Rychlíková E. Manuální medicína. 3. ed. Praha: Maxdorf 2004. 530 stran. ISBN 80−7345−010−0.
- Erban J. Dlouhodobá domácí oxygenoterapie. Praha: Maxdorf 2004. 109 stran. ISBN 80−7345−024−0.
- Višňa P, Hoch J et al. Traumatologie dospělých. Příprava ke zkouškám z chirurgických oborů. Praha: Maxdorf 2004. 157 stran. ISBN 80−7345−034−8.
- Mašata J, Jedličková A et al. Infekce v gynekologii a porodnictví. Praha: Maxdorf 2004. 371 stran. ISBN 80−7345−038−0.
- Hronek M. Výživa ženy v období těhotenství a kojení. Praha: Maxdorf 2004. 309 stran. ISBN 80−7345−013−5.
- Oznámení
- Oznámení
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: I. Etiopatogeneze, důsledky a diagnostika
- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: II. Léčba
- Nové poznatky o metabolizmu železa
- Předpokládané náklady na terapii diabetes mellitus a jeho pozdních komplikací v ČR – předbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



