-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSoučasný výskyt akutní megakaryoblastické leukemie a germinálního tumoru mediastina – kazuistika a přehled literatury
Concurrent acute megakaryoblastic leukaemia and mediastinal germ cell tumour – case report and literature review
The occurrence of haematological malignancies associated with germ cell tumours was described for the first time in literature in 1985. Since then, more than 60 cases have been published, mostly involving mediastinal germ cell tumour and acute megakaryoblastic leukaemia. Germ cell tumours as well as acute megakaryoblastic leukaemias are rare neoplasms characterized by poor prognosis when concurrent, with a dismal median survival of 6 months from the date of diagnosis. Recent data suggest a clonal relationship between these two neoplasms when occurring concurrently due to the common presence of isochromosome 12p and mutations of TP53, NRAS and PTEN in both. Our case report presents a rare case of concurrent mediastinal germ cell tumour and acute megakaryoblastic leukaemia treated at our centre as well as a review of literature focusing on molecular changes in these neoplasms.
Keywords:
acute megakaryoblastic leukaemia – mediastinal germ cell tumour
Autoři: E. Mnacakanová 1; T. Szotkowski 1; H. Urbánková 1; M. Holzerová 1; M. Divoká 1; Z. Pikalová 1; A. Lapčíková 1; J. Ehrmann 2; J. Soukup 3
; F. Čtvrtlík 4; R. Formánek 5; E. Faber 1; T. Papajík 1
Působiště autorů: Hemato-onkologická klinika LF UP a FN Olomouc 1; Ústav klinické a molekulární patologie, LF UP a FN Olomouc 2; Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha 3; Radiologická klinika LF UP a FN Olomouc 4; Klinika nukleární medicíny LF UP a FN Olomouc 5
Vyšlo v časopise: Transfuze Hematol. dnes,28, 2022, No. 1, p. 28-35.
Kategorie: Kazuistiky
doi: https://doi.org/10.48095/cctahd2022prolekare.cz4Souhrn
Souběžný výskyt germinálních tumorů a hematologických malignit byl poprvé popsán v roce 1985. Od té doby bylo publikováno více než 60 případů pacientů s těmito onemocněními, u nichž se nejčastěji jednalo o akutní megakaryoblastickou leukemii a neseminomový germinální tumor mediastina. Akutní megakaryoblastická leukemie a germinální tumory patří mezi vzácná nádorová onemocnění mající obvykle nepříznivý průběh s mediánem celkového přežití méně než 6 měsíců od stanovení diagnózy. Vzhledem k přítomnosti isochromozomu 12p a mutací TP53, PTEN a NRAS u obou nádorů se v případě jejich souběžného výskytu předpokládá existence společného progenitoru. Popisujeme vzácný případ současného výskytu akutní megakaryoblastické leukemie a germinálního tumoru mediastina a přinášíme přehled dosud publikovaných prací na toto téma.
Klíčová slova:
akutní megakaryoblastická leukemie – mediastinální germinální tumor
ÚVOD
Akutní megakaryoblastická leukemie (AML M7) patří mezi vzácné formy akutní myeloidní leukemie, která tvoří asi 1 % případů. V retrospektivní analýze pacientů s AML ve věku do 60 let byl v ČR podle databáze DATOOL výskyt v letech 2007–2018 0,4 % [1]. Její prognóza je nepříznivá, medián celkového přežití je mezi 4 a 10 měsíci [2]. U dětí se AML M7 rozděluje do dvou podskupin podle toho, zda je, nebo není asociována s Downovým syndromem (DS). U pacientů s DS je incidence AML M7 několikanásobně vyšší. Je spojována s mutací GATA1, která bývá přítomna téměř u všech pacientů s DS. Na rozdíl od skupiny pacientů bez DS (non-DS-AMKL) bývá AML M7 u pacientů s DS spojována s lepší prognózou [3]. U dospělých pacientů se objevuje častěji v souvislosti s jinými hematologickými onemocněními nebo po předchozí chemoterapeutické léčbě [4].
Extragonadální germinální tumory (germ cell tumor – GCT) se dle histologického nálezu rozdělují na seminomové a neseminomové, zralé a nezralé teratomy. Germinální tumory jsou spojovány s elevací sérového alfa-fetoproteinu (AFP) a/nebo beta podjednotky lidského choriogonadotropinu (beta-hCG). S elevací AFP jsou spojovány především mediastinální neseminomové germinální tumory. Mediastinální GCT se obvykle projevují dušností, bolestmi na hrudi a kašlem. Terapii zralých teratomů mediastina představuje chirurgická excize, většina těchto tumorů bývá rezistentní na chemoterapii a radioterapii. Prognóza primárního non-seminomového germinálního tumoru je nepříznivá, pravděpodobnost 5letého přežití je 45 % [5].
POPIS PŘÍPADU
Pacient, doposud zcela zdravý 35letý muž, byl v červenci 2019 vyšetřen na ambulanci ortopedické kliniky pro 3 měsíce trvající bolesti kyčlí a hrudní a bederní páteře s propagací do dolních končetin. Bylo provedeno rentgenologické vyšetření (RTG) skeletu doplněné o magnetickou rezonanci (MRI) páteře s nálezem spondylózních změn její hrudní části, proto byla pacientovi doporučena analgetická terapie s rehabilitacemi. O 2 měsíce později byl pacient vyšetřen cestou oddělení urgentního příjmu (OUP) pro zhoršující se bolesti skeletu predilekčně v oblasti mezi lopatkami, které se zhoršovaly při kašli nebo při změně polohy a které nereagovaly na žádná volně prodejná analgetika. Pacient negoval dušnost či bolesti na hrudi, kromě zmíněných potíží dále popisoval úbytek hmotnosti asi 8 kg za poslední 2 týdny, občasné febrilie až 39 °C během posledních šest měsíců, noční pocení a zvýšenou únavu. Na OUP byl proveden RTG snímek hrudníku s nálezem rozšířeného horního mediastina, pro tento nález následovalo vyšetření hrudníku výpočetní tomografií (CT) s průkazem nehomogenně se sytící ohraničené formace 84 × 61 × 72 mm v horním mediastinu.
Vzhledem k podezření na lymfom byl pacient odeslán k vyšetření na ambulanci naší kliniky. Klinické vyšetření neprokázalo přítomnost patologického nálezu, při vyšetření krevního obrazu byla zjištěna leukocytóza se zvýšeným počtem neutrofilů a mikrocytární normochromní anémie se zvýšenou hladinou ferritinu (tab. 1). Z nádorových markerů byly přítomny zvýšené patologické hodnoty beta-2-mikroglobulinu, AFP, beta-hCG a thymidinkinázy (tab. 2).
Tab. 1. Vývoj laboratorních parametrů v době diagnózy (09/2019) a po 1. cyklu konsolidační terapie (01/2020). 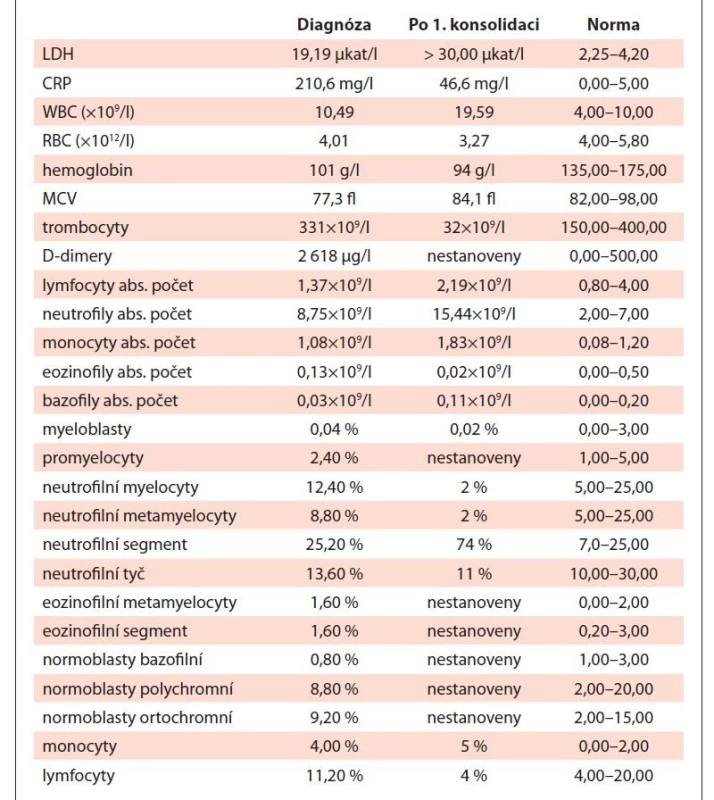
MCV – střední objem erytrocytů, RBC – erytrocyty, WBC – leukocyty Tab. 2. Tumor markery v době diagnózy. 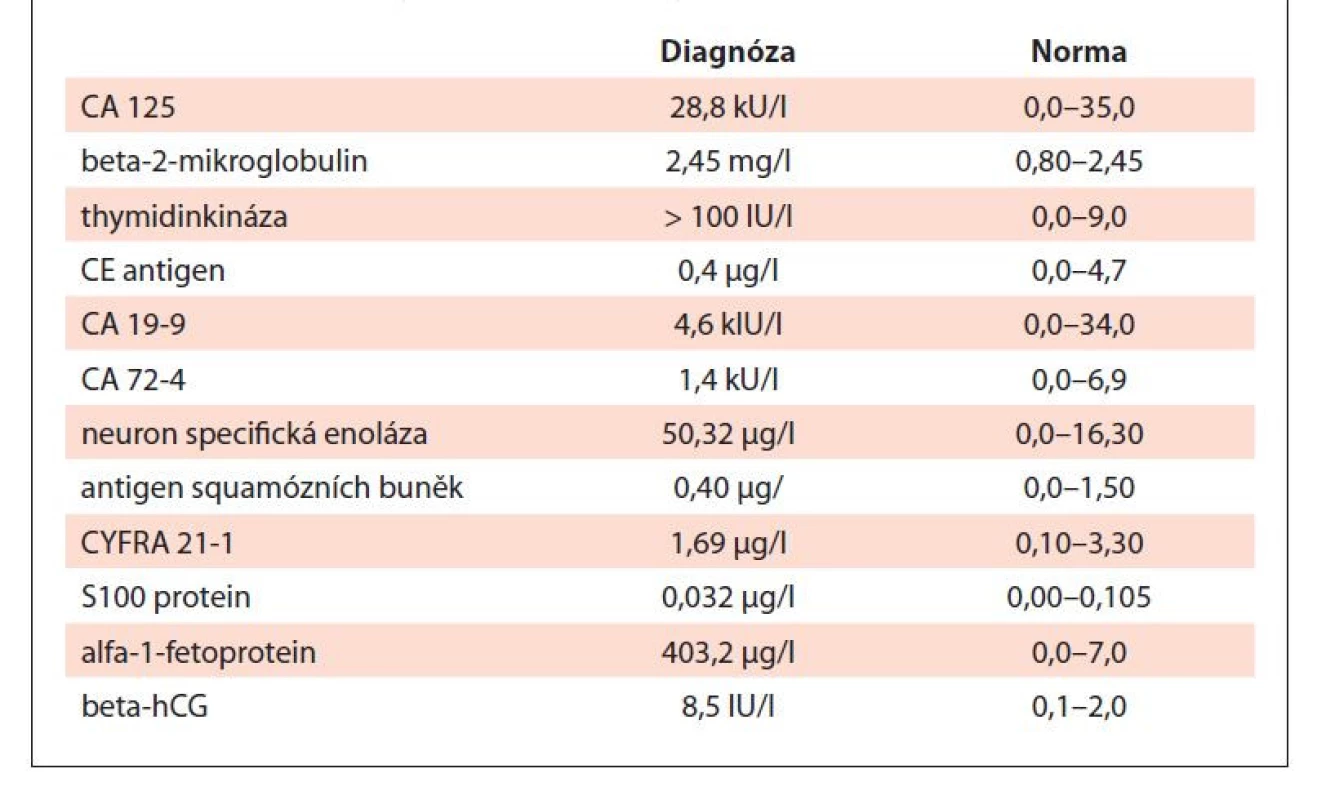
Pro účely histologického vyšetření mediastinální masy byla provedena diag - nostická core cut biopsie pod CT kontrolou. Zhodnocení bioptovaného materiálu následně potvrdilo nález maligního teratomu. Imunohistochemické vyšetření vykazovalo pozitivitu cytokeratinů AE1/3, CK7, AFP, vimentinu, CD56 a Gly-3 (obr. 1). Při celotělovém kombinovaném vyšetření pozitronovou emisní tomografií a CT s použitím 2-[18F] fluoro-2-deoxy-D-glukózy (18F-FDG PET/CT), provedeném v rámci stážování, byla nalezena mnohočetná ložiska hyperakumulace fluorodeoxyglukózy (FDG) v mediastinu (SUVmax 13,6), mnohočetně ve skeletu, chabě v lymfatických uzlinách retroperitonea a jaterního hilu (obr. 2–4). Vzhledem k těmto nálezům bylo doplněno vyšetření kostní dřeně. Při hodnocení nátěru kostní dřeně získaného sternální punkcí byly přítomny suspektní atypické buňky anaplastického a blastického vzhledu s tmavě bazofilní cytoplazmou (obr. 5). Imunofenotypizační vyšetření neprokázalo přítomnost nehemopoetických buněk, všechny vyšetřené subpopulace buněk byly v normě. Histologické vyšetření trepanobioptického vzorku kostní dřeně vedlo k překvapivému nálezu akutní megakaryoblastické leukemie. Při imunohistochemickém vyšetření byly přítomny buňky exprimující CD61, CD56 a CD117. Materiál z obou biopsií byl odeslán ke konzultačnímu vyšetření na nezávislé pracoviště (Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha), se závěrem AML M7 z trepanobioptického vzorku kostní dřeně, vzorek z biopsie mediastina byl hodnocen jako nehematologický tumor, pro limitovanou velikost odběru blíže neurčený.
Obr. 1. Vzorek z biopsie mediastinálního tumoru odebraný v době diagnózy, tvořený vřetenobuněčnou populací charakteru vaziva hladké svaloviny s drobnými epiteloidními úseky, vykazující imunohistochemickou pozitivitu alfa-fetoproteinu (A), AE 1/3 (B) a Ki67 (C). 
Obr. 2. PET/CT a CT skeletu v době diagnózy (A) a po 1. konsolidaci (B). Na snímku A (PET/CT) je ve všech úsecích páteře, v obou klíčcích a lopatkách, ve sternu, v pánvi, v proximálních partiích obou humerů a femurů přítomna zvýšená akumulace 18F-FDG (SUVmax 8,9). Na snímku B (PET/CT) a je prokázána zvýšená akumulace 18F-FDG (SUVmax 7,6) nehomogenně difuzně v celém zobrazeném skeletu. 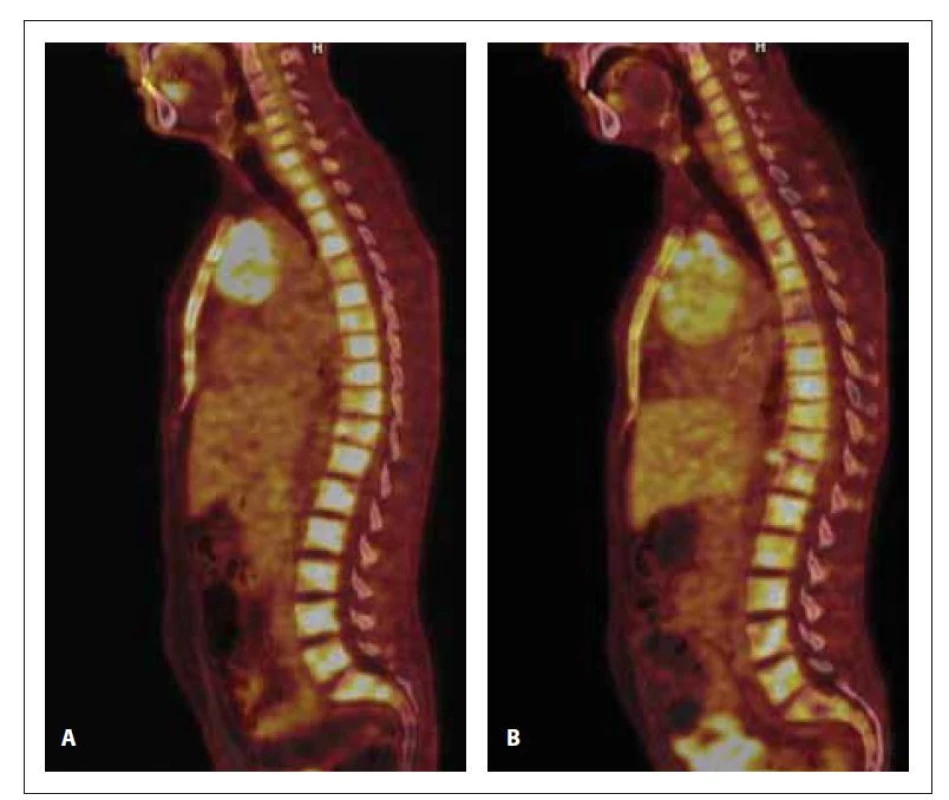
Obr. 3. PET/CT mediastina v době diagnózy (A) a po 1. indukci (B). Na snímku A je přítomna zvýšená akumulace 18F-FDG v předním mediastinu vel. 87 x 62 x 84 mm (SUVmax 13,6), ložisko lehce komprimuje levou brachicefalickou žílu a horní dutou žílu. Snímek B prokazuje progresi ložiska v mediastinu (vel. 117 x 87 x 116 mm, SUVmax 10,2), dále akumulaci 18F-FDG v jedné lymfatické uzlině paraesofageálně vlevo a jedné retroesofageálně velikosti do 11 mm (SUVmax 4,5) a v několika lymfatických uzlinách za bráničními crus velikosti do 9 mm (SUVmax 4,6). 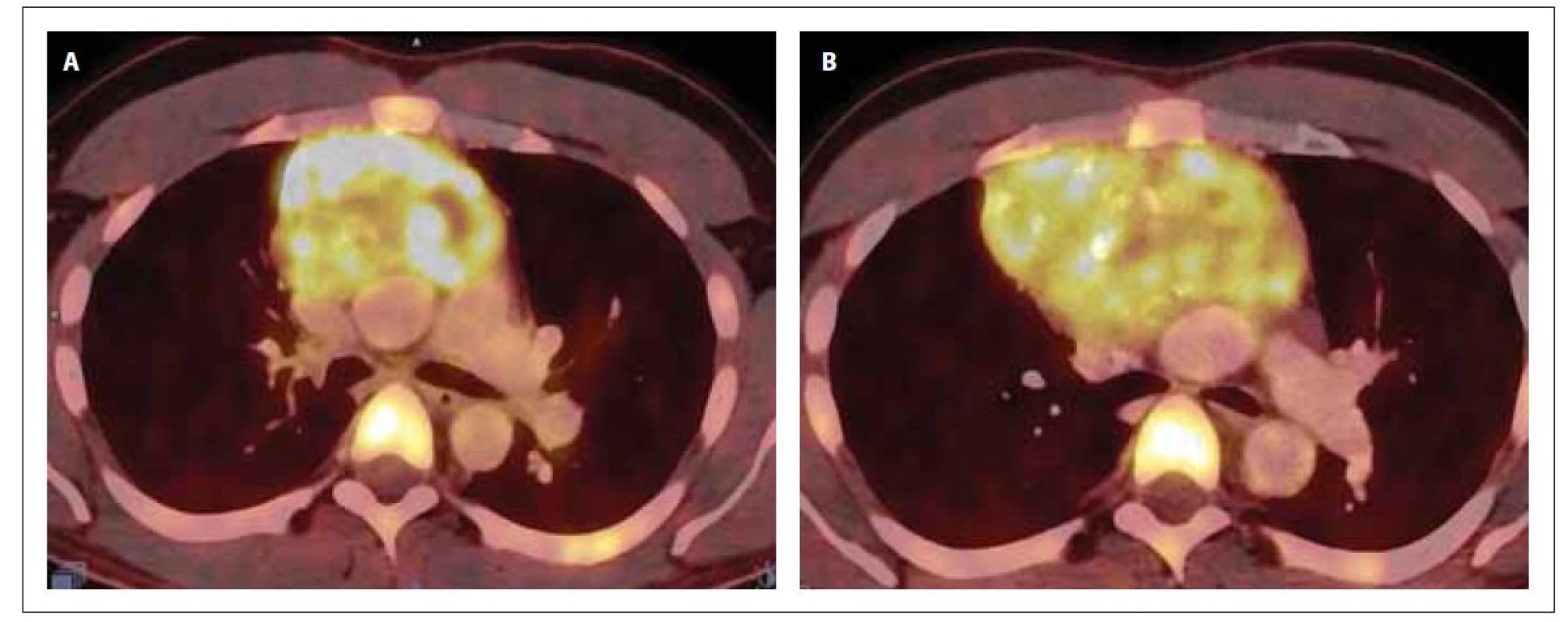
Obr. 4. PET/CT sleziny v době diagnózy (A) a po 1. konsolidaci (B). Slezina bez patologického nálezu (A) a s prokázaným hypermetabolizmem 18F-FDG (B) difuzně ve slezině vel. 134 x 39 x 128 mm (SUVmax 4,6), bez ložiskových změn a ve 2 lymfatických uzlinách retroperitonea. 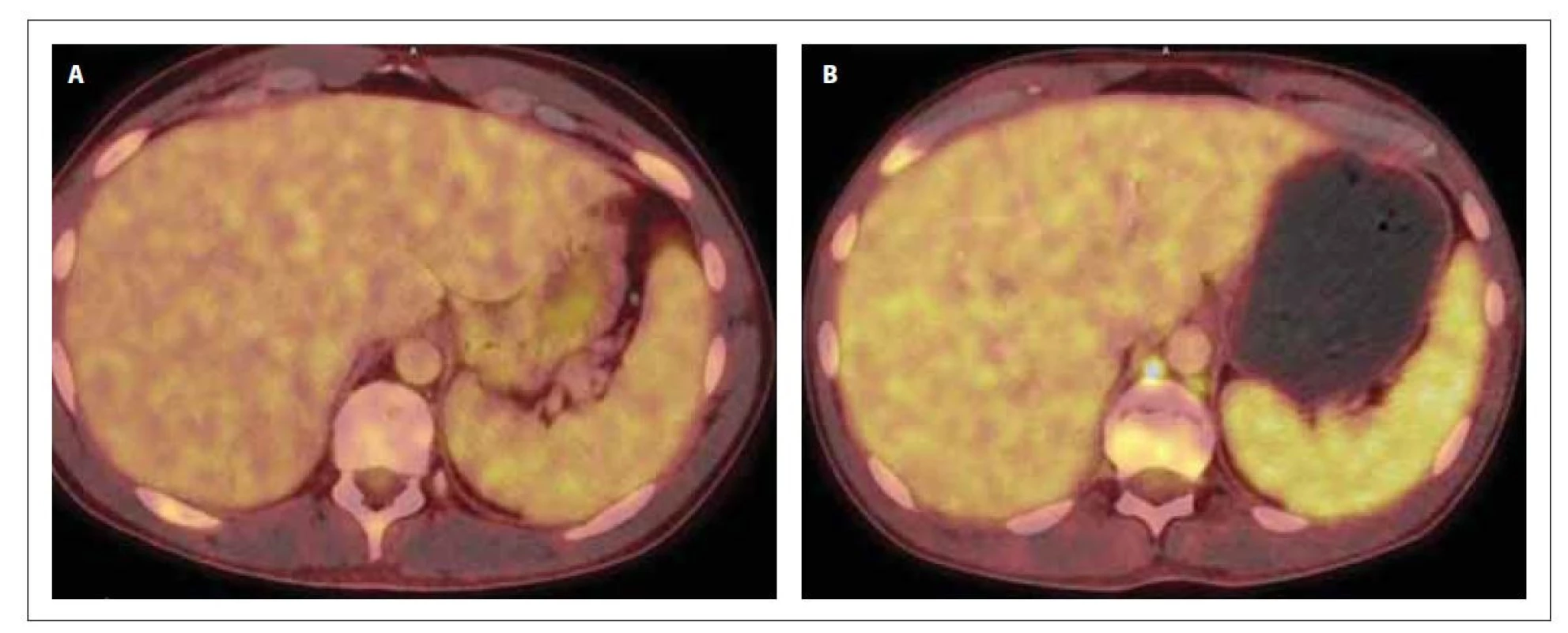
Obr. 5. Patologické megakaryoblasty v kostní dřeni. Zvětšení 1 000x. 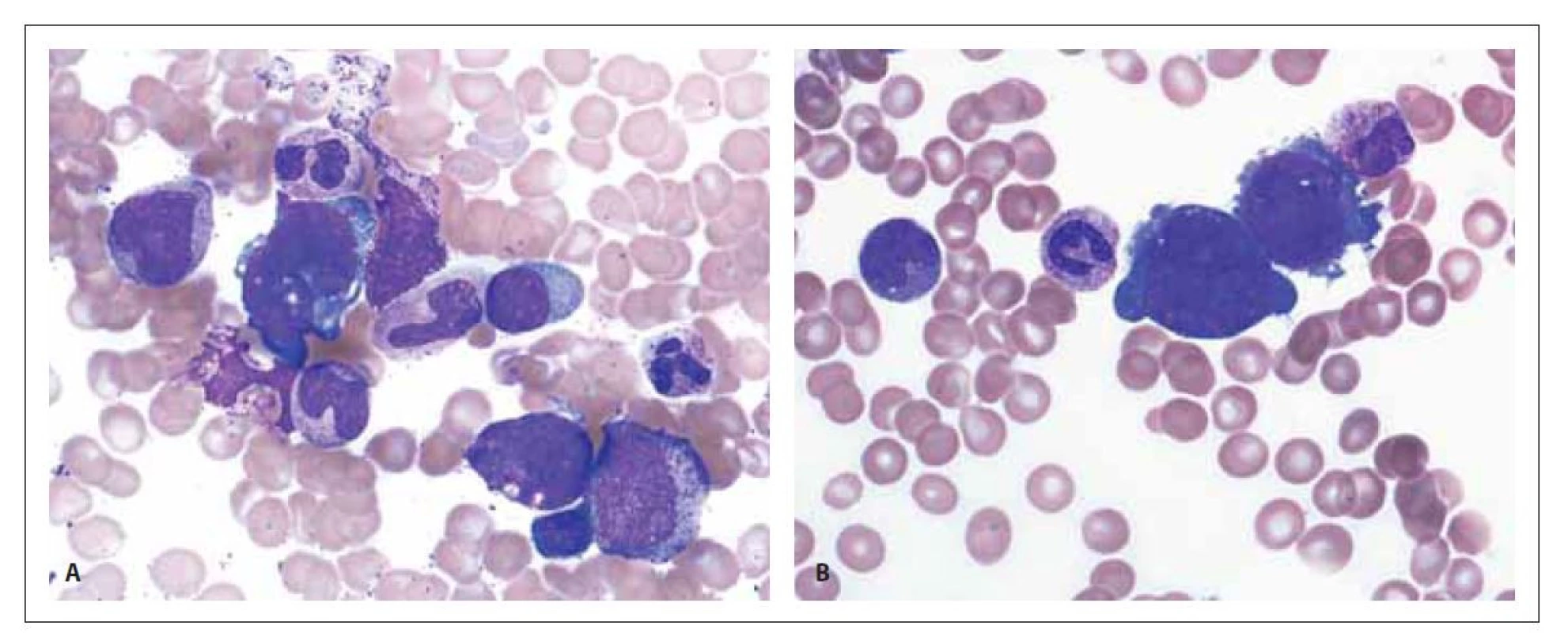
Metodou mnohobarevné fluorescenční hybridizace (MFISH) byly v aspirátu kostní dřeně nalezeny near-triploidní karyotypy s počtem chromozomů 70–74 a s mnohočetnými chromozomovými aberacemi, které se však v plném rozsahu neopakovaly, nebyly klonální. Mezi nejčastěji se opakující nalezené cytogenetické změny patřily např. der (6) t (3; 6) (?q; q?27), der (12) t (12; 21) (p?; q?) t (12; 18) (q?; q?), der (16) t (10; 16) (?; q?24), der (18) t (2; 18) (?; q?12). Isochromozom 12p nebyl u pacienta prokázán.
Metodou alelově specifické PCR byly vyloučeny mutace v genech MPL (pozice W515 a S505), JAK2 (V617F), CALR (exon 9) a ckit (D816V), zároveň nebyla pomocí nested PCR prokázána přítomnost fúzních genů FIP1L1/PDGFRA, ETV6/PDGFRB a BCR/ABL1. Isochromozom 12p nebyl u pacienta prokázán.
Bylo proto rozhodnuto o zahájení léčby akutní leukemie, složení chemoterapie bylo konzultováno s onkologem. Standardní indukční terapie (cytarabin, mitoxantron při dočasné nedostupnosti daunorubicinu) byla vzhledem k předpokládanému protinádorovému efektu tohoto léku vůči malignímu teratomu kombinována s etoposidem (tab. 3).
Tab. 3. Složení indukční, 1. a 2. konsolidační terapie. 
Po indukčním cyklu terapie bylo provedeno kontrolní vyšetření MRI hrudníku s nálezem stacionárního ložiska a také byl realizován kontrolní odběr kostní dřeně (aspirát i trepanobiopsie), který byl bez nálezu nádorové infiltrace. Hodnoty krevního obrazu po indukčním cyklu jsou uvedeny v tab. 1. Stav byl hodnocen jako hematologická remise AML a pacientovi byl od 28. dne po zahájení indukce podán první cyklus konsolidační chemoterapie. Od 63. dne po zahájení indukce byl poté podán druhý cyklus konsolidační chemoterapie (tab. 3).
Po jeho dokončení došlo u pacienta k opětovnému výskytu progredujících bolestí skeletu, které reagovaly na opiátová analgetika ve vysokých dávkách, avšak pouze s krátkodobým efektem. Na kontrolním PET/CT vyšetření byla prokázána akumulace FDG v ložisku v předním mediastinu, ve skeletu, difuzně ve slezině a v četných lymfatických uzlinách, svědčící o přítomnosti viabilní nádorové tkáně (obr. 2–4). Při srovnání s iniciálním PET/CT vyšetřením došlo ke zvětšení velikosti ložiska v předním mediastinu (84x× 61 x 72 mm, SUVmax 13,6 vs. 117 x 87 x 116 mm, SUVmax 10,2). O suspektním relapsu AML svědčila přítomnost těžké trombocytopenie a anémie v krevním obraze. Byla provedena sternální punkce s nálezem vyvolávajícím podezření z nekrózy kostní dřeně.
Vzhledem k progresi ložiska, elevaci nádorových markerů a neustupujícím bolestem skeletu bylo indikováno paliativní ozáření tumoru mediastina 8 Gy v jedné dávce.
Na základě výše uvedeného vývoje stavu pacienta bylo rozhodnuto nepokračovat v další chemoterapii, která se jevila jako neúčelná. Pacient čtyři měsíce od stanovení diagnózy AML M7 a maligního teratomu zemřel. Bezprostřední příčinou úmrtí byla bakteriální sepse.
DISKUZE
Asociace hematologických malignit s germinálními tumory byla poprvé popsána v roce 1985. V publikaci byl retrospektivně popsán malý soubor pacientů s non-seminomovými germinálními nádory mediastina a hematologickými onemocněními, z nichž převládala AML M7, myelodysplastický syndrom (MDS) s abnormálními megakaryocyty a idiopatická trombocytóza. Přibližně u jedné třetiny pacientů byly tyto dvě malignity zjištěny současně [6,7]. V rámci diagnostiky je nutné odlišit sekundární AML či MDS, které se u pacientů s germinálními tumory po podstoupení alkylační chemoterapie diagnostikují alespoň jeden rok po cytotoxické terapii.
Doposud největší mezinárodní multicentrická retrospektivní studie zaměřující se na koincidenci germinálních tumorů s hematologickými malignitami zahrnovala celkem 635 pacientů s GCT v období let 1975–1996. Hematologická onemocnění se diagnostikovala pouze ve skupině pacientů s germinálními non-seminomovými tumory mediastina, kdy z celkem 287 pacientů byla zjištěna u 17 z nich, jednalo se pouze o muže, medián věku při diagnóze byl 23 let (17–35 let). Incidence souběhu těchto diagnóz byla tedy 5,9 %. Časový interval mezi zjištěným germinálním tumorem mediastina a hematologickou malignitou byl převážně méně než 6 měsíců [8]. Prognóza těchto dvou souběžných diagnóz je infaustní, s mediánem přežití méně než 6 měsíců od stanovení diagnózy [5].
V literatuře byl popsán pouze jediný případ vyléčeného mladého pacienta s Klinefelterovým syndromem s těmito chorobami, a to konkrétně s mediastinálním germinálním tumorem a AML M7. Pacient byl léčen celkem šesti cykly chemoterapie skládající se z cytarabinu, etoposidu, mitoxantronu a idarubicinu, ke kterým byla přidána cisplatina, používaná v léčbě germinálních tumorů. Pacient dosáhl kompletní remise, po které následovala alogenní transplantace kostní dřeně a chirurgické odstranění tumoru mediastina [9].
Doposud bylo popsáno kolem 60 případů souběhu germinálního mediastinálního tumoru a hematologické malignity [10], v české literatuře zatím žádný případ těchto dvou souběžných diagnóz popsán nebyl. V roce 1989 byla publikována pouze kazuistika českých autorů (Mihál et al.) popisující případ 15letého chlapce, u kterého byla diagnostikována akutní megakaryoblastická leukemie. Po podání chemoterapie u něho došlo ke zhoršení stavu provázeného dušností s následným nálezem masy v předním mediastinu na rentgenovém snímku. Pacient zemřel 40 dní od přijetí do nemocnice – až jeho pitva prokázala diferencovaný teratom mediastina [11].
Primordiální germinální buňky a hematopoetické kmenové buňky mají stejný embryologický původ v buňkách žloutkového váčku, mohl by se tedy předpokládat souběžný vznik akutní megakaryoblastické leukemie a germinálního tumoru mediastina z rané progenitorové buňky. Jedna teorie předpokládá původ v progenitorové buňce z oblasti mezodermu, dávající vznik aortě, gonádám a mesonefros (AGM), odkud pochází i hematopoetické kmenové buňky. Z dosud neznámého důvodu by buňky z AGM oblasti mohly být přítomny i v kostní dřeni, což by mohlo vést ke vzniku GCT mediastina a AML v kostní dřeni [12]. Podle druhé teorie vzniká AML přímo z buněk GCT, zejména z buněk žloutkového váčku, který je součástí germinálního tumoru. Metastázování těchto buněk do kostní dřeně by tak vedlo k rozvoji akutní myeloidní leukemie [13].
Častý výskyt isochromozomu 12p u obou diagnóz potvrzuje existenci společné progenitorové buňky. Tato chromozomální abnormalita se typicky vyskytuje u pacientů s germinálními tumory a velice vzácně u pacientů s AML [8].
V kazuistice Oshrine et al. v roce 2014 byla poprvé popsána přítomnost somatických mutací TP53 a PTEN i isochromozomu 12p u pacienta s akutní megakaryoblastickou leukemií a mediastinálním germinálním tumorem [8]. PTEN (phosphatase and tensin homolog) je tumor supresorový gen, jehož inaktivace u heterozygotních myší vedla k rozvoji testikulárního germinálního tumoru [14–16]. Jak prokázala studie Di Vizio et al., ztráta exprese PTEN vede k progresi neinvazivního germinálního tumoru v invazivní formu. Předpokládá se, že ztráta genu vede k patologické proliferaci a ztrátě diferenciace [17]. Z celkem 200 případů AML v rámci TCGA projektu (The Cancer Genome Atlas program) nebyla mutace PTEN detekována u žádného pacienta. Mutace TP53 bývají často spojeny se solidními tumory, jejich přítomnost je však u germinálních tumorů vzácná. Inaktivace TP53 by mohla být příčinou špatné odpovědi na léčbu, jelikož se jedná o známý rizikový faktor chemorezistence [18]. Přítomnost těchto dvou mutací u pacientů se souběžným germinálním tumorem a akutní megakaryoblastickou leukemií publikovali v roce 2020 Akizuki et al., kteří provedli cytogenetickou analýzu a celoexomové sekvenování (whole exome sequencing – WES) u pacienta s mediastinálním GCT a AML M7 s následným nálezem pěti mutací (TP53, PTEN, RLF, DLG2 a YY2), jež nejspíše vedly ke vzniku společné progenitorové buňky obou nádorů, a dále čtyř mutací (PCLO, GOGLA8J, EDRF1 a ASF1A), které byly přítomny jak v buňkách germinálního tumoru, tak v leukemických buňkách [19].
Leonard et al. prezentovali další potenciální genetické mutace přítomné u obou nádorových diagnóz – mutace TP53 a NRAS u pacienta s akutní myeloidní leukemií a mediastinálním germinálním tumorem [10]. Somatické mutace genu NRAS jsou spojovány s diagnózami karcinomu rekta, melanomu a folikulárního karcinomu štítné žlázy. Ve studii 2 502 pacientů s diagnózou akutní myeloidní leukemie byla tato mutace přítomna u 10,3 % případů, kdy byla nejčastěji detekována u pacientů s inv (16) /t (16; 16) [20]. Pacientovi byly podány čtyři cykly VIP (vinblastin, ifosfamid, etoposid), po kterých následovaly dva cykly HAEP (HiDAC, etoposid, cisplatina), po nichž pacient dosáhl kompletní remise AML. Po resekci mediastinální masy došlo k relapsu AML, pro který byl pacientovi vzhledem k nálezu NRAS mutace podán trametinib, MEK inhibitor (mitogen-activated protein kinase inhibitor), u něhož se efekt u NRAS mutací předpokládá na základě in vitro studií. Před plánovanou alogenní transplantací kostní dřeně byl u pacienta detekován relaps GCT, a terapie byla proto po pěti měsících od zahájení podávání trametinibu zastavena pro neúčelnost [10].
Přítomností společné prekurzorové kmenové buňky vedoucí ke vzniku germinálních tumorů a hematologických malignit se zabývali i Taylor et al., kteří v roce 2020 publikovali novou hypotézu vzniku těchto malignit. Ta předpokládá původ buněk těchto nádorů v embryonálních karcinomových buňkách, jež mají schopnost diferenciace do buněk neseminomových GCT, stejně jako do buněk hematopoetických nádorových. Ve své studii hodnotili 15 pacientů s GCT a souběžnou hematologickou malignitou, přičemž u všech pacientů byl diagnostikován mediastinální germinální tumor a u téměř poloviny z nich byla přítomna i AML M7. Tyto pacienty srovnávali s kohortou pacientů s mediastinálními germinálními tumory, u nichž nedošlo ke vzniku hematologických malignit, a s pacienty s de novo AML. V jejich studii byly hematologické malignity geneticky podobné mediastinálním GCT více než de novo vznikajícím AML. Isochromozom 12p byl často přítomen u pacientů se souběžným GCT a AML, zatímco u de novo AML přítomen nebyl. Stejně tak i mutace TP53 byla přítomna u téměř všech pacientů s GCT a hematologickou malignitou, zatímco u pacientů pouze s GCT byla přítomná v 61 % a u pacientů s de novo AML jen v 9 % případů. Obdobné výsledky byly i u mutací KRAS a NRAS. Hematologické malignity při souběžném výskytu s GCT nevykazovaly typické mutace spojované s AML či MDS (např. FLT3, DNMT3A, TET2 a NMP1 mutace). Na základě těchto nálezů tedy Taylor et al. předpokládají odlišnou patogenezi nádorů krvetvorby spojenou s přítomností germinálních tumorů, než je tomu u hematologických malignit bez GCT, což by mohlo vysvětlit i jejich refrakteritu k léčbě [21].
Isochromozom 12p nebyl u našeho pacienta prokázán. Metodou alelově specifické PCR byly také vyloučeny mutace v genech MPL (pozice W515 a S505), JAK2 (V617F), CALR (exon 9) a ckit (D816V) a zároveň nebyla pomocí nested PCR prokázána přítomnost fúzních genů FIP1L1/PDGFRA, ETV6/PDGFRB a BCR/ABL1.
Naše kazuistika prezentuje případ vzácné kombinace diagnóz, která má pro svou rezistenci vůči chemoterapii v naprosté většině případů krátký a infaustní průběh. Recentně publikované práce zabývající se genetickými změnami u těchto souběžně se vyskytujících malignit představují východisko pro možné využití cílené léčby pacientů s těmito chorobami v budoucnosti.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
EM – příprava rukopisu
TS, EF, TP, JS – revize, korekce rukopisu
HU, MH, MD – revize, korekce rukopisu, zpracování cytogenetických výsledků
ZP, AL – revize, korekce rukopisu, poskytnutí obrazového materiálu, zpracování morfologické a imunotypizační části
JE – revize, korekce rukopisu, poskytnutí obrazového materiálu
FČ, RF – revize rukopisu, poskytnutí obrazového materiálu
GRANTOVÁ PODPORA
Práce vznikla za podpory grantu IGA_LF_2021_001.
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne: 27. 6. 2021.
Přijato po recenzi dne: 8. 11. 2021.
MUDr. Eva Mnacakanová
Hemato-onkologická klinika
FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
e-mail: eva.mnacakanova@gmail.com
Zdroje
1. Semerád L, Šustková Z, Cetkovský P, et al. Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML. Transfuze Hematol Dnes. 2020; 26 (3): 212–225.
2. Hahn AW, Li B, Prouet P, et al. Acute megakaryocytic leukemia: What have we learned. Blood Rev. 2016; 30 (1): 49–53.
3. Gruber TA, Downing JR. The biology of pediatric acute megakaryoblastic leukemia. Blood. 2015; 126 (8): 943–949.
4. Dima D, Oprita L, Rosu AM, et al. Adult acute megakaryoblastic leukemia: rare association with cytopenias of undetermined significance and p210 and p190 BCR-ABL transcripts. Onco Targets Ther. 2017; 10 : 5047–5051.
5. Hartmann JT, Nichols CR, Droz JP, et al. Hematologic disorders associated with primary mediastinal nonseminomatous germ cell tumors. J Natl Cancer Inst. 2000; 92 (1): 54–61.
6. Nichols CR, Hoffman R, Einhorn LH, et al. Hematologic malignancies associated with primary mediastinal germ-cell tumors. Ann Intern Med. 1985; 102 : 603–609.
7. DeMent SH, Eggleston JC, Spivak JL. Association between mediastinal germ cell tumors and hematologic malignancies. Report of two cases and review of the literature. Am J Surg Pathol. 1985; 9 : 23–30.
8. Oshrine BR, Olsen MN, Heneghan M, et al. Acquired isochromosome 12p, somatic TP53 and PTEN mutations, and a germline ATM variant in an adolescent male with concurrent acute megakaryoblastic leukemia and mediastinal germ cell tumor. Cancer Genetics. 2014; 207 : 153–159.
9. Hiramatsu H, Morishima T, Nakanishi H, et al. Successful treatment of a patient with Klinefelter‘s syndrome complicated by mediastinal germ cell tumor and AML (M7). Bone Marrow Transplant. 2008; 41 (10): 907–908.
10. Leonard JT, Raess PW, Dunlap J, et al. Functional and genetic screening of acute myeloid leukemia associated with mediastinal germ cell tumor identifies MEK inhibitor as an active clinical agent. J Hematol Oncol. 2016; 9 : 31.
11. Mihál V, Dusek J, Jarosová M, et al. Mediastinal teratoma and acute megakaryoblastic leukemia. Neoplasma. 1989; 36 (6): 739–747.
12. Medvinsky A, Dzierzak E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 1996; 86 (6): 897–906.
13. Zhao GQ, Dowell JE. Hematologic malignancies associated with germ cell tumors. Expert Rev Hematol. 2012; 5 : 427–437.
14. Suzuki A, de la Pompa JL, Stambolic V, et al. High cancer susceptibility and embryonic lethality associated with mutation of the PTEN tumor suppressor gene in mice. Curr Biol. 1998; 8 (21): 1169–1178.
15. Podsypanina K, Ellenson LH, Nemes A, et al. Mutations of Pten/Mmac1 in mice causes neoplasia in multiple organ systems. Proc Natl Acad Sci USA. 1999; 96 (4): 1563–1568.
16. Kimura T, Suzuki A, Fujita Y, et al. Conditional loss of PTEN leads to testicular teratoma and enhances embryonic germ cell production. Development. 2003; 130 : 1691–1700.
17. Di Vizio D, Cito L, Boccia A, et al. Loss of the tumor suppressor gene PTEN marks the transition from intratubular germ cell neoplasias (ITGCN) to invasive germ cell tumors. Oncogene. 2005; 24 : 1882–1894.
18. Lu C, Riedell P, Miller CA, et al. A common founding clone with TP53 and PTEN mutations gives rise to a concurrent germ cell tumor and acute megakaryoblastic leukemia. Cold Spring Harb Mol Case Stud. 2016; 2 (1): a000687.
19. Akizuki K, Kameda T, Shide K, et al. Short commentary on “TP53 and PTEN mutations shared in concurrent germ cell tumor and acute megakaryoblastic leukemia”. J Data Mining Genomics Proteomics. 2020; 11 (2): 230.
20. Bacher U, Haferlach T, Schoch C, Kern W, Schnittger S. Implications of NRAS mutations in AML: a study of 2502 patients. Blood. 2006; 107 (10): 3847–3853.
21. Taylor J, Donoghue MTA, Ho C., et al. Germ cell tumors and associated hematologic malignancies evolve from a common shared precursor. J Clin Invest. 2020; 130 (12): 6668–6676.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek EditorialČlánek Dr. Horská slaví 70 let
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2022 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Novinky v léčbě mycosis fungoides a Sézaryho syndromu
- Současný výskyt akutní megakaryoblastické leukemie a germinálního tumoru mediastina – kazuistika a přehled literatury
- Editorial
- Izolovaná infiltrace ledviny suspektními leukemickými buňkami – kazuistika s komplexní diferenciální diagnostikou neobvyklého stavu
- Doporučení České společnosti paliativní medicíny ČLS JEP a Společnosti pro transfuzní lékařství ČLS JEP
- Doporučení laboratorní sekce České hematologické společnosti ČLS JEP
- MUDr. Marcela Lukášová – ušlechtilá dáma české hematologie
- Muž s dýmkou, prof. MUDr. Pavel Klener, DrSc., se v dubnu 2022 dožívá 85 let
- Doc. RNDr. Miroslav Pecka, CSc., slaví 75 let
- Primář MUDr. Vladimír Komrska, CSc., sedmdesátiletý
- MUDr. Jan Haber, CSc., sedmdesátiletý
- Dr. Horská slaví 70 let
- Letermovir u pacientů po alogenní transplantaci krvetvorných buněk – přehled literatury
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení laboratorní sekce České hematologické společnosti ČLS JEP
- MUDr. Jan Haber, CSc., sedmdesátiletý
- Letermovir u pacientů po alogenní transplantaci krvetvorných buněk – přehled literatury
- Doporučení České společnosti paliativní medicíny ČLS JEP a Společnosti pro transfuzní lékařství ČLS JEP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



