-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNovinky v léčbě mycosis fungoides a Sézaryho syndromu
Treatment of mycosis fungoides and Sézary syndrome
The aim of this review article is to introduce the topic of cutaneous T-cell lymphomas – mycosis fungoides and Sézary syndrome and the current treatment options. Cutaneous T-cell lymphomas are a rare group of non-Hodgkin lymphomas. Mycosis fungoides and Sézary syndrome are the most common subtypes of cutaneous T-cell lymphomas. Advanced stages of mycosis fungoides and Sézary syndrome are burdened by significant morbidity, mortality and limited therapeutic options. In 2018, based on the phase 3 trial (MAVORIC) study, the FDA and EMA approved mogamulizumab for relapsed or refractory mycosis fungoides and Sézary syndrome pre-treated with at least one systemic therapy. Together with brentuximab vedotin and alemtuzumab, mogamulizumab represents a new effective systemic treatment for patients with mycosis fungoides and Sézary syndrome.
Keywords:
treatment – mycosis fungoides – Sézary syndrome – cutaneous T-cell lymphomas –mogamulizumab
Autoři: J. Polívka
Působiště autorů: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Transfuze Hematol. dnes,28, 2022, No. 1, p. 17-26.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd202217Souhrn
Přehledový článek si klade za cíl seznámit čtenáře s problematikou kožních T buněčných lymfomů – mycosis fungoides a Sézaryho syndromu – a s aktuálními léčebnými možnostmi. Kožní T buněčné lymfomy jsou vzácná skupina nehodgkinských lymfomů. Mycosis fungoides a Sézaryho syndrom představují nejčastější podtypy kožních T buněčných lymfomů. Pokročilá stádia mycosis fungoides a Sézary syndrom jsou zatížená významnou morbiditou a mortalitou a omezenými terapeutickými možnostmi. V roce 2018 Úřad pro kontrolu potravin a léčiv USA a Evropská agentura pro léčivé přípravky schválily na základě výsledků studie fáze 3 (MAVORIC) mogamulizumab pro léčbu pacientů s relapsem nebo s refrakterní mycosis fungoides a Sézaryho syndromem, kteří byli dříve léčeni alespoň jednou systémovou léčbou. Vedle brentuximab vedotinu a alemtuzumabu tak mogamulizumab přináší pacientům s mycosis fungoides a Sézaryho syndromem novou účinnou systémovou léčbu.
Klíčová slova:
léčba – mycosis fungoides – Sézaryho syndrom – kožní T buněčné lymfomy – mogamulizumab
ÚVOD
Primární kožní T buněčné lymfomy (cutaneous T cell lymphomas – CTCL) představují různorodou skupinou vzácných T buněčných lymfomů, které se manifestují na kůži a v době diagnózy není prokázané mimokožní postižení [1]. Mycosis fungoides (MF), nejčastější typ CTCL, tvoří přibližně 60 % všech CTCL. MF je obecně indolentní nádorové onemocnění charakterizované různým typem a rozsahem kožního postižení. Obvykle se projevuje erytematozními skvrnami (patches), kožními infiltráty (plaques) a méně často erytrodermií (obr. 1 a, b, c, f). Až u čtvrtiny pacientů s časným stádiem MF během let až desetiletí onemocnění postupuje do stádia kožních nádorů (obr. 1 d, e) [2]. Mimokožní postižení MF je v době diagnózy přítomné vzácně a rozvíjí se u malého procenta pacientů v závislosti na pokročilosti onemocnění (obr. 1 g) [3–5]. Sézaryho syndrom (SS) je nejčastější agresivní typ CTCL, který představuje méně než 5 % všech CTCL. SS je definovaný triádou: generalizovaná erytrodermie (postihující více než 80 % tělesného povrchu), periferní lymfadenopatie a cirkulující maligní T buňky (Sézaryho buňky) v periferní krvi (obr. 1 h, ch) [1]. U pacientů s MF a SS se s progresí onemocnění zhoršuje stav imunokompromitace provázený zvýšeným rizikem infekcí a sníženou protinádorovou imunitní odpovědí.
Obr. 1. Projevy MF a SS; fotografie autora článku. 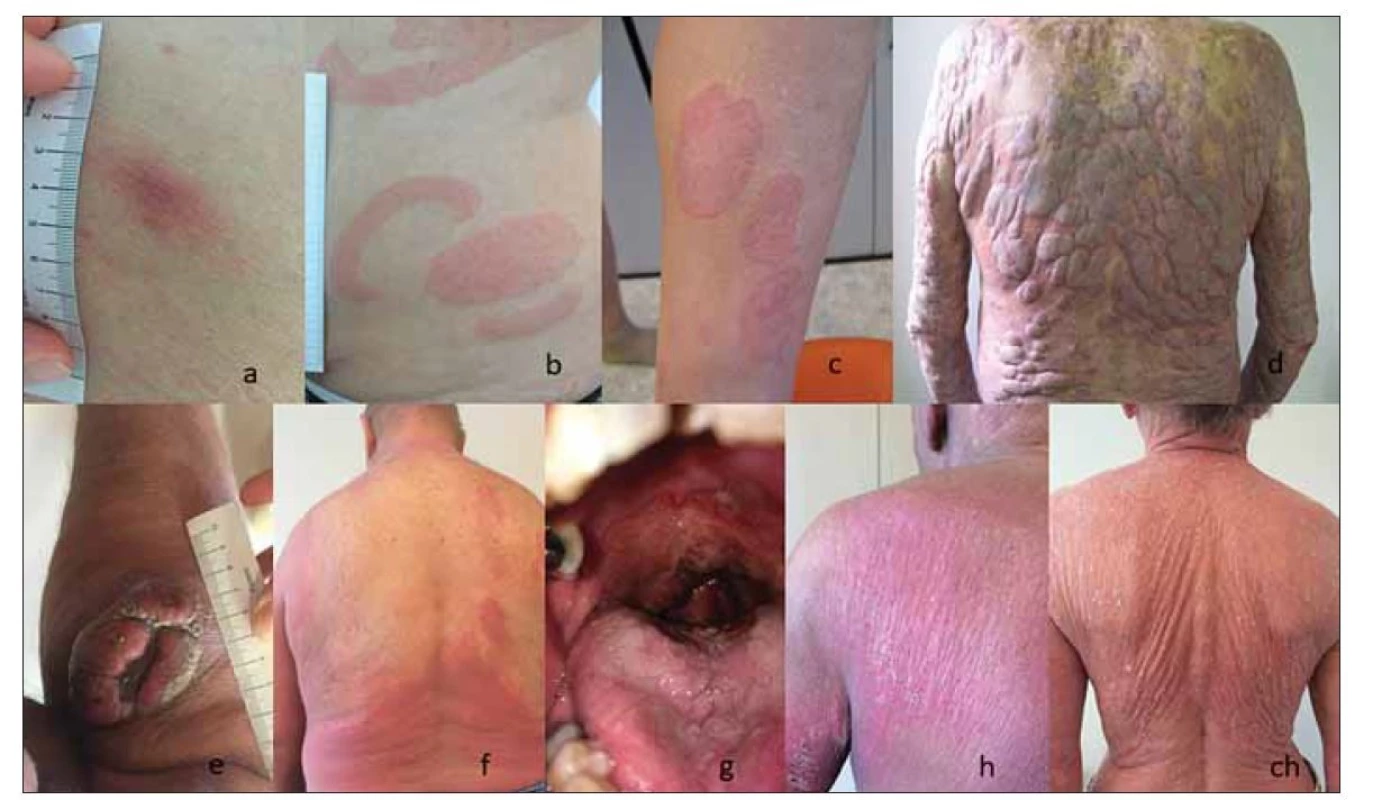
(a) stádium skvrn (patch) MF, (b, c) infiltrativní stádium MF (plaque); (d, e) tumorozní stádium MF; (f) erytrodermické stádium MF; (g) MF mimokožní systémové postižení; (h, ch) SS (erytrodermie)
MF – mycosis fungoides, SS – Sézaryho syndromCelosvětově je roční incidence CTCL nižší než 10 případů na milion obyvatel. Prevalence CTCL je až desetinásobně vyšší [6]. V roce 2015 České republice byly incidence CTCL 4,29 případu na milion obyvatel a prevalence, která má vzestupný trend, 483 případů. Medián věku při diagnóze MF a SS byl ve stejném období v České republice 67 a 75 let. Obě onemocnění postihují častěji muže, v poměru 1,5 : 1 [7,8].
Nádorové buňky MF a SS vykazují typický fenotyp CD4+ T buněk a exprimují tzv. skin-homing receptory CLA (cutaneous lymphocyte antigen) a CCR4 (chemokine receptor 4). MF buňky mají fenotyp připomínající rezidentní paměťové T buňky (CCR4++/ CLA1+/ L-selektin-/CCR7–), zatímco fenotyp buněk SS odpovídá fenotypu centrálních paměťových T (CCR4++/ CLA1++/L-selektin+/CCR7+) [9]. Novější studie ukázaly, že buňky SS a MF mohou nést rysy jakékoli z hlavních podskupin naivních nebo paměťových T buněk [10,11].
Stanovení diagnózy MF je obtížné. Klinicky i patologicky napodobuje benigní dermatózy. Diagnóza MF je až u 85 % pacientů stanovena opožděně, s mediánem trvání příznaků 36 měsíců [12]. Ke stanovení přesné diagnózy MF je nutné komplexní – klinické, patologické a biomolekulární – zhodnocení nálezů. V průběhu času trvání příznaků může být nezbytné provést více kožních biopsií. SS má také nespecifický klinický a histologický obraz, který bývá obtížné odlišit od erytematozních zánětlivých dermatóz [13]. Pro stanovení diagnózy SS je zásadní průtoková cytometrie a identifikace klonální populace T buněk [14,15]. Obě onemocnění, MF a SS sdílejí společný stážovací systém. Staging MF a SS je založen na komplexním hodnocení kůže (T, tumor), lymfatických uzlin (N, node), viscerálních orgánů (M, metastasis) a periferní krve (B, blood), který se souhrnně označuje jako TNMB klasifikace (tab. 1). Nezbytným základem pro stanovení diagnózy a určení stádia je komplexní fyzikální vyšetření, kožní biopsie, průtoková cytometrie periferní krve a zobrazovací vyšetření (a pouze v indikovaných případech biopsie lymfatických uzlin a kostní dřeně) [14,16].
Tab. 1. TNMB klasifikace ISCL/EORTC (2007) pro MF/SS [14]. ![TNMB klasifikace ISCL/EORTC (2007) pro MF/SS [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f4e90972d3309b339ca4ab94c5cc946a.jpg)
Prognóza pacientů s MF úzce závisí na klinickém stádiu. Pacienti s časným stádiem MF (IA, IB a IIA) mají dobrou prognózu, s celkovým přežitím v řádu desetiletí. Medián celkového přežití pacientů stádia IA je 35,5 roku a stádia IIA 15,8 roku. Téměř 25 % pacientů s časným stádiem MF však poměrně rychle progreduje do pokročilého stádia onemocnění. Medián 10letého přežití pacientů s časným stádiem IA, IB a IIA je 88 %, 70 % a 52 % Naproti tomu pacienti s pokročilým stádiem MF (IIB, IIIA, IIIB, IVA a IVB) mají prognózu v řádu měsíců až roků. Medián celkového přežití pacientů stádia IIB je 4,7 roku a stádia IVB 1,4 roku. Stejně tak mediány 10letého přežití jsou nízké, u pacientů stádia IIB je 34 % a u pacientů IVA je 15 %. Medián 5letého přežití pro stádium IVB je 18 % (tab. 2) [3,14,16,17]. Kromě stádia MF je prognóza pacientů ovlivněna i dalšími prognostickými faktory. Mezi příznivé prognostické ukazatele MF patří poikilodermatózní postižení, hypopigmentovaná varianta a asociace s lymfomatoidní papulozou, zatímco mezi špatné prognostické ukazatele se řadí vyšší věk v době diagnózy (> 60 let), velkobuněčná transformace (large cell transformation – LCT, definovaná jako > 25 % buněk MF čtyřikrát větších než normální lymfocyt nebo shluky velkých buněk), folikulotropní MF a zvýšená hodnota sérové laktátdehydrogenázy [18–20]. Jedním z výsledků prospektivní mezinárodní studie PROCLIPI byl návrh prognostického indexu pro pokročilé MF/SS (na základě čtyř nezávislých nepříznivých faktorů: věk > 60 let, LCT, stádium IV a zvýšená laktátdehydrogenáza nad normu), který stratifikuje pacienty do skupin s nízkým, středním a vysokým rizikem a může napomoci při volbě léčby [21].
Tab. 2. Stážovací systém ISCL/EORTC (2007) pro MF/SS, medián celkového přežití, 10leté přežití, 10leté přežití specifické k nemoci a 10leté riziko progrese onemocnění; upraveno podle [14,16,17]. ![Stážovací systém ISCL/EORTC (2007) pro MF/SS, medián celkového přežití, 10leté přežití, 10leté přežití
specifické k nemoci a 10leté riziko progrese onemocnění; upraveno podle [14,16,17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/092b0a26e313c31a44f9fbf1f664355d.jpg)
DSS – přežití specifické k nemoci, OS – celkové přežití, RDP– riziko progrese onemocnění Medián celkového přežití pacientů se SS je okolo 3 let. U SS má negativní prognostický dopad velikost nádorové nálože, tj. počet Sézaryho buněk v periferní krvi vyšší než 10 000/μl, a předchozí imunosupresivní léčba [21].
LÉČBA MF A SS
Mezinárodní doporučení, stejně tak doporučení České kooperativní lymfomové skupiny, rozdělují léčbu MF na možnosti léčby první volby a druhé a další volby, kterou je třeba zvážit později, ale nedoporučují vzhledem k nedostatku důkazů z klinických studií konkrétní pořadí jednotlivých terapií [22–26]. Hlavním cílem léčby je zlepšit klinický stav a kvalitu života související se zdravím (health-related quality of life – HRQOL) pacienta, ne úplné vymizení kožních lézí. V léčbě je však stejně důležité minimalizovat riziko progrese a vyvarovat se toxicity léčby. Na základě rozdílného chování časných stádií (IA-IIA) a pokročilých stádií (IIB-IVB) MF závisí strategie léčby na klinickém stádiu. Z tohoto důvodu je důležité správně provést staging a stanovit klinické stádium.
U pacientů s časným stádiem MF (např. T1a definované jako lokalizované erytematózní skvrny) s indolentním průběhem je namístě zvolit wait-and-see strategii, a to na základě zhodnocení věku, lokalizace kožního postižení, přidružených symptomů a vývoje onemocnění. Při rozhodování o léčbě je důležité pečlivě zvažovat léčebné možnosti, aby byla zachována potenciálně aktivní léčba do doby, kdy je opravdu potřebná. Neexistují důkazy, že agresivní léčba podávaná v časných stádiích MF má pozitivní vliv na průběh onemocnění a přežití [27]. V případě, že onemocnění progreduje, je třeba provést upgrade léčby, např. od fototerapie u časných stádií (stádium skvrn a kožních infiltrátů) (obr. 1 a–c) k systémové léčbě interferonem, retinoidy a celotělovým ozářením elektrony až po léčbu monoklonálními protilátkami a chemoterapií, které jsou indikované u pokročilých stádií (stádium tumorů a stádium mimokožního postižení) (obr. 1 d, e, g). V případě dosažení (kompletní nebo parciální) odpovědi je opodstatněný také downgrade léčby (např. zpět k fototerapii k léčbě reziduálních skvrn či kožních infiltrátů). U MF, na rozdíl od nodálních nehodgkinských lymfomů, jsou účinné předtím podávané léčby (re-challenge) a účinná bývá také stejná poslední podaná léčba (re-treatment). Léčba cílená na kůži (skin-directed therapy – SDT) je velmi účinná a dobře tolerovaná. Je důležité ji u časných stádií indikovat samostatně (účinnost se pohybuje v rozmezí 54–94 %). U pokročilých stádií (vč. časných stádií refrakterních na první linii léčby) může SDT společně se systémovou léčbou zlepšit odpověď anebo lépe zvládnout lokalizované kožní postižení [28]. U starších pacientů je při rozhodování o léčbě nutné u dostupných léčebných modalit zvažovat také jejich nežádoucí účinky, toxicitu léčby a dopad na HRQOL.
Léčba SS je specifická z důvodu agresivního chování nemoci, vysokého rizika život ohrožující infekce, silného pruritu a významného dopadu na kvalitu života pacientů. Léčba je závislá především na vlastní dostupnosti a únosnosti, tedy na věku a výkonnostním stavu pacienta. Léčbou volby je imunitní systém šetřící terapie spolu s léčbou pruritu a s antimikrobní léčbou či profylaxí. Polychemoterapie ve srovnání s monochemoterapií nevede u SS k významnému zvýšení míry odpovědi, naopak vede k zátěži větší systémovou toxicitou.
Alogenní transplantace krvetvorby představuje u vybraných pacientů s MF a SS jedinou dostupnou léčbou s kurativním potenciálem, je však zatížena relativně vysokým rizikem relapsu a závaž - nou nerelapsovou morbiditou, především reakcí štěpu proti hostiteli (graft-versus-host disease – GvHD) [29].
Doporučení pro léčbu MF a SS v České republice uvádí v přehledu tab. 3 a 4. Moderní systémovou léčbu pokročilých stádií MF a SS doplňuje od roku 2018 mogamulizumab (MOGA).
Tab. 3. Přehled léčby mycosis fungoides; upraveno podle [26]. ![Přehled léčby mycosis fungoides; upraveno podle [26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/39621288c33ebaf369938c0480429d89.jpg)
CHOP – cyklofosfamid, vinkristin, doxorubicin, prednison, CMED – cyklofosfamid, metotrexát, etoposid, dexametazon, ECP – extrakorporální fotoforéza, ICE – ifosfamid, karboplatina, etoposid, MF – mycosis fungoides Tab. 4. Přehled léčby Sézaryho syndromu; upraveno podle [26]. ![Přehled léčby Sézaryho syndromu; upraveno podle [26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ded86f391128b72905f6ea8e3dc89139.jpg)
CHOP – cyklofosfamid, vinkristin, doxorubicin, prednison, CMED – cyklofosfamid, metotrexát, etoposid, dexametazon, ECP – extrakorporální fotoferéza, ICE – ifosfamid, karboplatina, etoposid, IE – ifosfamid, etoposid, SS – Sézaryho syndrom MOGAMULIZUMAB
Mogamulizumab je humanizovaná defukosylovaná monoklonální protilátka IgG1 kappa, která cílí na C-C chemokinový receptor typu 4 (CCR4). CCR4 je důležitý pro migraci T lymfocytů do kůže a míst kožního zánětu. CCR4 je exprimovaný především na regulačních T-buňkách (Tregs) a na pomocných T-buňkách typu 2 (Th2), ale může být exprimovaný také na paměťových T-buňkách (Tm), monocytech, krevních destičkách, neuronech a endoteliálních buňkách. U většiny CTCL, včetně MF a SS, je CCR4 na neoplastických T buňkách nadměrně exprimovaný. Selektivní vazba mogamulizumabu na buňky exprimující CCR4 indukuje buněčnou cytotoxicitu závislou na protilátkách (antibody-dependent cellular cytotoxicity – ADCC) a depleci cílových buněk. Defukosylace Fc oblasti vede u mogamulizumabu k silnější ADCC než u tradičních glykosylovaných protilátek [30–33].
Výsledky klinických studií s MOGA fáze I a II prokázaly slibnou bezpečnost a účinnost u CTCL. Ve studii fáze I/II byla celková četnost odpovědí (overall response rate – ORR) u MF a SS 37 %, vyšší v podskupině se SS (47 %) než v MF (29 %) [34]. Ve studii fáze II byla ORR (hodnocená však podle kritérií Mezinárodní pracovní skupiny, vhodných spíše pro PTCL) 35 % (CR – kompletní odpověď – dosáhlo 14 %). V podskupině pacientů s CTCL byla ORR (při použití hodnocení složeným skóre odpovědí) 50 % (4 z 8 pacientů) [35].
Mogamulizumab byl v roce 2018 na základě výsledků klinické studie MAVORIC schválený FDA (Úřad pro kontrolu potravin a léčiv USA) a EMA (Evropská agentura pro léčivé přípravky) pro léčbu pacientů s relapsem nebo refrakterní MF a SS, kteří byli dříve léčeni alespoň jednou systémovou léčbou [36,37].
KLINICKÁ STUDIE MAVORIC
Studie MAVORIC byla mezinárodní multicentrická otevřená randomizovaná klinická studie fáze III s aktivní kontrolou, která probíhala v 61 centrech v USA, ve státech Evropy, v Japonsku a v Austrálii. Do studie byli zařazeni dospělí s relabující nebo refrakterní MF nebo SS ve stádiu IB-IVB po alespoň jedné předchozí systémové léčbě. Pacienti byli stratifikováni podle podtypu CTCL (MF vs. SS) a klinického stádia (IB-II vs. III-IV). Náhodně byli přiděleni k léčbě MOGA ve schváleném dávkování 1,0 mg/kg intravenózně (ve schématu: 1. cyklus 1., 8., 15. a 22. den, 2. a další cyklus 1. a 15. den; cyklus trval 28 dnů) nebo k léčbě komparátorem: vorinostat (VORI) 400 mg perorálně denně. Léčba pokračovala až do progrese onemocnění nebo nepřijatelné toxicity. Při neúčinnosti (resp. progresi po nejméně 2 cyklech) nebo nežádoucích účincích byl povolen přechod z VORI na MOGA (schéma 1). Do studie byli zařazeni pacienti bez ohledu na stav exprese CCR4 v nádoru. Ze studie byli vyloučeni pacienti s prokázanou histologickou velkobuněčnou transformací (LCT), pacienti po předchozí alogenní transplantaci krvetvorby (HSCT) a pacienti s aktivním autoimunitním onemocněním. Do studie bylo zařazeno 372 pacientů, vstupní charakteristiky souboru shrnuje v tab. 5.
Schéma 1. Studie MAVORIC [37]. ![Schéma 1. Studie MAVORIC [37].](https://pl-master.mdcdn.cz/media/image_pdf/d44279a7c17b2c9cc7a46ab06294ac36.jpg?version=1647858923)
MF – mycosis fungoides, SS – Sézaryho syndrom Tab. 5. Vstupní charakteristiky souboru studie MAVORIC; převzato z [37]. ![Vstupní charakteristiky souboru studie MAVORIC; převzato z [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0d31755fb8d758829304148a28b8dd69.jpg)
Konvenční chemoterapie jako systémová léčba mohla být použita jako monochemoterapie nebo v kombinaci s jinými léčivy.
ECOG – Eastern Cooperative Oncology Group, MF – mycosis fungoides, SS – Sézaryho syndromCílem studie bylo vyhodnotit účinnost a bezpečnost mogamulizumabu. Primární cíl studie, tedy přežití bez progrese (PFS), byl dosažen. V rameni s MOGA bylo PFS signifikantně delší než v rameni s VORI (7,7 vs. 3,1 měsíce) (graf 1). Také sekundárních cílů studie – ORR (hodnocená složeným skóre odpovědí v jednotlivých kompartmentech: kůže, lymfatické uzliny, vnitřní orgány, krev), délka trvání odpovědi (duration of response – DOR) a kvalita života (hodnocená SKINDEX-29, FACT-G, EQ-5D-3L a ItchyQoL) – bylo dosaženo. Ve skupině s MOGA byla ORR oproti skupině s VORI vyšší (28 vs. 5 %) a medián DOR ve skupině s MOGA byl delší než ve skupině s VORI (činilo 14,1 měsíce oproti 9,1 měsíce). Ve skupině s MOGA bylo zaznamenáno statisticky významnější zlepšení příznaků, funkce i celkové kvality života pacientů oproti skupině s VORI. Z hlediska kvality života měli větší prospěch při podávání MOGA pacienti s největší symptomovou zátěží a funkčním postižením [36–38].
Graf 1. Primární cíl studie MAVORIC: doba do progrese (podle výzkumníků); převzato z [37]. ![Primární cíl studie MAVORIC: doba do progrese (podle výzkumníků); převzato z [37].](https://pl-master.mdcdn.cz/media/image_pdf/9f90884dc88cc9fe659cbf320109e700.jpg?version=1647858976)
Zhodnocení výsledků ad hoc analýzami přineslo další výsledky podporující superioritu MOGA. U pacientů se SS byla ORR na MOGA vyšší než u pacientů s MF (37 vs. 21 %). ORR závislá na stádiu u MOGA byla nejvyšší u klinických stádií IV (36 %) v porovnání se stádii IB-IIA nebo IIB (19 %, 16 %). V jednotlivých hodnocených kompartmentech byla vyšší odpověď spíš zaznamenána v krvi (68 %) a na kůži (42 %), než v lymfatických uzlinách (17 %). Odpověď v postižených vnitřních orgánech nebyla zaznamenaná (0 %). Ve všech hodnoceních byla zaznamenána vyšší odpověď u MOGA oproti VORI, viz. tab. 6. Odpověď na MOGA byla přítomna ve všech případech, napříč širokým rozmezím exprese CCR4 (medián exprese CCR4 byl u 290 vyšetřených pacientů 80 %, rozmezí 1–100 %). Další analýza neprokázala žádný rozdíl v ORR u MOGA podle počtu předchozích systémových terapií, typu nebo imunitní aktivity poslední předchozí terapie [39]. Konečně post hoc analýza ve všech skupinách hodnocených stádií a také u obou onemocnění ukázala u MOGA výraznější prodloužení doby do další léčby (time to next treatment – TTNT) než u VORI (medián 11 vs. 3,5 měsíce) [40].
Tab. 6. Hodnocení léčebných odpovědí výzkumníky; převzato z [37]. ![Hodnocení léčebných odpovědí výzkumníky; převzato z [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f6c6a1677abb93da9689260871b14faa.jpg)
*podíl pacientů s celkovou odpovědí, tj. s kompletní nebo částečnou odpovědí, byl hodnocený celkovým složeným skórem odpovědí, p < 0,0001
MF – mycosis fungoides, NE – neodhadnutelný, SS – Sézaryho syndromNejčastějšími nežádoucími účinky mogamulizumabu s výskytem u více než 20 % pacientů byly reakce na infuzi, kožní erupce, průjem, únava, muskuloskeletální bolesti a infekce horních cest dýchacích. Dalšími nežádoucí účinky s výskytem u méně než 10 % pacientů byly kožní infekce, horečka, nevolnost, trombocytopenie, anemie, bolesti hlavy, zácpa, mukositida. Nežádoucí účinky stupně 3–4 byly hlášeny u 41 % pacientů (shodně jako ve skupině s vorinostatem), nejčastěji se jednalo o horečku a celulitidu. Léčbu přerušilo z důvodu toxicity ve skupině s MOGA 19 % pacientů a ve skupině s VORI 23 %. V souvislosti s léčbou MOGA došlo ke dvěma úmrtím, příčinou byla sepse a polymyozitida a v jednom případu došlo k úmrtí nesouvisejícímu s léčbou při progresi onemocnění. Ve skupině s VORI bylo zaznamenáno 9 úmrtí [37].
DISKUZE
Významné zlepšení přežití pacientů s B nehodgkinským lymfomem přineslo zavedení monoklonální protilátky rituximabu do léčby [41,42]. U T nehodgkinských lymfomů, včetně CTCL, dosud nebyla bezpečná, cílená a účinná látka vyvinuta. Pacienti s pokročilým stádiem MF a se SS se potýkají s absencí účinné léčby. Dostupné systémové léčby u MF a SS mají obecně nízkou četnost odpovědí, ORR se pohybuje od 14 % do 60 %, většinou je pouze 20–30 %. Zároveň systémové léčby dosahují krátkého trvání odpovědi, které zřídka přesahuje 12 měsíců, sledované krátkým TTNT, často trvajícím pouze několik měsíců (medián 5,4 měsíce) [43–46]. Navíc chybí dostatečně účinná a dobře snášená udržovací léčba. Mezi moderní systémovou léčbu můžeme v současné době v České republice řadit brentuximab vedotin, alemtuzumab a nově mogamulizumab.
Brentuximab vedotin (BV), anti-CD30 protilátka konjugovaná s monomethylauristatinem E, vykázal ve studii ALCANZA vysokou účinnost u pacientů s CD30+ CTCL. Ve studii bylo dosaženo primárního cíle – ORR4 (procento pacientů, kteří dosáhli celkové odpovědi přetrvávající po dobu nejméně 4 měsíců) 56,3 vs. 12,5 %. Na základě výsledků studie byl v roce 2017 BV schválen FDA a EMA pro léčbu CD30+ CTCL, tj. primárního kožního anaplastického velkobuněčného T lymfomu (PCALCL) a CD30+ MF po nejméně jedné systémové léčbě [47]. Výsledky studie byly potvrzeny ve dvou dalších otevřených studiích u pacientů s relabujícím CD30+ CTCL bez ohledu na úroveň exprese CD30, vč. pacientů s MF a PCALCL, pacientů se SS, s lymfomatoidní papulozou (LyP) a smíšenou histologií CTCL. ORR u MF byl 54–66 % a SS 50 % (PCALCL 67 %; LyP 92 %; smíšená CTCL histologie 82-85 %) [48,49]. V České republice je brentuximab vedotin dostupný pro léčbu CD30+ CTCL, a to po nejméně jedné předchozí systémové terapii. Hlavním nežádoucím účinkem BV je periferní neuropatie, která je obecně reverzibilní. Pro úhradu hrazenou z prostředků zdravotního pojištění je nutné schválení revizním lékařem dle § 16 zákona č. 48/1997 Sb.
Alemtuzumab, humanizovaná anti-CD52 monoklonální protilátka, prokázal dobrou účinnost u MF a SS (ORR 51–85 %). Při obvyklém dávkovacím schématu je zatížen nepřijatelně vysokou toxicitou v důsledku deplece T a B buněk. Alemtuzumab je pro vybrané pacienty s MF a SS, především s krevním postižením, podávaný v nízkém dávkování v zajištění specifickou podpůrnou léčbou [50–52]. V současné době je alemtuzumab v České republice dostupný pouze v centrech intenzivní hematologické péče v tzv. „named patient“ programu.
Inhibitory histondeacetylázy jsou dalšími možnostmi systémové léčby. Vorinostat byl schválen FDA v léčbě CTCL v roce 2006 a romidepsin v roce 2009, dosud však nebyly schváleny EMA a v České republice nejsou dostupné [44,53,54].
Výsledky studie MAVORIC, dosud největší randomizované kontrolované studie u CTCL, prokázaly ve všech primárních i sekundárních cílech superioritu mogamulizumabu ve srovnání s vorinostatem (PFS 7,7 vs. 3,1 měsíce, ORR 28 vs. 5 %, TTNT 11 vs. 3,5 měsíce a signifikantní zlepšení kvality života, symptomů a funkčnosti). Odpovědi byly častější u SS (37 %) ve srovnání s MF (21 %) a lišily se i v jednotlivých kompartmentech (v krvi 68 %, v kůži 42 %, v lymfatických uzlinách 17 %). Obtížnost hodnocení účinnosti MOGA pomocí složeného skóre odpovědí se odráží v dosaženém relativně nízkém ORR 28 %. MOGA vykazoval v klinických studiích celkově bezpečný toxický profil s dobře zvládnutelnými nežádoucími účinky, a to imunitně zprostředkované a infekční. Reakce na infuzi se vyskytla v 34 % (v 90 % případů během nebo krátce po první infuzi). Kožní erupce, manifestující se makulo/papulozní exantémem, lichenoidní nebo granulomatozní dermatitidou, byla zaznamenaná ve 24 % a může být obtížně odlišitelná od progrese onemocnění [37,55]. U pacientů, kteří následně po léčbě MOGA podstoupili alogenní transplantaci krvetvorby před uplynutím 50 dnů od poslední dávky, bylo zaznamenáno významné riziko rozvoje těžké a refrakterní GvHD nebo rozvoj opožděných imunitně podmíněných nežádoucích účinků po HSCT (podobně jako u inhibitorů kontrolních bodů). Tato rizika vyplývají z deplece nemaligních Treg exprimujících CCR4 po expozici MOGA [36,37,55].
Volba moderní systémové léčby MF i SS v druhé a další linii závisí na faktorech na straně pacienta (výkonnostní stav, komorbidity, únosnost k alogenní transplantaci krvetvorby, dostupnost péče, preference). U MF je nutné zvažovat charakteristiky onemocnění (stádium, forma postižení – kožní, uzlinové, viscerální či postižení krve a CD30 exprese) a prognostické faktory (histologická varianta, velkobuněčná transformace, dynamika vývoje onemocnění). Při volbě léčby u SS se můžeme řídit mírou mimokožního postižení. MOGA je vhodnou léčbou pro pacienty s MF/SS s postižením kompartmentů krve a kůže, pravděpodobně s lepším toxickým profilem ve srovnání s alemtuzumabem. Při rozhodování mezi MOGA a brentuximabem vedotinem může svoji roli sehrát také toxický profil. Brentuximab vedotin má omezené použití, pouze pro pacienty s CD30+ CTCL. Výsledky studie ALCANZA prokázaly účinnost BV u pokročilých stádií MF (stádia IIB, IIIA, IIIB), vč. CD30+ LCT-MF, bez postižení v krevním kompartmentu. Do studie nebyli zařazeni pacienti s pokročilou MF s postižením krevního kompartmentu (stádia IVA a IVB).
Zlepšení léčebných výsledků (případně toxického profilu) mogamulizumabu u CTCL se očekává od kombinované léčby. Probíhají klinické studie kombinované léčby MOGA s extrakorporální fotoferézou, s celotělovým ozářením svazkem elektronů a s inhibitory kontrolních bodů. Kombinovaná léčba BV (např. s lenalidomidem, s romidepsinem) je předmětem klinických studií. Vedle výzkumu a vývoje dalších nových léků probíhají klinické studie s novými léky u CTCL s nadějnými výsledky, např. lacutamab, cobomarsen, AFM13, rhIL-15, inhibitory kontrolních bodů (pembrolizumab), inhibitory PI3 kinázy (tenalisib, duvesilib) [44].
Mogamulizumab je od roku 2021 v České republice registrovaným léčivým přípravkem. Správní řízení na žádost držitele rozhodnutí o registraci o stanovení úhrady z prostředků zdravotního pojištění není ukončeno. V současné době je MOGA dostupný pouze na základě schválení revizním lékařem dle § 16 zákona č. 48/1997 Sb. V listopadu 2021 byl MOGA podán prvnímu pacientovi v České republice [56].
ZÁVĚR
Mycosis fungoides a Sézaryho syndrom jsou vzácná onemocnění zatížená významnou morbiditou a mortalitou a dopadem na kvalitu života pacientů. U mycosis fungoides a Sézaryho syndromu dosud chybí účinná systémová léčba. Mogamulizumab spolu s brentuximabem vedotinem a alemtuzumabem představují moderní účinnou léčbu s vysokou četností celkových odpovědí a relativně dlouhým trváním odpovědí dostupnou také v České republice. Nežádoucí účinky mogamulizumabu jsou imunitně podmíněné, přičemž jejich závažnost, povaha a dlouhodobý dopad nejsou dostatečně známy a vyžadují další výzkum. U konkrétních pacientů s mycosis fungoides a Sézaryho syndromem může mogamulizumab prodloužit život a zlepšit kvalitu života.
ČESTNÉ PROHLÁŠENÍ
Autor prohlašuje, že v posledních 24 měsících poskytl konzultační služby společnosti Kyowa Kirin, zúčastnil se odborné akce s podporou společnosti Kyowa Kirin a že vznik a publikace článku byly podpořeny společností Kyowa Kirin.
Doručeno do redakce dne: 19. 11. 2021.
Přijato po recenzi dne: 5. 1. 2022.
MUDr. Jindřich Polívka, MHA
Ústav hematologie a krevní transfuze
U Nemocnice 2094/1
128 00 Praha 2
e-mail: jindrich.polivka@uhkt.cz
Zdroje
1. Willemze R, Cerroni L, Kempf W, et al. The 2018 update of the WHO-EORTC classification for primary cutaneous lymphomas. Blood. 2019; 133 (16): 1703–1714.
2. Kempf W, Mitteldorf C. Cutaneous T-cell lymphomas – an update 2021. Hematol Oncol. 2021; 39 : 46–51.
3. Agar NS, Wedgeworth E, Crichton E, et al. Survival outcomes and prognostic factors in mycosis fungoides/Sezary syndrome: validation of the revised International Society for Cutaneous Lymphomas/European Organisation for Research and Treatment of Cancer staging proposal. J Clin Oncol. 2010; 28 : 4730–4739.
4. de Coninck EC, Kim YH, Varghese A, et al. Clinical characteristics and outcome of patients with extracutaneous mycosis fungoides. J Clin Oncol. 2001; 19 : 779–784.
5. Kim YH, Liu HL, Mraz-Gernhard S, et al. Long-term outcome of 525 patients with mycosis fungoides and Sezary syndrome: clinical prognostic factors and risk for disease progression. Arch Dermatol. 2003; 139 : 857–866.
6. Dobos G, Pohrt A, Ram-Wolff C, et al. Epidemiology of cutaneous T-cell lymphomas: a systematic review and meta-analysis of 16,953 patients. Cancers 2020; 12 : 2921.
7. Ettler J, Mužík J, Polívka J. Epidemiologie primárních kožních lymfomů v České republice podle dat Národního onkologického registru z let 2005–2015. Onkologie. 2018; 12 (3): 100–104.
8. Polivka J., Muzik J. Epidemiology of primary cutaneous lymphomas in the Czech Republic according to data of the Czech National Cancer Registry. Cutaneous lymphomas: insight & therapeutic progress, 13–15 October 2017, London.
9. Campbell JJ, Clark RA, Watanabe R, et al. Sezary syndrome and mycosis fungoides arise from distinct T-cell subsets: a biologic rationale for their distinct clinical behaviors. Blood. 2010; 116 : 767–771.
10. Horna P, Moscinski LC, Sokol L, et al. Naive/memory T-cell phenotypes in leukemic cutaneous T-cell lymphoma: putative cell of origin overlaps disease classification. Cytometry B Clin. Cytom. 2019; 96B: 234–241.
11. Roelens M, Delord M, Ram-Wolff C, et al. Circulating and skin-derived Sezary cells: clonal but with phenotypic plasticity. Blood. 2017; 130 : 1468–1471.
12. Scarisbrick JJ, Quaglino P, Prince HM, et al. The PROCLIPI international registry of early-stage mycosis fungoides identifies substantial diagnostic delay in most patients. Br J Dermatol. 2019; 181 : 350–357.
13. Ram-Wolff C, Martin-Garcia N, Bensussan A, et al. Histopathologic diagnosis of lymphomatous versus inflammatory erythroderma: a morphologic and phenotypic study on 47 skin biopsies. Am J Dermatopathol. 2010; 32 (8): 755–763.
14. Olsen EA, Whittaker S, Kim YH, et al. Clinical endpoints and response criteria in mycosis fungoides and Sézary syndrome: a consensus statement of the International Society for Cutaneous Lymphomas (ISCL), the United States Cutaneous Lymphoma Consortium (USCLC), and the Cutaneous Lymphoma Task Force of the European Organization of Research and Treatment of Cancer (EORTC). J Clin Oncol. 2011; 29 : 2598–2607.
15. Gibbs JD, Ma S, Kim A, et al. Utility of flow cytometry and gene rearrangement analysis in tissue and blood of patients with suspected cutaneous T-cell lymphoma. Oncol Rep. 2021; 45 : 349–358.
16. Olsen E, Vonderheid E, Pimpinelli N, et al. Revisions of the staging and classification of mycosis fungoides and Sézary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the Cutaneous Lymphoma Task Force of the European Organization of Research and Treatment of Cancer (EORTC). Blood. 2007; 110 : 1715–1722.
17. Hristov AC, Tejasvi T, Wilcox RA. Mycosis fungoides and Sézary syndrome: 2021 update on diagnosis, risk‐stratification, and management. Am J Hematol. 2021; 96 (10): 1313–1328.
18. Scarisbrick JJ, Prince H, Vermeer MH, et al. Cutaneous Lymphoma International Consortium study of outcome in advanced stages of mycosis fungoides and Sézary syndrome: effect of specific prognostic markers on survival and development of a prognostic model. J Clin Oncol. 2015; 33 : 3766–3773.
19. Benton EC, Crichton S, Talpur R, et al. A cutaneous lymphoma international prognostic index (CLIPi) for mycosis fungoides and Sezary syndrome. Eur J Cancer. 2013; 49 : 2859–2868.
20. Scarisbrick JJ, Kim YH, Whittakeet SJ, et al. Prognostic factors, prognostic indices and staging in mycosis fungoides and Sézary syndrome: where are we now? Br J Dermatol. 2014; 170 (6): 1226–1236.
21. Scarisbrick J, Quaglino P, Prince M et al. Prognostic factors in mycosis fungoides: the PROCLIPI study. In EORTC-CLTF Meeting on Cutaneous Lymphoma-Insights in Research and Catient Care. 2019; 119: S26–S26.
22. NCCN Guidelines. Primary Cutaneous Lymphomas. Version 2.2021 – March 4, 2021. [cit. 10. 11. 2021] Dostupné z: https: //www.nccn.org/professionals/physician_gls/pdf/primary_cutaneous.pdf
23. Willemze R, Hodak E, Zinzani PL, et al. Primary cutaneous lymphomas: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018; 29: iv30–iv40.
24. Wang Y, Bagot M. Updates in cutaneous lymphoma: evidence-based guidelines for the management of cutaneous lymphoma 2018. Br J Dermatol. 2019; 180 : 443–444.
25. Trautinger F, Eder J, Assaf C, et al. European Organisation for Research and Treatment of Cancer consensus recommendations for the treatment of mycosis fungoides/Sezary syndrome – update 2017. Eur J Cancer. 2017; 77 : 57–74.
26. Belada D, Trněný M, et al. Diagnostické a léčebné postupy u nemocných s maligními lymfomy – XI. vydání, KAP CZ, s. r. o., září 2020. ISBN 978-80-86780-61-0.
27. Quaglino P, Maule M, Prince HM, et al. Global patterns of care in advanced stage mycosis fungoides/Sezary syndrome: a multicenter retrospective follow-up study from the Cutaneous Lymphoma International Consortium. Ann Oncol. 2017; 28 : 2517–2525.
28. Tarabadkar ES, Shinohara MM. Skin directed therapy in cutaneous T-cell lymphoma. Front Oncol. 2019; 9 : 260.
29. Domingo-Domenech E, Duarte RF, Boumedil A, et al. Allogeneic hematopoietic stem cell transplantation for advanced mycosis fungoides and Sézary syndrome. An updated experience of the Lymphoma Working Party of the European Society for Blood and Marrow Transplantation. Bone Marrow Transplant. 2021; 6 : 1391–1401.
30. Wu XS, Lonsdorf AS, Hwang ST. Cutaneous T-cell lymphoma: roles for chemokines and chemokine receptors. J Invest Dermatol. 2009; 129 : 1115–1119.
31. Sokolowska-Wojdylo M, Wenzel J, Gaffal E, et al. Circulating clonal CLA (þ) and CD4 (þ) T cells in Sezary syndrome express the skin-homing chemokine receptors CCR4 and CCR10 as well as the lymph node-homing chemokine receptor CCR7. Br J Dermatol. 2005; 152 : 258–264.
32. Reneau JC, Wilcox RA. Novel therapies targeting cutaneous T cell lymphomas and their microenvironment. Sem Hematol. 2021; 58 : 103–113.
33. Larocca C, Kupper TS, LeBoeuf NR. Mogamulizumab forecast: clearer patients, with a slight chance of immune mayhem. Clin Cancer Res. 2019; 25 (24): 7272–7274.
34. Duvic M, Pinter-Brown LC, Foss FM, et al. Phase 1/2 study of mogamuli - zumab, a defucosylated anti-CCR4 antibody, in previously treated patients with cutaneous T-cell lymphoma. Blood. 2015; 125 (12): 1883–1889.
35. Ogura M, Ishida T, Hatake K, et al. Multicenter phase II study of mogamulizumab (KW-0761), a defucosylated anti-cc chemokine recep - tor 4 antibody, in patients with relapsed peripheral T-cell lymphoma and cutaneous T-cell lymphoma. J Clin Oncol. 2014; 32 (11): 1157–1163.
36. Kasamon YL, Chen H, de Claro RA, et al. FDA approval summary: mogamulizumab-kpkc for mycosis fungoides and Sezary syndrome. Clin Cancer Res. 2019; 25 : 7275–7280.
37. Kim YH, Bagot M, Pinter-Brown L, et al. Mogamulizumab versus vorinostat in previously treated cutaneous T-cell lymphomas (MAVORIC): an international, open-label, randomised, controlled phase 3 trial. Lancet Oncol. 2018; 19 (9): 1192–11204.
38. Porcu P, Hudgens S, Horwit S, et al. Quality of life effect of the anti-CCR4 monoclonal antibody mogamulizumab versus vorinostat in patients with cutaneous T-cell lymphoma. Clin Lymphoma Myeloma Leuk. 2021; 21 (2): 97–105.
39. Zinzani PL, Horwitz SM, Kim YH, et al. Efficacy of mogamulizumab by prior systemic therapy in patients with previously treated cutaneous T-cell lymphoma: post hoc analysis from the phase 3 MAVORIC study. Blood. 2018; 132 : 1619.
40. Pro B, Kim YH, Ortiz Romero PL, et al. Time to next treatment in patients with previously treated cutaneous T-cell lymphoma (CTCL) receiving mogamulizumab or vorinostat: a MAVORIC post hoc analysis. Hematol Oncol. 2019; 37 (15s): abstract 7539.
41. Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med. 2002; 346 : 235–242.
42. Salles G, Seymour JF, Offner F, et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet. 2011; 377 (9759): 42–51.
43. Photiou L, van der Weyden C, McCormack C, Miles Prince H. Systemic treatment options for advanced-stage mycosis fungoides and Sézary syndrome. Curr Oncol Rep. 2018; 20 (4): 32.
44. Sethi, TK, Montanari F, Foss F, et al. How we treat advanced stage cutaneous T‐cell lymphoma–mycosis fungoides and Sézary syndrome. Brit J Haemat. 2021; 195 (3): 352–364.
45. Whittaker S, Hoppe R, Prince HM. How I treat mycosis fungoides and Sezary syndrome. Blood. 2016; 127 (25): 3142–3153.
46. Hughes CFM, Khot A, McCormack C, et al. Lack of durable disease control with chemotherapy for mycosis fungoides and Sézary syndrome: a comparative study of systemic therapy. Blood. 2015; 125 (1): 71–81.
47. Prince HM, Kim YH, Horwitz SM, et al. Brentuximab vedotin or physician’s choice in CD30-positive cutaneous T-cell lymphoma (ALCANZA): an international, open-label, randomised, phase 3, multicentre trial. Lancet. 2017; 390 : 555–566.
48. Duvic M, Tetzlaff MT, Gangar P, et al. Results of a phase II trial of brentuximab vedotin for CD30+ cutaneous T-cell lymphoma and lymphomatoid papulosis. J Clin Oncol. 2015; 33 (32): 3759–3765.
49. Kim YH, Tavallaee M, Sundram U, et al. Phase II investigator-initiated study of brentuximab vedotin in mycosis fungoides and Sézary syndrome with variable CD30 expression level: a multi-institution collaborative project. J Clin Oncol. 2015; 33 (32): 3750–3758.
50. Stewart JR, Desai N, Rizvi S, et al. Alemtuzumab is an effective thirdline treatment versus single-agent gemcitabine or pralatrexate for refractory Sezary syndrome: a systematic review. Eur J Dermatol. 2018; 28 (6): 764–774.
51. Lundin J, Hagberg H, Repp R, et al. Phase 2 study of alemtuzumab (anti-CD52 monoclonal antibody) in patients with advanced mycosis fungoides/Sézary syndrome. Blood. 2003; 101 : 4267–4272.
52. deMasson A, Guitera P, Brice P, et al. Long-term efficacy and safety of alemtuzumab in advanced primary cutaneous T-cell lymphomas. Br J Dermatol. 2014; 170 (3): 720–724.
53. Olsen EA, Kim YH, Kuzel TM, et al. Phase IIb multicenter trial of vorinostat in patients with persistent, progressive, or treatment refractory cutaneous T-cell lymphoma. J Clin Oncol 2007; 25 (21): 3109–3115.
54. Piekarz RL, Frye R, Turner M, et al. Phase II multi-institutional trial of the histone deacetylase inhibitor romidepsin as monotherapy for patients with cutaneous T-cell lymphoma. J Clin Oncol. 2009; 27 (32): 5410–5417.
55. Zinzani PL, Quaglino P, Violetti SA, et al. Critical concepts and management recommendations for cutaneous T‐cell lymphoma: A consensus‐based position paper from the Italian Group of Cutaneous Lymphoma. Hematol Oncol. 2021; 39 (3): 275–283.
56. Polívka J. Mogamulizumab: nová léčba pokročilých stádií kožních T buněčných lymfomů – mycosis fungoides a Sézaryho syndromu. Onkologie. 2021; 15 (4): 187–193.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek EditorialČlánek Dr. Horská slaví 70 let
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2022 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Novinky v léčbě mycosis fungoides a Sézaryho syndromu
- Současný výskyt akutní megakaryoblastické leukemie a germinálního tumoru mediastina – kazuistika a přehled literatury
- Editorial
- Izolovaná infiltrace ledviny suspektními leukemickými buňkami – kazuistika s komplexní diferenciální diagnostikou neobvyklého stavu
- Doporučení České společnosti paliativní medicíny ČLS JEP a Společnosti pro transfuzní lékařství ČLS JEP
- Doporučení laboratorní sekce České hematologické společnosti ČLS JEP
- MUDr. Marcela Lukášová – ušlechtilá dáma české hematologie
- Muž s dýmkou, prof. MUDr. Pavel Klener, DrSc., se v dubnu 2022 dožívá 85 let
- Doc. RNDr. Miroslav Pecka, CSc., slaví 75 let
- Primář MUDr. Vladimír Komrska, CSc., sedmdesátiletý
- MUDr. Jan Haber, CSc., sedmdesátiletý
- Dr. Horská slaví 70 let
- Letermovir u pacientů po alogenní transplantaci krvetvorných buněk – přehled literatury
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení laboratorní sekce České hematologické společnosti ČLS JEP
- MUDr. Jan Haber, CSc., sedmdesátiletý
- Letermovir u pacientů po alogenní transplantaci krvetvorných buněk – přehled literatury
- Doporučení České společnosti paliativní medicíny ČLS JEP a Společnosti pro transfuzní lékařství ČLS JEP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



