-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodnocení vybraných ukazatelů apoptózy a angiogeneze u chronické lymfocytární leukemie
Assessment of selected markers of apoptosis and angiogenesis in chronic lymphocytic leukemia
Introduction:
Search for new prognostic markers in order to improve prognostic accuracy and predict clinical outcome at the time of diagnosis has recently become one of the major trends in chronic lymphocytic leukemia (CLL).Patients and methods, aim of study:
The aim of our study was assessment of selected markers of apoptosis and angiogenesis and their potential as new prognostic factors. We evaluated serum levels of tumor necrosis factor α (TNF‑α) and transforming growth factor β ‑ 1 (TGF‑β1) using comercially available enzyme‑linked immunosorbent assay; furthemore, we quantified expression of type II receptor for transforming growth factor beta (TGFβRII) and type 2 receptor for fibroblast growth factor ‑ 2 (FGFR2) on CLL cells using flow cytometry analysis in 75 previously untreated patients with CLL (47 males and 28 females, median age, 65 years, range 38 – 82) and healthy donors.Results:
We found significantly elevated TNF‑α in patients with CLL compared to the control group (p < 0.0001); high expression of TNF‑α was associated with unfavourable prognosis: significantly higher concentrations were found in patients with Rai high‑risk group compared to low and intermediate-risk group (p = 0.0008 and p = 0.0097), with high serum β2 - microglobulin (p = 0.045), massive lymphadenopathy (p = 0.0083), unmutated genes for variable region of immunoglobulin heavy chain (IgVH) (p = 0.041) and unfavourable cytogenetic aberrations (p = 0.0014). In addition, patients with progressive CLL had significantly higher TNF‑α than those with stable clinical course (p = 0.0009); time to treatment was significantly shorter in patients with higher TNF‑α (p = 0.0049). Higher TGF‑β1 concentrations were associated with favourable subgroups: with Rai low ‑ risk group compared to high‑risk group (p = 0.011), patients without massive lymphadenopathy (p = 0.041), patients with mutated IgVH (p = 0.012) and ZAP ‑ 70 negativity (zeta‑associated protein of 70 kilodaltons) (p = 0.044). Patients with progressive CLL had significantly lower TGF‑β1 levels than those with stable course (p = 0.0014) and time to treatment was significantly longer in patients with higher TGF‑β1 (p = 0.016). Patients with Rai high‑risk group had significantly lower TGFβRII expression than those with low ‑ risk group (p = 0.022). The prognostic significance of FGFR2 was not found. Significant and independent prognostic factors for overall survival were high serum concentrations of TNF‑α and massive lymphadenopathy (p = 0.036, resp. p = 0.047).Conclusion:
Based on our results, TNF‑α and TGF‑β1 possess prognostic significance in CLL; further research in this direction may also be important therapeutically, because these signal pathways could serve as possible treatment targets.Key words:
chronic lymphocytic leukemia – prognosis – TNF‑α – TGF‑β1 – TGFβRII – FGFR2 – apoptosis – angiogenesis
Autoři: M. Motyčková 1; L. Smolej 1; C. Andrýs 2
; V. Řezáčová 2; V. Řeháček 3; M. Šimkovič 1; D. Belada 1; P. Žák 1
Působiště autorů: IV. interní hematologická klinika Lékařské fakulty a FN Hradec Králové, přednosta doc. MU Dr. Pavel Žák, Ph. D. 1; Ústav klinické imunologie a alergologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc. 2; Transfuzní oddělení Lékařské fakulty UK a FN Hradec Králové, přednosta prim. MU Dr. Vít Řeháček 3
Vyšlo v časopise: Vnitř Lék 2013; 59(9): 782-793
Kategorie: Původní práce
Souhrn
Úvod:
Jedním z hlavních trendů u chronické lymfocytární leukemie (CLL) se v posledních letech stalo hledání nových prognostických faktorů umožňujících zpřesnit prognózu, a předpovědět tak klinický průběh onemocnění již v době stanovení diagnózy s možností načasování a přizpůsobení intenzity léčby individuálnímu riziku nemocného.Pacienti a metody, cíle práce:
Cílem naší práce bylo zhodnocení prognostického významu vybraných ukazatelů apoptózy a angiogeneze: byly měřeny sérové koncentrace tumor nekrotizujícího faktoru α (TNF‑α) a transformujícího růstového faktoru β ‑ 1 (TGF‑β1) metodou ELISA a exprese receptoru typu II pro TGF‑β (TGFβRII) a receptoru typu 2 pro fibroblastový růstový faktor (FGFR2) průtokovou cytometrií na lymfocytech periferní krve u 75 neléčených pacientů s CLL (47 mužů a 28 žen, medián věku 65 let, rozmezí 38 – 82 let).Výsledky:
Sérové koncentrace TNF‑α byly významně vyšší u nemocných s CLL v porovnání s kontrolní skupinou (p < 0,0001) a byly spojeny s nepříznivou prognózou: významně vyšší TNF‑α měli nemocní s vysokým rizikem dle Raie v porovnání s nemocnými s nízkým i středním rizikem (p = 0,0008, resp. p = 0,0097), nemocní s vysokou hodnotou sérového b2 - mikroglobulinu (p = 0,045), masivní lymfadenopatií (p = 0,0083), nemutovanými geny pro variabilní části těžkých řetězců imunoglobulinů (p = 0,041) a nepříznivými cytogenetickými aberacemi (p = 0,0014). Nemocní s progresí CLL měli významně vyšší hodnoty TNF‑α než nemocní se stabilním průběhem (p = 0,0009) a období do zahájení léčby bylo významně kratší u pacientů s vyššími koncentracemi TNF‑α (p = 0,0049). Zvýšené koncentrace TGF ‑ β1 byly naopak spojeny s příznivou prognózou: významně vyšší TGF‑β1 byl zjištěn u nemocných s nízkým rizikem dle Raie v porovnání s vysokým rizikem (p = 0,011), u nemocných bez masivní lymfadenopatie (p = 0,041), s mutovanými IgVH geny (p = 0,012) a negativitou ZAP ‑ 70 (zeta - asociovaný protein o 70 kilodaltonech) (p = 0,044). Nemocní s progredující chorobou měli významně nižší hodnoty TGF‑β1 než nemocní se stabilním onemocněním (p = 0,0014). Období do zahájení léčby bylo významně delší u nemocných s vyšším TGF‑β1 (p = 0,016). U nemocných s vysokým rizikem dle Raie v porovnání s nemocnými s nízkým rizikem byla zjištěna významně nižší exprese TGFβRII (p = 0,022). Prognostický význam exprese FGFR2 nebyl prokázán. Statisticky významnými a nezávislými prognostickými faktory pro celkové přežití byly zvýšené sérové koncentrace TNF‑α a masivní lymfadenopatie (p = 0,036, resp. p = 0,047).Závěr:
Další výzkum TNF‑α a TGF‑β je cenný nejen z prognostického, ale také léčebného hlediska, neboť signální dráhy těchto cytokinů by se mohly stát terapeutickým cílem u nemocných s CLL.Klíčová slova:
chronická lymfocytární leukemie – prognóza – TNF‑α – TGF‑β1 – TGFβRII – FGFR2 – apoptóza – angiogenezeÚvod
Chronická lymfocytární leukemie (CLL) je nejčastějším leukemickým onemocněním dospělých v euroamerické populaci s velmi variabilním klinickým průběhem [1]. V posledních letech se pohled na CLL zásadně změnil a pozornost se soustředila vedle použití intenzivní imunochemoterapie a některých nových léčiv zejména na studium prognostických faktorů.
Významnou roli v patogenezi CLL sehrává signální dráha nukleárního faktoru kappa B (NF ‑ kB), jejíž stálá aktivace je jedním z hlavních mechanizmů, který u CLL vede ke zvýšení metabolizmu buněk, jejich proliferaci a v neposlední řadě také umocňuje nevnímavost leukemických buněk vůči apoptóze, čímž zvyšuje jejich přežívání [2 – 4]. Jako ukazatel míry aktivace dráhy NF ‑ kB jsme zvolili sérovou koncentraci TNF‑α, který je NF ‑ kB pozitivně transkripčně regulován. B‑lymfocyty u CLL konstitutivně a spontánně produkují TNF‑α a jeho zvýšené hladiny lze u pacientů s CLL v séru/ plazmě detekovat [5 – 10]. U pacientů s CLL byla zjištěna exprese receptorů pro TNF‑α na maligních B‑lymfocytech, receptory byly nalezeny také v séru [11]. I když je biologický efekt TNF‑α různorodý, většina prací prokázala, že u CLL převažuje jeho funkce anti‑apoptotická a že působí jako autokrinní růstový faktor pro maligní B‑lymfocyty [7,10 – 12]. Ve většině studií jsou vyšší sérové/ plazmatické koncentrace TNF‑α spojovány s nepříznivou prognózou včetně kratšího období do zahájení léčby (time to treatment – TTT) i celkového přežití (overall survival – OS) (ve studii Ferrajoliové et al byl vyšší TNF‑α nezávislým faktorem pro OS včetně nemocných ve stadiích 0 – II dle Raie) [7,13 – 15].
Transformující růstový faktor β (TGF‑β) patří do rodiny TGF‑β proteinů; dosud bylo nalezeno 6 typů specifických povrchových buněčných receptorů zprostředkujících funkci těchto proteinů. Stěžejní jsou vysokoafinní typ I a typ II receptorů (TGFβRI a TGFβRII). Funkcí TGF‑β proteinů je zejména kontrola buněčné proliferace (na většinu buněk má antiproliferativní účinek), diferenciace, migrace a apoptózy (sníženou expresí Bcl ‑ 2 a Bcl ‑ XL potencuje apoptózu). Úlohu hrají i v imunitních dějích, kde působí převážně imunosupresivně, čímž inhibují protinádorové imunitní mechanizmy [10,16 – 19]. Transformující růstový faktor β je také důležitým aktivátorem angiogeneze, vede k sekreci hlavních angiogenních faktorů, a to fibroblastového růstového faktoru ‑ 2 (FGF ‑ 2) a cévního endotelového růstového faktoru (VEGF) [20,21]. TGF‑β je intenzivně studován v souvislosti s rozvojem některých solidních nádorů i hematologických malignit. I v patogenezi CLL hraje signální dráha TGF‑β důležitou roli [17,20]. Jeho úloha je však kontroverzní – u většiny pacientů s CLL přispívá autokrinní produkce TGF‑β k útlumu proliferace maligních B‑lymfocytů (zejména v časnějších stadiích), pomalejší progresi a indolentnímu průběhu onemocnění. Některé práce potvrdily tuto teorii nálezem významně nižších hladin TGF‑β u pacientů v pokročilých stadiích CLL [22 – 24]. Asi 1/ 3 pacientů s CLL je však (i v případech vysoké sekrece TGF‑β) vůči anti‑proliferačnímu a pro‑apoptotickému působení TGF‑β odolná [10,24,25]. Hlavní mechanizmus odolnosti vůči TGF‑β u CLL spočívá v patologii receptorů TGFβR na leukemických buňkách [17,23,25 – 27]. Genetické defekty TGFβRI či TGFβRII vedou ke snížení či ztrátě jejich exprese či k funkčním poruchám v TGFβR signalizaci navzdory normální expresi receptoru [20,25,27]. Ztráta citlivosti vůči působení TGF‑β tak může přispívat k progresi a agresivnějšímu průběhu CLL [25,28,29].
Fibroblastový růstový faktor ‑ 2 (FGF ‑ 2, dříve označován jako bazický fibroblastový růstový faktor – bFGF) je protein, jehož hlavní funkcí je úloha mitogenní, která není specifická pouze pro endotelie (jedná se o 1 z nejdůležitějších aktivátorů angiogeneze), ale působí také na fibroblasty nebo epiteliální buňky. Na maligní lymfocyty CLL působí anti‑apoptoticky [23,30 – 32]. Funkce FGF ‑ 2 se uplatňuje po vazbě na vysokoafinní transmembránové receptory (existují 4 typy – FGFR1 – 4), kdy dochází k aktivaci intracelulární části receptorů s funkcí tyrozin-kinázy a spuštění nitrobuněčné signalizace [30,33]. V séru či plazmě pacientů s CLL byly nalezeny zvýšené koncentrace FGF ‑ 2 i VEGF [23,31,34 – 38]. Dalším důležitým nálezem je vedle produkce angiogenních faktorů také exprese pro ně určených receptorů CLL buňkami, čímž je zajištěna i autokrinní stimulace novotvorby cév. Zatím byla u CLL jednoznačně ověřena exprese receptorů pro VEGF včetně jejich solubilní formy [39,40]. K dispozici je však velmi omezené množství prací zkoumajících expresi FGFR na leukemických buňkách CLL [41 – 43]. Zatím nejrozsáhlejší publikací týkající se problematiky exprese FGFR konkrétně u CLL je práce Krejčí. Krejčí et al prokázali expresi všech 4 typů FGFR na leukemických CLL-lymfocytech, nejsilněji (ve 100 % případů) byl exprimován typ FGFR1IIIc, velmi slabě naopak FGFR3IIIb a oba typy FGFR2 (IIIb i IIIc) [42]. Vyšší koncentrace FGF ‑ 2 a VEGF jsou spojeny s pokročilým klinickým stadiem, časnou progresí CLL a horší odpovědí na léčbu fludarabinem [1,23,32,37,38,40]. Některé práce ukázaly, že cirkulující FGF ‑ 2 a TGF‑β klesají po intenzivní léčbě purinovými analogy [35,36].
Cílem naší práce bylo:
- stanovení vybraných ukazatelů apoptózy a angiogeneze,
- zhodnocení jejich vztahu k prognostickým faktorům,
- zhodnocení souvislosti ukazatelů apoptózy a angiogeneze s klinickým průběhem onemocnění – celkovým přežitím (OS) a obdobím do zahájení léčby 1. linie (TTT).
Pacienti a metody
Do studie bylo zařazeno 75 nemocných s chronickou lymfocytární leukemií diagnostikovaných na IV. interní hematologické klinice FN Hradec Králové od ledna roku 2007 do srpna roku 2010. Před vstupem do studie podepsali všichni nemocní informovaný souhlas a studie byla provedena dle zásad Helsinské deklarace. Žádný z nemocných nebyl v době odběru zjišťovaných ukazatelů léčen. Diagnóza CLL vyžadovala splnění diagnostických kritérií dle mezinárodních doporučení NCI ‑ WG z roku 2008. Dle těchto doporučení byla v našem souboru také definována progredující (aktivní) choroba (s nutností zahájení léčby), ostatní případy byly označeny jako stabilní onemocnění [44].
Základní charakteristiky nemocných jsou uvedeny v tab. 1.
Tab. 1. Deskriptivní charakteristiky nemocných. 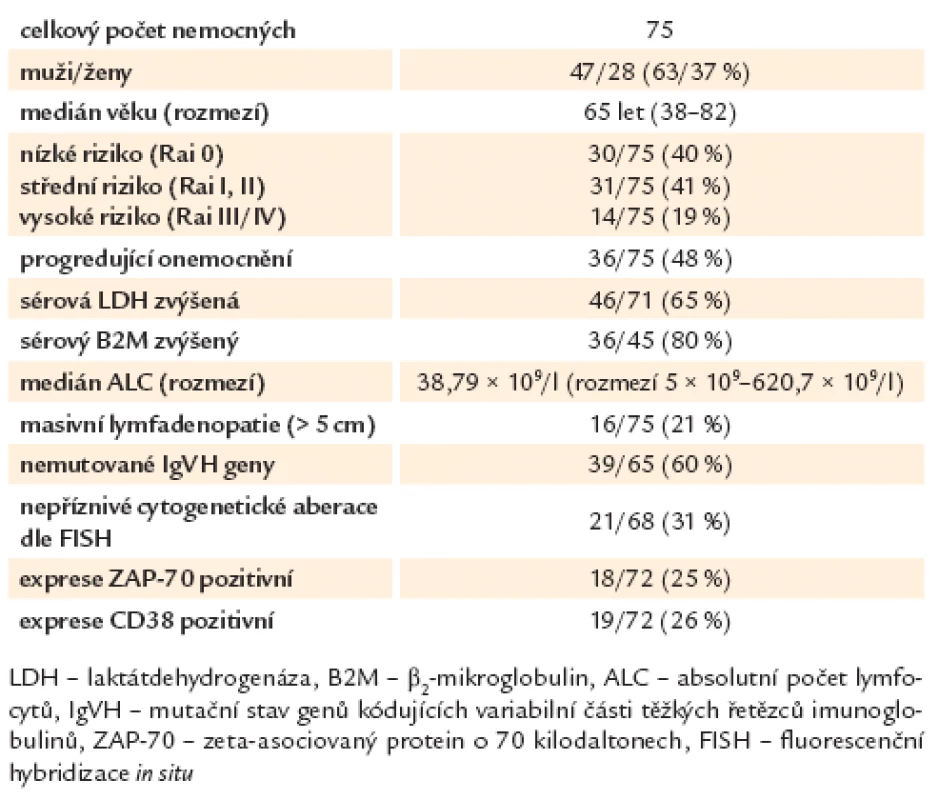
Do souboru bylo zařazeno 47 mužů (63 %) a 28 žen (37 %) s věkovým mediánem 65 let (rozmezí 38 – 82 let) v době odběru vybraných ukazatelů. Nízké/ střední/ vysoké riziko dle modifikovaného Raiova stagingu (stadium 0/ I a II/ III a IV) bylo přítomno u 30/ 31/ 14 nemocných (40/ 41/ 19 %) [45]. Sérová koncentrace laktátdehydrogenázy (LDH) byla vyšetřena u 71/ 75 (95 %) nemocných, u 46 pacientů (65 %) byla zvýšena nad horní hranici normy (3,75 μkat/ l). β2 - mikroglobulin (B2M) byl vyšetřen u 45/ 75 (60 %) pacientů, u 36 z nich (80 %) byla jeho hladina zvýšena nad horní hranici normy (1,8 μmol/ l). Medián absolutního počtu lymfocytů v periferní krvi (ALC) v době zařazení do studie byl 38,79 × 109/ l (rozmezí 5 × 109 – 620,7 × 109/ l). Mutační stav genů pro variabilní část těžkých řetězců imunoglobulinů (IgVH) byl vyšetřen z nesrážlivé periferní krve reverzně transkriptázovou polymerázovou řetězovou reakcí (RT‑PCR) s následnou sekvenací PCR produktů. Mutované IgVH geny měly více než 2 % rozdíl vůči sekvenci odpovídající zárodečné linii. K dispozici bylo hodnocení IgVH u 65/ 75 (87 %) nemocných. Dvacet šest pacientů (40 %) mělo mutované geny pro IgVH, 39 (60 %) mělo nemutované geny. Přítomnost cytogenetických aberací byla stanovena pomocí fluorescenční hybridizace in situ (FISH) u 68/ 75 nemocných (91 %) a hodnocena dle Döehnerovy hierarchické klasifikace [46]. Delece dlouhého ramene 13. chromozomu (del 13q14) byla nalezena u 19/ 68 nemocných (28 %), trisomie 12 u 12/ 68 (18 %), delece části dlouhého ramene 11. chromozomu (del 11q) u 16/ 68, (24 %) a delece krátkého ramene 17. chromozomu (del 17p13) u 5/ 68 nemocných (7 %). Šestnáct nemocných (16/ 68, 23 %) nemělo zachyceny žádné změny. Nemocní byli dle cytogenetického nálezu rozděleni do 2 rizikových skupin. Ve skupině s nízkým rizikem a příznivější prognózou byli nemocní s normálním nálezem, izolovanou del 13q14 a trisomií 12 (47/ 68, 69 %), do skupiny s nepříznivou prognózou patřili nemocní s nálezem del 11q a del 17p13 (21/ 68, 31 %). Exprese CD38 byla hodnocena průtokovou cytometrií z periferní krve a za pozitivní považována, pokud byla vyšší než 30 %. Byla vyšetřena u 72/ 75 nemocných (96 %) a pozitivní byla v 19 případech (26 %). Exprese ZAP ‑ 70 (zeta - asociovaný protein o molekulové hmotnosti 70 kDa) byla též hodnocena průtokovou cytometrií z periferní krve (za použití monoklonální protilátky značené fykoerytrinem klonu 1E7.2 firmy Caltag, USA), a jako ZAP ‑ 70 pozitivní případy byly považovány ty, kde bylo pozitivních více než 20 % buněk. Osmnáct nemocných ze 72 hodnocených (25 %) bylo ZAP ‑ 70 pozitivních. U 36/ 75 (48 %) pacientů bylo provedeno ultrasonografické vyšetření uzlin a/ nebo břicha. Paket uzlin v průměru 5 a více cm (masivní lymfadenopatie; tzv. bulk) byl v době zařazení do studie diagnostikován u 16 nemocných (16/ 75, 21 %), u 14 z nich (85 %) byl lokalizován nitrobřišně a zjištěn dle UZ vyšetření.
Způsob stanovení vybraných ukazatelů
Odběry krve ke zhodnocení vybraných ukazatelů byly provedeny buď v době stanovení diagnózy CLL (50/ 75, 67 %), nebo kdykoliv v průběhu onemocnění, které vykazovalo v době odběru stabilní průběh bez známek progrese (25/ 75, 33 %). Medián od data stanovení diagnózy do data provedení odběru byl 16,4 měsíce (rozmezí 0,3 – 132 měsíců). Hodnocení klasických prognostických faktorů (Rai stadia, ALC, LDH, B2M) a přítomnosti masivní lymfadenopatie bylo provedeno v době odběru zkoumaných ukazatelů. Moderní ukazatele byly vyšetřeny při zařazení do studie pouze v případě, že nebyly k dispozici v době stanovení diagnózy CLL.
Vyšetření sérových koncentrací TNF‑α a TGF‑β1 bylo pro srovnání provedeno u skupiny 57 dobrovolných zdravých dárců krve (26 mužů a 31 žen, medián 35 let, rozmezí 19 – 51 let) a stanovení lymfocytární exprese TGFβRII a FGFR2 u 10 dobrovolných zdravých dárců krve (6 mužů a 4 ženy, věkový medián 34 let, rozmezí 25 – 65 let) stejnými metodikami jako u pacientů s CLL.
Pro stanovení sérových koncentrací TNF‑α a TGF‑β1 byly všechny vzorky séra po centrifugaci zamraženy při teplotě – 70 °C až do měření. Stanovení koncentrací bylo provedeno standardními postupy metodiky ELISA (Enzyme ‑ Linked ImmunoSorbent Assay) a dle firemních doporučení. Použity byly soupravy Quantikine HS Human TNF‑α a Quantikine Human TGF‑β1 (R&D Systems, USA).
K hodnocení lymfocytární exprese TGFβRII a FGFR2 byly použity vzorky nesrážlivé periferní krve, které byly měřeny na průtokovém cytometru EPICS XL(Beckman Coulter, USA) se softwarem EPICS XL verze 3.0. K hodnocení exprese TGFβRII byla použita myší monoklonální protilátka proti lidskému TGFβRII konjugovaná s karboxyfluoresceinem (R&D Systems, USA). K hodnocení exprese FGFR2 byla použita lyofilizovaná neznačená protilátka FGFR2 (IIIc) (R&D Systems, USA) a sekundární protilátka značená FITC (Fluorescein Isothiocyanate) (Beckman Coulter, USA).
Statistická analýza
Statistická analýza byla provedena pomocí softwaru Analyse ‑ it (Analyse ‑ it Software Ltd, Velká Británie). Všechna data byla testována na normalitu Shapirovým ‑ Wilkovým testem. Pokud bylo rozdělení dat normální, byl k testování rozdílů vůči kontrolní skupině použit parametrický t‑test. Pokud neměla data normální rozdělení, byl užit neparametrický Mannův ‑ Whitneyův U test. Korelace byla stanovena pomocí Spearmanova korelačního koeficientu (r). Celkové přežití (overall survival – OS) bylo definováno jako období od data odběru vybraných ukazatelů do úmrtí na jakoukoliv, i nenádorovou příčinu. Období do zahájení léčby (time to treatment – TTT) bylo hodnoceno od data provedení odběru do data zahájení léčby 1. linie. K hodnocení OS a TTT byly zkonstruovány Kaplan ‑ Meierovy křivky přežití a jednotlivé podskupiny porovnány pomocí log rank testu. P ‑ hodnoty nižší než 0,05 byly považovány za statisticky významné.
Výsledky
V době analýzy v prosinci roku 2012 byl medián sledování žijících nemocných 48 měsíců (rozmezí 1 – 111 měsíců) a stav souboru byl následující: 10 nemocných (13 %) zemřelo, z toho 5 z důvodu progrese CLL. Třicet šest nemocných (48 %) progredovalo a vyžadovalo zahájení léčby. Medián TTT celého souboru byl 44 měsíců. Pravděpodobnost 5letého přežití celého souboru byla 84 %, medián OS nebyl dosažen.
Přehled nejdůležitějších nálezů pro jednotlivé ukazatele shrnuje tab. 2.
Tab. 2. Přehled nejdůležitějších nálezů v našem souboru – deskriptivní statistika. 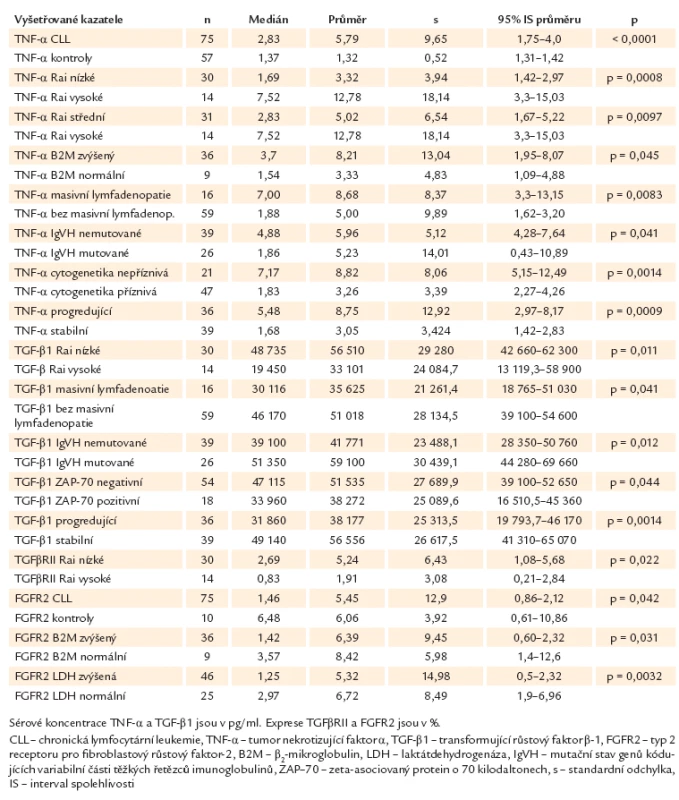
Sérový TNF‑α byl detekovatelný ve všech vzorcích. Koncentrace TNF‑α byly statisticky významně vyšší u pacientů s CLL (medián 2,83 pg/ ml, průměrná sérová koncentrace 5,79 pg/ ml) oproti kontrolní skupině (medián 1,37 pg/ ml, průměrná sérová koncentrace 1,32 pg/ ml) (p < 0,0001) (graf 1).Nebyl zaznamenán statisticky významný rozdíl v koncentracích TNF‑α a mezi muži a ženami (p = 0,78). Významně vyšší sérové koncentrace TNF‑α měli nemocní ve skupině s vysokým rizikem dle Raie v porovnání se skupinou s nízkým rizikem dle Raie (medián 7,52 vs 1,69 pg/ ml, p = 0,0008) i v porovnání se skupinou se středním rizikem dle Raie (medián 7,52 vs 2,83 pg/ ml, p = 0,0097). Při srovnání skupiny s nízkým a středním rizikem dle Raie nebyl v koncentracích TNF‑α rozdíl (p = 0,13) (graf 2). Významný rozdíl nebyl ani mezi skupinami nemocných s rozdílnou koncentrací LDH (p = 0,14). U nemocných se zvýšenou hladinou B2M byla sérová koncentrace TNF‑α významně vyšší (medián 3,70 vs 1,54 pg/ ml, p = 0,045). S koncentrací TNF‑α slabě pozitivně koreloval absolutní počet lymfocytů (p = 0,018, r = 0,27). Nemocní s masivní lymfadenopatií měli významně vyšší koncentrace TNF‑α než nemocní bez masivní lymfadenopatie (medián 7,0 vs 1,88 pg/ ml, p = 0,0083) (graf 3). Statisticky významně vyšší sérové koncentrace TNF‑α měli pacienti s nemutovanými IgVH geny v porovnání s mutovanými (medián 4,88 vs 1,86 pg/ ml, p = 0,041) (graf 4), a nemocní s nepříznivými cytogenetickými aberacemi v porovnání s prognosticky příznivými (medián 7,17 vs 1,83 pg/ ml, p = 0,0014) (graf 5). Exprese ZAP ‑ 70 ani exprese CD38 s koncentrací TNF‑α významně nekorelovaly (p = 0,35, resp. p = 0,44).
Graf 1. Statisticky významné zvýšení sérových koncentrací TNF-α u nemocných s CLL v porovnání s kontrolami. Koncentrace jsou uvedeny v pg/ml. 
Graf 2. Statisticky významné zvýšení sérových koncentrací TNF-α u nemocných s vysokým rizikem dle Raie v porovnání se středním i nízkým rizikem. Sérové koncentrace TNF-α se neliší mezi skupinou s nízkým a středním rizikem dle Raie. Koncentrace jsou uvedeny v pg/ml. 
Graf 3. Statisticky významné zvýšení sérových koncentrací TNF-α u nemocných s masivní lymfadenopatií. Koncentrace jsou uvedeny v pg/ml. 
Graf 4. Statisticky významné zvýšení sérových koncentrací TNF-α u nemocných s nemutovanými IgVH geny. Koncentrace jsou uvedeny v pg/ml. 
Graf 5. Statisticky významné zvýšení sérových koncentrací TNF-α u nemocných s nepříznivými cytogenetickými aberacemi. Koncentrace jsou uvedeny v pg/ml. 
Nemocní, kteří v průběhu onemocnění progredovali (n = 36), měli významně vyšší hodnoty TNF‑α než nemocní se stabilním onemocněním (medián 5,48 vs 1,68 pg/ ml, p = 0,0009) (graf 6). Pacienti s koncentracemi TNF‑α vyššími než medián (n = 37) měli významně kratší období do zahájení léčby než nemocní s nižšími koncentracemi (n = 38) (medián 2vs 100 měsíců, p = 0,0049) (graf 7). Mezi těmito dvěma skupinami nebyl významný rozdíl v celkovém přežití (p = 0,085).
Graf 6. Nemocní s progresí CLL mají statisticky významně vyšší sérové koncentrace TNF-α než nemocní se stabilním onemocněním. Koncentrace jsou uvedeny v pg/ml. 
Graf 7. Období do zahájení léčby je významně kratší u nemocných se sérovými koncentracemi TNF-α vyššími než medián (2,83 pg/ml). 
Sérový TGF‑β1 byl detekovatelný ve všech vzorcích. Nebyl zaznamenán statisticky významný rozdíl mezi koncentracemi TGF‑β1 u pacientů s CLL (medián 44 280 pg/ ml, průměrná sérová koncentrace 47 734 pg/ ml) a kontrolní skupinou (medián 48 700 pg/ ml, průměrná sérová koncentrace 48 068 pg/ ml) (p = 0,26). Mezi muži a ženami nebyly koncentrace TGF‑β1 významně rozdílné (p = 0,088). Nemocní ve skupině s nízkým rizikem dle Raie měli významně vyšší hladiny TGF‑β1 v porovnání se skupinou s vysokým rizikem dle Raie (medián 48 735 vs 19 450 pg/ ml, p = 0,011), nebyl ale rozdíl mezi skupinou nemocných s nízkým a středním rizikem (p = 0,11) a skupinou se středním a vysokým rizikem dle Raie (p = 0,10) (graf 8). Koncentrace TGF‑β1 slabě negativně korelovala s absolutním počtem lymfocytů v periferní krvi (p = 0,0037, r = – 0,33). Významně vyšší sérové koncentrace TGF‑β1 byly nalezeny u pacientů bez masivní lymfadenopatie v porovnání s nemocnými s masivní lymfadenopatií (medián 46 170 vs 30 116 pg/ ml, p = 0,0410) (graf 9). Nebyl zaznamenán rozdíl v koncentracích TGF‑β1 u nemocných se zvýšeným LDH (p = 0,35) a B2M (p = 0,36), ani u nemocných s nepříznivými cytogenetickými aberacemi (p = 0,081) či expresí CD38 (p = 0,091). Statisticky významně vyšší sérové koncentrace TGF‑β1 měli pacienti s mutovanými IgVH geny v porovnání s nemutovanými (medián 51 350 vs 39 100 pg/ ml, p = 0,012) (graf 10), a pacienti ZAP ‑ 70 negativní (vs ZAP ‑ 70 pozitivní) (medián 47 115 vs 33 960 pg/ ml, p = 0,044) (graf 11). S hladinou TGF‑β1 velmi významně souvisel klinický průběh onemocnění – nemocní s progredující chorobou měli významně nižší hodnoty TGF‑β1 než nemocní se stabilním onemocněním (medián 31 860 vs 49 140 pg/ ml, p = 0,0014) (graf 12). Období do zahájení léčby bylo významně delší u pacientů, kteří měli koncentrace TGF‑β1 vyšší než medián (n = 37) v porovnání s nemocnými s koncentracemi TGF‑β1 nižšími (n = 38) (medián nedosažen vs medián 2 měsíce, p = 0,016) (graf 13). V celkovém přežití nebyl mezi těmito dvěma skupinami rozdíl (p = 0,44). Nebyla nalezena korelace exprese TGF‑β1 a TNF‑α (p = 0,059, r = – 0,22).
Graf 8. Statisticky významné zvýšení sérových koncentrací TGF-β1 u nemocných s nízkým rizikem dle Raie v porovnání s vysokým rizikem. Sérové koncentrace TGF-β1 se neliší mezi skupinami s nízkým a středním rizikem ani mezi skupinami se středním a vysokým rizikem dle Raie. Koncentrace jsou uvedeny v pg/ml. 
Graf 9. Statisticky významné zvýšení sérových koncentrací TGF-β1 u nemocných bez masivní lymfadenopatie. Koncentrace jsou uvedeny v pg/ml. 
Graf 10. Statisticky významné zvýšení sérových koncentrací TGF-β1 u nemocných s mutovanými IgVH geny. Koncentrace jsou uvedeny v pg/ml. 
Graf 11. Statisticky významné zvýšení sérových koncentrací TGF-β1 u nemocných se ZAP-70 negativitou. Koncentrace jsou uvedeny v pg/ml. 
Graf 12. Nemocní s progresí CLL mají statisticky významně nižší sérové koncentrace TGF-β1 než nemocní se stabilním onemocněním. Koncentrace jsou uvedeny v pg/ml. 
Graf 13. Období do zahájení léčby je významně delší u nemocných se sérovými koncentracemi TGF-β1 vyššími než medián (44 280 pg/ml). 
Exprese TGFβRII byla měřitelná u všech nemocných, nemocní s CLL neměli v porovnání s kontrolami významně rozdílnou expresi TGFβRII (medián 1,320 vs 1,09, p = 0,22). Statisticky významně nižší exprese TGFβRII byla zaznamenána u nemocných s vysokým rizikem dle Raie v porovnání s nemocnými s nízkým rizikem (medián 0,83 vs 2,69, p = 0,022). Nebyl ale rozdíl v expresi TGFβRII mezi skupinou nemocných s nízkým a středním (p = 0,53) a středním a vysokým rizikem dle Raie (p = 0,076) (graf 14). Exprese TGFβRII nebyla rozdílná v závislosti na pohlaví (p = 0,17) a na laboratorních ukazatelích, jako jsou LDH a B2M (p = 0,11, resp. 0,78), ani mutačním stavu, cytogenetických aberacích (p = 0,97, resp. p = 0,29) a expresi ZAP ‑ 70 a CD38 (p = 0,39, resp. p = 0,94) či přítomnosti masivní lymfadenopatie (p = 0,31). Nebyl rozdíl v expresi TGFβRII mezi nemocnými se stabilní a progredující chorobou (p = 0,29). Období do zahájení léčby ani celkové přežití nebylo významně rozdílné u pacientů, kteří měli expresi TGFβRII vyšší než medián (n = 37) v porovnání s nemocnými s expresí TGFβRII nižší než medián (n = 38) (p = 0,46, resp. p = 0,81). Nebyla nalezena souvislost mezi expresí TGFβRII a koncentrací TGF‑β1 (p = 0,69, r = – 0,05) ani absolutním počtem lymfocytů (p = 0,79, r = – 0,03).
Graf 14. Statisticky významně nižší exprese TGFβRII u nemocných s vysokým rizikem dle Raie v porovnání s nemocnými s nízkým rizikem. Exprese TGFβRII se neliší mezi skupinami s nízkým a středním rizikem ani mezi skupinami se středním a vysokým rizikem dle Raie. Exprese je uvedena v procentech (%). 
Exprese FGFR2 na lymfocytech byla zjistitelná ve všech vyšetřovaných vzorcích. Byla zjištěna statisticky významně vyšší exprese FGFR2 v kontrolní skupině v porovnání s CLL pacienty (medián 6,48 vs 1,46, p = 0,042). Nebyl zaznamenán statisticky významný rozdíl v expresi FGFR2 mezi muži a ženami (p = 0,35) a mezi rizikovými skupinami dle Raie (nízké vs střední riziko, p = 0,77; nízké vs vysoké, p = 0,12; střední vs vysoké riziko, p = 0,11). Nemocní s normálním LDH i B2M v séru měli statisticky významně vyšší expresi FGFR2 (medián 2,97, p = 0,0032, resp. medián 3,57, p = 0,031). Nebyla nalezena souvislost mezi expresí FGFR2 a mutačním stavem a výskytem cytogenetických aberací (p = 0,88, resp. p = 0,18), ani expresí ZAP ‑ 70 a CD38 (p = 0,12, resp. p = 0,89), ani masivní lymfadenopatií (p = 0,42). S expresí FGFR2 slabě negativně koreloval absolutní počet lymfocytů (p = 0,033, r = – 0,25). Nebyl rozdíl v expresi FGFR2 mezi nemocnými se stabilní a progredující chorobou (p = 0,15). Období do zahájení léčby ani celkové přežití nebylo významně rozdílné u pacientů, kteří měli expresi FGFR2 vyšší než medián (n = 36), v porovnání s nemocnými s expresí FGFR2 nižší než medián (n = 39) (p = 0,27, resp. p = 0,11). Exprese FGFR2 nekorelovala s TNF‑α (p = 0,12), TGF‑β1 (p = 0,80) ani TGFβRII (p = 0,15).
Při provedení multivariantní analýzy pro celkové přežití byly identifikovány jako statisticky významné a nezávislé 2 prognostické faktory, a to sérová koncentrace TNF‑α a masivní lymfadenopatie (p = 0,036, resp. p = 0,047).
Diskuze a závěry
Stanovení a zpřesnění prognózy u pacientů s CLL je v několika posledních letech věnována velká pozornost. Zpřesnění prognózy má význam zejména u skupiny pacientů v časných klinických stadiích, kteří v současné době tvoří většinu nově diagnostikovaných pacientů s CLL, neboť i tito nemocní mohou velmi rychle progredovat a mít agresivní průběh onemocnění. Velkým pokrokem byl objev nových ukazatelů (zejména IgVH mutační stav, cytogenetické aberace, ZAP ‑ 70, CD38 a další), díky kterým je již v době stanovení diagnózy možné rozdělit nemocné do skupin významně se lišících prognózou, a předpovědět tak klinický průběh onemocnění. Hledání dalších nových faktorů stále pokračuje, neboť otázkou do budoucna zůstává, jak co nejlépe načasovat a přizpůsobit intenzitu léčby individuálnímu riziku nemocného právě na základě znalosti těchto nových prognostických faktorů (tzv. risk‑adapted strategies) [47 – 49]. Z tohoto hlediska má zatím dominantní postavení nepříznivá cytogenetická aberace delece 17p13, jejíž přítomnost může v některých případech ovlivnit výběr cíleného léčebného postupu [50 – 53]. Nález ostatních nepříznivých ukazatelů tvoří důležité doplňující informace o prognóze nemocných. Je nutno zdůraznit, že žádný z nových prognostických faktorů sám o sobě není důvodem k zahájení léčby. Pro zahájení léčby u pacientů s CLL je nadále dle aktuálních kritérií NCI ‑ WG z roku 2008 rozhodující aktivita choroby [44]. To, zda a kdy by měla být léčba zahájena na základě určení negativních prognostických faktorů zejména u pacientů v časných klinických stadiích a zda by nemocní z včasného zahájení léčby profitovali, je otázkou, kterou se zabývají klinické prospektivní studie a na kterou v současné době dosud nemáme jednoznačnou odpověď [54,55]. Prognostické faktory také vypovídají mnohé o patogenezi onemocnění. Chronická lymfocytární leukemie je příkladem onemocnění, kde zásadní roli v patogenezi hraje porucha mechanizmů geneticky řízené buněčné smrti – apoptózy [56,57]. Na klinickém průběhu a progresi onemocnění se kromě poruchy apoptotických mechanizmů podílí také aktivace signálních drah vedoucích k proliferaci maligních buněk, např. signální dráha NF ‑ kB [2,3]. Značná pozornost je v posledních letech věnována také studiu angiogeneze u CLL. V séru či plazmě pacientů s CLL byly prokázány zvýšené koncentrace angiogenních faktorů, zejména VEGF a FGF ‑ 2. Lymfocyty CLL vedle tvorby angiogenních cytokinů zároveň exprimují odpovídající receptory, čímž je zajištěna autokrinní stimulace angiogenních procesů [39,40,42,43]. Vyšší hladiny těchto proangiogenních cytokinů jsou spojeny s pokročilým klinickým stadiem, časnou progresí CLL a horší odpovědí na léčbu fludarabinem [11,23,37,38,40]. Z dalších cirkulujících cytokinů, které sehrávají důležitou roli v patogenezi a biologickém chování maligního klonu a jsou často zmiňovány v souvislosti s poruchou apoptických drah, proliferací a angiogenezí u CLL, je třeba jmenovat zejména TNF‑α, TGF‑β1 a jejich receptory [7,17,22,23].
TNF‑α je cytokin působící anti‑apoptoticky a jako autokrinní růstový faktor pro maligní B‑lymfocyty [7,10 – 12]. V souladu s literárními údaji potvrzují naše výsledky úlohu TNF‑α jako významného negativního prognostického ukazatele u CLL: významně vyšší sérové koncentrace TNF‑α měli nemocní ve skupině s vysokým rizikem dle Raie v porovnání se skupinou s nízkým i středním rizikem, s masivní lymfadenopatií, s nemutovanými IgVH geny a nepříznivými cytogenetickými aberacemi. Právě IgVH a cytogenetické nálezy jsou v současné době u CLL považovány za nejdůležitější prognostické faktory ve vztahu k celkovému přežití [49]. Významně vyšší koncentrace TNF‑α byly také zjištěny u nemocných s vyšší hodnotou sérového B2M, který je u CLL spojován s pokročilým klinickým stavem, objemnou lymfadenopatií, významnou infiltrací kostní dřeně, pozitivitou ZAP ‑ 70 a CD38 [47,58]. Na rozdíl od literárních údajů jsme neprokázali souvislost mezi koncentrací TNF‑α a expresí CD38 a ZAP ‑ 70, pravděpodobně v důsledku relativně omezeného rozsahu souboru. S koncentrací TNF‑α pozitivně koreloval absolutní počet lymfocytů, šlo však o slabou korelaci (r = 0,27), z čehož vyplývá, že hodnota TNF‑α není lineárním ukazatelem velikosti nádorové masy. Výše koncentrace TNF‑α významně souvisela s klinickým průběhem onemocnění – nemocní s progresí CLL měli významně vyšší hodnoty TNF‑α než nemocní se stabilním onemocněním. Také TTT bylo významně kratší u pacientů s vyššími koncentracemi TNF‑α, naznačen byl i trend směrem ke kratšímu OS.
V rozporu s literárními daty jsme nepotvrdili zvýšení sérových koncentrací TGF‑β1 u nemocných s CLL v porovnání s kontrolami. Při analýze jednotlivých podskupin a zcela v souladu s dosud publikovanými pracemi měli i v našem souboru nemocní ve skupině s nízkým rizikem dle Raie významně vyšší hladiny TGF‑β1 v porovnání se skupinou s vysokým rizikem dle Raie. Významně vyšší koncentrace TGF‑β1 byly také spojeny s výskytem dalších příznivých prognostických ukazatelů, jako jsou nepřítomnost masivní lymfadenopatie, mutované IgVH geny a negativita ZAP ‑ 70 i příznivějším klinickým průběhem onemocnění (vyšší hladiny měli pacienti se stabilním onemocněním a delším TTT). Dále koncentrace TGF‑β1 negativně korelovala s absolutním počtem lymfocytů. To, že je role TGF‑β1 v patogenezi CLL rozporuplná a ne zcela jasná, prokázala řada prací [17,22 – 25,59,60]. TGF‑β1 působí jako důležitý autokrinní inhibitor proliferace maligních B‑lymfocytů a má i pro‑apoptotickou funkci. Má však také vlastnosti imunosupresivní a pro‑angiogenní, což je spojováno s méně příznivou prognózou [1,20,23,32,51]. Signální dráha TGF‑β je regulována na několika úrovních počínaje vazbou ligandů na TGFβR přes regulaci v nitrobuněčné signalizaci až po regulaci transkripce příslušných genů na úrovni buněčného jádra. I tento fakt znesnadňuje hodnocení vlivu TGF‑β v patogenezi CLL [17,20].
V našem souboru byla statisticky významně nižší lymfocytární exprese TGFβRII zaznamenána u nemocných s vysokým rizikem dle Raie v porovnání s nemocnými s nízkým rizikem. Nízká exprese TGFβRII by u nemocných v pokročilých klinických stadiích dle Raie mohla přispívat k rezistenci na anti‑proliferační působení TGF‑β a horší prognóze.
Naše práce přispěla k rozšíření dosavadních znalostí o expresi FGFR u CLL; v této oblasti bylo dosud k dispozici naprosté minimum dat. Exprese FGFR2 byla významně nižší na CLL lymfocytech v porovnání s kontrolní skupinou, což mohlo být způsobeno negativní zpětnou vazbou při zvýšených sérových koncentracích FGF ‑ 2. Prognostický význam FGFR2 nebyl prokázán. Nebyla zjištěna vzájemná souvislost mezi jednotlivými hodnocenými ukazateli. Statisticky významnými a nezávislými prognostickými faktory pro celkové přežití byly v našem souboru zvýšené sérové koncentrace TNF‑α a přítomnost masivní lymfadenopatie. Některé práce prokázaly, že nemocní s masivní lymfadenopatií mají horší prognózu (nižší procento kompletních remisí, kratší období do progrese, naznačen i trend směrem ke kratšímu OS, vysoké riziko relapsu po alogenní transplantaci) [61 – 64]. I naše práce potvrzuje, že nález masivní lymfadenopatie, která byla přítomna u 16 % nemocných a v naprosté většině případů (85 %) se jednalo o retroperitoneální uzliny, má negativní prognostický význam s dopadem na OS. Dalším důležitým zjištěním je fakt, že diagnóza retroperitoneální lymfadenopatie byla ve všech případech založena na UZ vyšetření. Naše nálezy tedy také podporují význam použití zobrazovacích metod (resp. UZ) u CLL, což je v současné době velmi diskutovaná problematika. Dle současných doporučení nejsou zobrazovací metody zahrnuty v rámci běžné péče ani k vstupnímu určení rozsahu onemocnění ani k hodnocení léčebné odpovědi [44].
Dosud nebyla publikována práce, ve které by bylo provedeno tak rozsáhlé srovnání TNF‑α, TGF‑β1, TGFβRII a FGFR2 s prognostickými faktory a klinickým průběhem onemocnění. V tomto jsou naše výsledky prioritní. V naší studii měly největší význam zvýšené sérové koncentrace TNF‑α, které byly spojeny s nepříznivou prognózou, a zvýšené sérové koncentrace TGF‑β1, které naopak souvisely s příznivějším klinickým průběhem. Další výzkum těchto cytokinů a jejich signálních drah je cenný nejen z prognostického, ale také léčebného hlediska. Monoklonální protilátky proti TNF‑α jsou již nyní používány např. k léčbě Crohnovy choroby, revmatoidní artritidy či psoriázy [65]. Objevují se poznatky o použití tzv. antisense RNA či oligonukleotidů ke snížení hladiny TGF‑β či použití protilátky proti TGF‑β zejména u pokročilých solidních nádorů [17,20]. K dispozici jsou rovněž nadějná data z klinických studií využívajících antiangiogenní léky, jako jsou thalidomid či lenalidomid [36,66].
Práce byla podpořena výzkumným záměrem PRVOUK P37/ 08/ 400 Lékařské fakulty Univerzity Karlovy v Hradci Králové, grantem NT/ 13412 – 4 IGA MZ ČR a výzkumným záměrem MZO 00179906 MZ ČR.
MU Dr. Monika Motyčková, Ph.D.
www.fnhk.cz
e‑mail: motyckova.monika@seznam.cz
Doručeno do redakce: 18. 2. 2013
Přijato po recenzi: 21. 4. 2013
Zdroje
1. Vroblová V, Smolej L, Vrbacký F et al. Biological prognostic markers in chronic lymphocytic leukemia. Acta Medica (Hradec Kralove) 2009; 52 : 3 – 8.
2. Zanioni A, Imperiali FG, Pasquini C et al. Cytokine modulation of nuclear factor ‑ kB activity in B ‑ chronic lymphocytic leukemia. Exp Hematol 2003; 31 : 185 – 190.
3. Meinhardt G, Wendtner CM, Hallek M. Molecular pathogenesis of chronic lymphocytic leukemia: factors and signaling pathways regulating cell growth and survival. J Mol Med (Berl) 1999; 77 : 282 – 293.
4. Gerondakis S, Strasser A. The role of Rel/ NF ‑ kappaB transcription factors in B lymphocyte survival. Semin Immunol 2003; 15 : 159 – 166.
5. Digel W, Porzsolt F, Schmid M et al. High levels of circulating soluble receptors for tumor necrosis factor in hairy cell leukemia and type Bchronic lymphocytic leukemia. J Clin Invest 1992; 89 : 1690 – 1693.
6. Rosati E, Sabatini R, Tabilio A et al. B ‑ chronic lymphocytic leukemia cells exert an in vitro cytotoxicity mediated by tumor necrosis factor alpha. Leuk Res 2005; 29 : 829 – 839.
7. Ferrajoli A, Keating MJ, Manshouri T et al. The clinical significance of tumor necrosis factor‑alpha plasma level in patients having chronic lymphocytic leukemia. Blood 2002; 100 : 1215 – 1219.
8. Kast RE, Altschuler EL. Anti‑apoptosis function of TNF‑alpha in chronic lymphocytic leukemia: lessons from Crohnʼs disease and the therapeutic potential of bupropion to lower TNF‑alpha. Arch Immunol Ther Exp (Warsz) 2005; 53 : 143 – 147.
9. Trentin L, Zambello R, Agostini C et al. Expression and regulation of tumor necrosis factor, interleukin‑2, and hematopoietic growth factor receptors in B ‑ cell chronic lymphocytic leukemia. Blood 1994; 84 : 4249 – 4256.
10. Cheson BD. Chronic lymphoid leukemias: Second Edition, revised and Expanded. New York: Marcel Dekker, Inc. 2001 : 118 – 141.
11. Waage A, Espevik T. TNF receptors in chronic lymphocytic leukemia. Leuk Lymphoma 1994; 13 : 41 – 46.
12. Munzert G, Kirchner D, Stobbe H et al. Tumor necrosis factor receptor‑associated factor 1 gene overexpression in B ‑ cell chronic lymphocytic leukemia: analysis of NF ‑ kappa B/ Rel ‑ regulated inhibitors of apoptosis. Blood 2002; 100 : 3749 – 3756.
13. Bojarska ‑ Junak A, Hus I, Szczepanek E et al. Peripheral blood and bone marrow TNF and TNF receptors in early and advanced stages of B ‑ CLL in correlation with ZAP ‑ 70 protein and CD38 antigen. Leuk Res 2008; 32 : 225 – 233.
14. Singer M, Assem M, Abdel AB et al. Role of TNF‑alpha as a survival prognostic marker in chronic lymphocytic leukemia patients. Egypt J Immunol 2011; 18 : 51 – 60.
15. Lech ‑ Maranda E, Grzybowska ‑ Izydorczyk O, Wyka K et al. Serum tumor necrosis factor‑alpha and interleukin‑10 levels as markers to predict outcome of patients with chronic lymphocytic leukemia in different risk groups defined by the IGHV mutation status. Arch Immunol Ther Exp (Warsz) 2012; 60 : 477 – 486.
16. Huang SS, Huang JS. TGF‑beta control of cell proliferation. J Cell Biochem 2005; 96 : 447 – 462.
17. Dong M, Blobe GC. Role of transforming growth factor‑beta in hematologic malignancies. Blood 2006; 107 : 4589 – 4596.
18. Buske C, Becker D, Feuring ‑ Buske M et al. TGF‑beta and its receptor complex in leukemic B ‑ cell precursors. Exp Hematol 1998; 26 : 1155 – 1161.
19. von Bergwelt ‑ Baildon M, Maecker B, Schultze J et al. CD40 activation: potential for specific immunotherapy in B ‑ CLL. Ann Oncol 2004; 15 : 853 – 857.
20. Fuchs O. Úloha signální dráhy indukované transformačním růstovým faktorem beta při vzniku nádoru. Klin Onkol 2002; 15 : 7 – 16.
21. Pertovaara L, Kaipainen A, Mustonen T et al. Vascular endothelial growth factor is induced in response to transforming growth factor‑beta in fibroblastic and epithelial cells. J Biol Chem 1994; 269 : 6271 – 6274.
22. Friedenberg WR, Salzman SA, Phan SM et al. Transforming growth factor‑beta and multidrug resistance in chronic lymphocytic leukemia. Med Oncol 1999; 16 : 110 – 118.
23. Gora ‑ Tybor J, Blonski JZ, Robak T. Circulating proangiogenic cytokines and angiogenesis inhibitor endostatin in untreated patients with chronic lymphocytic leukemia. Mediators Inflamm 2003; 12 : 167 – 171.
24. Ho CL, Phyliky RL, Li CY. B ‑ cell chronic lymphocytic leukemia: correlation of clinical stages with angiogenic cytokine expression. Appl Immunohistochem Mol Morphol 2006; 14 : 154 – 160.
25. DeCoteau JF, Knaus PI, Yankelev H et al. Loss of functional cell surface transforming growth factor beta (TGF‑beta) type 1 receptor correlates with insensitivity to TGF‑beta in chronic lymphocytic leukemia. Proc Natl Acad Sci USA 1997; 94 : 5877 – 5881.
26. Lagneaux L, Delforge A, Bron D et al. Heterogenous response of B lymphocytes to transforming growth factor‑beta in B ‑ cell chronic lymphocytic leukaemia: correlation with the expression of TGF‑beta receptors. Br J Haematol 1997; 97 : 612 – 620.
27. Schiemann WP, Rotzer D, Pfeifer WM et al.Transforming growth factor‑beta (TGF‑beta)‑resistant B cells from chronic lymphocytic leukemia patients contain recurrent mutations in the signal sequence of the type I TGF‑beta receptor. Cancer Detect Prev 2004; 28 : 57 – 64.
28. R Romano S, Mallardo M, Chiurazzi F et al. The effect of FK506 on transforming growth factor beta signaling and apoptosis in chronic lymphocytic leukemia B cells. Haematologica 2008; 93 : 1039 – 1048.
29. Lagneaux L, Delforge A, Bernier M et al. TGF‑beta activity and expression of its receptors in B ‑ cell chronic lymphocytic leukemia. Leuk Lymphoma 1998; 31 : 99 – 106.
30. Okada ‑ Ban M, Thiery JP, Jouanneau J. Fibroblast growth factor ‑ 2. Int J Biochem Cell Biol 2000; 32 : 263 – 267.
31. Baguma ‑ Nibasheka M, Li AW, Osman MSet al. Coexpression and regulation of the FGF ‑ 2 and FGF antisense genes in leukemic cells. Leuk Res 2005; 29 : 423 – 433.
32. Bairey O, Zimra Y, Shaklai M et al. Bcl ‑ 2 expression correlates positively with serum basic fibroblast growth factor (bFGF) and negatively with cellular vascular endothelial growth factor (VEGF) in patients with chronic lymphocytic leukaemia. Br J Haematol 2001; 113 : 400 – 406.
33. Smolej L, Benešová P. Význam angiogeneze u maligních nádorů. Acta Medica Suppl 2005; 48 : 69 – 72.
34. Smolej L, Andrýs C, Maisnar V et al. Plasma concentrations of vascular endothelial growth factor and basic fibroblast growth factor in lymphoproliferative disorders. Acta Medica (Hradec Kralove) 2005; 48 : 57 – 58.
35. Gora ‑ Tybor J, Blonski JZ, Robak T. Cladribine decreases the level of angiogenic factors in patients with chronic lymphocytic leukemia. Neoplasma 2002; 49 : 145 – 148.
36. Smolej L, Andrýs C, Krejsek J et al. Bazický fibroblastový růstový faktor (bFGF) a cévní endotelový růstový faktor (VEGF) jsou zvýšeny v plazmě periferní krve nemocných s chronickou lymfocytární leukemií a klesají po intenzivní léčbě obsahující fludarabin. Vnitř Lék 2007; 53 : 1171 – 1176.
37. Molica S, Vitelli G, Levato D et al. Clinicoprognostic implications of increased serum levels of vascular endothelial growth factor and basic fibroblastic growth factor in early B ‑ cell chronic lymphocytic leukaemia. Br J Cancer 2002; 86 : 31 – 35.
38. Molica S, Cutrona G, Vitelli G et al. Markers of increased angiogenesis and their correlation with biological parameters identifying high‑risk patients in early B ‑ cell chronic lymphocytic leukemia. Leuk Res 2007; 31 : 1575 – 1578.
39. Bairey O, Boycov O, Kaganovsky E. All three receptors for vascular endothelial growth factor (VEGF) are expressed on B ‑ chronic lymphocytic leukemia (CLL) cells. Leuk Res 2004; 28 : 243 – 248.
40. Gora ‑ Tybor J, Blonski JZ, Robak T. Circulating vascular endothelial growth factor (VEGF) and its soluble receptors in patients with chronic lymphocytic leukemia. Eur Cytokine Netw 2005; 16 : 41 – 46.
41. Allouche M, Bayard F, Clamens S et al. Expression of basic fibroblast growth factor (bFGF) and FGF ‑ receptors in human leukemic cells. Leukemia 1995; 9 : 77 – 86.
42. Krejci P, Dvorakova D, Krahulcova E et al. FGF ‑ 2 abnormalities in B cell chronic lymphocytic and chronic myeloid leukemias. Leukemia 2001; 15 : 228 – 237.
43. König A, Menzel T, Lynen S et al. Basic fibroblast growth factor (bFGF) upregulates the expression of bcl ‑ 2 in B cell chronic lymphocytic leukemia cell lines resulting in delaying apoptosis. Leukemia 1997; 11 : 258 – 265.
44. Hallek M, Cheson BD, Catovsky D et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute ‑ Working Group 1996 guidelines. Blood 2008; 111 : 5446 – 5456.
45. Rai KR. A critical analysis of staging in CLL. In: Gale RP, Rai KR (eds). Chronic Lymphocytic Leukemia. Recent Progress and Future Direction. New York: AR Liss 1987.
46. Döhner H, Stilgenbauer S, Benner A et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343 : 1910 – 1916.
47. Bockstaele VF, Verhasselt B, Philippé J. Prognostic markers in chronic lymphocytic leukemia: a comprehensive review. Blood Rev 2009; 23 : 25 – 47.
48. Montillo M, Hamblin T, Hallek M et al. Chronic lymphocytic leukemia: novel prognostic factors and their relevance for risk‑adapted therapeutic strategies. Haematologica 2005; 90 : 391 – 399.
49. Motyčková M, Žák P, Vroblová V et al. Prognostické faktory u chronické lymfocytární leukemie. Vnitř Lék 2011; 57 : 847 – 857.
50. Malčíková J, Pospíšilová Š, Mayer J et al. Význam nádorového supresoru p53 u chronické lymfocytární leukemie. Transfuze Hematol Dnes 2010; 16 : 29 – 32.
51. Kozák T. Prognostické faktory chronické lymfocytátní leukemie. Transfuze Hematol Dnes 2010; 16 : 56 – 61.
52. Hamblin TJ. Prognostic markers in chronic lymphocytic leukaemia. Best Pract Res Clin Haematol 2007; 20 : 455 – 468.
53. Hallek M, Pflug N. State of the art treatment of chronic lymphocytic leukaemia. Blood Rev 2011; 25 : 1 – 9.
54. Gentile M, Mauro FR, Guarini A et al. New developments in the diagnosis, prognosis and treatment of chronic lymphocytic leukemia. Curr Opin Oncol 2005; 17 : 597 – 604.
55. Moreno C, Montserrat E. New prognostic markers in chronic lymphocytic leukemia. Blood Rev 2008; 22 : 211 – 219.
56. Osorio LM, Jondal M, Aguilar ‑ Santelises M. Regulation of B ‑ CLL apoptosis through membrane receptors and Bcl ‑ 2 family proteins. Leuk Lymphoma 1998; 30 : 247 – 256.
57. Novosad J, Kodydková K, Krejsek J. Apoptóza, její mechanizmy a medicínský význam. II. Poruchy regulace apoptózy a jejich souvislost s rozvojem onemocnění. Vnitř Lék 2001; 47 : 387 – 390.
58. Gentile M, Cutrona G, Neri A et al. Predictive value of beta2 - microglobulin (beta2-m)levels in chronic lymphocytic leukemia since Binet A stages. Haematologica 2009; 94 : 887 – 888.
59. Douglas RS, Capocasale RJ, Lamb RJ et al. Chronic lymphocytic leukemia B cells are resistant to the apoptotic effects of transforming growth factor‑beta. Blood 1997; 89 : 941 – 947.
60. Lagneaux L, Delforge A, Dorval C et al. Excessive production of transforming growth factor‑beta by bone marrow stromal cells in B ‑ cell chronic lymphocytic leukemia inhibits growth of hematopoietic precursors and interleukin‑6 production. Blood 1993; 82 : 2379 – 2385.
61. Norin S, Kimby E, Lundin J. Tumor burden status evaluated by computed tomography scan is of prognostic importance in patients with chronic lymphocytic leukemia. Med Oncol 2010; 27 : 820 – 825.
62. Smolej L, Bachh A, Vodárek P et al. The role of imaging methods in chronic lymphocytic leukemia: significant internal lymphadenopathy is frequent and associated with shorter overall survival. Haematologica 2012; 97 : 302.
63. Eichhorst BF, Fischer K, Fink AM et al. Limited clinical relevance of imaging techniques in the follow‑up of patients with advanced chronic lymphocytic leukemia: results of a meta‑analysis. Blood 2011; 117 : 1817 – 1821.
64. Sorror ML, Storer BE, Sandmaier BM et al. Five‑year follow‑up of patients with advanced chronic lymphocytic leukemia treated with allogeneic hematopoietic cell transplantation after nonmyeloablative conditioning. J Clin Oncol 2008; 26 : 4912 – 4920.
65. Horiuchi T, Mitoma H, Harashima S et al. Transmembrane TNF‑alpha: structure, function and interaction with anti‑TNF agents. Rheumatology 2010; 49 : 1215 – 1228.
66. Pour L, Hájek R, Buchler T et al. Angiogeneze a antiangiogenní terapie u nádorů. Vnitř Lék 2004; 50 : 930 – 938.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Využití natriuretických peptidů v diagnostice hypertrofie levé komory u obézních hypertoniků s metabolickým syndromem – editorial
- Jak zlepšit adherenci k lékovému režimu u klinicky komplexních polymorbidních seniorů? Editorial
- Vede fyzická aktivita při přerušení dodávky inzulinu inzulinovou pumpou u pacientů s diabetem 1. typu ke klinicky významným změnám?
- Využití natriuretických peptidů v diagnostice hypertrofie levé komory srdeční u obézních hypertoniků s metabolickým syndromem
- Význam stanovení kardiálních biomarkerů ve stratifikaci a sledování nemocných s AL‑ amyloidózou – zkušenosti jednoho centra
- Hodnocení vybraných ukazatelů apoptózy a angiogeneze u chronické lymfocytární leukemie
- Compliance starších nemocných s kognitivní poruchou
- Studie RESOLUTE v České republice: inzulin glargin zlepšuje kompenzaci diabetu 2. typu u pacientů s dosud neuspokojivým výsledkem terapie kombinací inzulin detemir a perorální antidiabetika. Výsledky neintervenčního projektu RESOLUTE v České republice
- Food intake regulation – 1st part
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Regionální migrující osteoporóza – diferenciálně diagnostický problém
- Nová data a indikace pro sulodexid
-
ERS 2013
Duální bronchodilatace aneb Ve dvou (se) to lépe táhne - Dabigatran – klinická zkušenost z více než dvou miliónů pacientoroků
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Food intake regulation – 1st part
- Nová data a indikace pro sulodexid
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



