-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulárně genetické změny u Richterovy transformace chronické lymfocytární leukemie
Molecular genetic aberrations in Richter transformation of chronic lymphocytic leukaemia
Richter transformation (Richter syndrome – RT) is defined as the transformation of chronic lymphocytic leukaemia (CLL) into high-grade lymphoma. Development of diffuse large B-cell lymphoma (DLBCL) clonally related to CLL is most common, less frequent is transformation to Hodgkin´s lymphoma. RT occurs in approximately 2–10% of CLL patients during the disease course. It develops in patients treated with immunochemotherapy as well as in those treated with novel agents (ibrutinib, idelalisib, venetoclax). In this review, we discuss recent discoveries in the understanding of molecular genetic changes associated with RT. The most common molecular events in RT are concurrent disruptions of TP53 and CDKN2A genes that occur in approximately one half of RT patients. The occurrence of TP53 and CDKN2A aberrations is often associated with aberrant activation of the MYC gene, which is usually caused by structural changes (gain 8q, t(8; 14)) or indirectly by mutations in the MGA gene. In 30% RT patients, activating NOTCH1 mutations are detected, which are often present already prior to transformation. Approximately 20% RT patients carry heterogeneous molecular genetic aberrations. RT in ibrutinib-treated patients is also associated with TP53 and CDKN2A disruptions, activation of MYC as well as NOTCH1 mutations. Additionally, in 40% patients who develop RT on ibrutinib, mutations in BTK and PLCG2 genes were identified, known to be associated with treatment resistance. To date, the genetic landscape associated with RT on idelalisib and venetoclax was not studied. Despite improved understanding of molecular genetic changes linked to RT, genetic aberrations driving RT development have not been reported as yet. Further studies on large patient cohorts together with the development of more sensitive molecular technologies may help elucidate the underlying genetic risk factors in these difficult-to-treat patients.
Keywords:
mutations – chronic lymphocytic leukaemia – signalling pathway inhibitors – Richter syndrome – molecular genetic aberrations
Autoři: A. Petráčková 1; T. Papajík 2; E. Kriegová 1
Působiště autorů: Ústav imunologie, Lékařská fakulta, Univerzita Palackého a Fakultní nemocnice Olomouc 1; Hemato-onkologická klinika, Lékařská fakulta, Univerzita Palackého a Fakultní nemocnice Olomouc 2
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 1, p. 36-54.
Kategorie: Souhrnné/edukační práce
Souhrn
Richterova transformace (Richterův syndrom – RT) představuje transformaci chronické lymfocytární leukemie (CLL) do lymfoproliferace vyšší malignity. Nejčastěji dochází k transformaci do difuzního velkobuněčného B-lymfomu (DLBCL), vzácněji do Hodgkinova lymfomu. K transformaci může dojít kdykoli v průběhu choroby a její výskyt se v literatuře udává v rozmezí 2–10 %. S RT se setkáváme u pacientů léčených imunochemoterapií, ale také u těch, kteří jsou léčeni inhibitory buněčných drah (ibrutinib, idelalisib, venetoklax). Práce se zaměřuje na nejčastější molekulárně genetické aberace asociované s RT-DLBCL vzniklé klonálně z původní CLL. Mezi tyto změny patří disrupce TP53 genu (delece 17p a/nebo mutace) a současně také CDKN2A genu, které se vyskytují u více než poloviny pacientů s RT. S výskytem TP53 a CDKN2A aberací také často souvisí aberantní aktivace genu MYC, která bývá obvykle způsobena strukturálními změnami (zisk 8q, t(8;14)) nebo nepřímo mutacemi v MGA genu. U dalších 30 % pacientů s RT nacházíme aktivační mutace v genu NOTCH1, které bývají často přítomny v CLL klonu ještě před rozvojem RT. Přibližně 20 % případů RT tvoří heterogenní skupina pacientů s dalšími genetickými aberacemi. Také u RT, která vznikla u pacientů léčených ibrutinibem, se setkáváme s disrupcí genu TP53, ztrátou genu CDKN2A, aktivací genu MYC a aktivačními mutacemi v genu NOTCH1. Navíc u 40 % pacientů s RT vzniklou během léčby ibutinibem jsou přítomny mutace v genech BTK a PLCG2, které jsou spojeny s rezistencí k této léčbě. U pacientů s RT vzniklou během léčby idelalisibem a venetoklaxem zatím genetické změny nebyly studovány. I přes popis řady genetických změn u RT nebyla doposud nalezena molekulárně genetická aberace přímo asociovaná s rozvojem RT. Další studie na větších počtech pacientů spolu s rozvojem citlivějších molekulárně diagnostických metod nám v budoucnosti mohou pomoci objasnit molekulární procesy, které vedou k rozvoji této agresivní formy nemoci.
Klíčová slova:
inhibitory buněčných drah – chronická lymfatická leukemie – Richterova transformace – molekulárně genetické aberace – mutace
ÚVOD
Richterova transformace (RT) představuje transformaci chronické lymfocytární leukemie (CLL) do lymfoproliferace vyšší malignity. Nejčastěji dochází k transformaci do difuzního velkobuněčného B-lymfomu (DLBCL) s velmi nepříznivou prognózou, vzácněji do Hodgkinova lymfomu [1]. K transformaci může dojít kdykoli v průběhu choroby, a to nejen u pacientů léčených imunochemoterapií, ale také u těch, kteří jsou léčeni inhibitory buněčných drah (ibrutinib, idelalisib, venetoklax); u malé části nemocných se RT může vyskytnout i v případě dosud neléčené CLL. Výskyt RT se v literatuře udává v rozmezí 2–10 % u pacientů léčených imunochemoterapií [2, 3]. U pacientů léčených novými inhibitory buněčných drah je medián výskytu RT 6 % u těch, kteří byli relabující/refrakterní k imunochemoterapii, a 1 % u pacientů, kteří obdrželi léčbu inhibitorem buněčných drah v první linii léčby (tab. 1) [2].
Tab. 1. Přehled studií uvádějících výskyt Richterovy transformace (RT) u pacientů s chronickou lymfocytární leukemií (CLL) a s lymfomem z malých lymfocytů (SLL) léčených inhibitory buněčných drah 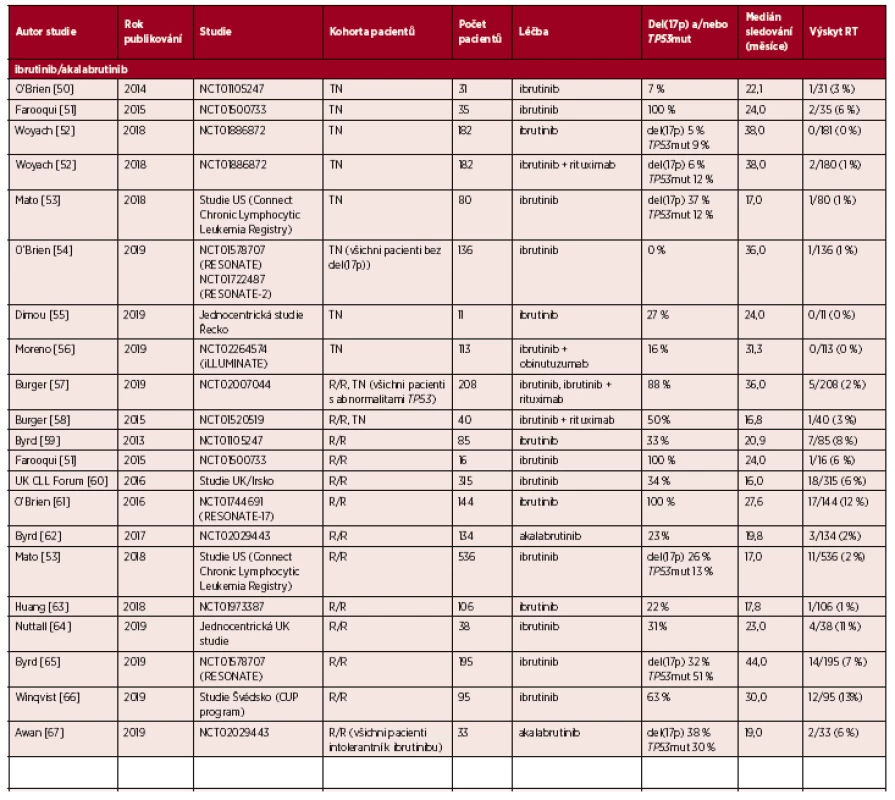

R/R – relabující/refrakterní, TN – bez předchozí léčby U nejčastější transformace CLL do DLBCL rozlišujeme dvě biologicky odlišné skupiny RT: (1) vzniklou klonálně z původní CLL a (2) nepříbuznou s původním CLL klonem. Častěji se setkáváme s RT vzniklou klonálně z původní CLL, která se vyskytuje s frekvencí přibližně 80 % [4–6]. Tato forma RT je charakteristická agresivním průběhem, rezistencí vůči chemoterapii a špatnou prognózou, s mediánem celkového přežití (OS) 6 měsíců, a to i v éře nových inhibitorů buněčných drah [7]. U RT vzniklé klonálně z původní CLL se velmi často setkáváme s výskytem aberací genu TP53, a to až u 60 % pacientů [7, 8]. S RT, která nevznikla klonálně z původní CLL, se setkáváme přibližně u 20 % případů [4–6]. RT-DLBCL nepříbuzná s původním CLL klonem nese molekulární znaky typické pro de novo DLBCL, je citlivá na chemoterapii a u těchto pacientů se dosahuje léčebných odpovědí obdobných jako v případě de novo DLBCL [8]. U této skupiny RT je výskyt TP53 aberací relativně nízký, přibližně 10–20 % [5, 6, 9].
Přestože molekulární procesy rozvoje RT nejsou zcela objasněny, je zřejmé, že klíčovou roli hraje genetika [8, 9] společně s řadou dalších faktorů, jako je biologická charakteristika CLL klonu, mikroprostředí, klinické faktory, terapie a další (obr. 1) [2, 10]. V této práci shrnujeme molekulárně genetické změny popsané u RT, a to nejen u případů pacientů léčených imunochemoterapií, ale také inhibitory buněčných drah (ibrutinib, idelalisib, venetoklax).
Obr. 1. Rizikové faktory rozvoje Richterovy transformace (RT) chronické lymfocytární leukemie (CLL). Upraveno podle [10]. ![Rizikové faktory rozvoje Richterovy transformace (RT) chronické lymfocytární leukemie (CLL). Upraveno podle [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b6e4c4c39968ecc3bc27ac35db99db20.jpeg)
MOLEKULÁRNĚ GENETICKÉ ABERACE U RICHTEROVY TRANSFORMACE
Největší rozvoj znalostí o molekulárně genetických aberacích u RT přineslo sekvenování nové generace (NGS), které odhalilo přítomnost řady mutací a malých strukturních změn [11] a doplnilo spektrum aberací detekovaných pomocí cytogenetických metod. Většina informací o genetických aberacích u RT byla popsána u nejčastější formy DLBCL vzniklé klonálně z původní CLL, které se v další části práce věnujeme.
Mezi nejvýznamnější nalezené genetické změny asociované s RT patří aberace genu TP53 (del(17p) a/nebo mutace), mutace v genu NOTCH1, ztráta CDKN2A/B genu a aktivace genu MYC [11]. Přítomnost alespoň jedné této abnormality/mutace se vyskytuje u 90 % pacientů s RT [8, 11]. Podle výskytu těchto klíčových genetických změn můžeme pacienty s RT rozdělit do tří skupin: (1) pacienti s TP53 a CDKN2A/B aberacemi (~50 % případů), často s aberantní aktivací genu MYC, (2) pacienti s mutacemi v genu NOTCH1 (~30 % případů) a (3) heterogenní skupina pacientů s dalšími genetickými aberacemi (~20 % případů), mezi které patří zejména ztráty v oblastech 7q31, 8p a 14q a amplifikace v oblastech 8q21, 18q a 13q (obr. 2) [12, 13].
Obr. 2. Genetické změny u Richterovy transformace chronické lymfocytární leukemie (CLL) do difuzního velkobuněčného lymfomu (RT DLBCL). Upraveno podle [10, 48, 49]. ![Genetické změny u Richterovy transformace chronické lymfocytární leukemie (CLL) do difuzního velkobuněčného lymfomu (RT DLBCL). Upraveno podle [10, 48, 49].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/4ab94e7a6a97b085ca5c19c8e6449166.jpeg)
K dalším genetickým abnormalitám asociovaným s RT patří komplexní karyotyp, delece 11q, trizomie chromozomu 12, nemutovaný stav IGHV, stereotypní BCR subset 8, deregulovaná exprese mikroRNA (miR-125a, miR-34a, miR-21, miR-146b, miR-181b a miR-150) [14, 15] a krátká délka telomer [16] (obr. 2) [2, 6, 11, 16–19]. Byly popsány také jednonukleotidové polymorfismy (SNP) v genech CD38, LRP4 a BCL2 predisponující k RT [10, 20].
TP53, MYC a CDKN2A aberace
Mezi nejčastější genetické změny asociované s RT patří disrupce TP53 genu (delecí 17p a/nebo mutací) a současně CDKN2A genu, které se vyskytují u více než poloviny pacientů s RT vzniklou klonálně z původní CLL (obr. 3) [12]. S výskytem TP53 a CDKN2A aberací také často koreluje aberantní aktivace genu MYC [9, 11]. Jedná se o skupinu RT pacientů s nejhorší prognózou [7].
Obr. 3. Výskyt mutací v genech TP53 a NOTCH1 v různých fázích chronické lymfocytární leukemie (CLL) [34, 48, 49]. MBL – monoklonální B-lymfocytóza, R/R – relabující/refrakterní, dg – při diagnóze, RT – Richterova transformace ![Výskyt mutací v genech TP53 a NOTCH1 v různých fázích chronické lymfocytární leukemie (CLL) [34, 48, 49]. MBL – monoklonální B-lymfocytóza, R/R – relabující/refrakterní, dg – při diagnóze, RT – Richterova transformace](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/9e47f545fd25d4310cc46b8a7419dd1d.jpeg)
Všechny postižené geny se významně podílí na patogenezi CLL. Tumor supresorový gen TP53 kóduje protein p53, který má centrální postavení v ochraně genomové integrity buňky. p53 je aktivován poškozením DNA a buněčným stresem (např. hypoxií, nadměrnou aktivitou onkogenů) a funguje jako transkripční faktor mnoha genů, kterými směřuje osud buňky k zastavení buněčného cyklu s následnou reparací DNA a/nebo do apoptózy [21]. Ukazuje se, že přibližně 50 % pacientů s RT má prokázanou TP53 aberaci v CLL klonu již před transformací [4,17].
Druhým z poškozených genů je CDKN2A. Ten kóduje protein p16INK4A, který inhibuje aktivitu kináz Cdk4 a 6, a tím negativně reguluje postup buněčného cyklu z G1 do S fáze [22]. Dále kóduje také p14ARF, který je inhibitorem MDM2 [23]. Ztráta CDKN2A je obvykle způsobena delecí 9p21 [9]. Gen CDKN2B kóduje další negativní regulátor buněčného cyklu p15INK4B a jeho ztráta je také relativně častá u RT [8]. Zajímavé je, že u RT nebyly popsány inaktivující somatické mutace a ztráta funkce tohoto genu je zřejmě realizována pouze delecí části chromozomů. Na rozdíl od TP53 aberací se delece CDKN2A objevují až v čase transformace [6].
S výskytem TP53 a CDKN2A aberací často koreluje aberantní aktivace genu MYC [9, 11]. MYC funguje jako transkripční faktor ohromného množství genů (10–15 % všech genů) [24], a tím pozitivně ovlivňuje buněčný růst a proliferaci, reguluje metabolismus, adhezi a mitochondriální funkce [25]. Aberantní aktivace MYC je obvykle způsobená strukturními změnami, např. translokací (t(8;14)), kdy se MYC dostává pod velmi aktivní promotor nebo zmnožením úseku DNA s MYC lokusem (amplifikace 8q24) [4, 6, 9]. Další možností je nepřímá aktivace MYC skrze delece nebo mutace v MGA genu, který kóduje antagonistu MYC [26, 27].
NOTCH1 mutace
Aktivační mutace v genu NOTCH1 se nachází přibližně u 30 % pacientů s RT-DLBCL vzniklé klonálně z původní CLL, přičemž tito pacienti současně nemají TP53 a CDKN2A aberace [12]. Aktivační NOTCH1 mutace se u RT pacientů často vyskytují současně s trizomií chromozomu 12, nemutovaným IGHV, ZAP-70 pozitivitou a někdy také se stereotypním BCR subsetem 8 [6, 19, 28, 29]. Mutace v NOTCH1 jsou zpravidla přítomny v CLL klonu ještě před RT (obr. 3) [9, 12, 30].
NOTCH1 kóduje transmembránový receptor, který po vazbě ligandu prochází konformačními změnami a proteolytickým štěpením, jehož výsledkem je translokace odštěpeného krátkého aktivního fragmentu ICN1 do buněčného jádra. ICN1 působí jako transkripční faktor řady genů, které podporují buněčnou proliferaci (CCND1, MYC a další) a inhibují apoptózu (např. BCL2) [31–33]. Nejčastější NOTCH1 mutací, kterou nacházíme u 80 % CLL pacientů i pacientů s RT, je delece dvou bází (c.7541_7542delCT) v C-terminální PEST doméně [34]. Tato delece vede k vytvoření předčasného stop kodonu a vzniká zkrácený protein, jenž postrádá regulační domény pro proteozomální degradaci. Důsledkem je hromadění aktivního aberantního ICN1 [35].
MOLEKULÁRNÍ GENETIKA RICHTEROVY TRANSFORMACE V ÉŘE INHIBITORŮ BUNĚČNÝCH DRAH
Také u pacientů léčených inhibitory buněčných drah (ibrutinib, idelalisib a venetoklax) se setkáváme s RT, nejčastěji typu DLBCL vzniklou klonálně z původní CLL [2]. Incidence RT u CLL pacientů léčených inhibitory buněčných drah je u relabujících/refrakterních (R/R) pacientů 6 % (medián) a v první linii léčby 1 % (tab. 1). Tato skutečnost naznačuje, že k vývoji RT přispívá více biologická charakteristika CLL než samotný typ léčby [12]. K rozvoji RT u pacientů léčených inhibitory buněčných drah dochází zpravidla během prvních 18 měsíců léčby [11, 35]. Medián OS je u pacientů s RT přibližně 6 měsíců [11, 35].
Je třeba si však uvědomit, že většina pacientů léčených ibrutinibem, idelalisibem i venetoklaxem jsou rizikoví pacienti s TP53 abnormalitami [36–41] a komplexním karyotypem [42], často intenzivně předléčení [2, 12, 43]. Současné práce prokázaly, že typické molekulárně genetické změny asociované s RT na imunochemoterapii se neliší od změn u RT získaných na inhibitorech buněčných drah [11, 40]. Jedná se především o abnormality genů TP53, CDKN2A, MYC a NOTCH1, které byly popsány u pacientů léčených ibrutinibem [40]. Kromě těchto RT-typických aberací byl u 40 % pacientů s RT léčených ibrutinibem prokázán výskyt mutací v genech BTK a PLCG2 [13, 36, 40, 44], které bývají zjištěny až u 80 % případů CLL pacientů s rezistencí k této léčbě (obr. 4) [13, 36, 40, 44, 45]. Na rozdíl od ibrutinibu nebyly zatím studovány molekulárně genetické změny u CLL pacientů, u kterých došlo k RT na léčbě idelalisibem a venetoklaxem.
Obr. 4. Porovnání výskytu rezistentních mutací v genech BTK a PLCG2 u pacientů s chronickou lymfocytární leukemií (CLL), u kterých došlo během léčby ibrutinibem k progresi onemocnění nebo k Richterově transformaci – souhrn výsledků čtyř studií [13, 36, 40, 44] ![Porovnání výskytu rezistentních mutací v genech BTK a PLCG2 u pacientů s chronickou lymfocytární leukemií (CLL), u kterých došlo během léčby ibrutinibem k progresi onemocnění nebo k Richterově transformaci – souhrn výsledků čtyř studií [13, 36, 40, 44]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/4a9fe8f86c12b0752100d8a7b96f87ae.jpeg)
Přehled jednotlivých studií zaměřených na výskyt RT u pacientů léčených ibrutinibem, idelalisibem a venetoklaxem je uveden v tabulce 1. Zatím největší skupina pacientů léčených novými inhibitory, u kterých došlo k RT, zahrnovala 59 (83 %) pacientů na BTK inhibitoru, 6 (8 %) na PI3K inhibitoru a 6 (8 %) na venetoklaxu [43]. Bohužel, studie neuvádí genetické změny asociované s RT ani nesrovnává výskyt RT u jednotlivých léčebných modalit.
MOLEKULÁRNÍ GENETIKA TRANSFORMOVANÉHO KLONU
Velmi zajímavou studii provedli Kadri et al. [40], kteří u šesti pacientů s RT léčených ibrutinibem porovnali genetické změny detekované v CLL klonu přítomném v periferní krvi s párovým vzorkem tkáně s transformovaným klonem. Autoři prokázali abnormality RT-asociovaných genů TP53, CDKN2A, MYC nebo NOTCH1 u všech pacientů a většina těchto změn (60–95 %) byla přítomna jak v CLL klonu v krvi, tak v tkáni s RT [40]. U čtyř pacientů byly v CLL klonu současně detekovány rezistentní mutace v genu BTK, z toho u dvou pacientů se tytéž mutace potvrdily také v nádorové tkáni s RT, u jednoho pacienta byla nalezena jiná BTK mutace v tkáni s RT než v CLL klonu a u jednoho pacienta byla rezistentní mutace prokázána pouze v CLL klonu [40]. Rozdílný výskyt rezistentních mutací v tkáních s RT, periferní krvi a/nebo kostní dřeni ukazuje na nutnost správného odběru vhodných materiálů pro genetickou analýzu.
MOLEKULÁRNĚ GENETICKÉ FAKTORY JAKO PREDIKTIVNÍ FAKTORY
I přes intenzivní výzkum posledních let nebyly dosud nalezeny jednoznačné molekulárně genetické markery přímo asociované s rozvojem RT. První studie přesto naznačují, že některé genetické změny by mohly sloužit jako prediktivní markery vzniku RT. CLL pacienti s nemutovaným stereotypním BCR subsetem 8 mají 70% pravděpodobnost rozvoje RT v horizontu 5 let [19], pacienti s mutacemi v NOTCH1 45% pravděpodobnost v horizontu 15 let [7, 46, 47]. Vysoká exprese miR-125a a nízká exprese miR-34a predikovala rozvoj RT u ~50 % RT pacientů [14]. Také délka telomer kratší než 5000 párů bází byla popsána jako nezávislý prognostický faktor rozvoje RT [16]. Zatím žádný z uvedených markerů však není využíván v rutinní diagnostice.
ZÁVĚR
Richterova transformace je nejčastěji asociována s disrupcí TP53 genu (delecí 17p a/nebo mutací) a CDKN2A genu, které se společně vyskytují u více než poloviny pacientů s RT vzniklé klonálně z původní CLL. U dalších 30 % pacientů s RT nacházíme aktivační mutace v genu NOTCH1, které bývají často přítomny v CLL klonu ještě před rozvojem RT. U 40 % pacientů s RT léčených ibrutinibem se setkáváme také s rezistentními mutacemi v genech BTK a PLCG2. Role genetiky u RT ještě není kompletně objasněná, nicméně první studie naznačují, že některé genetické změny by mohly sloužit jako prediktivní ukazatele vzniku RT. Bude zajímavé sledovat pokračující výzkum molekulární patogeneze RT v kontextu klinického významu.
Podíl autorů na přípravě rukopisu
AP, EK: příprava rukopisu
AP, TP, EK: revize, korekce rukopisu
Poděkování
Grantová podpora: MZ ČR VES16-32339A, IGA UP_2020_016, MH CZ-DRO (FNOL, 00098892)
Čestné prohlášení
Autoři práce prohlašují, že vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Autoři deklarují tento možný střet zájmů:
Papajík T.: Gilead, Janssen, Abbvie – cestovní a výzkumné granty, konzultace, prezentace
doc. Dr. Eva Kriegová
Ústav imunologie, LF UP a FN Olomouc
Hněvotínská 3
775 15 Olomouc
e-mail: eva.kriegova@email.cz
Zdroje
1. Bockorny B, Codreanu I, Dasanu CA. Hodgkin lymphoma as Richter transformation in chronic lymphocytic leukaemia: a retrospective analysis of world literature. Br J Haematol. 2012;156 : 50–66.
2. Ding W. Richter transformation in the era of novel agents. Hematology Am Soc Hematol Educ Program. 2018;2018(1):256–263.
3. Doubek M, Špaček M, Pospíšilová Š, et al. Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) – 2018. Transfuze Hematol. Dnes. 2018;24 : 203–216.
4. Rossi D, Spina V, Deambrogi C, et al. The genetics of Richter syndrome reveals disease heterogeneity and predicts survival after transformation. Blood. 2011;117 : 3391–3401.
5. Rossi D, Gaidano G. Richter syndrome: pathogenesis and management. Semin Oncol. 2016;43 : 311–319.
6. Chigrinova E, Rinaldi A, Kwee I, et al. Two main genetic pathways lead to the transformation of chronic lymphocytic leukemia to Richter syndrome. Blood. 2013;122 : 2673–2682.
7. Eyre TA, Schuh A. An update for Richter syndrome - new directions and developments. Br J Haematol. 2017;178 : 508–520.
8. Rossi D, Spina V, Gaidano G. Biology and treatment of Richter syndrome. Blood. 2018;131 : 2761–2772.
9. Fabbri G, Khiabanian H, Holmes AB, et al. Genetic lesions associated with chronic lymphocytic leukemia transformation to Richter syndrome. J Exp Med. 2013;210 : 2273–2288.
10. Parikh SA, Shanafelt TD. Risk factors for Richter syndrome in chronic lymphocytic leukemia. Curr Hematol Malig Rep. 2014;9 : 294–299.
11. Allan JN, Furman RR. Current trends in the management of Richter‘s syndrome. Int J Hematol Oncol. 2019;7(4). DOI 10.2217/ijh-2018-0010. Elektronicky publikováno 8. ledna 2019.
12. Khan M, Siddiqi R, Thompson PA. Approach to Richter transformation of chronic lymphocytic leukemia in the era of novel therapies. Ann Hematol. 2018;97 : 1–15.
13. Ahn IE, Underbayev C, Albitar A, et al. Clonal evolution leading to ibrutinib resistance in chronic lymphocytic leukemia. Blood. 2017;129 : 1469–1479.
14. Balatti V, Tomasello L, Rassenti LZ, et al. MiR-125a and MiR-34a expression predicts Richter syndrome in chronic lymphocytic leukemia patients. Blood. 2018;132 : 2179–2182.
15. Van Roosbroeck K, Bayraktar R, Calin S, et al. The involvement of microRNA in the pathogenesis of Richter syndrome. Haematologica. 2019;104 : 1004–1015.
16. Rossi D, Lobetti Bodoni C, Genuardi E, et al. Telomere length is an independent predictor of survival, treatment requirement and Richter’s syndrome transformation in chronic lymphocytic leukemia. Leukemia. 2009;23 : 1062–1072.
17. Wang Y, Tschautscher MA, Rabe KG, et al. Clinical characteristics and outcomes of Richter transformation: Experience of 204 patients from a single center. Haematologica; publikováno elektronicky 13. června 2019. DOI 10.3324/haematol.2019.224121.
18. Strati P, Abruzzo LV, Wierda WG, et al. Second cancers and Richter transformation are the leading causes of death in patients with trisomy 12 chronic lymphocytic leukemia. Clin Lymphoma Myeloma Leuk. 2015;15 : 420–427.
19. Rossi D, Spina V, Cerri M, et al. Stereotyped B-cell receptor is an independent risk factor of chronic lymphocytic leukemia transformation to Richter syndrome. Clin Cancer Res. 2009;15 : 4415–4422.
20. Rasi S, Spina V, Bruscaggin A, et al. Avariant of the LRP4 gene affects the risk of chronic lymphocytic leukaemia transformation to Richter syndrome. Br J Haematol. 2011;152 : 284–294.
21. Catherwood MA, Gonzalez D, Donaldson D, et al. Relevance of TP53 for CLL diagnostics. J Clin Pathol. 2019;72 : 343–346.
22. Serrano M, Hannon GJ, Beach D. A new regulatory motif in cell-cycle control causing specific inhibition of cyclin D/CDK4. Nature. 1993;366 : 704–707.
23. Pomerantz J, Schreiber-Agus N, Liegeois NJ, et al. The Ink4a tumor suppressor gene product, p19Arf, interacts with MDM2 and neutralizes MDM2‘s inhibition of p53. Cell. 1998;92 : 713–723.
24. Knoepfler PS. Myc goes global: New tricks for an old oncogene. Cancer Res. 2007;67 : 5061–5063.
25. Dang CV, O’Donnell KA, Zeller KI, et al. The c-Myc target gene network. Semin Cancer Biol. 2006;16 : 253–264.
26. Edelmann J, Holzmann K, Miller F, et al. High-resolution genomic profiling of chronic lymphocytic leukemia reveals new recurrent genomic alterations. Blood. 2012;120 : 4783–4794.
27. De Paoli L, Cerri M, Monti S, et al. MGA, a suppressor of MYC, is recurrently inactivated in high risk chronic lymphocytic leukemia. Leuk Lymphoma. 2013;54 : 1987–1990.
28. Balatti V, Bottoni A, Palamarchuk A, et al. NOTCH1 mutations in CLL associated with trisomy 12. Blood. 2012;119 : 329–331.
29. Del Giudice I, Rossi D, Chiaretti S, et al. NOTCH1 mutations in +12 chronic lymphocytic leukemia (CLL) confer an unfavorable prognosis, induce a distinctive transcriptional profiling and refine the intermediate prognosis of +12 CLL. Haematologica. 2012;97 : 437–441.
30. Rossi D, Rasi S, Spina V, et al. Different impact of NOTCH1 and SF3B1 mutations on the risk of chronic lymphocytic leukemia transformation to Richter syndrome. Br J Haematol. 2012;158 : 426–429.
31. Kopan R, Ilagan MX. The canonical Notch signaling pathway: unfolding the activation mechanism. Cell. 2009;137 : 216–233.
32. Guruharsha KG, Kankel MW, Artavanis-Tsakonas S. The Notch signalling system: recent insights into the complexity of a conserved pathway. Nat Rev Genet. 2012;13 : 654–666.
33. Fabbri G, Holmes AB, Viganotti M, et al. Common nonmutational NOTCH1 activation in chronic lymphocytic leukemia. Proc Natl Acad Sci USA. 2017;114(14):E2911–E2919.
34. Rosati E, Baldoni S, De Falco F, et al. NOTCH1 Aberrations in chronic lymphocytic leukemia. Front Oncol. 2018;8 : 229.
35. Di Ianni M, Baldoni S, Rosati E, et al. A new genetic lesion in B-CLL: a NOTCH1 PEST domain mutation. Br J Haematol. 2009;146 : 689–691.; Woyach JA, Ruppert AS, Guinn D, et al. BTK(C481S)-mediated resistance to ibrutinib in chronic lymphocytic leukemia. J Clin Oncol. 2017;35 : 1437–1443.
36. Maddocks KJ, Ruppert AS, Lozanski G, et al. Etiology of ibrutinib therapy discontinuation and outcomes in patients with chronic lymphocytic leukemia. JAMA Oncol. 2015;1(1):80–87.
37. Ahn IE, Farooqui MZH, Tian X, et al. Depth and durability of response to ibrutinib in CLL: 5-year follow-up of a phase 2 study. Blood. 2018;131 : 2357–2366.
38. Jain P, Keating M, Wierda W, et al. Outcomes of patients with chronic lymphocytic leukemia after discontinuing ibrutinib. Blood. 2015;125 : 2062–2067.
39. Jain P, Thompson PA, Keating M, et al. Long-term outcomes for patients with chronic lymphocytic leukemia who discontinue ibrutinib. Cancer. 2017;123 : 2268–2273.
40. Kadri S, Lee J, Fitzpatrick C, et al. Clonal evolution underlying leukemia progression and Richter transformation in patients with ibrutinib-relapsed CLL. Blood Adv. 2017;1 : 715–727.
41. Ding W, LaPlant BR, Call TG, et al. Pembrolizumab in patients with CLL and Richter transformation or with relapsed CLL. Blood. 2017;129 : 3419–3427.
42. Miller CR, Ruppert AS, Heerema NA, et al. Near-tetraploidy is associated with Richter transformation in chronic lymphocytic leukemia patients receiving ibrutinib. Blood Adv. 2017;1 : 1584–1588.
43. Davids MS, Roberts AW, Seymour JF, et al. Phase I first-in-human study of venetoklax in patients with relapsed or refractory non-Hodgkin lymphoma. J Clin Oncol 2017;35 : 826–833.
44. Burger JA, Landau DA, Taylor-Weiner A, et al. Clonal evolution in patients with chronic lymphocytic leukaemia developing resistance to BTK inhibition. Nat Commun. 2016;7 : 11589.
45. Lampson BL, Brown JR. Are BTK and PLCG2 mutations necessary and sufficient for ibrutinib resistance in chronic lymphocytic leukemia? Expert Rev Hematol. 2018;11 : 185–194.
46. Rossi D, Rasi S, Fabbri G, et al. Mutations of NOTCH1 are an independent predictor of survival in chronic lymphocytic leukemia. Blood. 2012;119 : 521–529.
47. Analysis of the chronic lymphocytic leukemia coding genome: role of NOTCH1 mutational activation. J Exp Med. 2011;208 : 1389–1401.
48. Fabbri G, Dalla-Favera R. The molecular pathogenesis of chronic lymphocytic leukaemia. Nat Rev Cancer. 2016;16 : 145–162.
49. Gaidano G, Foà R, Dalla-Favera R. Molecular pathogenesis of chronic lymphocytic leukemia. J Clin Invest. 2012;122 : 3432–3438.
50. O‘Brien S, Furman RR, Coutre SE, et al. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol. 2014;15 : 48–58.
51. Farooqui MZ, Valdez J, Martyr S, et al. Ibrutinib for previously untreated and relapsed or refractory chronic lymphocytic leukaemia with TP53 aberrations: a phase 2, single-arm trial. Lancet Oncol. 2015;16 : 169–176.
52. Woyach JA, Ruppert AS, Heerema NA, et al. Ibrutinib regimens versus chemoimmunotherapy in older patients with untreated CLL. N Engl J Med. 2018;379 : 2517–2528.
53. Mato AR, Nabhan C, Thompson MC, et al. Toxicities and outcomes of 616 ibrutinib-treated patients in the United States: a real-world analysis. Haematologica. 2018;103 : 874–879.
54. O‘Brien SM, Byrd JC, Hillmen P, et al. Outcomes with ibrutinib by line of therapy and post-ibrutinib discontinuation in patients with chronic lymphocytic leukemia: Phase 3 analysis. Am J Hematol. 2019;94 : 554–562.
55. Dimou M, Iliakis T, Pardalis V, et al. Safety and efficacy analysis of long-term follow up real-world data with ibrutinib monotherapy in 58 patients with CLL treated in a single-center in Greece. Leuk Lymphoma. 2019;60 : 2939–2945.
56. Moreno C, Greil R, Demirkan F, et al. Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (iLLUMINATE): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019;20 : 43–56.
57. Burger JA, Sivina M, Jain N, et al. Randomized trial of ibrutinib vs ibrutinib plus rituximab in patients with chronic lymphocytic leukemia. Blood. 2019;133 : 1011–1019.
58. Burger JA, Tedeschi A, Barr PM, et al. Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med. 2015;373 : 2425–2437.
59. Byrd JC, Furman RR, Coutre SE, et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med. 2013;369 : 32–42.
60. UK CLL Forum. Ibrutinib for relapsed/refractory chronic lymphocytic leukemia: a UK and Ireland analysis of outcomes in 315 patients. Haematologica. 2016;101 : 1563–1572.
61. O‘Brien S, Jones JA, Coutre SE, et al. Ibrutinib for patients with relapsed or refractory chronic lymphocytic leukaemia with 17p deletion (RESONATE-17): a phase 2, open-label, multicentre study. Lancet Oncol. 2016;17 : 1409–1418.
62. Byrd JC, Wierda WG, Schuh A, et al. Acalabrutinib monotherapy in patients with relapsed/refractory chronic lymphocytic leukemia: updated results from the phase 1/2 ACE-CL-001 Study. Blood. 2017;130 : 498.
63. Huang X, Qiu L, Jin J, et al. Ibrutinib versus rituximab in relapsed or refractory chronic lymphocytic leukemia or small lymphocytic lymphoma: a randomized, open-label phase 3 study. Cancer Med. 2018;7 : 1043–1055.
64. Nuttall E, Tung J, Trounce E, et al. Real-world experience of ibrutinib therapy in relapsed chronic lymphocytic leukemia: results of a single-center retrospective analysis. J Blood Med. 2019;10 : 199–208.
65. Byrd JC, Hillmen P, O‘Brien S, et al. Long-term follow-up of the RESONATE phase 3 trial of ibrutinib vs ofatumumab. Blood. 2019;133 : 2031–2042.
66. Winqvist M, Andersson PO, Asklid A, et al. Long-term real-world results of ibrutinib therapy in patients with relapsed or refractory chronic lymphocytic leukemia: 30-month follow up of the Swedish compassionate use cohort. Haematologica. 2019;104:e208–e210.
67. Awan FT, Schuh A, Brown JR, et al. Acalabrutinib monotherapy in patients with chronic lymphocytic leukemia who are intolerant to ibrutinib. Blood Adv. 2019;3 : 1553–1562.
68. Fraser G, Cramer P, Demirkan F, et al. Updated results from the phase 3 HELIOS study of ibrutinib, bendamustine, and rituximab in relapsed chronic lymphocytic leukemia/small lymphocytic lymphoma. Leukemia. 2019;33 : 969–980.
69. O‘Brien SM, Lamanna N, Kipps TJ, et al. A phase 2 study of idelalisib plus rituximab in treatment-naïve older patients with chronic lymphocytic leukemia. Blood. 2015;126 : 2686–2694.
70. Furman RR, Sharman JP, Coutre SE, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med. 2014;370 : 997–1007.
71. Zelenetz AD, Barrientos JC, Brown JR, et al. Idelalisib or placebo in combination with bendamustine and rituximab in patients with relapsed or refractory chronic lymphocytic leukaemia: interim results from a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2017;18 : 297–311.
72. Flinn IW, Hillmen P, Montillo M, et al. The phase 3 DUO trial: duvelisib vs ofatumumab in relapsed and refractory CLL/SLL. Blood. 2018;132 : 2446–2455.
73. Cramer P, von Tresckow J, Bahlo J, et al. Bendamustine followed by obinutuzumab and venetoclax in chronic lymphocytic leukaemia (CLL2-BAG): primary endpoint analysis of a multicentre, open-label, phase 2 trial. Lancet Oncol. 2018;19 : 1215–1228.
74. Flinn IW, Gribben JG, Dyer MJS, et al. Phase 1b study of venetoclax-obinutuzumab in previously untreated and relapsed/refractory chronic lymphocytic leukemia. Blood. 2019;133 : 2765–2775.
75. Stilgenbauer S, Eichhorst B, Schetelig J, et al. Venetoclax for patients with chronic lymphocytic leukemia with 17p deletion: results from the full population of a phase II pivotal trial. J Clin Oncol. 2018;36 : 1973–1980.
76. Roberts AW, Davids MS, Pagel JM, et al. Targeting BCL2 with venetoclax in relapsed chronic lymphocytic leukemia. N Engl J Med. 2016;374 : 311–322.
77. Seymour JF, Ma S, Brander DM, et al. Venetoclax plus rituximab in relapsed or refractory chronic lymphocytic leukaemia: a phase 1b study. Lancet Oncol. 2017;18 : 230–240.
78. Seymour JF, Kipps TJ, Eichhorst B, et al. Venetoclax-rituximab in relapsed or refractory chronic lymphocytic leukemia. N Engl J Med. 2018;378 : 1107–1120.
79. Jones JA, Mato AR, Wierda WG, et al. Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, open-label, phase 2 trial. Lancet Oncol. 2018;19 : 65–75.
80. Coutre S, Choi M, Furman RR, et al. Venetoclax for patients with chronic lymphocytic leukemia who progressed during or after idelalisib therapy. Blood. 2018;131 : 1704–1711.
81. Rogers KA, Huang Y, Ruppert AS, et al. Phase 1b study of obinutuzumab, ibrutinib, and venetoclax in relapsed and refractory chronic lymphocytic leukemia. Blood. 2018;132 : 1568–1572.
82. Eyre TA, Kirkwood AA, Gohill S, et al. Efficacy of venetoclax monotherapy in patients with relapsed chronic lymphocytic leukaemia in the post-BCR inhibitor setting: a UK wide analysis. Br J Haematol. 2019;185 : 656–669.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Chromozomové změny u chronické lymfocytární leukemie, jejich prognostický a prediktivní význam
- Chromozomové aberace a jejich role v transformaci chronické lymfocytární leukemie v éře léčby inhibitory BCR signalizace
- Molekulárně genetické změny u Richterovy transformace chronické lymfocytární leukemie
- Mutace asociované s rezistencí u pacientů s chronickou lymfocytární leukemií léčených ibrutinibem, idelalisibem a venetoklaxem
- Rozvoj Richterovy transformace u nemocného s refrakterní chronickou lymfocytární leukemií na léčbě ibrutinibem
- Transformace chronické lymfocytární leukemie do Hodgkinovy varianty Richterova syndromu
- Vzdělávací workshop – uplatnění nových technologií v precizní medicíně CML a ALL
- Novinky z redakce
- Prof. MUDr. Ladislav Jebavý, CSc., slaví 70 let
- Životní jubileum MUDr. Věry Vozobulové
- Editorial
- Richterova transformace chronické lymfocytární leukemie v éře léčby inhibitory buněčných drah
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Chromozomové změny u chronické lymfocytární leukemie, jejich prognostický a prediktivní význam
- Molekulárně genetické změny u Richterovy transformace chronické lymfocytární leukemie
- Richterova transformace chronické lymfocytární leukemie v éře léčby inhibitory buněčných drah
- Transformace chronické lymfocytární leukemie do Hodgkinovy varianty Richterova syndromu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



