-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaZjednodušený algoritmus určování poruch acidobazické rovnováhy
Autoři: MUDr. Rajdl Daniel, Ph.D.
Působiště autorů: Ústav klinické biochemie a hematologie, FN Plzeň a LF v Plzni, Univerzita Karlova
Vyšlo v časopise: Svět praktické medicíny, 3, 2022, č. 3, s. 69-73
Kategorie: Medicína v ČR: přehledový článek
Souhrn
S poruchami acidobazické rovnováhy se v klinické praxi setkáváme velmi často. Jejich diagnostika a interpretace laboratorních ukazatelů spojených s ABR je pro mnohé lékaře výzvou. V přehledném článku prezentujeme zjednodušený praktický algoritmus založený na spojení klinického podezření a hodnot pH, pCO2, BEECT, AG a Clkor, pomocí kterého spolehlivě odhalíme jakoukoliv jednoduchou poruchu ABR a jejich kombinace. Tento přístup zároveň významně pomáhá při odhalení příčiny poruchy a při následném terapeutickém managementu.
Poruchy acidobazické rovnováhy (ABR) nacházíme velmi často zejména u pacientů hospitalizovaných na jednotkách intenzivní péče. Při managementu pacienta s poruchou ABR je zásadní identifikovat příčinu stavu a tu léčit. Laboratorní výsledky jsou v tomto procesu klíčové. Patogeneze je určena komplexem řady faktorů a obvykle je spojena s poruchou funkce plic, ledvin, jater nebo zažívacího traktu. Výsledkem jsou pak změny v koncentraci vodíkových iontů (pH), iontové dysbalance a poruchy oxygenace tkání. V tomto souhrnu se zaměříme na zjednodušený praktický postup, jak s pomocí laboratorních výsledků určit poruchu ABR a v kombinaci s klinickými údaji identifikovat její pravděpodobnou příčinu. Pro podrobnější rozbor teorie použitých modelů a patofyziologie odkazujeme na zdroje uvedené v literatuře.
Před vlastním výkladem si zdůrazněme, že pro správnou interpretaci laboratorních výsledků je nezbytné dodržet preanalytické podmínky. Stanovení parametrů ABR je obzvláště náchylné na preanalytické vlivy a zároveň i malá změna v ukazatelích, jako je pH nebo pCO2, je klinicky významná, protože jejich biologická variabilita je velmi nízká. Zmíníme tři nejčastější chyby: bubliny ve vzorku (odběr musí být anaerobní; bublina mj. falešně sníží pCO2 a zvýší pO2), sraženiny (vzorek je nutné promíchat ihned po odběru, jinak jsou výsledky nepředvídatelně zkreslené) a chybný transport (co nejrychleji doručit do laboratoře, na zchlazeném gelu). První dvě chyby jsou velmi časté i při měření na analyzátorech umístěných v blízkosti pacienta (POCT).
Jednoduché poruchy ABR jsou acidózy nebo alkalózy, podle příčiny mohou být respirační nebo metabolické. Vznikají tak čtyři kombinace: respirační acidóza (RAC) a alkalóza (RAL) + metabolická acidóza (MAC) a alkalóza (MAL). Respirační poruchy se mohou kompenzovat ledvinami (plně za 2–3 dny), metabolické poruchy kompenzují plíce (do 24 hodin). Klinicky se nejčastěji setkáváme se smíšenými poruchami, kdy se kombinuje více jednoduchých poruch (např. MAC + MAL). K našemu cíli – identifikaci poruch ABR a jejich pravděpodobných příčin – nás dostanou odpovědi na čtyři otázky. Ty nás systematicky vedou od klinického podezření přes změny pH, pCO2 až po rozklíčování příčin změn v koncentraci hydrogenuhličitanu (HCO3 −) vyjádřených ve formě base excess extracelulární tekutiny (BEECT). Nejprve si vysvětlíme význam jednotlivých otázek a jak na ně odpovídat, následně si vše vyzkoušíme na příkladech. Odpovědi na otázky 2 až 4 získáme interpretací laboratorních výsledků.
1. Na co mám klinické podezření?
V anamnéze, fyzikálním, klinickém a laboratorním vyšetření hledáme hlavně změny ve funkci plic (např. hyper/hypoventilace, dušnost, kašel, teplota, výsledky zobrazovacích vyšetření, hypoxemie), ledvin (např. zvýšený kreatinin, proteinurie, iontové dysbalance), jater (např. ikterus, zvýšená krvácivost, známky abúzu etanolu, zvýšení ALT), zažívacího traktu (zvracení a průjem). Všímáme si změn v příjmu tekutin (hydratace) a potravy (hladovění, malnutrice). Nezapomeneme na stav vědomí, toxikologickou anamnézu, prokrvení a poškození tkání (ischemie, svalové křeče) a již diagnostikovaná a léčená onemocnění (např. diabetes mellitus, CHOPN, endokrinologické poruchy).
Dušný pacient se známkami bronchopneumonie nás povede k podezření na respirační acidózu; pacienta se selháním ledvin a hyperkalemií budeme spíše směrovat k metabolické acidóze; u kli enta s diabetem 1. typu, polyurií/polydipsií a hyperventilací budeme uvažovat rovněž o metabolické acidóze. Pacient se zvracením nebo s vysokými dávkami furosemidu v nás vyvolá myšlenky na metabolickou alkalózu.
2. Jaká je primární porucha? (pH)
Koncentraci H+ tradičně vyjadřujeme jako záporný dekadický logaritmus aktivity H+, resp. aktivity oxoniových kationtů H3O+, neboli pH. Je to výsledek všech příčin, efektu pufrů a orgánových kompenzačních reakcí. Při odpovídání na otázku: „Jaká je primární porucha ABR?“ vycházíme z předpokladu, že žádnou poruchu organismus nekompenzuje až na opačnou stranu pH (acidemické pH na alkalemické a naopak). Pokud je tedy primární poruchou acidóza, je pH nižší než 7,36; u alkalózy je pH vyšší než 7,44. Tabulka 1 uvádí referenční rozmezí pro diskutované parametry a zároveň má v posledním sloupci „středovou hodnotu“. Tu budeme používat pro zjednodušení úvah i pro další laboratorní parametry. Když aplikujeme toto zjednodušení na pH, pak pH < 7,4 znamená acidózu, pH > 7,4 alkalózu. U kombinovaných protisměrných poruch (např. metabolická acidóza s metabolickou alkalózou) je pH posunuto na stranu převažující poruchy. Odpověď na otázku však zůstává jednoznačná: primární (a ev. i převažující u kombinovaných) poruchou je buď acidóza, nebo alkalóza.
Tab. 1. Referenční rozmezí a „středové hodnoty“ u vybraných parametrů ABR 
3. Jsou plíce příčinou poruchy, nebo ji kompenzují? (pCO2)
Parciální tlak oxidu uhličitého (pCO2) můžeme velmi zjednodušeně označit jako globální ukazatel výměny plynů v plicích. Pokud je pCO2 < 5,3 kPa, vylučuje se více CO2, než se produkuje, jde o hypokapnii – je spojená s hyperventilací. Analogicky jsou hodnoty pCO2 > 5,3 kPa spojeny s hypoventilací (se špatnou výměnou plynů v plicích). Spojíme - li údaj o pCO2 s primární poruchou ABR (viz předchozí krok), můžeme odpovědět na otázku, zda jsou plíce příčinou poruchy, nebo ji kompenzují. Například je-li primární poruchou acidóza a pCO2 je v pásmu hypokapnie, jde o (hyperventilací) kompenzovanou metabolickou acidózu. Všechny kombinace patologických hodnot pH a pCO2 shrnuje tabulka 2 (fyziologické hodnoty pCO2 bychom mohli najít u akutních/nekompenzovaných metabolických poruch). U metabolických poruch jsou změny pCO2 odrazem kompenzace, u respiračních jsou příčinou poruchy a jejich ev. kompenzaci zjistíme až ze změn v koncentraci HCO3 − (viz další krok). Klinicky přínosná může být i informace, zda je metabolická porucha kompenzovaná částečně, nebo úplně. Například pokud po dvou dnech rozvoje metabolické acidózy nenajdeme úplnou kompenzaci plícemi, máme zároveň podezření na nějakou plicní patologii (např. pneumonii). Plná kompenzace by se u zdravých plic měla rozvinout do 24 hodin. Kompenzační graf (Obr. 1) je nejjednodušší způsob, jak zjistit adekvátnost kompenzace u všech poruch ABR. Graf lze vyjádřit také pomocí různě složitých a různě spolehlivých rovnic (nejznámější jsou tzv. Bostonská kritéria). V tomto stručném textu zmíníme jen jeden relativně spolehlivý a jednoduchý výpočet použitelný pro odhad stupně kompenzace metabolické acidózy. Pomocí vztahu BEECT/8 zjistíme přibližný pokles pCO2, který bychom očekávali při úplné kompenzaci MAC hyperventilací. Například při BEECT 16 mmol/l je očekávaný pokles z normálních hodnot pCO2 2 kPa (16/8), tedy na 3,3 kPa (5,3–2). U tohoto příkladu mohou tak nastat tři situace:
- naměřené pCO2 je v rozmezí 3,3 kPa +/ − 0,5 kPa => jde o úplnou kompenzaci,
- naměřené pCO2 je významně vyšší (> 3,8 kPa) => hledáme patologii plic,
- naměřené pCO2 je významně nižší (< 2,8 kPa) => myslíme na kombinaci s RAL.
Tab. 2. Určení základní poruchy ABR z kombinace pH a pCO2 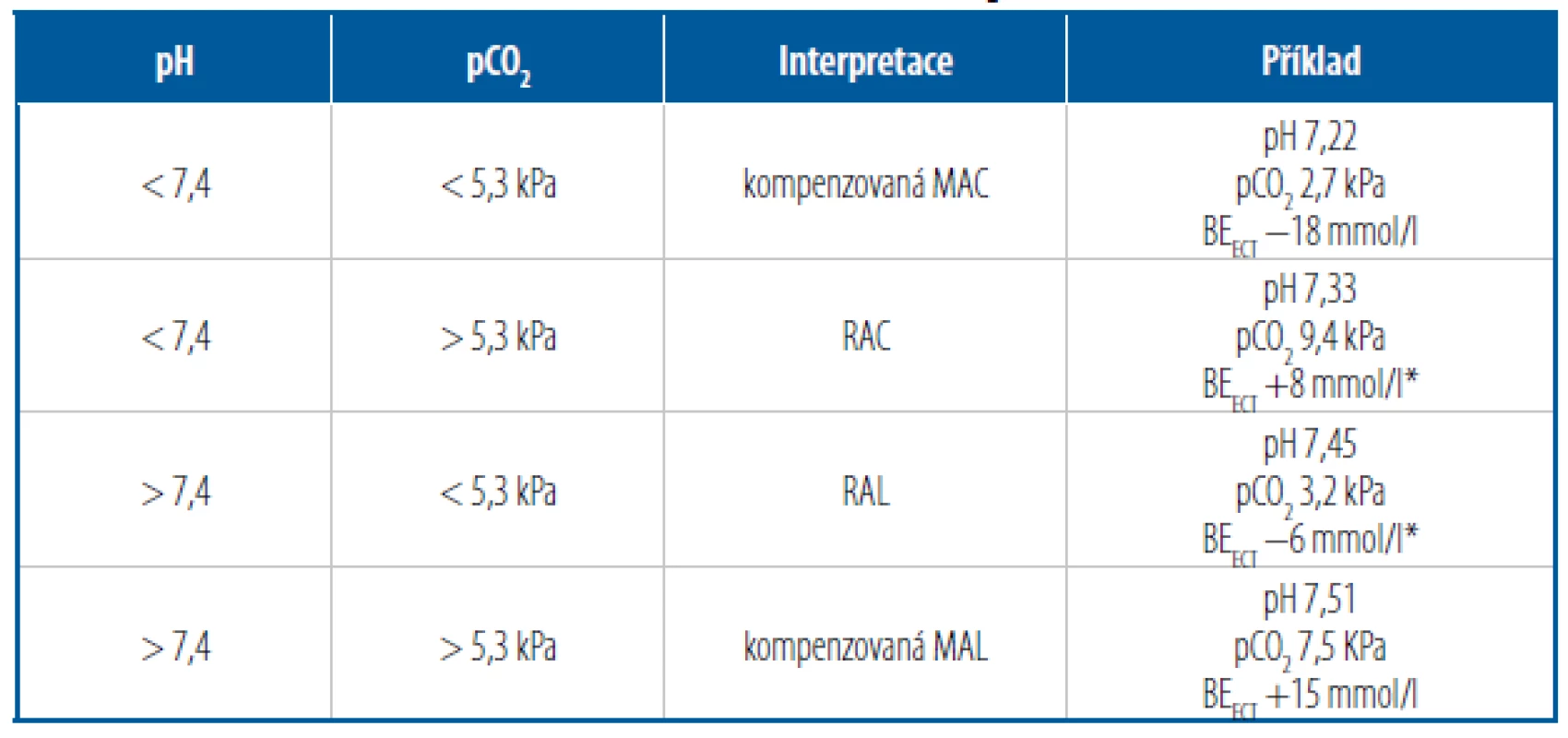
* s tímto BEECT jde o respirační poruchy kompenzované funkcí ledvin (viz další krok) Obr. 1. Kompenzační graf. Nanesením hodnot pCO2, BEECT (a pH) zjistíme typ poruchy a její časový vývoj (stupeň kompenzace). „a“ před zkratkou poruchy znamená „akutní“, „c“ před zkratkou poruchy znamená „kompenzovaná“. 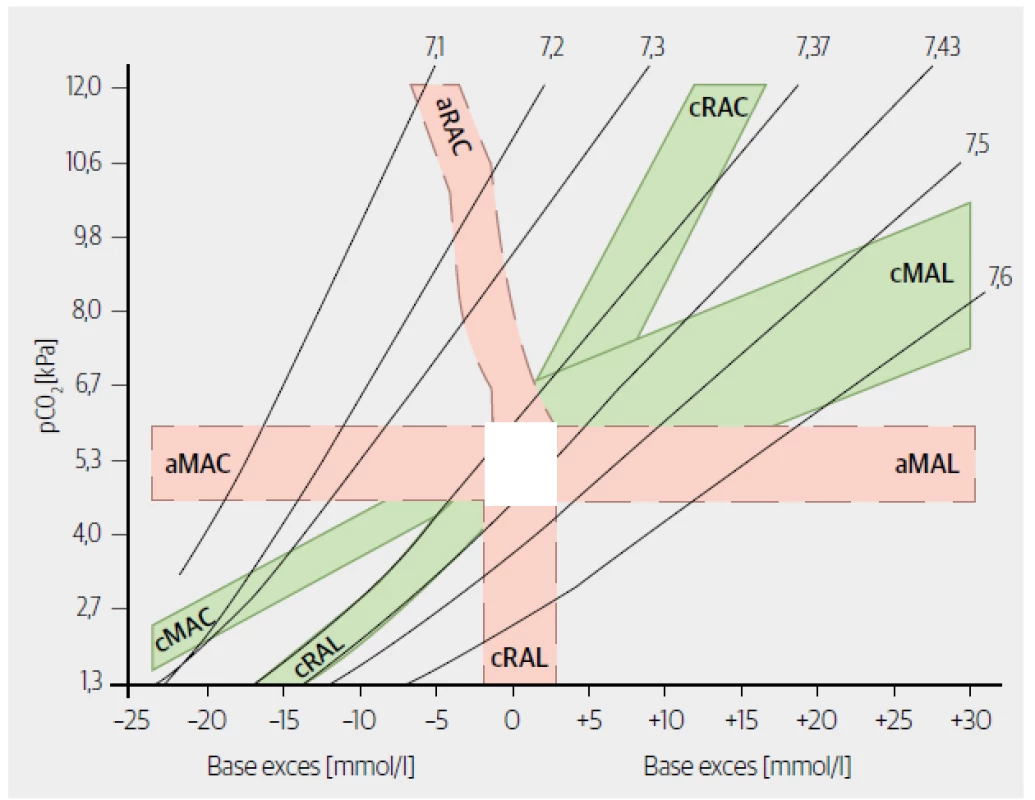
4. Co způsobuje změny v HCO3 − ? (AG, Clkor)
HCO3 − je hlavní pufr extracelulární tekutiny (ECT) a vzhledem k čilým transportům mezi intra - a extracelulárním prostorem můžeme výslednou extracelulární koncentraci HCO3 − zjednodušeně považovat za celkový odraz pufrovacích a metabolických reakcí spojených s ABR. HCO3 − měříme (v ČR počítáme z pH a pCO2) v krvi. Plazma tvoří asi ¼ celého ECT a ve zbylých ¾ ECT je stejná koncentrace HCO3 − jako v plazmě (a probíhají zde stejné pufrovací reakce). Proto změny v HCO3 − nevypovídají optimálně o změnách celkové pufrovací kapacity HCO3 − v ECT. Lepším vyjádřením změn v HCO3 − je výpočet base excess extracelulární tekutiny (BEECT). Při hodnocení poruch ABR proto doporučujeme používat BEECT místo koncentrace HCO3 −. Zjednodušeně BEECT 0 mmol/l odpovídá normální koncentraci HCO3 − (24 mmol/l) a např. BEECT −10 mmol/l odpovídá koncentraci HCO3 − 14 mmol/l (24–10).
Koncentrace HCO3 − v ECT se mění jak vlivem pufrovacích reakcí, tak metabolickými funkcemi ledvin. Oba vlivy charakterizují laboratorní parametry anion gap (AG) a korigované chloridy (Clkor). Nejprve si AG a Clkor vysvětlíme a naučíme se jejich interpretaci, následně se pak vrátíme do kontextu celého algoritmu a ukážeme si, jak nám tyto dva parametry pomohou určit příčinu změn v BEECT.
Anion gap
Anion gap (AG), někdy označované jako anionové okno, vyjadřuje množství aniontů, které zbyly po disociaci kyselin způsobujících acidózu. Například si zjednodušeně můžeme představit, že při diabetické ketoacidóze vzestup koncentrace kyseliny β-hydroxymáselné o 5 mmol/l povede k produkci 5 mmol/l H+, které budou pufrovány 5 mmol/l HCO3 − (hydrogenuhličitan klesne o 5 mmol/l). Zároveň po kyselině zbyde 5 mmol/l aniontu β-hydroxybutyrátu. Výsledek AG se vypočítá odečtením hlavních aniontů plazmy (HCO3 − a Cl−) od hlavních kationtů plazmy (Na+ a K+): AG = ([Na+] + [K+]) – ([HCO3 −] + [Cl−])
Do metabolických acidóz způsobených kyselinami, jejichž anionty se odrazí ve zvýšené hodnotě AG, patří nejčastější příčiny metabolických acidóz, jako je např. laktátová acidóza nebo diabetická ketoacidóza (Tab. 3). Při pohledu na iontové složení plazmy (Obr. 2) je také zřejmé, že většinu AG tvoří fyziologicky albumin – při významných změnách koncentrace albuminu může být výpočet AG zkreslený a nemusí nám ev. přítomnost aniontů kyselin odhalit. Proto je vhodné AG na aktuální koncentraci albuminu korigovat. Vycházíme ze zjednodušeného předpokladu, že náboj albuminu v mmol/l odpovídá ¼ koncentrace albuminu v g/l. Klesne-li tedy albumin ze 40 g/l na 20 g/l, klesne náboj albuminu z 10 mmol/l na 5 mmol/l. O stejné množství nám klesne i AG a korekce AG na albumin spočívá v tom, že vypočtený AG navýšíme právě o tento pokles náboje albuminu způsobený poklesem koncentrace albuminu.
Tab. 3. Příčiny metabolické acidózy se zvýšeným AG. Snížený AG nemá význam v určení poruchy ABR 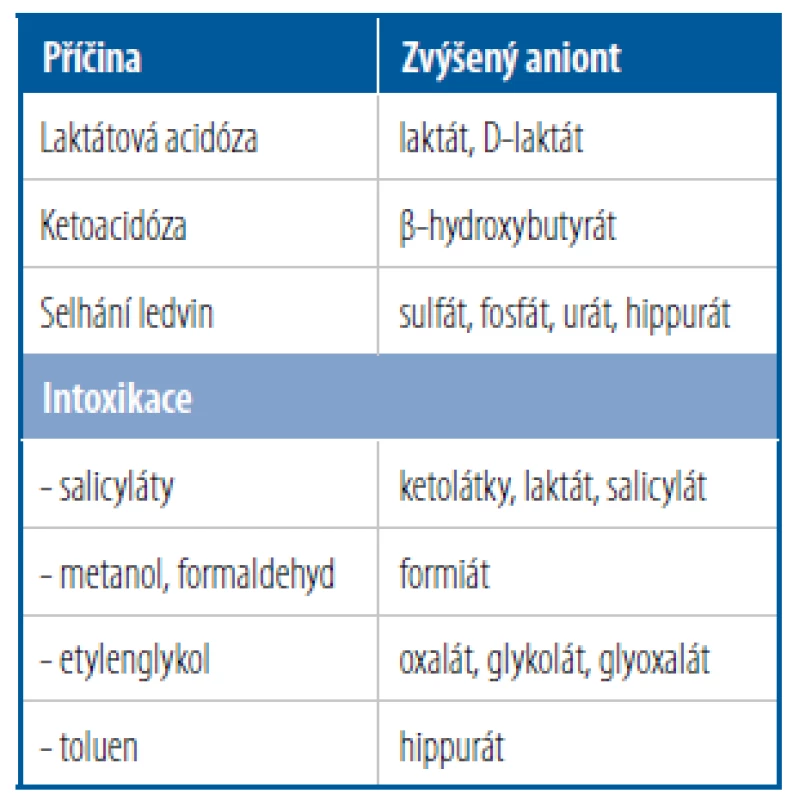
Obr. 2. Základní iontové složení plazmy a zobrazení prostoru, který přibližně reprezentuje AG (červeně ohraničený obdélník). Skutečná hodnota AG je snížena o neměřené kationty (Ca2+, Mg2+), které nejsou na straně kationtů ve vzorci započítány. UA− – neměřené anionty. 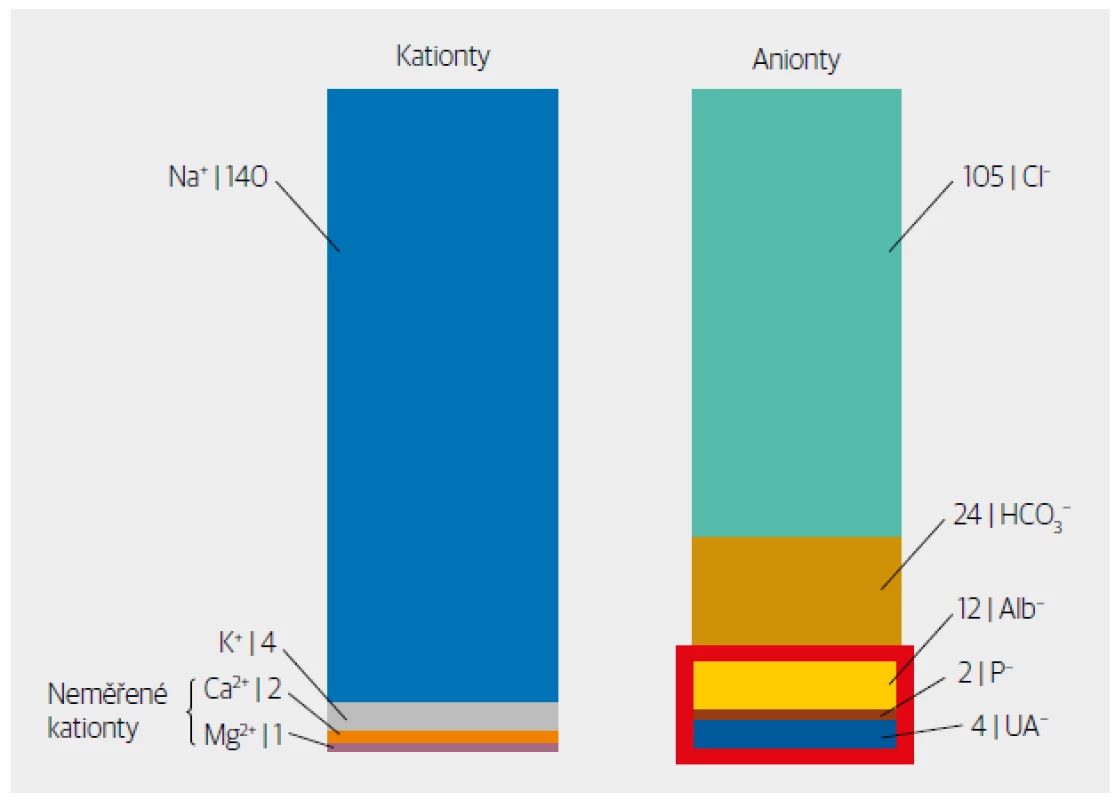
Korigované chloridy (Clkor)
Změny chloridů jsou na úrovni iontových kanálů svázány se změnami hydrogenuhličitanů. Stoupá-li Cl−, klesá HCO3 − a naopak. Dalším významným faktorem, který do vztahu Cl− a HCO3 − vstupuje, je koncentrace Na+. Ta základně určuje prostor pro všechny anionty, včetně HCO3 −. Při hypernatremii je prostor pro HCO3 − vyšší a naopak. Protože ke změnám Cl− a Na+ často dochází současně, není na první pohled z koncentrací Cl− patrné, jaký měly vliv na koncentraci HCO3 −. Proto si situaci zjednodušujeme korekcí chloridů na sodík ve výpočtu korigovaných chloridů. Korigované chloridy jsou chloridy, které by měl pacient při normální koncentraci Na+ v plazmě (140 mmol/l). Vypočítají se tedy jako: Clkor = Cl− × 140/Na+
Interpretace je pak velmi přímočará: zvýšené Clkor (tedy > 105 mmol/l) znamenají hyperchloremickou metabolickou acidózu (nebo kompenzovanou RAL), snížené Clkor (tedy < 105 mmol/l) značí hypochloremickou metabolickou alkalózu (nebo kompenzovanou RAC). Příklady změn Clkor a jejich interpretace najdete v Tabulce 4.
Tab. 4. Příčiny snížení a zvýšení Clkor 
Interpretace BEECT v kontextu AG a Clkor
Jak jsme si uvedli výše, změny v HCO3 − jsou nejlépe vyjádřeny pomocí BEECT a jsou určeny buď změnami (nárůstem) AG, nebo změnami (nárůstem nebo poklesem) Clkor anebo změnami jak AG, tak i Clkor současně. Představme si pacienta s BEECT −10 mmol/l, AG 35 mmol/l a Clkor 95 mmol/l. Vzestup AG o 20 mmol/l („středová koncentrace“ je 15 mmol/l) sníží HCO3 − o 20 mmol/l. Pokles Clkor o 10 mmol/l („středová koncentrace“ je 105 mmol/l) zvýší koncentraci HCO3 − o 10 mmol/l. Jde o protichůdné vlivy (acidifikující a alkalinizující), jejichž výsledkem je BEECT −10 mmol/l (tedy pokles HCO3 − v ECT o celkem 10 mmol/l). Jde tedy o kombinovanou poruchu: metabolickou acidózu se zvýšeným AG a hypochloremickou metabolickou alkalózu. Jen z klinického kontextu můžeme odvodit příčiny těchto odchylek: zvýšení AG může být způsobeno diabetickou ketoacidózou nebo laktátovou acidózou nebo některými intoxikacemi (Tab. 3), snížení Clkor může plynout z podávání furosemidu, zvracení nebo kompenzace RAC (Tab. 4). Komplexní demonstraci celého postupu určení poruchy ABR ilustruje následující kazuistika.
Kazuistika
51letý muž, alkoholik s jaterní cirhózou, byl přijat pro celkové zhoršení stavu s rozvojem ikteru, dušností, anorexií a bolestí břicha a pro zvětšující se objem břicha. Při klinickém vyšetření dominuje sinusová tachykardie 120/min, extrémní tachypnoe (30/min) a břicho s tenzním ascitem. Z laboratorních výsledků vybíráme hodnoty uvedené v tabulce 5.
Tab. 5. Vybrané laboratorní výsledky u pacienta 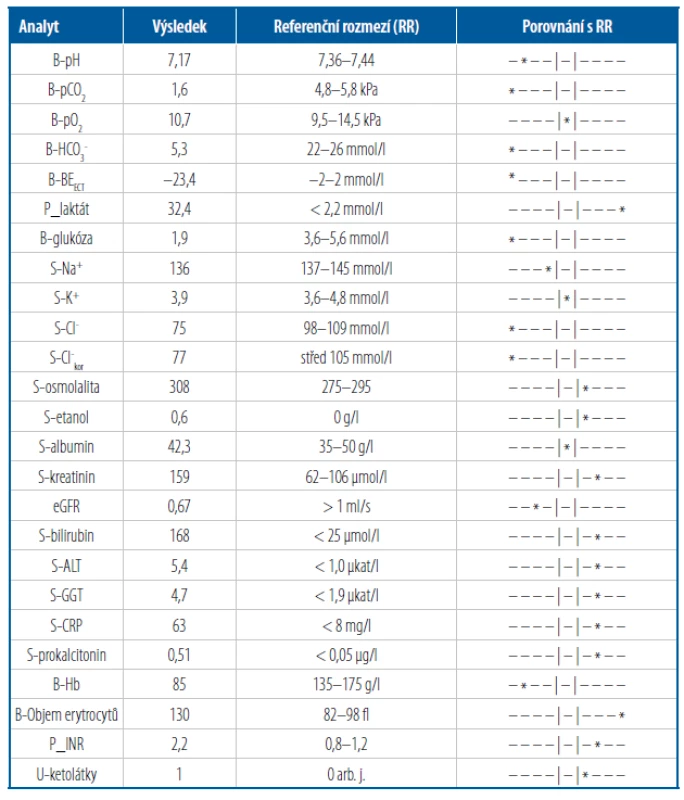
Při hodnocení poruchy ABR budeme odpovídat na výše uvedené otázky:
- Na co mám klinické podezření? Hyperventilace nás vede k úvaze o RAL nebo kompenzaci MAL; známky dekompenzace jaterní cirhózy směřují k úvahám o vlivu selhání jater na ABR a laktátová acidóza bude první možností, na kterou myslíme. V laboratoři nám lehce zvýšené ALT podporuje podezření na poškození jaterních buněk, poruchu jaterních funkcí vyjadřuje vysoký bilirubin, INR (porucha proteosyntézy v játrech), hypoglykemie nalačno (porucha glukoneogeneze a glykogenolýzy). Velký objem erytrocytů v kombinaci s anamnézou a zvýšeným GGT potvrzuje chronický etylismus. Z ostatních výsledků stojí za zmínku významný pokles glomerulární filtrace a známky zánětu (CRP, PCT).
- Jaká je primární porucha? pH je 7,17 – primární porucha je tedy jednoznačně acidóza.
- Jsou plíce příčinou poruchy, nebo ji kompenzují? pCO2 je 1,6 kPa – hypokapnie nemůže být příčinou acidózy, je odrazem kompenzační hyperventilace při acidóze; jde tedy o kompenzovanou MAC (cMAC). Pokud si orientačně vypočítáme limit pro kompenzaci (BEECT/8 = −23,4/8 = −2,93; očekáváme tedy pokles pCO2 o 2,93 kPa = 5,3 − 2,93 = 2,37 kPa ± 0,5 kPa), jehož spodní hranice je 1,87 kPa (= 2,37 − 0,5), vidíme, že aktuální pCO2 je ještě nižší. Máme tedy podezření na kombinaci cMAC s RAL (může být způsoben např. rozvíjejícím se zánětem nebo bolestí a emočním stresem). Obdobně můžeme překročení limitu kompenzace odečíst z kompenzačního grafu (Obr. 1).
- Co způsobuje změny v HCO3 − ? AG je přibližně 60 mmol/l, navíc (nad „normálních“ 15 mmol/l) má pacient 45 mmol/l aniontů kyselin. BEECT by vlivem těchto kyselin měl klesnout na −45 mmol/l. Z nich laktát tvoří asi 32 mmol/l. Při absenci významné hypoxie je u tohoto pacienta nejpravděpodobnější příčinou extrémně zvýšeného laktátu selhání jaterních funkcí. O vysvětlení zbylých 13 mmol/l můžeme z dostupných údajů jen hypotetizovat – ketolátky při hladovění nebo při alkoholické ketoacidóze, acetát jako metabolit etanolu, ev. sulfáty a další anionty při renální acidóze. U alkoholické ketoacidózy lze předpokládat vyšší podíl betahydroxybutyrátu, který nereaguje s močovými proužky – naměřená koncentrace ketolátek může být falešně nízká. Albumin není významně snížený, hodnotu AG na něj není potřeba korigovat.
Clkor jsou 77 mmol/l, chybí (v porovnání s „normálními hodnotami“ 105 mmol/l) 28 mmol/l Cl−, které by vedly k vzestupu HCO3 − o 28 mmol/l. Jde tedy o hypochloremickou metabolickou alkalózu. Pacient nezvrací, dostává však (kvůli ascitu) vysoké dávky furosemidu, které způsobují významné ztráty chloridů močí.
Pokud vlivy AG a Clkor na změnu koncentrace HCO3 − sečteme (pokles o 45 mmol/l a vzestup o 28 mmol/l), vyjde nám −17 mmol/l, které se blíží analyzátorem vydanému výsledku BEECT (23,4 mmol/l). Součet všech nalezených vlivů (AG, Clkor) na koncentraci HCO3 − není nutné provádět, jde jen o kontrolu hrubých chyb (ve výpočtech, v analytice stanovení). Důležité je, že jsme pomocí AG a Clkor odhalili smíšenou poruchu ABR a máme směr pro terapii:
- hyperventilací kompenzovaná MAC se zvýšeným AG způsobená laktátem, ketolátkami a ev. i acetátem – snížit laktát nám může pomoci podání vysokých dávek thiaminu (pravděpodobný deficit) a snaha o kompenzaci jaterních funkcí, podání glukózy zmírní ketogenezi, etanol se metabolizuje spontánně,
- pravděpodobná kombinace s RAL – zvážit rozvíjející se systémový zánět/ sepsi,
- hypochloremická MAL způsobená podáváním furosemidu – suplementace chloridů ve formě KCl (sklon k hypokalemii).
Závěr
Závěrem si shrňme, že spojením klinického podezření a algoritmu založeného na hodnotách pH, pCO2, BEECT, AG a Clkor spolehlivě odhalíme jakoukoliv jednoduchou poruchu ABR a jejich kombinace. Výhodou tohoto přístupu je pomoc při odhalení příčiny poruchy a následné nasměrování ke konkrétním terapeutickým úvahám.
Zdroje
1. Rajdl D. Acidobazická rovnováha a oxygenace tkání. In: Racek J, Rajdl D. Klinická biochemie. 3. vydání. Praha: Galén, 2021 : 67–95.
2. Rose BD, Post TW. Clinical physiology of acid-base and electrolyte disorders. 5th ed. McGraw-Hill, Medical Pub. Division, 2001.
3. Sheldon M, Ali E. Practical approach to physical-chemical acid-base management: Stewart at the bedside. Ann Am Thorac Soc. American Thoracic Society; 2015;12 : 111–7.Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2022 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Trazodon pohledem praktického lékaře
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Úvodní slovo
- Nové registrace na evropském poli
- Diabetes MODY: rychlý přehled faktů
- Komentář k článku Diabetes MODY: rychlý přehled faktů
- Nová naděje pro pacienty s chronickým onemocněním ledvin
- Prediabetes – význam včasné diagnostiky
- Racionální pohled na klinický přínos gliflozinů v terapii diabetiků
- Známe dobře metformin?
- „Prevence může udělat život nejenom dlouhý, ale i kvalitní“
- Inkretinová analoga v léčbě obezity v současnosti
- Základní postupy při diagnostice a léčbě familiární hypercholesterolemie
- Dyslipidemie a doporučení ESC 2021 pro kardiovaskulární prevenci
- Kombinovaná terapie hypolipidemiky (statin + ezetimib)
- Hyperurikemie – nový rizikový faktor pro kardiovaskulární onemocnění?
- Dnavá artritida
- Poruchy „metabolismu“ iontů – nejčastější patologie, se kterými se setkáme v klinické praxi
- Zjednodušený algoritmus určování poruch acidobazické rovnováhy
- Betablokátory v léčbě kardiovaskulárních onemocnění
- Praktické rady pro použití vybraných lékových skupin z pohledu léčby srdečního selhání podle doporučení ESC 2021
- Kulatý stůl: Očkování v ČR. Význam vakcinační politiky v systému zdravotní péče, aktuální otázky a nástin budoucího vývoje
- Význam dědičnosti (nejen) v psychiatrii
- Léčba idiopatických střevních zánětů – informace pro lékaře v praxi
- Znalostní test: 2 kredity ČLK
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diabetes MODY: rychlý přehled faktů
- Poruchy „metabolismu“ iontů – nejčastější patologie, se kterými se setkáme v klinické praxi
- Inkretinová analoga v léčbě obezity v současnosti
- Známe dobře metformin?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



