-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSoučasný pohled na protézy v herniologii (kýlní síťky) – klasifikace, indikace, výhody a nevýhody jednotlivých materiálů, komplikace
Current view on prostheses in herniology (hernia meshes) – classifications, indications, advantages and disadvantages of different implants, complications J. Skach, M. Slamborova, V. Blecher, P. Hromadka, R. Gurlich
Hernia repair is one of the most commonly performed surgical procedures worldwide. Reinforcement of the tissue with a surgical mesh requires the implantation of much over 1 million meshes per year worldwide. Implant design remains a critical challenge for the prevention of hernia recurrence. Currently available implants exhibit a wide spectrum of different characteristics. This review summarizes the specifics, advantages, limitations, complications and functionalities of commonly accessible prostheses. There is still no ideal mesh for every surgery.
Keywords:
Hernia – mesh – repair – Biocompatibility
Autoři: J. Škach 1; M. Šlamborová 2; V. Blecher 1; P. Hromádka 1; R. Gürlich 3
Vyšlo v časopise: Rozhl. Chir., 2019, roč. 98, č. 3, s. 85-99.
Kategorie: Souhrnné sdělení
Souhrn
Plastika kýly je jedním z celosvětově nejčastěji prováděných chirurgických výkonů. Posílení tkáně chirurgickou síťkou vyžaduje implantaci mnohem více než 1 milionu sítěk ročně celosvětově. Konstrukce (design) implantátu zůstává zásadním prvkem v prevenci recidivy kýly. V současnosti dostupné implantáty vykazují různě široké spektrum specifických vlastností. Tento přehledný článek shrnuje specifika, výhody, omezení, komplikace a funkční vlastnosti běžně dostupných protéz. Stále ještě neexistuje ideální síťka pro všechny operace.
Klíčová slova:
kýla – síťka – plastika – biokompatibilita
Úvod
Použití implantátu – síťky – se stalo již standardním postupem při operaci kýl. Proporčně stárnoucí populace s oslabenou pojivovou tkání a nárůst morbidně obézních pacientů vyžaduje stále větší nároky na podporu tkání. Klinická zkušenost prokázala mnohem menší riziko recidivy kýly při užití implantátu. To bývá přičítáno zejména tzv. tension free efektu, tedy plastice bez napětí. Možnost a vhodnost indikace použití síťky je ale mnohem širší. Implantát je možné použít všude, kde poskytuje dočasnou nebo trvalou podporu fascie v místě, kde je z nějakého důvodu oslabena nebo zcela chybí. Síťku lze použít též jako substituci při rekonstrukci hrudní stěny, bránice, perikardu, při operacích v malé pánvi při funkčních obtížích s močením či defekací, k ošetření poranění parenchymatózních orgánů, jako dočasný uzávěr laparostomatu, k řešení svalové kýly po odeznění kompartment syndromu končetiny aj. V některých případech se jeví užití implantátu téměř nezastupitelné, jindy má chirurg možnost volby. Přes nesporné výhody má užití implantátu i svá rizika a omezení [1].
V herniologii je jednoznačně menší riziko recidivy při použití implantátu částečně vykoupeno rizikem specifických komplikací:
- infekce protetického materiálu
- serom
- srůsty
- migrace implantátu
- chronická bolest
I v současnosti dochází u 10 % nekomplikovaných laparotomií k rozvoji kýly v jizvě [2].
Protetické materiály byly vyvinuty, aby jako záplata posílily plastiku kýly a zabránily recidivě. Ideální materiál by se měl charakterem přiblížit břišní stěně. V současné době jsou na trh uváděny stále nové a nové typy protéz a spektrum výběru se stále rozšiřuje. V tuto dobu je na trhu přes 260 (!) různých typů implantátů. Oproti tomu jen málo modelů zastarává a je z trhu stahováno [3].
Před zavedením umělých materiálů se používaly kovové síťky (stříbrná síťka 1990, tantalový drát 1948, nerezová ocel 1950), které měly řadu nevýhod. Únava materiálu, migrace kovového materiálu, zlomeniny, až celkový rozpad a silný pocit cizího tělesa jsou jen některé z mnoha. Mezi první umělé materiály patřil nylon (polyamid), jenž v důsledku degradace brzy ztrácel své vlastnosti [4]. V zemích třetího světa se používají implantáty z vysterilizované rozstříhané moskytiéry nylonové nebo polyetylenové doposud.
Biomaterial Consensus Conference 1983 definovala implantát jako substanci nebo kombinace substancí, kromě syntetických a přírodních drog, která může být použita sama nebo v kombinaci různě dlouhou dobu léčby k posílení nebo náhradě funkce organismu [5].
Vlastnosti implantátů
Požadavky na ideální implantát k hernioplastice:
Nepodkročitelné:
Chemicky inertní
Nekancerogenní
Nealergenní
Kýžené:
Pevný
Biologicky inertní
S omezenou reakcí organismu na cizí těleso
Tvarově a velikostí upravitelný
Sterilizovatelný bez změny vlastností
Levně vyrobitelný
Specifické vlastnosti:
Odolný vůči infekci
Chovající se jako okolní tkáň (izodynamický)
Nesmáčivý (požadováno, pokud je síťka v kontaktu se střevem
Ani takový ideální implantát (a zatím nebyl takový vyroben) by patrně nebyl zcela bez rizik následných specifických komplikací. I přes nesporně lepší výsledky plastik s použitím sítěk tak zůstává chirurgická bias proti jejich použití [6]. Tato bias bývá často přeceňována pro neznalost a nepochopení použitelných materiálů a špatné zkušenosti při jejich nevhodném použití.
Historicky bylo již několik úspěšných pokusů rozdělit síťky podle strukturálních vlastností, které byly poplatné své době. Například Amid v roce 1997 v první edici časopisu Hernia volil jako kritérium porozitu implantátu [7]. Se zvětšující se porozitou byla snaha dělit síťky dle specifické váhy, například Coda v roce 2011 [8]. Dělení podle jednoho kritéria se ale postupem doby ukazuje jako insuficientní. Specifická váha (denzita) například nerozliší, zda se jedná o strukturu filmu, flísu nebo síťoviny, což je pro biokompatibilitu mnohem zásadnější [9]. Též u částečně vstřebatelných sítěk by se pak měla udávat jen denzita nevstřebatelné komponenty. S nejnovějším uznávaným komplexním dělením přišel Klinge v roce 2012 a rozlišuje implantáty do 6 tříd [10]. V tomto článku dále vycházíme ze zjednodušeného a podobného dělení na síťky 1.−3. generace a síťky speciální. Sami producenti nabízejí své portfolio většinou zjednodušeně dělením na implantáty podle anatomického použití a preferenčních indikací. Naopak data o strukturálních vlastnostech udávají výrobci nejednotně a často jen kusé [8].
Strukturální vlastnosti
Monofilamentní, multifilamentní, fólie
Pokud je syntetická síťka vyrobena z vláken, rozlišujeme dle textilní technologie implantáty na tkané a pletené (Obr. 1). Tkaná textilie se skládá z paralelních vláken (osnova) a kolmo na ně procházejících vláken (útek). Taková síťka je principiálně tzv. těžká (viz Váha) s malými póry s vlákny natěsno, aby se nepovolovala, a izotropní, tedy stejně pevná v obou základních směrech. Pletené síťky jsou tvořeny jedním či více vlákny navzájem proplétanými ve smyčkách a jejich vzorec je často velmi komplexní a liší se i mezi produkty jednoho výrobce. Jsou ohebnější, lehčí a více tažné. Technicky lze způsob pletení rozlišit na osnovní a útkové. První užívané síťky byly tkané, v současné době je od nich maximální odklon. Jeden a ne jediný důvod je jejich třepení na okrajích při sestřižení. Podobné problémy vykazuje útkový úplet, proto se též prakticky nepoužívá. Nejčastěji používanými systémy strojového pletení jsou Raschel a Tricot [11,12].
Obr. 1. Tkaná a pletená síťka
Fig. 1: Woven and knitted mesh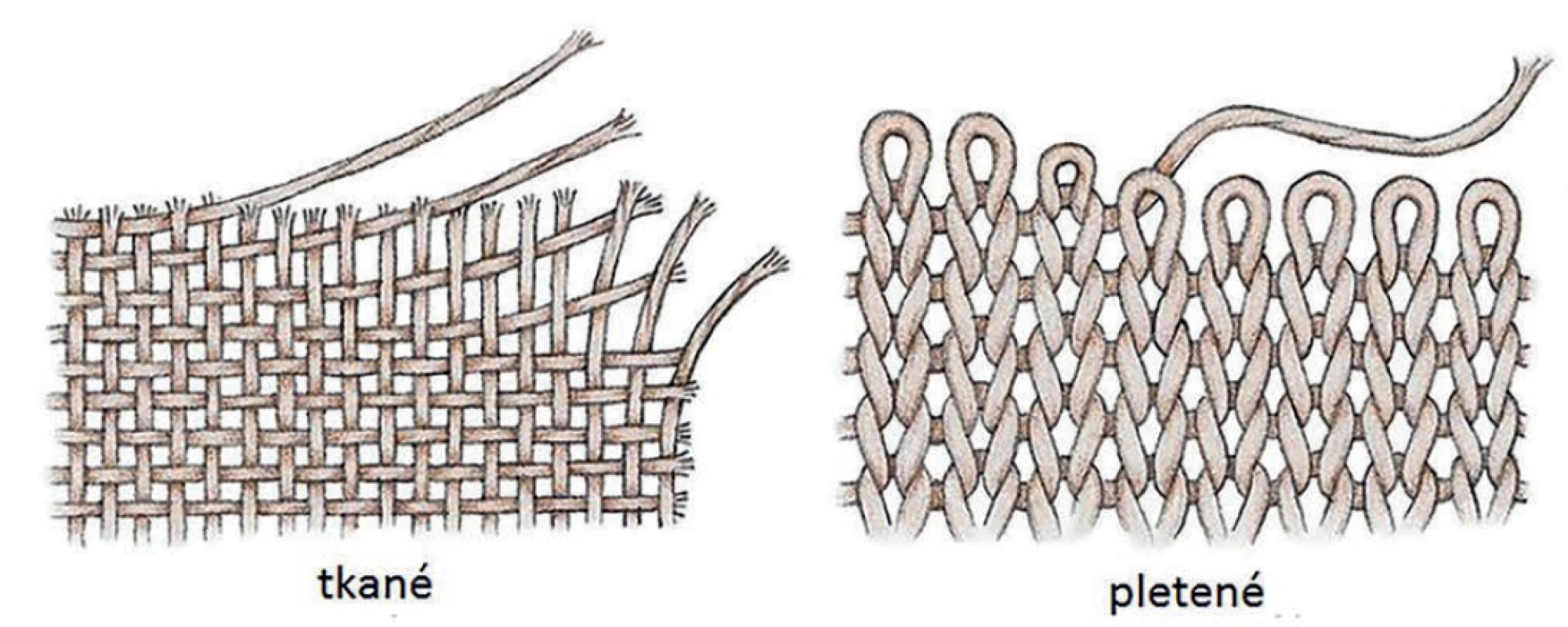
Struktura samotného vlákna může být jednoduše momofilamentní nebo složená z více vláken (svazek, jádro s opletem nebo pletené). Síťky z multifilamentních vláken jsou měkčí a poddajnější, ale mají i své nevýhody. Praxe ukázala výhodnější vlastnosti monofilamentních implantátů, jelikož v organismu způsobují menší reakci proti cizímu tělesu a jsou odolnější vůči infekci. Toto se připisuje celkově menšímu souhrnnému povrchu materiálu a absenci imunitně špatně dosažitelným prostorům mezi jednotlivými filamenty svazku multifilamentního vlákna. Zde může docházet k tzv. ukrytí mikroorganismů před efektem imunitního systému a k perzistenci infekce nebo k jejímu propuknutí s odstupem i mnoha měsíců či let po operaci (Obr. 2) [13,14].
Obr. 2. Monofilamentní a multifilamentní vlákno
Fig. 2: Monofilament and multifilament fibre
Specifickým typem implantátů jsou různě perforované fólie.
Velikost pórů
Velikost pórů (porozita) ovlivňuje vyvolanou reakci tkání v místech implantace.
Makroporézní je materiál s póry většími než 75 µm (arbitrárně stanoveno).
Mikroporézní (například ePTFE) materiál má velikost pórů pod 10 µm.
Dostatečná velikost pórů umožní penetraci makrofágů, vrůstání fibroblastů, ukládání kolagenu a neovaskularizaci uvnitř póru. Implantáty s většími póry vytvářejí menší reakci okolní tkáně. Ideálně pak nedochází k nevhodnému přerůstání granulomatózní tkáně napříč póry (Obr. 3). Každé vlákno vytváří ve svém okolí izolovanou reakci. Přemostěním pórů (zpravidla menších než 80 µm) granulomatózní tkání dochází k jakémusi opouzdření implantátu a k nechtěnému zvýšení jeho rigidity. Rigidita je mimo jiné jeden z hlavních důvodů kontraindikace použití nevstřebatelných implantátů u dětí (před dokončením růstu) a v některých případech u fertilních žen, které ještě nevylučují další těhotenství.
Obr. 3. Prorůstání a enkapsulace
Fig. 3: Tissue ingrowth contra encapsulation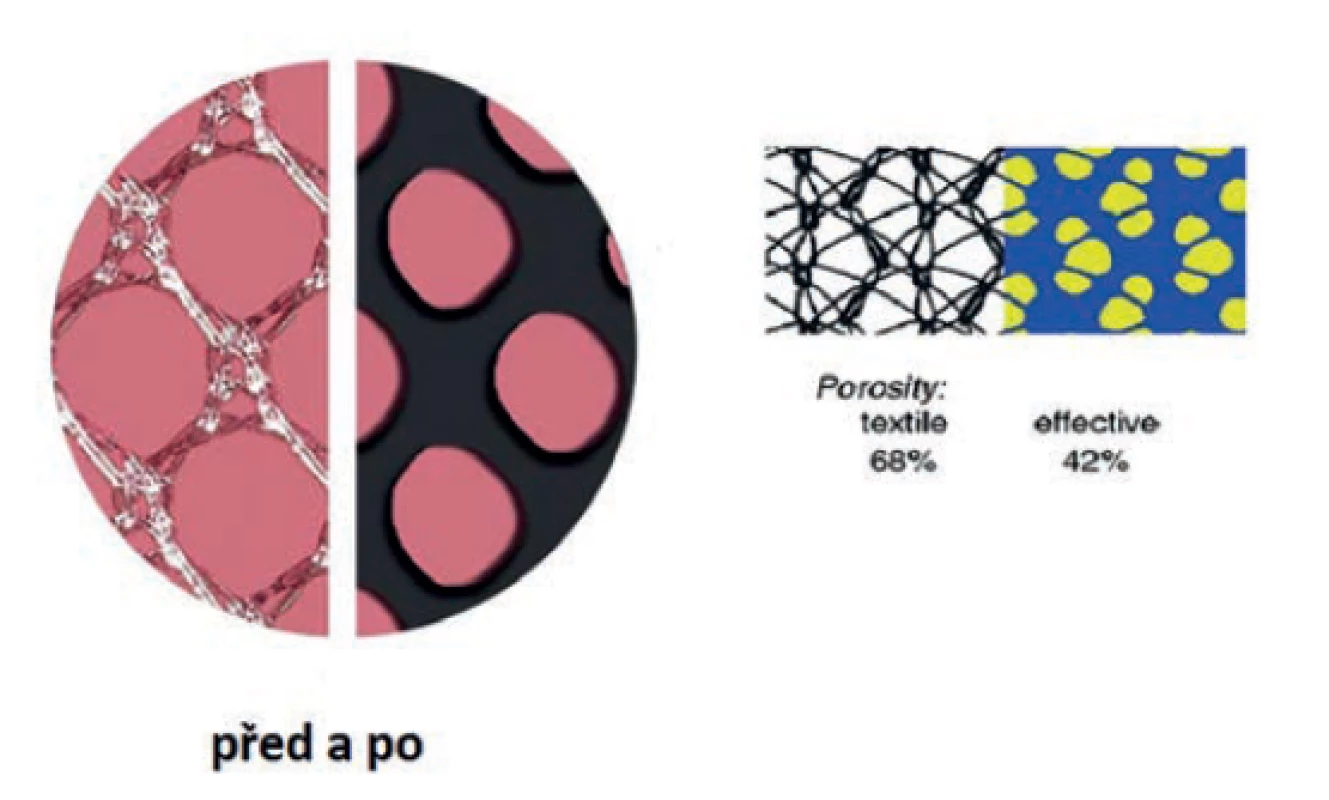
Sama porozita materiálu je nazývána textilní porozitou. Reziduální porozita po vzniku granulomatózní tkáně kolem materiálu v organismu se nazývá porozitou efektivní. U materiálů s textilní porozitou pod 60 % je efektivní porozita prakticky vždy nula [4].
Mikroporézní implantát je rizikový při infekci, kdy při velikosti pórů pod 10 µm jsou makrofágy (21 micronů) a neutrofily příliš velké, aby materiálem prostoupily a bakterie eliminovaly. Fibroblast má velikost 30 micronů. Mikroporézní implantáty jsou vhodné u kýl prakticky jen pro plastiku typu IPOM (intraperitoneal onlay mesh) a dále jako náhrady anatomických struktur jako bránice, perikard ad., kde je jejich vlastnost omezené tvorby srůstů kýžená. Síťky makroporézní lépe prorůstají okolní tkání, integrují se do organismu a jsou tak u kýl všeobecně vhodným materiálem pro umístění implantátu mezi jednotlivé vrstvy břišní stěny [15].
Váha (denzita)
Tento parametr závisí přeneseně na typu polymeru, tloušťce vlákna úpletu, velikosti ok úpletu, velikosti pórů a dalším. Specifickou váhu lze zjednodušeně definovat jako množství materiálu spotřebovaného při výrobě na m2. Tento parametr bývá předmětem zájmu u polypropylenových implantátů. Tzv. těžké síťky mají historicky >90 g/m2 materiálu [16].
Lehké nebo jinak též nazývané odlehčené síťky vyvolávají menší zánětlivou odpověď, menší tvorbu granulomatózní tkáně, a celkově tak vedou k větší elasticitě definitivní jizvy. Pro přemostění velkých defektů, bez podpory další vazivové tkáně, mají ale tyto síťky do doby vytvoření definitivní jizvy nedostatečné mechanické vlastnosti. Nevhodné se tak jeví pro přemostění větších defektů a při jejich použití je o to více nutné přechodné odlehčování břišní stěny kýlním pásem. I při optimální fixaci síťky dochází v místě přemostění k jejímu vyklenování, tzv. buldgingu.
Koncept odlehčených sítěk se datuje k roku 1998 a komerčnímu rozšíření síťky Vypro® od firmy Ethicon. Použitý materiál byl redukován o 30 % v porovnání z do té doby standardními implantáty zejména tím, že se zvětšily póry na 3 až 5 mm proti dříve klasickým <1 mm.
Později bylo tohoto konceptu dosaženo též rozvojem částečně vstřebatelných sítěk. Polypropylenová vlákna byla potažena rozpustnými polymery (např. polyglactine 910 /Vypro II®-Ethicon/ či polyglycapone /Ultrapro®-Ethicon/). Polyglactine se vstřebá za 6 týdnů, polyglycapone za 12−20 týdnů.
Nové typy sítěk s velkými póry, ale velkou relativní váhou (tedy dle kritérií tzv. těžké síťky) vykazují tak dobrou biokompatibilitu, že se v současnosti považuje sama relativní váha za irelevantní ve srovnání s porozitou [17].
Reometrie
Reometrie implantátu neboli jeho mechanické vlastnosti jsou definovány jeho pevností, tuhostí, elasticitou a poddajností (compliance) [16,18]. Pevnost v tahu je definována jako maximum síly, které musí materiál odolat na jednotku plochy, než dojde k jeho narušení nebo roztržení. Měří se v pascalech nebo N/cm2. Implantát musí samozřejmě odolat maximálním fyziologickým silám, které v břišní stěně vznikají. Normální intraabdominální tlak je 1,8 mmHg vleže a 170 mmHg například při doskoku. Laboratorní data ukazují, že protetický materiál by měl odolat minimálně síle 16 N/cm v jakémkoli směru a nejlépe 32 N/cm v nejvíce namáhaném směru. Většina komerčních implantátů tyto požadované limity násobně přesahuje. Rozdílná tuhost vede k rozdílům ve tvarové paměti implantátu. Elasticita je definována jako tendence materiálu vrátit se po zdeformování do původního tvaru a měřitelná elastickými moduly. Přirozená elasticita břišní stěny je přibližně až 38 % při 32 N/cm. U mužů bývá přirozeně o něco menší než u žen. Implantát, jehož elasticita je větší než 30 % při 32 N/cm, není vhodný k plastice. Na druhé straně, příliš málo elastický implantát může omezovat distenzi břišní stěny a působit bolest a vést k selhání plastiky (například vytržením kotvicího stehu). Nejmenší elasticita by měla být mezi 4−15 % při 16 N/cm. Compliance lze definovat jako míru přetrvávající deformace po ukončení působení jednotky síly. Absolutně elastický materiál se po natažení stáhne na původní velikost. Naopak absolutně poddajný materiál zůstane po natažení bez jakékoli tendence k návratu do původního stavu. Významnější compliance je proto nevhodnou vlastností implantátu. Malá compliance a vyšší tuhost materiálu vede v praxi častěji k pocitu cizího tělesa.
Pevnost je standardně testována uniaxilně tahem, biaxiálně kolmými tahy, protruzí (tlačení kuličky skrz upnutou síťku) a trhem [19].
Anizotropie
S reometrickými vlastnostmi implantátů (sítěk) souvisí ve většině případů anizotropie materiálu. Anizotropií materiálu se rozumějí rozdílné mechanické vlastnosti při působení sil různými směry (včetně prokázaných rozdílných hodnot u trhacích zkoušek). Téměř všechny umělé implantáty vykazují díky své struktuře různý stupeň anizotropie [20]. Velmi výrazně se toto projevuje u pleteného materiálu, na rozdíl od tkaného materiálu. Pletený materiál bývá například v jedné ose výrazně poddajnější než v ose na ní kolmé. Tuto vlastnost a její orientaci by měl výrobce na implantátu vyznačit, aby mohl chirurg optimalizovat jeho definitivní uložení. Toto se děje bohužel zcela výjimečně. Naštěstí lze výraznější rozdíly vypozorovat jednoduchým průzkumem a otestováním ručním tahovým testem těsně před implantací. Tento test by měl být nedílnou součástí operace. Z biomechanických vlastností břišní stěny vyplývá, že je výhodnější orientovat implantát nejpoddajnější osou svisle při rekonstrukci střední čáry [21]. Jinak se to ale jeví u rekonstrukce kýly v jizvě po pararektálním řezu nebo při okluzi stomie u velké parastomální kýly. Zde je naopak výhodné, pokud se anizotropie ve dvou hlavních osách maximálně eliminuje orientací a fixací síťky nakoso [9].
Biokompatibilita
Jelikož neexistuje biologicky inertní materiál, který by mohl být jen mechanickou podporou tkání bez buněčné interakce, hovoříme o různém stupni biokompatibility. Každý materiál, který je do organismu implantován, je vystaven zánětlivé reakci a buňkám imunitního systému, přičemž míra těchto reakcí jako jeden z faktorů predisponuje úspěch plastiky. Biokompatibilita je jeden z limitujících faktorů použití implantátu pro medicínské účely. Hovoříme kvantitativně o reakci proti cizímu tělesu. Ideálně slouží implantát jako lešení pro příslušené kolonizující buňky a stává se permanentní mechanickou podporou poškozené nebo oslabené tkáně. Povrch biomateriálu je hned po implantaci obalen proteiny krve a intersticiální tekutinou, které obsahují imunomodulační látky jako imunoglobuliny a komplement (C3, fibrinogen, factor XII). Proteiny nespecificky adherující k implantátu následně ztrácejí svou terciální strukturu a jsou exponovány imunitní reakcí. V řádu hodin je materiál rozpoznán neutrofily, které začínají vytvářet látky zvané mediátory zánětu. V řádu dní jsou pak neutrofily doprovázeny makrofágy. V dlouhodobém sledu je pak implantát vystaven lymfocytům. Zánětlivá odpověď vede v konečném důsledku k akceptování implantátu nebo k jeho destrukci. Čím menší zánětlivá odpověď, tím lépe. Kvantifikovat stupeň takové reakce lze jen nepřímo měřením počtu makrofágů a granulocytů, rozsahu granulomu, vaskularizace, množstvím deponovaného kolagenu a klinicky pak migrací implantátu a dalších komplikací. Excesivní aktivaci fibroblastů nebo proliferace vede k opouzdření, tvorbě fibrózní tkáně obalující materiál, která brání integraci, kolonizaci a vaskularizaci, a vede tak v organismu k izolaci materiálu.
Zjednodušeně tak vyvolá implantát jednu ze tří různých reakcí organismu a může být buď integrován, opouzdřen, nebo degradován.
Úspěch biomateriálu je ale dán nejen jeho biokompatibilitou, ale i způsobem jeho implantace. Udržením maximální vitality okolních tkání, sterility, anatomického umístění, přesahu do pevných tkání, způsobem a materiálem fixace a dalším.
Omezená reakce na cizí těleso
Při použití cizího materiálu k plastice dochází v organismu k zánětlivé reakci (která není způsobena infekcí) a která je přechodná. Sama po menší či delší době odezní. Oproti plastice bez implantátu přetrvávají v krvi delší dobu vyšší hodnoty CRP, fibrinogenu, α1-antitrypsinu a interleukinu-6.
Pokud není materiál stabilní, eroduje, degraduje nebo se remodeluje, stává se jeho vnitřní struktura exponovaná pro imunitní buňky a substance a tvoří se další nechtěné vlny zánětlivé odpovědi.
Degradace
Degradace implantátu je definována jako jeho vymizení nebo postupný úbytek hmoty. Degradace může být očekávaná či dokonce kýžená, nebo je naopak nechtěná. U vstřebatelných implantátů je cílem jejich setrvání v organismu do doby, než se vytvoří jizva nebo regenerační tkáň, která implantát nahradí a vyzraje do maxima své pevnosti. Předpokládá se nabytí 80 % původní pevnosti břišní stěny do 6 měsíců a další pozvolné zrání i dále. Bezpečnější interval degradace se tak jeví 12 měsíců. Vstřebatelné síťky jsou zcela nevhodné k přemostění defektů (tzv. bridging), jelikož recidiva kýly pak nastává prakticky ve 100 %. Vzhledem k nemalé ceně biologických implantátů se pak o těchto pejorativně hovoří jako o nejdražším kýlním vaku. Dalším důležitým momentem k pochopení interakcí je otázka, co nahradí implantát po jeho kompletní degradaci: zda jizva, nebo regenerovaná tkáň. Například cross-linked prasečí implantáty jsou více antigenní, a proto jsou nahrazeny jizvou, zatímco non-cross-linked implantáty jako méně antigenní jsou nahrazeny reparační tkání [22].
Bohužel také u nevstřebatelných materiálů dochází k určité pozvolné degradaci. Polyesterové síťky jsou známy nevýhodou částečné degradace v dlouhodobém horizontu. I poměrně hodně odolné polypropylenové síťky mohou při nevhodném nakládání (např. vysoké teploty při opakované sterilizaci, lámání, ohýbání) vést k narušení jejich struktury a snížené odolnosti vůči degradačním procesům.
Tvarově a velikostí upravitelný
Kromě specifických implantátů (např. typu 3D MAX®-Bard, ONFLEX®-Bard a dalších), kde je okraj implantátu nedílnou součástí produktu se specifickou funkcí a kde jsou anatomické indikace implantace poměrně úzké, by měla být struktura materiálu (metráže) designována tak, aby při zastřižení, zmenšení, tvarové úpravě nedocházelo k třepení okrajů implantátu, jeho trhání nebo prořezávání fixačních stehů.
Sterilizovatelný
Všechny výše uvedené vlastnosti si musí ideální implantát udržet i po sterilizaci, a to i opakované a různými technikami.
Svrašťování
Téměř všechny implantáty mají tendenci se při vhojení do těla smršťovat. Tato nechtěná vlastnost byla prokázána jak testy in-vivo, tak klinickým pozorováním (revizní operace) [15,23]. Největší svraštění vykazuje ePTFE. Dostatečný přesah tzv. overlap materiálu přes hranu defektu (například 4−5 cm u ventrální kýly) je tak nezbytný k dlouhodobému úspěchu a trvalému efektu operace. Tento imperativ vzrůstá zejména u nefixovaných plastik (např. TAPP, TEP) a u laparoskopických hernioplastik ventrálních kýl. Těžké PP síťky se svrašťují vesměs více než lehké PP a redukují tak více compliance a elasticitu břišní stěny se všemi důsledky. Tendence ke svrašťování je dána spíše velikostí ok než samotnou specifickou váhou materiálu. U PP bývá běžné až 30% svrašťování, v některých případech pozorováno až 50%. Fixace tackery nebo tkáňovým lepidlem umožní větší svraštění než fixace transfasciálními stehy.
Materiál implantátů
Umělé materiály se principiálně dělí na nevstřebatelné a vstřebatelné. Biologické materiály existují jen ve vstřebatelné formě.
Umělé implantáty
Dělení technologické: /převzato od Bellona [15]/
síťované (pletené, tkané)
nevstřebatelné – polypropylen, polyester, PVDF
částečně vstřebatelné – polypropylen/polyglactin 910, polypropylen/polyglecaprone
vstřebatelné – polyglactin 910m, polylactic
laminární (lisované, odlitkové, fólie)
nevstřebatelné – ePTFE (DualMesh®-Gore), PP zalitý silikonem (Surgimesh XB®-Aspide Medical), polyuretan (Mycromesh®-Gore)
vstřebatelné – jen biologické síťky (střevní submukóza, perikard, dermální matrix…)
kompozitní
nevstřebatelné – polypropylen/ePTFE, polypropylen/polyuretan
vstřebatelná komponenta – polypropylen/polyetylen glycerol, polyester/polyetylen glycerol, polypropylen/hyaluronová kyselina,
polypropylen/polydiaxon/celulóza
Počet publikovaných studií založených na konkrétním materiálu je dlouhodobě zhruba 70 : 5:1 (PP:PE:ePTFE). Zkušenosti a sběr dat tak zahrnují u těchto tří nejpoužívanějších materiálů již více než 50leté období [24]. Usher popsal užití PP 1959 [25,26], Calne použití PE v roce 1967 a Capello PTFE 1968.
Polypropylen (PP)
PP je daleko nejčastěji užívaný materiál k výrobě implantátů. Mimo medicínu se používá například k výrobě kelímku na jogurty, víček na plastové láhve, brček ad. Materiál byl představen jako implantační materiál k plastice kýly v roce 1958 Usherem. Jako cévní protéza byl užit ještě dříve v roce 1954. Jedná se termoplastický polymer skládající se s etylenu a připojených metylových skupin (Obr. 4). Za jeho objev dostali Natta a Ziegler Nobelovu cenu za chemii. Polymerace probíhá systémem head-to-tail. Je hydrofobní, elektrostaticky neutrální, prakticky rezistentní biologické degradaci, lehce elastický. Biologické vlastnosti implantátu se odvíjejí od hmotnosti, tloušťky vlákna, velikosti pórů, architektoniky a odpovědi příjmového organismu [27].
Obr. 4. Chemické vzorce
Fig. 4: Structural formulas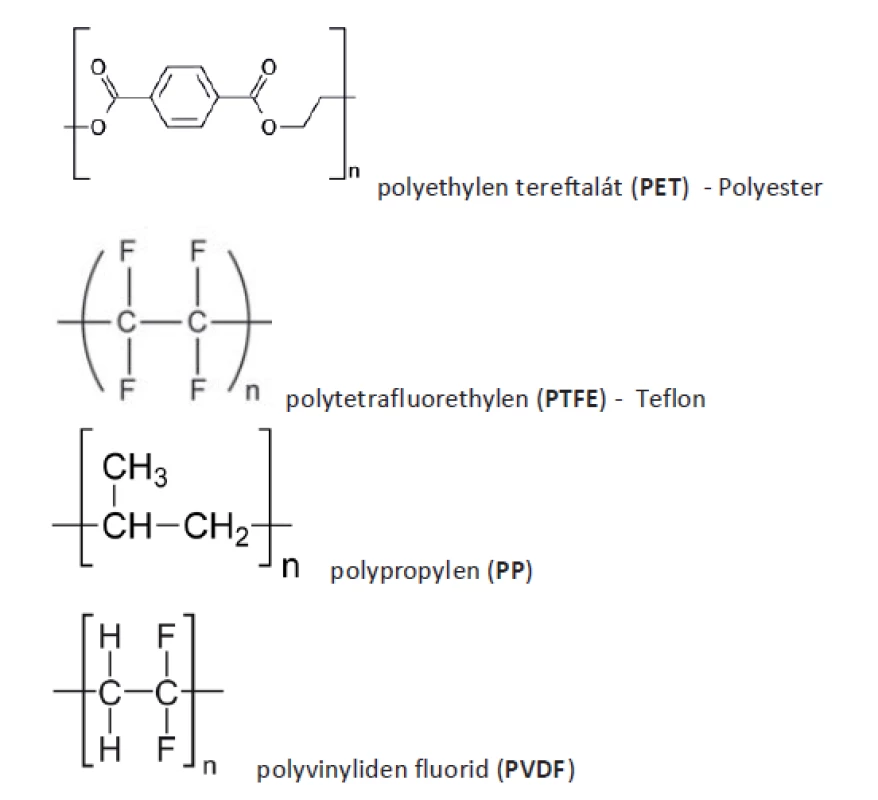
Klasičtí zástupci: Prolene®-Ethicon, Marlex®-Bard, Softmesh®-Bard, Vypro®-Ethicon, Premilene®-BBraun, Optilene®-BBraun, Parietene®-Covidien, Prolite®-Atrium.
Takzvané těžké síťky PP jsou sice velmi pevné, ale v porovnání s elasticitou břišní stěny a živé tkáně jsou velmi tuhé. Proto byla snaha vyvinout odlehčené síťky (méně materiálu na normovanou plochu) při adekvátní pevnosti a menší tuhosti. Předpokládá se a některými studiemi byla potvrzena menší reakce na cizí těleso, menší pooperační bolestivost a absence pocitu cizího tělesa v břišní stěně. Toto bylo sice prokázáno v některých studiích, výsledky nejsou ale zcela jednoznačné [15,16,17].
PP síťky mají neoddiskutovatelnou vlastnost se při implantaci časem svrašťovat/kontrahovat.
Extrudovaný materiál je ve tvaru vlákna nebo svazku vláken, která pak pletením nebo tkaním vytvářejí síť. Celkový design pak určí sílu a tažnost síťky. Makroporézní (více než 1 mm) lépe prorůstá a tvoří menší granulomatózní formaci.
Těžké síťky 80 g/m2 odolají síle v tahu 90 N/cm.
Zdravá fascie 12−16 N/cm (při maximu intraabdominálního tlaku 20 kPa).
Lehké síťky 30 g/m2 odolají síle 30−40 N/cm.
Z tohoto pohledu jsou tedy prakticky všechny PP implantáty značně naddimenzované. Při augmentaci (posílení) břišní stěny síťkou – tedy při možnosti beznapěťového uzavření fascie – může být požadavek na pevnost síťky redukován až na 16 N/cm (například prevence kýly v jizvě u operace břišního aneuryzmatu).
Odlehčené síťky tvoří menší granulom a jizevnatou tkáň v jizvě. Udrží břišní tlak s menším množstvím materiálu na čtverec plochy. Existuje více klasifikací dle váhy.
Klasifikace dle váhy /Coda [28]/
ultralehké pod 35 g/m2
lehké 35−70 g/m2
standard 70−140 g/m2
těžké nad 140 g/m2
Odlehčené síťky mají většinou makroskopický vzor sítě ok ve tvaru čtverců, kosočtverců, hexagonů a dalších.
Polyester (PET)
Polyester nebo též polyetylen tereftalát (PET) má široké nemedicínské využití na výrobu látek, umělých láhví ad. Komerční názvy například Dacron® a Mersilene®. Byla provedena řada studií, které srovnávaly výsledky při použití PP a PET při plastice kýly. V současné době neexistuje jasný důkaz o tom, který z materiálů je jednoznačně výhodnější [15,16,17]. Polyester byl představen Calnem v roce 1967. Tento materiál je na rozdíl od PP hydrofilní.
Chirurgové u tohoto materiálu doceňují především jeho poddajnost a „lepkavost“. „Lepkavost“ či spíše přilnavost je způsobena především jeho hydrofilním charakterem, tudíž má tendenci se za suchého stavu přichytávat k mokrému povrchu, což může být při umísťování během operace nápomocné (zejména laparoskopie). Poddajnost tento materiál favorizuje například při laparoskopické operaci tříselné kýly, jelikož ideálně kopíruje a obaluje důležité anatomické struktury, aniž by mechanicky vzdoroval. Nevyvolává u pacienta pocit cizího tělesa a lépe se inkorporuje do tkání [19].
Komerčně je dostupných výrazně méně zástupců než u PP: Mersilene (Ethicon), Parietex (Covidien), CHS 100 (VUP Medical, ČR). PET síťky se vyrábějí jen multifilamentní.
Polyester podléhá větší hydrolytické degradaci (chemické i mechanické), což teoreticky nevadí u letitého pacienta, ale nutno brát v potaz u mladšího pacienta s očekávanou dlouhou dobou dožití. Prakticky se toto ale u moderních sítěk (zejména 3D technologie pletení) jeví spíše jako nepodstatné. Poznámka: nezaměňovat 3D technologii pletení (PET) a 3D tvarově preformované síťky (typicky PP a PVDF).
Polyvinylidenfluorid (PVDF)
Tomuto materiálu se věnuje preferenčně firma FEG Techtiltechnik (Německo) s komerčním názvem DynaMesh®. Byla prokázána menší reakce proti cizímu tělesu než u PP. Vlákno je jemnější a hladší, a tudíž méně afinní k osídlení mikroorganismy. Materiál je výrazně odolnější proti stárnutí. Minimálně ztrácí v čase pevnost a minimálně tuhne. Je nejmladší a na dlouhodobé výsledky se tedy ještě čeká.
Polytetrafluoretylen (PTFE)
PTFE – Známější pod komerčním názvem Teflon™ se prakticky nepoužívá pro plastiku kýly a rekonstrukce břišní stěny, jelikož je velmi hydrofobní. Jedná se spíše o membránu než o síťku. Expandovaný PTFE [ePTFE] (Gore-Tex® Soft Tissue Patch-Gore, Gore Dualmesh®-Gore, Composix®-Bard, Teflon® EI DuPont) se vyrábí roztažením PTFE za vzniku mikropórů. Až při takovéto mikroporézní úpravě prakticky prorůstá vazivovou tkání, ale zároveň zůstává opouzdřen jako cizí materiál. Byl původně vyvinut pro cévní protézy. Vytváří také často kolekce tekutiny ve svém okolí, tzv. seromy. Z tohoto důvodu se v současnosti používá jen při technice IPOM, kde se využívá jeho nesmáčivost k omezené tvorbě srůstů při přímém kontaktu s břišními orgány. Právě tento materiál znamenal revoluci v laparoskopickém řešení kýl.
Nověji byly vyvinuty i makroporézní formy – kondenzovaný PTFE [cPTFE] (Infinit®-Gore, MotifMESH®–ProxyBiomedical, Omyra®-B Braun), který je odolnější vůči infekci a má lepší biokompatibilitu. Pro všechny formy PTFE je typické, že je stejně pevný ve všech směrech. Je rizikový při infekci, kdy při velikosti pórů pod 10 µm jsou makrofágy a neutrofily příliš velké, aby materiálem prostoupily a bakterie eliminovaly.
Důležitý rozdíl oproti ostatním materiálům je i ten, že nelze přepálit elektrokauterem. Působením tepla se neškvaří ani nezapáchá. Při nutnosti laparotomie skrz implantát je tedy nutno použít „chladnou zbraň“ (skalpel, nůžky..). Lze jej jednoduše stříhat a tvarově upravovat.
Vstřebatelné syntetické síťky
Všeobecně indukují menší zánětlivou odpověď než vstřebatelné biologické implantáty. Pro rychlou degradaci sítěk z polyglycolové k./PGA (Dexon®-Covidien) – datováno již od r. 1986 – byla vyvinuta síťka z Polyglactinu 910 (Vicryl®-Ethicon). I tyto síťky selhávaly pro extrémně vysoký počet recidiv. Lepší výsledky jsou s trvanlivějšími materiály (Polylactic acid/PLA, PLA 94, poly(p-dioxanone/PDO, polyester uretane urea/PEUU). Poslední trendy u tohoto typu sítěk jsou kombinace rychle degradabilní polylactic-co-glycolic kyseliny polymerizované s polytrimetylen karbonátem/PTMC a pomalu degradovatelné PLA-PTMC, PGA-PTMC nebo poly 4-hydroxybutyrate/P4HB s výrazně lepšími experimentálními výsledky (Tab. 1). Phasix®Bard si při testech in vivo udrží 70 % pevnosti po dobu 12 týdnů.
Tab. 1. Přehled vstřebatelných syntetických implantátů
Tab. 1: Overview of absorbable synthetic implants
Zkratky: viz text V klinické praxi zatím stále platí, že syntetické vstřebatelné síťky jsou jen nouzovým řešením s prakticky jistým rozvojem kýly (například po uzávěru open abdomen) nebo její recidivy. Jejich uplatnění je tak možné v některých případech primárně infikovaného terénu. Vstřebatelné syntetické materiály bývají také součástí kompozitních implantátů (viz dále).
Kompozitní implantáty „síťky druhé generace“
Některé specifické komplikace tradičních implantátů bez další úpravy vedly k vývoji implantátů tzv. druhé generace, kdy kombinací materiálů došlo k vylepšení přidané hodnoty. Především velkou takovou skupinou jsou implantáty bránící více či méně vzniku adhezí vnitřních orgánů při umístění implantátu do břišní dutiny [29,30,31].
Na jedné straně tyto implantáty kombinují výhody jak smáčivých materiálů, které se dobře integrují/vhojují do organismu, kdy na straně přilehlé k břišní stěně umožňují prorůstání pojivové tkáně, na druhé straně exponují hydrofobní mikroporézní vrstvu, která je v kontaktu s vnitřními orgány a brání vzniku adhezí [32].
Kompozitní materiály mají některé složky vstřebatelné nebo jsou kompletně nevstřebatelné. Je nutné je správně orientovat a až na výjimky (např. Dualmesh®-Gore) je nelze tvarově upravovat střihem. Vrstva bránící adhezím má většinou při okrajích přesah na odvrácenou plochu.
Dalším typem jsou síťky částečně vstřebatelné, kdy vstřebatelná komponenta je vpletena jako vlákna do nosné struktury (např. polypropylen s polyglactinem 910 – Vypro II®-Ethicon), nebo se jedná o potažená nevstřebatelná vlákna (např. beta-glukanem potažený PP -Glucamesh®-Genzyme). Někteří autoři tyto síťky označují jako kombinované a pojem kompozitní používají jen pro síťky tvořící plošné vrstvy (další viz Tab. 2).
Tab. 2. Přehled kompozitních implantátů
Tab. 2: Overview of composed implants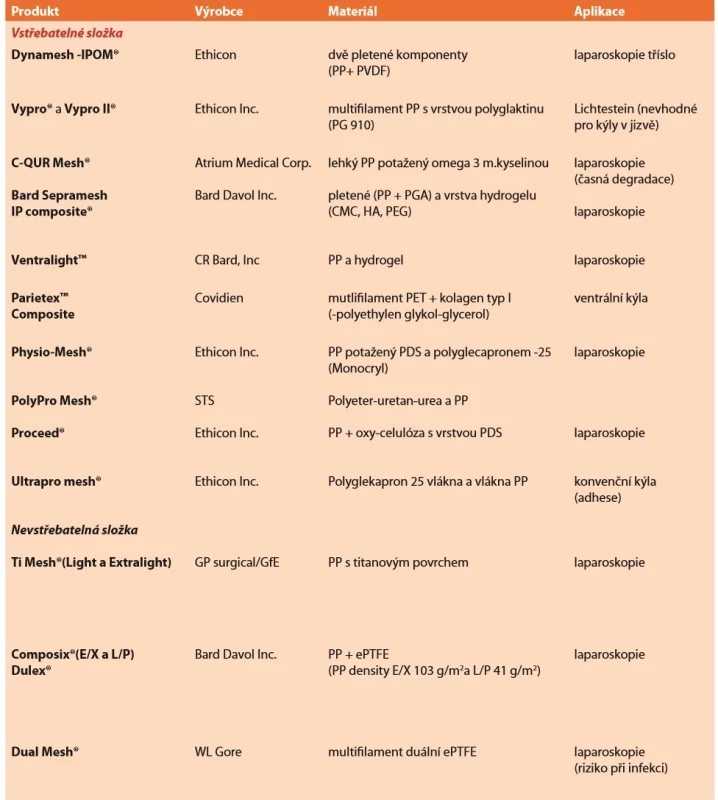
Zkratky: CMC – karboxy-metyl-celulóza, PGA – polyglykolová k., HA – hyaluronát sodný, PEG – polyetylen-glykol, PVDF – polyvinyleden-fluorid, PP –polypropylen, PET – polyetylen-tereftalát, PDS – polydi-oxanone Vstřebatelná komponenta kombinovaných implantátů se inkorporuje cca do 60 dní. Ale objektivně nebyla prokázána výhoda. Možná lepší zacházení pro jemnější charakter. Spíše přáním je menší zánětlivá odpověď (např. polypropylen s polyglecapronem 25, tzv. extralehká Ultrapro®-Ethicon).
V různé fázi výzkumu či uplatnění jsou síťky modifikované potažením materiálu s přidanou hodnotou (viz Tab. 3) [33].
Tab. 3. Materiály používané k potažení sítěk
Tab. 3: Materials of mesh coating
Zkratky: PLA – polylactic acid, PGA – polyglycolic acid, ORC – oxygenated regenerated celulose, SCMC – carboxymethylcellulose, NVP – N-vinyl pyrrolydone, BMA – N-butylmethacrylate, Omega-3 FA – fatty acids, RMSC – mesenchymal stem cells, HDF – human dermal, RKF – rat kidney fibroblasts, NCSP – nanocystalline silver particles V současnosti jsou vkládány velké naděje do nanotechnologie. Je prováděn výzkum ve smyslu samotné výroby sítěk z nanovláken (obvykle nedostatečná pevnost), tak technologie povrchové úpravy osvědčených materiálů. Velký specifický povrch pro přilnutí buněk, vyšší strukturální porozita, 3D mikroprostředí pro lepší interakci buňka-buňka a buňka-biomateriál a specifické fyzikální a mechanické vlastnosti. Využitelné jsou též jako nosiče léků a dalších aktivních látek.
Biologické implantáty „třetí generace sítěk“
Ideální biologická síťka nevyvolává imunitní reakci organismu, stimuluje tvorbu nového kolagenu, je odolná vůči infekci a není jí degradována a zachovává si dlouhodobou pevnost.
Biologické implantáty jsou chemicky stabilizovanou porózní acelulární extracelulární matrix (zejména kolagen) vyrobené z kadaverů. Prakticky užitečné jsou při nutnosti implantace do infekčního prostředí. Jejich nevýhodou je cena, která je cca 10−100x větší než u syntetických implantátů. Z tohoto důvodu nemají v české chirurgii dlouhodobější tradici. Xenotransplantáty (bovinní i porcinní) jsou cca o 20 % levnější než allotransplantáty (z humánní dermis). Smyslem biologického implantátu je vytvořit jakési lešení či kostru (platformu), která na jedné straně postupně degraduje, na druhé straně podporuje neovaskularizaci, potencuje osídlení fibroblasty a zároveň místně dodává svou degradací potřebný substrát (koktejl růstových faktorů, proteoglykánu, elastinu, hyaluronátu, fibronektinu ad.). Přechodně si zachovává jistě biomechanické vlastnosti podobné fascii [28]. Trojitá šroubovice molekul kolagenu je přirozeně stabilizována příčnou vazbou mezi vodíky (vodíkové můstky neboli tzv. cross-link). Tyto vazby brání enzymatické degradaci kolagenu kolagenázou. Cílené chemické procesy (HMDI, EDAC nebo genipin), které potencují míru těchto kovalentních vazeb (cross-linking) a brání tak navázání kolagenázám na receptorová místa, způsobují větší odolnost implantátu vůči degradačním procesům. Taková stabilizace implantátu vede na druhou stranu ke zhoršenému procesu vhojení. Biologický implantát bez této úpravy vydrží v organismu maximálně měsíce, stabilizovaný až roky.
Jelikož při racionálním pohledu jsou biologické implantáty jen dočasnou podporou břišní stěny a ve většině případů kýla při jejich použití s delším časovým odstupem recidivuje, má tak jistý smysl jejich užití pouze v některých komplikovaných případech [22]. Některými autory bývá vyzdvihována možnost jejich použití v infekčním prostředí [34], jiní autoři poukazují na velmi zrychlenou degradaci síťky v takovém prostředí [28]. V současnosti neexistuje jasná evidence based indikace pro použití biologických implantátů v těchto případech [34]. Každopádně v případě infekce takového materiálu není třeba jej explantovat, ale jen provádět debridement rány do zhojení. Vzhledem k jejich zastupitelnosti a specifické problematice postačí pro potřeby tohoto sdělení jen tabulkový informativní přehled těch světově nejrozšířenějších (Tab. 4).
Tab. 4. Přehled vstřebatelných biologických implantátů
Tab. 4: Overview of absorbable biological implants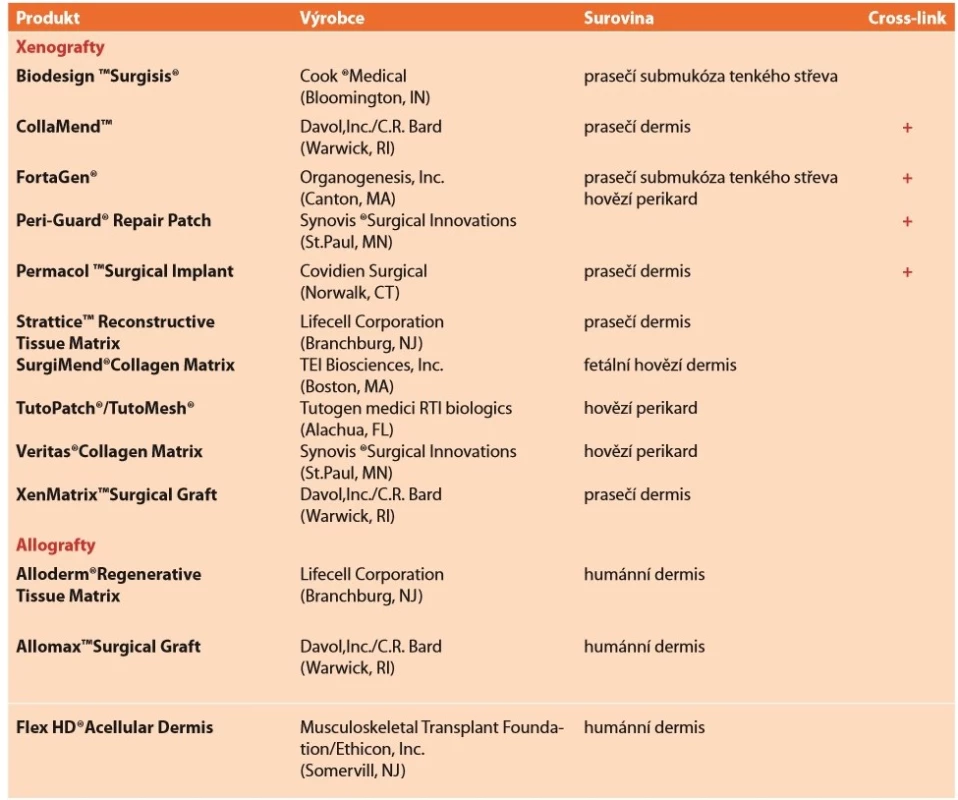
Na bázi experimentální probíhají nadějné pokusy s materiály extrahovaným z larev bource morušového (Bombyx mori), pavouků nebo hedvábí produkovaného transgenními organismy (bakterie, červy). Na rostlinném základě se testují lněné materiály, které jsou prakticky nevstřebatelným bioimplantátem.
O síťkách hybridních hovoříme, pokud je umělý materiál kombinován s biologickým materiálem (např. PP + porcinní střevní submukóza – Zenapro®-Cook Medical). Tento typ implantátů se zatím více neujal.
Speciální síťky
3D struktura („3D-scaffold“)
protiadhezivní povrch („antiadhesive“)
antibakteriální („antibacterial“)
nanovlákna („nanofibrous“)
MR kontrastní („MRI visible“)
potažení buňkami („cell-coated“)
titanizované („titanized“)
samofixační („self-gripping“)
s aplikátorem („positioning system“)
Do této skupiny patří sofistikovanější implantáty konstruované s přidanou hodnotou ve smyslu jednodušší aplikace, efektivnější fixace, lepší anatomické specifikace (např. 3D implantáty). Jejich indikace tak bývá většinou zúžena na určitou anatomickou lokalizaci. U tříselných kýl pak existuje u některých dokonce i stranové omezení. Pro didaktičnost uvádíme několik typických zástupců této skupiny.
Síťky s aplikátorem (Echo PS™ Bard Positioning System-Davol/Bard), který pomáhá umístění implantátu při operaci do optimální pozice a ulehčuje její následnou fixaci u ventrálních kýl řešených laparoskopicky. V konečné fázi se inflační (starší verze) nebo plastový (novější) aplikátor odstraňuje.
Samofixační síťky (ProGrip™-Covidien) – PP síťka s vstřebatelnými mikroháčky z PLA (obdoba suchého zipu), které při aplikaci a v nejbližších dnech po výkonu zabraňují posunu a dislokaci síťky. Umístění takové síťky vyžaduje od operatéra vyšší míru zručnosti zejména při laparoskopické variantě.
Samolepicí síťky (Adhesix®-Cousin Biotech) – další implantát s technologií atraumatické fixace je PP potažený PEG a polyvinylpyrrolidonem (PVP).
3D síťky (3DMax®-Bard nebo Endolap 3D®-FEG Techtiltechnik) – předtvarované síťky pro lepší umístění a samofixaci při laparoskopické plastice tříselné kýly.
Dříve Polysoft® Hernia Patch, nyní Onflex®-Bard jsou síťky pro svéráznou metodu preperitoneální otevřené operace tříselné kýly z miniincize a s minimální fixací ONSTEP. Síťka se sama fixuje samorozpínacím obvodovým předpruženým PET prstencem.
Podobně originální systémy Proflor® na tříselnou kýlu a Octomesh® na kýlu v jizvě nabízí Insightra Medical.
Kompozitní síťky na pupeční kýlu Ventralex®-Bard složené z polypropylenové síťky, ePTFE vrstvy a vstřebatelného samorozpínacího prstence.
Dále existuje též celá řada cíleně designovaných síťek pro parastomální a hiátové kýly.
Vývoj v oblasti speciálních sítěk je obzvláště pestrý a rychlý a každá větší firma přichází každý rok s několika novinkami. Zejména právě tato podkategorie speciálních sítěk je i cílem řady start-upů posledních let. Úplný výčet všech existujících speciálních implantátů by rozhodně přesahoval smysl tohoto sdělení.
Při výrobě již lze použít i 3D tisk k výrobě implantátu pacientovi „šitý“ anatomicky přímo na míru.
Hudbou blízké budoucnosti se zdá použití kmenových buněk pro kvalitnější inkorporaci biomateriálu včetně snížení zánětlivé odpovědi. Obdobná očekávání se pojí s implantáty obohacenými o růstové faktory [35].
Koncept síťky po implantaci viditelné na MR (např. Dynamesh visible®-FEG Techtiltechnik) má pomoci diagnostikovat komplikace v podobě svraštění, eroze, migrace a deformace implantátu.
Antibakteriální síťky mohou být impregnovány antibiotikem (zde riziko vzniku rezistence) nebo antiseptikem – triclosan, chlorhexidine; nebo enzymy – lysostaphin či dalšími látkami – furanone (tzv. léky uvolňující implantáty) [36].
Osvědčenou zbraní proti infekci jsou ionty kovů (v tomto kontextu stříbro, zlato, palladium) [37]. Výhodou je jejich efektivita proti G+ i G+ bakteriím, stabilita a velmi nízké riziko vzniku rezistence. Zkoumají se různé způsoby inkorporace do materiálu a optimalizuje jejich uvolňování (např. nanovlákna) [35,37]. V praxi lze použít Dualmesh Plus®-Gore, což je ePTFE protéza potažená ionty stříbra a chlorhexidinem.
Titanizované síťky (povrchová úprava vlákna) zvyšují takto svoji hydrofilitu a zmenšují bolestivost v ráně. Niklo-titanová (nitinol) kostice pomáhá samofixační funkci některých sítěk a jejich kontrastnímu zobrazení na verifikačním RTG vyšetření (Rebound HRD®-MMD).
Ekonomický aspekt
Ekonomická náročnost umělých implantátů stoupá všeobecně řádově v pořadí: PP (stokoruny) – PE/PVDF (tisíce) – PTFE (desetitisíce) ve svých základních variantách. Toto samozřejmě neplatí absolutně, jelikož není zohledněna dynamická marketingová politika jednotlivých firem a akční pobídky. Řádový nárůst ceny lze vypozorovat i s každou vyšší generací sítěk. Biologické implantáty běžně prolamují stotisícové hranice. Implantace takového implantátu bez zvláštní úhrady je tak v našich podmínkách zcela nereálná.
U speciálních sítěk si vývoj svého patentu či užitného vzoru nechají firmy oproti původní verzi téže síťky/materiálu refundovat také zhruba řádovým zdražením. Tato oblast je také typickým příkladem nevyužitých, pokřivených nebo scestných indikací za současné neexistence nadstandardní zdravotní péče v ČR.
Komplikace
Mezi komplikace související s implantátem patří infekce, bolest, adhese (srůsty), píštěle, migrace implantátu a v neposlední řadě recidiva kýly.
Recidiva
Nejčastější komplikací po operaci kýly je její recidiva! To platí i v případě implantace síťky. Příčina této komplikace je většinou multifaktoriální, či spíše je obtížné jedinou a konkrétní příčinu prokázat. Problém může být na straně šicího materiálu, volby implantátu, způsobu jeho fixace, v operační technice, nedostatečné compliance pacienta a spoustě dalšího. Zkoumání a eliminace této komplikace je hlavním motivem a motorem celého oboru herniologie. Například použití nevstřebatelných stehů sníží oproti vstřebatelným rekurenci z 25 na 10 %.
V případě implantátu se může jednat o časnou degradaci materiálu, jeho časné odstranění v případě infekce nebo selhání/uvolnění síťky, potažmo samotné plastiky. Při selhání síťky hovoříme buď o jejím centrálním selhání (roztržení síťky), nebo selhání v místě fixace. Centrální selhání je prakticky možné jen u tzv. lehkých sítěk, a to při narušení jejich struktury. Selhání implantátu v místě fixace je naopak všeobecně dominující příčinou a je bezpochyby dependentní na chirurgické technice. Při absenci shovívavosti tak lze hovořit o příčině iatrogenní. Tím se otvírá velmi široké a expertdependentní téma způsobu fixace implantátu, které je v herniologii vždy důležitější než volba samotného implantátu a jehož nedostatečná standardizace je příčinou špatné komparability jednotlivých klinických studií, a dokonce i výsledků operatérů na jednom pracovišti. Částečné odpovědi nabízí řada publikovaných studií, některé národní databáze či doporučení expertních komisí. Vzhledem k multifaktoriálním vstupům a laxnímu (nebo minimálně málo detailnímu) sběru dat bude ale i do budoucna přetrvávat řada velkých rozporů.
Infekce
Plastika kýly je obecně čistou operací s nízkým rizikem infekčních komplikací. Právě incidence této komplikace bývá pro dobrou reprodukovatelnost na řadě pracovišť zvolena jako indikátor kvality péče a hygienické survillance. Například incidence u otevřené plastiky tříselné kýly se udává 2−4 %, u kýly v jizvě pak 6−10 % a při laparoskopické plastice kýly v jizvě klesá incidence k 3 %. Výskyt infekce při použití implantátu je vyšší u těžkých, mikroporézních a multifilamentních než u lehkých, monofilamentních [38,39].
Prevalence infekce se prokazatelně zvyšuje s velikostí kýly, operačním časem, a tedy prakticky s expozicí rány. Samozřejmostí je fyziologické operování s minimálním vznikem tkáňových nekróz hmožděním, odstranění všech avitálních tkání a zamezení excesivního vzniku koagulačních nekróz. Chráněné koagulum (tedy profylaktické užití antibiotik) je při použití implantátu všeobecně doporučováno. V praxi je někteří u laparoskopických výkonů a nerizikových pacientů nepovažují za nezbytné (krátká expozice) [40].
Riziko infekce je též výrazně vyšší u plastiky uskřinuté kýly, ať už je nebo není součástí operace i resekce střeva. Sama infekce v ráně je jednou z typických příčin recidivy kýly pro alteraci remodelačních procesů jizevnaté tkáně nebo uvolnění fixace při fascitidě.
Riziko infekce se u pacientů zvyšuje v souvislosti s imunosupresí (užívání steroidů), obezitou, cukrovkou, chronickou obstrukční chorobou, renální insuficiencí, kouřením, abúzem alkoholu, s recidivou kýly – zejména při infekci v ráně při předchozím hojení. Na druhé straně je přesně tato skupina pacientů nejrizikovější k selhání plastiky a vzniku recidivy, pokud nedojde při plastice/rekonstrukci k použití implantátu. Klíčovým momentem prakticky všech těchto komorbidit je nedostatečná kapilární perfúze tkání (zejména podkoží pod Scarpovou fascií) a s tím související efektivní dosah imunitních reakcí.
Dříve se považovalo za nutné při rozvoji infekce síťky její chirurgické odstranění. V současnosti již toto není nutné a naprostou většinu implantátů se podaří zachránit, tedy do organismu úspěšně inkorporovat. Převrat v této problematice znamenalo především užití podtlakové terapie, tzv. NPWT (negative pressure wound therapy). Nutno podotknout, že záchrana implantátu s sebou nese značné finanční náklady (protrahovaná hospitalizace, antibiotika, převazový materiál atd.). Pacienta je však tato záchrana implantátu schopna ušetřit dalších operací nebo dokonce invalidizace například při rozvoji velkých břišních kýl. V současnosti se jeví jako jediný důvod k časnému odstranění implantátu těžká obtížně zvládnutelná sepse. Jinou problematikou je pak chronická infekce a s ní související fistulace – tvoření píštělí, kdy minimálně částečné odstranění síťky je nezbytným kauzálním řešením problému.
V literatuře bývá opakovaně uváděna absolutní nutnost odstranění protézy z PTFE v případě její infekce. Ačkoli se tento materiál jeví stran infekce jako nejproblematičtější, je publikována již řada případů, kdy se podařilo i takové implantáty zachránit. Ani zde tedy nelze imperativ k jeho odstranění stavět jako absolutní [41].
Mezi nejběžnější infekční agens při infekcích implantátu patří Staphylococcus spp. (zejména S. aureus – ten až ve 2/3 případů methicillin rezistentní), Streptococcus spp., gram-negativní bakterie (především Enterobacteriaceae) a anaerobní bakterie (např. Peptostreptococcus spp.). Zřídka lze prokázat i Candida spp. a Mycobacterium spp., navíc zcela výjimečně jako jediné agens působící infekci (Tab. 5) [42].
Tab. 5. Nejčastější patogeny působící infekce implantátů
Tab. 5: The most common pathogens of implant infections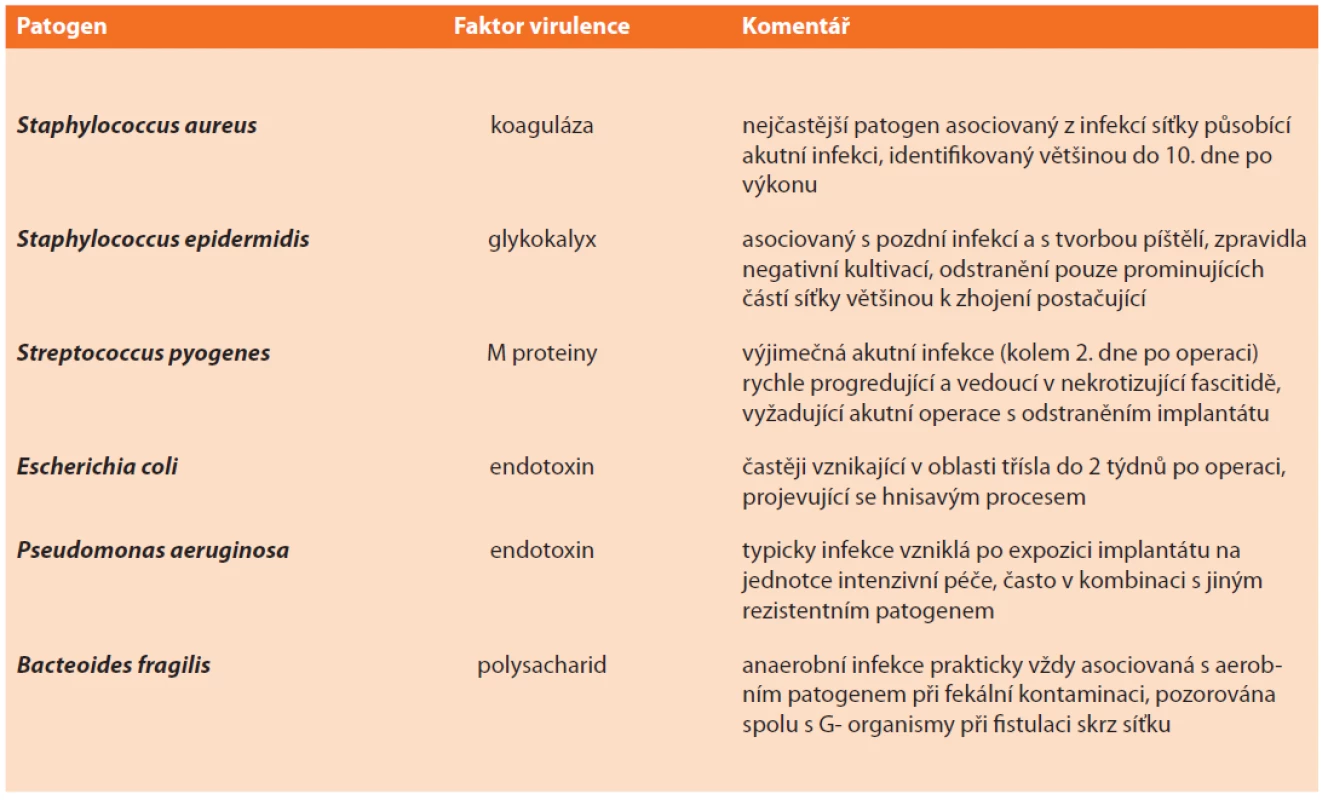
Pokud dojde ke kontaminaci implantátu, závisí na materiálu a konkrétním mikroorganismu, zda dojde k jeho adherenci na povrch materiálu a zformování biofilmu. Adherence mikroorganismů na povrch implantátu má dvě stadia. První rychlé reverzibilní, na kterém se podílejí faktory fyziko-chemické (gravitace, Van der Waalsovy síly, elektrostatické napětí, hydrofobní interakce, chemotaxe ad.) a druhé ireverzibilní k substrátu tvořenému buňkami a proteiny zvanými adhesiny. Jakmile dojde k ireverzibilnímu stadiu, mají některé mikroorganismy (např. Staphylococcus spp.) schopnost tvořit komplex kolonií tvořících polysacharidové substance a extracelulární proteinovou matrix, která se chová jako amorfní kapsula bránící bakterie proti vlivu antibiotik a buněk imunitního systému. Uvnitř biofilmu prodělávají bakterie navíc fenotypové změny, které je činí ještě odolnějšími než jejich volné formy. Pomocí vzájemné komunikace tzv. quorum sensing spolu bakterie prakticky spolupracují. Pokud dojde při infekci protézy k tvorbě biofilmu, je obzvláště obtížné, až nemožné tuto infekci eradikovat, a jediným řešením tak může být jen kompletní odstranění síťky a debridement okolí. Riziko kolonizace je výrazně ovlivněno strukturou implantátu. Obecně platí, že čím komplexnější architektonika implantátu, tím větší afinita ke kolonizaci. Například síťky z vlákna multifilamentního (PET) jsou náchylnější než z monofilamentního (PP, PVDF) [43]. Přičítáno je to většímu celkovému kontaktnímu povrchu materiálu. Stejně tak lze vysvětlit větší odolnost sítěk odlehčených a velkoporézních. Vstřebatelné síťky nebo jejich vstřebatelná komponenta zase v případě její implantace do primárně kontaminovaného prostředí zvyšují riziko rané sepse. Laminární implantáty (tedy takové, které nemají charakter síťky, ale fólie, např. PTFE a ePTFE) jsou všeobecně mikroporézní (póry menší než 10 µm). Tyto póry umožní bakteriální osídlení (1 µm), ale brání prostupu makrofágů (10−15 µm). Jejich implantace je tak do kontaminovaného prostředí kontraindikována a v případě jejich osídlení infekcí bývá zpravidla jedinou možností jejich odstranění z organismu k eradikaci infekce. Naopak zcela neporézní laminární implantáty mají celkově nejmenší kontaktní plochu, a jeví se tak nejoptimálnějším adeptem pro implantaci do primárně kontaminovaného prostředí. Tam ale zcela selhávají ve smyslu vhojení.
Samostatnou kapitolou jsou síťky biologické. Nedostatek konsenzu a jasně rozporuplná experimentální i klinická data vedou při jejich vysoké ceně k důraznému doporučení, tyto implantáty za kontaminovaných podmínek nepoužívat jako definitivní řešení.
Podání antibiotické profylaxe systémově před operací při implantaci protézy je běžnou praxí a je důrazně doporučováno zejména u rizikových pacientů. Toto opatření riziko infekce sníží, ale rozhodně mu není schopno samo o sobě zabránit. Klinická data ukazují výrazný vliv u otevřených výkonů, u laparoskopických výkonů se incidence infekce již výrazněji nesnižuje.
V současné době se jeví nejnadějnější strategií použití protetického materiálu s přidanými antibakteriálními vlastnostmi, které brání bakteriální adherenci a vytvoření biofilmu na jejich povrchu [45]. Design těchto odolných implantátů je založen na modifikaci jejich povrchu povlečením antiadhezivní substancí, antimikrobiálním agens, antiseptikem, antibiotikem, kovy nebo jejich ionty, inhibitory bakteriální adherence. Tato úprava by měla být netoxická, v případě uvolňování kontrolovaně degradovatelná, neovlivňující původní biomechanické vlastnosti materiálu a nebránící integraci implantátu do organismu.
Mezi antiadhezivní substance patří polyvinylpyrrolidone, polyetylen glykol, polyetylen oxid, které jsou hydrofobní a vedou ke snížení nálože mikroorganismů, které adherují na povrch implantátu a zároveň snižují pevnost adherence. Polymery na bázi polysilazanu se používají jako antivegetativní složka. Antiadhesivum polydimetylsiloxane lze použít nejen ke kontrole bakteriální adheze, ale také jako prevence tvorby srůstů při implantaci síťky do přímého kontaktu s orgány.
Chronická infekce
K chronické infekci implantátu dochází zpravidla tam, kde došlo k nedostatečné nebo nevhodné léčbě jeho akutní infekce nebo při infekci u rizikového implantátu. Projevuje se zejména recidivující fistulací a jejím jediným řešením je kompletní explantace protézy. Částečné odstranění s traktotomií má zpravidla jen přechodný efekt.
Pooperační bolest
Akutní a časná pooperační bolest může být přičítána různým typům implantátu, mnohem pravděpodobněji se ale jedná o poškození nebo iritaci nervů v důsledku operace. U plastiky pod napětím je časná bolestivost právě úměrná velikosti napětí. Typická je několik týdnů po operaci přetrvávající bolestivost z transparietálních kotevních stehů vedených napříč břišní stěnou. Právě i z tohoto důvodu velká část publikujících chirurgů preferuje kotvení dlouhodobě vstřebatelnými stehy před stehy nevstřebatelnými.
Chronická bolest a dyskomfort
Pozdní nástup bolesti může mít naopak reálnější souvislost s implantací cizího materiálu a s reakcí proti němu nebo s jeho svrašťováním. U některých typů implantátu bývají tyto reakce udávány jako příčina pocitu cizího tělesa. Předpokládá se, že odlehčené nebo částečně i kompletně vstřebatelné implantáty výrazně snižují riziko vzniku těchto komplikací. Pocit cizího tělesa bývá popisován častěji u těžkých sítěk. Problém klasických neuralgií po implantaci síťky bývá často obtížně řešitelný a je noční můrou každého kýlního specialisty. Operační revize, neurolýzy, odstranění fixačního materiálu či částí síťky bývají úspěšné jen u malé části pacientů.
Adheze/srůsty
V případě expozice síťky ve volné břišní dutině dochází k formování srůstů. Řada studií prokázala, že dvouvrstevné nebo potahované bariérové kompozitní implantáty jsou efektivní proti tvorbě těchto adhezí. Avšak po celosvětové letité praxi a zkušenostech by bylo iluzorní domnívat se, že nevzniknou srůsty vůbec žádné [31]. U sítěk potahovaných degradabilní antiadhezivní vrstvou je problém v tom, že není zcela jasné, jak dlouho po implantaci může ještě k tvorbě adhezí dojít. Lze předpokládat, že riziko je minimální, až když implantát přeroste neoperitoneem (týden až měsíc). Odlehčené síťky tak mají výhodu rychlejší integrace a časnějšího dosažení tohoto relativně bezpečného stavu [30]. Všeobecně mají nízké riziko vzniku adhezí implantáty z ePTFE. Rizikovým místem u všech implantátů jsou jejich okraje a fixační místa zejména při použití kovových skrutek/tuckerů bez ochranné polymerové čepičky. Síťky primárně určené k intraperitoneální plastice mají již většinou speciálně upravené okraje. Například nesmáčivý povrch částečně přesahuje na stranu parietální. Z tohoto důvodu není doporučováno implantáty dále stříhat a tvarově upravovat [46]. Velké riziko srůstu je i při nedokonalé peritonealizaci preperitoneálně uložených tzv. smáčivých sítěk – implantátů bez antiadhezivní vrstvy či úpravy.
DISKUZE
Princip tkáňového inženýrství „nahradit stejné stejným“ lze při rekonstrukci břišní stěny jen obtížně, jelikož je břišní stěna složitý anatomicko-funkční komplex s velmi specifickými dynamickými vlastnostmi a požadavky.
V současnosti bohužel neexistuje jeden ideální implantát. Vždy je třeba maximálně vyhodnotit konkrétní případ a někdy téměř doslova ušít implantát pacientovi přímo na míru.
To vše navíc při zodpovědném zhodnocení možností samotného chirurga i jeho pracoviště.
Znalosti výše uvedeného by měly pomoci k volbě nejvhodnějšího implantátu. V praxi toto nebývá zcela jednoznačné. Jednoznačnější již ale bývá určit, který implantát je naopak nevhodný [47].
Tento článek má prezentovat základní principy designu a technických aspektů v současné době používaných materiálů a běžně dostupných implantátů a upozornit chirurgy na některé kritické aspekty jejich racionálního použití. Nedává například zcela smysl fixovat částečně vstřebatelnou monofilamentní síťku nevstřebatelnými multifilamentními kotevními stehy apod.
Aby se mohl chirurg v současné záplavě implantátů a inovativních technik bezpečně opřít o přesvědčivá klinická data a ne jen o dedukce ze střípků objektivních částí živelně designovaných studií, je důležité provádět více takových studií jako například Agarwal v roce 2009. Pacienti s oboustrannou tříselnou kýlou podstoupili operaci metodou TEP, kdy jim do jednoho třísla byla stejným operatérem v jedné době implantována těžká PP síťka a do druhého třísla odlehčená jako kontrola [17].
Nutno podotknout, že příspěvky českých autorů k tématu kýl a sítěk do odborné literatury nejen za poslední dekádu jsou zcela „homeopatické“. Prakticky se jedná jen o iniciální zkušenosti [47−52].
Preference různých implantátů se liší i u chirurgů na pracovišti autorů článku. Charakteristika implantátu, která je pro jednoho výhodou, jiného limituje. A tak to asi má a bude muset být. Návodem budiž jejich všeobecná odborná a filozofická shoda: za a) že v jednoduchosti je krása (principy KISS); za b) že není všechno krásné, co se třpytí; za c) že méně je někdy více; a za d) některé zkušenosti jsou nepřenosné. A tak pro současnou generaci chirurgů-herniologů bude ještě dlouhou dobu zkoušení dalších a dalších inovativních implantátů nedílnou součástí jejich odbornosti a každodenní práce.
ZÁVĚR
Při neexistenci ideálního ani zcela univerzálního implantátu jsou teoretické znalosti o používaných a dostupných implantátech a jejich technických parametrech nezbytnou podmínkou správného, až optimálního výběru u konkrétního pacienta (personalizovaná medicína). Důležité je znát zejména limitace použité protézy. Expertdependentní je pak již způsob její fixace a implantace. Tyto faktory jsou v herniologii všeobecně důležitější než volba samotného implantátu a jejich nedostatečná standardizace je příčinou špatné komparability jednotlivých klinických studií, a dokonce i výsledků operatérů na jednom pracovišti vztažených k použitému materiálu. K tomu přispívá absence přesnějšího „Návodu k použití“ u téměř všech komerčně vyráběných implantátů. Známkou excelence je, když chirurg-herniolog dokáže při revizním výkonu rozeznat dříve použitý materiál či lépe i typ síťky. Stran implantátu může tzv. osvědčené znamenat zastaralé a taktéž dražší rozhodně neznamená automaticky lepší.
Seznam zkratek
PE − polyetylen
PET − polyester (polyetylen tereftalát)
PEU − polyeteruretan
PG 910 − polyglactin 910
PGA − polyglykolová kyselina (polyglycolic acid)
PGACL − polyglycolic acid caprolacton
PGC − polyglecaprone
PGCA − polyglecaprone acid
PP − polypropylen
PVDF − polyvinylidenfluorid
PVP − polyvinylpyrrolidone
HMDI − hexametylen diisokyanát
EDAC − 1-etyl-3-(3-dimetylaminopropyl) karbodimid hydrochlorid
ePTFE − expandovaný polytetrafluoretylen
cPTFE − kondenzovaný polytetrafluoretylen
PLA − polylactic acid
PDO − poly-dioxanone
PEUU − polyester uretane urea
PTMC − polytrimetylen karbonát
P4HB − polyhydroxybutyrát
PEG − polyetylen glykol
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Jiří Škach
oddělení chirurgie
Krajská nemocnice Liberec, a. s.
Husova 10
Liberec 460 01
e-mail: jiri.skach@nemlib.cz
Zdroje
- Schumpelick V, Nylus L. Meshes: benefits and risks. Springer, Berlin 2003.
- Shankaran V, Weber DL, Reed RL, et al. A review of available prosthetics for ventral hernia repair. Ann Surg. 2011;253 : 16−24.
- LeBlanc KA. Prosthetic biomaterials for hernioplasty In: LeBlanc KA. Laparoscopic hernia surgery: An operative guide. London, NY 2003.
- Bilsel Y, Abci I. The search for ideal hernia repair; mesh materials and types. International Journal of Surgery 2012;10 : 317–21.
- Consensus conference. Clinical applications of biomaterials. JAMA 1984;249 : 1050.
- Kalaba S, Gerhard E, Winder JS, et al. Design strategies and applications of biomaterials and devices for hernia repair. Bioactive Materials 2016;1 : 2−17.
- Amid PK. Classification of biomaterials and their related complications in abdominal wall hernia surgery. Hernia 1997;1 : 15.
- Coda A, Lamberti R, Martorana S. Classification of prosthetics used in hernia repair based on weight and biomaterial. Hernia 2012; 16 : 9−20.
- Bryan N, Battersby C, Smart N, et al. A review of biocompatibility in hernia repair; considerations in vitro and in vivo for selecting the most appropriate repair material. Hernia 2015;19 : 169−78.
- Klinge U, Klosterhalfen B. Modified classification of surgical meshes for hernia repair based on the analyses of 1,000 explanted meshes. Hernia 2012;16 : 251−8.
- Sanbhal N, Miao L, Xu R, et al. Physical structure and mechanical properties of knitted hernia mesh materials: A review. Journal of Industrial Textiles 2017 : 1−28.
- Baylon K, Camarillo PR, Zuniga AE, et al. Past, present and future of surgical meshes: A review. Membranes 2017;7 : 47.
- Williams DF. On the mechanisms of biocompatibility. Biomaterials 2008;29 : 2941−53.
- Rastegarpour A, Cheung M, Vardhan M, et al. Surgical mesh for ventral incisional hernia repairs: Understanding mesh design. Plast Surg 2016;1 : 41−50.
- Bellon JM, Contreras LA, Pascual G, et al. Evaluation of the acute scarring response to the implant of different types of biomaterial in the abdominal wall. J Mater Sci Mater Med 2000;11 : 25−9.
- King MW, Soares BM, Guidoin R. The chemical, physical and structural properties of synthetic biomaterials used in hernia repair. In: Bendavin R. (ed) Prostheses and abdominal wall hernias. Landes, Austin 1994; 191−206.
- Agarwal BB, Agarwal KA, Mahajn KC. Prospective double-blind randomized controlled study comparing heavy - and lightweight polypropylene mesh in totally extraperitoneal repair of inguinal hernia: early results. Surg Endosc 2009;23 : 242−7.
- Miao L, Wang F, Wang L. et al. Physical characteristics of medical textile prostheses designes for hernia repair: A comprehensive analysis of select commercial devices. Materials 2015;8 : 8148−68. doi: 10.3390/ma8125453.
- Deeken CR, Abdo MS, Frisella MM, et al. Physicomechanical evaluation of polypropylen, polyester, and polytetrafluorethylene meshes for inguinal hernia repair. J Am Coll Surg. 2011;212 : 68−79.
- Anurov MV, Titkova SM, Oettinger AP. Biochemical compatibility of surgical mesh and fascia being reinforced: dependence of experimental hernia defect repair results on anisotropi surgical mesh positioning. Hernia 2012;16 : 199−210.
- Saberski ER, Orenstein SB, Novitsky YW. Anisotropic evaluation of synthetic surgical meshes. Hernia 2011;15 : 47−52.
- Hiles M, Ritchie RD, Altizer AM. Are biologic grafts effective for hernia repair? A systematic review of the literature. Surg Innov 2009;16 : 26−37.
- Carter PR, LeBlanc KA, Hausmann MG, et al. Does expanded polytetrafluoroethylene mesh really shrink after laparoscopic ventral hernia repair? Hernia 2012;16321−5.
- Trabuco EC, Gebhart JB. Reconstructive materials used in surgery: Classification and host response. UpToDate 2017.
- Usher FC, Fries JG, Ochsner JL, et al. Marlex mesh, a new plastic mesh for replacing tissue defects. II. Clinical studies. AMA Arch Surg. 1959;78 : 138−45.
- Usher FC, Gannon JP. Marlex mesh, a new plastic mesh for replacing tissue defects. I. Experimental studies. AMA Arch Surg 1959;78 : 131−7.
- Brown CN, Finch JG. Which mesh for hernia repair? Ann R Coll Surg Engl 2010;92 : 272−8.
- Hodde J, Hiles M. Constructive soft tissue remodeling with a biologic extracellular matrix graft: overview and review of the clinical literature. Acta Chir Belg 2007;107 : 641−7.
- Gonzales R, Rodeheaver GT, Moody DL, et al. Reisistance to adhesion formation: a comparative study of treated and untreated mesh products placed in the abdominal cavity. Hernia 2004;8 : 213−9.
- Bellon JM, Garcia-Honduvilla N, Lopez R, et al. In vitro mesothelialization of prosthetic materials designed for the repair of abdominal wall defects. J Mater Sci Mater Med 2003;14 : 359−64.
- Ramakrishna HK, Lakshman K. Intraperitoneal polypropylene mesh and newer meshes in ventral hernia repair: What EBM says? Indian J Surg 2013;5 : 346−51.
- Deeken CR, Faucher KM, Matthews BD. A review of the composition, characteristics, and effectiveness of barrier mesh prostheses utilized for laparoscopic ventral hernia repair. Surg Endosc 2012;26 : 566−75.
- Guillame O, Teuschl AH, Gruber-Blum S, et al. Emerging trends in abdominal wall reinforcement: Bringing bio-functionality to meshes. Adv Healthcare Mater 2015;4 : 1763−89.
- Fitzgerald JF, Kumar AS. Biologic versus synthetic mesh reinforcement: What are the pros and cons? Clin Colon Rectal Surg 2014;27 : 140−8.
- Plencner M, East B, Tonar Z, et al. Abdominal closure reinforcement by using polypropylene mesh functionalized with poly-epsilon-caprolactone nanofibers and growth factors for prevention of incisional hernia formation. Int J Nanomed 2014;9 : 3263−77.
- Labay C, Canal JM, Modic M, et al. Antibiotic-loaded polypropylene surgical meshes with suitable biological behaviour by plasma functionalization and polymerization. Biomaterials 2015;71 : 132−44.
- Cohen MS, Stern JM, Vanni AJ, et al. In vitro analysis of a nanocrystalline silver-coated surgical mesh. Surgical Infections 2007;8 : 397−403.
- Mancino AT, Lalani T. Wound infection following repair of abdominal wall hernia. UpToDate 2017.
- Falagas ME, Kasiakou SK. Mesh-related infections after hernia repair surgery. Clin Microbiol Infect 2005;11 : 3−8.
- Narkhede R, Shah NM, Dalal PR, et al. Postoperative mesh infection – Still a concern in laparoscopic era. Indian J Surg 2015;4 : 322−6.
- Choi JJ, Palaniappa NC, Dallas KB, et al. Use of mesh during ventral hernia repair in clean-contaminated and contaminated cases: outcomes of 33.832 cases. Ann Surg 2012;255 : 176−80.
- Perez-Kohler B, Bayon Y, Bellon JM. Mesh infection and hernia repair: a review. Surgical Infections 2016;10 : 1−14.
- Cevasco M, Itani KMF. Ventral hernia repair with synthetic, composite and biologic mesh: characteristics, indications and infection profile. Surgical Infections 2012;13 : 209−15.
- Aydinuraz K, Agalar C, Agalar F, et al. In vitro S.epidermidis and S.aureus adherence to composite and lightweight polypropylene grafts. Journal of Surgical Research 2009;157:e79−e86.
- Belyansky I, Tsirline VB, Montero PN, et al. Lysostaphin-coated mesh prevents staphylococcal infection and significantly improves survival in a contaminated surgical field. The American Surgeon 2011;8 : 1025−31.
- Biondo SML, Calvalho LB, Conceicao LT, et al. Comparative study of polypropylene versus Parietex composite®, Vicryl® and Ultrapro® meshes, regarding the formation of intraperitoneal adhesions. Acta Cir Bras 2017;32 : 98−104.
- Škach J, Harcubová R, Petráková V, et al. Program monstrózních kýl v Kýlním centru Liberec. Rozhl Chir 2016;5 : 177−87.
- Strašlipka J, Mrázek M, Ludvík P. Plastika tříselné kýly „tension free“ metodou s využitím síťky CHS 100 – naše zkušenosti. Rozhl chir 2008;2 : 87−8.
- Martínek L, Dostalík J, Guňková P, et al. Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti. Rozhl Chir 2012;4 : 216−8.
- Šimánek V, Třeška V, Špidlen V, et al. Plastika tříselné kýly otevřenou metodou, porovnání různých technik – pilotní studie. Rozhl Chir 2005;12 : 595−8.
- Kohoutek L, Musil J, Plecháčová P, et al. Operace tříselné kýly technikou ONSTEP. Rozhl Chir 2015;4 : 152−5.
- Marešová P, Peteja M, Lerch M, et al. Costs of inguinal hernia repair associated with using different medical devices in the Czech Republic. Therapeutics and Clinical Risk Management 2016;12 : 1593−7.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2019 Číslo 3- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Zvířecí modely jaterních onemocnění a jejich využití v experimentální chirurgii
- Přínos hodnocení perfuze pomocí fluorescenční angiografie při robotické nízké resekci rekta: výsledky nerandomizované prospektivní studie
- Dysfágia po prednej krčnej diskektómii a intersomatickej fúzii – prospektívna štúdia s jednoročným sledovaním
- Primární Ewingův sarkom v retroperitoneu
- Synoviální cysta vycházející z kyčelního kloubu prezentující se jako stehenní kýla – kazuistika
- Distální intestinální obstrukční syndrom u pacienta s cystickou fibrózou po transplantaci plic
- Zemřel primář Michal Leško
- Pracovní dny Koloproktologické sekce České chirurgické společnosti ČLS JEP
- Všeobecná chirurgie?
- Současný pohled na protézy v herniologii (kýlní síťky) – klasifikace, indikace, výhody a nevýhody jednotlivých materiálů, komplikace
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný pohled na protézy v herniologii (kýlní síťky) – klasifikace, indikace, výhody a nevýhody jednotlivých materiálů, komplikace
- Synoviální cysta vycházející z kyčelního kloubu prezentující se jako stehenní kýla – kazuistika
- Distální intestinální obstrukční syndrom u pacienta s cystickou fibrózou po transplantaci plic
- Zemřel primář Michal Leško
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



