-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaZvířecí modely jaterních onemocnění a jejich využití v experimentální chirurgii
Animal models of liver diseases and their application in experimental surgery
Both acute and chronic liver diseases are frequent and potentially lethal conditions. Development of new therapeutic strategies and drugs depends on understanding of liver injury pathogenesis and progression, which can be studied on suitable animal models. Due to the complexity of liver injury, the understanding of underlying mechanisms of liver diseases and their treatment has been limited by the lack of satisfactory animal models. SO far, a wide variety of animals has been used to mimic human liver disease, however, none of the models include all its clinical aspects seen in humans. Rodents, namely rats and mice, represent the largest group of liver disease models despite their limited resemblance to human. On the other hand, large animal models like pigs, previously used mostly in acute liver failure modeling, are now playing an important role in studying various acute and chronic liver diseases. Although significant progress has been made, the research in hepatology should continue to establish animal models anatomically and physiologically as close to human as possible to allow for translation of the experimental results to human medicine. This review presents various approaches to the study of acute and chronic liver diseases in animal models, with special emphasis on large animal models and their role in experimental surgery.
Keywords:
liver disease – Animal models – experimental surgery – pig
Autoři: A. Malečková 1,2; Z. Tonar 1,2; P. Mik 3; K. Michalová 4; V. Liška 2,5; R. Pálek 2,5; J. Rosendorf 2,5; M. Králíčková 1,2; V. Třeška 5
Působiště autorů: Ústav histologie a embryologie, Lékařská fakulta v Plzni, Univerzita Karlova 1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova 2; Evropské centrum excelence NTIS, Fakulta aplikovaných věd, Západočeská univerzita v Plzni 3; Šiklův ústav patologie, Lékařská fakulta v Plzni, Univerzita Karlova 4; Chirurgická klinika, Fakultní nemocnice Plzeň, Lékařská fakulta v Plzni, Univerzita Karlova 5
Vyšlo v časopise: Rozhl. Chir., 2019, roč. 98, č. 3, s. 100-109.
Kategorie: Souhrnné sdělení
Souhrn
Akutní a chronická jaterní onemocnění představují širokou skupinu chorob, které často ohrožují pacienty na životě. Pochopení mechanismů stojících za patogenezí a progresí jaterního poškození je klíčové pro vývoj nových terapeutických strategií a léků. Nejvýznamnějším faktorem limitujícím studium patogeneze a progrese jaterních onemocnění je nedostatek vhodných zvířecích modelů. Do současné doby bylo etablováno množství zvířecích modelů napodobujících jaterní onemocnění u lidí. Hlodavci, konkrétně potkani a myši, představují největší skupinu modelů jaterních onemocnění. Tyto modely ovšem dokážou manifestovat všechny klinické aspekty jaterního onemocnění u lidí jen do omezené míry, především pro jejich omezenou anatomickou a fyziologickou podobnost s lidmi. Velké zvířecí modely reprezentované prasetem, významné zejména v oblasti modelování akutního jaterního selhání, jsou stále častěji využívány v modelování dalších akutních i chronických jaterních onemocnění. Přenos výsledků testování nových léčebných metod do humánní medicíny je závislý na vývoji dokonalejších zvířecích modelů reflektujících průběh jaterních onemocnění u lidí. Toto přehledné sdělení shrnuje dosud publikované zvířecí modely chronických i akutních jaterních onemocnění se zvláštním důrazem na velké zvířecí modely a jejich využití v experimentální chirurgii.
Klíčová slova:
onemocnění jater – zvířecí modely – experimentální chirurgie – prase
Úvod
Akutní jaterní onemocnění (acute hepatic injury, acute liver disease ALD) a chronická jaterní onemocnění (chronic liver disease CLD) představují širokou skupinu chorob jater s různou etiologií a mechanismem vzniku jaterního poškození. ALD mohou vyústit v akutní selhání jater (acute liver failure ALF) nebo přejít do chronicity. CLD typicky vedou k progresivní destrukci jaterního parenchymu a ve svém důsledku vyúsťují v jaterní fibrózu a cirhózu.
Navzdory pokroku v diagnostických a léčebných metodách v hepatologii stále zůstává řada nezodpovězených otázek týkajících se patogeneze, progrese a případného terapeutického ovlivnění jaterních onemocnění. Jednou z vhodných cest ke zkoumání těchto mezer v poznání je experimentální využití zvířecích modelů jaterních onemocnění.
Do současné doby byly formou přehledných sdělení zmapovány oblasti zvířecích modelů akutních i chronických jaterních onemocnění [1–5]. ALD i CLD jsou nejčastěji modelovány na malých laboratorních savcích, kteří se uplatňují zejména díky své snadné genetické manipulovatelnosti, krátkému životnímu cyklu (dospějí v případě CLD do stadia fibrózy či cirhózy [5]) a cenové dostupnosti. Ovšem jejich malá anatomická a fyziologická podobnost s člověkem omezuje aplikovatelnost výsledků studií do humánní medicíny. Proto jsou zde tendence provádět experimenty původně s malými savci na modelech relevantnějších pro humánní medicínu, jako např. na praseti [6], jehož játra jsou do velké míry anatomicky a histologicky podobná játrům lidským (Obr. 1).
Obr. 1. Histologický obraz zdravých (A–F) a patologicky změněných jater prasete (G–I)
A–C – Přehledné zvětšení zobrazující jaterní parenchym členěný v jednotlivé jaterní lalůčky, které jsou u prasete ohraničené oproti člověku významně větším množstvím vaziva.
D–F – Detail portobiliárních prostor obsahujících hepatickou trias – interlobulární větev a. hepatica propria, v. portae a žlučovodu.
G – Centrilobulární hemoragická nekróza u zvířete se sinusoidálním obstrukčním syndromem vyvolaným experimentální aplikací pyrrolizidinového alkaloidu monocrotalinu.
H – Nodulární transformace jaterní tkáně s porušenou mikrostrukturou jater a typicky zmnoženým interlobulárním vazivem u jaterní cirhózy.
I – Steatóza jater charakterizována nahromaděním tukových vakuol v cytoplazmě hepatocytů v důsledku toxického poškození jater.
Barvení: hematoxylin a eosin – přehledné barvení (A, D, G–I), anilinová modř a jádrová červeň – detekce kolagenního vaziva (B, E), stříbření (impregnační metoda) (C, F) – detekce retikulárních vláken. Měřítka: 100 μm.
Fig. 1: Histology of healthy (A–F) and diseased (G–I) porcine liver
A–C – The liver parenchyma divided into morphological hepatic lobules, in pigs the lobules are demarcated by a signifi cantly higher amount of connective tissue when compared to human.
D–F – Detail of portal tracts containing bile ducts and branches of the hepatic artery and portal vein surrounded by connective tissue.
G – Centrilobular hemorrhagic necrosis seen in animal with Sinusoidal Obstruction Syndrome, experiment included the application of alkaloid monocrotaline.
H – Cirrhotic liver histologically represented by nodular transformation of liver parenchyma with disruptions of liver microarchitecture and excessive amount of interlobular connective tissue.
I – Steatosis characterized by lipid droplets accumulation within hepatocytes caused by toxic liver injury.
Staining: hematoxylin and eosin staining (A, D, G–I), aniline blue staining, counterstained with nuclear fast red – detection of collagen connective tissue (B, E), silver impregnation technique – detection of reticular fibers.
Scale bars: 100 μm.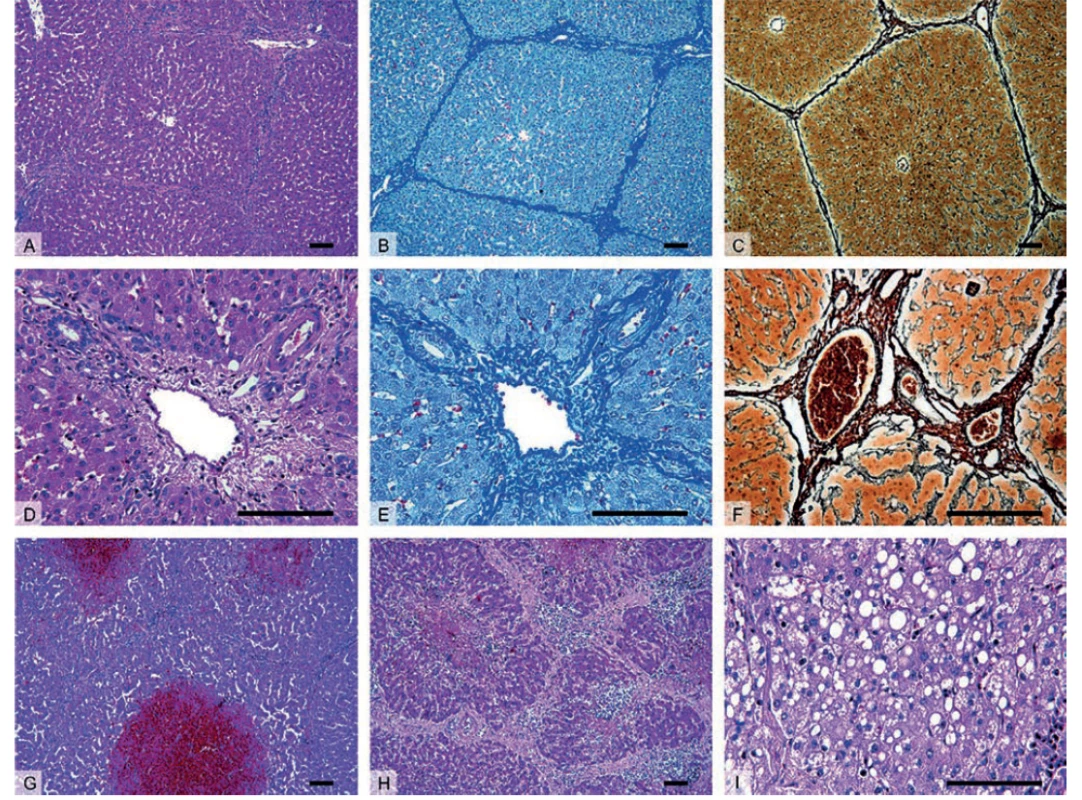
Naproti tomu v oblasti modelování ALF převažují velké zvířecí modely, které umožňují napojení na mimotělní oběh, opakované odběry krve a jsou vhodné pro nácvik chirurgických technik, které jsou na rozdíl od mikrochirurgických technik používaných na hlodavcích jednak méně náročné na dovednosti operatéra, ale především bližší chirurgické praxi (Tab. 1).
Tab. 1. Srovnání zvířecích modelů jaterních onemocnění
Tab. 1: Comparison of animal models of liver diseases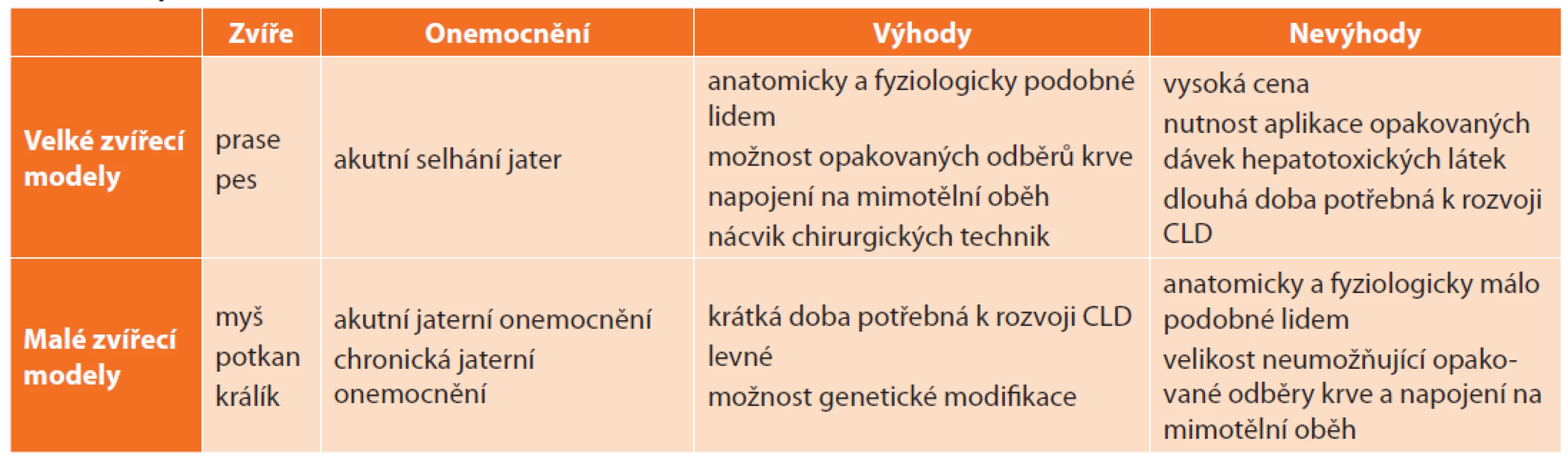
Vysvětlivky: CLD – chronické jaterní onemocnění (chronic liver disease). V literatuře nacházíme množství způsobů dělení zvířecích modelů jaterních onemocnění, které se do jisté míry překrývají a duplikují. Liu et al. [4] navrhl rozdělení modelů CLD dle mechanismu vzniku jaterní fibrózy a cirhózy na (i.) klasické modely: neberou v potaz etiologii jaterního poškození, aplikací hepatotoxických látek dosahují u zvířat jaterní fibrózy, (ii.) modely napodobující specifická jaterní onemocnění: kladou důraz na etiologii CLD, která významným způsobem ovlivňuje patogenezi, progresi a prognózu CLD. Poněkud přehlednějším je zde navržené dělení, které zahrnuje většinu možností modelování jak akutního, tak chronického jaterního poškození (Tab. 2).
Tab. 2. Přehled zvířecích modelů jaterních onemocnění
Tab. 2: List of animal models of liver diseases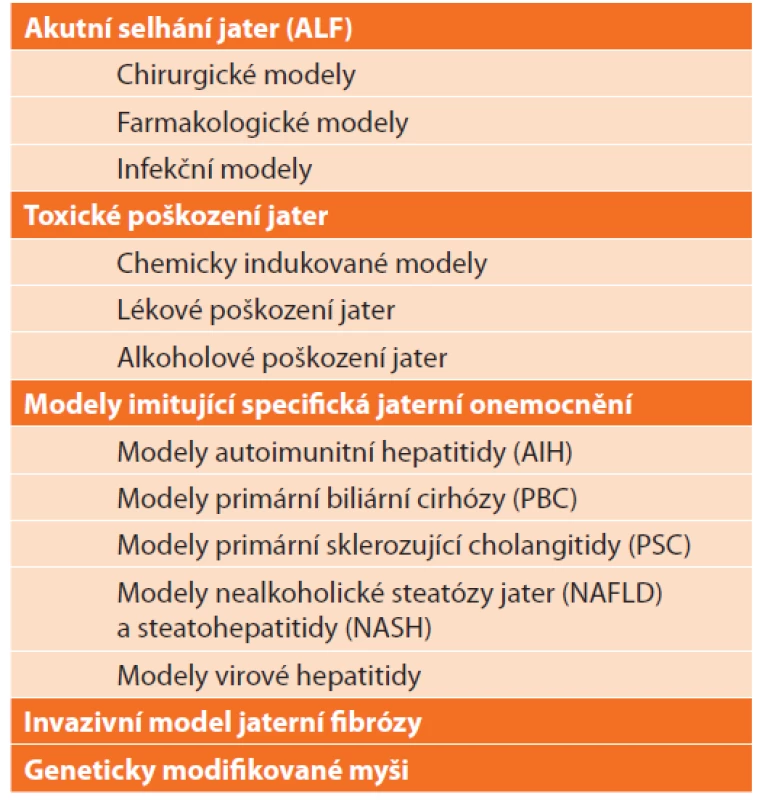
Cílem tohoto sdělení je představit zvířecí modely jaterních onemocnění a jejich současné využití v experimentu. Pro zachování kompatibility se zahraničními zdroji ponecháváme vedle některých pojmů v češtině i jejich ustálené protějšky v anglickém jazyce.
1. Zvířecí modely akutních a chronickýchjaterních onemocnění
Následující text shrnuje vybrané modely zvířecích modelů akutních a chronických jaterních onemocnění na základě literární rešerše. Rešerše byla provedena v databázi PubMed k datu 30. 8. 2018 s využitím klíčových slov: acute liver failure, chronic liver disease, animal models. Přehledná sdělení (review) byla následně doplněna o konkrétní studie s využitím klíčových slov nalezených v literatuře, např.: acetaminophen, acute liver failure, animal model, pig. V předkládaném článku jsou uvedena jak přehledná sdělení (review) na dané téma, tak příklady studií, které využily zvířecí model ke konkrétním experimentům, např. k testování podpůrných jaterních systémů (Tab. 4). Zahrnuty byly zejména studie s prasečími modely jaterních onemocnění.
1.1 Modely akutního jaterního selhání
Navzdory vysoké regenerační kapacitě hepatocytů a možnosti spontánního návratu jaterních funkcí zůstává pro pacienty s ALF bez uspokojivé regenerace jedinou terapeutickou možností ortotopická transplantace jater (orthotopic liver transplantation OLT). Ve většině případů OLT zlepšuje celkové přežití, ovšem počet pacientů na čekací listině pro transplantaci neustále přibývá [1]. Zlepšení regenerační kapacity jater lze dosáhnout arterializací portální vény (portal vein arterialization PVA), jak bylo testováno v experimentu na potkanech [7] a prasatech [8]. Současné léčebné možnosti používané k překlenutí čekací doby na OLT (tzv. „bridging“) jsou omezené a zahrnují transplantaci hepatocytů [9] a využití podpůrných jaterních systémů, tzv. „umělých jater“ (liver support systems) [10,11].
Pokusy o vysvětlení patofyziologických procesů a propojení metabolických změn s klinickými projevy ALF vyústily ve formulování dvou teorií: „toxin hypothesis“ a „critical mass theory“. „Toxin hypothesis“ předpokládala, že za klinické projevy ALF jsou zodpovědné nahromaděné látky jako např. amoniak, fenoly či volné žlučové kyseliny, které jsou ve zdravých játrech odbourávány. „Critical mass theory“ pak za příčinu jaterního selhání považovala ztrátu hepatocytů pod určitou kritickou mez, kdy již játra nejsou schopna udržovat svou metabolickou aktivitu na takové úrovni, aby dokázala zajistit podporu funkce dalších periferních orgánů. Hlubší studium problematiky ALF ovšem ukázalo, že mechanismus nahromadění toxických látek a ztráty syntetické kapacity jater nejsou jedinými mechanismy a že vlastní poškozené hepatocyty se podílejí na prohloubení a progresi ALF uvolňováním zánětlivých cytokinů či vazoaktivních látek [12]. Přesto dodnes zůstávají některé mechanismy ALF nepopsány. Pro studium patogeneze ALF a testování nových terapeutických přístupů z hlediska jejich bezpečnosti a efektivity je proto nezbytné etablovat zvířecí model, který bude co nejvíce reflektovat průběh ALF u člověka.
Terblanche a Hickman [13] počátkem 90. let navrhli systém šesti kritérií, která by měl ideální zvířecí model ALF splňovat (Tab. 3). V současnosti žádný zvířecí model ALF nesplňuje všechna popsaná kritéria. Pro vytvoření modelu ALF se využívají tři hlavní přístupy: chirurgický, farmakologický (toxický) a infekční model [1–3].
Tab. 3. Kritéria pro ideální zvířecí model akutního selhání jater (ALF) – převzato a upraveno dle Terblanche a Hickman [13]
Tab. 3: Criteria for an ideal animal model of acute liver failure (ALF) postulated by Terblanche and Hickman [13]![Kritéria pro ideální zvířecí model akutního selhání jater (ALF) – převzato a upraveno dle Terblanche a Hickman [13]<br>
Tab. 3: Criteria for an ideal animal model of acute liver failure (ALF) postulated by Terblanche and Hickman [13]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b83c9c5baf0dff05c251170a68e9bd0e.png)
1.1.1 Chirurgické modely ALF
Chirurgické modely s výhodou využívají velká zvířata. Rozdělují se do 3 základních skupin: velká resekce (partial hepatectomy), hepatektomie (anhepatic model) a ischemický model (ischemic model, devaskularizace) (Tab. 4).
Tab. 4. Přehled chirurgických modelů akutního selhání jater a jejich současné využití v experimentu na praseti
Tab. 4: Surgical models of acute liver failure and their current application in experimental research on pigs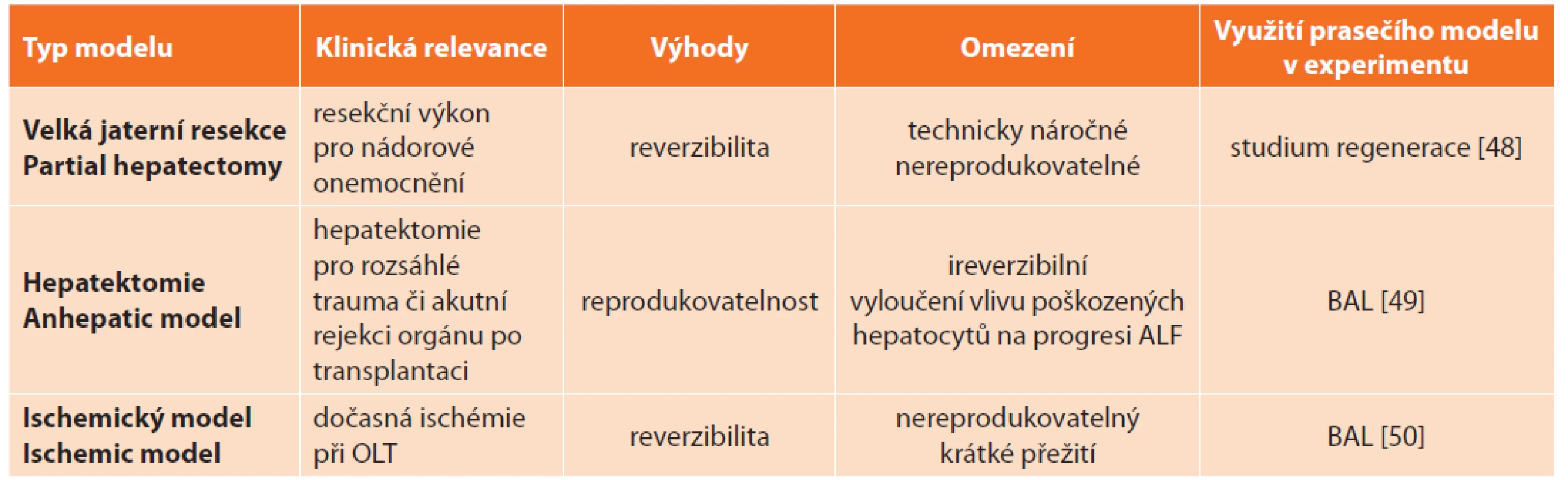
Vysvětlivky: OLT – ortotopická transplantace jater (orthotopic liver transplantation), BAL – bioartifi cial liver. Modely velké jaterní resekce jsou pro svoji náročnost provedení, jež závisí na technickém vybavení a zkušenostech operatérů, těžko reprodukovatelné. Alternativou k prosté resekci může být kombinace resekce s ischemií zbytku jaterního parenchymu [14].
Anhepatický model zahrnuje odstranění celého orgánu [15], je oproti předchozímu snadněji reprodukovatelný. Pro jeho využití v experimentu je mimo jiné důležitá i pooperační intenzivní péče: monitorování hemodynamických parametrů, zajištění ventilace, monitorování a případná úprava mikce, monitorování množství hemoglobinu, hematokritu a laktátu, elektrolytů v séru, acidobazické rovnováhy, krevních plynů a hladiny glukózy, které ovlivňují délku přežití zvířete, a tedy i délku terapeutického okna pro použití a testování nových léčebných strategií [16].
Ischemický model představuje dvoustupňový chirurgický výkon, při kterém se vytváří portokavální shunt s následným uzávěrem hepatické arterie [17]. Okluze může být dočasná, pak je model potenciálně reverzibilní, ovšem průběh ALF je značně nestálý a těžko reprodukovatelný. Jiným přístupem k vytvoření ischemického modelu je přerušovaná okluze v. portae a a. hepatica s následnou arteriální ligací [18]. Tento model splňuje všechna kritéria dle Terblanche a Hickmana s výjimkou reverzibility [13].
1.1.2 Farmakologické modely
Většinu farmakologických zvířecích modelů ALF představují malí laboratorní savci [19–21]. Velké zvířecí modely jsou zatížené nutností opakované aplikace poměrně vysokých dávek toxinu s nestálým klinickým průběhem ALF. Přesto velkých zvířecích modelů v současnosti přibývá, a to zejména pro testování jaterních podpůrných systémů. Nejvýznamnějšími toxiny, jejichž účinky byly studovány na řadě zvířecích druhů a které jsou v současnosti používány k vývoji modelu ALF, patří: galaktosamin [22], acetaminofen [23] a tetrachlormethan [8,24] (Tab. 5).
Tab. 5. Farmakologické modely akutního jaterního selhání a jejich využití v experimentu na praseti
Tab. 5: Pharmacological models of acute liver failure and their application in experimental research on pigs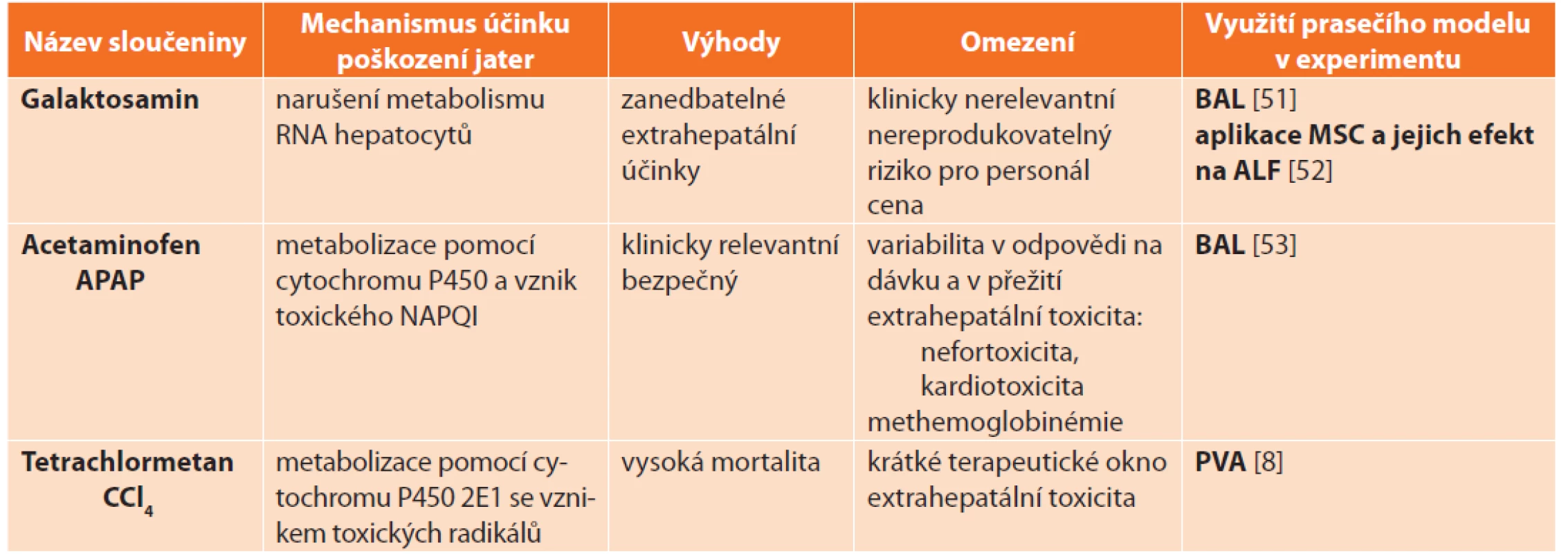
Vysvětlivky: ALF – akutní selhání jater (acute liver failure), NAPQI – N-acetyl-p-benzoquinone imine, BAL – bioartificial liver, PVA – portal vein arterialization, NO – oxid dusnatý, MSC – mezenchymální kmenové buňky (mesenchymal stem cells). 1.1.3 Infekční modely
Navzdory tomu, že virové hepatitidy jsou celosvětově jednou z nejčastějších příčin jaterního selhání, byly snahy o vytvoření zvířecího modelu na podkladě infekce dlouhou dobu neúspěšné. Myší modely hepatitidy B přispěly ke studiu patogeneze ALF, ovšem tento malý zvířecí model neumožňoval opakované krevní rozbory a připojení na mimotělní eliminační metody. Z tohoto důvodu se infekční modely prozatím ve studiu ALF neuplatnily.
1.2 Modely toxického poškození jater
Játra hrají zásadní roli v biotransformaci a eliminaci exogenních látek, jejichž nadměrnou expozicí často dochází k jaternímu poškození. Opakované aplikace hepatotoxických látek představují klasický způsob indukce jaterní fibrózy u experimentálních zvířat. V závislosti na způsobu podávání ale mohou hepatotoxické látky místo jaterní fibrózy způsobit akutní jaterní poškození, až selhání (viz kapitola 1.1.2 Farmakologické modely ALF) (Tab. 5).
Z preventivního hlediska lze hepatotoxické látky, a tedy i zvířecí modely toxického poškození jater, dělit do dvou kategorií: (i.) skutečné hepatotoxiny – jejich podání vyvolá poškození jater u všech jedinců, jde především o produkty chemického průmyslu jako tertrachlormethan CCl4, thioacetamid (TAA), dimethylnitrosamin (DMN) a diethylnitrosamin (DEN) – a (ii.) potenciální hepatotoxiny – vyvolají poškození jater jen u části jedinců, jedná se především o léky, např. chemoterapeutika (Tab. 6). Zvláštní kapitolu tvoří alkoholové poškození jater.
Tab. 6. Zvířecí modely toxického poškození jater
Tab. 6: Animal models of hepatic injury induced by hepatotoxins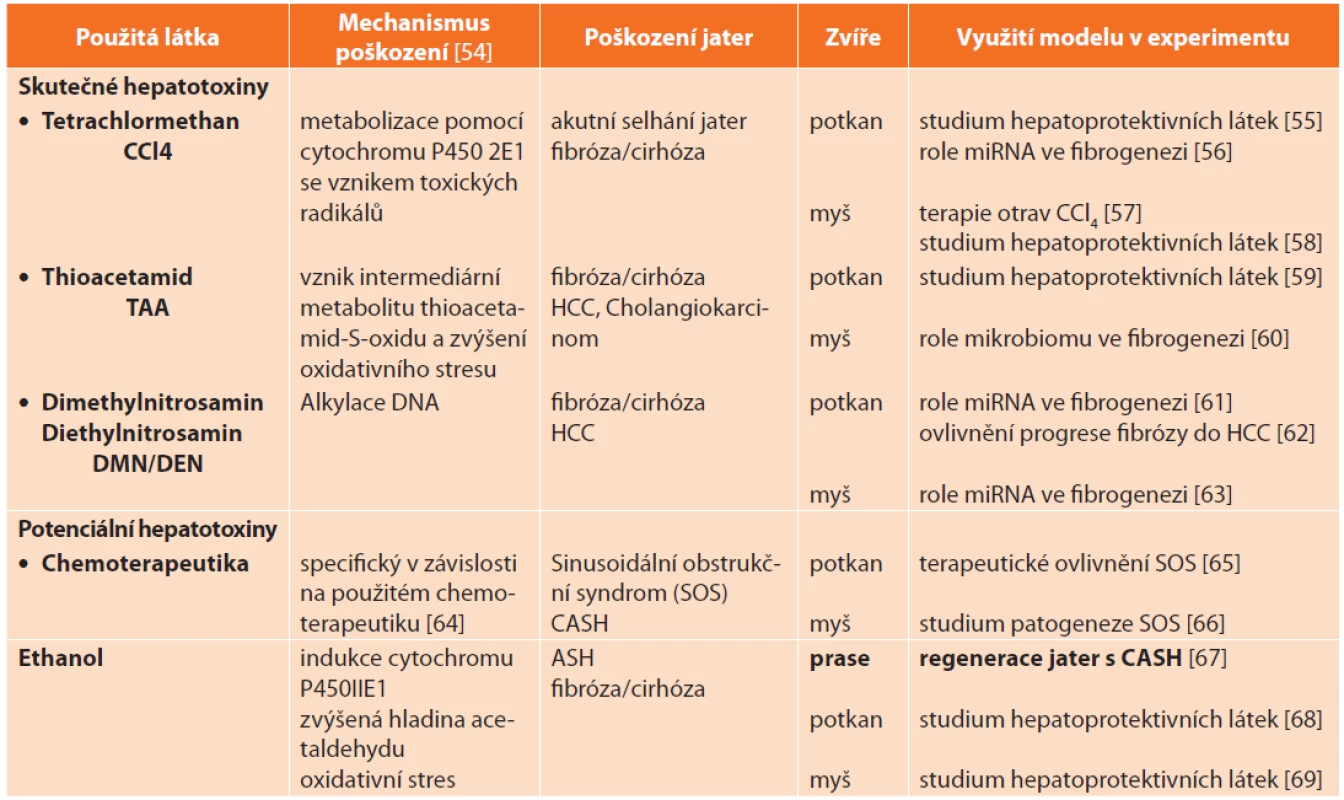
Vysvětlivky: HCC – hepatocelulární karcinom, CASH – steatohepatitida spojená s chemoterapií (chemotherapy-associated steatohepatitis), ASH – alkoholová steatohepatitida (alcoholic steatohepatitis), ALD – alkoholové poškození jater (alcoholic liver disease). 1.2.1 Alkoholové poškození jater
Nadměrná konzumace alkoholu, ať už akutní, či chronická, je závažným sociálním, ekonomickým i zdravotním problémem. Alkoholové postižení jater zahrnuje stavy od poměrně nezávažné steatózy až po cirhózu jater s možností vzniku hepatocelulárního karcinomu.
Alkoholové poškození jater se nejčastěji modeluje na myších a potkanech. Nejrozšířenějším modelem je chronické podávání alkoholu (Lieber–DeCarli liquid diet;LD diet), chronická intragastrická aplikace alkoholu nebo kombinace podávání alkoholu se specifickou dietou (high-fat diet), s hepatotoxickými látkami nebo u geneticky modifikovaných myší [25].
1.3 Modely imitující specifická jaterní onemocnění
Společným znakem většiny chronických jaterních onemocnění je jejich vliv na histologickou stavbu jaterního parenchymu se vznikem jaterní fibrózy až cirhózy. Etiologické a patogenetické mechanismy zodpovědné za tyto změny se ovšem u jednotlivých specifických jaterních onemocnění liší a často je ani neznáme. Vytvoření zvířecích modelů je tak komplikováno nejen neznalostí etiopatogeneze onemocnění, ale také tím, že některé choroby se vyskytují pouze u lidí (virové hepatitidy). Prozatím se nedaří modely, které by měly všechny atributy lidského onemocnění, vytvořit (Tab. 7). Navzdory tomu jsou zvířecí modely specifických jaterních onemocnění ideálním nástrojem k pochopení vzniku a progrese CLD a k nalezení jejich účinné léčby.
Tab. 7. Zvířecí modely specifi ckých jaterních onemocnění
Tab. 7: Animal models mimicking specific chronic liver diseases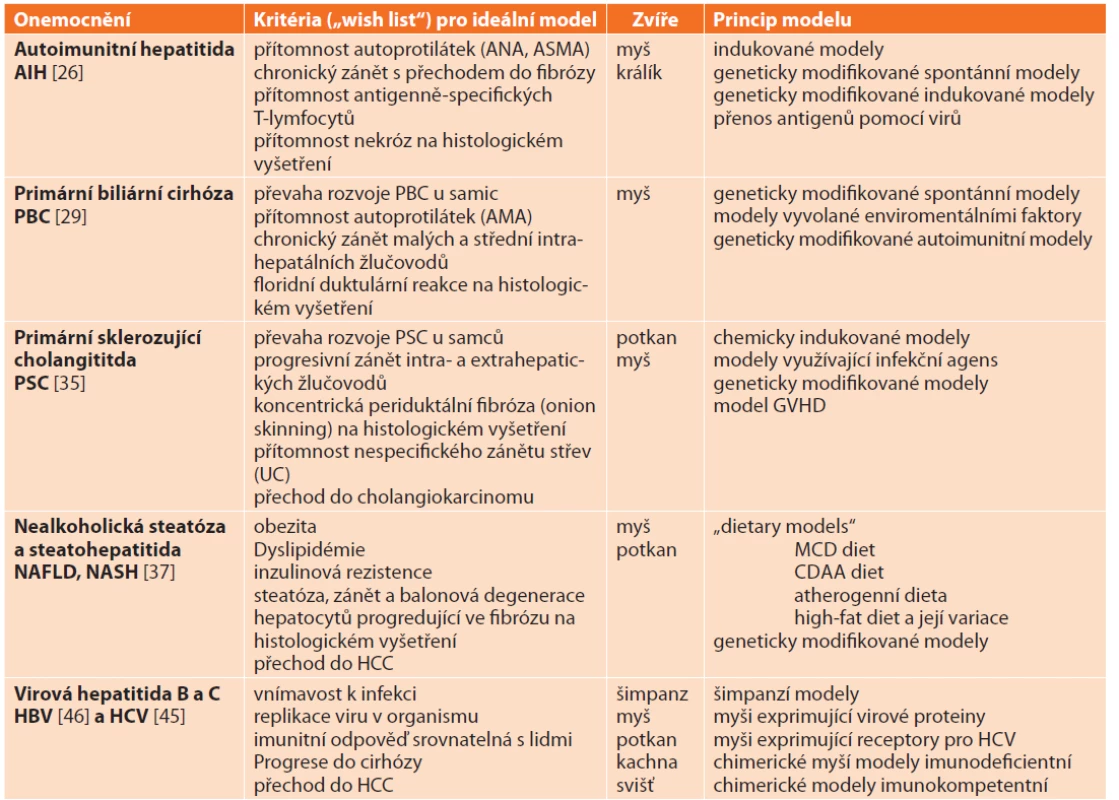
Vysvětlivky: ANA – antinukleární autoprotilátky, ASMA – autoprotilátky proti hladkým svalovým buňkám, AMA – antimitochondriální protilátky, UC – ulcerózní kolitida, HCC – hepatocelulární karcinom, GVHD – reakce štěpu proti hostiteli, MCD diet – methionine and cholin deficiency diet, CDAA diet – choline-deficient L-amino acid-defined diet. 1.3.1 Modely autoimunitní hepatitidy(autoimmune hepatitis AIH)
AIH je chronické zánětlivé onemocnění jater neznámé etiologie charakterizované přítomností autoprotilátek, histopatologickými změnami v játrech a klinickými příznaky vyplývajícími z jaterního poškození – únava, letargie, méně často ikterus. Charakteristickým diagnostickým klinickým znakem AIH je rychlá odpověď na imunosupresivní léčbu, která se vyskytuje asi u 90 % pacientů. Léčba AIH je založena na imunosupresivní terapii.
Zvířecí modely AIH lze vytvořit několika způsoby. V období před možností genetické manipulace modelových organismů se AIH indukovala aplikací jaterních antigenů nebo rostlinného lektinu concavalinu A, který nespecificky aktivuje T-lymfocyty a vede k poškození jater. Velkou skupinu modelů AIH ovšem představují geneticky modifikované myší modely [26] (Tab. 7).
1.3.2 Primární biliární cirhóza(primary biliary cirrhosis PBC)
PBC je chronické cholestatické onemocnění postihující malé a střední intrahepatální žlučovody a objevující se nejčastěji u žen středního věku (v páté a šesté dekádě života). Klasická forma PBC je spojena s přítomností antimitochondriálních protilátek v séru [27]. Aspekty ovlivňující etiologii ovšem zatím zůstávají neznámé a studie se zaměřují nejen na vnitřní, ale i environmentální faktory v rozvoji onemocnění [28]. Do současné doby bylo ke studiu etiopatogeneze a interakce možných genetických a environmentálních faktorů vytvořeno množství zvířecích modelů PBC (myši) [29]. PBC u těchto modelů vzniká buď spontánně u geneticky modifikovaných myší [30–32], nebo je indukována působením environmentálních faktorů na zvíře, jako je expozice xenobiotikům (např. 2-octynoic acid (2-OA) [32]) nebo působení infekční agens [33].
1.3.3 Primární sklerozující cholangitida(primary sclerosing cholangitis PSC)
Primární sklerozující cholangitida (primary sclerosing cholangitis PSC) patří mezi další chronické zánětlivé onemocnění jater postihující intra - a extrahepatické žlučové cesty a pomalu může progredovat k biliární cirhóze a jaternímu selhání. PSC se často vyskytuje u pacientů s nespecifickým střevním zánětem, zejména s ulcerózní kolitidou [34]. Klinické a laboratorní nálezy jako T-lymfocytární infiltrace v okolí cílových žlučovodů, přítomnost autoprotilátek pANCA (perinukleární autoprotilátky proti cytoplasmě neutrofilů, perinuclear antineutrophil cytoplasmatic antibodies) a spojitost s určitými HLA haplotypy a dalšími autoimunitními chorobami (UC) svědčí o autoimunitně zprostředkovaném mechanismu vzniku a progrese onemocnění. Ovšem v porovnání s jinými autoimunitními chorobami PSC špatně reaguje na imunosupresivní léčbu, vyskytuje se častěji u mužů (2–3 : 1) a je zde jen slabá korelace mezi hladinou sérových autoprotilátek s klinickými a laboratorními nálezy.
Pollheimer a Fickert [35] rozdělují zvířecí modely PSC do několika skupin dle mechanismu indukce onemocnění. Žádný z modelů ovšem ještě nezodpověděl všechny otázky týkající se patogeneze a progrese onemocnění.
1.3.4 Nealkoholická steatóza jater(non-alcoholic fatty liver disease NAFLD) a nealkoholická steatohepatitida(non-alcoholic steatohepatitis NASH)
NAFLD je v současné době nejčastějším chronickým progresivním jaterním onemocněním v rozvinutém světě, jehož prevalence se odhaduje až na 30 % populace. Ve většině případů je NAFLD úzce spojena s nadváhou a obezitou a s nimi spojenými metabolickými projevy, a to především inzulinovou rezistencí. Pokud jsou v játrech současně přítomny steatóza, zánět a poškození hepatocytů (balonová degenerace, ballooning), hovoříme o NASH, která může být doprovázena progresivní fibrózou a je spojena s vyšším rizikem vzniku hepatocelulárního karcinomu.
Nejlépe popsanými a nejčastěji používanými modely NAFLD jsou tzv. „dietary models“, kde je navozeno jaterní poškození změnami ve stravě modelového organismu. Různé typy diet jsou pro zvířecí modely NASH klíčové. Představují buď vlastní příčinu NASH, nebo slouží jako spouštěče jaterního poškození u geneticky modifikovaných modelů. Diety jsou založeny buď na kaloricky bohaté stravě – fruktózová dieta, high-fat diet (HFD) – nebo na deficitu určitých živin podílejících se na správném metabolismu tuků – methionine and choline deficient diet (MCD diet), choline-deficient L-amino acid-defined diet (CDAA diet). Z geneticky modifikovaných modelů se nejčastěji uplatňují modely myší s diabetem [36,37].
1.3.5 Modely virové hepatitidy
Studium virové hepatitidy B a C bylo dlouho omezeno na in vitro podmínky nebo na studie probíhající na jediném zvířeti, které je k infekci těmito hepatotropními viry vnímavé – na šimpanzovi [38,39]. Šimpanzí model hrál klíčovou roli při studiu interakce hostitel-vir a bylo na něm možno testovat první antivirové strategie v léčbě infekce. Přelomovým objevem bylo objevení buněčných receptorů pro HBV a HCV, díky nimž bylo možné vytvořit buněčné linie pro studium životního cyklu a jednotlivých virových komponent in vitro. Základních strategií tvorby in vivo myších modelů virové infekce je několik. Jednou z nich je exprese virových proteinů nebo receptorů pro lidské viry samotnými hepatocyty u transgenních myší [40]. Další možností je vytvoření chimerických myší, a to transplantací lidských hepatocytů imunodeficientním myším [41,42]. Imunodeficientní organismy ovšem nedovolují studium imunitních mechanismů. Z tohoto důvodu byly vyvinuty imunokompetentní modely (potkan), kterých bylo dosaženo současnou transplantací lidských krvetvorných kmenových buněk [43,44].
V současnosti máme tedy k dispozici množství modelů jak pro preklinické testování antivirové terapie (imunodeficitní), tak pro studium imunitní odpovědi na léčbu (imunokompetentní). Žádný z modelů ovšem nesplňuje všechna kritéria pro ideální model, a to zejména přechod do chronicity se vznikem jaterní cirhózy a eventuálně HCC [45,46].
1.4 Invazivní model jaterní fibrózy
Podvaz ductus hepaticus communis (bile duct ligation BDL) je invazivní metodou vyvolání sekundární biliární cirhózy. Obstrukce toku žluči způsobuje intrahepatální cholestázu, proliferaci žlučovodů, zánět v portobiliárních prostorech a fibrózu a vede ke vzniku sekundární biliární cirhózy a jaternímu selhání. BDL se provádí u potkanů, kteří nemají žlučník [47]
1.5 Geneticky modifikované myši jako zvířecí modely jaterních onemocnění
Geneticky modifikované myši se používají k modelování jaterní fibrózy, kdy vyřazení specifických genů nebo naopak jejich over-exprese umožňuje studium jejich fibrogenního nebo antifibrogenního vlivu exprimovaných faktorů [5]. Transgenní myši se uplatňují i při modelování specifických jaterních onemocnění, jak je uvedeno v předchozích kapitolách.
Závěr
Snahy o vytvoření zvířecích modelů jaterních onemocnění probíhají již několik desetiletí s většími či menšími úspěchy o přiblížení se průběhu jaterních chorob u lidí. Největší skupinu tvoří malé zvířecí modely reprezentované myšmi a potkany, které se využívají nejčastěji ke studiu etiopatogeneze a progrese onemocnění. Testování nových terapeutických přístupů, a to jak léků, tak invazivních metod, je ovšem z těchto modelů jen omezeně přenositelné do humánní medicíny.
Na druhou stranu velké zvířecí modely, ze kterých je často používaným modelem prase, představují spojující článek mezi experimentální medicínou a klinickou praxí. Uplatňují se zejména při studiu akutního selhání jater (Tab. 1), kde je velké zvíře jedním ze zásadních kritérií ideálního modelu, a stále častěji při vývoji nových chirurgických přístupů a invazivních terapeutických metod, jako jsou podpůrné jaterní systémy.
Využití anatomické a fyziologické podobnosti jater prasete s játry člověka může být s výhodou využito při přenosu výsledků experimentálních výzkumů do humánní klinické medicíny. Vývoj nových velkých zvířecích modelů jaterních onemocnění, např. v oblasti autoimunitních jaterních onemocnění, je ovšem zatížen řadou nevýhod spojených s prací s velkými zvířaty. Menší počet jedinců v porovnávaných skupinách ztěžuje statistické vyhodnocení experimentů s možným ovlivněním výsledků značnou interindividuální variabilitou. Oproti laboratorním hlodavcům by ale prasečí modely chronických jaterních onemocnění mohly přinést nové poznatky o mechanismech způsobujících jaterní poškození a umožnit tak přesnější diagnózu či účinnější léčbu našich pacientů.
Seznam zkratek
AIH – autoimunitní hepatitida, autoimmune hepatitis
ALD – akutní jaterní onemocnění, acute liver disease
ALF – akutní selhání jater, acute liver failure
AMA – antmitochondriální protilátky, anti-mitochondrial antibodies
ANA – antinukleární protilátky, antinuclear antibodies
APAP – acetaminophen
ASH – alkoholová steatohepatitida (alcoholic steatohepatitis)
ASMA – autoprotilátky proti hladkým svalovým buňkám, anti-smooth muscle antibodies
BAL – bioartificial liver
BDL – podvaz ductus hepaticus communis, bile duct ligation
CASH – steatohepatitida spojená s chemoterapií, chemotherapy-associated steatohepatitis
CDAA diet – choline-deficient L-amino acid-defined diet
CCl4 – tetrachlormethan
CLD – chronická jaterní onemocnění, chronic liver disease
DEN – diethylnitrosamin
DNM – dimethylnitrosamin
GVHD – reakce štěpu proti hostiteli, graft versus host disease
HBV – virus hepatitidy B, hepatitis B virus
HCC – hepatocelulární karcinom, hepatocellular carcinoma
HCV – virus hepatitidy C, hepatitis C virus
HFD – dieta bohatá na tuky, high-fat diet
MCD diet – methionine and cholin deficiency diet
MSC – mezenchymální kmenové buňky, mesenchymal stem cells
NAFLD – nealkoholická steatóza jater, non-alcoholic fatty liver disease
NAPQI – N-acetyl parabenzoquinoneimine
NASH – nealkoholická steatohepatitida, non-alcoholic steatohepatitis
NO – oxid dusnatý, nitric oxide
OLT – ortotopická transplantace jater, orthotopic liver transplantation
pANCA – perinukleární autoprotilátky proti cytoplasmě neutrofilů, perinuclear antineutrophil cytoplasmatic antibodies
PBC – primární biliární cirhóza, primary biliary cirrhosis
PSC – primární sklerozující cholangitida, primary sclerosing cholangitis
PVA – arterializace portální vény, portal vein arterialization
TAA – thioacetamid
UC – ulcerózní kolitida, ulcerative colitis
Podpora:
Program rozvoje vědních oborů Univerzity Karlovy (Progres Q39); Národní program udržitelnosti I (NPU I) č. LO1503 poskytovaný Ministerstvem školství, mládeže a tělovýchovy; SVV 260390 Univerzity Karlovy; Univerzitní výzkumná centra UK UNCE/MED/006 „Univerzitní centrum klinické a experimentální jaterní chirurgie“; Projekt Aplikace moderních technologií v medicíně a průmyslu reg. č.: CZ.02.1.01/0.0/0.0/17_048/0007280 financovaného z EFRR.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Anna Malečková
Ústav histologie a embryologie LF UK v Plzni
Karlovarská 48
301 00 Plzeň
Zdroje
- Van De Kerkhove MP, Hoekstra R, Van Gulik TM, et al. Large animal models of fulminant hepatic failure in artificial and bioartificial liver support research. Biomaterials 2004;25 : 1613–25.
- Rahman TM, Hodgson HJ. Animal models of acute hepatic failure. Int J Exp Pathol 2000;81 : 145–57.
- Newsome PN, Plevris JN, Nelson LJ, et al. Animal models of fulminant hepatic failure: a critical evaluation. Liver Transpl 2000;6 : 21–31.
- Liu Y, Meyer C, Xu C, et al. Animal models of chronic liver diseases. AJP Gastrointest. Liver Physiol 2013;304:G449–68.
- Starkel P, Leclercq IA. Animal models for the study of hepatic fibrosis. Best Pract Res Clin Gastroenterol 2011;25 : 319–33.
- Pálek R, Liška V, Třeška V, et al. Sinusoidal obstruction syndrome induced by monocrotaline in a large animal experiment – a pilot study. Rozhl Chir 2018;97 : 214–21.
- Fan YD, Praet M, Van Huysse J, et al. Effects of portal vein arterialization on liver regeneration after partial hepatectomy in the rat. Liver Transplant 2002;8 : 146–52.
- Zullo A, Cannistrà M, Cavallari G, et al. Liver regeneration induced by extracorporeal portal vein arterialization in a swine model of carbon tetrachloride intoxication. Transplant Proc 2015;47 : 2173–5.
- Hughes RD, Mitry RR, Dhawan A. Current status of hepatocyte transplantation. Transplantation 2012;93 : 342–7.
- Laleman W, Wilmer A, Evenepoel P, et al. Review article: Non-biological liver support in liver failure. Aliment Pharmacol Ther 2006;23 : 351–63.
- Ryska O, Pantoflíček T, Lásziková E, et al. Současný význam biologických a nebiologických eliminačních metod v léčbě akutního selhání jater. Rozhl Chir 2008;87 : 291–6.
- Losser M-R, Payen D. Mechanisms of liver damage. Semin Liver Dis 1996;16 : 357–67.
- Terblanche J, Hickman R. Animal models of fulminant hepatic failure. Dig Dis Sci 1991;36 : 770–4.
- Ladurner R, Hochleitner B, Schneeberger S, et al. Extended liver resection and hepatic ischemia in pigs: A new, potentially reversible model to induce acute liver failure and study artificial liver support systems. Eur Surg Res 2005;37 : 365–9.
- Sosef MN, Van Gulik TM. Total hepatectomy model in pigs: Revised method for vascular reconstruction using a rigid vascular prosthesis. Eur Surg Res 2004;36 : 8–12.
- Thiel C, Thiel K, Etspueler A, et al. Standardized intensive care unit management in an anhepatic pig model: new standards for analyzing liver support systems. Crit Care 2010;14:R138.
- Nieuwoudt M, Kunnike R, Smuts M, et al. Standardization criteria for an ischemic surgical model of acute hepatic failure in pigs. Biomaterials 2006;27 : 3836–45.
- Lee KU, Zheng L, Cho YB, et al. An experimental animal model of fulminant hepatic failure in pigs. J Korean Med Sci 2005;20 : 427–32.
- Saracyn M. Hepatoprotective effect of nitric oxide in experimental model of acute hepatic failure. World J Gastroenterol 2014;20 : 17407.
- Carvalho NR, Tassi CC, Dobraschinski F, et al. Reversal of bioenergetics dysfunction by diphenyl diselenide is critical to protection against the acetaminophen-induced acute liver failure. Life Sci 2017;180 : 42–50.
- Zhang S, Zhu Z, Wang Y, et al. Therapeutic potential of Bama miniature pig adipose stem cells induced hepatocytes in a mouse model with acute liver failure. Cytotechnology 2018;70 : 1131−41.
- Kalpana K, Ong HS, Soo KC, et al. An improved model of galactosamine-induced fulminant hepatic failure in the pig. J Surg Res 1999;82 : 121–30.
- Thiel C, Thiel K, Etspueler A, et al. A reproducible porcine model of acute liver failure induced by intrajejunal acetaminophen administration. Eur Surg Res 2011;46 : 118–26.
- Nayak NC, Chopra P, Dhar A, et al. Diverse mechanisms of hepatocellular injuries due to chemicals: evidence in rats administered carbon tetrachloride or dimethylnitrosamine. Br J Exp Pathol 1975;56 : 103–12.
- Ghosh Dastidar S, Warner J, Warner D, et al. Rodent models of alcoholic liver disease: Role of binge ethanol administration. Biomolecules 2018;8 : 3.
- Christen U, Holdener M, Hintermann E. Animal models of autoimmune hepatitis. Autoimmun Rev 2007;6 : 306–11.
- Oertelt S, Rieger R, Selmi C, et al. A sensitive bead assay for antimitochondrial antibodies: Chipping away at AMA-negative primary biliary cirrhosis. Hepatology 2007;45 : 659–65.
- Tanaka A, Leung PSC, Young HA, et al. Toward solving the etiological mystery of primary biliary cholangitis. Hepatol Commun 2017;1 : 275–87.
- Katsumi T, Tomita K, Leung PSC, et al. Animal models of primary biliary cirrhosis. Clin Rev Allergy Immunol 2015;48 : 142–53.
- Koarada S, Wu Y, Fertig N, et al. Genetic control of autoimmunity: Protection from diabetes, but spontaneous autoimmune biliary disease in a nonobese diabetic congenic strain. J Immunol. 2004;173 : 2315–23.
- Oertelt S, Lian Z-X, Cheng C-M et al. Anti-mitochondrial antibodies and primary biliary cirrhosis in TGF - receptor II dominant-negative mice. J Immunol 2006;177 : 1655–60.
- Wakabayashi K, Lian Z-X, Moritoki Y, et al. IL-2 receptor α−/ − mice and the development of primary biliary cirrhosis. Hepatology 2006;44 : 1240–9.
- Wang JJ, Yang GX, Zhang WC, et al. Escherichia coli infection induces autoimmune cholangitis and anti-mitochondrial antibodies in non-obese diabetic (NOD).B6 (Idd10/Idd18) mice. Clin Exp Immunol 2014;175 : 192–201.
- Fausa O, Schrumpf E, Elgjo K. Relationship of inflammatory bowel disease and primary sclerosing cholangitis. Semin Liver Dis 1991;11 : 31–9.
- Pollheimer MJ, Fickert P. Animal models in primary biliary cirrhosis and primary sclerosing cholangitis. Clin Rev Allergy Immunol 2015;48 : 207–17.
- Santhekadur PK, Kumar DP, Sanyal AJ. Preclinical models of non-alcoholic fatty liver disease. J Hepatol 2018;68 : 230–7.
- Van Herck MA, Vonghia L, Francque SM. Animal models of nonalcoholic fatty liver disease—a starter’s guide. Nutrients 2017;9 : 1–13.
- Bukh J. A critical role for the chimpanzee model in the study of hepatitis C. Hepatology 2004;39 : 1469–75.
- Wieland SF. The chimpanzee model for hepatitis B virus infection. Cold Spring Harb. Perspect Med 2015;5 : 1–19.
- Moriya K, Fujie H, Shintani Y, et al. The core protein of hepatitis C virus induces hepatocellular carcinoma in transgenic mice. Nat Med 1998;4 : 1065–7.
- Dandri M, Burda MR, Török E, et al. Repopulation of mouse liver with human hepatocytes and in vivo infection with hepatitis B virus. Hepatology 2001;33 : 981–8.
- Bissig K-D, Wieland SF, Tran P, et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment. J Clin Invest 2010;120 : 924–30.
- Washburn ML, Bility MT, Zhang L, et al. A humanized mouse model to study hepatitis C virus infection, immune response, and liver disease. Gastroenterology 2011;140 : 1334–44.
- Billerbeck E, Mommersteeg MC, Shlomai A, et al. Humanized mice efficiently engrafted with fetal hepatoblasts and syngeneic immune cells develop human monocytes and NK cells. J Hepatol 2016;65 : 334–43.
- Vercauteren K, De Jong YP, Meuleman P. HCV animal models and liver disease. J Hepatol 2014;61:S26–33.
- Dandri M, Petersen J. Animal models of HBV infection. Best Pract Res Clin Gastroenterol 2017;31 : 273–9.
- Abd El Motteleb DM, Ibrahim IAAEH, Elshazly SM. Sildenafil protects against bile duct ligation induced hepatic fibrosis in rats: Potential role for silent information regulator 1 (SIRT1). Toxicol Appl Pharmacol 2017;335 : 64–71.
- Michalopoulos GK. Liver regeneration after partial hepatectomy. Am J Pathol 2010;176 : 2–13.
- Abrahamse SL, Van De Kerkhove MP, Sosef MN, et al. Treatment of acute liver failure in pigs reduces hepatocyte function in a bioartificial liver support system. Int J Artif Organs 2002;25 : 966–74.
- Lee J-H, Lee D-H, Lee S, et al. Functional evaluation of a bioartificial liver support system using immobilized hepatocyte spheroids in a porcine model of acute liver failure. Sci Rep 2017;7 : 3804. doi: 10.1038/s41598-017-03424-2.
- Lv G, Zhao L, Zhang A et al. Bioartificial liver system based on choanoid fluidized bed bioreactor improve the survival time of fulminant hepatic failure pigs. Biotechnol Bioeng 2011;108 : 2229–36.
- Sang J-F, Shi X-L, Han B, et al. Intraportal mesenchymal stem cell transplantation prevents acute liver failure through promoting cell proliferation and inhibiting apoptosis. Hepatobiliary Pancreat Dis Int 2016;15 : 602–11.
- He G-L, Feng L, Cai L, et al. Artificial liver support in pigs with acetaminophen-induced acute liver failure. World J Gastroenterol 2017;23 : 3262.
- Saxena R. Practical hepatic pathology: A diagnostic approach. Elsevier/Saunders, Philadelphia 2011.
- Hamid M, Abdulrahim Y, Liu D, et al. The hepatoprotective effect of selenium-enriched yeast and gum Arabic combination on carbon tetrachloride-induced chronic liver injury in rats. J. Food Sci 2018;83 : 525–34.
- Ma L, Yang X, Wei R, et al. MicroRNA-214 promotes hepatic stellate cell activation and liver fibrosis by suppressing Sufu expression. Cell Death Dis 2018;9 : 1–13.
- Alam MF, Safhi MM, Anwer T, et al. Therapeutic potential of Vanillylacetone against CCl4 induced hepatotoxicity by suppressing the serum marker, oxidative stress, inflammatory cytokines and apoptosis in Swiss albino mice. Exp Mol Pathol 2018;105 : 81–8.
- Sung YC, Liu YC, Chao PH, et al. Combined delivery of sorafenib and a MEK inhibitor using CXCR4-targeted nanoparticles reduces hepatic fibrosis and prevents tumor development. Theranostics 2018;8 : 894–905.
- Czechowska G, Celinski K, Korolczuk A, et al. Protective effects of melatonin against thioacetamide-induced liver fibrosis in rats. J Physiol Pharmacol 2015;66 : 567–79.
- Mazagova M, Wang L, Anfora AT, et al. Commensal microbiota is hepatoprotective and prevents liver fibrosis in mice. FASEB J 2015;29 : 1043–55.
- Chandel R, Saxena R, Das A, et al. Association of rno-miR-183-96-182 cluster with diethyinitrosamine induced liver fibrosis in Wistar rats. J Cell Biochem 2018;119 : 4072–84.
- Jilkova ZM, Kuyucu AZ, Kurma K, et al. Combination of AKT inhibitor ARQ 092 and sorafenib potentiates inhibition of tumor progression in cirrhotic rat model of hepatocellular carcinoma. Oncotarget 2018;9 : 11145–58.
- Marrone AK, Shpyleva S, Chappell G, et al. Differentially expressed microRNAs provide mechanistic insight into fibrosis-associated liver carcinogenesis in mice. Mol Carcinog 2016;55 : 808–17.
- King PD, Perry MC. Hepatotoxicity of chemotherapy. Oncologist 2001;6 : 162–76.
- Nakamura K, Hatano E, Narita M, et al. Sorafenib attenuates monocrotaline-induced sinusoidal obstruction syndrome in rats through suppression of JNK and MMP-9. J. Hepatol 2012;57 : 1037–43.
- Robinson SM, Mann DA, Manas DM, et al. The potential contribution of tumour-related factors to the development of FOLFOX-induced sinusoidal obstruction syndrome. Br J Cancer 2013;109 : 2396–403.
- Bruha J, Vycital O, Tonar Z, et al. Monoclonal antibody against transforming growth factor beta 1 does not influence liver regeneration after resection. Large Animal Experiments 2015;340 : 327–40.
- Chen X, Ying X, Sun W, et al. The therapeutic effect of fraxetin on ethanol-induced hepatic fibrosis by enhancing ethanol metabolism, inhibiting oxidative stress and modulating inflammatory mediators in rats. Int Immunopharmacol 2018;56 : 98–104.
- Choi Y, Abdelmegeed MA, Song BJ. Preventive effects of indole-3-carbinol against alcohol-induced liver injury in mice via antioxidant, anti-inflammatory, and anti-apoptotic mechanisms: Role of gut-liver-adipose tissue axis. J Nutr Biochem 2018;55 : 12–25.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2019 Číslo 3- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Zvířecí modely jaterních onemocnění a jejich využití v experimentální chirurgii
- Přínos hodnocení perfuze pomocí fluorescenční angiografie při robotické nízké resekci rekta: výsledky nerandomizované prospektivní studie
- Dysfágia po prednej krčnej diskektómii a intersomatickej fúzii – prospektívna štúdia s jednoročným sledovaním
- Primární Ewingův sarkom v retroperitoneu
- Synoviální cysta vycházející z kyčelního kloubu prezentující se jako stehenní kýla – kazuistika
- Distální intestinální obstrukční syndrom u pacienta s cystickou fibrózou po transplantaci plic
- Zemřel primář Michal Leško
- Pracovní dny Koloproktologické sekce České chirurgické společnosti ČLS JEP
- Všeobecná chirurgie?
- Současný pohled na protézy v herniologii (kýlní síťky) – klasifikace, indikace, výhody a nevýhody jednotlivých materiálů, komplikace
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný pohled na protézy v herniologii (kýlní síťky) – klasifikace, indikace, výhody a nevýhody jednotlivých materiálů, komplikace
- Synoviální cysta vycházející z kyčelního kloubu prezentující se jako stehenní kýla – kazuistika
- Distální intestinální obstrukční syndrom u pacienta s cystickou fibrózou po transplantaci plic
- Zemřel primář Michal Leško
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



