-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Echokardiografie a antikoagulační léčba u nemocných s embolickou CMP
Echocardiography and anticoagulation treatment of patients with cardioembolic stroke
Cardioembolism accounts for 20–25 % of ischemic strokes. Transthoracic echocardiography (TTE) can detect potential cardiac source of embolism in left atrium, on mitral or aortic valve (thrombi, myxoma, vegetation) or detect mitral valve disease. It is well recognized that rheumatic valvular heart disease is a risk factor for stroke. Left ventricular dysfunction, when severe, can lead to thromboembolism and stasis of blood flow within the heart. Transesophageal echocardiography (TEE) is more sensitive than TTE in the detection of potential cardiogenic sources of emboli. The sensitivity is nearly 100% in detecting left atrial thrombi, spontaneous echo contrast, atrial septal aneurysm, interatrial shunts supportive of a possible paradoxical cerebral embolus, ventricular thrombi or aneurysm. TEE is reported to reveal a left atrial appendage thrombus in roughly 10 % of patients with nonvalvular atrial fibrillation and in 20 to 40 % of patients with recent thromboembolism.
It is reported a significantly higher prevalence of patent foramen ovale in patients with ischemic stroke who were younger than 55 years of age. In detecting left atrial thrombi, spontaneous echo contrast, atrial septal aneurysm, interatrial shunts supportive of a possible paradoxical cerebral embolus, ventricular thrombi or aneurysm, or myxomatous mitral valve was 8 % when transthoracic echocardiography was performed and 46 % when transesophageal echocardiography was performed. The echocardiographic finding can decide in a fundamental way on the indication for anticoagulation treatment and thus reduce the risk of relapse of stroke.Key words:
stroke, echocardiography, anticoagulation treatment.
Autoři: J. Chlumský 1; M. Bojar 2
Působiště autorů: Univerzita Karlova v Praze 2. lékařská fakulta a Fakultní nemocnice Motol ; Interní klinika Přednosta: prof. MUDr. Milan Kvapil, CSc., MBA. 1; Neurologická klinika Přednosta: doc. MUDr. Martin Bojar, CSc. 2
Vyšlo v časopise: Prakt. Lék. 2009; 89(9): 482-487
Kategorie: Přehledy
Souhrn
Cévní mozkové příhody (CMP) embolické etiologie tvoří 20–25 % ischemických příhod. Transtorakální echokardiografie (TTE) diagnostikuje větší útvary v levé síni nebo v oblasti mitrální či aortální chlopně (tromby, myxomy, vegetace), nebo prokáže a kvantifikuje mitrální vady. Porevmatická mitrální vada je výrazným rizkem pro vznik CMP. Důležitým údajem je velikost levé síně, jejíž zvětšení zvyšuje pravděpodobnost embolizační CMP. Těžká dysfunkce levé srdeční komory se stázou krve a vnikem trombu rovněž znamená vysoké riziko tromboembolie. Transezofageální echokardiografie (TEE) je oproti TTE citlivější v diagnostice zdroje embolizace ze srdce. TEE má téměř 100% senzitivitu v průkazu trombů levé síně, spontánního echokontrastu, aneuryzmatu septa síní nebo zkratu na úrovni síní, který podporuje diagnózu paradoxní embolizace. U asymptomatických nemocných s fibrilací síní prokážeme trombus v oušku levé síně v 10 % vyšetření, u nemocných s čerstvou příhodou v 20–40 %.
Otevřené foramen ovale je často prokazatelné u nemocných s CMP ve věku do 55 let. Tromby v levé síní, spontánní echokontrast, aneuryzma septa síní, zkrat v oblasti septa síní, tromby nebo aneuryzma levé srdeční komory zjišťujeme při vyšetření TTE u 8 % nemocných, a při vyšetření TEE u 46 % nemocných. Echokardiografický nález může zásadním podílem rozhodnout o indikaci k antikoagulační léčbě a tím snížit riziko recidivy CMP.Klíčová slova:
cévní mozková příhoda, echokardiografie, antikoagulační léčba.Úvod
Embolické CMP mohou vzniknout embolií ze srdce nebo velkých cév a způsobují pětinu ischemických CMP. Pro embolické CMP je charakteristický těžší průběh, vyšší úmrtnost a vyšší výskyt recidiv (18). Vyznačují se častěji poruchami vědomí, náhlým začátkem, současným postižením více mozkových teritorií, hemoragickou transformací ischemického ložiska, nebo časnou rekanalizací uzavřené cévy (14). Častější je rovněž porucha vidění nebo afázie, naopak bolest hlavy nebo křeče nejsou typické pro embolickou CMP (34).
Hemoragická transformace nastává u 20–40 % nemocných s ischemickou CMP, a to většinou během prvního týdne. V případě embolických CMP je popisována až v 71 % (30). Podezření na embolii do CNS zvyšuje nález průchodné cévy v místě infarktu při angiografii nebo transkraniální dopplerovské sonografii. Transkraniální dopplerovská sonografie je zároveň přínosná pro průkaz nitrosrdečních zkratů (29), které mohou být příčinou paradoxní embolizace.
V klinické praxi nález fibrilace síní, porevmatické srdeční vady nebo umělé chlopně je sám o sobě dostatečný k vyslovení diagnózy embolické mozkové příhody (11). Paroxysmální fibrilace síní je významnou příčinou embolizace a vyžaduje Holterovskou monitoraci EKG v prvních 48 hodinách po vzniku CMP (6).
Embolizace ze srdce nejčastěji směřuje do CNS a embolizační CMP tvoří 50 až 80 % embolizačních příhod ze srdečního zdroje.
Transtorakální echokardiografie
U všech nemocných s embolizací do periferie je indikovaná transtorakální echokardiografie (TTE). S výjimkou 5–10 % nemocných, kteří pro emfyzém nebo anatomické důvody nejsou vyšetřitelní transtorakálním přístupem, nám vyšetření zodpoví čtyři otázky (27):
- TTE může diagnostikovat větší útvary v levé síni či oblasti mitrální nebo aortální chlopně. Těmito útvary jsou větší tromby či myxomy síní nebo vegetace na mitrální či aortální chlopni. Nutno však zdůraznit, že nejde o diagnostiku časnou, protože rozlišovací schopnost transtorakálního vyšetření je omezená na větší útvary. V praxi je v těchto případech senzitivita TTE se zaměřením na tromby levé síně nebo vegetace na chlopních pouze 60 %, tedy velice nízká.
- TTE diagnostikuje mitrální vady, které významně zvyšují riziko tromboembolie u nemocných jak se sinusovým rytmem, tak s fibrilací síní.
- Velikost levé síně je rovněž zásadní údaj. Rozměr nad 25 mm/m2 plochy těla významně zvyšuje pravděpodobnost embolizace.
- TTE bezpečně diagnostikuje tromby levé srdeční komory. Vyskytují se u nemocných v prvních dnech po srdečním infarktu přední stěny, nebo v jizvě či aneuryzmatu po srdečním infarktu – tedy zásadně v místě poruchy kinetiky při echokardiografickém vyšetření. Trombolýza nesnižuje pravděpodobnost výskytu trombu, pouze heparinizace s následnou antikoagulační léčbou zabrání jejímu vzniku. Často lze tromby prokázat u nemocných s dilatovanou kardiomyopatií. Tromby levé komory mohou samy vymizet, je však nutno zdůraznit, že ve 20 % dochází k embolizaci.
Citlivost TTE je 85 %, a pokud je nemocný dobře vyšetřitelný, tak doplnění vyšetření transezofageálním přístupem nepřináší další podstatné informace.
Jícnová echokardiografie
Jícnová echokardiografie (TEE) je již invazivním vyšetřením, vyžadujícím spolupráci nemocného a zkušeného echokardiografisty. Při TEE je jícnová sonda umístěna v jícnu, což umožňuje lepší zobrazení síní, ouška levé síně a oblasti chlopní. TEE v současnosti indikujeme prakticky u všech nemocných s podezřením na embolizaci ze srdce.
Nejčastějším nálezem jsou tromby levé síně, pro něž je TEE 100% senzitivní. TEE nám rovněž zobrazí ouško levé síně, kde se nachází více než polovina trombů levé síně, a které je při TTE zcela nevyšetřitelné. Nejčastěji nacházíme tromby levé síně u nemocných s mitrální stenózou různé závažnosti, přítomnost fibrilace síní zvyšuje až trojnásobně nález trombů (44). Proto je důležité provést TEE u všech nemocných s mitrální stenózou, a to i v případech lehké vady se sinusovým rytmem (27).
Z intrakardiálních tumorů je nejčastější myxom levé síně a embolizace je v 25 až 50 % jeho první klinickou manifestací. TEE je suverénní metodou k jeho průkazu a u nemocných mladších 40 let postačuje toto vyšetření k indikaci operačního odstranění (45).
Aneuryzma septa síní prokazujeme u 1 % jedinců vyšetřených TEE. Je definováno jako vychylování septa síní v průběhu srdečního cyklu o více než 1,5 cm do pravé nebo levé síně. Při tomto nálezu je jeho nositel vystaven rovněž riziku paradoxní embolizace, neboť v 50 % nacházíme otevřené foramen ovale (36).
V oblasti aneuryzmatu se mohou tvořit destičkové tromby, které pohybem septa snadno embolizují. V tomto případě je doporučována léčba kyselinou acetylsalicylovou.
Otevřené foramen ovale je v populaci přítomno u 25 % osob. Při TEE je třeba po něm pátrat a vyšetření doplňovat použitím echokontrastu současně s Valsalvovým manévrem. Otevřené foramen ovale se častěji nachází u mladších nemocných, u kterých musíme pátrat po hluboké žilní trombóze již při diagnóze embolizace. Hodnocení ale vyžaduje zkušeného lékaře.
Popisovaná shoda nálezů mezi vyšetřujícími dosahuje v jednotlivých studiích 0,77-0,82. Rozpor v nálezu aneurysmatu septa síní dosahuje 6 %, velikost foramen ovale je odlišná u 10 % a významnost zkratu se liší u 26 % nemocných (39).
Otevřené foramen ovale (FOP) se vyskytuje u 25–30 % nemocných s CMP, zejména u mladších nemocných s velikostí zkratu 2–8 mm (24). Aneuryzma septa síní je popisováno u 0,5–4 % vyšetření jícnovou echokardiografií (1). Nemocní s FOP častěji trpí migrénou.
Studie sledující prognózu těchto nemocných prokázala zvýšené riziko CMP pouze u nemocných s přítomností jak aneuryzmatu, tak i otevřeného foramen ovale (9).
Defekt septa síní je nejčastější vrozenou srdeční vadou v dospělosti a podobně jako FOP ohrožuje nositele paradoxní embolizací. Dělí se anatomicky na typ sekundum, primum a sinus venosus. Citlivost TEE je ve zkušených rukou stoprocentní. Rovněž v tomto případě je vhodné v nejasných případech podat nemocnému echokontrast, čímž dosáhneme vyšší citlivosti vyšetření proti užití barevného dopplerovského mapování.
Spontánní echokontrast prokazujeme velice často v levé síní při TEE hlavně u nemocných s mitrální stenózou nebo fibrilací síní, ve 30–40 % u nemocných s fibrilací síní a u 1 % nemocných se objeví po úspěšné kardioverzi. Jeho výskyt souvisí se stázou krve a hladinou fibrinogenu v séru. Proto může být přítomen v levé síni pouze přechodně, např. u predisponovaných jedinců se objeví při infekční chorobě, která vede ke zvýšení hladiny sérového fibrinogenu (45). Při vyšetření dělá dojem „mlhy” a odhaluje nemocné se zvýšeným rizikem tromboembolie.
Spontánní echokontrast se vždy nachází u nemocných s trombem v levé síni a naopak při zjištění echokontrastu v polovině případů prokážeme trombus (46). Jde tedy o jednoznačný pretrombotický stav. Je jen otázkou, zda všichni nemocní bez embolizace s nálezem echokontrastu mají být antikoagulováni. Současná doporučení Evropské kardiologické společnosti spontánní echokontrast považují za faktor ovlivňující rozhodnutí o intenzitě antikoagulační léčby (41).
Mitrální anulární kalcifikaci, při které se mohou z kalcifikované chlopně uvolnit kousky vápníku, prokazujeme vzácněji. Prolaps mitrální chlopně ohrožuje nemocné dvěma způsoby:
- Jednak může způsobit významnou mitrální insuficienci s dilatací levé síně a tvorbou trombů – z tohoto důvodu tyto nemocné antikoagulujeme (4).
- U nemocných bez výraznější insuficience se na prolabujícím cípu mohou tvořit destičkové tromby s vyšším rizikem embolizace. Tyto nemocné léčíme kyselinou acetylsalicylovou.
Prolaps mitrální chlopně se nachází u 6 % populace – převážně u mladých žen. Je však též popisován jako artefakt, například při hypovolemii. Podle současných doporučení, zpřísňujících diagnostiku prolapsu, je jeho incidence podstatně nižší (38). U mladých nemocných prokazujeme myxomatozní degeneraci, redundantní tkáň chlopně a časté supraventrikulární arytmie.
Endokarditida na nativní chlopni vede k embolizaci až u 30 % nemocných. TTE je při snaze o časnou diagnostiku a léčbu infekční endokarditidy málo citlivá, takže TEE často odhalí několikamilimetrové vegetace u nemocných s normálním nálezem při transtorakálním vyšetření.
Embolizace se vyskytují při nálezu jak infekčních, tak i neinfekčních vegetací. Neinfekční endokarditida je komplikací nádorů, systémového lupusu nebo antifosfolipidového syndromu. V případě embolizace je u těchto nemocných indikovaná antikoagulační léčba warfarinem.
Infekční endokarditida je komplikována embolizací až u 10 % nemocných, a to zejména v prvních dvou týdnech léčby. Riziko embolizace souvisí s velikostí a pohyblivostí vegetace. Vyšší riziko se popisuje při infekci zlatým stafylokokem (43). Sami jme pozorovali několik nemocných s embolizací do periferie či CNS, včetně jednoho nemocného, kde embolie do koronární tepny způsobila srdeční infarkt manifestující se náhlou smrtí (27).
Jícnová echokardiografie prokazuje vegetace větší než 2 mm, rozlišovací schopnost transtorakální echokardiografie je podstatně horší (45).
Antikoagulační léčba warfarinem nebo heparinem zvyšuje riziko embolizace, proto tuto léčbu nezahajujeme. Pouze u antikoagulovaných nemocných – kdy antikoagulace je indikovaná z důvodu umělé chlopně – léčbu ponecháváme (22). Rizikovost vegetace stran embolizace rozhoduje o případném operačním odstranění vegetace po přeléčení akutního stavu.
Embolizace u nemocného s umělou chlopní je absolutní indikací k TEE. Při vyšetření pátráme po trombech v oblasti protézy, vzácněji pak prokážeme vegetace (37).
Aorta je v posledních letech ve středu pozornosti echokardiografistů. Aneuryzma aorty je vzácnou příčinou embolizace, naopak ateromy patří k častým nálezům. Ateromy, které se zobrazují jako hyperechogenní útvary prominující do lumina aorty, mohou být přisedlé, prominující, mobilní či dokonce s tromby na povrchu. Jejich velikost, jakož i pohyblivost či přítomnost trombů, zvyšuje riziko embolie.
Prevalence větších ateromů aorty u nemocných s CMP dosahuje 14–20 %, což je srovnatelné s nálezem stenózy karotidy (10–13 %) nebo fibrilace síní (18 až 30 %) v této populaci nemocných.
Při vyšetření TEE v neselektovaných souborech se ateromy aorty vyskytují u 44 % nemocných, komplexní ateromy větší než 4 mm u 7,5 % nemocných. Frekvence nálezů ateromů stoupá v průběhu aorty, v ascendentní aortě jsou nacházeny u 8 % nemocných, v oblouku 31 % a v descendentní aortě u 45 procent nemocných (31).
Patologicko-anatomické studie prokázaly, že ateromy s ulceracemi jsou přítomny u 26 % nemocných s anamnézou CMP, ale jen u 5 % osob z kontrolního souboru. U 25–50 % nemocných jsou na větších ateromech mobilní tromby. Ateromy aorty větší než 4 mm jsou nacházeny u nemocných s CMP 3–9 krát častěji, a kalkulované riziko těchto ateromů pro vznik CMP je 1,6–4,3 (32). Roční riziko CMP u těchto nemocných dosahuje až 10 %. Navíc nález ulcerace, snížené echogenity a větší pohyblivost ateromů dále zvyšuje riziko recidivy embolizační příhody.
Nález ateromů aorty je výrazem generalizované aterosklerózy a koreluje s věkem, kouřením, diabetem, hypertenzí, nálezem stenózy v karotickém nebo koronárním řečišti. Dále i se sérovou koncentrací homocysteinu, C reaktivního proteinu a hypertrofií levé srdeční komory.
Zlatým standardem zobrazení ateromů aorty je TEE (25). TTE zobrazí ateromy jen u části nemocných. Angiografie, počítačová tomografie a magnetická rezonance nejsou v našich podmínkách k zobrazení ateromů rutinně používány.
Léčebný postup u těchto nemocných zahrnuje antiagregační léčbu kyselinou acetylsalicylovou v kombinaci se statiny. Antikoagulační léčba warfarinem nesnižuje riziko embolizace ateromových plátů (12). Pouze ve studii SPAF III a několika malých studiích antikoagulační léčba warfarinem snižovala riziko CMP (13). Tyto výsledky jsou vysvětlovány tím, že část ateromů je komplexních a mobilních s tromby, jejichž embolizace je antikoagulační léčbou snížena.
Embolie mnohdy nastává při manipulaci s aortou při srdeční operaci, balónkové kontrapulzaci nebo při katetrizačním vyšetření. Důležité jsou terapeutické odlišnosti ateromů. Jestliže ateromy s tromby vyžadují antikoagulační léčbu, u ateromů bez trombů naopak podáváme kyselinu acetylsalicylovou.
Léčebný postup shrnuje tabulka 1. Antikoagulační léčba (INR 2–3) je indikovaná při nálezu trombu nebo echokontrastu v levé síni, otevřeném foramen ovale, defektu septa síní, pohyblivých trombech v aortě nebo trombu v levé srdeční komoře. Léčba kyselinou acetylsalicylovou je indikovaná u nemocných s prolapsem mitrální chlopně, aneuryzmatu septa síní a přisedlých ateromech v aortě (18).
Tab. 1. Léčba nemocných v závislosti na echokardiografickém nálezu. 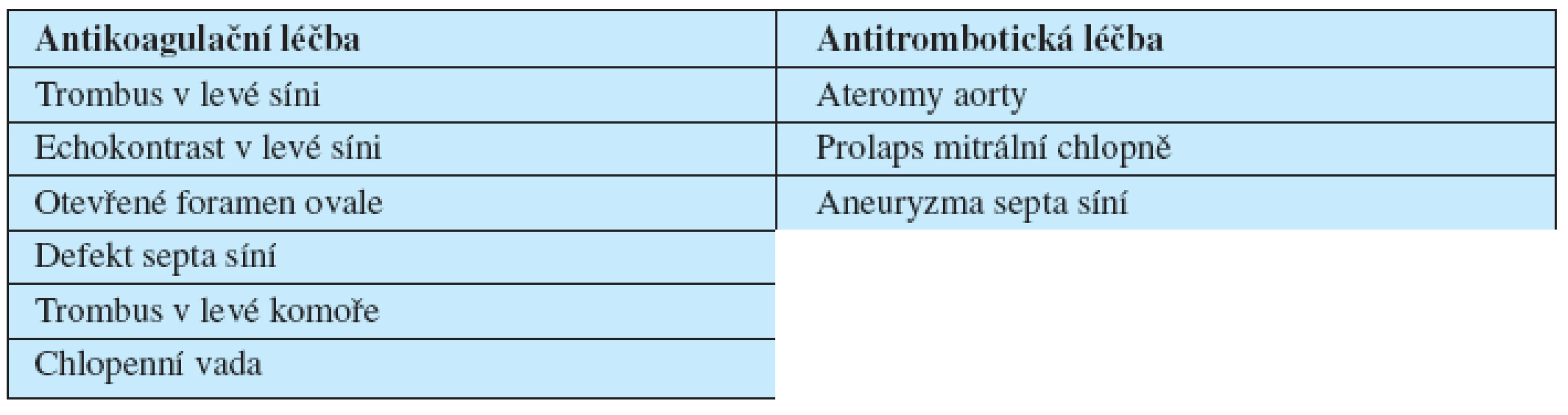
TTE na základě současných znalostí a výsledků našich studií dnes provádíme u všech nemocných s ischemickou CMP. TEE indikujeme u nemocných se sinusovým rytmem, kde předpokládáme podle anamnézy, klinického nálezu nebo TTE přítomnost patologického nálezu indikovaného k antikoagulační léčbě.
Vyšetření TEE u všech nemocných s ischemickou CMP (CMPi) není doposud v klinické praxi možné a ani přínosné. Naše studie z roku 1996, kdy jsme provedli TEE u 52 nemocných s CMPi a fibrilací síní, potvrdila vysoký záchyt patologických nálezů; 34 % nemocných mělo trombus nebo spontánní echokontrast v levé síni, dalších 13 % nemocných mělo jiné patologické nálezy. Proto je TEE v současnosti v této skupině nemocných indikována pouze v případě diferenciálně diagnostických problémů nebo relativních kontraindikací antikoagulační léčby (27).
Jiná situace je u nemocných se sinusovým rytmem, u nichž je embolizační etiologie méně pravděpodobná. TEE jsme provedli u 159 nemocných s CMPi a sinusovým rytmem a trombus v levé síni nebo spontánní echokontrast byl zjištěn u 14,5 % nemocných. Přítomnost tohoto nálezu korelovala s velikostí levé síně, u nemocných s rozměrem levé síně 48–50 mm jsme trombus popřípadě echokontrast prokázali téměř v polovině případů (28).
Antikoagulační léčba
Antikoagulační léčba s cílovou hodnotou INR 2–3 vede ke snížení rizika recidivy CMPi o 64 % ve srovnání s placebem a o 48 % ve srovnání s léčbou ASA (5). Warfarin snižuje riziko embolických příhod u všech nemocných s fibrilací síní (16). Výjimkou jsou nemocní do 65 let s nerevmatickou fibrilaci síní bez rizikových faktorů, kterými jsou hypertenze, diabetes, anamnéza embolické příhody a srdeční selhání (7).
Nemocní nad 75 let profitují nejvíce z antikoagulační léčby, ale na druhé straně mají vyšší riziko krvácivých komplikací (27, 35). Antikoagulační léčba s INR pod 1,5 nepřináší klinický efekt (17).
Antikoagulační nebo antiagregační léčba u nemocných s nerevmatickou fibrilací síní
V roce 1985 vstoupil první nemocný do randomizované studie, sledující vliv antikoagulační léčby v prevenci vzniku CMPi. Od té doby jsou k dispozici data týkající se více než 13 000 pacientů z více než 25 studií.
Antikoagulační léčba je dnes v prevenci CMPi u nemocných s fibrilací síní přesně definovaná. Metaanalýza 16 studií ukázala při léčbě warfarinem s cílovým INR 2–3 snížení rizika CMPi o 62 %. Absolutní riziko embolizace bylo v primární prevenci nižší o 2,7 %, v sekundární prevenci o 8,4 % ročně.
Kyselina acetylsalicylová (ASA) snížila riziko embolizace o 27 %, což v absolutních číslech znamená snížení v primární prevenci 1,5 % a v sekundární prevenci o 2,5 % ročně. Ve srovnání s léčbou warfarinem byla účinnost léčby ASA 36 % (26). Znamená to, že nemocné s nižším rizikem embolizace léčíme ASA, vyšší riziko embolizace je indikací k plné antikoagulační léčbě. U nemocných starších 75 let někteří autoři považují za výhodnější udržovat INR v hodnotách 1,7–2,5, což zaručuje nižší riziko krvácení při zachování antikoagulačního efektu (19). Pokles INR pod 1,7 ale zdvojnásobuje riziko embolizace, na druhé straně ke krvácení dochází nejčastěji při hodnotách INR nad 3,5 (42).
Otázku zahájení léčby u nemocného s fibrilací síní bez anamnézy CMPi nebo TIA sledovala nedávno publikovaná metaanalýza. Zhodnotila 9 studií, kde bylo léčeno 9 598 nemocných s fibrilací síní v rámci primární prevence CMPi buď ASA v dávce 75–325 mg denně, nebo warfarinem v plné terapeutické dávce (3). Při průměrné délce sledování 1,9 roku bylo zjištěno při léčbě warfarinem oproti léčbě ASA snížení rizika vzniku CMP o 32 %, CMPi o 47 %, fatálního CMP o 29 %, srdečního infarktu o 31 % a systémové embolizace o 52 %. Celková úmrtnost ovlivněna nebyla, a riziko intracerebrálního krvácení bylo dvojnásobně zvýšeno.
Význam antikoagulační léčby warfarinem ukázala studie ACTIWE W, která byla publikovaná v roce 2007. Nemocní s fibrilací síní při léčbě warfarinem měli významně nižší riziko CMPi, embolie, srdečního infarktu nebo úmrtí ve srovnání s užíváním ASA s klopidogrelem (8).
Riziko embolizace lze spočítat podle skóre CHADS2 (tab. 2) a následně podle rizika určit způsob léčby (tab. 3). Přehled primární a sekundární prevence CMP při fibrilaci siní shrnuje tab. 4.
Tab. 2. Výpočet CHADS2 skóre. 
*Skóre počítáno: srdeční selhávání, hypertenze, věk >75, diabetes = 1 bod; CMP nebo TIA = 2 body Tab. 3. Praktické doporučení k antikoagulační léčby u nemocných s fibrilací síní. 
Tab. 4. Prevence CMP u nemocných s fibrilací síní. 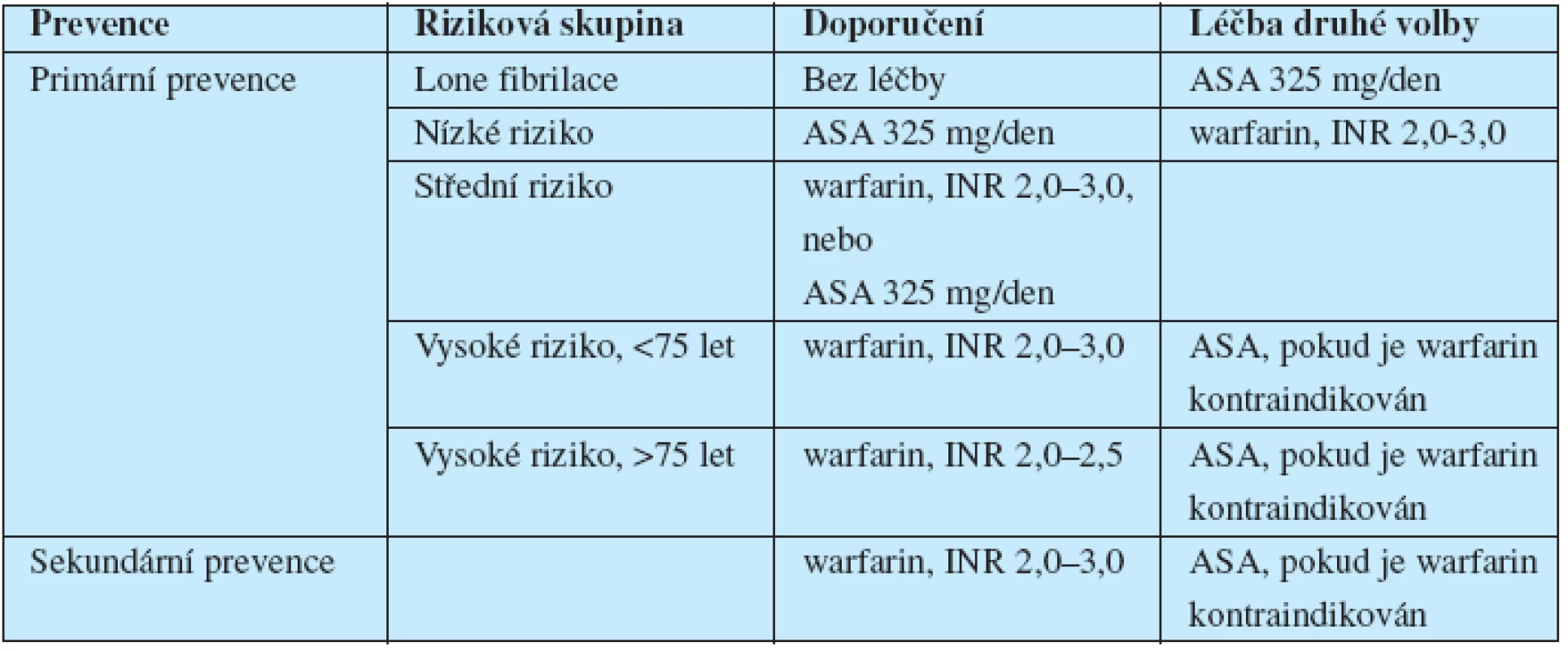
Carl von Walraven v metaanalýze zhodnotil individuální riziko každého nemocného v 6 studiích, zabývajících se prevencí CMPi při fibrilaci síní (47). Antikoagulační léčba ve srovnání s léčbou ASA snížila riziko CMPi o 45 %, CMPi o 52 % a srdeční příhody o 29 %. Na druhé straně riziko krvácení bylo vyšší o 71 %. Paroxysmální fibrilace síní byla stejně riziková jako trvalá fibrilace síní. Léčba warfarinem oproti ASA u 1 000 nemocných s fibrilací síní zabrání ročně vzniku 23 CMPi a vede k devětkrát častějším krvácivým příhodám.
Zcela nedávno byla publikována poslední metaanalýza, která zhodnotila 29 relevantních studií, publikovaných od roku 1966 do března 2007. Do těchto studií bylo zařazeno 28 044 nemocných průměrného věku 71 let, sledovaných v průměru 1,5 roku (21). Antikoagulační léčba warfarinem proti placebu snížila riziko CMPi o 64 % a celkovou úmrtnost o 25 %. Samotná léčba ASA snížila riziko vzniku CMPi o 22 %. Riziko vzniku CMPi bylo sníženo při léčbě warfarinem ve srovnání s léčbou ASA o 39 %. Analýza studií ukázala pouze malé zvýšení rizika krvácivých příhod, a to o méně než 0,3 % za jeden rok léčby.
Zhodnocení protokolů užívajících nízké dávky warfarinu v kombinaci s ASA přineslo zklamání. Studie SPAF III (1998) prokázala čtyřnásobné riziko embolizace u rizikových nemocných při léčbě nízkou dávkou warfarinu s ASA ve srovnání s plnou antikoagulací (20). Navíc tato léčba vedla ke zvýšenému riziku krvácení. Na základě těchto výsledků byly předčasně ukončeny tři studie.
Studie AFASAK-2 (The Second Copenhagen Atrial Fibrilation Aspirin Anticoagulation Trial) a PATAF (Primary Prevention of Arterial Tromboembolism in Patients with Non-Valvular Atrial Fibrilation in general practice) rovněž potvrdily vyšší riziko krvácení i embolizace při kombinační léčbě nízkou dávkou warfarinu s ASA ve srovnání s plnou antikoagulační léčbou warfarinem (10).
Výsledky těchto studií však nejsou překvapující, uvědomíme-li si, že pokles INR pod 2,0 zvyšuje riziko embolizace při fibrilaci síní (2). Při léčbě kombinací nízkou dávkou warfarinu a ASA nejsou ovlivněny markery trombogeneze (D-dimer, fragmenty protrombinu 1+2), ani aktivace krevních destiček, na rozdíl od plné antikoagulace, kdy tyto markery jsou léčbou zcela normalizovány (5).
Vlastní zkušenosti
V roce 1994 byla na interní klinice 2. LF UK ve FN Motol zavedena do diagnostického algoritmu u nemocných s CMPi nejprve TTE, a následně i TEE. Po dovybavení sonografického pracoviště v roce 1999 byla do rutinního provozu uvedena sonografie karotid. Zmíněné metody vedly ve spolupráci s pracovníky neurologické kliniky 2. LF UK ve FN Motol k významnému posunu v rozhodování o léčebném postupu těchto nemocných.
V letech 1995, 2000 a 2006 jsme retrospektivně zhodnotili u našich nemocných využití ultrazvukových metod a jejich vliv na indikaci k zahájení antikoagulační léčby warfarinem. Výsledky ukazuje tabulka 5.
Tab. 5. Využití ultrazvukových metod u nemocných s ischemickou CMP. 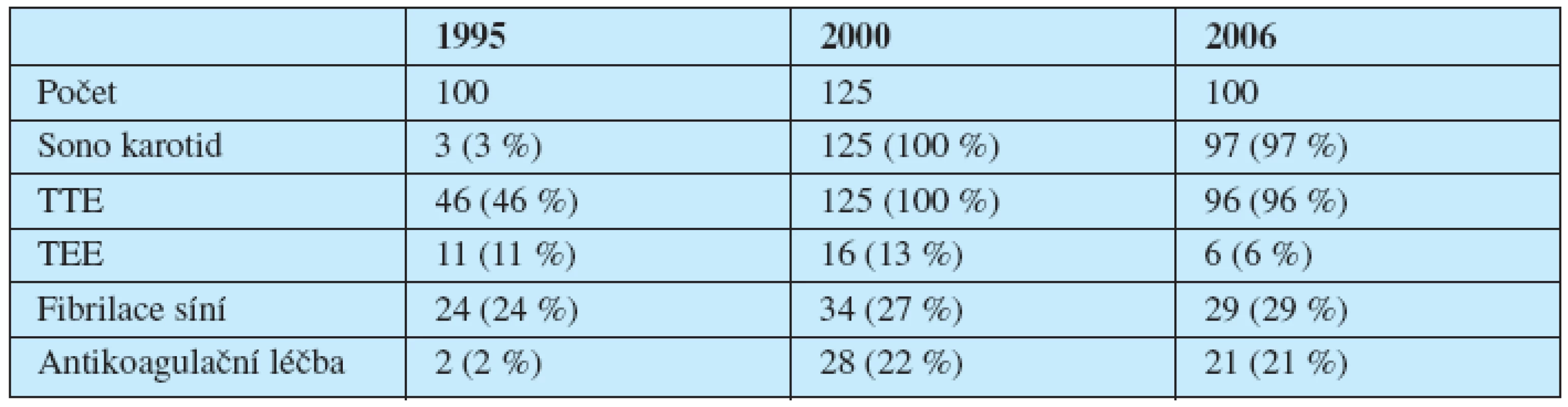
Soubor nemocných z roku 1995 ukazuje na špatnou dostupnost sonografie karotid u našich nemocných a ani TTE nepatřila do základního vyšetřovacího postupu. Naopak TEE byla relativně často používána a často právě u nemocných s fibrilací síní, kde bychom ji podle současných znalostí neindikovali. Od roku 1996 (27) užíváme vlastní schéma diagnostického postupu (graf 1).
Graf 1. Algoritmus indikace echokardiografického vyšetření a antikoagulační léčby u nemocných s ischemickou CMP. 
V roce 2000 a 2006 prakticky všichni nemocní měli provedeno sonografické vyšetření karotid a TTE. Naopak indikace k TEE vykazují pokles, který je způsoben výsledky studií publikovaných po roce 2000 (4, 14, 43) i vlastními zkušenostmi (27). Nicméně procento nemocných, u kterých byla zahájena antikoagulační léčba, zůstává téměř nezměněno.
Diskuse
Současné znalosti o významu antikoagulační léčby vycházejí z mnoha klinických studií s přísným výběrem nemocných (15). Například ze studii SPAF bylo vyřazeno přes 90 % nemocných s fibrilací síní. Vycházíme-li z výsledků takto navržených studií, pak často léčíme nemocné jiné věkové kategorie s jiným spektrem rizik, jinou motivací k léčbě a jinou kvalitou monitorace léčby (19).
Antikoagulační léčba u nemocných s fibrilací síní je nedostatečná. Na rozdíl od ostatních indikací k antikoagulační léčbě, máme v případě fibrilace síní mnoho dat o nízkém počtu antikoagulovaných nemocných. Evropská observační studie prokázala antikoagulační léčbu jen u 16 % nemocných přijatých do nemocnice s CMPi a fibrilací síní, 25 % nemocných propuštěných z nemocnice v Birminghamu s nově zjištěnou fibrilací síní bylo léčeno warfarinem a v několika studiích z USA užívalo antikoagulační léky 16–50 % nemocných s fibrilací síní (23). Počet léčených nemocných výrazně klesal u nemocných starších 80 let (40).
Monitorace antikoagulační léčby se v praxi rovněž liší oproti klinickým studiím (14). Kontroly INR jsou prováděny méně často (38 dní oproti doporučovaným 28 dnům), INR se pohybuje v terapeutickém rozmezí méně často (50 % dnů proti 68 % dnů ve studiích).
Specializované ambulance pro péči o antikoagulované nemocné vykazují podle zahraničních dat (23) snížení rizika krvácivých i tromboembolických příhod na jednu třetinu ve srovnání s běžnou péčí (tabulka 6). Stejně pozitivně se projevuje u nás zatím nedostupný self-monitoring protrombinového času.
Tab. 6. Srovnání komplikací antikoagulační léčby ve specializované nebo běžné ambulanci. 
doc. MUDr. Jaromír Chlumský, Ph.D.
Interní klinika 2. LF UK ve FN Motol
V úvalu 84
150 00 Praha 5
E-mail: monicka@mediclub.cz
Zdroje
1. Adams, H.P. Patent foramen ovale: paradoxical embolism and paradoxical data. Mayo Clin. Proc. 2004, 79, p. 15-20.
2. Abdelhafiz, A.H. A Review of anticoagulation with warfarin in patients with nonvalvular atrial fibrillation. Clin. Therap. 2001, 23, p. 1628-1636.
3. Aquilar, M.I., Hart, R.G., Pearce, L.A. Oral anticoagulants versus antiplatelet therapy for preventing stroke in patients with non-valvular atrial fibrillation and no history of stroke or transient ischemic attacks. Cochrane Database Syst. Rev. 2007, 3, CD006186.
4. Barnett, H.M. Stroke by cause. Some common, some exotic, some controversial. Stroke 2005, 36, p. 2523-2525.
5. Bath, P.M., Zhao, L., Heptinstall, S. Current status of stroke prevention in patients with atrial fibrillation. Eur. J. Cardiol. 2005, 7, Suppl, p. C12-C18.
6. Bell, C., Kapral, M. Use of ambulatory electrocardiography for the detection of paroxysmal atrial fibrillation in patients with stroke. Canadian Task Force on Preventive Health Care. Can. J. Neurol. Sci. 2000, 27, p. 25-32.
7. Cauli, C., Barcellona, D., Marongiu, F. Oral anticoagulant therapy in the primary and secondary prophylaxis of stroke. Ital. Heart J. 2003, 4, p. 755-767.
8. Connolly, S., Pogue, J., Hart, R.G. et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial Fibrillation Clopidogrel Trial with Irbesartan for Prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006, 367, p. 1877-1878.
9. Corboy, J.R. Patent foramen ovale, atrial septal aneurysm, and recurrent stroke. N. Engl. J. Med. 2002, 346, p. 1331-1332.
10. Emmerich, J., Heuzey, L.J-Y., Bath, P.M.W., Connolly, S.J. Indication for antithrombotic therapy for atrial fibrillation: reconciling the guidelines with clinical practise. Eur. J. Cardiol. 2005, 7, Suppl, p. C28-C33.
11. Ferro, J.M. Cardioembolic stroke: an update. Lancet Neurology 2003, 2, p. 177-188.
12. Furberg, C.D. Natural statins and stroke risk. Circulation 1999, 99, p. 185-188.
13. Fuster, V., Ryden, L.E., Cannom, D.S. et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation-executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines. J. Am. Coll. Cardiol. 2006, 48, p. 854-906.
14. Gage, B.F., van Walraven, C., Pearce, L. Selecting patients with atrial fibrillation for anticoagulation: stroke risk stratification in patients taking aspirin. Circulation 2004, 110, p. 2287-2292.
15. Go, A.S., Hylek, E.M., Chang, Y. Anticoagulation therapy for stroke prevention in atrial fibrillation: how well do randomized trials translate into clinical practice? JAMA 2003, 290, p. 2685-2692.
16. Gorelick, P.B., Sacco, R.L., Smith, D.B. et al. Prevention of a first stroke: a review of guidelines and a multidisciplinary consensus statement from the National Stroke Association. JAMA 1999, 281, p. 1112-1120.
17. Hardman, S.M.C., Cowie, M.R. Anticoagulation in heart disease. BMJ 1999, 318, p. 238-244.
18. Hart, R.G., Halperin, J.L. Atrial fibrillation and thromboembolism: a decade of progress in stroke prevention. Ann. Intern. Med. 1999, 131, p. 688-695.
19. Hart, R.G., Halperin, J.L., Pearce, L.A. Lessons from the stroke prevention in atrial fibrillation trials. Ann. Intern. Med. 2003, 138, p. 831-838.
20. Hart, R.G., Tonarelli, S.B., Pearce, L.A. Avoiding central nervous system bleeding during antithrombotic therapy: recent data and ideas. Stroke 2005, 36, 1588-1593.
21. Hart, R.G., Pearce, L.A., Aguillar, M.I. Meta-analysis: Antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann. Intern. Med. 2007, 146, p. 857-867.
22. Heiro, M., Nikoskelainen, J., Engblom, E. Neurologic manifestations of infective endocarditis: a 17-year experience in a teaching hospital in Finland. Arch. Intern. Med. 2000, 160, p. 2781-2787.
23. Hirsh, J. Current anticoagulant therapy - unmet clinical needs. Thromb. Res. 2003, 109, S1-S8.
24. Homma, S., Di Tullio, M.R., Sacco, R.L. Surgical closure of patent foramen ovale in cryptogenic stroke patients. Stroke 1997, 28, p. 2376-2381.
25. Husain, A.M., Alter, M. Transesophageal echocardiography in diagnosing cardioembolic stroke. Clin. Cardiol. 1995, 18, p. 705-708.
26. Chaves, C.J., Caplan, L.R. Heparin and oral anticoagulants in the treatment of brain ischemia. J. Neurol. Sci. 2000, 173, p. 3-9.
27. Chlumský, J. Antikoagulační léčba. Praha: Grada, 2005, 235 s.
28. Chlumský, J., Charvát, J. Echocardiography and carotid sonography in diabetic patients after cerebrovascular attacks. J. Int. Med. Res. 2006, 34, p. 689-694.
29. Iqbal, M.B., Tajena, A.K., Lip, G.Y.H. et al. Recent developments in atrial fibrillation. BMJ 2005, 330, p. 238-243.
30. Jorgensen, H.S., Nakayama, H., Reith, J. et al. Acute stroke with atrial fibrillation. The Copenhagen Study. Stroke 1996, 27, p. 1765-1769.
31. Kapral, M.K., Silver, F.L. Preventive health care, 1999 update: 2. Echocardiography for the detection of a cardiac source of embolus in patients with stroke. Canadian Task Force on Preventive Health Care. CMAJ 1999, 161, p. 989-996.
32. Kronzon, I., Tunick, P.A. Transesophageal echocardiography as a tool in the evaluation of patients with embolic disorders. Progr. Cardiovasc. Dis. 1993, 36, p. 39-60.
33. Kronzon, I., Tunick, P.A. Aortic atherosclerotic disease and stroke. Circulation 2006, 114, p. 63-75.
34. Lin, H.J., Wolf, P.A., Kelly-Hayes, M. et al. Stroke severity in atrial fibrillation. The Framingham study. Stroke 1996, 27, p. 1760-1764.
35. Mant, J., Hobbs, F.D.R., Fletcher, K. on behalf of the BAFTA investigators and the Midland Research Practices Network (MidReC), Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007, 370, p. 493-503.
36. Mattioli, A. V., Aquilina, M., Oldani, A. Atrial septal aneurysm as a cardioembolic source in adult patients with stroke and normal carotid arteries. A multicentre study. Eur. Heart J. 2001, 22, p. 261 - 268.
37. McNamara, R.L., Tamarou, L.J., Segal, J.B. et al. Management of atrial fibrillation: review of the evidence for the role of pharmacologic therapy, electrical cardioversion, and echocardiography. Ann. Intern. Med. 2003, 139, p. 1018-1033.
38. Meissner, I., Whisnant, J.P., Khandheria, B.K. Prevalence of potential risk factors for stroke assessed by transesophageal echocardiography and carotid ultrasonography: the SPARC study. Stroke Prevention Assessment of Risk in a Community. Mayo Clin. Proc. 1999, 74, p. 862-869.
39. Messé, S.R., Silverman, I.E., Kizer, J.R. Practice parameter: recurrent stroke with patent foramen ovale and atrial septal aneurysm: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2004, 62, p. 1042-1050.
40. Rash, A., Downes, T., Portner, R. et al. A randomised controlled trial of warfarin versus aspirin for stroke prevention in octogenarians with atrial fibrillation (WASPO). Age Ageing 2007, 36, p. 151-156.
41. Shermann, D.G. Stroke prevention in atrial fibrillation. Pharmacological rate versus rhythm control. Stroke 2007, 38, p. 615-617.
42. Son-Hing, M.M., Laupacis, A. Balancing the risks of stroke and upper gastrointestinal tract bleeding in older patients with atrial fibrillation. Arch. Intern. Med. 2002, 162, p. 541-550.
43. Strandberg, M., Marttila, R.J., Helenius, H., Hartiala, J. Transoesophageal echocardiography in selecting patients for anticoagulation after ischaemic stroke or transient ischemic attack. J. Neurol. Neurosurgery Psychiatry 2002, 73, p. 29-33.
44. Tan, C.N., Fraser, A.G. Transesophageal echocardiography and cardiovascular source of embolism. Anestesiology 2007, 107, p. 333-346.
45. Toman, J. Nitrosrdeční útvary a zdroje embolií. In Niederle P. Echokardiografie 1.díl. Praha: Triton 2003.
46. Uslu, N., Nurkalem, Z., Orhan, A.L. et al. Transthoracic echocardiographic predictors of the left atrial appendage contraction velocity in stroke patients with sinus rhythm. Tokohu J. Exp. Med. 2006, 20, p. 291-298.
47. Van Walraven, C., Hart, R.G., Singer, D.E. et al. Oral anticoagulants vs aspirin in nonvalvular atrial fibrillation: an individual patient meta-analysis. JAMA 2002, 288, p. 2441-2448.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2009 Číslo 9- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Helsinská deklarace Světové lékařské asociace (WMA)
- Koncepce oboru všeobecné praktické lékařství
- Dříve vyslovená přání aneb o lidské svobodě a důstojnosti
- Echokardiografie a antikoagulační léčba u nemocných s embolickou CMP
- Demence v ordinaci praktického lékaře
- Sebepoškozování – závažný symptom a nebezpečný společenský jev
- Životní styl mladých zdravých žen s rozdílným kuřáckým chováním
- Syndrom vyhoření a posudkoví lékaři
- Deprese a úzkost těhotných žen
- Recenze
- Hudba a zpěv v životě J. E. Purkyně
- Miniportréty slavných českých lékařů: Profesor MUDr. Bohumil Prusík – zakladatel české angiologie
- Čtyřicet let s Rozhledy v chirugii
- Düsseldorfský veletrh MEDICA oslavuje čtyřicátiny
- Kolonoskopie pomáhá zachraňovat životy
- Redakční pošta: Náhle vzniklá dramatická porucha vnímání chuti
- Vybrané kapitoly z medicínskej etiky
- Klíšťata jsou stále nebezpečná: Boj proti klíšťatům nemá konce!
- Blok I
- Blok II
- Blok III
- Blok IV
- Jubilea
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Deprese a úzkost těhotných žen
- Sebepoškozování – závažný symptom a nebezpečný společenský jev
- Demence v ordinaci praktického lékaře
- Echokardiografie a antikoagulační léčba u nemocných s embolickou CMP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



