-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nekonvenční typy dysplastických změn ve sliznici gastrointestinálního traktu – přehled morfologie jednotlivých podtypů
Non-conventional types of dysplastic changes in gastrointestinal tract mucosa – review of morphological features of individual subtypes
Evaluation of the dysplastic changes evolving in mucosa of various segments of gastrointestinal tract is a part of routine practice. Morphologically different or non-conventional types of dysplastic changes are described in the mucosa of gastrointestinal tract besides the most common conventional type of dysplasia. Non-conventional dysplasias can arise de-novo or they can be found in association with chronic gastrointestinal conditions, such as Barrett’s esophagus, chronic atrophic gastritis, and inflammatory bowel disease. Non-conventional types of dysplasia include serrated, crypt base of foveolar dysplasia and lesions as pyloric or oxyntic gland adenoma. Non-conventional types of dysplasia arising in inflammatory bowel disease represent specific category with broad morphological spectrum of changes. The aim of this work is to present a comprehensive review of morphological characteristics of individual subtypes of non-conventional dysplastic changes with focus on differences and specificity in particular parts of gastrointestinal tract and provide a functional handout for daily diagnostic practice.
Keywords:
Dysplasia – intraepithelial neoplasia – non-conventional type – foveolar dysplasia – serrated dysplasia – IBD-associated dysplasia
Autoři: Kateřina Kamaradová 1,2
Působiště autorů: Fingerlandův ústav patologie, Fakultní nemocnice Hradec Králové 1; AeskuLab Patologie k. s., Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 1, p. 38-51
Kategorie: Přehledový článek
Souhrn
Posouzení rozvoje dysplastických změn je součástí rutinního hodnocení bioptických vzorků z různých etáží gastrointestinálního traktu. Kromě nejčastějšího typu, tzv. konvenční dysplázie, jsou ve sliznici trávicího traktu popisovány také morfologicky odlišné speciální typy dysplastických změn, které lze shrnout pod pojmem nekonvenční dysplázie. Nekonvenční typy dysplastických změn mohou vznikat de novo nebo v terénu chronických onemocnění trávicího traktu jako je Barrettův jícen, chronická atrofická gastritida či idiopatické střevní záněty. Mezi nekonvenční typy dysplastických změn spadá pilovitá, kryptová či foveolární dysplázie a léze jako pylorický adenom nebo adenom z oxyntických žlázek. Nekonvenční typy dysplázií vznikající v terénu idiopatických střevních zánětů pak představují dosti specifickou kategorii s širokým morfologickým spektrem změn. Cílem tohoto doškolovacího textu je přinést zevrubný popis morfologických charakteristik jednotlivých podtypů nekonvenčních dysplastických změn s důrazem na rozdíly a specifika v jednotlivých etážích gastrointestinálního traktu a poskytnout tak přehledný materiál pro každodenní diagnostickou praxi.
Klíčová slova:
dysplázie – intraepiteliální neoplázie – nekonvenční typ – foveolární dysplázie – pilovitá dysplázie – IBD-asociovaná dysplázie
Hodnocení přítomnosti dysplastických změn je součástí rutinního hodnocení bioptických vzorků z různých etáží gastrointestinálního traktu (GIT). Nejčastější a nejlépe charakterizovaná je dysplázie standardně popisovaná v klasických adenomech tlustého střeva vznikající ve sliznici intestinálního typu. (1) K tomuto typu dysplázie se nyní často přidává přídomek konvenční nebo adenomová dysplázie. Konvenční dysplázie se může vyskytovat i v jiných úsecích GIT, kde vzniká např. v terénu chronického zánětu či intestinální metaplázie jako je Barrettův jícen, chronická atrofická gastritida nebo idiopatické střevní záněty (IBD). (1)
Dlouhodobé sledování pacientů a nárůst endoskopických vyšetření a biopsií vedlo k detekci a rozpoznání širšího spektra prekancerózních lézí a odhalení méně častých a morfologicky odlišných podtypů dysplázií v jednotlivých etážích GIT. (1) Tyto léze lze shrnout pod pojmem nekonvenční typy dysplázie a je možné je v základu rozdělit na nekonvenční dysplázie intestinálního a neintestinální typu. Mezi intestinální nekonvenční dysplázie spadá jednak pilovitá dysplázie a tzv. kryptová dysplázie (dysplázie bazálních krypt, v anglické literatuře basal crypt dysplasia, BCD), resp. dysplázie jamek (v anglické literatuře pit dysplasia) popisovaná především v jícnu a v žaludku. (2,3) Pilovitá dysplázie je přítomná v pilovitých lézích tlustého střeva včetně pacientů s IBD, popsána je ale také v tenkém střevě (4-6), v žaludku (7) a vzácně i v jícnu. (8) Neintestinální typ nekonvenční dysplázie zahrnuje především foveolární typ dysplázie vyskytující se v jícnu, žaludku a duodenu, pylorický typ dysplázie resp. pylorický adenom žaludku a duodena a v neposlední řadě oxyntickou dysplázii resp. oxyntický adenom žaludku. (9-11) Dosti specifickou kategorií jsou pak nekonvenční typy dysplázií vznikající v terénu idiopatických střevních zánětů, kterým bude věnována samostatná kapitola tohoto textu. (12-14)
Hlavním předmětem tohoto sdělení je tedy ucelený přehled a morfologická charakteristika nekonvenčních typů dysplázie v jednotlivých etážích GIT.
Nicméně je vhodné na tomto místě zopakovat také morfologickou charakteristiku konvenční dysplázie. Dle obecné definice dysplázie představuje jednoznačně neoplastický epitel bez známek invaze do lamina propria sliznice. (15) Konvenční adenomatózní dysplázie (intraepiteliální neoplázie) je charakterizována hypercelularitou, zvětšením velikosti jader s hyperchromázií, jejich shlukováním, variabilitou uložení a stratifikací, postupnou ztrátou polarity a změnami v charakteru jaderného chromatinu a přítomností mitóz. (16) V současné době je užíváno dvoustupňové dělení na dysplázii nízkého stupně (low-grade dysplázie, LGD) a dysplázii vysokého stupně (high-grade dysplázie, HGD). (17) U konvenční dysplázie nízkého stupně jsou jádra relativně uniformní a tužkovitá, obvykle umístěná v dolní polovině buňky se zachovanou polaritou a cytoplazmou na luminální straně. (obr. 1) S přibývajícím stupněm dysplázie mohou být jádra vezikulární a oválná s patrným jadérkem. V cytoplazmě dochází ke ztrátě hlenu nebo se objevují dystrofické či atypické pohárkové buňky s reverzní polaritou. High-grade dysplázie také vykazuje nápadnější stratifikaci jader, která se přemisťují apikálním směrem a jeví nápadnější pleomorfie. High-grade dysplázie navíc kombinuje komplexní architektonické změny ve formě shlukujících se žlázek nepravidelného tvaru. Žlázky se často větví nebo jsou kribriformní a v lumen může být přítomen nekrotický detritus. Architektonické změny vždy musí doprovázet cytologické změny jako ztráta polarity buněk, zvětšení jader s patrnými jadérky či hrubý chromatin a hojná mitotická aktivita včetně atypických mitóz. (16-17) (obr. 2)
Obr. 1. Konvenční dysplázie, low-grade. Low-grade dysplastické změny v konvenčním tubulovilózním adenomu tlustého střeva. Jádra jsou protáhlá, stratifikovaná, převážně při bazi, s disperzními mitózami (hematoxylin a eosin, 40x). 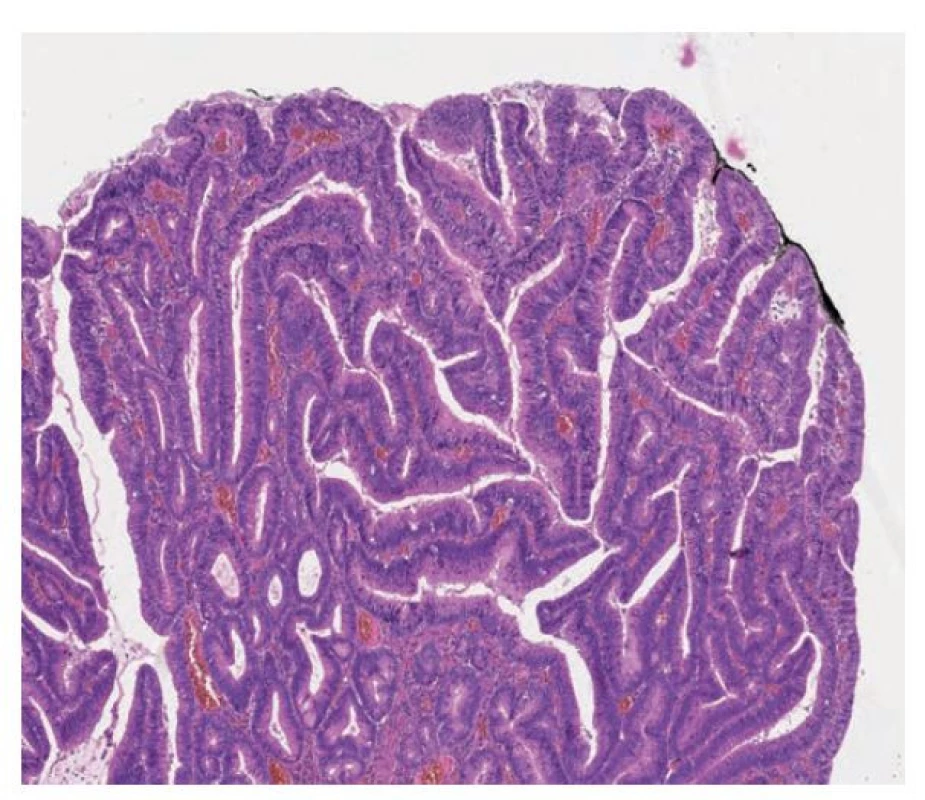
Obr. 2. Konvenční dysplázie, high-grade. High-grade dysplastické změny kombinující komplexní změny architektoniky s větvením a pučením žlázek, výraznou stratifikaci jader a nápadnou mitotickou aktivitou (hematoxylin a eosin, 200x). 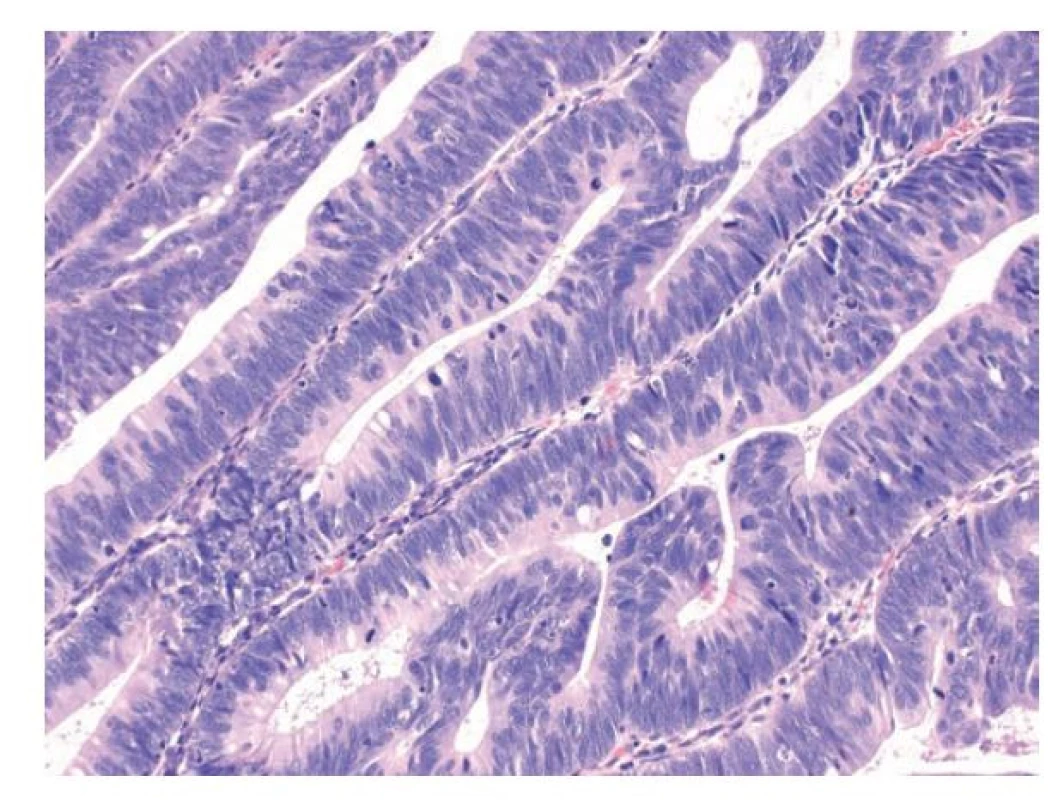
NEKONVENČNÍ DYSPLÁZIE INTESTINÁLNÍHO TYPU
Kryptová dysplázie (basal crypt dysplasia (BCD), dysplázie jamek, dysplázie s povrchovou maturací)
Kryptová dysplázie je relativně nový a pro některé autory kontroverzní koncept dysplastické léze vycházející ze studií prekurzorových změn především v Barrettově jícnu a v žaludeční sliznici. (2,3,18-20) Histologicky vykazuje kryptová dysplázie jaderný pleomorfismus a pseudostratifikace jader a de fakto splňuje kritéria konvenční dysplázie, nicméně tyto změny jsou limitované především na baze krypt. Klíčovým morfologickým znakem je vyzrávání povrchové části epitelu nad atypickými žlázkami. Přítomné mohou být i architektonické změny, které obvykle postihují menší skupiny krypt (průměrně 5) a zahrnují nejčastěji shlukování, pučení a větvení žlázek. Na základě přítomnosti architektonických změn a výrazných pleomorfií dělí někteří autoři BCD na low-grade a high-grade typ. (obr. 3) (2,3)
Obr. 3. Kryptová dysplázie. Dysplastické změny v bazálních kryptách v terénu intestinální metaplázie Barrettova jícnu. Povrchový epitel vyzrává (hematoxylin a eosin, 200x). 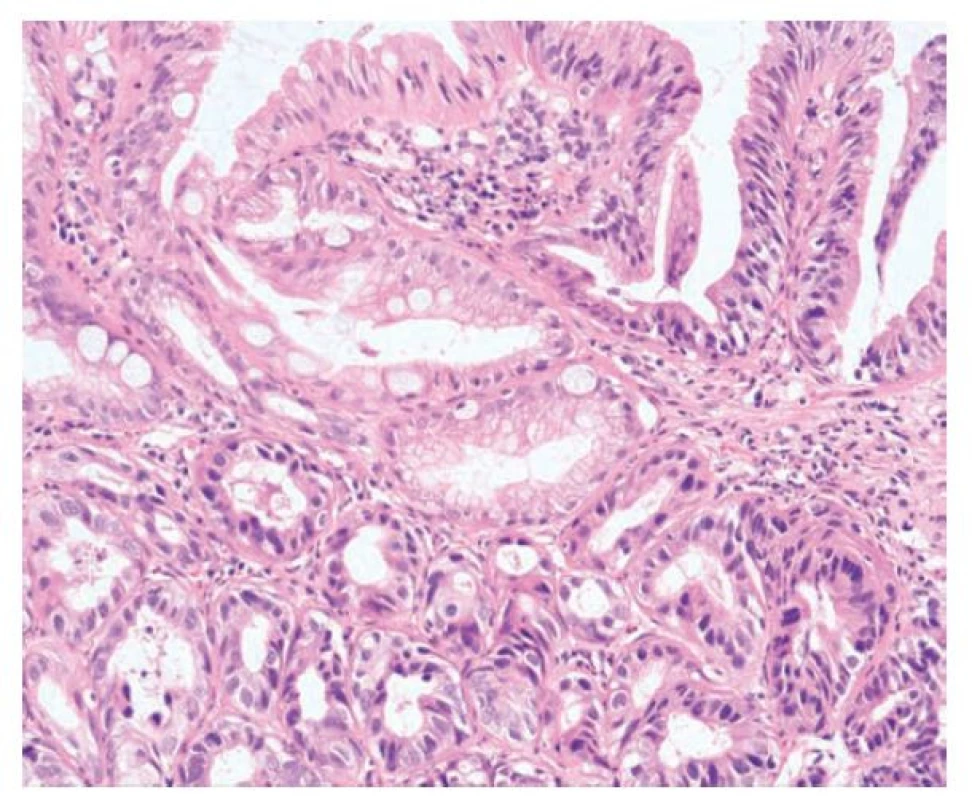
Diagnostika tohoto typu dysplázie je obtížná především stran odlišení od regenerativního epitelu. V Barrettově jícnu jsou to především běžně přítomné lehké atypie v metaplastickém epitelu s mírným zvětšením jader a výraznější proliferační aktivitou (tzv. metaplastické atypie). (21) Pro dysplázii pak svědčí spíše ostrý přechod mezi dysplastickým a normálním epitelem a chybění aktivního zánětu v okolí, který by vysvětloval jaderné atypie. (2,21) Někteří autoři pak spíše než diagnózu BCD raději volí kategorii „neurčitý pro dysplázii“ (indefinite for dysplasia). (20,22)
Úseky s kryptovou dysplázií v jícnu i žaludku, bez ohledu na grade, mohou být spojeny s aberantní expresí p53 a vyšší proliferační aktivitou v Ki-67 oproti okolní sliznici. (2,18,19,23) Nicméně aberantní exprese může být přítomna i v reaktivním a regenerujícím epitelu (až 10 % případů), což může limitovat diagnostické využití těchto markerů. (24) Kryptová dysplázie obvykle vykazuje intestinální fenotyp s expresí CDX2 a MUC2. Kryptová dysplázie v žaludku může vykazovat i hybridní nebo gastrický fenotyp s expresí MUC5AC a MUC6. (3,19,23). Ve více než 50 % případů BCD jícnu byla prokázána aneuploidie a významný rozdíl oproti přilehlému vyzrávajícímu povrchovému epitelu, nicméně jiná studie popsala výskyt stejné mutace v dysplastickém i zralém povrchové epitelu a teoretickou možnost reverzní maturace epitelu. (25,26)
Prevalence BCD v jícnu není jednoznačně známá, v původní studii v kohortě 206 pacientů představovala 7,3 %. (2) V další studii byl podíl případů s BCD dokonce 22,9 %, nicméně vyšší podíl mohl být z důvodu primární selekce vzorků pro účely studie. (25) V žaludku byla BCD zastižena až ve 14 % vzorků pacientů s chronickou gastritidou a intestinální metapláziíí a ve 49 % resekátů v blízkosti invazivního karcinomu. (3) Jiné studie popisují nižší prevalenci mezi 2,8 % - 4,3 %. (19,23)
Kryptová dysplázie může představovat místo iniciálního vzniku dysplastických změn v kryptách s postupnou progresí do dysplázie postihující celou šíři epitelu včetně povrchu. Kryptová dysplázie v jícnu může být asociovaná s plně vyvinutou dysplázií v celé šíři sliznice či s invazivním karcinomem v okolí nebo dalších vzorcích. (2) V žaludku je popsáno přetrvávání BCD nebo progrese do plně rozvinuté dysplázie v rámci sledování pacientů v 38 %, resp. v 25 %. (3)
Pilovitá (serrated) dysplázie
Pilovitá dysplázie je typ nekonvenční dysplázie, která je popisovaná v terénu pilovitých lézí tlustého střeva, a to především v terénu ploché pilovité léze (SSL), resp. SSL s dysplázií (SSL-D) nebo v terénu tradičního pilovitého adenomu (TSA) tlustého střeva. (27-29) Detailní charakteristika samotného SSL a TSA je nad rámec tohoto textu, uvedeny zde budou především cytologické změny charakterizující pilovitou dysplázii, tak jak je popsaná v lézích kolon, se zaměřením na výskyt tohoto typu dysplázie v jiných etážích GIT.
Pilovitou (serrated) dysplázii charakterizuje obvykle proliferace kuboidálních buněk s hojnou eozinofilní cytoplazmou. Jádra jsou zvětšená, atypická, ale obvykle jsou okrouhlá, vezikulární s otevřeným chromatinem a prominentním jadérkem. Jaderná membrána je hladká. Jádra jsou menší než u intestinálního typu dysplázie. (30) Méně často se pilovitá dysplázie prezentuje minimálními atypiemi (minimal deviation) anebo hypermucinózní změnou. (28) S přítomností dysplázie ve žlázkách ubývá pilovitých změn a jsou spíše okrouhlé, často těsně nakupené a při malém zvětšení může být patrný ostrý přechod mezi nedysplastickou reziduální pilovitou lézí a dysplázií. (obr. 4) S progresí pilovité dysplázie jsou pak jádra zvětšená, více nepravidelná a stratifikovaná se ztrátou polarity a nápadnou mitotickou aktivitou včetně atypických mitóz. Chromatin může být kondenzovaný a hrudkovitý a přibývá jaderné stratifikace. Cytoplazma zůstává obvykle nápadně eosinofilní. Ve žlázkách pak kromě pilovitých změn mohou být i nápadnější komplexní architektonické změny včetně tvorby kribriformních struktur. (obr. 5) (27-30) Otázka gradingu pilovité dysplázie je kontroverzní vzhledem k variabilitě hodnocení i mezi erudovanými patology a například v lézích typu SSL-D se nedoporučuje. (17)
Obr. 4. Pilovitá dysplázie nižšího stupně. Dysplázie pilovitého typu nižšího stupně, zachované jsou pilovité formace a nápadně eosinofilní cytoplazma. Jádra jsou při bazi, okrouhlá, vezikulární, s jemným chromatinem a disperzními mitózami (hematoxylin a eosin, 100x). 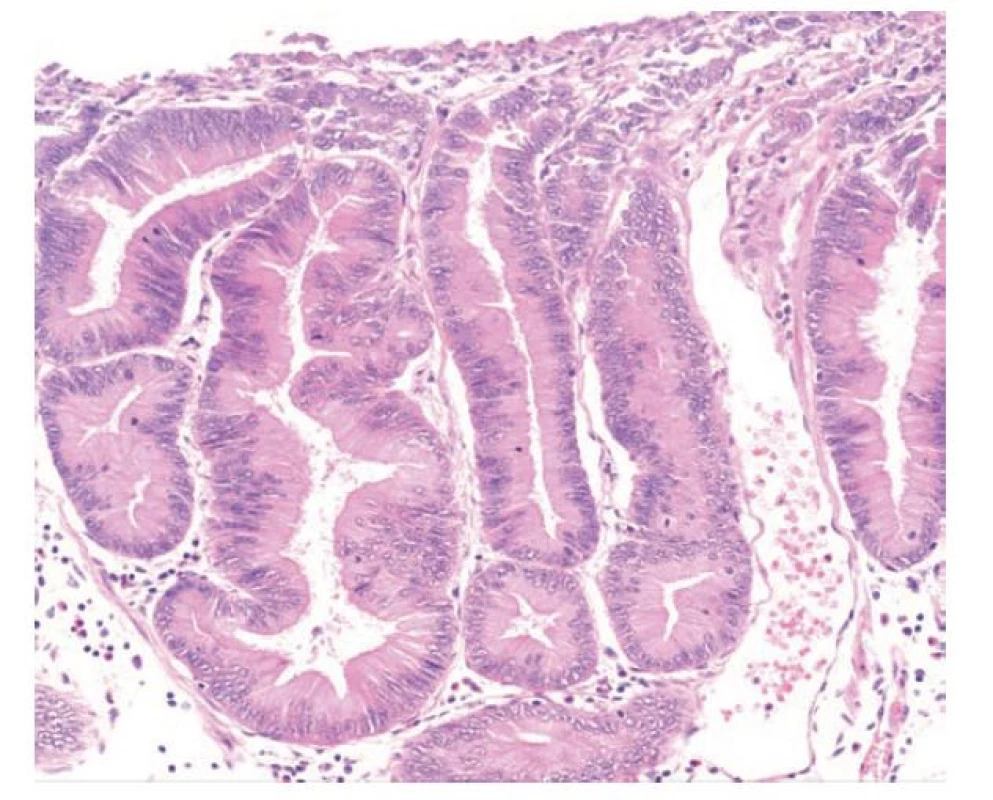
Obr. 5. Pilovitá dysplázie vyššího stupně. Vyšší stupeň pilovité dysplázie s úbytkem pilovitých struktur, větvením žlázek, zachovanou nápadně eosinofilní cytoplazmou a výrazně zvětšenými jádry s jadérky a mitotickou aktivitou. Ložiskově je v lumen nekrotický detritus. Vpravo je patrný zbytek pilovité léze bez dysplázie, kde jsou jádra menší a při bazi (hematoxylin a eosin, 200x). 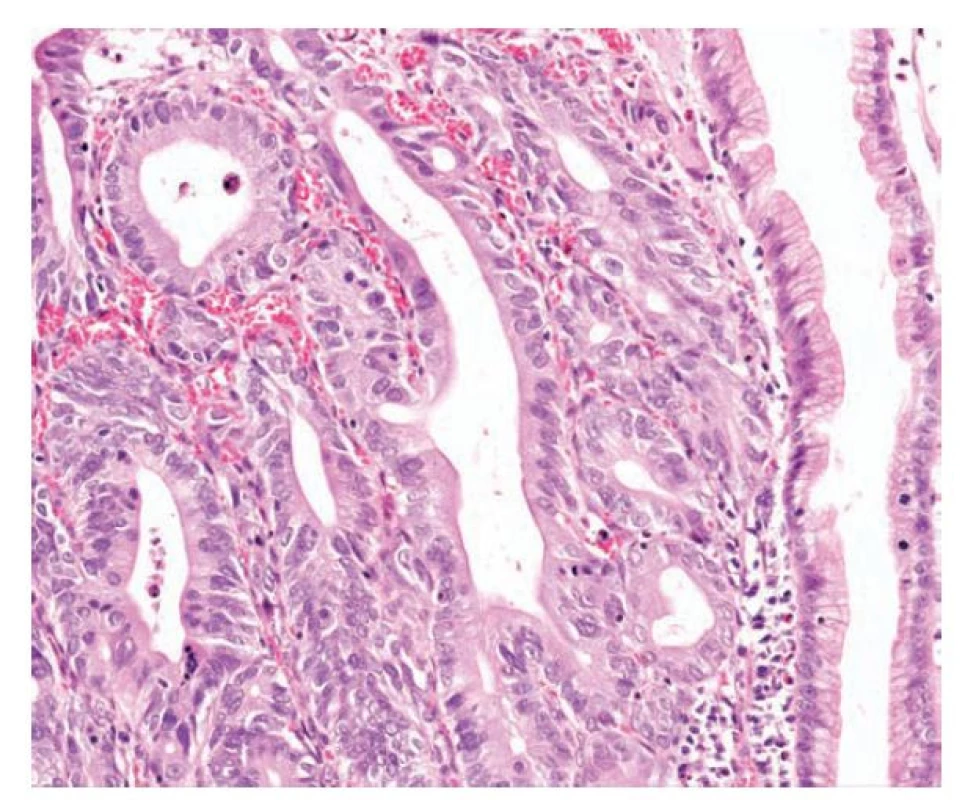
Střevní SSL-D s minimální deviací mohou být spojeny se ztrátou exprese MLH. (28) Molekulární změny ve střevních SSL a TSA s dysplázií jsou pak obvykle spojeny s hypermetylacemi CpG ostrůvků. U SSL-D jsou také zastiženy mutace v genu BRAF a případně mikrosatelitní nestabilita (MSI). (31,32)
V lézích mimo kolon byla popsána exprese MUC5AC a MUC6 a negativní průkaz MUC2 a CD10 v pilovitých lézích žaludku. Ztráta exprese MLH1 (popisovaná např. i v SSL-D) je přítomna asi u 20 % žaludečních lézí, z genetických změn jsou popsány mutace především v genu KRAS. (28,33) Duodenální pilovité léze TSA typu si naopak zachovávají intestinální fenotyp s expresí CDX2 a CK20 a je v nich patrná aberantní jaderná exprese beta-cateninu v ektopických kryptách. V části lézí může být detekována mutace genu KRAS. (5,34)
V jícnu je pilovitá dysplázie dalším podtypem nekonvenční dysplázie v jícnu. Pilovité změny mohou být přítomny i v nedysplastickém žlázovém epitelu Barrettova jícnu bez ohledu na fenotyp (intestinální, foveolární, pylorokardiacký) a mohou připomínat plochou pilovitou lézi (SSL) nebo tradiční pilovitý adenom. (8,35) Někteří autoři je nicméně považují pouze za komponentu komplexních změn v rámci intestinální konvenční dysplázie. (36,37)
Serrated dysplázie/léze žaludku jsou extrémně vzácné. (obr. 6) Pilovitá léze jako samostatná jednotka byla popsána poprvé Rubiem v roce 2001 a další léze jsou popsány ve formě kazuistik a minisérií. (7,33,34,38-41) Část lézí odpovídala tradičnímu pilovitému adenomu. (34,38) Většina publikovaných případů se vyskytla u mužů v horní třetině žaludku.
Obr. 6. Pilovitá léze žaludku. Pilovitá léze žaludku s tubulovilózní stavbou, pilovitými změnami, nápadně eosinofilní cytoplazmou a převážně menšími jádry při bazi nebo s nenápadnou stratifikací. Při spodině jsou patrné fokusy intestinální metaplázie a mucinózní žlázky (hematoxylin a eosin, 200x). 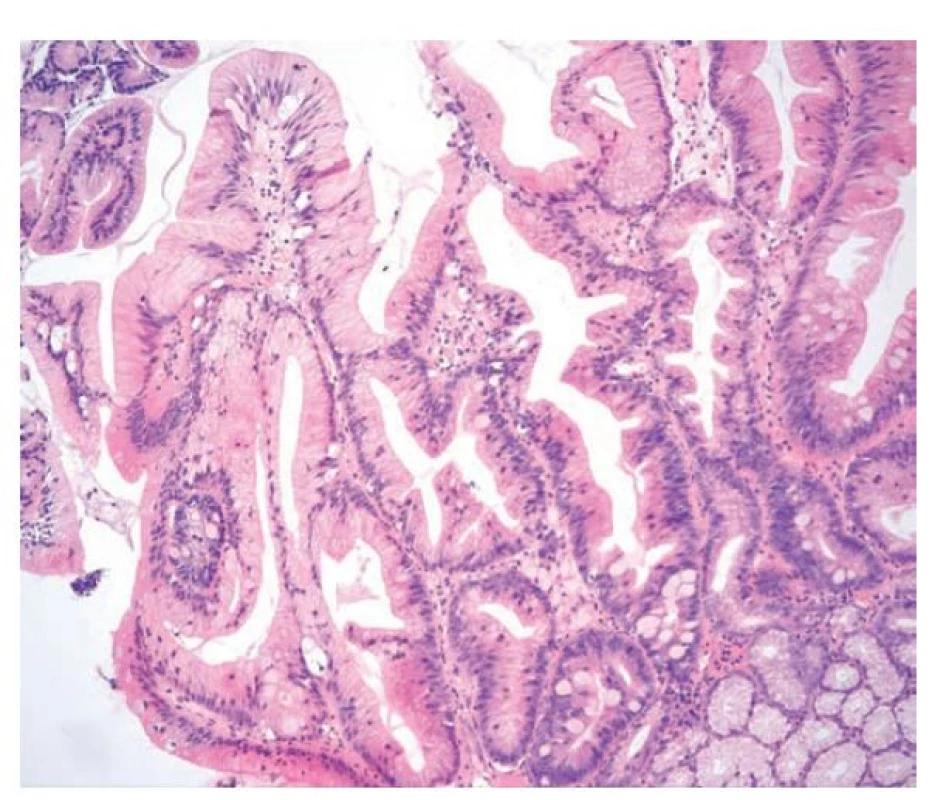
Pilovité léze v duodenu a tenkém střevě jsou také vzácné a jejich výskyt je dokumentován v podobě kazuistik nebo malých sérií. (obr. 7) (4-6, 42) Morfologicky má většina popsaných případů charakter tradičního pilovitého adenomu s nápadnými pilovitými změnami žlázek, tubulovilózní stavbou a ektopickými kryptami. (4,5,38,43)
Obr. 7. Pilovitá léze duodena. Pilovitá léze duodena podobná tradičnímu pilovitému adenomu s hypereosinofilní cytoplazmou, tvorbou ektopických krypt a oválnými až tužkovitými stratifikovanými jádry. Při spodině jsou patrné reziduální nenádorové žlázky s pohárkovými buňkami (hematoxylin a eosin, 100x). 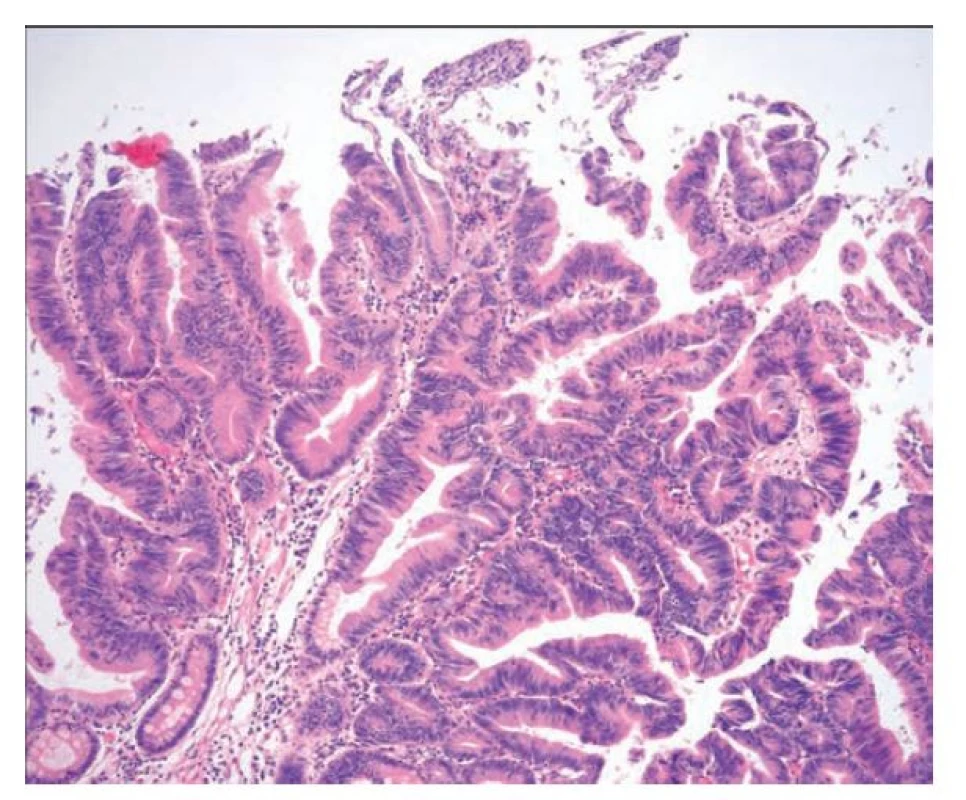
Prevalence a biologické chování pilovitých změn a dysplázie v jícnu, žaludku i duodenu není zcela jasná, vzhledem k tomu, že se jedná povětšinou o malé série případů nebo kazuistiky. (35,44) Dle dostupné literatury je větší část pilovitých lézí v žaludku a v duodenu asociovaná s high-grade dysplázií a karcinomem a předpokládá se vyšší riziko progrese než u konvenčních adenomů. (5,34,38)
NEKONVENČNÍ DYSPLÁZIE NEINTESTINÁLNÍHO TYPU
Stručný přehled níže popsaných lézí je uveden v tab. 1.
Tab. 1. Nekonvenční léze gastrointestinálního typu mimo IBD (převzato a upraveno podle: Pereira D, Kővári B, Brown I et al. Non-conventional dysplasias of the tubular gut: a review and illustration of their histomorphological spectrum. Histopathology 2021 Apr; 78(5): 658-675. 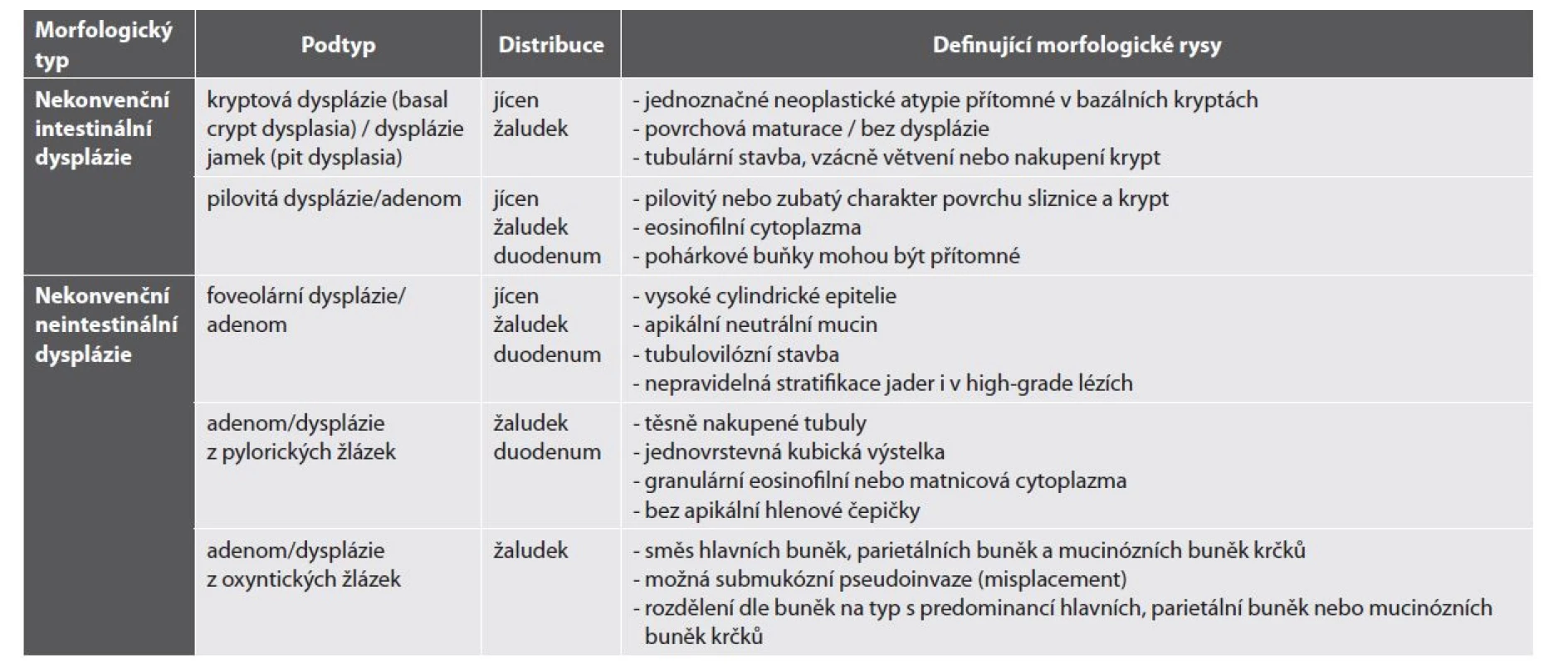
Foveolární dysplázie/adenom (dysplázie foveolárního typu, gastrický typ dysplázie; typ II dysplázie)
Foveolární dysplázie představuje neoplázii epitelu s diferenciací k foveolárním (povrchovým) mucinózním buňkám žaludku. Foveolární dysplázie se vyskytuje v žaludku, jícnu, vzácněji v duodenu a raritně v terénu žaludeční heterotopie v distálním GIT včetně rekta. (35,45-48) Léze mohou být ploché, elevované nebo polypovité, pro které lze použít označení foveolární adenom. (17,44) Epitel ve foveolární dysplázii je cylindrický, s okrouhlými nebo protáhlými jádry. Příznačným nálezem je apikální vrstva (čepička) neutrálního (PAS-pozitivního) hlenu. Tento supranukleární cytoplazmatický hlen dodává epiteliím světle eosinofilní až granulární charakter. Žlázky jsou obvykle okrouhlé, menší a těsně nakupené a mohou tvořit i menší papilární proliferace nebo být i lehce cystické. (44) Low-grade dysplastický epitel pak má obvykle lehce zvětšená okrouhlá nebo oválná hyperchromní bazálně uložená jádra s nevýraznou stratifikací, bez ztráty jaderné polarity a s lehce zvýšenou mitotickou aktivitou. (obr. 8) Při progresi do high-grade foveolární dysplázie dochází ke zvětšení jader, která mají nepravidelné kontury, jemný otevřený chromatin a patrná jadérka. Nukleocytoplazmatický poměr je nápadně zvýšený, stejně jako mitotická aktivita. Stratifikace jader je nepravidelná, ale může být zastižena v celé šířce epitelu. Cytoplazma epitelií je stále mucinózní, ale hlen může být redukovaný. (obr. 9) (21,35,46,47,49,50)
Obr. 8. Foveolární dysplázie v žaludku, low-grade. Low-grade foveolární dysplázie tvořená jednou vrstvou cylindrických foveolárních epitelií s tmavší cytoplazmou, apikální čepičkou hlenu a zvětšenými oválnými jádry. Vpravo je patrný je ostrý přechod mezi dysplastickým a nenádorovým foveolárním epitelem (hematoxylin a eosin, 40x). 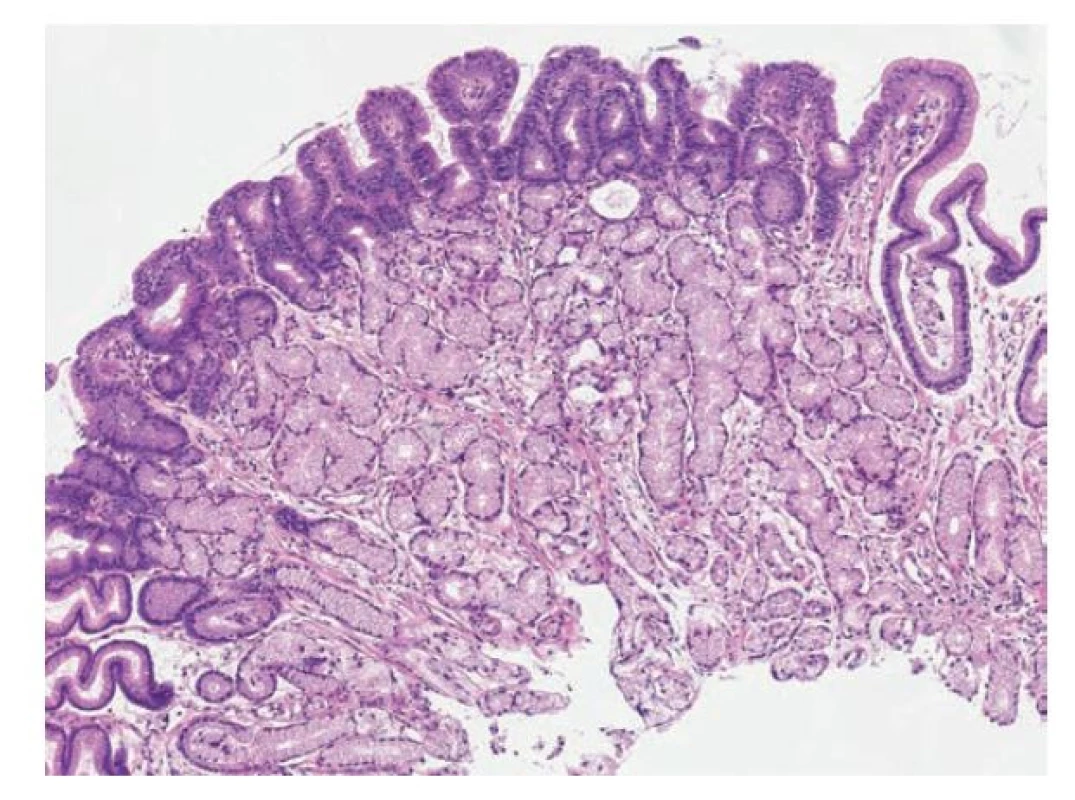
Obr. 9. Foveolární dysplázie v terénu Barrettova jícnu, high-grade. High-grade foveolární dysplázie s úbytkem hlenu, větvením žlázke a s výraznější stratifikací zvětšeným jader a nápadnými mitózami (hematoxylin a eosin, 200x). 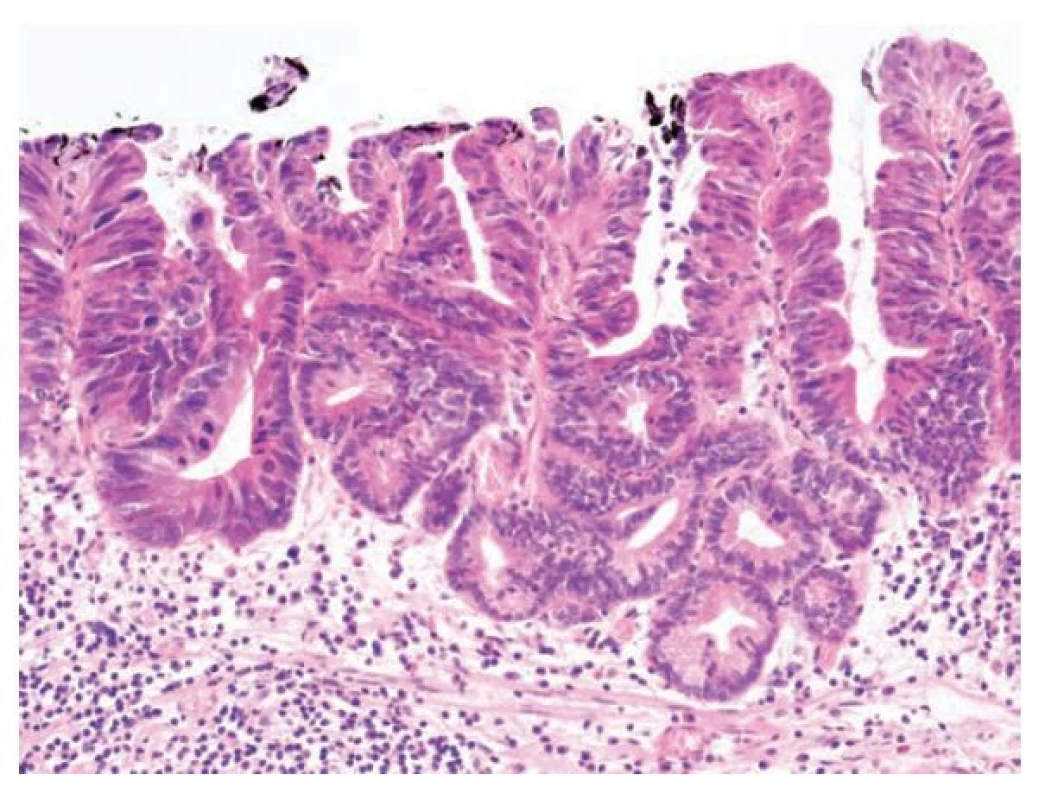
Neoplastický foveolární epitel vykazuje silnou difúzní expresi MUC5AC a slabou fokální expresi MUC6. Průkaz markerů intestinální diferenciace jako MUC2, CDX2, CD10 a villin je negativní. S progresí dysplázie stoupá podíl smíšeného fenotypu prokazatelný na základě exprese gastrických i intestinálních markerů. (35,45,51-53) Použítí imunohistochemie se v rámci rutinní diagnostiky spíše nedoporučuje a základem je histologická diagnóza založená na základním a ancilárním barvení (HE, PAS). (17) Nejčastější genetické změny zahrnují mutace v genech KRAS a APC. Prokázané jsou i jiné alelické imbalance a změny v metylačním stavu DNA. (54)
Foveolární dysplázie v jícnu vzniká v terénu žlázové metaplázie a představuje méně častý typ tzv. Barrettovské dysplázie. Foveolární dysplázie v jícnu postihuje obvykle celou šíři sliznice v podobě jedné vrstvy dysplastických cylindrických buněk. Může vznikat v terénu intestinální metaplázie (kompletní či nekompletní), kde se může kombinovat s konvenční dysplázií nebo vznikat v terénu metaplastického epitelu bez pohárkových buněk. Pokud jsou v příměsi pohárkové nebo Panethovy buňky, lze hovořit o tzv. hybridní nebo smíšené dysplázii. (35,45) Prevalence se v rámci studií liší i s ohledem na typ materiálu a velikost diagnostického centra a pohybuje se mezi 5–20 % v bioptickém materiálu až k 46 % v esofagektomiích. (35,45,50)
V žaludku vzniká foveolární dysplázie de novo nebo v terénu hyperplastických polypů či polypů z fundických žlázek. (56-58) Sporadický výskyt foveolárního typu dysplázie v terénu polypu z fundických žlázek je vzácný (do 1 % případů). Mnohem častější je výskyt v terénu polypózního syndromu. (59) Nejčastěji se jedná o asociaci se syndromem familiární adenomatózní polypózy (FAP) a se syndromem adenokarcinomu a proximální polypózy žaludku (GAPPS). (59-62) Především u FAP je výskyt foveolární dysplázie v terénu polypů z fundických žlázek mnohem častější (25–46 %), obvykle se jedná o léze s low-grade dysplázií. (59,60) Naopak v terénu GAPPS je přítomna low-grade i high-grade dysplázie. (61,62) Foveolární léze asociované s polypózními syndromy pak obvykle vykazují odpovídající genotyp s germinální mutací genu APC u familiární adenomatózní polypózy a promotoru 1B genu APC u syndromu GAPPS. (59,61,62) Recentně pak byl vysoký podíl foveolárního typu dysplázie popsán v polypech žaludeční sliznice u pacientů s neatrofickou gastritidou bez vazby na infekci H. pylori a s endoskopickým bobulovitým vzhledem. (63)
Foveolární typ dysplázie v duodenu je méně častý, může mít tubulovilózní stavbu a je tvořena cylindrickým epitelem s apikální čepičkou mucinu. Vznik je možný v žaludeční heterotopii, popsány jsou i případy v terénu gastrické metaplázie v proliferativních lézích Brunnerových žlázek. (44,64)
Určit biologické chování foveolárního typu dysplázie je problematické. Low-grade léze je někdy obtížné odlišit od reaktivních změn a reálný výskyt a sledování progrese je ztíženo možným zařazením dysplastické léze do nenádorové skupiny. (47,57,65) Jednoznačný rizikový znak progrese stanoven není, nicméně výskyt hybridní diferenciace u části foveolárních adenomů s sebou může nést vyšší riziko progrese do karcinomu. (17)
Adenom/dysplázie z pylorických žlázek (pyloric gland adenoma, PGA)
PGA je vzácný typ adenomu, který se nejčastěji vyskytuje v žaludku, ale může být zachycen i v jícnu, duodenu, rektu, či ve žlučníku, žlučovodu a pankreatu. (9,66-71)
Průměrná velikost PGA se pohybuje okolo 20 mm. V základu je PGA tvořen těsně nakupenými okrouhlými žlázkami, někdy s nevýraznou cystickou dilatací. Epitel je kubický až cylindrický se světle eosinofilní až granulární cytoplazmou, někdy až matnicového charakteru, s okrouhlými bazálně uloženými jádry, obvykle bez nápadnějších atypií. Na rozdíl od foveolárních buněk zde chybí apikální čepička hlenu. (obr. 10) (9,68) Některé starší studie rozdělovaly PGA na léze bez dysplázie, s low-grade a high-grade dysplázií. (68, 71) Nicméně i PGA s nevýraznými atypiemi vykazují molekulární a genetické abnormality podporující názor, že i tyto cytologicky blandní léze představují minimálně low-grade neoplastickou lézi. (66) PGA s jasnou high-grade dysplázií pak vykazuje komplexní změny v architektonice včetně kribriformní stavby a výrazné atypie jader s hyperchromazií, zvýšeným N/C poměrem, ztrátu polarity jader a patrná jadérka. Vzhledem k úbytku produkce hlenu může být cytoplazma více eosinofilní než v low-grade lézích. (66-71)
Obr. 10. Adenom z pylorických žlázek. Žlázky v low-grade adenomu z pylorických žlázek jsou nakupené a lehce dilatované. Epitel je kubický až cylindrický se světle eosinofilní cytoplazmou, ve které chybí apikální čepička hlenu. Jádra jsou okrouhlá, bazálně uložená, bez nápadnějších atypií (hematoxylin a eosin, 200x). 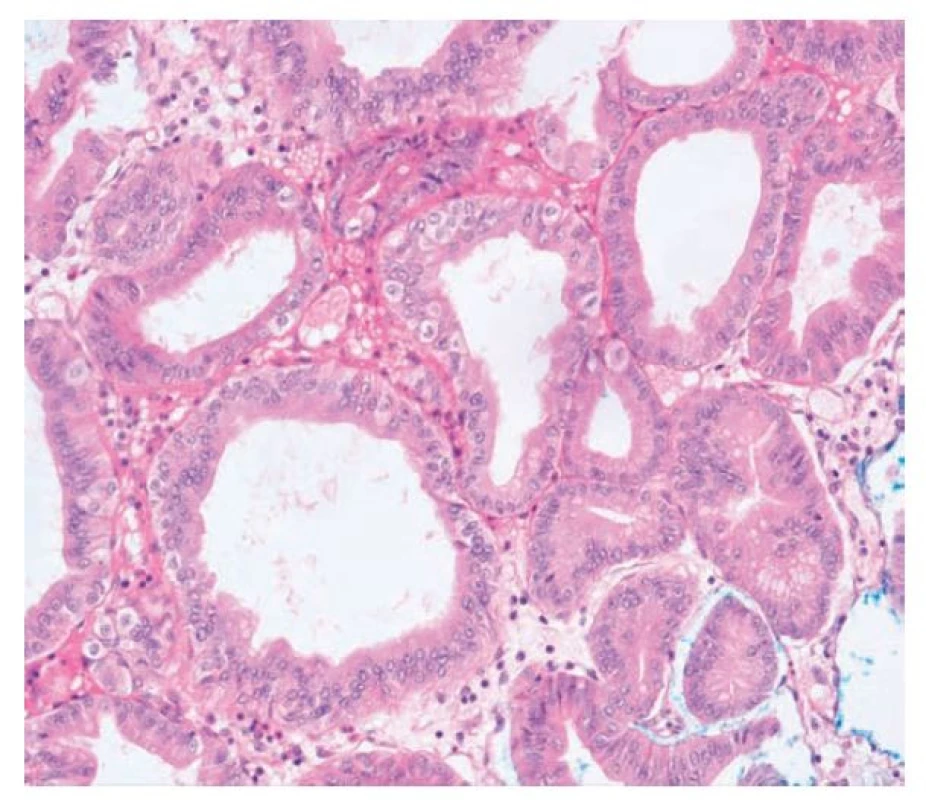
Imunohistochemicky jsou PGA pozitivní v MUC6, což je charakteristický marker pylorické diferenciace a v MUC5AC, který je pozitivní i ve foveolárních adenomech. (68,72,73) Na rozdíl od adenomů intestinálního typu nejsou přítomny pohárkové nebo Panethovy buňky a negativní je průkaz MUC2, CD10 a CDX2. Pylorické adenomy se pak podle exprese mohou dělit na čistě pylorické, převážně foveolární nebo smíšené, které jsou nejčastější. (66)
Genetické změny sporadických i familiárních PGA jsou obdobné, s převahou mutací v genech GNAS a KRAS. V případě asociace s FAP je ve 100 % případů přítomna mutace APC. U lézí vyskytujících se u Lynchova syndromu je pak zastižena i ztráta exprese MMR proteinů, která je jinak u sporadických PGA zachovaná. (66,75-78) Recentní práce naznačují i možnost dvou odlišných mutačních cest v low-grade a high-grade PGA za účasti genů jako PIK3CA, TP53 aj. (79)
V žaludku představuje PGA zhruba 2,7 % ze všech gastrických polypů, obvykle postihuje oxyntickou sliznici a vyskytuje se častěji u starších žen s autoimunitní gastritidou v 20-48 %. (9) V mladším věku se pak objevuje v rámci syndromů jako je familiární polypóza, Lynchův syndrom, syndrom juvenilní polypózy nebo McCune-Albrightův syndrom. (9,66,74,80)
Duodenální PGA může být zastižen v 0,8 – 2 % endoskopií horního trávicího traktu. (81,82) Jejich patogeneze není stále objasněna, nejpravděpodobnější hypotézy zahrnují vznik v heterotopické sliznici žaludku nebo v terénu regenerujících Brunnerových žlázek. (68,71) V duodenu je nutné PGA odlišit od proliferativních lézí z Brunnerových žlázek, se kterými může sdílet blandní cytologii, tubulární architektoniku a expresi MUC6. K odlišení těchto lézí může pomoci jejich zachovaná lobulární stavba a přítomnost vazivových nebo hladkosvalových sept. (84)
Na rozdíl od žaludečních PGA nejsou duodenální PGA popsány u McCune-Albrightova syndromu (u kterého se vyskytuje postzygotická mutace genu GNAS) a nutné je také zdůraznit fakt, že u syndromů typu FAP, Lynchův syndrom a syndrom juvenilní polypózy jsou duodenální PGA zcela raritní. (74-78,85)
Maligní potenciál žaludečního adenomu z pylorických žlázek je vyšší, high-grade dysplázie je zastižena až v polovině resekovaných adenomů a podíl asociace s adenokarcinomem se dle recentnější literatury pohybuje spíše mezi 12–16 %. (66,71,80)
U duodenálních PGA stoupá možnost zastižení invazivního adenokarcinomu s velikostí léze. Míra progrese do adenokarcinomu, stejně jako u gastrických PGA kolísá v rámci malých sérií mezi 11–66 %, nicméně rekurence jsou minimální a endoskopické řešení představuje dostačující terapii. (9,70,71)
Adenom/dysplázie z oxyntických žlázek (oxyntic gland adenoma, OGA)
OGA je relativně nedávno popsaná a vzácná léze, který vykazuje diferenciaci směrem k hlavním nebo méně často parietálním buňkám. (11,44,86-88) Dle doposud největší studie těchto lézí, se OGA vyskytuje především u starších dospělých (průměrný věk 66 let) s převahou mužského pohlaví. (89) Častěji je zastižen v horní třetině žaludku jako elevovaná léze nebo tumorózní ložisko s centrální depresí. Dosahovat může rozměru od 3 mm do 40 mm. (89)
Mikroskopicky je OGA tvořen kompaktními okrouhlými žlázkami, ve kterých převažují hlavní buňky s příměsí parietálních buněk připomínajících fundické žlázky. Ve větších adenomech byla zastižena i příměs buněk s diferenciací do foveolárních buněk nebo mucinózních buněk krčků (mucous neck cell), které mohou představovat agresivnější fenotyp. (89) (obr. 11) V menších nebo středně velkých lézích jsou obvykle patrné mírné atypie jader. U high-grade lézí jsou atypie nápadné a přibývá komplexní růst v trabekulách a kribriformních formacích. (11,88,89)
Obr. 11. Adenom z oxyntických žlázek. Adenom z oxyntických žlázek je tvořen kompaktními okrouhlými žlázkami, ve kterých jsou v tomto případě především hlavní buňky, ojedinělé parietálních buňky a hojná příměs elemntů vzhledu mucinózních buněk krčků (hematoxylin a eosin, 200x). Snímek laskavě zapůjčil: Bence Péter Kővári, MD, PhD (Szeged, Hungary and Tampa, FL, USA) 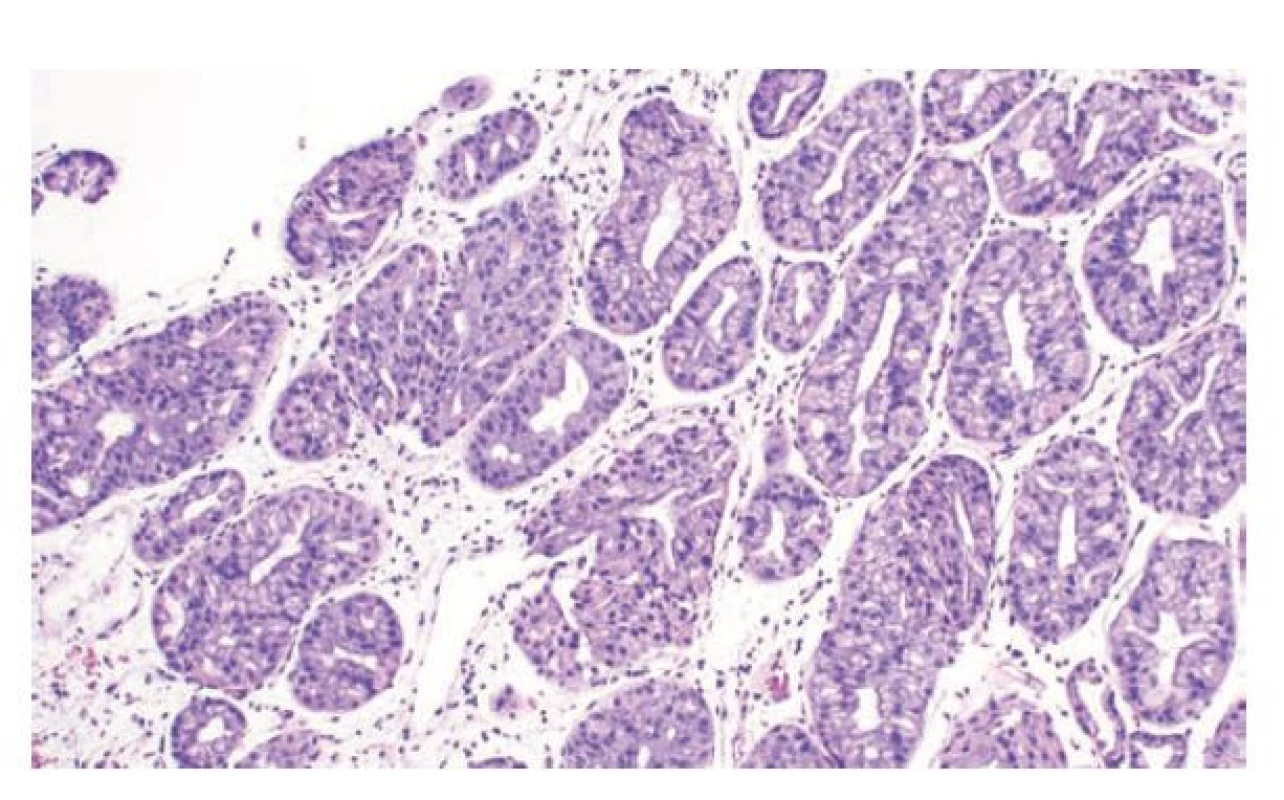
Imunohistochemicky je v OGA přítomna exprese pepsinogenu - I v hlavních buňkách. Většina tumorů také exprimuje MUC5AC a MUC6 a parietální buňky lze znázornit imunohistochemickým průkazem exprese H+/K+ ATP-ázy. Případné diagnostické rozpaky může přinést prokázaná exprese CD56 a synaptofyzinu ve více než 80 % případů. (11) Proliferační aktivita v Ki-67 je v oxyntických adenomech obvykle nízká. (11,88) Genetické změny v OGA se nejčastěji týkají mutací v genech GNAS a KRAS a vykazují překryv se změnami v adenomu z pylorických žlázek a mohou představovat širší spektrum neoplázií s diferenciací směrem k hlubokým žaludečním žlázkám. (76)
Důležité je hodnocení atypií a rozpoznání high-grade léze a pátrání po případném invazivním růstu a progresi do karcinomu. Invaze může mít spíše expanzivní charakter a infiltrativní typ růstu s desmoplastickou reakcí je pozorován méně často. (89) Pro některé léze původně popsané jako adenokarcinom z hlavních buněk byla navržena reklasifikace na OGA v případě nepřítomnosti submukózní propagace a pro opravdu invazivní karcinom s oxyntickou diferenciací je navržen termín adenokarcinom z fundických žlázek (adenocarcinoma, fundic gland (mucosa) type). (17,87,89-91)
Základem diagnostiky u výše uvedených lézí je jejich rozpoznání a zhodnocení tíže dysplastických změn v základním barvení. Výsledky imunohistochemického vyšetření intestinálních, gastrických a dalších markerů obvykle vycházejí ze studií souborů lézí, které byly diagnostikovány na základě histomorfologických kritérií. V části lézí lze sice prokázat čistě intestinální (CDX2, CD10, MUC2) nebo čistě gastrický (MUC5AC, MUC6) fenotyp. Kromě toho však existují i léze s hybridním fenotypem s variabilní expresí výše uvedených markerů. V rámci rutinního hodnocení tedy nelze výsledků exprese těchto imuhistochemických markerů využít k diagnostickému odlišení jednotlivých lézí. (17)
DYSPLÁZIE ASOCIOVANÉ S IDIOPATICKÝMI STŘEVNÍMI ZÁNĚTY
Idiopatické střevní záněty (ulcerózní kolitida a Crohnova choroba) představují chronické zánětlivé onemocnění postihující především střevní sliznici, která je v rámci dlouhodobé zánětlivé iritace a regenerace ohrožena akumulací genetických změn a rozvojem intraepiteliální neoplázie, včetně invazivního karcinomu. (92-94) Dlouhodobě uznávanou prekurzorovou lézí v terénu IBD je dysplázie střevního epitelu odpovídající konvenčnímu typu dysplázie. Ještě nedávno byly tyto dysplastické změny označovány termínem DALM (dysplasia associated lesion and mass, léze a masa asociovaná s dysplázií). (95, 96) Užití tohoto termínu se již nedoporučuje. (97) V posledních letech byly navíc popsány další histologické typy preneoplastických změn ve sliznici IBD pacientů, které morfologicky neodpovídají konvenční dysplázii a představují skupinu tzv. nekonvenčních lézí. (12-14,98)
Konvenční IBD-asociovaná dysplázie
Přestože je text zaměřen především na nekonvenční léze, téma dysplastických změn u IBD je natolik důležité, že je vhodné na tomto místě zmínit krátce i některé problematické aspekty diagnostiky konvenčního typu IBD-asociované dysplázie. Konvenční IBD-dysplázii lze rozdělit na dysplázii nízkého stupně (low–grade, LGD) a vysokého stupně (high-grade, HGD), případně u hraničních lézí využít kategorii „neurčitý pro dysplázii“ (indefinite for dysplasia). (99-102) Morfologicky je konvenční IBD dysplázie podobná adenomatózní dysplázii se zvětšenými hyperchromními jádry, zvýšeným nukleocytoplazmatickým poměrem a jadernými atypiemi. U high-grade dysplázie se vyskytují komplexní architektonické změny a atypie vyššího stupně. (obr. 12) Rozlišení reaktivních změn od dysplázie a odlišení low-grade a high-grade dysplázie u pacientů s IBD je stále problematické, nicméně důležité, především z důvodu odlišných rizik pro rozvoj kolorektálního karcinomu (KRK). Regenerativní a degenerativní změny v epitelu zahrnují úbytek hlenu, zvětšení jader s patrnými jadérky a mitotickou aktivitu v kryptách. (103) Pokud se mitotická aktivita vyskytuje i v horní části krypt nebo v povrchovém epitelu, lze tento nález považovat za abnormální a spíše svědčící pro dysplázii. Přesto je odlišení lézí z kategorie „neurčitý pro dysplázii“ (indefinite for dysplasia) od LG dysplázie zatíženo nízkou shodou dokonce i mezi erudovanými gastrointestinálními patology. (104)
Obr. 12. Konvenční IBD-asociovaná dysplázie, high-grade. High-grade dysplázie v terénu ulcerózní kolitidy s morfologií odpovídající konvenčnímu typu. Patrné jsou poruchy architektoniky žlázek, jádra jsou nápadně stratifikovaná, hyperchromní nebo s vesikulárním jádrem. Mitotická aktivita je výrazná (hematoxylin a eosin, 100x). 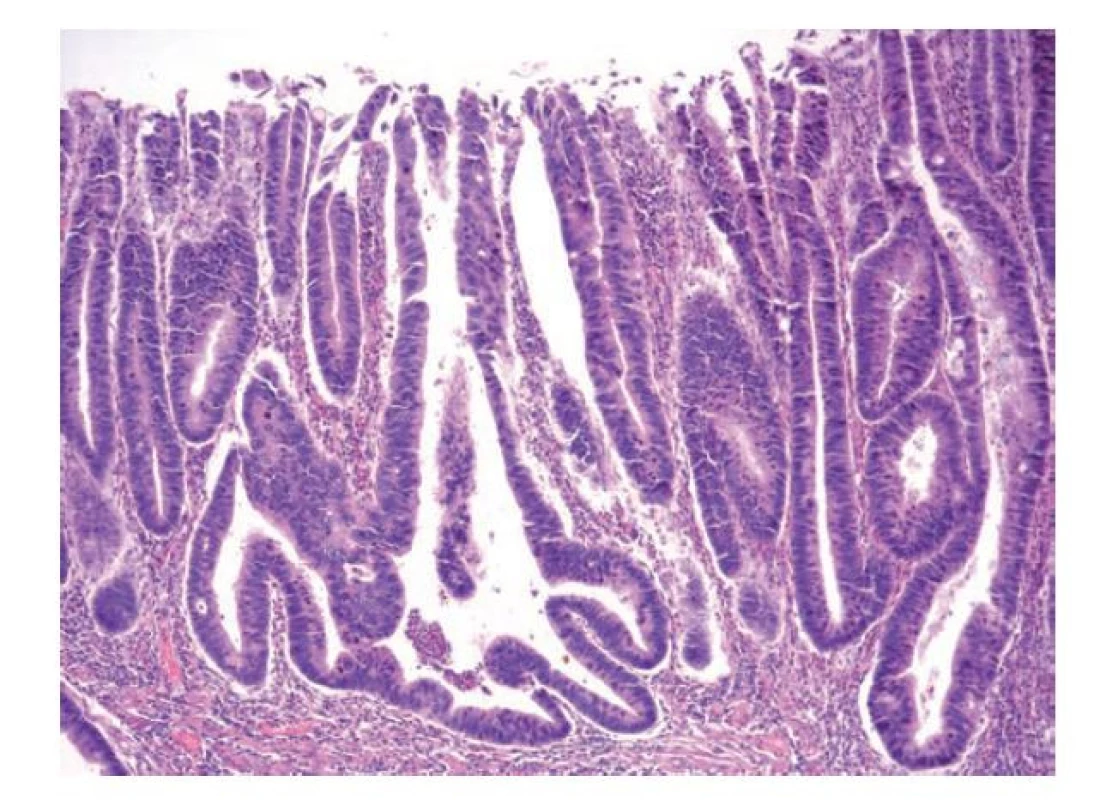
Pro odlišení vystupňovaných reaktivních změn od konvenční IBD-dysplázie je také snaha využít imunohistochemické barvení. Nejčastější je využití detekce aberantní exprese p53 v dysplastickém epitelu, která se vyskytuje zhruba u 35 % low - -grade dysplázií, cca 67 - 70 % případů high-grade dysplázie. (104-108) Mezi další markery patří alfa-methylacyl-CoA racemáza (AMACR) a bcl2, u kterých se obvykle využívá kombinace průkazu exprese spolu s aberantní expresí p53. (109-111) Novější studie pak poukazují na možné využití antigenu SATB2, který vykazuje aberantní ztrátu exprese v 41 % případů IBD - -asociované dysplázie a 67 % případech IBD-asociovaného karcinomu. (112,113) Nicméně aberantní exprese některých markerů, především pak p53, může být zastižena i v malém procentu regenerativních změn a je nutné tedy taková vyšetření interpretovat s vysokou obezřetností.
Rozlišení IBD dysplázie od konvenčního adenomu může být obdobně obtížné jako předchozí situace. V takovém případě je možné se řídit několika pomocnými diagnostickými parametry jako je věk pacienta, lokalizace dysplastické léze a morfologie endoskopická i mikroskopická. Konvenční adenomy obvykle vyrůstající proximálně od zánětlivě změněné části kolon a představují ostře ohraničenou lézi tvořenou stejně velkými dysplastickými žlázkami bez přilehlé ploché dysplázie v okolí. Pacienti jsou obvykle starší 60 let s kratším trváním onemocnění a v neaktivním stadiu. (104,105) Naopak pro IBD dysplázii je typický nižší věk pacientů, delší trvání, větší rozsah postižení střeva a aktivita IBD. Dysplastické žlázky v rámci IBD dysplázie jsou pak nepravidelné, různě velké a mohou se střídat s nepostiženými žlázkami v hloubce sliznice i s fokusy nedysplastického epitelu při povrchu. (104,105) Tato kritéria lze použít jak pro UC, tak pro CD. Endoskopické odběry okolní ploché sliznice a nález chronického zánětu a dysplastických změn mohou podpořit diagnózu IBD dysplázie vznikající v zánětlivém terénu.
Nekonvenční prekurzorové/dysplastické léze
Stručný přehled níže popsaných lézí je uveden v Tab. 2.
Tab. 2. Nekonvenční léze asociované s idiopatickým střevním zánětem (převzato a upraveno podle: Choi WT. Non-conventional dysplastic subtypes in inflammatory bowel disease: a review of their diagnostic characteristics and potential clinical implications. J Pathol Transl Med. 2021; 55(2): 83-93). 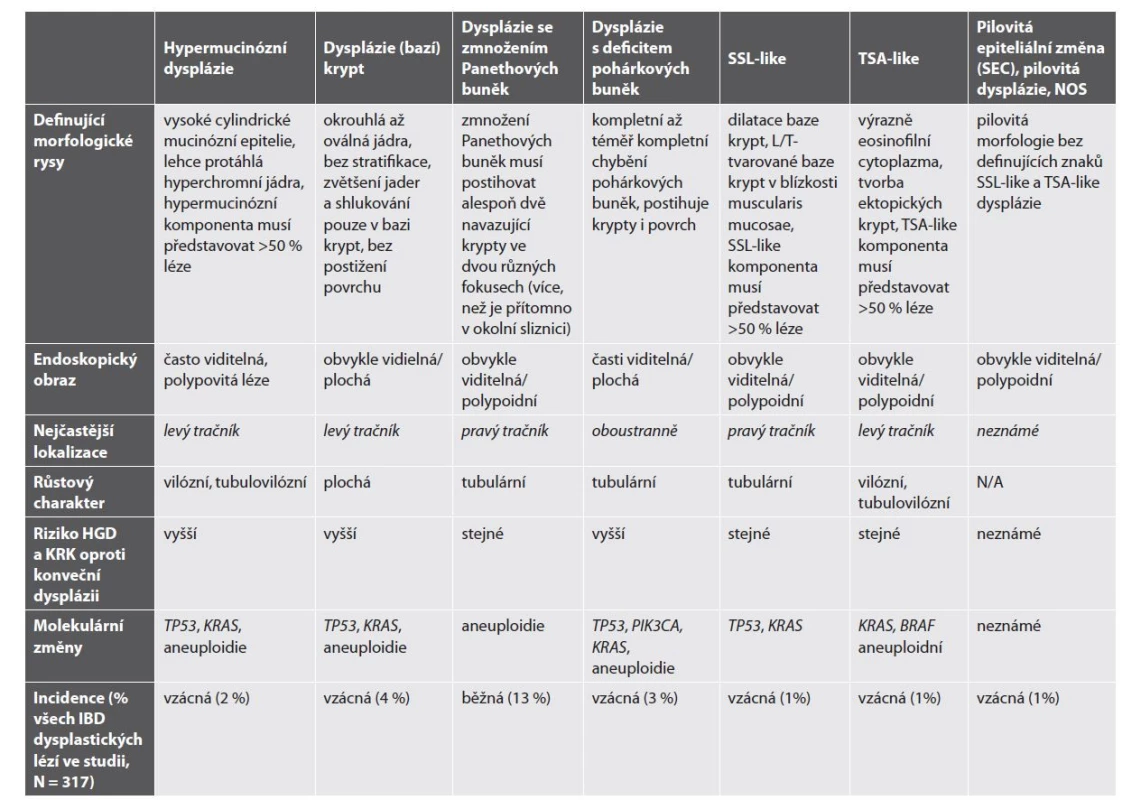
Zkratky: HGD – high grade dysplázie; IBD – idiopatický střevní zánět (inflammatory bowel disease); KRK – kolorektální karcinom; NOS – blíže nespecifikovaný (not otherwise specified); SEC – pilovitá epiteliální změna (serrated epithelial change); SSL – plochá pilovitá léze (sessile serrated lesion); TSA – tradiční pilovitý adenom (traditional serrated adenoma) Nekonvenční dysplastické léze u pacientů s IBD představují heterogenní skupinu lézí, kterým je recentně věnována velká pozornost. Striktní morfologická kritéria pro jejich diagnózu a klinickopatologické znaky či prognostický význam nejsou sice ještě zcela vyřešené, přesto přestavují skupinu lézí, resp. slizničních změn, o kterých je vhodné mít do budoucna povědomí a v rámci rutinní diagnostiky je rozpoznat. Stejně jako konvenční dysplázie se vyskytují ve sliznici postižené zánětem, ale nesplňují kritéria adenomatózní dysplázie, což činí jejich rozpoznání složitější. Nekonvenční dysplastické léze se vyskytují častěji v terénu ulcerózní kolitidy. (12,13) Průměrný věk pacientů v době diagnózy kolísá ve studiích mezi 38–55 lety a obě pohlaví jsou postižena rovnoměrně. (12-14)
Nekonvenční slizniční léze byly u pacientů s IBD popsány již v minulosti. Podrobněji na jednu z těchto lézí upozornil již v roce 1984 Rubio et al. v sérii pacientů s dlouhotrvající ulcerózní kolitidou a lézi pojmenoval jako vilózní adenomatózní léze, resp. vilózní dysplázie. (114) Podobnou změnu následně popsali další autoři jako vilózní regenerativní změnu nebo hyperplastic-like lézi u pacientů s Crohnovou chorobou. (115-117) Další popsanou lézí byla tzv. pilovitá epiteliální změna (serrated epithelial change, SEC) popsaná Rubiem v roce 2007. (118,119) Postupně jsou popisovány i další podtypy nekonvenčních dysplastických lézí v terénu IBD jako je dysplázie s deplecí pohárkových buněk nebo dysplázie s terminální diferenciací a Panethovými buňkami. (13,14,98)
Hypermucinózní dyplázie (vilózní hypermucinózní změna/dysplázie)
Již ve starších studiích se jednalo o léze s obdobnou morfologií s protáhlými vilózními výběžky či papilami, které jsou lemovány cylindrickým epitelem s nápadně světlou cytoplazmou. Jádra epitelu jsou obvykle menší, okrouhlá s kondenzovaným chromatinem nebo vezikulární a obvykle bazálně lokalizovaná. (obr. 13) Přechod do dysplázie je spojen s nápadnou hyperchromazií jader, změnou nukleocytoplazmatického poměru a s redukcí hypermucinózního vzhledu spíše s eosinofilní cytoplazmou. (obr. 14) (12-14,114,117,120) Přestože je vzhled této léze dosti blandní, tak jsou popisovány případy asociované s invazivním karcinomem včetně plynulého přechodu bez zjevné dysplázie. Nádorové buňky karcinomu asociovaného s touto lézí si mohou zachovat obdobný světlý až mucinózní vzhled jako prekurzorová léze. (12,120)
Obr. 13. Hypermucinózní (vilózní) dysplázie v terénu idiopatického střevního zánětu. Hypermucinózní dysplázie je tvořena protáhlými vilózními nebo větvenými výběžky, které jsou kryté cylindrickým epitelem s nápadně světlou cytoplazmou a menšími jádry při bazi (hematoxylin a eosin, 40x). 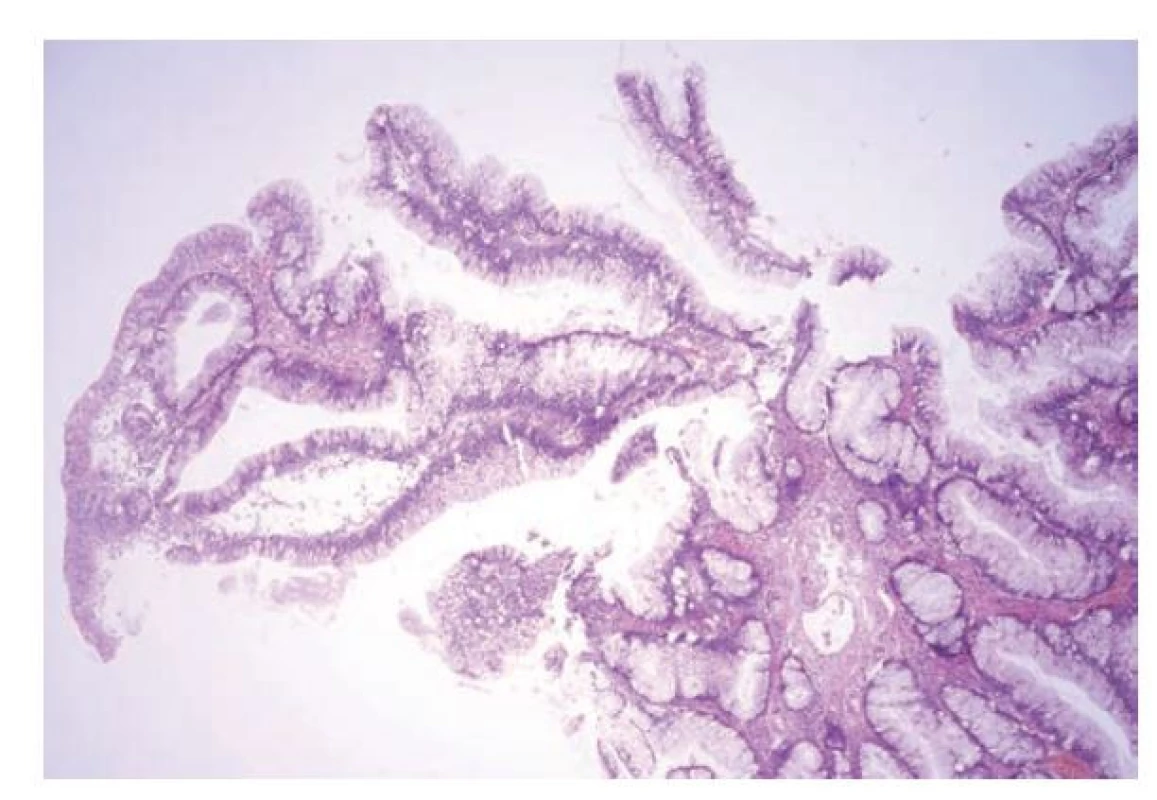
Obr. 14. Hypermucinózní (vilózní) dysplázie s high-grade dysplázií. Zachovaná je vilózní stavba léze, ale ztrácí se hlenovitá cytoplazma a zvyšuje se nukleocytoplazmatický poměr. Jádra jsou zvětšená, protáhlá, s hrubým chromatinem nebo jadérky (hematoxylin a eosin, 100x). 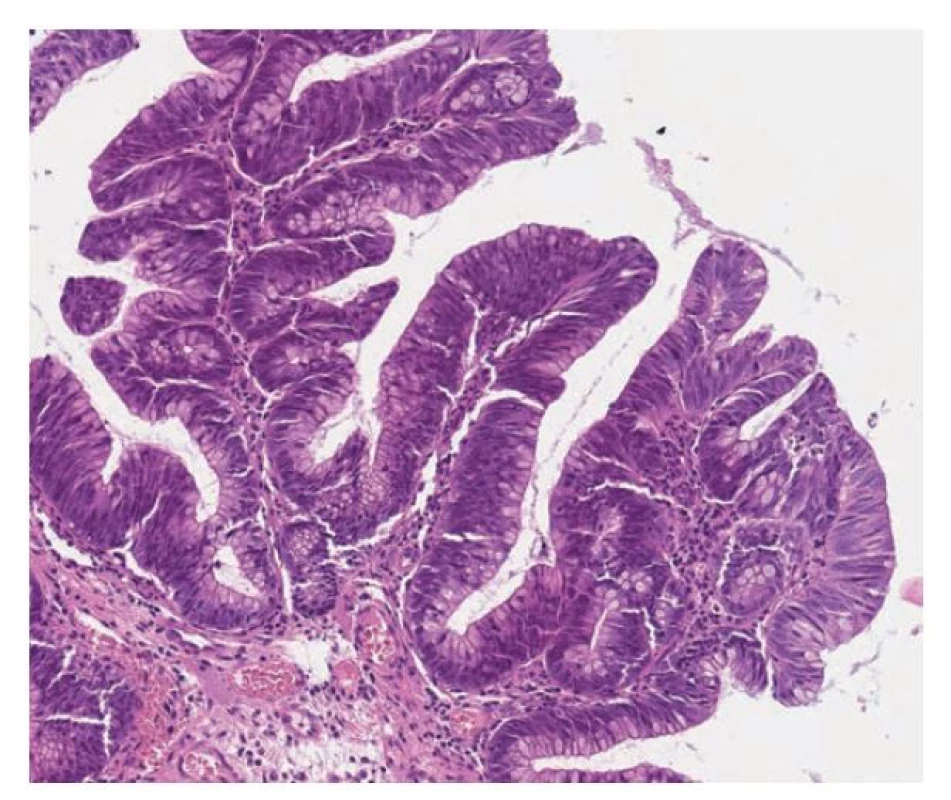
Pilovitá epiteliální změna, pilovitá dysplázie, blíže neurčená (serrated epithelial change, SEC, serrated dysplasia, NOS)
Pilovitá epiteliální změna (SEC) je charakterizována variabilně vyjádřenou pilovitou přeměnou povrchové sliznice a žlázek. Léze jsou obvykle ploché a přisedlé nebo lehce elevované, ostře ohraničené od okolní sliznice, nicméně mohou představovat i větší plošné až kobercovité léze. (12) SEC je popisována jako superficiální pilovitá změna, která nesplňuje kritéria pro pravý pilovitý polyp, protože pilovité formace jsou zastiženy v horní třetině až polovině léze. (obr. 15) Žlázky jsou deformované nebo dilatované, ale změny nedosahují baze, resp. k muscularis mucosae, a chybí krypty ve tvaru obráceného písmene T nebo písmene L. (118,121-123) V části lézí může být patrná ztráta hlenotvorby v epitelu, která dodávala lézím hypereozinofilní vzhled. Jádra epitelií byla obvykle lehce zvětšená, oválná a vezikulární, někdy s patrnými jadérky. (12) Recentní studie pak zdůrazňují zvýšené riziko konkomitantní dysplázie u pacientů se SEC a dále podporují předpoklad, že SEC představuje možný předstupeň či rizikový znak progrese dysplázie či karcinomu u IBD pacientů. (124-126)
Obr. 15. Pilovitá epiteliální změna, pilovitá dysplázie, blíže nespecifikovaná. Vpravo je na snímku v terénu ulcerózní kolitidy pilovitá epiteliální změna. Žlázky jsou větvené až pilovité, protáhlé a epitel jeví ztrátu hlenu a eosinofilii. Vlevo je pak zastižen přímý přechod do cytologických atypí, které již odpovídají low-grade dysplastickým změnám (hematoxylin a eosin, 100x). 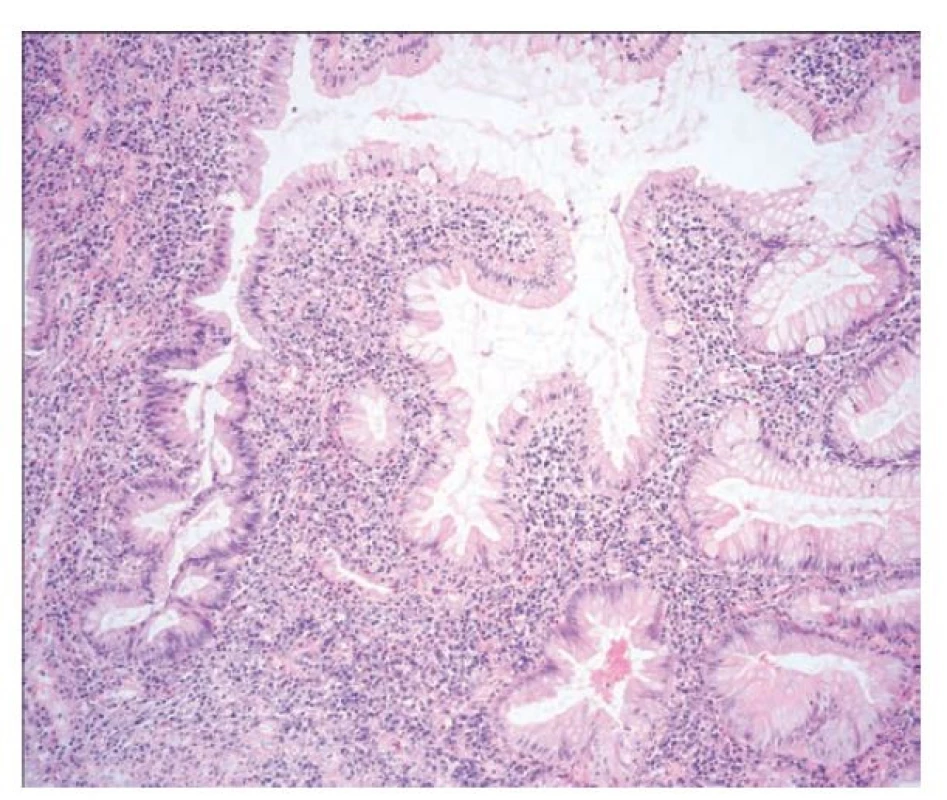
Některé léze jsou popisovány jako pilovitá dysplázie, blíže nespecifikovaná (serrated dysplasia, NOS) s pilovitou architektoniku, ale může být přítomna i vilózní komponenta. (obr. 15) V lézi však chybí typické znaky SSL (jako je dilatace nebo inverze krypt) a TSA (tvorba ektopických krypt). Enterocyty mohou mít eosinofilní cytoplazmu nebo naopak cytoplazmu bohatou na mucin, jádra jsou obvykle lehce zvětšená, oválná nebo okrouhlá, s nenápadným nebo naopak prominentním jadérkem. (44)
Pilovité léze u IBD – SSL-like, TSA-like léze
Výskyt pilovitých lézí v terénu IBD je možný a jedná se obvykle o léze, které odpovídají morfologicky sporadickým SSL/TSA ve střevě pacientů bez IBD. Nicméně jsou-li tyto léze zastiženy v oblasti střeva postiženého idiopatickým zánětem, je vhodné je reportovat jako lézi podobnou SSL nebo TSA – tedy jako SSL-like nebo TSA-like lézi. (13,14,44,98,127)
Léze typu SSL jsou charakterizovány prodlouženými kryptami s výraznou pilovitou změnou. Proliferační zóna není umístěna do baze krypty, ale obvykle laterálně a krypty jsou asymetrické. Baze krypt jsou navíc dilatované až cysticky rozšířené nebo jeví laterální protruze do tvaru písmene „L“ nebo obráceného písmene „T“. Jádra SSA/P mohou být nenápadná a blandní nebo vykazovat různý stupeň atypií (vezikulární jádra) a mohou mít patrná jadérka. (obr. 16) (13,14,127)
Obr. 16. Léze podobná ploché pilovité lézi (SSL-like léze) v terénu ulcerózní kolitidy. Rozsáhlá SSL-like léze v resekátu s pilovitou architektonikou včetně dilatovaných a větvených krypt. Pilovité změny postihují i oblast zánětlivého pseudopolypu. V části léze je patrné výraznější větvení žlázek a zvětšená jádra odpovídající fokusu pilovité dysplázie (hematoxylin a eosin, 40x). 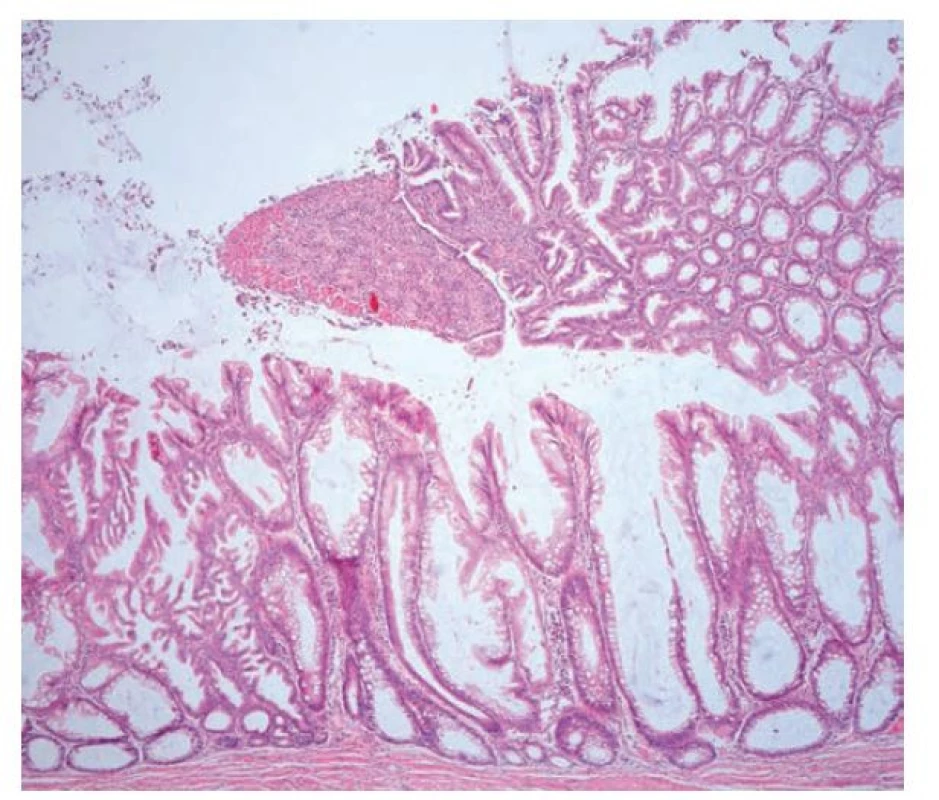
Léze podobné TSA pak jeví podobně komplexní stavbu, s prominentními pilovitými změnami, někdy s viliformním růstem a cylindrickými epiteliemi s protáhlými až tužkovitými jádry a nápadně eosinofilní cytoplazmou. Další typickou změnou je tzv. tvorba ektopických krypt (ECF, ectopic crypt formation). (13,14,127)
Dysplázie s deplecí pohárkových buněk (deplece pohárkových buněk, eosinofilní dysplázie)
Dysplázie s nápadnou deplecí pohárkových buněk má obvykle tubulární uspořádání. Pohárkové buňky téměř až zcela chybí a jsou nahrazeny enterocyty s eosinofilní cytoplazmou se zvětšenými protáhlými a hyperchromními jádry s minimální či chybějící stratifikací. V lumen tubulů může být přítomen eosinofilní materiál/sekret. (obr. 17) (13,14,98)
Obr. 17. Dysplázie s deplecí pohárkových buněk. Dysplázie s nápadnou deplecí pohárkových buněk má tubulární uspořádání. Pohárkové buňky téměř až zcela chybí a jsou nahrazeny enterocyty s eosinofilní cytoplazmou se zvětšenými protáhlými a hyperchromními jádry s minimální či chybějící stratifikací (hematoxylin a eosin, 200x). 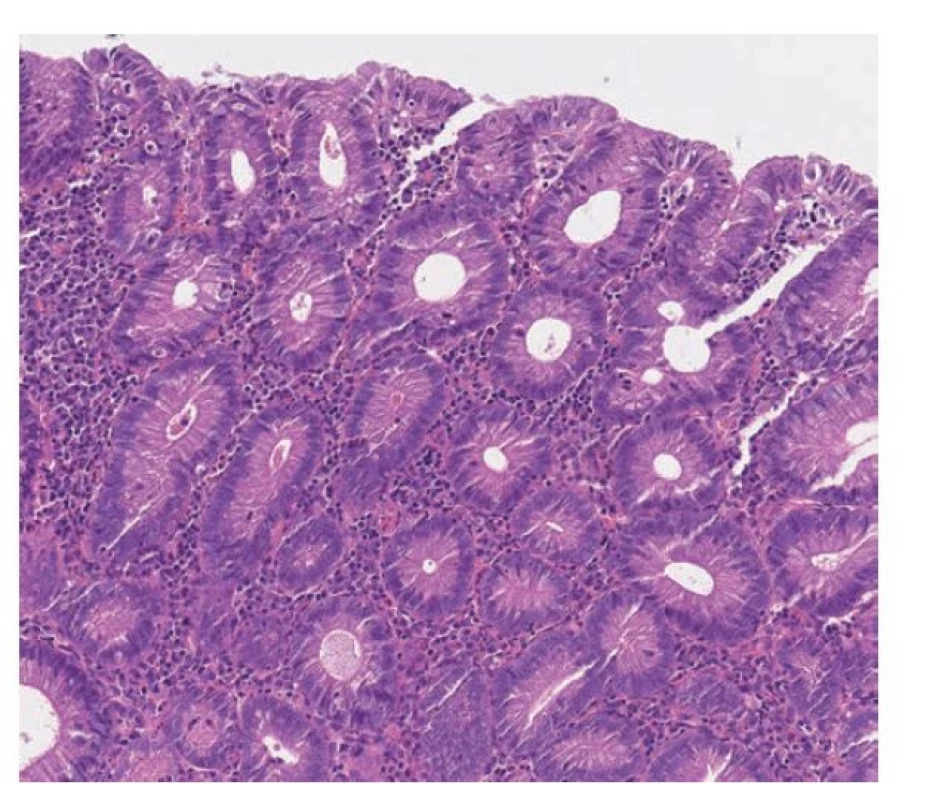
Diferencovaná dysplázie (dysplázie s terminální diferenciací) a dysplázie s Panethovými buňkami
Tento typ dysplázie má obvykle tubulární nebo tubulovilózní charakter a dysplastické krypty jsou lemovány elementy enterocytárního charakteru s protáhlými jádry, pohárkové buňky jsou obvykle redukované. Jádra jsou okrouhlá nebo oválná, lehce nepravidelná a hyperchromní, bez nápadnější stratifikace, s nevýraznými jadérky. Diferenciace směrem k Panethovým buňkám se zvýšeným počtem oproti okolní sliznici je zastižena minimálně ve dvou sousedních kryptách ve dvou různých fokusech. (13,14) (obr. 18)
Obr. 18. Diferencovaná dysplázie s Panethovými buňkami. V diferencované dysplázii převažují elementy enterocytárního charakteru s protáhlými jádry, která jsou v této lézi hyperchromní. Patrné jsou hojné Panethovy buňky v četných kryptách (hematoxylin a eosin, 200x). 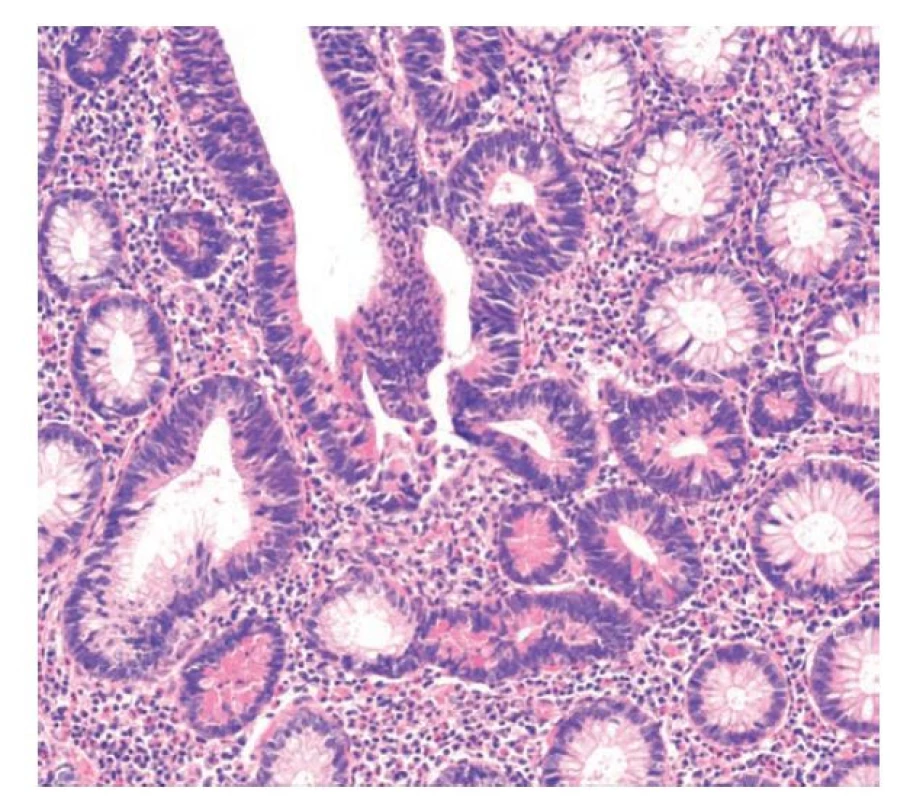
V některých případech jsou změny patrné především v hloubce žlázek, resp. při bazi krypt. Někteří autoři tento typ změn v rámci studií popisují samostatně jako tzv. kryptovou dysplázii, nicméně přesná kritéria pro definici této léze jako samostatné jednotky dosud neexistují. (128-130)
Recentní studie zabývající se nekonvenčními prekurzorovými lézemi v terénu IBD prokázaly ztrátu exprese MGMT a aberantní expresi p53 v části lézí. (12) Ztráta exprese MLH1 a SATB2 byla prokázána pouze v menší části případů (do 20 %). (131) Na molekulární úrovni jsou nejčastěji testovány a prokázány mutace v genech KRAS a BRAF, a to včetně průkazu shodné mutace v prekurzorové lézi a přilehlém invazivním karcinomu. (120,131) Mutace BRAF je obvykle častější v pilovitých lézích. (44)
High-grade konvenční IBD-dysplázie, a to především v plochých nebo endoskopicky neviditelných lézích, je spojena s výskytem synchronního nebo časně navazujícího karcinomu až u 42–67 % případů. (105) Naopak progrese LGD je nižší a riziko vzniku KRK je popisováno u menšího počtu pacientů (3–8 %). (105) Faktory, které ovlivňují progresi LGD do HGD nebo karcinomu, jsou především makroskopicky nepolypoidní charakter léze, rozsah dysplastické léze větší než 1 cm a opakovaná diagnóza „neurčitý pro dysplázii“ v předchozích endoskopických vyšetřeních. (129) Rozlišení tíže IBD-asociované dysplázie a odlišení regenerativních změn je tedy zásadní pro rozhodování ohledně dalšího terapeutického postupu, včetně určení četnosti kontrolních endoskopických vyšetření, nebo pro rozhodování o následné chirurgické léčbě jako je profylaktické kolektomie, která je indikována u pacientů s detekovanou high-grade IBD dysplázií. (99,10,104)
Přestože je prokázána progrese různých typů nekonvenčních dysplastických lézí u IBD do invazivního karcinomu, přesná míra maligního potenciálu těchto lézí známá není. (12-14) Recentní studie prokázala u pacientů s pilovitou epiteliální změnou (SEC) větší šanci výskytu dalšího typu dysplázie v kontrolních biopsiích v rámci sledování oproti pacientům bez SEC. (126) Jak ukazují klinické studie, endoskopická detekce nekonvenčních lézí spadá často do problematické kategorie tzv. endoskopicky neviditelné léze a cílené sledování a detekce těchto lézí je možná jen u menší části lézí. (124,125) Postavení a význam těchto lézí v rámci dlouhodobého sledování pacientů, rozvoje invazivního karcinomu i případných klinických konsekvencí je tedy stále otázkou výzkumu. Nicméně již nyní je zřejmé, že povědomí o různých typech nekonvenčních IBD-asociovaných dysplastických změn je nutné i pro rutinní praxi.
ZÁVĚR
Nekonvenční typy dysplastických změn patří mezi méně časté léze GIT, nicméně jejich rozpoznání je důležité i v rutinní praxi. Přestože u některých lézí nejsou ještě pro jejich vzácnost známy všechny aspekty jejich biologického chování, správné rozpoznání nekonvenční dysplastické léze může mít vliv na algoritmus sledování pacientů nebo vést k odhalení asociace s familiárním syndromem. Především pak v terénu IBD je povědomí o nekonvenčních typech dysplázie a jejich rozpoznání v běžné praxi kruciální, protože může umožnit jejich další výzkum a přinést nové a přesnější informace o jejich biologickém potenciálu.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
PODĚKOVÁNÍ
Práce je podpořena projektem BBMRI-CZ LM2018125.
Adresa pro korespondenci:
MUDr. Kateřina Kamarádová, Ph.D.
Fingerlandův ústav patologie
Fakultní nemocnice Hradec Králové
Sokolská 581
500 03, Hradec Králové
email: katerina.kamaradova@fnhk.cz
Zdroje
1. Montgomery EA, Arnold CA, Lam-Himlin DM, et al. Some Morphology Frontiers of Dysplasia in the Tubular Gastrointestinal Tract: The Rodger C. Haggitt Memorial Lecture. Am J Surg Pathol. 2020; Epub ahead of print.
2. Lomo LC, Blount PL, Sanchez CA, et al. Crypt dysplasia with surface maturation: a clinical, pathologic, and molecular study of a Barrett‘s esophagus cohort. Am J Surg Pathol 2006; 30(4): 423-435.
3. Agoston AT, Odze RD. Evidence that gastric pit dysplasia-like atypia is a neoplastic precursor lesion. Hum Pathol 2014;45(3):446-455.
4. Rubio CA. Serrated adenoma of the duodenum. J Clin Pathol. 2004; 57(11): 1219-1221.
5. Rosty C, Campbell C, Clendenning M, et al. Do serrated neoplasms of the small intestine represent a distinct entity? Pathological findings and molecular alterations in a series of 13 cases. Histopathology 2015; 66(3): 333-342.
6. Sarbia M, Jüttner S, Bettstetter M, Berndt R. Serratierte Polypen des Duodenums. Drei Fälle mit immunhistologischen und molekularpathologischen Befunden. Pathologe 2013; 34(4): 347-351.
7. Rubio CA. Serrated neoplasia of the stomach: a new entity. J Clin Pathol 2001; 54(11): 849 - 853.
8. Rubio CA, Tanaka K, Befrits R. Traditional serrated adenoma in a patient with Barrett‘ s esophagus. Anticancer Res 2013; 33(4): 1743-1745.
9. Vieth M, Kushima R, Borchard F, Stolte M. Pyloric gland adenoma: a clinico-pathological analysis of 90 cases. Virchows Arch 2003; 442(4): 317-321.
10. Vieth M, Vogel C, Kushima R, et al. Pyloric gland adenoma- - how to diagnose? Cesk Patol 2006; 42(1):4-7.
11. Chan K, Brown IS, Kyle T, et al. Chief cell-predominant gastric polyps: a series of 12 cases with literature review. Histopathology 2016; 68(6): 825-833.
12. Kamarádová K, Vošmiková H, Rozkošová K, et al. Non-conventional mucosal lesions (serrated epithelial change, villous hypermucinous change) are frequent in patients with inflammatory bowel disease-results of molecular and immunohistochemical single institutional study. Virchows Arch 2020; 476(2): 231-241.
13. Choi WT, Yozu M, Miller GC, et al. Nonconventional dysplasia in patients with inflammatory bowel disease and colorectal carcinoma: a multicenter clinicopathologic study. Mod Pathol 2020; 33(5): 933-943.
14. Gui X, Iacucci M, Ghosh S, et al. Revisiting the distinct histomorphologic features of inflammatory bowel disease-associated neoplastic precursor lesions in the SCENIC and post-DALM Era. Hum Pathol 2020; 100 : 24-37.
15. Riddell RH, Goldman H, Ransohoff DF, et al. Dysplasia in inflammatory bowel disease: standardized classification with provisional clinical applications. Hum Pathol 1983; 14(11): 931-968.
16. Vieth M, Quirke P, Lambert R, et al. Quality assurance in pathology in colorectal cancer screening and diagnosis: annotations of colorectal lesions. Virchows Arch 2011; 458(1) :21-30.
17. WHO Classification of Tumours Editorial Board. Digestive system tumours. Lyon (France): International Agency for Research on Cancer; 2019 : 83-92.
18. Shin N, Jo HJ, Kim WK, et al. Gastric pit dysplasia in adjacent gastric mucosa in 414 gastric cancers: prevalence and characteristics. Am J Surg Pathol 2011; 35(7): 1021-1029.
19. Li Y, Chang X, Zhou W, et al. Gastric intestinal metaplasia with basal gland atypia: a morphological and biologic evaluation in a large Chinese cohort. Hum Pathol 2013; 44(4): 578 - 590.
20. Tava F, Luinetti O, Ghigna MR, et al. Type or extension of intestinal metaplasia and immature/ atypical „indefinite-for-dysplasia“ lesions as predictors of gastric neoplasia. Hum Pathol 2006; 37(11): 1489-1497.
21. Goldblum JR. Current issues in Barrett‘ s esophagus and Barrett‘s-related dysplasia. Mod Pathol 2015; 28 Suppl 1: S1-6.
22. Odze RD. Diagnosis and grading of dysplasia in Barrett‘s oesophagus. J Clin Pathol 2006; 59(10) :1029-1038.
23. Kim A, Ahn SJ, Park DY, et al. Gastric crypt dysplasia: a distinct subtype of gastric dysplasia with characteristic endoscopic features and immunophenotypic and biological anomalies. Histopathology 2016; 68(6): 843 - 849.
24. Odze RD. Update on the diagnosis and treatment of Barrett esophagus and related neoplastic precursor lesions. Arch Pathol Lab Med 2008; 132(10): 1577-1585.
25. Zhang X, Huang Q, Goyal RK, Odze RD. DNA ploidy abnormalities in basal and superficial regions of the crypts in Barrett‘s esophagus and associated neoplastic lesions. Am J Surg Pathol 2008; 32(9): 1327-1335.
26. Khan S, McDonald SA, Wright NA, et al. Crypt dysplasia in Barrett‘s oesophagus shows clonal identity between crypt and surface cells. J Pathol 2013; 231(1): 98-104.
27. Sheridan TB, Fenton H, Lewin MR, et al. Sessile serrated adenomas with low - and high-grade dysplasia and early carcinomas: an immunohistochemical study of serrated lesions „caught in the act“. Am J Clin Pathol 2006; 126(4): 564-571.
28. Liu C, Walker NI, Leggett B, et al. Sessile serrated adenomas with dysplasia: morphological patterns and correlations with MLH1 immunohistochemistry. Mod Pathol 2017; 30(12): 1728-1738.
29. Pai RK, Bettington M, Srivastava A, Rosty C. An update on the morphology and molecular pathology of serrated colorectal polyps and associated carcinomas. Mod Pathol 2019; 32(10): 1390-1415.
30. Cenaj O, Gibson J, Odze RD. Clinicopathologic and outcome study of sessile serrated adenomas/polyps with serrated versus intestinal dysplasia. Mod Pathol 2018; 31(4): 633 - 642
31. Rex DK, Ahnen DJ, Baron JA, et al. Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol 2012; 107(9): 1315-1329.
32. Bettington M, Walker N, Clouston A, et al. The serrated pathway to colorectal carcinoma: current concepts and challenges. Histopathology 2013; 62(3): 367-386.
33. Kwon MJ, Min BH, Lee SM, et al. Serrated adenoma of the stomach: a clinicopathologic, immunohistochemical, and molecular study of nine cases. Histol Histopathol 2013; 28(4): 453-462.
34. Kiremitçi S, Cansız Ersöz C, et al. Gastric and small intestinal traditional serrated adenomas: a detailed morphologic and immunohistochemical analysis. Turk J Gastroenterol 2020; 31(6): 441-450.
35. Vieth M, Montgomery EA, Riddell RH. Observations of different patterns of dysplasia in barretts esophagus - a first step to harmonize grading. Cesk Patol 2016; 52(3): 154-163.
36. Naini BV, Souza RF, Odze RD. Barrett‘ s Esophagus: A Comprehensive and Contemporary Review for Pathologists. Am J Surg Pathol 2016; 40(5): e45-66.
37. Odze RD. What the gastroenterologist needs to know about the histology of Barrett‘ s esophagus. Curr Opin Gastroenterol 2011; 27(4): 389-986.
38. Rubio CA. Traditional serrated adenomas of the upper digestive tract. J Clin Pathol 2016; 69(1): 1-5.
39. Rubio CA, Björk J. Serrated adenoma of the stomach: Case report and literature review. World J Gastrointest Endosc 2013; 5(5): 261 - 264.
40. Rubio CA, Lagergren J. Serrated adenomas of the cardia. Anticancer Res 2004; 24(3b): 2113-2116.
41. Rubio CA, Schmidt PT. An additional case of gastric serrated adenoma. Anticancer Res 2014; 34(6):3 7-10.
42. Cao HL, Dong WX, Xu MQ, et al. Clinical features of upper gastrointestinal serrated lesions: An endoscopy database analysis of 98746 patients. World J Gastroenterol 2016; 22(45): 10038-10044.
43. Iwamuro M, Hori K, Tanaka T, Okada H. Serrated polyp of the duodenum. Gastrointest Endosc 2015; 82(5): 966-967; discussion 967.
44. Pereira D, Kővári B, Brown I, et al. Non-conventional dysplasias of the tubular gut: a review and illustration of their histomorphological spectrum. Histopathology 2021; 78(5): 658-675.
45. Brown IS, Whiteman DC, Lauwers GY. Foveolar type dysplasia in Barrett esophagus. Mod Pathol 2010; 23(6): 834-843.
46. Abraham SC, Montgomery EA, Singh VK, et al. Gastric adenomas: intestinal-type and gastric-type adenomas differ in the risk of adenocarcinoma and presence of background mucosal pathology. Am J Surg Pathol 2002; 26(10): 1276-1285.
47. Park DY, Srivastava A, Kim GH, et al. Adenomatous and foveolar gastric dysplasia: distinct patterns of mucin expression and background intestinal metaplasia. Am J Surg Pathol 2008; 32(4): 524-533.
48. Mannan AASR, Vieth M, Khararjian A, et al. The outlet patch: gastric heterotopia of the colorectum and anus. Histopathology 2018; 73(2): 220-229.
49. Goldblum JR. Controversies in the diagnosis of Barrett esophagus and Barrett-related dysplasia: one pathologist‘s perspective. Arch Pathol Lab Med 2010; 134(10): 1479-1784. Erratum in: Arch Pathol Lab Med 2010; 134(12): 1729.
50. Mahajan D, Bennett AE, Liu X, et al. Grading of gastric foveolar-type dysplasia in Barrett‘ s esophagus. Mod Pathol 2010; 23(1): 1-11.
51. Khor TS, Alfaro EE, Ooi EM, et al. Divergent expression of MUC5AC, MUC6, MUC2, CD10, and CDX-2 in dysplasia and intramucosal adenocarcinomas with intestinal and foveolar morphology: is this evidence of distinct gastric and intestinal pathways to carcinogenesis in Barrett Esophagus? Am J Surg Pathol 2012 Mar;36(3): 331-342.
52. Patil DT, Bennett AE, Mahajan D, et al. Distinguishing Barrett gastric foveolar dysplasia from reactive cardiac mucosa in gastroesophageal reflux disease. Hum Pathol 2013; 44(6): 1146-1153.
53. Chlumská A, Mukenšnabl P, Waloschek T, Zámečník M. Esophageal dysplasia and adenocarcinoma: a study with double immunostaining for intestinal and gastric markers. Cesk Patol 2018; 54(2): 81-85.
54. Sugai T, Uesugi N, Habano W, et al. The clinicopathological and molecular features of sporadic gastric foveolar type neoplasia. Virchows Arch 2020; 477(6): 835-844.
55. Rucker-Schmidt RL, Sanchez CA, Blount PL, et al. Nonadenomatous dysplasia in barrett esophagus: a clinical, pathologic, and DNA content flow cytometric study. Am J Surg Pathol 2009; 33(6): 886-893.
56. Hattori T. Morphological range of hyperplastic polyps and carcinomas arising in hyperplastic polyps of the stomach. J Clin Pathol 1985; 38(6): 622-630.
57. Abraham SC, Park SJ, Mugartegui L, et al. Sporadic fundic gland polyps with epithelial dysplasia: evidence for preferential targeting for mutations in the adenomatous polyposis coli gene. Am J Pathol. 2002; 161(5): 1735 - 1742.
58. Stolte M, Vieth M, Ebert MP. High-grade dysplasia in sporadic fundic gland polyps: clinically relevant or not? Eur J Gastroenterol Hepatol 2003;15(11): 1153-1156.
59. Wu TT, Kornacki S, Rashid A, et al. Dysplasia and dysregulation of proliferation in foveolar and surface epithelia of fundic gland polyps from patients with familial adenomatous polyposis. Am J Surg Pathol 1998; 22(3): 293-298.
60. Abraham SC, Nobukawa B, Giardiello FM, et al. Fundic gland polyps in familial adenomatous polyposis: neoplasms with frequent somatic adenomatous polyposis coli gene alterations. Am J Pathol 2000; 157(3): 747-754.
61. Worthley DL, Phillips KD, Wayte N, et al. Gastric adenocarcinoma and proximal polyposis of the stomach (GAPPS): a new autosomal dominant syndrome. Gut 2012; 61(5): 774-779.
62. de Boer WB, Ee H, Kumarasinghe MP. Neoplastic Lesions of Gastric Adenocarcinoma and Proximal Polyposis Syndrome (GAPPS) Are Gastric Phenotype. Am J Surg Pathol 2018; 42(1): 1-8.
63. Shibagaki K, Fukuyama C, Mikami H, et al. Gastric foveolar-type adenomas endoscopically showing a raspberry-like appearance in the Helicobacter pylori -uninfected stomach. Endosc Int Open 2019; 7(6): E784-E791.
64. Sakurai T, Sakashita H, Honjo G, et al. Gastric foveolar metaplasia with dysplastic changes in Brunner gland hyperplasia: possible precursor lesions for Brunner gland adenocarcinoma. Am J Surg Pathol 2005; 29(11): 1442-1448.
65. Valente P, Garrido M, Gullo I, et al. Epithelial dysplasia of the stomach with gastric immunophenotype shows features of biological aggressiveness. Gastric Cancer 2015; 18(4): 720-728.
66. Choi WT, Brown I, Ushiku T, et al. Gastric pyloric gland adenoma: a multicentre clinicopathological study of 67 cases. Histopathology 2018; 72(6): 1007-1014.
67. Pezhouh MK, Park JY. Gastric pyloric gland adenoma. Arch Pathol Lab Med 2015; 139(6): 823-826.
68. Chlumská A, Waloschek T, Mukenšnabl P, et al. Pyloric gland adenoma: a histologic, immunohistochemical and molecular genetic study of 23 cases. Cesk Patol 2015; 51(3): 137 - 143. PMID:
69. Vieth M, Kushima R, de Jonge JP, et al. Adenoma with gastric differentiation (so-called pyloric gland adenoma) in a heterotopic gastric corpus mucosa in the rectum. Virchows Arch 2005; 446(5): 542-545.
70. Miller GC, Kumarasinghe MP, Borowsky J, et al. Clinicopathological features of pyloric gland adenomas of the duodenum: a multicentre study of 57 cases. Histopathology 2020; 76(3): 404-410.
71. Chen ZM, Scudiere JR, Abraham SC, Montgomery E. Pyloric gland adenoma: an entity distinct from gastric foveolar type adenoma. Am J Surg Pathol 2009; 33(2): 186-193.
72. Vieth M, Kushima R, Mukaisho K, et al. Immunohistochemical analysis of pyloric gland adenomas using a series of Mucin 2, Mucin 5AC, Mucin 6, CD10, Ki67 and p53. Virchows Arch 2010; 457(5): 529-536.
73. Nagata S, Ajioka Y, Nishikura K, et al. Co-expression of gastric and biliary phenotype in pyloric-gland type adenoma of the gallbladder: immunohistochemical analysis of mucin profile and CD10. Oncol Rep 2007; 17(4): 721 - 729.
74. Wood LD, Noë M, Hackeng W, et al. Patients with McCune-Albright syndrome have a broad spectrum of abnormalities in the gastrointestinal tract and pancreas. Virchows Arch 2017; 470(4): 391-400.
75. Hashimoto T, Ogawa R, Matsubara A, et al. Familial adenomatous polyposis-associated and sporadic pyloric gland adenomas of the upper gastrointestinal tract share common genetic features. Histopathology 2015; 67(5): 689-698.
76. Hackeng WM, Montgomery EA, Giardiello FM, et al. Morphology and genetics of pyloric gland adenomas in familial adenomatous polyposis. Histopathology 2017; 70(4): 549 - 557.
77. Lee SE, Kang SY, Cho J, et al. Pyloric gland adenoma in Lynch syndrome. Am J Surg Pathol 2014; 38(6): 784-792.
78. Wood LD, Salaria SN, Cruise MW, et al. Upper GI tract lesions in familial adenomatous polyposis (FAP): enrichment of pyloric gland adenomas and other gastric and duodenal neoplasms. Am J Surg Pathol 2014; 38(3): 389 - 393.
79. Setia N, Wanjari P, Yassan L, et al. Next-generation sequencing identifies 2 genomically distinct groups among pyloric gland adenomas. Hum Pathol 2020; 97 : 103-111.
80. Vieth M, Montgomery EA. Some observations on pyloric gland adenoma: an uncommon and long ignored entity! J Clin Pathol 2014; 67(10): 883-890.
81. Kushima R, Rüthlein HJ, Stolte M, et al. ‚Pyloric gland-type adenoma‘ arising in heterotopic gastric mucosa of the duodenum, with dysplastic progression of the gastric type. Virchows Arch 1999; 435(4): 452-457.
82. Mitsuishi T, Hamatani S, Hirooka S, et al. Clinicopathological characteristics of duodenal epithelial neoplasms: Focus on tumors with a gastric mucin phenotype (pyloric gland-type tumors). PLoS One 2017 Apr 4;12(4):e0174985.
83. Kushima R, Vieth M, Borchard F, et al. Gastric - type well-differentiated adenocarcinoma and pyloric gland adenoma of the stomach. Gastric Cancer 2006; 9(3): 177-184.
84. Kim K, Jang SJ, Song HJ, Yu E. Clinicopathologic characteristics and mucin expression in Brunner‘s gland proliferating lesions. Dig Dis Sci 2013; 58(1): 194-201.
85. Ma C, Giardiello FM, Montgomery EA. Upper tract juvenile polyps in juvenile polyposis patients: dysplasia and malignancy are associated with foveolar, intestinal, and pyloric differentiation. Am J Surg Pathol 2014; 38(12): 1618-1626.
86. Ueyama H, Yao T, Nakashima, et al. Gastric adenocarcinoma of fundic gland type (chief cell predominant type): proposal for a new entity of gastric adenocarcinoma. Am J Surg Pathol 2010; 34(5): 609-619.
87. Singhi AD, Lazenby AJ, Montgomery EA. Gastric adenocarcinoma with chief cell differentiation: a proposal for reclassification as oxyntic gland polyp/adenoma. Am J Surg Pathol 2012; 36(7): 1030-1035.
88. Kővári B, Kim BH, Lauwers GY. The pathology of gastric and duodenal polyps: current concepts. Histopathology 2021; 78(1): 106 - 124.
89. Ushiku T, Kunita A, Kuroda R, et al. Oxyntic gland neoplasm of the stomach: expanding the spectrum and proposal of terminology. Mod Pathol 2020; 33(2): 206-216.
90. Sato Y, Sato T, Matsushima J, et al. Histopathologic Change of a Case of Gastric Oxyntic Neoplasm (Gastric Adenocarcinoma of Fundic Gland Mucosa Type) Through 5 Years With Concurrent Other Oxyntic Gland Lesions. Int J Surg Pathol In press 2020
91. Tsukamoto T, Yokoi T, Maruta S, et al. Gastric adenocarcinoma with chief cell differentiation. Pathol Int 2007; 57(8): 517-522.
92. Dyson JK, Rutter MD. Colorectal cancer in inflammatory bowel disease: what is the real magnitude of the risk? World J Gastroenterol 2012; 18(29): 3839-3848.
93. Lukas M. Inflammatory bowel disease as a risk factor for colorectal cancer. Dig Dis 2010; 28 : 619-624.
94. Munkholm P. Review article: the incidence and prevalence of colorectal cancer in inflammatory bowel disease. Aliment Pharmacol Ther 2003; 18 : 1-5.
95. Ullman T, Odze R, Farraye FA. Diagnosis and Management of Dysplasia in Patients with Ulcerative Colitis and Crohn’s Disease of the Colon. Inflamm Bowel Dis 2009;15 : 630–638.
96. Neumann H, Vieth M, Langner C, et al. Cancer risk in IBD: How to diagnose and how to manage DALM and ALM. World J Gastroenterol 2011; 17(27): 3184-3191
97. Laine L, Kaltenbach T, Barkun A, et al. SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastrointest Endosc 2015; 81 : 489-501.
98. Choi WT. Non-conventional dysplastic subtypes in inflammatory bowel disease: a review of their diagnostic characteristics and potential clinical implications. J Pathol Transl Med 2021; 55(2): 83-93.
99. Magro F, Gionchetti P, Eliakim R, et al. Third European Evidence-based [5] Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders. J Crohns Colitis 2017; 11(6): 649 - 670.
100. Gomollón F, Dignass A, Annese V, et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis 2017; 11(1): 3-25.
101. Šerclová Z, Ryska O, Bortlík M, et al. Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 3. část: ulcerózní kolitida, indikace k operaci. Gastroent Hepatol 2016; 70(3): 252–261.
102. Šerclová Z, Ryska O, Bortlík M, et al. Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 2. část: Crohnova choroba. Gastroent Hepatol 2016; 70(3): 252–261. Gastroent Hepatol 2015; 69(3): 223–238
103. Jouret-Mourin A, Faa, G, Geboes, K (Eds.) Colitis. A Practical Approach to Colon and Ileum Biopsy Interpretation, Springer International Publishing Switzerland 2018
104. Magro F, Langner C, Driessen A, et al. European consensus on the histopathology of inflammatory bowel disease. J Crohns Colitis 2013; 7 : 827-851.
105. Langner C, Magro F, Driessen A, et al. The histopathological approach to inflammatory bowel disease: a practice guide. Virchows Arch 2014; 464(5): 511-527.
106. Scarpa M, Castagliuolo I, Castoro C, et al. Inflammatory colonic carcinogenesis: A review on pathogenesis and immunosurveillance mechanisms in ulcerative colitis. World J Gastroenterol 2014; 20(22): 6774–6785.
107. Gerrits MM, Chen M, Theeuwes M, et al. Biomarker-based prediction of inflammatory bowel disease-related colorectal cancer: a case-control study. Cell Oncol (Dordr). 2011; 34(2): 107-17.
108. van Schaik FD, Oldenburg B, Offerhaus GJ, et al. Role of immunohistochemical markers in predicting progression of dysplasia to advanced neoplasia in patients with ulcerative colitis. Inflamm Bowel Dis 2012; 18(3): 480 - 488.
109. Mueller E, Vieth M, Stolte M, Mueller J. The differentiation of true adenomas from colitis - associated dysplasia in ulcerative colitis: a comparative immunohistochemical study. Hum Pathol 1999; 30(8): 898-905.
110. Dorer R, Odze RD. AMACR immunostaining is useful in detecting dysplastic epithelium in Barrett‘s esophagus, ulcerative colitis, and Crohn‘s disease. Am J Surg Pathol 2006; 30(7): 871-877.
111. Marx A, Wandrey T, Simon P, et al. Combined alpha-methylacyl coenzyme A racemase/ p53 analysis to identify dysplasia in inflammatory bowel disease. Hum Pathol 2009; 40(2): 166-173.
112. Ma C, Henn P, Miller C, et. al. Loss of SATB2 Expression Is a Biomarker of Inflammatory Bowel Disease-associated Colorectal Dysplasia and Adenocarcinoma. Am J Surg Pathol 2019 ; 43(10): 1314-1322.
113. Iwaya M, Ota H, Tateishi Y, et al. Colitis-associated colorectal adenocarcinomas are frequently associated with non-intestinal mucin profiles and loss of SATB2 expression. Mod Pathol 2019; 32(6): 884-892.
114. Rubio CA, Johansson C, Slezak P, et al. Villous dysplasia: an ominous histologic sign in colitis patients. Dis. Colon Rectum 1984; 27 : 283–287.
115. Chaubert P, Benhattar J, Saraga E, et al. K-ras mutations and p53 alterations in neoplastic and nonneoplastic lesions associated with longstanding ulcerative colitis. Am J Pathol 1994; 144(4): 767-775.
116. Andersen SN, Lovig T, Clausen OP, et al. Villous, hypermucinous mucosa in long standing ulcerative colitis shows high frequency of K-ras mutations. Gut 1999; 45 : 686-692.
117. Kilgore SP, Sigel JE, Goldblum JR. Hyperplastic - Like Mucosal Change in Crohn’s Disease: An Unusual Form of Dysplasia? Mod Pathol 2000; 13 : 797–801.
118. Rubio CA. Serrated neoplasias and de novo carcinomas in ulcerative colitis: a histological study in colectomy specimens. J Gastroenterol Hepatol 2007; 22 : 1024-1031.
119. Rubio CA, Befrits R, Jaramillo E, Nesi G, Amorosi A. Villous and serrated adenomatous growth bordering carcinomas in inflammatory bowel disease. Anticancer Res 2000; 20(6C): 4761-4764.
120. Kamarádová K, Vošmiková H, Rozkošová K, et al. J. Morphological, immunohistochemical and molecular features of inflammatory bowel disease associated colorectal carcinoma and associated mucosal lesions - Single institution experience. Pathol Res Pract 2019; 215(4): 730-737.
121. Odze RD, Maley CC. Neoplasia without dysplasia: lessons from Barrett esophagus and other tubal gut neoplasms. Arch Pathol Lab Med 2010; 134(6): 896-906.
122. Harpaz N1, Ward SC, Mescoli C, et al. Precancerous lesions in inflammatory bowel disease. Best Pract Res Clin Gastroenterol 2013; 27 : 257-267
123. Parian AM, Lazarev MG. Serrated Colorectal Lesions in Patients With Inflammatory Bowel Disease. Gastroenterol Hepatol (N Y). 2018; 14(1): 19-25.
124. Parian A, Koh J, Limketkai BN, et al. Association between serrated epithelial changes and colorectal dysplasia in inflammatory bowel disease. Gastrointest Endosc 2016; 84 : 87-95
125. Johnson DH, Khanna S, Smyrk TC, et al. Detection rate and outcome of colonic serrated epithelial changes in patients with ulcerative colitis or Crohn’s colitis. Aliment Pharmacol Ther 2014; 39 : 1408-1417.
126. Batts KP, Atwaibi M, Weinberg DI, McCabe RP. Significance of serrated epithelial change in inflammatory bowel disease. Postgrad Med 2021; 133(1): 66-70.
127. Miller GC, Liu C, Bettington ML, et al. Traditional serrated adenoma-like lesions in patients with inflammatory bowel disease. Hum Pathol 2020;97 : 19-28.
128. Wen KW, Umetsu SE, Goldblum JR, et al. DNA flow cytometric and interobserver study of crypt cell atypia in inflammatory bowel disease. Histopathology 2019; 75(4): 578-588.
129. Choi CH, Ignjatovic-Wilson A, Askari A, et al. Low-grade dysplasia in ulcerative colitis: risk factors for developing high-grade dysplasia or colorectal cancer. Am J Gastroenterol 2015; 110(10): 1461-1471.
130. Lee H, Rabinovitch PS, Mattis AN, et al. Non-conventional dysplasia in inflammatory bowel disease is more frequently associated with advanced neoplasia and aneuploidy than conventional dysplasia. Histopathology 2021;78(6): 814-830.
131. Gui X, Köbel M, Ferraz JG, et al. Histological and molecular diversity and heterogeneity of precancerous lesions associated with inflammatory bowel diseases. J Clin Pathol 2020; 73(7): 391-402.
Štítky
Patologie Soudní lékařství Toxikologie
Článek 'UROPATOLOGIEČlánek 'HISTORIE PATOLOGIEČlánek 'PATOLOGIE GITČlánek 'HEMATOPATOLOGIEČlánek 'NEUROPATOLOGIEČlánek 'GYNEKOPATOLOGIEČlánek 'NEFROPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'PATOLOGIE ORL OBLASTIČlánek 'PULMOPATOLOGIEČlánek DOPIS REDAKCI
Článek vyšel v časopiseČesko-slovenská patologie

2022 Číslo 1-
Všechny články tohoto čísla
- 'UROPATOLOGIE
- 'HISTORIE PATOLOGIE
- Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace
- Morfologie zánětlivých střevních onemocnění (IBD)
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu
- Zemřel MUDr. Jiří Kudrmann (24. 10. 1928 – 21. 1. 2022)
- Nekonvenční typy dysplastických změn ve sliznici gastrointestinálního traktu – přehled morfologie jednotlivých podtypů
- Při volbě patologie nebylo třeba dlouhého váhaní
- 'PATOLOGIE GIT
- 'HEMATOPATOLOGIE
- Penilní parafinom: kazuistika
- Transplantace dělohy v léčbě ženské neplodnosti z pohledu patologa
- 'NEUROPATOLOGIE
- 'GYNEKOPATOLOGIE
- Prof. MUDr. Boris Habanec, DrSc., 90letý.
- Životné jubileum prof. MUDr. Lukáša Planka, CSc.
- DOPIS REDAKCI
- 'NEFROPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'PULMOPATOLOGIE
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Morfologie zánětlivých střevních onemocnění (IBD)
- Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace
- Nekonvenční typy dysplastických změn ve sliznici gastrointestinálního traktu – přehled morfologie jednotlivých podtypů
- Penilní parafinom: kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



