-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
Molecular diagnosis of hereditary canalicular cholestasis and familial hyperbilirubinemias
Molecular and differential diagnosis of hereditary canalicular cholestasis and predominantly conjugated jaundice, both characterised by autosomal recessive pattern of inheritance and low prevalence, is described. Classification of the disorders is presented in the introduction. Detailed description of clinical, laboratory and histology findings and typical results of mutation analysis follows. Published and yet unpublished results obtained in the Laboratory of Experimental Hepatology, IKEM, since 2002, are presented at the end.
Key words:
progressive familial intrahepatic cholestasis, recurrent familial intrahepatic cholestasis, intrahepatic cholestasis of pregnancy, Dubin-Johnson syndrome, Rotor syndrome.
Autoři: Milan Jirsa
Působiště autorů: Institut klinické a experimentální medicíny Praha, Laboratoř experimentální hepatologie, Pracoviště experimentální medicíny
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 7-13
Kategorie: Přehledový článek
Souhrn
Práce je věnována diagnostice, molekulární diagnostice a diferenciální diagnostice nejčastějších geneticky podmíněných cholestáz kanalikulárního typu a převážně konjugovaných hyperbilirubinémií, jejichž společným rysem je nízká prevalence a autozomálně recesivní dědičnost. V úvodu je podána klasifikace těchto nemocí. Následuje popis klinických projevů jednotlivých chorob, laboratorních a histologických nálezů a výsledků mutační analýzy příslušného genu, pokud je znám. Nakonec jsou prezentovány publikované i dosud nepublikované výsledky vyšetření českých a zahraničních nemocných provedených v Laboratoři experimentální hepatologie IKEM od jejího založení v roce 2002 až do současnosti.
Klíčová slova:
progresivní familiární intrahepatální cholestáza, rekurentní familiární intrahepatální cholestáza, těhotenská intrahepatální cholestáza, Dubin-Johnsonův syndrom, Rotorův syndrom.Úvod
Cholestáza je definována jako porucha sekrece nebo odtoku žluče v důsledku strukturních nebo biochemických abnormalit jaterních buněk či žlučovodů (1). Prvotní příčina intrahepatální cholestázy tkví buď v hepatocytech (kanalikulární typ cholestázy), nebo v drobných nitrojaterních žlučovodech (duktální typ cholestázy). Dědičné choroby, jejichž dominujícím projevem je kanalikulární cholestáza, zahrnují progresivní familiární cholestázu 1. až 3. typu, benigní rekurentní intrahepatální cholestázu 1. a 2. typu, syndrom familiární cholelitiázy z nedostatku biliární sekrece fosfolipidů, některé formy těhotenské intrahepatální cholestázy, dědičné poruchy syntézy a konjugace žlučových kyselin a několik dalších vzácných onemocnění (2). Dědičná predispozice hraje úlohu i u polékové intrahepatální cholestázy včetně cholestázy indukované hormonálními kontraceptivy.
Familiární nehemolytické žloutenky jsou izolované hyperbilirubinémie bez cholestázy. Podle poměru nekonjugovaného a konjugovaného bilirubinu se dělí na převážně nekonjugované hyperbilirubinémie (Crigler-Najjarův syndrom I. a II. typu a benigní hyperbilirubinémii Gilbertova typu) a převážně konjugované hyperbilirubinémie (Dubin-Johnsonův a Rotorův syndrom) (3).
Předkládaná práce podložená vlastní desetiletou zkušeností je věnována diagnostice, molekulární diagnostice a diferenciální diagnostice nejčastějších dědičných cholestáz kanalikulárního typu a familiárních převážně konjugovaných hyperbilirubinémií.
Progresivní familiární intrahepatální cholestáza
Progresivní familiární intrahepatální cholestáza (PFIC) je souhrnný název pro geneticky heterogenní skupinu autozomálně recesivně dědičných nemocí dětského věku podmíněných mutacemi v genech kódujících kanalikulární proteiny odpovědné za transport žlučových kyselin a fosfolipidů z hepatocytů do žluči (4, 5) (obr. 1). Klinicky se PFIC obvykle manifestuje v 1. roce života žloutenkou, těžkým pruritem, hepatosplenomegalií, steatoreou, anorexií, retardací růstu a psychického vývoje. Dále bývají přítomny symptomy deficitu vitaminů rozpustných v tucích: koagulopatie, osteopenie a neuromuskulární poruchy (6). Bez adekvátní léčby choroba progreduje do jaterní fibrózy až cirhózy a končí obvykle smrtí v důsledku jaterního selhání v první či vzácněji ve druhé dekádě. Konzervativní léčba zahrnuje podávání kyseliny ursodeoxycholové, simvastatinu, cholestyraminu a rifampicinu a bývá obvykle bez většího efektu. Chirurgická léčba – ileální bypass či nověji parciální drenáž žluči cholecystostomií (7), jejímž cílem je efektivně redukovat pool žlučových kyselin a zabránit tvorbě toxických hydrofobních sekundárních žlučových kyselin, může oddálit potřebu transplantace jater, která je v současné době jedinou účinnou léčebnou metodou.
Obr. 1. Bazolaterální transportéry solí žlučových kyselin a kanalikulární transportéry žlučových lipidů a pigmentů. 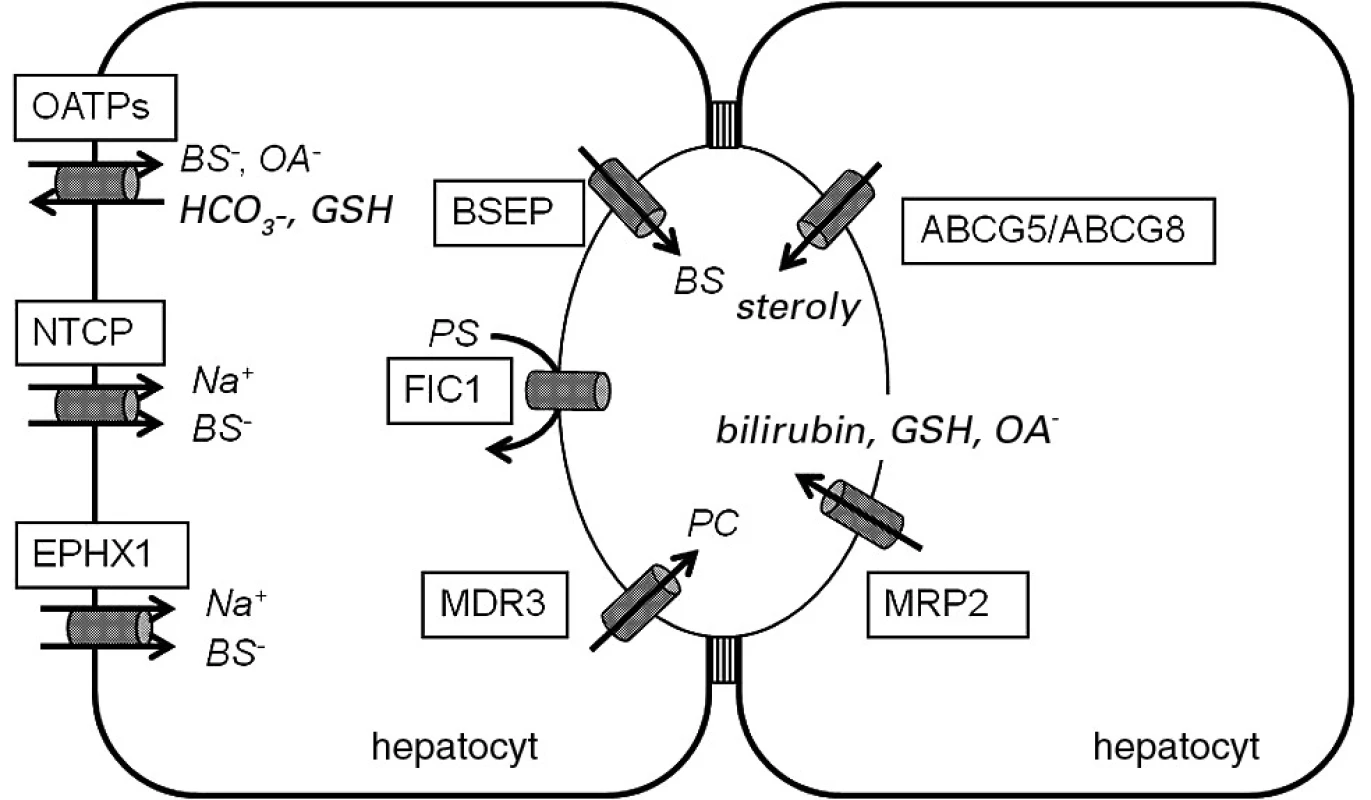
OATPs – organic anion transporting polypeptides, NTCP – Na+- taurocholate cotransporting polypeptide, EPHX1 – microsomal epoxide hydrolase, BSEP – bile salt export pump, FIC1 – familial intrahepatic cholestasis 1, MDR3 – multidrug resistance protein 3, ABCG5/ABCG8 – ATP-binding cassette protein, subfamily G, member 5/member 8, MRP2 – multidrug resistance-associated protein 2, BS – bile salts, OA – organické anionty, GSH – glutation, PS – fosfatidylserin Progresivní familiární intrahepatální cholestáza 1. typu (PFIC1)
PFIC1 (OMIM#211600), nazývaná původně Bylerova nemoc (8), je podmíněna defektem v genu ATP8B1 kódujícím ATPázu ATP8B1/FIC1 (Familial Intrahepatic Cholestasis 1) lokalizovaném na dlouhém raménku 18. chromosomu (18q21) (9). Gen ATP8B1 je z fylogenetického hlediska řazen do čtvrté třídy ATPáz typu P (http://www.patbase.kvl.dk/), sestává z 27 protein kódujících exonů a z dosud neznámého počtu exonů v 5’ - nepřekládané oblasti. Umístění regulačních oblastí genu ani mechanismy regulace jeho exprese nejsou známy. Stejně tak není znám počet, přesná délka a relativní zastoupení jednotlivých transkriptů.
Protein ATP8B1 je nejvíce exprimován v apikální membráně enterocytů s maximem v ileu, v kanalikulární membráně hepatocytů, v apikální membráně acinárních buněk pankreatu, v menší míře pak v mnoha dalších tkáních (10). ATP8B1 působí jako flipáza translokující aminofosfolipidy z vnějšího do vnitřního listu apikální membrány polarizovaných epitelií, ve kterých je exprimována (11, 12). V hepatocytech se ATP8B1 podílí na sekreci žlučových kyselin z hepatocytů do žluči, přesný molekulární mechanismus není objasněn.
Mezi klinické projevy PFIC1 patří kromě výše popsaných příznaků PFIC i symptomy extrahepatální – vodnatý průjem, poruchy sluchu a/nebo pankreatitida. Tyto symptomy přetrvávají i po transplantaci jater. Laboratorně je přítomna cholestáza s nízkou sérovou koncentrací γGT. Hladina cholesterolu je normální. Sérová koncentrace primárních žlučových kyselin je zvýšena. Hodnoty jaterních aminotransferáz jsou zpočátku v referenčním rozmezí, s progresí choroby postupně stoupají až na desetinásobek normálních hodnot (13). Histologický nález – různě těžký stupeň jaterní fibrózy až cirhózy a intrahepatální cholestáza – závisí na pokročilosti onemocnění. V elektronové mikroskopii je typický nález „Bylerovy“ hrubě granulární žluči ve žlučových kanalikulech, jejíž vznik se vysvětluje zvýšenou koncentrací aminofosfolipidů ve žluči (12). Diagnostický význam má imunohistochemický průkaz absence proteinu ATP8B1 v kanalikulární membráně. Vzhledem k tomu, že neexistuje protilátka proti ATP8B1 vhodná pro použití v parafinových řezech, je imunohistochemická diagnostika použitelná jen velmi omezeně. Molekulární diagnóza se opírá o nález mutace (mutací) v obou alelách genu ATP8B1.
V našem souboru nemocných bylo podezření na Bylerovu chorobu vysloveno u dvou českých a jednoho řeckého nemocného. Diagnóza byla potvrzena pouze v jedné rodině českého původu – šestiletý proband se ukázal být složeným heterozygotem pro dříve popsanou mutaci c.2097+2T>C, jejímž předpokládaným důsledkem je abnormální sestřih kódované mRNA (9), a novou missense mutaci c.2677G>C, jejímž předpokládaným důsledkem je aminokyselinová záměna p.Asp893His v konzervované sekvenci III. ATPase signature domény. U řecké rodiny byla molekulárním vyšetřením stanovena diagnóza PFIC2, ve druhé české rodině nebyly nalezeny mutace v žádném z genů ATP8B1 a ABCB11.
Progresivní familiární intrahepatální cholestáza 2. typu (PFIC2)
PFIC2 (OMIM#601847) je způsobena defektem v genu ABCB11 kódujícím ATP-dependentní pumpu žlučových kyselin konjugovaných s taurinem či s glycinem nazývanou BSEP (bile salt export pump) (14). Gen ABCB11 se nachází na dlouhém raménku 2. chromosomu (2q24), sestává z 28 exonů a zaujímá 109 kb. První exon není překládán. Fylogeneticky náleží ABCB11 do podrodiny B rodiny ABC transportérů (http://nutrigene.4t.com/humanabc.htm). Transkript o délce 4776 bp (GenBank Acc. No. AF_091582) kóduje membránový protein o relativní molekulové hmotnosti 160 kDa. Protein BSEP je exprimován výlučně v kanalikulární membráně hepatocytů (15, 16). Regulace exprese BSEP byla detailně studována (17). Rozhodující oblastí pro regulaci a tkáňovou specifitu exprese je proximální promotor v rozsahu cca 1200 bp před začátkem transkripce. Významnou úlohu v regulaci transkripce genu ABCB11 hraje nukleární transkripční faktor farnesoid X-aktivovaný receptor (FXR), který je zároveň důležitým regulátorem homeostázy cholesterolu (18). FXR po navázání žlučové kyseliny jakožto nízkomolekulárního ligandu vytváří heterodimer s retinoid X-receptorem (RXR) vázajícím kyselinu retinovou. Takto vzniklý transkripční komplex aktivuje trankripci genu ABCB11. K aktivaci dochází při zvýšené koncentraci žlučových kyselin v cytoplazmě hepatocytů, a to buď vychytávaných z portální krve, nebo syntetizovaných de novo. Zpětnovazebná regulace transkripce zprostředkovaná FXR/RXR představuje významný ochranný mechanismus hepatocytů proti toxicitě žlučových kyselin při cholestáze.
Klinický průběh i laboratorní nález PFIC2 je podobný PFIC1, extrahepatální příznaky však nejsou přítomny. Oproti PFIC1 dochází u nemocných s PFIC2 ke vzniku žlučových konkrementů a k časné elevaci sérové aktivity aminotransferáz. Histologicky je typický obraz obrovskobuněčné hepatitidy. Elektronmikroskopicky je kanalikulární žluč amorfní nebo filamentózní. Spolehlivé odlišení PFIC1 a PFIC2 je možné pouze imunohistologickým a/nebo molekulárně genetickým vyšetřením. Imunohistologicky je BSEP u PFIC2 zpravidla nedetekovatelný. Imunohistologický průkaz deficitu BSEP je možné provést v parafinových formaldehydem fixovaných řezech, avšak pouze pomocí komerčně nedostupných protilátek. Neléčená PFIC2 obvykle vykazuje rychlejší progresi jaterní fibrózy. Po transplantaci jater dochází k ústupu všech příznaků onemocnění. Možnou komplikací PFIC2 je vznik hepatobiliárních malignit, které u PFIC1 nebyly nikdy pozorovány (19, 20).
V našem souboru jsme diagnózu PFIC2 potvrdili u čtyř z osmi indikovaných českých kandidátů a u šesti ze šesti indikovaných zahraničních kandidátů. Dále byla diagnóza PFIC2 stanovena u řeckého probanda indikovaného jako PFIC1. Zachycené mutace jsou uvedeny v tabulce 1. Výsledky českých nemocných z let 2002–2007 byly zahrnuty do studie Strautnieks et al. (21), která ukázala, že pacienti s PFIC2 a zejména nosiči nulových mutací jsou predisponováni ke vzniku hepatocelulárního karcinomu v dětském věku.
Tab. 1. Mutace v genu ABCB11 nalezené u nemocných s PFIC 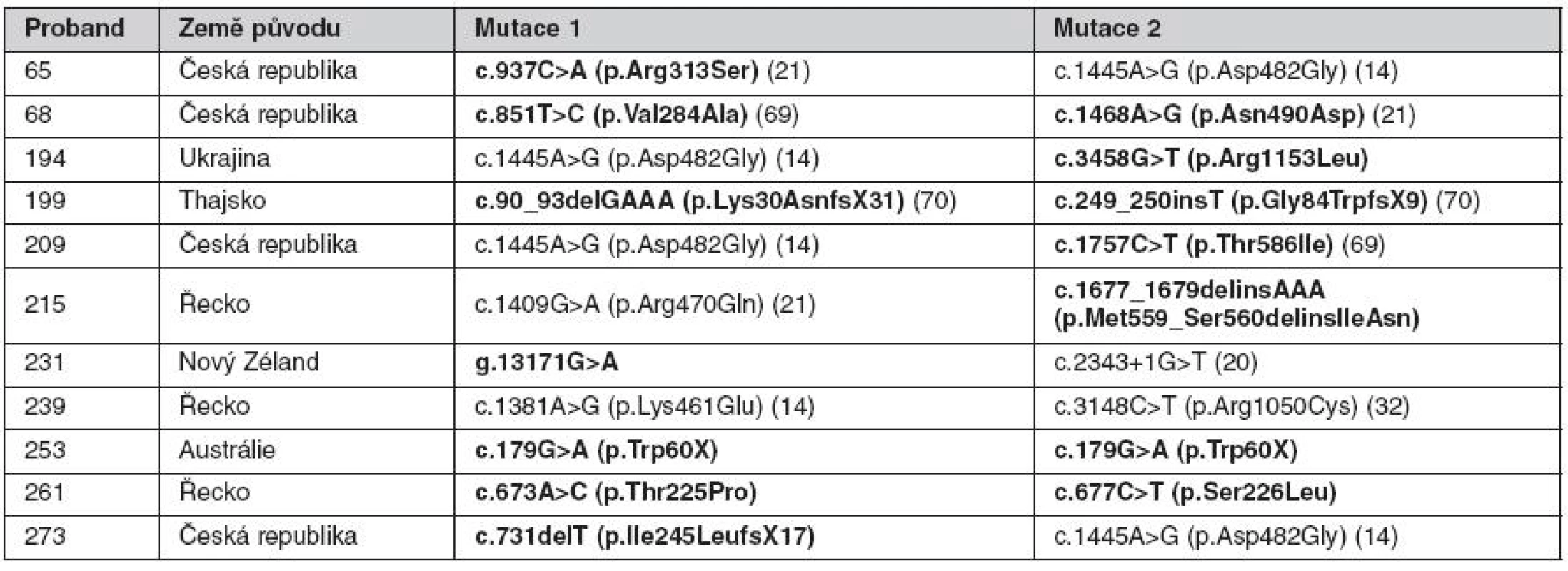
Publikované a dosud nepublikované mutace, které byly poprvé zachyceny na našem pracovišti, jsou vyznačeny tučně. Progresivní familiární intrahepatální cholestáza 3. typu (PFIC3)
PFIC3 (OMIM #602347) je podmíněna mutacemi v genu ABCB4/MDR3 (multidrug resistance protein 3) (22) kódujícím fosfolipidový transportér MDR3 exprimovaný na žlučovém pólu hepatocytů. MDR3 náleží do stejné podrodiny ABC transportérů jako BSEP. Gen zaujímá více než 70 kb na chromosomu 7 (7q21) a sestává z 27 protein kódujících a nejméně jednoho nekódujícího exonu v 5’ - nepřekládané oblasti. Přesný začátek transkripce ABCB4 není znám.
Protein MDR3 odpovídá za sekreci lecitinu z hepatocytů. MDR3 je homologní s proteinem MDR1 fungujícím jako exportní pumpa řady nepolárních xenobiotik. Zvýšená exprese MDR1 v nádorových buněčných liniích vysvětluje jejich rezistenci k nízce polárním cytostatikům (tzv. multidrug resistance). Úloha proteinu MDR3 a jeho myšího ortologu Mdr2 v sekreci žlučových fosfolipidů byla objasněna pomocí animálních modelů. Vyřazení genu Mdr2 mělo za následek ztrátu schopnosti secernovat do žluči fosfolipidy (23), postupný rozvoj nehnisavé cholangitidy, vznik preneoplastických lézí a multilokulárních hepatocelulárních karcinomů (24). Specifická exprese lidského MDR3 v hepatocytech Mdr2 -/ - myší kontrolovaná albuminovým promotorem vedla k obnovení sekrece fosfolipidů do žluči a zabránění rozvoje hepatobiliární léze popsané u Mdr2 -/ - myší. Smith et al. (25) tak podali přímý důkaz, že lidský MDR3 je funkčním ortologem myšího Mdr2. U pacientů s deficitem MDR3 byla stejně jako u Mdr2 -/ - myší pozorována absence fosfolipidů ve žluči. Důsledkem chybění žlučových fosfolipidů je porucha tvorby smíšených micel a poškození jaterního parenchymu vyvolané působením volných žlučových kyselin, jejichž sekrece není narušena a jejichž detergentní účinek není tvorbou micel neutralizován (26). Absence fosfolipidů ve žluči má za následek i to, že cholestáza u Mdr2 -/ - myši není provázena přítomností lipoproteinu X (LpX) v séru (27). LpX je atypický lipoprotein, který se v séru objevuje pouze u cholestázy či obstrukce žlučových cest, je tvořen dvojvrstvou fosfolipidů s převahou lecitinu a s vysokým obsahem neesterifikovaného cholesterolu. Centrální část LpX neobsahuje lipidy, nýbrž vodnou fázi. LpX neobsahuje žádný specifický apoprotein. Mechanismus vzniku LpX u cholestázy není jasný. Nejpravděpodobnější je únik žluči obsahující smíšené micely do krevní plazmy, ve které se díky poklesu koncentrace žlučových kyselin pod kritickou micelární koncentraci vytvoří vesikuly LpX.
Klinický průběh i laboratorní nález PFIC3 je podobný předchozím dvěma formám, extrahepatální příznaky s výjimkou cholelitiázy a jejích případných komplikací nejsou přítomny. Laboratorně je u PFIC3, na rozdíl od PFIC1 a PFIC2, zvýšená sérová aktivita γGT, což umožňuje odlišení PFIC 3. typu od ostatních typů PFIC (22). U PFIC3 dále nedochází k vzestupu sérového cholesterolu, což zřejmě souvisí s neschopností tvořit LpX (28). V jaterní histologii dominuje těžká fibróza až cirhóza s portální zánětlivou infiltrací a duktulární proliferace (22, 29). Imunohistologicky lze obvykle prokázat nepřítomnost proteinu MDR3 v játrech, vyšetření je možné provést i v parafinových řezech.
V našem souboru byla diagnóza PFIC3 potvrzena na molekulární úrovni u dvou nepříbuzných sourozeneckých párů z Austrálie a u jednoho nemocného původem z Itálie. Italský nemocný byl na zahraničním pracovišti nejprve veden pod diagnózou autoimunitní hepatitida. V České republice byli indikováni dva kandidáti, avšak u žádného z nich jsme diagnózu PFIC3 nepotvrdili.
Benigní rekurentní intrahepatální cholestáza
Benigní rekurentní intrahepatální cholestáza (BRIC), nazývaná též syndrom Summerskill-Walsheův, je geneticky heterogenní autozomálně recesivně dědičné onemocnění projevující se intermitentními atakami cholestázy (30). Genetickým podkladem nemoci jsou mutace v genech ATP8B1 a ABCB11 a velmi pravděpodobně i ve třetím dosud neidentifikovaném genu (31). Analogicky ke klasifikaci PFIC můžeme i BRIC rozdělit na BRIC1 (OMIM#3243300) a BRIC2 (OMIM#605479). Zatímco mutace nalezené u PFIC1 a PFIC2 jsou obvykle lokalizovány v oblastech kódujících konzervované funkční domény a závažně narušují normální funkci těchto proteinů, u BRIC se zpravidla jedná o mutace v méně konzervovaných oblastech s částečným dopadem na funkci či expresi proteinu (32).
Choroba se typicky manifestuje před 2. dekádou, věk první manifestace je ale velmi variabilní. Rovněž variabilní je i doba trvání cholestatické epizody (několik dní až několik měsíců) a její intenzita. Spouštěcím faktorem ataky může být interkurentní infekce či těhotenství. V klinickém obrazu dominuje ikterus, pruritus, únava, anorexie a steatorea. V době trvání ataky nacházíme laboratorně elevaci bilirubinu a žlučových kyselin v séru, aktivita γGT a sérová koncentrace cholesterolu je normální. Aktivita aminotransferáz je normální nebo jen lehce zvýšená. V mezidobí se všechny biochemické parametry vracejí do normálního rozmezí. V jaterní biopsii provedené v průběhu cholestatické ataky dominuje obraz kanalikulární cholestázy bez zánětlivých změn, přičemž struktura jaterního parenchymu je normální. V asymptomatickém období je histologický obraz zcela normální. Exprese proteinů FIC1 a BSEP v kanalikulární membráně hepatocytů je imunohistologicky prokazatelná. Diagnóza se opírá o průkaz mutací v obou alelách genu ABCB11 nebo ATP8B1. Průběh BRIC je typicky benigní, zhoršuje ale kvalitu života, invalidizuje pacienta a intenzivní pruritus může vést v extrémních případech až k suicidálním pokusům. Terapie statiny, cholestyraminem a ursodeoxycholovou kyselinou je zpravidla málo účinná stejně jako podávání kortikoidů či rifampicinu. Rovněž vliv medikamentózní terapie na prevenci vzniku další ataky je sporný (30). Nejúčinnějším způsobem přerušení cholestatické ataky s konzervativně nezvládnutelným pruritem je zavedení dočasné nazobiliární drenáže (33).
Byly publikovány případy pacientů, u nichž se původně rekurentně probíhající zdánlivě benigní choroba změnila po letech v progredující formu s postupným rozvojem jaterní cirhózy (30). Proto jsou v současné době BRIC a PFIC chápány jako dva extrémy kontinuálního spektra fenotypů jedné nemoci (2, 13). Místo BRIC byl proto navržen nový název rekurentní familiární intrahepatální cholestáza (Thompson R. London, UK: Liver Institute, King’s College Hospital, osobní sdělení).
Genetické vyšetření pro BRIC bylo na našem pracovišti indikováno u šesti českých, šesti polských, dvou britských a jednoho řeckého kandidáta. Ve čtyřech případech (dva Češi, jeden Polák, jeden Brit) byly nalezeny mutace v obou alelách genu ATP8B1 a diagnostikována BRIC1. V dalších třech případech (opět dva Češi a jeden Polák) byla potvrzena diagnóza BRIC2. U jedné probandky polského původu jsme prokázali současnou přítomnost mutací v obou vyšetřovaných genech. Další dva probandi byli heterozygoty pro jednu mutaci, a to v ATP8B1 (Polák) nebo v ABCB11 (Češka, u které byla ataka cholestázy vyprovokována podáním kontraceptiva). U zbývajících pěti kandidátů jsme v genech ATP8B1 a ABCB11 žádné mutace nenalezli, což však nevylučuje přítomnost defektů v běžně neanalyzovaných intronech a (v případě genu ATP8B1 dosud neznámých) regulačních oblastech. Přehled nalezených mutací je uveden v tabulce 2.
Tab. 2. Mutace v genech ATP8B1 a ABCB11 u nemocných s BRIC 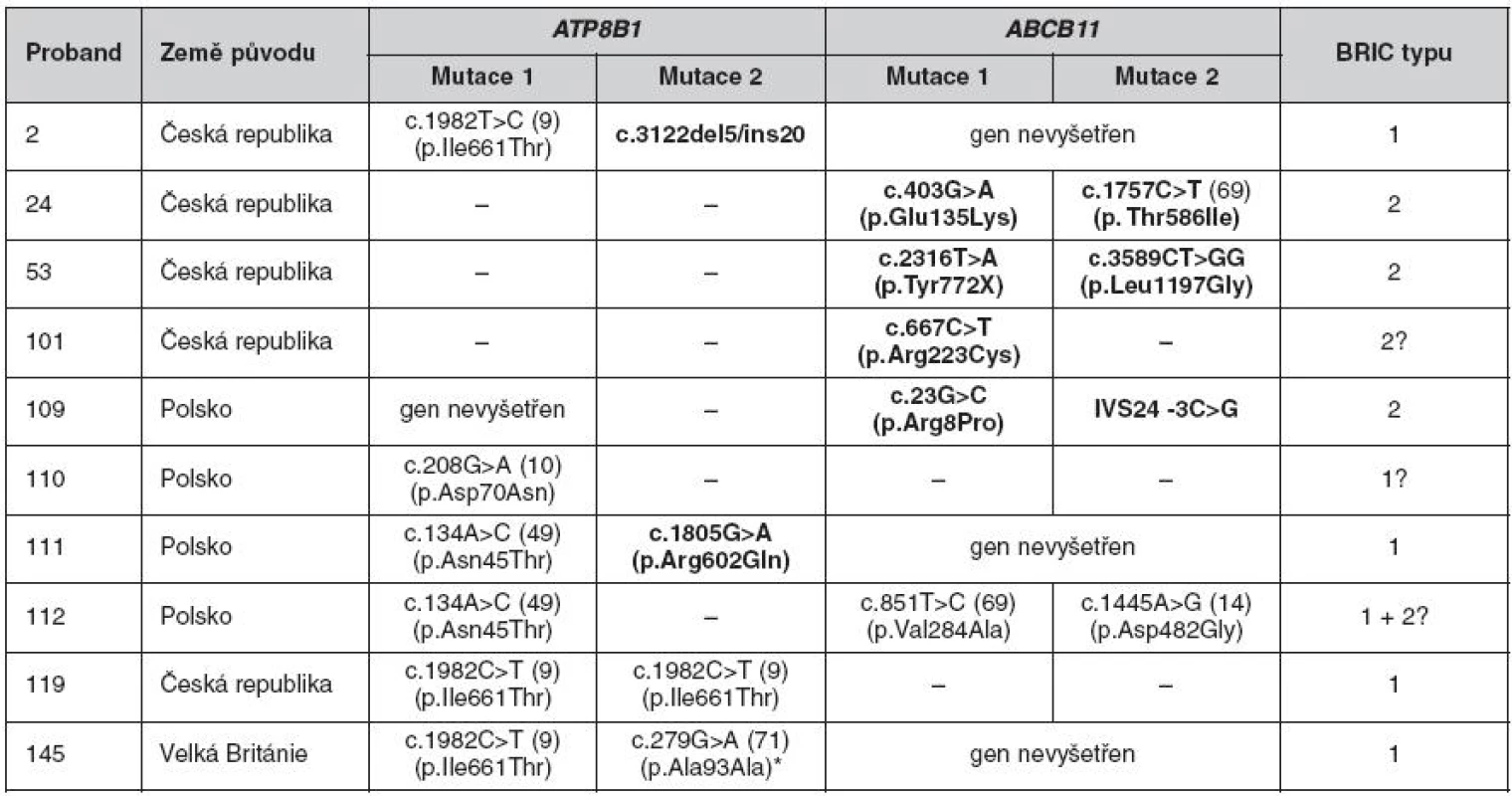
Publikované a dosud nepublikované mutace, které byly poprvé zachyceny na našem pracovišti, jsou vyznačeny tučně. * Bodová záměna c.279G>A sice nevede k záměně aminokyseliny, avšak analýza vlivu záměny na sestřih programem GeneSplicer (www.tigr.org/tdb/GeneSplicer/gene_spl.html) predikuje zánik donor splice site na konci druhého protein kódujícího exonu. BRIC – benigní rekurentní intrahepatální cholestáza Další fenotypy deficitu biliární sekrece fosfolipidů
Mutace, které vedou ke snížení avšak nikoliv k úplné ztrátě schopnosti vylučovat do žluči fosfolipidy, mohou kromě těhotenské intrahepatální cholestázy vyvolat i různě rychle progredující chronické jaterní onemocnění s mírnou trvalou či intermitentní cholestázou (29). Variabilita fenotypu se může projevit i v rámci postižení jedné rodiny či osoby (34). Patogeneze onemocnění spojených s mutacemi v ABCB4 není zcela objasněna. Snížený obsah fosfolipidů ve žluči vede ke zvýšení toxicity žluči, což se u Mdr2 -/ - myší projevuje jako jaterní léze kombinovaná s aseptickou cholangitidou připomínající primární sklerózující cholangitidu (24, 26). Pacienti s oběma mutovanými alelami genu ABCB4 mají obvykle závažnější fenotyp než nosiči pouze jedné mutované alely, u kterých byly popsány spíše mírné nebo podmíněné fenotypy (např. těhotenská či hormonálně indukovaná cholestáza). Část symptomatických heterozygotů tvořili příbuzní nemocných se závažným fenotypem. Histologicky bývá na počátku onemocnění přítomna portální fibróza s minimální zánětlivou celulizací, která může progredovat až do obrazu jaterní cirhózy. Protein MDR3 je v kanalikulární membráně hepatocytů imunohistologicky detekovatelný.
Významným projevem částečného deficitu ABCB4 je familiární cholesterolová cholelitiáza z nedostatku žlučových fosfolipidů označovaná jako Gallbladder disease 1 (OMIM #600803) nebo též Low Phospholipid Associated Cholelithiasis (LPAC) (35, 36). Vznik cholelitiázy je výsledkem nedostatečné transportní kapacity žluči pro cholesterol.
Závažným podmíněným fenotypem je hormonálně indukovaná intrahepatální cholestáza vyvolaná těhotenstvím (viz dále) nebo kontraceptivy (37).
Na našem pracovišti jsme přítomnost mutací alespoň v jedné alele genu ABCB4 nalezli u pěti českých žen, u kterých se jejich onemocnění manifestovalo jako kontraceptivy indukovaná cholestáza a které splňovaly klinická diagnostická kritéria LPAC publikovaná Rosmorducem a Pouponem (38).
Intrahepatální těhotenská cholestáza
Intrahepatální těhotenská cholestáza (ICP – intrahepatic cholestasis of pregnancy, OMIM #147480) postihující v Evropě kolem 1 % gravidit je charakterizována vznikem cholestázy obvykle ve 3. trimestru gravidity bez známek jaterní nemoci v předchorobí. Typickým příznakem je pruritus, který se s pokračující graviditou stupňuje. Laboratorním diagnostickým kritériem je zvýšená hladina sérových žlučových kyselin nad 40 μmol/l. Současně bývá zvýšena aktivita jaterních aminotransferáz. V těžších případech dochází i k elevaci bilirubinu a cca u 10–15 % postižených žen i k vzestupu aktivity γGT. ICP způsobuje fetální distres, předčasný porod nezralého plodu či dokonce intrauterinní odumření plodu (39). Léčba kyselinou ursodeoxycholovou vede ke snížení pruritu, zlepšení laboratorního nálezu a dokonce i ke snížení rizika předčasného porodu a úmrtí plodu (40–44). Jaterní testy se spontánně normalizují bezprostředně po porodu (39). U některých žen s ICP byly nalezeny heterozygotní mutace v genu ABCB4 (34, 45–47). Předpokládá se, že 50% exprese proteinu MDR3 za normálních okolností stačí k zajištění biliární sekrece a teprve při extrémní hormonální zátěži dojde k manifestaci preexistující poruchy. Byla popsána i asociace ICP s mutacemi v ATP8B1 (48, 49).
Familiární hyperbilirubinémie
Bilirubin je konečným produktem degradace hemu. Hlavními zdroji hemu jsou erytrocyty a buňky erytropoetické řady. Hlavními producenty bilirubinu jsou makrofágy ve slezině a v krvetvorné kostní dřeni. Nekonjugovaný ve vodě prakticky nerozpustný bilirubin se váže na albumin, ze kterého je v játrech vychytáván hepatocyty. Po disociaci vazby na albumin je bilirubin importován do hepatocytů. V jejich cytosolu se váže na proteiny ze skupiny glutathion-S-transferáz označované souhrnným názvem ligandin. Následuje konjugace se dvěma molekulami kyseliny glukuronové, která se odehrává v lumen endoplazmatického retikula za katalýzy uridindifosfátglukosiduronát bilirubin glukuronosyltransferázou UGT1A1 (EC 2.4.1.17).
Gen UGT1A1 lokalizovaný v komplexním genovém lokusu UGT1A kóduje jediný pro bilirubin specifický konjugační enzym UGT1A1. Konjugovaný ve vodě rozpustný bilirubin je zatím neznámým mechanismem exportován z lumen endoplazmatického retikula zpět do cytosolu, odkud migruje ke žlučovému pólu hepatocytu. Ze žlučového pólu je konjugovaný bilirubin aktivně secernován do žluči působením kanalikulárního ABC transportéru ABCC2/MRP2 fungujího jako exportní pumpa multivalentních organických aniontů. Ve střevě je konjugovaný bilirubin dekonjugován, zčásti resorbován a zčásti dále degradován působením bakteriální střevní flóry.
Na základě biochemického vyšetření je možné rozlišovat převážně nekonjugované žloutenky vyvolané buď nadprodukcí bilirubinu při hemolýze, nebo sníženou rychlostí jaterní konjugace a převážně konjugované žloutenky, jejichž vyvolávající příčinou je onemocnění jaterního parenchymu, intrahepatální cholestáza nebo obstrukce žlučových cest. Dědičné převážně nekonjugované hyperbilirubinémie jsou vyvolány mutacemi v genu pro UGT1A1 a zahrnují Crigler-Najjarův syndrom I. a II. typu a benigní hyperbilirubinémii Gilbertova typu. Dědičné převážně konjugované hyperbilirubinémie zahrnují Dubin-Johnsonův a Rotorův syndrom. Jejich význam je především diferenciálně diagnostický.
Dubin-Johnsonův syndrom (DJS)
Dubin-Johnsonův syndrom (DJS, OMIM #237500) je vzácná benigní autozomálně recesivní konjugovaná hyperbilirubinémie. Genetickou příčinou DJS jsou mutace v genu ABCC2/MRP2 (50). Gen ABCC2 je lokalizován na dlouhém raménku 10. chromosomu (10q24), zaujímá 45 kb a sestává z 32 protein kódujících exonů. Protein ABCC2/MRP2 patří do podrodiny C rodiny ABC transportérů. Exprese genu je řízena proximálním promotorem v délce cca 1500 bp (51).
Pro klinický obraz DJS je charakteristický kolísavý ikterus sklér a někdy i kůže bez dalších příznaků. Hladina celkového bilirubinu se pohybuje kolem 100 μmol/l přičemž více než 50 % připadá na přímý bilirubin (52, 53). Ostatní laboratorní nálezy včetně odpadu celkových porfyrinů jsou normální, avšak izomer I koproporfyrinu představuje více než 50 % vylučovaného koproporfyrinu (54). Vylučování bromsulfoftaleinu do žluči po i.v. podání je zpomaleno a v 45. minutě po podání dochází k opětovnému vzestupu jeho koncentrace (55). Obdobnou kinetiku jako bromsulfoftalein mají indocyaninová zeleň a další organické anionty včetně radiofarmak používaných k cholescintigrafii, takže vizualizace jater i plnění žlučníku jsou opožděny (56–58). Jaterní histologie je normální s výjimkou akumulace tmavého melanin-like pigmentu s výraznou autofluorescencí v hepatocytech. Pigment, jehož chemické složení není známé, dává pozitivní PAS reakci a redukuje amoniakální roztok stříbra (Masson-Fontanova reakce), avšak na rozdíl od melaninu neredukuje neutrální roztok stříbra. Byly dokumentovány i případy DJS bez pigmentace jater (59, 60). Imunohistologicky lze ve většině případů prokázat absenci proteinu ABCC2 v kanalikulární membráně hepatocytů (61). Výjimečně může být mutovaný nefunkční protein ABCC2 normálně exprimován (62).
Rotorův syndrom (RS)
Rotorův syndrom (RS, OMIM %237540) je velmi vzácná autozomálě recesivně dědičná forma převážně konjugované žloutenky, která je klinickým a základním laboratorním vyšetřením neodlišitelná od DJS. Stejně jako u DJS je převažujícím vylučovaným koproporfyrinem izomer I. Na rozdíl od DJS je odpad celkových porfyrinů v moči zvýšen a poměr izomeru I koproporfyrinu k izomeru III bývá nižší než u DJS (63). Vylučování aniontových barviv játry je pomalejší než u DJS a nedochází k opětovnému vzestupu jejich koncentrace (64). Při cholescintigrafii se nezobrazí ani játra ani žlučník a zobrazení žlučníku bylo pozorováno teprve po řadě hodin (56, 65, 66). Jaterní histologie je zcela normální. Příčina RS není známa. Výsledky studie Hřebíčka et al. (67) ukázaly normální strukturu genu ABCC2 i normální expresi proteinu MRP2.
Na našem pracovišti bylo pro izolovanou převážně konjugovanou (13 kandidátů) či smíšenou (dva kandidáti) hyperbilirubinémii vyšetřeno celkem 15 nositelů této metabolické odchylky. U jednoho českého a jednoho řeckého postiženého jsme na molekulární úrovni protvrdili diagnózu DJS. U dvou jedinců původem z České republiky a USA se smíšenou převážně nekonjugovanou žloutenkou, kdy sérové koncentrace přímého bilirubinu dosahovaly pouze 20 až 50 % koncentrace celkového bilirubinu, byla zjištěna současná přítomnost mutací typických pro DJS a Gilbertův syndrom. Pro tento typ smíšené žloutenky odlišný od DJS a RS jsme navrhli název duální hereditární žloutenka (68). U zbývajících jedenácti kandidátů původem z České republiky (2×), Slovenské republiky (1×), Ukrajiny (1×), Filipín (1×) a Saúdské Arábie (šest probandů ze tří rodin) nebyly v genu ABCC2 detekovány žádné mutace a v kontextu s dalšími klinickými a laboratorními nálezy byla stanovena konečná diagnóza RS. Objasnění molekulární podstaty tohoto posledního klasického syndromu v hepatologii, jehož příčina je dosud neznámá, je předmětem naší právě dokončované mapovací studie.
Zkratky
- ABCBn – ATP-binding cassette protein třídy B, typ n
- ABCC2 – ATP-binding cassette protein třídy C, typ 2
- ATP8B1 – ATPáza I. třídy, typ 8B, člen 1
- BRIC – benigní rekurentní intrahepatální cholestáza
- BSEP – bile salt export pump
- DJS – Dubin-Johnsonův syndrom
- FIC1 – familial intrahepatic cholestasis 1 protein
- FXR – farnesoid X-activated receptor
- γGT – gamma-glutamyltransferáza
- ICP – idiopatic cholestasis of pregnancy
- LPAC – low phospholipid associated cholelithiasis
- LpX – lipoprotein X
- Mdr2 – myší ortholog lidského MDR3
- MDR3 – multidrug resistance protein 3
- MRP2 – multidrug resistance-associated protein 2
- PFIC – progresivní intrahepatální familiární cholestáza
- RS – Rotorův syndrom
- RXR – retinoid X-receptor
- UGT1A1 – uridine diphosphate glucuronosyltransferase 1A1
Adresa pro korespondenci:
doc. MUDr. Mgr. Milan Jirsa, CSc.
Laboratoř experimentální hepatologie, Pracoviště experimentální medicíny IKEM
Vídeňská 1958/9, 140 21 Praha 4
fax: +420 241 721 666, e-mail: milan.jirsa@ikem.cz
Zdroje
1. van Mil SW, Houwen RH, Klomp LW. Genetics of familial intrahepatic cholestasis syndromes. J Med Genet 2005; 42 : 449–463.
2. Carlton VE, Pawlikowska L, Bull LN. Molecular basis of intrahepatic cholestasis. Ann Med 2004; 36 : 606–617.
3. Chowdhury JR, Wolkoff AW, Chowdhury NR, Arias IM. Hereditary jaundice and disorders of bilirubin metabolism. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The metabolic & molecular bases of inherited disease. 8 ed. New York: McGraw Hill 2001; 3063–3101.
4. Elferink RP, Groen AK. The mechanism of biliary lipid secretion and its defects. Gastroenterol Clin North Am 1999; 28 : 59–74, vi.
5. Jansen PL, Muller M. Genetic cholestasis: lessons from the molecular physiology of bile formation. Can J Gastroenterol 2000; 14 : 233–238.
6. Thompson R, Strautnieks S. BSEP: function and role in progressive familial intrahepatic cholestasis. Semin Liver Dis 2001; 21 : 545–550.
7. Kalicinski PJ, Ismail H, Jankowska I, et al. Surgical treatment of progressive familial intrahepatic cholestasis: comparison of partial external biliary diversion and ileal bypass. Eur J Pediatr Surg 2003; 13 : 307–311.
8. Clayton RJ, Iber FL, Ruebner BH, McKusick VA. Byler disease. Fatal familial intrahepatic cholestasis in an Amish kindred. Am J Dis Child 1969; 117 : 112–124.
9. Bull LN, van Eijk MJ, Pawlikowska L, et al. A gene encoding a P-type ATPase mutated in two forms of hereditary cholestasis. Nat Genet 1998; 18 : 219–224.
10. Klomp LW, Vargas JC, van Mil SW, et al. Characterization of mutations in ATP8B1 associated with hereditary cholestasis. Hepatology 2004; 40 : 27–38.
11. Ujhazy P, Ortiz D, Misra S, et al. Familial intrahepatic cholestasis 1: studies of localization and function. Hepatology 2001; 34 : 768–775.
12. Paulusma CC, Groen A, Kunne C, et al. Atp8b1 deficiency in mice reduces resistance of the canalicular membrane to hydrophobic bile salts and impairs bile salt transport. Hepatology 2006; 44 : 195–204.
13. van Mil SW, Klomp LW, Bull LN, Houwen RH. FIC1 disease: a spectrum of intrahepatic cholestatic disorders. Semin Liver Dis 2001; 21 : 535–544.
14. Strautnieks SS, Bull LN, Knisely AS, et al. A gene encoding a liver-specific ABC transporter is mutated in progressive familial intrahepatic cholestasis. Nat Genet 1998; 20 : 233–238.
15. Gerloff T, Stieger B, Hagenbuch B, et al. The sister of P-glycoprotein represents the canalicular bile salt export pump of mammalian liver. J Biol Chem 1998; 273 : 10046–10050.
16. Jansen PL, Muller M. The molecular genetics of familial intrahepatic cholestasis. Gut 2000; 47 : 1–5.
17. Ananthanarayanan M, Balasubramanian N, Makishima M, Mangelsdorf DJ, Suchy FJ. Human bile salt export pump promoter is transactivated by the farnesoid X receptor/bile acid receptor. J Biol Chem 2001; 276 : 28857–28865.
18. Davis RA, Miyake JH, Hui TY, Spann NJ. Regulation of cholesterol-7alpha-hydroxylase: BAREly missing a SHP. J Lipid Res 2002; 43 : 533–543.
19. Knisely AS, Strautnieks S, Meier Y, et al. Hepatocellular carcinoma in ten children under five years old with bile salt export pump deficiency. Hepatology 2006; 44 : 478–486.
20. Scheimann AO, Strautnieks SS, Knisely AS, Byrne JA, Thompson RJ, Finegold MJ. Mutations in bile salt export pump (ABCB11) in two children with progressive familial intrahepatic cholestasis and cholangiocarcinoma. J Pediatr 2007; 150 : 556–559.
21. Strautnieks SS, Byrne JA, Pawlikowska L, et al. Severe bile salt export pump deficiency: 82 different ABCB11 mutations in 109 families. Gastroenterology 2008; 134 : 1203–1214.
22. de Vree JM, Jacquemin E, Sturm E, et al. Mutations in the MDR3 gene cause progressive familial intrahepatic cholestasis. Proc Natl Acad Sci U S A 1998; 95 : 282–287.
23. Smit JJ, Schinkel AH, Oude Elferink RP, et al. Homozygous disruption of the murine mdr2 P–glycoprotein gene leads to a complete absence of phospholipid from bile and to liver disease. Cell 1993; 75 : 451–462.
24. Mauad TH, van Nieuwkerk CM, Dingemans KP, et al. Mice with homozygous disruption of the mdr2 P–glycoprotein gene. A novel animal model for studies of nonsuppurative inflammatory cholangitis and hepatocarcinogenesis. Am J Pathol 1994; 145 : 1237–1245.
25. Smith AJ, de Vree JM, Ottenhoff R, Oude Elferink RP, Schinkel AH, Borst P. Hepatocyte-specific expression of the human MDR3 P-glycoprotein gene restores the biliary phosphatidylcholine excretion absent in Mdr2 (-/-) mice. Hepatology 1998; 28 : 530–536.
26. Fickert P, Fuchsbichler A, Wagner M, et al. Regurgitation of bile acids from leaky bile ducts causes sclerosing cholangitis in Mdr2 (Abcb4) knockout mice. Gastroenterology 2004; 127 : 261–274.
27. Elferink RP, Ottenhoff R, van Marle J, Frijters CM, Smith AJ, Groen AK. Class III P-glycoproteins mediate the formation of lipoprotein X in the mouse. J Clin Invest 1998; 102 : 1749–1757.
28. Oude Elferink RP, Paulusma CC. Function and pathophysiological importance of ABCB4 (MDR3 P-glycoprotein). Pflugers Arch 2007; 453 : 601–610.
29. Jacquemin E, De Vree JM, Cresteil D, et al. The wide spectrum of multidrug resistance 3 deficiency: from neonatal cholestasis to cirrhosis of adulthood. Gastroenterology 2001; 120 : 1448–1458.
30. van Ooteghem NA, Klomp LW, van Berge-Henegouwen GP, Houwen RH. Benign recurrent intrahepatic cholestasis progressing to progressive familial intrahepatic cholestasis: low GGT cholestasis is a clinical continuum. J Hepatol 2002; 36 : 439–443.
31. Floreani A, Molaro M, Mottes M, et al. Autosomal dominant benign recurrent intrahepatic cholestasis (BRIC) unlinked to 18q21 and 2q24. Am J Med Genet 2000; 95 : 450–453.
32. van Mil SW, van der Woerd WL, van der Brugge G, et al. Benign recurrent intrahepatic cholestasis type 2 is caused by mutations in ABCB11. Gastroenterology 2004; 127 : 379–384.
33. Stapelbroek JM, van Erpecum KJ, Klomp LW, et al. Nasobiliary drainage induces long–lasting remission in benign recurrent intrahepatic cholestasis. Hepatology 2006; 43 : 51–53.
34. Lucena JF, Herrero JI, Quiroga J, et al. A multidrug resistance 3 gene mutation causing cholelithiasis, cholestasis of pregnancy, and adulthood biliary cirrhosis. Gastroenterology 2003; 124 : 1037–1042.
35. Rosmorduc O, Hermelin B, Poupon R. Mdr3 gene defect in adults with symptomatic intrahepatic and gallbladder cholesterol cholelithiasis. Gastroenterology 2001; 120 : 1459–1467.
36. Rosmorduc O, Hermelin B, Boelle PY, Parc R, Taboury J, Poupon R. ABCB4 gene mutation–associated cholelithiasis in adults. Gastroenterology 2003; 125 : 452–459.
37. Ganne-Carrie N, Baussan C, Grando V, Gaudelus J, Cresteil D, Jacquemin E. Progressive familial intrahepatic cholestasis type 3 revealed by oral contraceptive pills. J Hepatol 2003; 38 : 693–694.
38. Rosmorduc O, Poupon R. Low phospholipid associated cholelithiasis: association with mutation in the MDR3/ABCB4 gene. Orphanet J Rare Dis 2007; 2 : 29.
39. Lammert F, Marschall HU, Glantz A, Matern S. Intrahepatic cholestasis of pregnancy: molecular pathogenesis, diagnosis and management. J Hepatol 2000; 33 : 1012–1021.
40. Berkane N, Cocheton JJ, Brehier D, et al. Ursodeoxycholic acid in intrahepatic cholestasis of pregnancy. A retrospective study of 19 cases. Acta Obstet Gynecol Scand 2000; 79 : 941–946.
41. Glantz A, Marschall HU, Lammert F, Mattsson LA. Intrahepatic cholestasis of pregnancy: a randomized controlled trial comparing dexamethasone and ursodeoxycholic acid. Hepatology 2005; 42 : 1399–1405.
42. Kondrackiene J, Beuers U, Kupcinskas L. Efficacy and safety of ursodeoxycholic acid versus cholestyramine in intrahepatic cholestasis of pregnancy. Gastroenterology 2005; 129 : 894–901.
43. Zapata R, Sandoval L, Palma J, et al. Ursodeoxycholic acid in the treatment of intrahepatic cholestasis of pregnancy. A 12-year experience. Liver Int 2005; 25 : 548–554.
44. Binder T, Salaj P, Zima T, Vitek L. Randomized prospective comparative study of ursodeoxycholic acid and S-adenosyl-L--methionine in the treatment of intrahepatic cholestasis of pregnancy. J Perinat Med 2006; 34 : 383–391.
45. Dixon PH, Weerasekera N, Linton KJ, et al. Heterozygous MDR3 missense mutation associated with intrahepatic cholestasis of pregnancy: evidence for a defect in protein trafficking. Hum Mol Genet 2000; 9 : 1209–1217.
46. Gendrot C, Bacq Y, Brechot MC, Lansac J, Andres C. A second heterozygous MDR3 nonsense mutation associated with intrahepatic cholestasis of pregnancy. J Med Genet 2003; 40: e32.
47. Floreani A, Carderi I, Paternoster D, et al. Intrahepatic cholestasis of pregnancy: three novel MDR3 gene mutations. Aliment Pharmacol Ther 2006; 23 : 1649–1653.
48. Mullenbach R, Linton KJ, Wiltshire S, et al. ABCB4 gene sequence variation in women with intrahepatic cholestasis of pregnancy. J Med Genet 2003; 40: e70.
49. Painter JN, Savander M, Ropponen A, et al. Sequence variation in the ATP8B1 gene and intrahepatic cholestasis of pregnancy. Eur J Hum Genet 2005; 13 : 435–439.
50. Paulusma CC, Oude Elferink RP. The canalicular multispecific organic anion transporter and conjugated hyperbilirubinemia in rat and man. J Mol Med 1997; 75 : 420–428.
51. Stockel B, Konig J, Nies AT, Cui Y, Brom M, Keppler D. Characterization of the 5’-flanking region of the human multidrug resistance protein 2 (MRP2) gene and its regulation in comparison withthe multidrug resistance protein 3 (MRP3) gene. Eur J Biochem 2000; 267 : 1347–1358.
52. Dubin IN. Chronic idiopathic jaundice; a review of fifty cases. Am J Med 1958; 24 : 268–292.
53. Shani M, Seligsohn U, Gilon E, Sheba C, Adam A. Dubin-Johnson syndrome in Israel. I. Clinical, laboratory, and genetic aspects of 101 cases. Q J Med 1970; 39 : 549–567.
54. Wolkoff AW, Cohen LE, Arias IM. Inheritance of the Dubin–Johnson syndrome. N Engl J Med 1973; 288 : 113–117.
55. Erlinger S, Dhumeaux D, Desjeux JF, Benhamou JP. Hepatic handling of unconjugated dyes in the Dubin-Johnson syndrome. Gastroenterology 1973; 64 : 106–110.
56. Bar-Meir S, Baron J, Seligson U, Gottesfeld F, Levy R, Gilat T. 99mTc–HIDA cholescintigraphy in Dubin-Johnson and Rotor syndromes. Radiology 1982; 142 : 743–746.
57. Bujanover Y, Bar-Meir S, Hayman I, Baron J. 99mTc–HIDA cholescintigraphy in children with Dubin-Johnson syndrome. J Pediatr Gastroenterol Nutr 1983; 2 : 311–312.
58. Artiko V, Obradovic VV, Kostic K, Petrovic N, Markovic S, Popovic O. Cholescintigraphy in Dubin-Johnson syndrome. Nucl Med Rev Cent East Eur 1999; 2 : 83–84.
59. Arias IM. Studies of chronic familial non-hemolytic jaundice with conjugated bilirubin in the serum with and without an unidentified pigment in the liver cells. Am J Med 1961; 31 : 510–518.
60. Shieh CC, Chang MH, Chen CL. Dubin-Johnson syndrome presenting with neonatal cholestasis. Arch Dis Child 1990; 65 : 898–899.
61. Kartenbeck J, Leuschner U, Mayer R, Keppler D. Absence of the canalicular isoform of the MRP gene-encoded conjugate export pump from the hepatocytes in Dubin-Johnson syndrome. Hepatology 1996; 23 : 1061–1066.
62. Mor-Cohen R, Zivelin A, Rosenberg N, Shani M, Muallem S, Seligsohn U. Identification and functional analysis of two novel mutations in the multidrug resistance protein 2 gene in Israeli patients with Dubin-Johnson syndrome. J Biol Chem 2001; 276 : 36923–36930.
63. Wolkoff AW, Wolpert E, Pascasio FN, Arias IM. Rotor’s syndrome. A distinct inheritable pathophysiologic entity. Am J Med 1976; 60 : 173–179.
64. Wolpert E, Pascasio FM, Wolkoff AW, Arias IM. Abnormal sulfobromophthalein metabolism in Rotor’s syndrome and obligate heterozygotes. N Engl J Med 1977; 296 : 1099–1101.
65. Fretzayas AM, Garoufi AI, Moutsouris CX, Karpathios TE. Cholescintigraphy in the diagnosis of Rotor syndrome. J Nucl Med 1994; 35 : 1048–1050.
66. Fretzayas AM, Stavrinadis CS, Koukoutsakis PM, Sinaniotis CA. Diagnostic approach of Rotor syndrome with cholescintigraphy. Clin Nucl Med 1997; 22 : 635–636.
67. Hrebicek M, Jirasek T, Hartmannova H, et al. Rotor-type hyperbilirubinaemia has no defect in the canalicular bilirubin export pump. Liver Int 2007; 27 : 485–491.
68. Cebecauerova D, Jirasek T, Budisova L, et al. Dual hereditary jaundice: simultaneous occurrence of mutations causing Gilbert’s and Dubin-Johnson syndrome. Gastroenterology 2005; 129 : 315–320.
69. Byrne JA, Strautnieks SS, Ihrke G, et al. Missense mutations and single nucleotide polymorphisms in ABCB11 impair bile salt export pump processing and function or disrupt pre-messenger RNA splicing. Hepatology 2009; 49 : 553–567.
70. Treepongkaruna S, Gaensan A, Pienvichit P, et al. Novel ABCB11 mutations in a Thai infant with progressive familial intrahepatic cholestasis. World J Gastroenterol 2009; 15 : 4339–4342.
71. Lang C, Meier Y, Stieger B, et al. Mutations and polymorphisms in the bile salt export pump and the multidrug resistance protein 3 associated with drug–induced liver injury. Pharmacogenet Genomics 2007; 17 : 47–60.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Aktualizace doporučení GOLD pro farmakoterapii CHOPN z roku 2026
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
-
Všechny články tohoto čísla
- Katetrizační ablace fibrilace síní
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Akutní selhání jater: současná doporučení
- IKEM – Institut klinické a experimentální medicíny – na prahu páté dekády úspěšné existence
- Plánované akce odborných složek ČLS JEP
- Specifika perioperační péče o pediatrické pacienty podstupující transplantaci jater
- Zemřelí dárci orgánů k transplantacím
- Imunohistochemická detekce glypicanu-3 zpřesňuje diagnózu hepatocelulárního karcinomu
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
- Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
- IKEM – odborné, politické a další souvislosti vzniku a dosavadního vývoje
- Transplantace ledviny v IKEM
- Výsledky dlouhodobého sledování prvních 500 pacientů po transplantaci jater provedených v Institutu klinické a experimentální medicíny v Praze
- Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
- Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
- Transplantace jater u pacientů s trombózou v. portae
- Vliv chirurgických komplikací na funkci transplantované ledviny
-
Molecular Diagnostic Europe
Hannover, 4. až 7. října 2010 -
Konference Tabák a zdraví po jedenácté v Lékařském domě
Praha, 5. listopadu 2010 - Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Spolek lékařů českých v Praze
-
Strouhal E, Vachala B, Vymazalová H.
Lékařství starých Egypťanů
I. staroegyptská chirurgie, Péče o ženu a dítě - CHARLES BRENTON HUGGINS
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní selhání jater: současná doporučení
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



