-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Katetrizační ablace fibrilace síní
Catheter ablation in atrial fibrillation
During the last years catheter ablation has become the treatment of choice for patients with paroxysmal or persistent atrial fibrillation that is symptomatic and resistant to pharmacologic therapy. The cornerstone of the procedure is complete electrical isolation of pulmonary veins that is achieved by creation of series of lesions in the pulmonary vein adjancent atrial tissue. In patients with persistent or permanent atrial fibrillation the isolation is accompanied by more extensive modification of arrhythmogenic substrate within the atria. The success rate in prevention of recurrences of atrial fibrillation ranges between 70–90%. Despite the significant progress catheter ablation of atrial fibrillation remains a complex procedure that is associated with the risk of severe complications.
Key words:
atrial fibrillation, catheter ablation.
Autoři: Petr Peichl; Robert Čihák; Dan Wichterle; Josef Kautzner
Působiště autorů: Institut klinické a experimentální medicíny Praha, Klinika kardiologie
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 14-19
Kategorie: Přehledový článek
Souhrn
Katetrizační ablace se během posledních let stala metodou volby pro pacienty s paroxyzmální či perzistující fibrilací síní, která vede k výrazným obtížím a je rezistentní na medikamentózní léčbu. Základním cílem výkonu je elektrická izolace plicních žil od svaloviny levé síně, protože fibrilace síní je u většiny nemocných spouštěna z arytmogenních ložisek umístěných právě ve svalovině plicních žil. U pacientů s perzistující či chronickou formou arytmie bývá izolace doplněna o modifikaci arytmogenního substrátu v síňové svalovině – většinou ve formě přídatných linárních lézí. Účinnost výkonu v odstranění fibrilací síní se pohybuje v rozmezí 70–90 % v závislosti na studované populaci, použité technice a metodě sledování po zákroku. I přes výrazný pokrok se jedná o komplexní výkon, který je spojen s rizikem závažných komplikací, a proto by mělo být jeho provádění vyhrazeno pro specializovaná pracoviště.
Klíčová slova:
fibrilace síní, katetrizační ablace.Úvod
Fibrilace síní (FS) je nejčastější tachyarytmie, která postihuje 1–2 % celkové populace. V současnosti touto arytmií trpí více než 6 milionů obyvatel Evropy. Podle odhadů by měl výskyt FS v následujících 50 letech stoupnout na dvojnásobek, a to zejména v důsledku stárnutí populace (1). Pacienti s paroxyzmální nebo perzistující formou FS mají obvykle výrazně sníženou kvalitu života. Mezi hlavní příznaky patří palpitace, námahová dušnost, únava. Vedle symptomatologie jsou pacienti s FS ohroženi tromboembolickými komplikacemi a je u nich vyšší riziko vzniku srdečního selhání a úmrtí (2).
Základními pilíři terapie FS jsou léčba základního onemocnění, prevence tromboembolických příhod, kontrola srdeční frekvence a kontrola rytmu. U části pacientů s FS postačuje antitrombotická léčba a kontrola srdeční frekvence. Kontrola frekvence však není vždy uspokojivá, někteří nemocní zůstávají symptomatičtí i při FS s vyrovnanou odpovědí komor, nebo preferují udržení sinusového rytmu. Současná antiarytmika mají však omezenou úspěšnost a jejich podávání je spojeno s rizikem nežádoucích účinků. Nejlépe to dokumentují studie porovnávající kontrolu rytmu a kontrolu frekvence u FS. Ze zpětné analýzy studie AFFIRM se ukázalo, že přítomnost sinusového rytmu je spojena s nižší mortalitou (o 53 %), zatímco podávání antiarytmik mortalitu zvyšuje (o 49 %). Nežádoucí vliv antiarytmik tedy neutralizuje příznivý efekt udržení sinusového rytmu (3). Hledají se proto nové způsoby léčby, ať již medikamentózní nebo nemedikamentózní. Nejrozšířenější a nejúčinnější metodou nemedikamentózní léčby FS je v současnosti katetrizační ablace. Tento přehled shrnuje současný pohled na postavení katetrizační ablace v léčbě FS a je doplněn o vlastní výsledky.
Princip katetrizační ablace fibrilace síní
V minulosti bylo jedinou možností katetrizační léčby u pacientů s FS provedení neselektivní ablace AV uzlu a implantace kardiostimulátoru. I když lze takto odstranit symptomy a regulovat srdeční frekvenci, řada nemocných byla následně dependentní na kardiostimulaci. Ta může vést u nemocných s porušenou systolickou funkcí levé komory k dalšímu zhoršování, a to v souvislosti s elektromechanickou dyssynchronií navozenou stimulací pravé komory. Přetrvávání arytmie v síních znamená přetrvávání rizika tromboembolismu a určité zhoršení hemodynamiky v důsledku chybění síňového příspěvku k diastolickému plnění komor.
Proto se soustředila velká pozornost na rozvoj techniky, která by účinně zasáhla do patofyziologických mechanismů FS a vedla k dlouhodobému udržení sinusového rytmu. Revolučním krokem v tomto smyslu byla operace MAZE („bludiště“) amerického kardiochirurga Jamese Coxe, která byla navržena počátkem devadesátých let 20. století. Jejím principem bylo vytvoření série incizí ve svalovině síní tak, aby bránily kroužení mnohočetných reentry okruhů a současně dovolily průchod elektrického vzruchu ze sinusového k síňokomorovému uzlu (tj. jediná správná cesta jako v bludišti). Úspěšnost výkonu v udržení sinusového rytmu byla velmi dobrá a dosahovala 90 %. Nicméně vzhledem ke složitosti a možným závažným komplikacím nedoznal tento zákrok v navržené podobě většího rozšíření. Nastartoval však snahy o nalezení nových metod nemedikamentózní léčby FS.
První katetrizační výkony prováděné selektivně pro FS v polovině devadesátých let 20. století se snažily napodobit schéma chirurgických lézí při proceduře MAZE. S použitím tehdejších katétrů to bylo velmi obtížné a první výkony byly provázeny četnými komplikacemi. Skupina z Bordeaux v čele s Michele Haissaguerre si však jako první při těchto výkonech povšimla, že FS bývá spouštěna z fokálního zdroje (tj. jediného ložiska, které vydává rychlé elektrické vzruchy a dokáže „rozfibrilovat“ obě srdeční síně) (4). Tito autoři později prokázali, že tato ektopická ložiska se nacházejí nejčastěji v myokardu, který obklopuje plicní žíly. Současně demonstrovali, že katetrizační ablace těchto ložisek může zcela odstranit paroxyzmy FS. Tato fokální ablace se začala zpočátku provádět jen u vybraných nemocných, kteří měli dokumentován počátek FS ve vazbě na supraventrikulární extrasystoly. Brzy se ukázalo, že tento přístup má celou řadu nevýhod – jednak se ektopické ložisko v průběhu výkonu nemusí projevovat, jednak aplikace radiofrekvenční energie uvnitř plicních žil je spojena s rizikem vzniku stenózy plicní žily. Proto byla navržena technika tzv. segmentární izolace plicních žil. Při ní se do plicní žíly zavádí cirkulární katétr s malými elektrodami (pro podobu s lasem používá firma Biosense Webster chráněnou značku Lasso), který snímá elektrické potenciály z jejího obvodu (obr. 1). Série bodových ablací v ústí plicní žíly má za cíl úplné přerušení vedení elektrických impulzů mezi žilou a levou srdeční síní. Takto zůstanou spouštěcí ektopická ložiska izolována a nemohou již dále uchvátit svalovinu síně. Paralelně se rozvíjela technika obkružující ablace ústí plicních žil, která byla navržena v Itálii Carlem Papponem (5). Jejím principem bylo použití elektroanatomického mapovacího systému k trojrozměrné rekonstrukci levé síně a ústí plicních žil s následným anatomickým obkroužením ostií všech plicních žil sérií ablačních lézí. Použití trojrozměrných map zjednodušilo výkon a dovolilo jeho rozšíření do řady dalších center. Také účinnost této metody (6) byla vyšší, protože výsledkem ablace je vedle eliminace spouštěcích ložisek v ústí plicních žil i modifikace substrátu pro udržení FS. Postupně byly vypracovány různé varianty této metody, z nichž nejčastější je kombinace s použitím cirkulárního katétru k průkazu skutečné elektrické izolace plicních žil. V současné době je tedy u pacientů s paroxyzmální FS nejčastěji používanou technikou obkružující ablace plicních žil s dosažením jejich elektrické izolace.
Obr. 1. A. Rentgenogram zachycující cirkulární katétr (Lasso) v pravé horní plicní žíle a ablační katétr u jejího ostia. V dolní části obrázku je multipolární katétr zavedený v koronárním sinu. B. Elektrogramy v okamžiku dosažení elektrické izolace plicní žíly. V záznamech z cirkulárního katétru umístěného v plicní žíle je v prvních dvou stazích přítomna elektrická aktivita (šipka), která následně po izolaci vymizí. 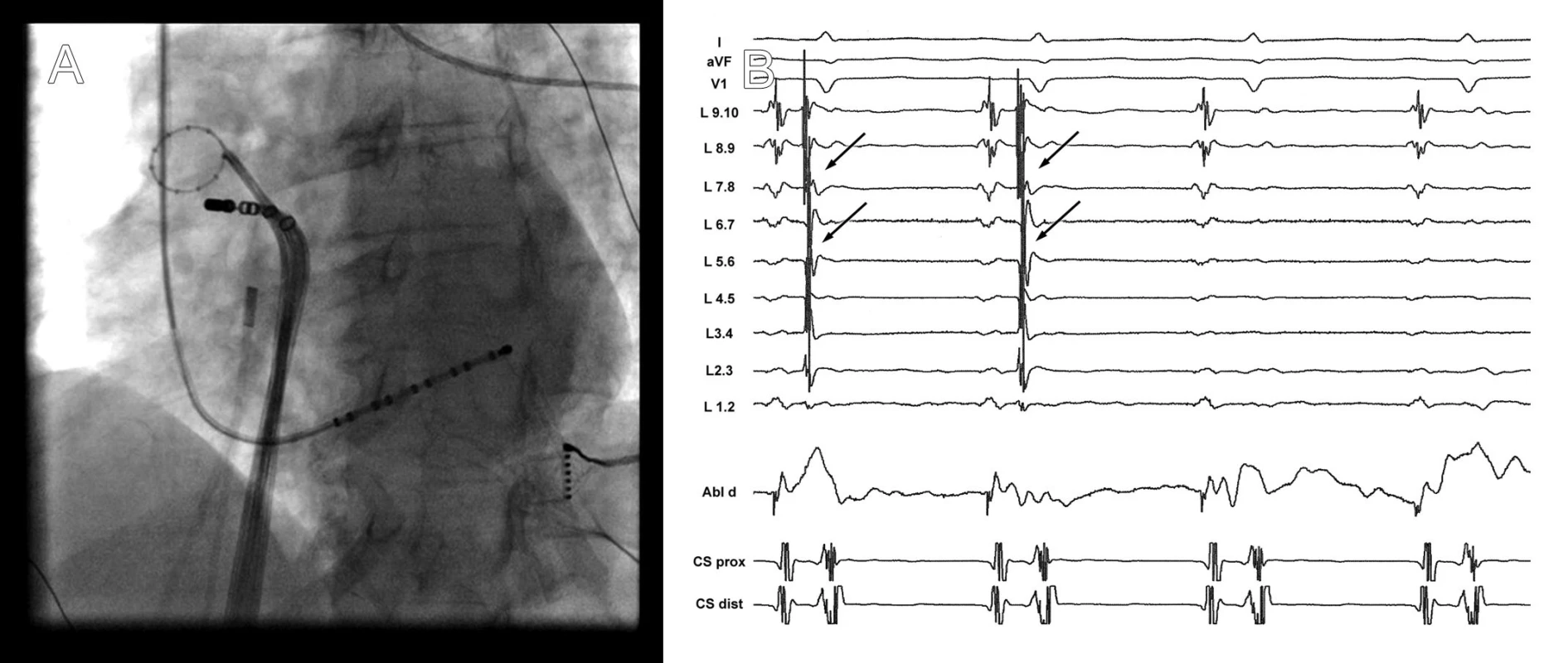
Postupně se ukázalo, že u nemocných s perzistující formou FS sama obkružující izolace plicních žil nestačí. Při dlouhodobém přetrvávání FS totiž dochází k elektrické a morfologické remodelaci, která dále přispívá k jejímu udržení („fibrilace síní plodí fibrilaci“). Je známo, že čím déle arytmie trvá, tím obtížněji ji lze přerušit pomocí kardioverze. Morfologické změny ve svalovině síní zvyšují anizotropii elektrického vedení a vytvářejí substrát pro udržení FS. Proto nestačí provést prostou izolaci plicních žil, ale je nezbytné doplnit výkon o modifikaci tohoto „arytmogenního substrátu“. To znamená vytvoření série dalších lineárních lézí (tedy jistá obdoba operace MAZE) nebo ložiskové ablace v místech s vysoce frakcionovanými elektrogramy v průběhu FS (narušení okruhů reentry). Cílem těchto ablací je nastolení sinusového rytmu či „organizace“ FS, kdy se velmi rychlá a chaotická aktivace v síních zpomalí a uspořádá do pravidelné síňové tachykardie. V takovém případě lze pomocí moderních trojrozměrných systémů přesně zmapovat okruh reentry, který zodpovídá za šíření arytmie, a ablací zasáhnout v kritickém místě. Čím déle FS trvá, tím obtížnější je její odstranění a často je k tomu zapotřebí několika opakovaných výkonů. Katetrizační ablace pro dlouhodobě perzistující FS proto patří v současné době mezi nejobtížnější výkony.
Použití nových technologií
Vzhledem k technické náročnosti výše uvedených výkonů se neustále rozvíjejí nové techniky, které mají za cíl zjednodušení a zvýšení bezpečnosti. Velkým přínosem je používání zobrazovacích metod, jako je intrakardiální echokardiografie nebo implementace anatomických obrazů levé síně a plicních žil, získaných pomocí CT angiografie nebo magnetické rezonance (obr. 2). Ty dovolují zobrazení individuální anatomie plicních žil a vedou ke zlepšení účinnosti a bezpečnosti výkonu. Nové ablační katétry s hrotem proplachovaným fyziologickým roztokem umožnily aplikaci většího množství radiofrekvenčního proudu, a tak provedení větších lézí bez rizika nasedající trombózy. K rychlejšímu vytvoření obkružujících ablačních lézí byly vyvinuty speciální balonkové katétry, které se zaklíní v ústí plicní žíly a dovolí aplikaci určité energie po celém obvodu žíly. Zkouší se použití mražení (kryobalonek), fokusovaného ultrazvuku nebo laseru. Některé současné systémy dovolují dokonce zavedení endoskopu do levé srdeční síně a provádění katetrizační ablace pod zrakovou kontrolou (obr. 3). Jinou možností je použití cirkulárního katétru, který dovoluje aplikaci radiofrekvenční energie z elektrod umístěných na svém obvodu. Dosavadní zkušenosti prozatím jednoznačně neukazují, že by tyto nové systémy byly jednoznačně účinnější nebo levnější. Kromě toho je lze použít pouze u pacientů s paroxyzmální formou FS, u kterých lze předpokládat dominantní roli spouštěcích ložisek v plicních žilách.
Obr. 2. CT angiogram levé srdeční síně a plicních žil, který je integrován s trojrozměrnou elektroanatomickou mapou levé srdeční síně získanou pomocí mapovacího systému (CARTO, Biosense Webster). To umožňuje provádět katetrizační ablaci okolo ostií plicních žil s přesnou znalostí jejich anatomie. Místa aplikace radiofrekvenční energie jsou označena tmavě červenými body. 
Obr. 3. Ukázka balonkového katétru, který umožňuje aplikace laserové energie do antra plicní žíly A. Zobrazení balonkového katétru umístěného v levostranných plicních žilách pomocí intrakardiální echokardiografie během ablace. B. Obraz z endoskopu umístěného uvnitř balonku, který ukazuje vnitřek ostia plicních žil s odstupy žilních větví. Zelenou barvou je označeno místo ablace. 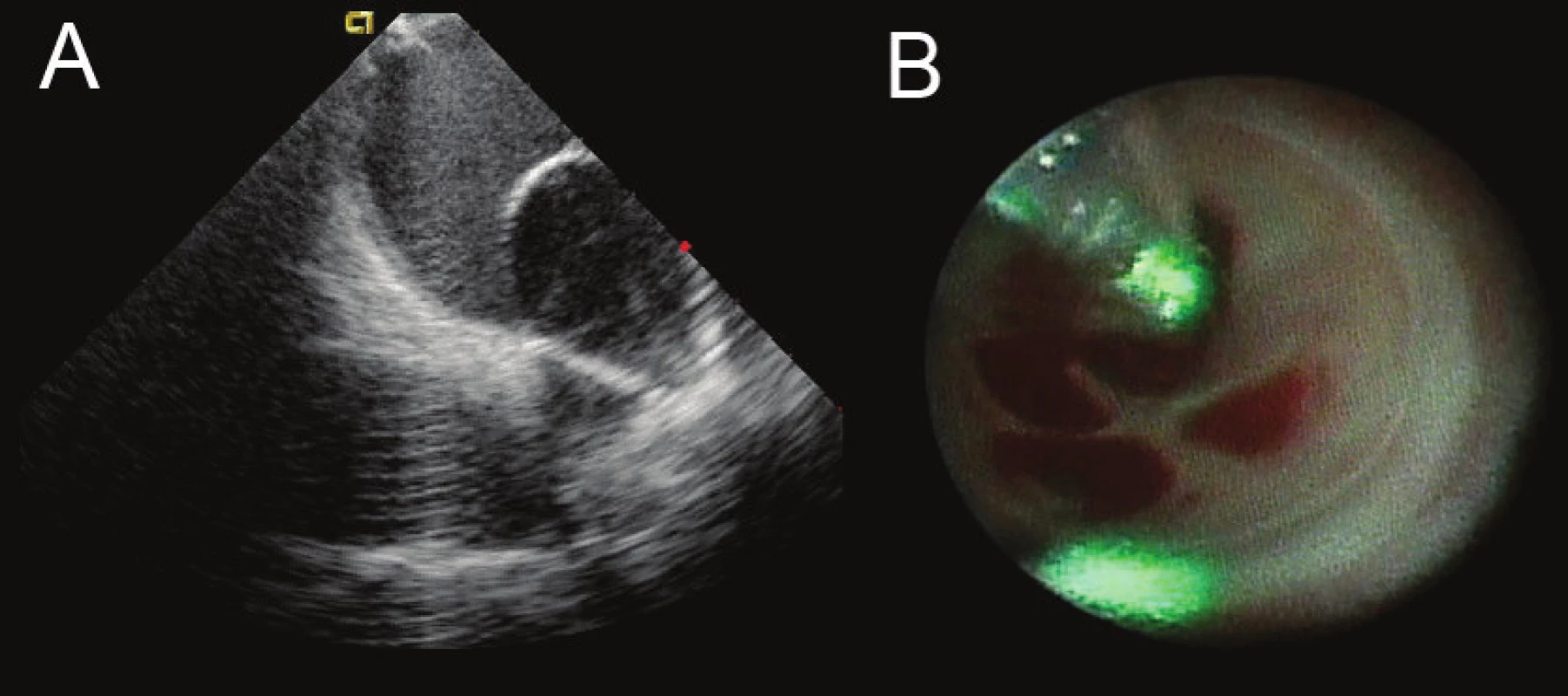
Další možností je zpřesnění a zjednodušení manipulace ablačního katétru pomocí robotické navigace. V současné době jsou k dispozici dva odlišné systémy. V prvním případě (systém Sensei, Hansen Medical) je konvenční katétr řízen pomocí dvou metalických ohebných zavaděčů, jejichž pohyb je ovládán s vysokou přesností pomocí „joysticku“ umístěného na pracovní stanici ve vedlejší místnosti katetrizačního sálu. Vlastní manipulaci katétru zajišťuje speciální manipulační jednotka umístěná na katetrizačním stole (obr. 4). U druhého systému (Niobe II, Stereotaxis) je používán velmi měkký katétr s malým magnetem na konci, jehož pohyb je řízen změnami magnetického pole, které je generováno okolo hrudníku pacienta ze dvou velkých magnetů. Pohyb magnetů (a tím pohyb katétru) je ovládán opět pomocí joysticku v ovládací místnosti.
Obr. 4. Systém pro robotickou ablaci (Hansen-Medical) A. Ovládací panel robotického systému, který je umístěn mimo katetrizační sál. B. Rameno robotického systému, které řídí pomocí zavaděčů pohyb ablačního katétru uvnitř srdce pacienta. 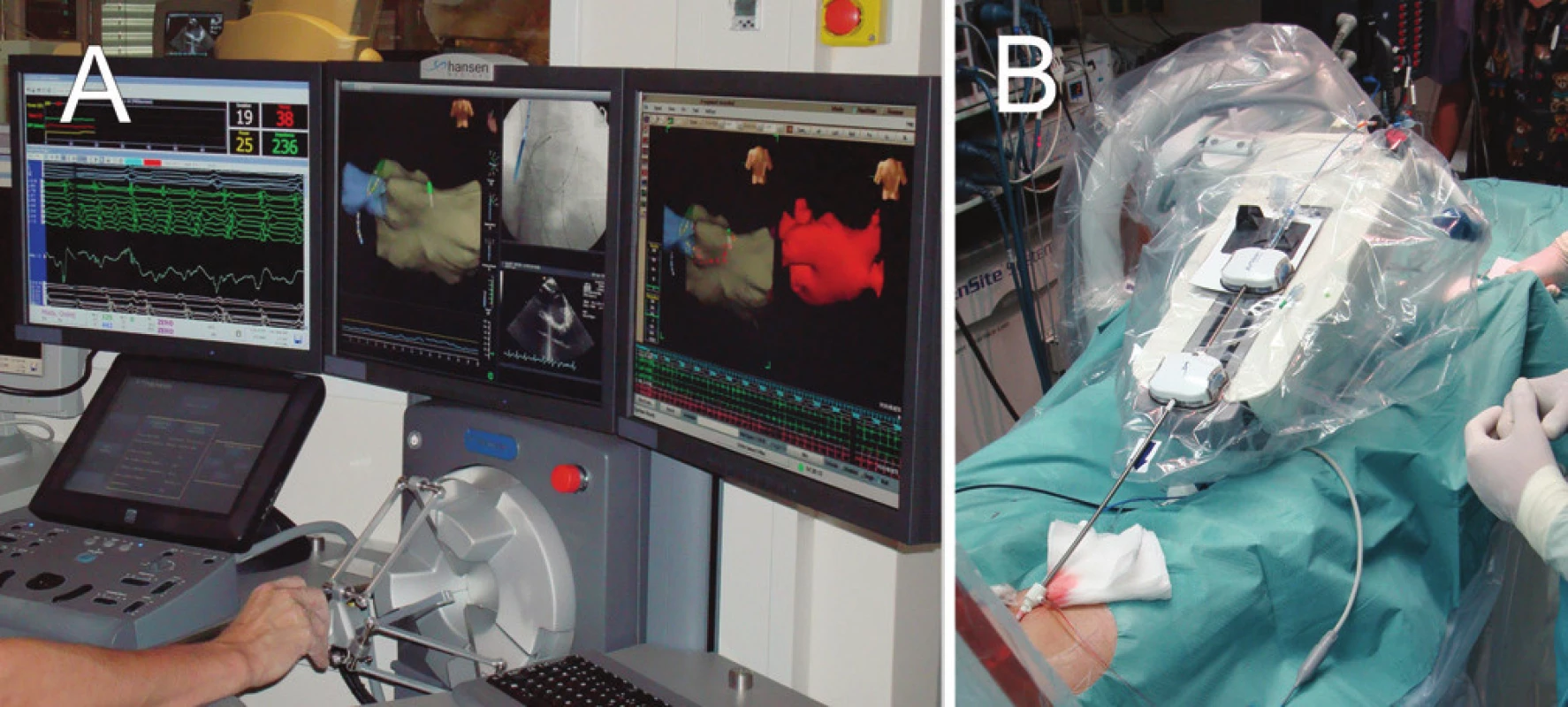
Úspěšnost katetrizační ablace a indikační kritéria
V současné době jsou dostupné výsledky nejméně čtyř randomizovaných studií, které prokázaly, že u pacientů s paroxyzmální či krátkodobě perzistující FS, u kterých selhala léčba jedním antiarytmikem, je katetrizační ablace účinnější než léčba jiným lékem (7–10). Obecně lze konstatovat, že úspěšnost katetrizační ablace v dlouhodobém nastolení sinusového rytmu se pohybuje v rozmezí 70–90 % v závislosti na výběru pacientů, technice prováděného výkonu a délce a typu sledování pacientů po výkonu (11). Mnohem méně údajů existuje o úspěšnosti katetrizační ablace u dlouhodobě perzistující FS. Zcela chybí data o tom, zda je dlouhodobé udržení sinusového rytmu provázeno nižším výskytem komplikací, jako jsou mozkové příhody nebo srdeční selhávání. Podobně zatím neexistují údaje o příznivém vlivu katetrizační léčby na mortalitu.
Současné postavení katetrizačních ablací v léčbě FS odráží nedávno zveřejněná nová verze doporučení Evropské kardiologické společnosti (1) pro léčbu FS (obr. 5). U paroxyzmální FS existuje poměrně dobrá evidence účinnosti katetrizační ablace, a proto je doporučení ve třídě IIa s úrovní důkazů ve třídě A (tj. podpořeno randomizovanými studiemi). K ablaci jsou indikováni primárně pacienti se symptomy, u kterých není antiarytmická léčba účinná nebo žádoucí. Zatím není jednoznačně zodpovězena otázka, zda má být katetrizační ablace prováděna jako metoda první volby bez předchozí antiarytmické léčby. V tomto smyslu byla doposud publikována pouze jediná randomizovaná studie, i když její výsledky vyzněly pro ablaci příznivě (12). Dále prozatím nejsou důkazy o účinnosti katetrizační ablace u asymptomatických pacientů. Provedení ablace lze zvážit v případě, kdy se jedná o mladého pacienta a je podezření na tachykardickou kardiomyopatii. V případě srdečního selhání, dysfunkce levé komory srdeční a nekontrolovatelné odpovědí komor totiž dochází po katetrizační ablaci a úpravě srdečního rytmu ke zlepšení ejekční frakce levé komory (13). V klinické praxi je katetrizační ablace někdy vyhledávána pacienty, kteří jsou asymptomatičtí a nechtějí dlouhodobě užívat antikoagulační léčbu. Dosud však chybí data o účinnosti katetrizační ablace v prevenci tromboembolických příhod. Proto by pacientovo přání vysadit antikoagulační léčbu nemělo být bráno v potaz jako indikační kritérium.
Obr. 5. Doporučené postupy pro léčbu fibrilace síní (upraveno dle 1) 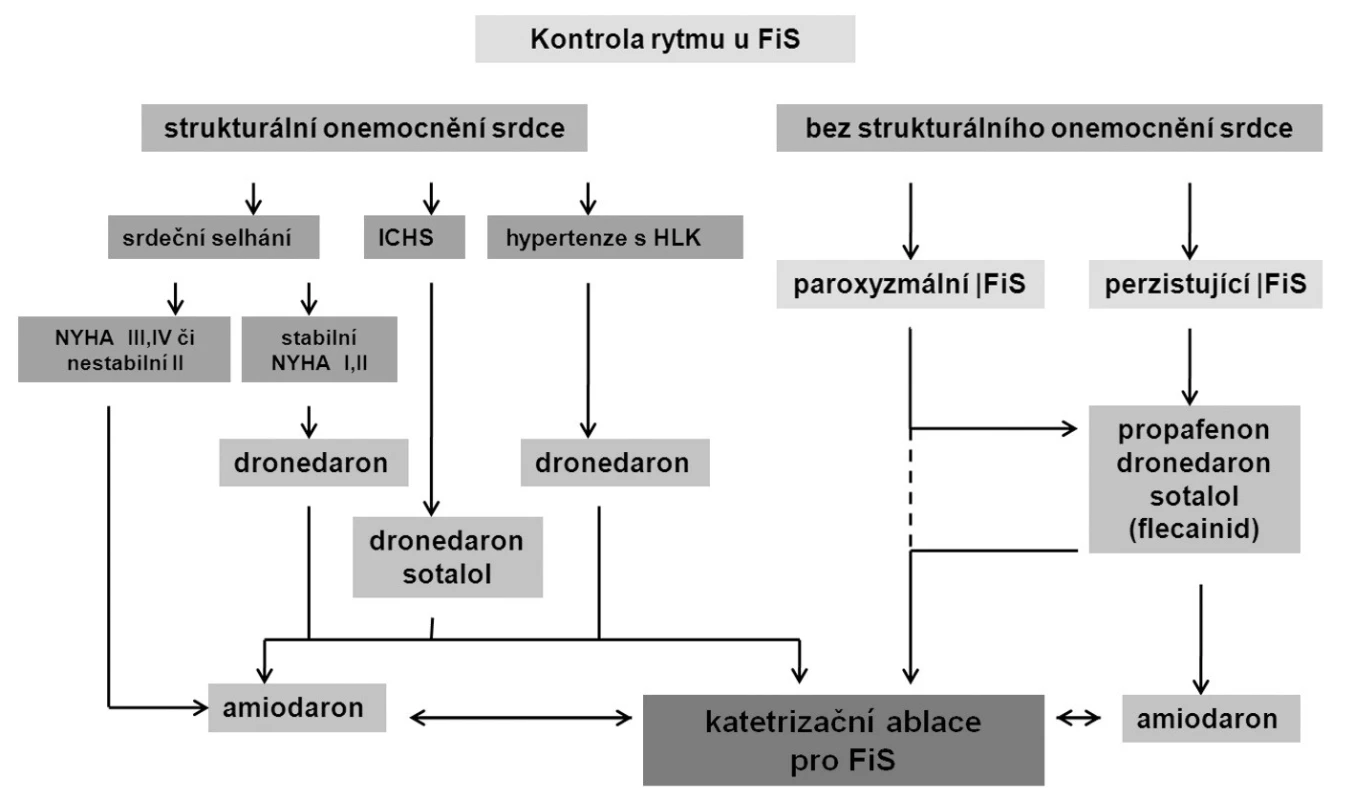
Mezi parametry, které významně ovlivňují úspěšnost výkonu, patří především rozměr levé síně. Výrazná dilatace levé síně (obvykle nad 50–55 mm) je obvykle spojena s elektrickou a mechanickou remodelací, která snižuje šanci na dlouhodobé udržení sinusového rytmu (14). Také anamnéza dlouhodobě se udržující perzistující FS zvyšuje riziko neúspěchu ablace (obvykle při trvání FS více než 2 roky). Naopak u pacientů s paroxyzmální FS, u kterých se střídá arytmie se sinusovým rytmem, doba trvání obtíží úspěšnost výkonu neovlivňuje. Ve skupině starších pacientů (nad 70 let) uvádí různí autoři obdobnou účinnost katetrizační ablace a ani riziko periprocedurálních komplikací není uváděno významně vyšší (15).
Při zvažování indikace k ablaci bychom proto měli vzít v úvahu: 1. symptomy, 2. stadium onemocnění síní (typ FS, četnost a trvání FS, velikost síní), 3. přítomnost a závažnost základního srdečního onemocnění, 4. dosavadní způsob léčby a 5. volbu pacienta. Přínos ablace musí převážit nad možnými riziky komplikací. Protože úspěšnost a riziko komplikací úzce souvisí se zkušeností operatéra a počtem prováděných výkonů, nová doporučení zdůrazňují, že ablace by měly být prováděny téměř výhradně ve specializovaných centrech.
Potenciální komplikace výkonu
Ablace pro FS patří k jednomu z nejkomplexnějších výkonů v intervenční elektrofyziologii, a proto je četnost komplikací vyšší než u konvenčních výkonů. Riziko významnějších komplikací katetrizační ablace FS lze odhadovat na 6 % (16). Naštěstí jen malá část z nich zanechává trvalé následky (embolizační mozková příhoda, stenóza plicních žil, diafragmatická paréza). Ačkoliv jsou závažné komplikace v dnešní době méně časté, stále se jejich frekvence ve velkých registrech pohybuje okolo 4 % (17). Riziko úmrtí v příčinné souvislosti s výkonem (zpravidla při nerozpoznaném masivním krvácení, při pozdní tamponádě nebo po vzniku atrioezofageální fistule) je pravděpodobně kolem 0,1 %. Komplikace katetrizační ablace FS a možnosti jejich prevence byly recentně shrnuty v přehledu (18). Je nutné zdůraznit, že naprostá většina komplikací je rozpoznána a léčena bezprostředně při vlastním výkonu nebo během observace při navazující hospitalizaci. Pozdních komplikací se závažným průběhem po propuštění je minimum, ale tím více je třeba pomýšlet na příčinnou souvislost mezi jakýmikoliv akutními změnami zdravotního stavu a provedenou katetrizační ablací a včas konzultovat příslušné kardiocentrum. Platí to i pro nespecifické příznaky, jako jsou subfebrilie nebo horečky, schvácenost, kašel, atypické bolesti na hrudi nebo dysfagické potíže.
Specifickou komplikací ablace FS je vznik pravidelných síňových tachykardií po výkonu. Tyto arytmie se objevují u 3–50 % pacientů a jejich výskyt je častější, jestliže je součástí ablační strategie tvorba lineárních lézí (např. linie na stropě levé síně, od levostranných plicních žil k mitrálnímu anulu) (19–21). Mechanismem těchto tachykardií je reentry (nejčastěji perimitrální reentry, reentry okolo ipsilaterálních plicních žil) se zónou pomalého vedení v oblasti nekompletní linie. Pravidelné síňové tachykardie vedou obvykle k rychlejší komorové odpovědi než FS a bývají proto hůře tolerovány a jsou rezistentní k medikamentózní léčbě. Nejvíce se objevují časně po výkonu a až v 50 % ustoupí do několika týdnů po zhojení lézí. Pokud přetrvávají déle, měla by být indikována reablace.
Sledování pacientů po výkonu
Selhání výkonu je v současné době definováno jako recidiva jakéhokoliv paroxyzmu FS delšího než 30 sekund dokumentovaná v odstupu více než 2 měsíce po katetrizační ablaci. Časně po výkonu (< 2 měsíce) dochází totiž k recidivě FS až u 45 % pacientů. Ačkoli je časná recidiva nezávislým prediktorem dlouhodobého neúspěchu, není indikací k časné reablaci, protože až u 60 % těchto pacientů k dalším recidivám během dlouhodobého sledování nedochází.
Protože část epizod FS po předchozí ablaci nemusí být spojena se symptomy, bývá klinický efekt ablace podstatně lepší než data získaná opakovaným monitorováním EKG. Proto je doporučováno (11), aby pacienti po ablaci FS byli sledováni v tříměsíčních intervalech po dobu prvního roku a v šestiměsíčních intervalech po dobu druhého roku. Při všech ambulantních návštěvách má být získáno standardní EKG a pacienti by během prvního roku měli navíc absolvovat několikadenní kontinuální monitorování EKG (formou několika samostatných 24hodinových nebo 1–2 vícedenních „holterů“) nebo několikatýdenní monitorování pomocí epizodního záznamníku EKG.
Výše uvedené monitorování rekurencí arytmie je významné zejména tehdy, pokud sledujeme pacienta s hraničním tromboembolickým rizikem (CHADS2 (22) nebo CHA2DS2-VASc skóre (23)) a uvažujeme o vysazení antikoagulační léčby. Vzhledem k chybějícím datům by rozhodování o dlouhodobé antikoagulační léčbě mělo být zatím založeno spíše na tromboembolickém profilu než na výsledku ablace FS. Jinými slovy, pacienti s vyšším rizikem tromboembolismu by měli být léčeni antikogulancii navzdory dokumentovanému přetrvávání sinusového rytmu. Není totiž možné vyloučit velmi pozdní recidivy FS i při příznivém vývoji během standardního 1–2letého intenzivního sledování po ablaci (24). Ukončení antikoagulační léčby musí být individuálně zváženo s přihlédnutím k absolutní absenci arytmie, k reverzní remodelaci levé síně a eventuálně i k ověřené dostatečné vyprazdňovací funkci ouška levé síně.
Zkušenosti kliniky kardiologie IKEM
První ablace fokálního zdroje spouštějícího FS byla na našem pracovišti provedena již v roce 1999. V roce 2001 jsme provedli jako první pracoviště v České republice katetrizační izolaci plicních žil. V průběhu let došlo k nárůstu počtu výkonů (obr. 6) a do konce roku 2010 to bylo celkem 1381 zákroků. V posledních 5 letech se stala katetrizační ablace FS jednoznačně nejčastějším ablačním výkonem pro srdeční arytmie. V roce 2003 jsme jako první pracoviště v České republice použili k vedení výkonu intrakardiální echokardiografii, která dle našich zkušeností umožňuje minimalizovat riziko závažných komplikací. To dokumentuje souhrn komplikací z našeho pracoviště za poslední 4 roky (tab. 1). Naše pracoviště také jako první začalo rutinně provádět katetrizační ablaci FS pomocí robotického systému (Sensei, Hansen Medical). Účinnost tohoto systému lze demonstrovat na souboru 100 pacientů s paroxyzmální FS, kteří podstoupili výkon v posledních 2 letech. Průměrná délka zákroku byla 225 ± 57 min a skiaskopický čas 12,9 ± 6,8 min. Při sledování 10 ± 5měsíců měsíců bylo 86 % pacientů bez recidivy jakékoliv epizody FS delší než 30 sekund. Přibližně u pětiny pacientů však bylo nutné výkon zopakovat.
Obr. 6. Přehled počtu katetrizačních ablací pro fibrilaci síní na Klinice kardiologie IKEM v Praze 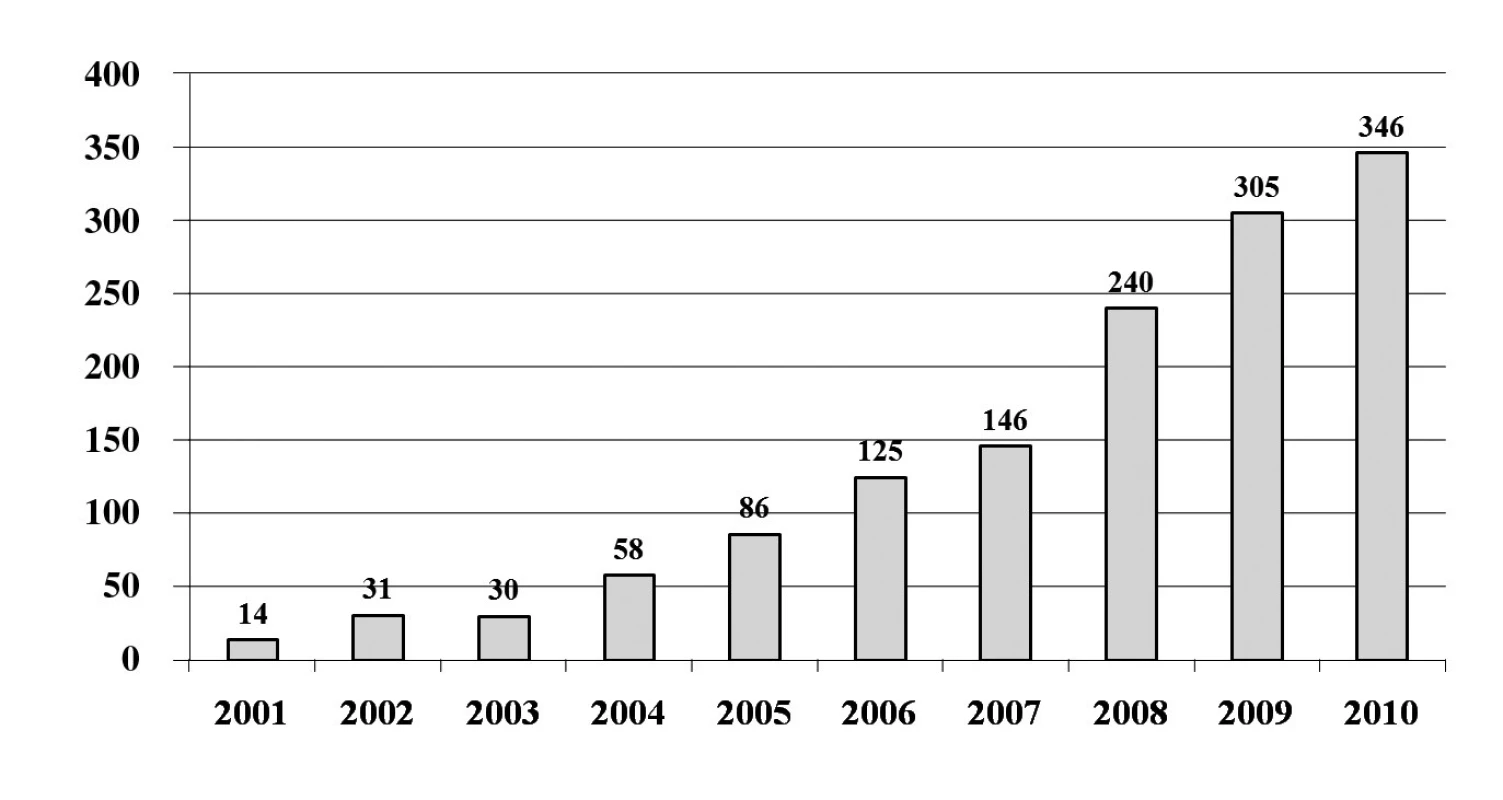
Tab. 1. Přehled komplikací katetrizační ablace fibrilace síní od 3/2006 do 8/2010. (V tomto období bylo provedeno 1057 výkonů u 857 pacientů.) 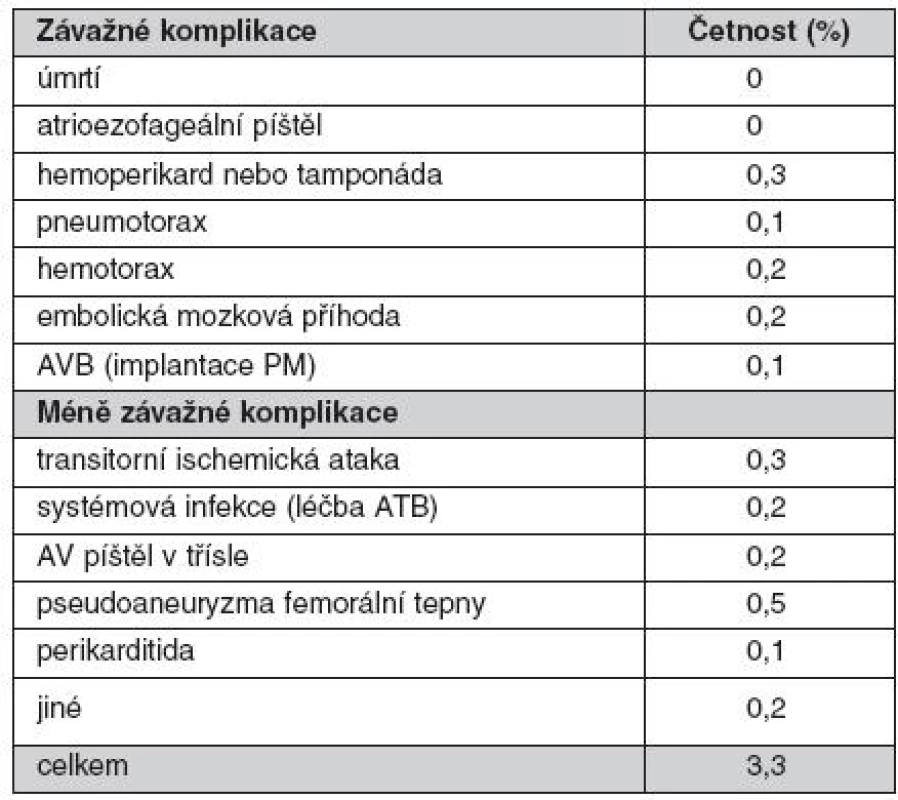
Závěr
Katetrizační ablace se během posledních let stala metodou volby pro pacienty s paroxyzmální nebo perzistující FS, která vede k výrazným obtížím a je rezistentní na medikamentózní léčbu. Základním cílem výkonu je úplná elektrické izolace plicních žil od svaloviny levé síně, které je dosaženo vytvořením série lézí v proximálním segmentu plicních žil. U pacientů s perzistující nebo chronickou formou arytmie bývá izolace doplněna o další léze s cílem rozsáhlejší modifikace arytmogenního substrátu. Účinnost výkonu v odstranění FS se pohybuje v rozmezí 70–90 % v závislosti na studované populaci, typu FS, použité technice a metodě sledování po zákroku. I přes výrazný pokrok se stále jedná o komplexní výkon, který je spojen s rizikem závažných komplikací. Proto by mělo být jeho provádění vyhrazeno pro vysoce specializovaná pracoviště, která používají moderní technologie a provádějí velký objem těchto výkonů.
Zkratky
- ATB – antibiotoka
- AVB – AV blokáda
- FS – fibrilace síní
- PM – kardiostimulátor
Adresa pro korespondenci:
MUDr. Petr Peichl, Ph.D.
Klinika kardiologie IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: pepi@medicon.cz
Zdroje
1. Camm AJ, Kirchhof P, Lip GY, Schotten U, Savelieva I, Ernst S, et al. Guidelines for the management of atrial fibrillation: The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31(19): 2369–2429.
2. Fuster V, Ryden LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA, et al. ACC/AHA/ESC 2006 Guidelines for the Management of Patients with Atrial Fibrillation. Circulation 2006; 114(7): e257–e354.
3. Corley SD, Epstein AE, DiMarco JP, Domanski MJ, Geller N, Greene HL, et al. Relationships between sinus rhythm, treatment, and survival in the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Study. Circulation 2004; 109(12): 1509–1513.
4. Haissaguerre M, Jais P, Shah DC, Takahashi A, Hocini M, Quiniou G, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339(10): 659–666.
5. Pappone C, Rosanio S, Oreto G, Tocchi M, Gugliotta F, Vicedomini G, et al. Circumferential radiofrequency ablation of pulmonary vein ostia: A new anatomic approach for curing atrial fibrillation. Circulation 2000; 102(21): 2619–2628.
6. Oral H, Scharf C, Chugh A, Hall B, Cheung P, Good E, et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation 2003; 108(19): 2355–2360.
7. Jais P, Cauchemez B, Macle L, Daoud E, Khairy P, Subbiah R, et al. Catheter ablation versus antiarrhythmic drugs for atrial fibrillation: the A4 study. Circulation 2008; 118(24): 2498–2505.
8. Oral H, Pappone C, Chugh A, Good E, Bogun F, Pelosi F, Jr., et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006; 354(9): 934–941.
9. Pappone C, Augello G, Sala S, Gugliotta F, Vicedomini G, Gulletta S, et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atrial fibrillation: the APAF Study. J Am Coll Cardiol 2006; 48(11): 2340–2347.
10. Stabile G, Bertaglia E, Senatore G, De SA, Zoppo F, Donnici G, et al. Catheter ablation treatment in patients with drug-refractory atrial fibrillation: a prospective, multi-centre, randomized, controlled study (Catheter Ablation For The Cure Of Atrial Fibrillation Study). Eur Heart J 2006; 27(2): 216–221.
11. Calkins H, Brugada J, Packer DL, Cappato R, Chen SA, Crijns HJ, et al. HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. Europace 2007; 9(6): 335–379.
12. Wazni OM, Marrouche NF, Martin DO, Verma A, Bhargava M, Saliba W, et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA 2005; 293(21): 2634–2640.
13. Hsu LF, Jais P, Sanders P, Garrigue S, Hocini M, Sacher F, et al. Catheter ablation for atrial fibrillation in congestive heart failure. N Engl J Med 2004; 351(23): 2373–2383.
14. Arya A, Piorkowski C, Sommer P, Bollmann A, Hindricks G. Ablation of atrial fibrillation: patient selection, techniques, and the results. Herzschrittmacherther Elektrophysiol 2008; 19(2): 68–72.
15. Traub D, Daubert JP, McNitt S, Zareba W, Hall B. Catheter ablation of atrial fibrillation in the elderly: where do we stand? Cardiol J 2009; 16(2): 113–120.
16. Cappato R, Calkins H, Chen SA, Davies W, Iesaka Y, Kalman J, et al. Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circulation 2005; 111(9): 1100–1105.
17. Cappato R, Calkins H, Chen SA, Davies W, Iesaka Y, Kalman J, et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 2010; 3(1): 32–38.
18. Peichl P, Mlčochova H, Čihák R, Kautzner J. Selektivní katetrizační ablace fibrilace síní: potenciální komplikace výkonu a možnosti jejich prevence. Interv Akut Kardiol 2008; 7 : 226–229.
19. Raviele A, Themistoclakis S, Rossillo A, Bonso A. Iatrogenic postatrial fibrillation ablation left atrial tachycardia/flutter: how to prevent and treat it? J Cardiovasc Electrophysiol 2005; 16(3): 298–301.
20. Mesas CE, Pappone C, Lang CC, Gugliotta F, Tomita T, Vicedomini G, et al. Left atrial tachycardia after circumferential pulmonary vein ablation for atrial fibrillation: electroanatomic characterization and treatment. J Am Coll Cardiol 2004; 44(5): 1071–1079.
21. Chung MK, Martin DO, Sprecher D, Wazni O, Kanderian A, Carnes CA, et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001; 104(24): 2886–2891.
22. Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001; 285(22): 2864–2870.
23. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor–based approach: the euro heart survey on atrial fibrillation. Chest 2010; 137(2): 263–272.
24. Sawhney N, Anousheh R, Chen WC, Narayan S, Feld GK. Five-year outcomes after segmental pulmonary vein isolation for paroxysmal atrial fibrillation. Am J Cardiol 2009; 104(3): 366–372.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Katetrizační ablace fibrilace síní
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Akutní selhání jater: současná doporučení
- IKEM – Institut klinické a experimentální medicíny – na prahu páté dekády úspěšné existence
- Plánované akce odborných složek ČLS JEP
- Specifika perioperační péče o pediatrické pacienty podstupující transplantaci jater
- Zemřelí dárci orgánů k transplantacím
- Imunohistochemická detekce glypicanu-3 zpřesňuje diagnózu hepatocelulárního karcinomu
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
- Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
- IKEM – odborné, politické a další souvislosti vzniku a dosavadního vývoje
- Transplantace ledviny v IKEM
- Výsledky dlouhodobého sledování prvních 500 pacientů po transplantaci jater provedených v Institutu klinické a experimentální medicíny v Praze
- Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
- Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
- Transplantace jater u pacientů s trombózou v. portae
- Vliv chirurgických komplikací na funkci transplantované ledviny
-
Molecular Diagnostic Europe
Hannover, 4. až 7. října 2010 -
Konference Tabák a zdraví po jedenácté v Lékařském domě
Praha, 5. listopadu 2010 - Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Spolek lékařů českých v Praze
-
Strouhal E, Vachala B, Vymazalová H.
Lékařství starých Egypťanů
I. staroegyptská chirurgie, Péče o ženu a dítě - CHARLES BRENTON HUGGINS
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní selhání jater: současná doporučení
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



