-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNáš článek po 10 letech: Intrathecal midazolam as supplementary analgesia for chronic lumbar pain – 15 years’experience
Our article after ten years: Intrathecal midazolam as supplementary analgesia for chronic lumbar pain – 15 years’experience
Ten years ago, our experiences with intrathecal midazolam in patients suffering with chronic low back pain were published in Pain Medicine. This review article provides a critical assessment of our results and further development of this method as seen from a distance of one decade.
Keywords:
spinal analgesia – midazolam – chronic low back pain – failed back surgery syndrome – off‑ label therapy
Autoři: J. Procházka 1; A. Hejčl 2; L. Procházková 3
Působiště autorů: Centrum léčby chronické bolesti při Klinice anesteziologie, perioperační a intenzivní medicíny Univerzity J. E. Purkyně, Krajská zdravotní, a. s., Masarykova nemocnice o. z., Ústí nad Labem 1; Neurochirurgická klinika Univerzity J. E. Purkyně, Krajská zdravotní, a. s., Masarykova nemocnice o. z., Ústí nad Labem 2; Oční klinika Univerzity J. E. Purkyně, Krajská zdravotní, a. s., Masarykova nemocnice o. z., Ústí nad Labem 3
Vyšlo v časopise: Anest. intenziv. Med., 32, 2021, č. 2, s. 94-98
Kategorie: Přehledové články
Souhrn
Před 10 lety byly v Pain Medicine publikovány naše zkušenosti s intratékální aplikací midazolamu u pacientů s chronickou bolestí zad. Tento přehledový článek přináší kritické zhodnocení výsledků naší práce a dalšího vývoje této metody s od stupem desetiletí.
Klíčová slova:
spinální analgezie – midazolam – chronická bolest dolních zad – syndrom neúspěšné operace dolních zad – off‑label terapie
Stručná charakteristika článku a publikovaných výsledků
Chronické bolesti dolních zad a syndrom neúspěšné operace dolních zad (failed back surgery syndrome, FBSS) jsou závažným zdravotním problémem, který má i sociální a ekonomické důsledky. U těchto pacientů, zejména v důsledku chronicity uvedených onemocnění, nejsou často dostačující jednoduché léčebné metody nebo použití jednoho analgetika, mnohdy proto vyžadují mnohem komplexnější léčebný přístup. Standardně se používají neuroaxiální aplikace steroidů, které mají nicméně své nežádoucí účinky a jejich efekt taktéž není vždy zaručen. Nabízí se spinální použití opioidů, nicméně kromě nutnosti implantace dávkovacího zařízení pro kontinuální podávání vzhledem k jejich krátké době účinku mají také řadu nežádoucích účinků a rizik, např. tvorbu granulace na konci katétru nebo rozvoj morfinové tolerance. Hledají se proto jiné alternativní metody neuroaxiální analgezie s použitím látek, které by bylo možné aplikovat jednorázově a které by nebyly zatížené uvedenými komplikacemi. Jednou ze zajímavých látek působících neuroaxiální analgezii je midazolam, agonista spinálního inhibičního GABAA receptoru. V uvedené studii [1] jsme publikovali 15 let zkušeností s touto metodou u pacientů s chronickými bolestmi zad nebo se syndromem neúspěšné operace dolních zad FBSS, u kterých předchozí epidurální aplikace steroidů nepřinesla požadovaný analgetický efekt.
Pro péči o pacienty s bolestmi zad jsme vyvinuli algoritmus intervencí, kde v prvním stupni byly obstřiky spouštěcích bodů, obstřiky sakroiliakálních skloubení (periartikulárně) nebo obstřiky facetových kloubů. Pokud byl analgetický efekt nedostačující, přistoupili jsme ke druhému stupni, což představovala epidurální aplikace depotních steroidů (kaudálním nebo interlaminárním přístupem). Při nedostatečném efektu steroidů jsme pacientovi nabídli třetí stupeň, intratékální aplikaci midazolamu (obr. 1).
Obr. 1. Náš třístupňový algoritmus pro intervenční terapii u chronických bolestí zad (TrPs = myofasciální spouštěcí body) 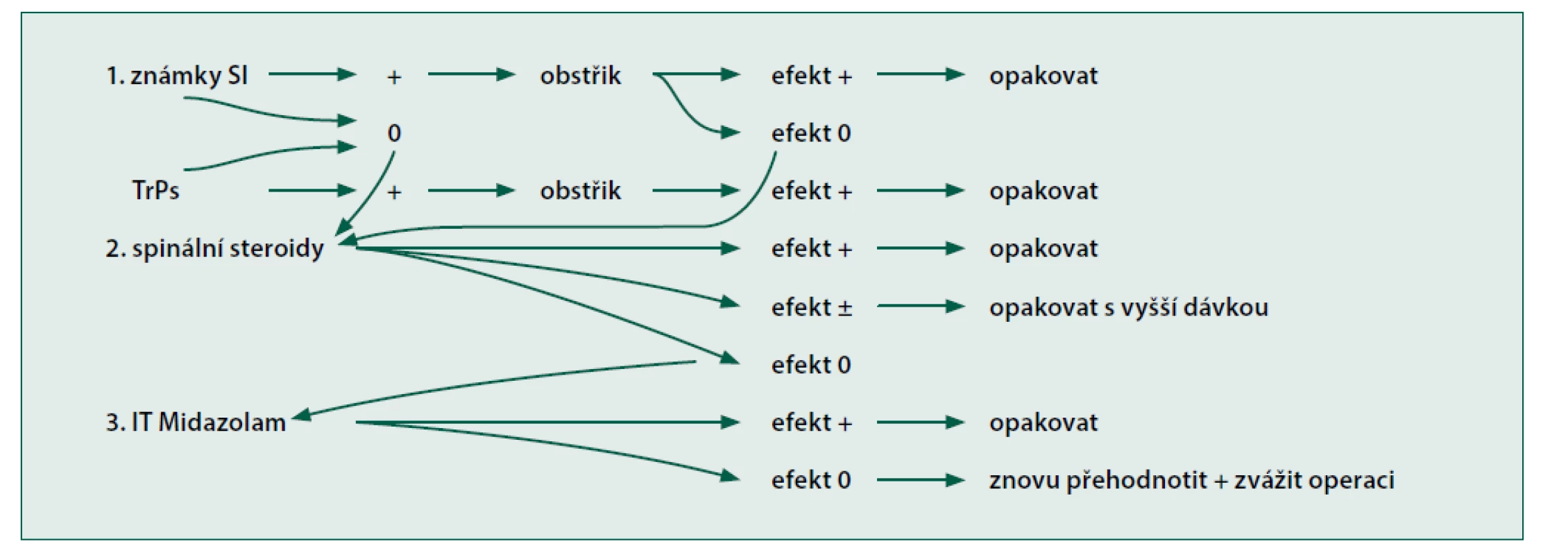
Po obdržení informovaného souhlasu spolu s vysvětlením, že se jedná o off‑label metodu, po zajištění periferního žilního přístupu a po místním znecitlivění byla do bederní páteře (v prostoru L2/3, L3/4 nebo L4/5, podle toho, kde byly nejpříznivější anatomické podmínky) zavede - na spinální jehla 25G (která v roce 1997 nahradila původně používanou jehlu 22G). Touto jehlou jsme aplikovali dávku 2 až 5 mg midazolamu naředěnou do objemu 3 ml pomocí fyziologického roztoku nebo 5% glukózy. Výchozí dávka byla vždy 2 mg, poté podle dosaženého analgetického efektu jsme buď tuto dávku ponechali nebo postupně zvyšovali až do maximální dávky 5 mg. Tato dávka odpovídá 0,02 až 0,05 mg/kg. Podle přání pacienta jsme intervenci opakovali, intervaly do následující aplikace byly vždy nejméně 4 týdny.
Analgetický efekt jsme hodnotili dotazem na úroveň snížení bolesti a délku trvání analgezie při následující kontrole pacienta na ambulanci. Follow‑up byl nejméně 4 týdny, nejdéle 9 let. V některých případech pacienti mohli po dobu trvání účinku i přechodně vysadit další analgetickou terapii (tzv. „lékové prázdniny“). Jako dostatečnou analgezii jsme hodnotili alespoň 50% snížení úrovně bolesti se zlepšením kvality života (Quality of life, QoL) a zlepšením funkčního stavu pacienta.
V době od roku 1995 do roku 2010 jsme provedli celkem 500 aplikací midazolamu: 227 aplikací u 57 mužů a 273 aplikací u 69 žen. Důvodem 81 aplikací byly chronické bolesti dolních zad, indikací k 419 aplikacím byl FBSS. Průměrný věk pacientů v době aplikace byl 50 let (v rozmezí 28 až 86 let). Podaná dávka byla 2 až 5 mg midazolamu jednorázovou aplikací.
Intratékálním podáním midazolamu jsme dosáhli u 65 % aplikací snížení úrovně bolesti alespoň o polovinu po dobu nejméně 4 týdnů. Incidence nežádoucích účinků byla nízká, nejčastěji pozorovaným nežádoucím účinkem byla ospalost (30 %), bolesti hlavy (< 2 %), nevolnost (< 2 %), přechodné zhoršení potíží (5 %). Po aplikaci midazolamu jsme nepozorovali žádné klinické známky neurotoxicity (dysfunkce střev nebo močového měchýře, radikulopatie) [1].
Tehdejší stav poznání
Analgetický účinek intratékálně nebo epidurálně podaného midazolamu byl potvrzen řadou klinických studií, obvykle byl použitý jako doplněk spolu s opioidy a lokálními anestetiky v pooperační analgezii, např. po císařském řezu [2, 3], po abdominální chirurgii [4, 5, 6] nebo perianální chirurgii [7]. Posloužil také v analgezii pro neuropatické nebo neuromuskulární bolesti v kontinuální analgezii spolu s klonidinem [8]. Podával se též epidurálně, např. v pooperační analgezii po abdominálních operacích [9] nebo kaudálně po inguinálních herniotomiích u dětí [10]. Zkušenosti s jednorázovými aplikacemi midazolamu a srovnání se spinálními steroidy u pacientů s chronickými bolestmi zad publikoval kolektiv okolo prof. Goodchilda [11], tato práce byla též impulsem pro naše klinické používání intratékálního midazolamu.
Proč právě midazolam?
Midazolam je ve vodě rozpustný benzodiazepin, který se používá v urgentní medicíně k sedaci před diagnostickými nebo terapeutickými výkony, v premedikaci před anestezií nebo k dlouhodobé sedaci spolu s opioidy v rámci intenzivní péče. Má rychlý nástup účinku, výrazný antikonvulzivní účinek, výhodou je též možnost intramuskulárního podání v případě nedostupnosti nitrožilní linky. Jeho krátkodobý účinek je dán jednak vysokou rozpustností v tucích a jednak rychlou hepatální clearance. Rozpustnost midazolamu ve vodě je závislá na pH, kdy se se vzestupem pH snižuje. Základním předpokladem jeho možnosti použití je skutečnost, že jako jeden z mála ve vodě rozpustných benzodiazepinů je v Evropě dostupný bez konzervačních látek. Jeho účinek při spinální aplikaci je založen na ovlivnění spinálních GABAA receptorů, se kterými vytváří vazbu a pozitivně zde moduluje jejich inhibiční efekt, přičemž se uvolňují endogenní opioidy působící na spinálním delta‑receptoru [12].
Následný vývoj problematiky na našem pracovišti
Uvedenou metodu používáme na našem pracovišti i nadále, stále je nedílnou součástí algoritmu intervencí u pacientů s chronickými bolestmi dolních zad.
Od začátku užívání této metody v prosinci 1995 do prosince 2020 jsme provedli celkem 858 aplikací u pacientů s bolestmi zad: 359 aplikací u celkem 68 mužů a 499 aplikací u 95 žen, průměrný věk 52,6 roku (rozmezí 28 až 86 let). U 747 aplikací byl indikací k aplikaci midazolamu syndrom neúspěšné operace dolních zad (FBSS) a u 111 aplikací chronické bolesti zad. Aplikovaná dávka byla 2 až 5 mg midazolamu, přičemž výchozí je vždy 2 mg a dále na této dávce setrváváme podle dosaženého analgetického efektu, případně dávku navyšujeme až do maximální dávky 5 mg (viz tab. 1). Po aplikaci pacienti setrvají na lůžku pod dohledem sestry po dobu 4 hodin, poté jsou propuštění s doprovodem nebo sanitním vozem domů. Výkon je ambulantní. Původně jsme využívali lůžko na neurochirurgické klinice, nyní máme k dispozici vlastní stacionář.
Tab. 1. Aplikovaná jednorázová dávka intratékálního midazolamu 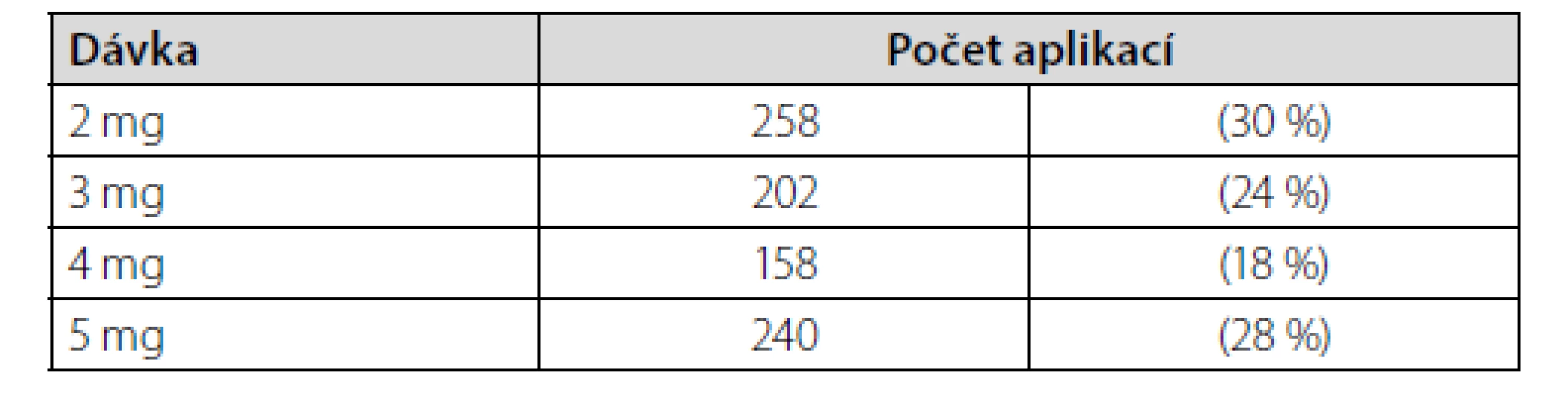
Průměrná doba dosažené analgezie je 9 týdnů, medián je 6 týdnů. Po 65 % aplikacích jsme dosáhli zmírnění bolestí po dobu 4 týdnů nebo déle. Po 96 aplikacích (11 %) nebyl dosažený žádný analgetický efekt, Po 40 aplikacích (5 %) nemáme výsledky k dispozici. Z nežádoucích účinků nejčastěji pozorujeme ospalost (31 %), přechodné zhoršení potíží (7 %), bolesti hlavy (4 %) nebo nevolnost (1 %). Nepozorovali jsme žádné klinické známky neurotoxicity (dysfunkce střev nebo močového měchýře, případně vznik nové radikulopatie), a to ani v případě, že u 18 pacientů jsme provedli 10 a více aplikací (nejvíce bylo u jedné pacientky 65 aplikací během 15 let). Po aplikacích jsme nepozorovali žádné změny hemodynamických nebo respiračních parametrů. S čím se ale často setkáváme, je určitá tachyfylaxe na analgetický efekt intratékálního midazolamu, případně určitá nevyváženost jeho účinku při opakovaných aplikacích některým chronickým pacientům. Tachyfylaxe je bohužel nežádoucí vlastnost jakékoli chronické analgetické terapie, svůj podíl zde může hrát i neuronální plasticita a případná „únava“ GABA‑ergních receptorů. Na nevyváženosti účinku se podle našeho názoru může podílet hlavně určitá kompetice mezi descendentními excitačními a inhibičními mechanismy u pacientů, kteří se jinak věnují běžným denním aktivitám, při kterých může nastat excesivní nociceptivní aktivizace [12].
U žádného pacienta se nejedná o intervenční monoterapii, všichni mají zajištěnou komplexní terapii včetně neopioidních i opioidních analgetik, ko‑analgetik ze skupin gabapentinoidů či antidepresiv, případně i léčebného konopí. Intratékální midazolam má sloužit jen jako její doplněk. Všem pacientům je před aplikací vysvětlen princip off‑label léčby. Etická komise vzala tuto metodu na vědomí.
Současný náhled na tuto metodu ve světě
Spinální analgezie je ve světě široce diskutované téma. V roce 2007 byla ustanovena Konference polyanalgetického konsenzu (Polyanalgesic Consensus Conference, PACC), které se scházejí vždy s odstupem několika let, kdy zhodnotí dosavadní klinické výsledky a závěry studií a vytvoří algoritmus pro neuroaxiální metody. V těchto algoritmech jsou uvedené léky první volby a jejich alternativy a kombinace pro kontinuální infuzní intratékální analgezii. V současné době je aktuální PACC z roku 2017, kde jsou algoritmy rozdělené zvlášť pro nociceptivní a neuropatickou bolest, pro bolest lokalizovanou a difuzní a pro bolest nádorovou či nenádorovou. Midazolam je zde uveden pouze jako adjuvans v 6. linii pro nádorovou bolest nebo pro pacienty v terminálním stavu [13]. Jeho potenciál je ale podle nás vyšší, nehledě na to, že konsenzus se zabývá infuzním kontinuálním podáním, zatímco výhodou midazolamu je možnost jednorázových aplikací s dlouhým trváním účinku [12].
Podívejme se blíže na jednotlivé léky uvedené v algoritmech pro kontinuální intratékální analgetickou terapii.
V první linii je zde uveden hydrofilní opioid morfin, který zůstává stále zlatým standardem pro kontinuální intratékální aplikaci. Mechanismus jeho účinku je založen na agonistickém ovlivnění spinálního mí‑opioidního receptoru. Pro dosažení analgetického efektu stačí setiny dávek užívaných systémově. Není neurotoxický, ale jeho nevýhodou je při dlouhodobém podávání tvorba intratékálních granulomů distálně od konce katétru, tvořených fibroblasty, zrajícím kolagenem a buňkami účastnícími se zánětlivých procesů. Podobný problém se týká i dalších mí‑opioidních agonistů, hydrofilního hydromorfonu a lipofilního fentanylu. V důsledku těchto granulomů může dojít k obstrukci katétru a tím selhání terapie, v extrémních případech nicméně i k paraplegii v důsledku útlaku míchy. Komplikací intratékálních opioidů je u řady pacientů respirační útlum, sedace, nauzea a zvracení, pruritus a retence moči [13, 14, 15].
Dalším lékem z první linie je zikonotid. Jedná se o syntetický analog konopeptidu ω‑konotoxin, který je obsažen v jedu mořského měkkýše Conus magus. Tato látka selektivně blokuje napěťově řízené kalciové kanály N‑typu, tím se v zadních rozích míšních inhibuje uvolňování neurotransmiterů a tím spinální přenos bolesti. Jeho problémem je velice úzké terapeutické okno s vysokým rizikem kognitivních a neuropsychiatrických nežádoucích reakcí, rozvoje meningitidy či jiných infekčních komplikací, snížení úrovně vědomí atd. a též vysoká cena [15, 16, 17].
Standardním doplňkem opioidů bývá amidické lokální anestetikum bupivakain. Při nízké koncentraci používané v analgetických systémech se ovlivní pouze senzitivní vedení bez ovlivnění motorických funkcí, nedochází k tachyfylaxi a synergicky potencuje účinek opioidů. Může však být neurotoxický, vyvolává leptomeningeální zánětlivou infiltraci nebo vakuolizaci neuronů, může vyvolat i syndrom kaudy, viz níže [13, 15].
V dalších liniích algoritmu podle PACC jsou kombinace uvedených látek, případně potentní alfa2 agonista klonidin.
Náhled na neurotoxicitu
Přestože podle klinických zkušeností se intratékální midazolam zdá být bezpečný, jeho širšímu používání brání strach z neurotoxicity. Dosavadní studie jsou rozporuplné. V mnoha případech jsou problémem metodologické nedostatky (počty zvířat použitých v laboratorních studiích, nemožnost adekvátního srovnání dávek a koncentrací u laboratorních zvířat a u lidí). Dalším sporným bodem může být i skutečnost, že v USA není k dispozici midazolam bez konzervačních látek, čímž mohou být animální studie též výrazně zkreslené. Z tohoto důvodu se stanovilo několik organizačních principů týkajících se způsobu podání, dávky, koncentrace a doby expozice, které se musí brát v úvahu u jednotlivých typů laboratorních zvířat, aby zjištěné výsledky byly reálně hodnotitelné [12, 18].
V počátečních dobách byly za neurotoxicitu označovány nově vzniklé neurologické komplikace v návaznosti na provedení neuroaxiální anestezie, které se dávaly do souvislosti se zánětlivými změnami v tomto kompartmentu: aseptickou meningitidou, neuritidou, meningoTab myelitidou, arachnoiditidou apod. [19]. Až později se začalo rozlišovat mezi histopatologickými známkami neurotoxicity (poškození nervů, glióza, poškození myelinových pochev, zánětlivé změny), fyziologickými známkami (změny míšní perfuze krve, porušení hemato‑encefalické či hemato‑myelické bariéry, elektrofyziologické změny) a klinickými známkami neurotoxicity (bolest, senzomotorický deficit, dysfunkce střev či močového měchýře, změny chování laboratorních zvířat). Mimoto velký podíl mohou hrát i další přidané látky v léčivém přípravku (antioxidanty, stabilizancia, excipienty), které mohou též způsobit u laboratorních zvířat neurotoxické změny, i když při intravenózním podání se tyto přípravky považují za bezpečné [20]. Rizikové mohou být i léky uvedené výše v algoritmu PACC. Např. lokální anestetika mohou při kontinuálním intratékálním podání vyvolat syndrom kaudy equiny (perianogenitální hypestezie, slabost dolních končetin, dysfunkce střev nebo močového měchýře) způsobený poškozením nervových kořenů. Toto poškození je úměrné použité koncentraci a je charakterizované axonální degenerací, vakuolizací šedé hmoty, infiltrací makrofágů nebo degenerací Schwannových pochev. Opioidy mohou způsobovat tvorbu již výše zmíněných granulomů z mastocytů, fibroblastů a kolagenu, což podle některých autorů může být též považováno za známku neurotoxicity [18].
Klinické využití v praxi
Volba látek pro intratékální aplikaci v léčbě bolesti se řídí zejména doporučeními PACC, přičemž v USA se pro intratékální analgezii smí používat pouze léky schválené FDA (Food and Drugs Administration, Úřad pro léky a potraviny), což je pouze morfin a zikonotid. U pacientů, kteří na tyto látky nereagují, je teprve možné použít medikace off‑label, jimiž podle PACC jsou další doporučené kombinace. Těmi jsou v první řadě morfin plus bupivakain pro neuropatickou bolest a hydromorfon nebo fentanyl pro nociceptivní bolest. Pro léčbu spasticity je schválené použití baclofenu [13, 17, 21]. V dostupných zahraničních studiích v posledních letech jasně dominuje použití intratékálního midazolamu v pooperační analgezii. Tyto práce nicméně pocházejí ze zemí, jako je např. Írán, Jihoafrická republika, Indie nebo Egypt. Možným vysvětlením (aspoň pro nás) je liberálnější vztah k „doporučením“ ze strany PACC v těchto zemích. Nevylučuje to použití midazolamu i v dalších zemích „blíže Evropě“, jejich výsledky však nejsou kromě našeho pracoviště publikované. Dalším důvodem pro použití v těchto pro nás exotických zemích mohou být minimální provozní náklady a tím využití této alternativní metody neuromodulace u většího počtu pacientů [12, 22–27]. V naprosto recentní studii [28] opírající se o data registru Medtronic Neuromodulation [29] jsou uvedeny výsledky neuromodulace provedených pomocí zařízení od této firmy. Zajímavé je sdělení, že pouze cca 31 % dávkovacích zařízení bylo charakterizováno jako on‑label (tzn. morfin nebo zikonotid v monoterapii), zatímco 69 % jako off‑label, tzn. použily se neschválené léky nebo přísady, ovšem bez bližšího určení daných látek, takže o nich lze pouze spekulovat. Otevírá se též otázka definice off‑label podání léku. V případě intratékálního midazolamu se jedná o alternativní způsob přivedení registrovaného léku do organismu (namísto perorálně nebo intravenózně či intramuskulárně je provedena aplikace intratékálně), případně o použití v jiných indikacích mimo registraci (jako analgetikum). Ale uvědomme si, že intratékální či epidurální aplikace morfinu se používá od roku 1976, přičemž FDA byl pro akutní bolest schválen až v roce 1984 a pro chronickou bolest teprve v 1990 [30, 31].
Závěr
Analgetický efekt intratékálně podaného midazolamu je způsoben ovlivněním spinálních GABAA receptorů. Zdá se být vhodným doplňkem komplexní léčby u pacientů s chronickými bolestmi zad nebo s FBSS, kteří trpí nociceptivní nebo neuropatickou bolestí, u kterých spinální steroidy nepřinesly požadovaný efekt. Naše zkušenosti ukazují, že po jednorázovém intratékálním podání midazolamu lze po 2/3 aplikací poskytnout analgezii trvající 4 týdny a déle, výskyt nežádoucích účinků je minimální. Tento výsledek je konzistentní po celou dobu využívání této metody [1, 12, 32]. Otázka jeho neurotoxicity je nadále kontroverzní, proto též striktně doporučujeme používat midazolam bez konzervačních látek. Výhodou této terapeutické metody je jednorázová aplikace bez nutnosti použití jakýchkoli externích nebo implantovaných zařízení pro kontinuální podávání. Jedná se stále o metodu off‑label, avšak pouze široké využívání této metody ji může konvertovat na on‑label, stejně jako tomu bylo před mnoha lety v otázce opioidů.
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Tato práce je původní a nebyla publikována ani nabídnuta k publikaci v jiném médiu. Tyto výsledky byly průběžně publikovány na řadě národních nebo i mezinárodních akcích ve formě přednášek nebo posterů. Střet zájmů: Nikdo z autorů nemá střet zájmů v souvislosti s tématem sdělení. Podíl autorů: Všichni autoři text četli a souhlasili se zasláním do redakce časopisu Anesteziologie a intenzivní medicína. Spoluautoři A.H. i L.P. se na článku podíleli doplněním informací a korekturami výsledného textu. Financování: Žádné. Projednání etickou komisí: Etickou komisí projednáno, vzala na vědomí.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Procházka, Ph.D.
Jan.prochazka@kzcr.eu, Jan.prochazka@yahoo.com
Článek přijat redakcí: 24. 2. 2021;
Článek přijat k tisku: 18. 3. 2021;
Cit. zkr: Anest intenziv Med. 2021; 32(2): 94–98
Zdroje
1. Procházka J, Hejčl A, Procházková L. Intrathecal midazolam as supplementary analgesia for chronic lumbar pain – 15 years’experience. Pain Medicine 2011; 12 : 1309–1315.
2. Velentine JMJ, Lyons G, Bellamy MC. The effect of intrathecal midazolam on post‑operative pain. Eur J Anaesthesiol 1996; 13(6): 589–593.
3. Prakash S, Joshi N, Gogia AR, Prakash S, Singh R. Analgesic efficacy of two doses intrathecal midazolam with bupivacaine in patients undergoing cesarean delivery. Reg Anesth Pain Med 2006; 31(3): 221–226.
4. Shah FR, Halbe AR, Panchal ID, Goodchild CS. Improvement in postopereative pain relief by the addition of midazolam to an intrathecal injection of buprenorphine and bupivacaine. Eur J Anesthesiol 2003; 20(11): 904–910.
5. Bharti N, Madan R, Mohanty PR, Kaul HL. Intrathecal midazolam added to bupivacaine improves duration and quality of spinal anesthesia. Acta Anaesthesiol Scand 2003; 47(9): 1101–1105.
6. Duncan MA, Savage J, Tucker APOD. Prospective audit comparing intrathecal analgesia (incorporating midazolam) with epidural and intravenous analgesia after major open abdominal surgery. Anaesth Intensive Care 2007; 35(4): 558–562.
7. Yegin A, Sanli S, Dosemeci L, Kayacan L, Akbas M, Karsli B. The analgesic and sedative effect of midazolam in perianal surgery. Eur J Anesthesiol 2004; 21(8): 658–662.
8. Borg PAJ, Krijnen HJ. Long‑term intrathecal administration of midazolam and clonidine. Clin J Pain 1996; 12(1): 63–68.
9. Nishiyama T, Yokoyama T, Hanaoka K. Midazolam improves postoperative epidural analgesia with continuous infusion of local anaesthetics. Can J Anaesth 1998; 45(6): 551–555.
10. Naguib M, El Gammal M, Elhattab YS, Seraj M. Midazolam for caudal analgesia for childern: comparison with caudal bupivacaine. Can J Anaesth 1995; 42(9): 758–764.
11. Serrao JM, Marks RL, Morley SJ, Goodchild CS. Intrathecal midazolam for the treatment of chronic mechanical low back pain: A controlled comparison with epidural steroids in a pilot study. Pain 1992; 48(1): 5–12.
12. Procházka J. Descendentní GABA‑ergní inhibice v léčbě bolesti – je něco nového? Naše 20leté zkušenosti. Bolest 2017; 20(2): 80–88.
13. Deer TR, Pope JE, Hayek SM, Bux A, Buchser E, Eldabe S, et al. The Polyanalgesic Consensus Conference (PACC): Recommendations on intrathecal drug infusion systems best practices and guidelines. Neuromodulation 2017; 20(2): 96–132.
14. Saulino MF, Patel T, Fisher SP. The application of falure modes and effects analysis methodology to intrathecal drug delivery for pain management. Neuromodulation 2017; 20 : 177–186.
15. Yaksh TL, Fisher CJ, Hockman TM, Wiese AJ. Current and future issues in the development of spinal agents for the management of pain. Curr Neuropharmacol 2017; 15(2): 232–259.
16. McDowell GC, Pope JE. Intrathecal ziconotide: dosing and administration strategies in patients with refraktory chronic pain. Neromodulation 2016; 19 : 522–532.
17. Pope JE, Deer TR, Bruel BM, Falowski S. Clinical uses of intrathecal therapy and its placement in the pain care algorithm. Pain Practice 2016; 16(8): 1092–1106.
18. Emami A, Tepper J, Short B, Yaksh TL, Bendele AM, Ramani T, et al. Toxicology evaluation of drugs administered via uncommon routes: intranasal, intraocular, intrathecal/intraspinal and intra‑articular. Int J Toxicology 2017; 37(1): 4–27.
19. Wilson G, Rupp C, Wilson WW. The dangers of intrathecal medication. JAMA 1949 Jul 30; 40(13): 1076–1079.
20. Hodgson PS, Neal JM, Pollock JE, Liu SS. The neurotoxicity of drugs given intrathecally (spinal). Anesth Analg 1999; 88(4): 797–809.
21. Bottros MM, Christo PJ. Current perspectives on intrathecal drug delivery. J Pain Res 2014; 7 : 615–626.
22. Khoshfetrat M, Davarpanah S, Keykha A. Egffacacy of intrathecal midazolam on enhancing analgesic effect of fentanyl in patients undergoing lower limb surgery. Biomed Res Ther 2018; 5(10): 2726–2732.
23. Abdollahpour A, Azadi R, Bandari R, Mirmohammadkhani M. Effects of adding midazolam and sufentanil to intrathecal bupivacaine on analgesia quality and postoperative complications in elective cesarean section. Anesth Pain Med 2015; 5(4): e23565.
24. Boules ML, Botros JM. Comparative study between the effect of intrathecal midazolam versus intrathecal midazolam plus magnesium sulphate on the efficacy and duration of analgesia in patients undergoing cesarean section. Ain‑Shams J Anesthesiol 2015; 08 : 70–75.
25. Dodawad R, Sumalatha GB, Pandarpurkar S, Jajee P. Intrathecal midazolam as an adjuvant in pregnancy ‑ induced hypertensive patients undergoing an elective caesarean section: a clinical comparative study. Anesth Pain Med 2016; 6(5): e38550.
26. Francis C, Vitalis M, Thikra S. A randomised controlled trial comparing the effect of adjuvant intrathecal 2 mg midazolam to 20 micrograms fentanyl on postoperative pain for patients undergoing lower limb orthopaedic surgery under spinal anaesthesia. Afri Health Sci 2016; 16(1): 282–291.
27. Kishnani KL, Gupta A, Bansal A. Comparison of intrathecal bupivacaine and bupivacaine plus midazolam in spinal analgesia. Paripex Ind J Res 2019; 8(6): 19–22.
28. Schultz DM, Abd‑Elsayed A, Calodney A, Stromberg K, Weaver T, Spencer RJ. Targeted drug delivery for chronic nonmalignant pain: Longitudinal data from the product surveillance registry. Neuromodulation 2021; doi: 10.1111/ner.13353
29. Neuromodulation Product Performance – Summary of Data from the Medtronic Post‑market Registry. [on‑line]. Dostupné z: https://www.medtronic.com/us‑en/ healthcare‑professionals/ products/product‑performance/ neuromodulation‑product‑performance. html
30. Procházka J. Má off ‑ label léčba význam pro rozvoj léčebných postupů? Bolest 2005; 8 : 21–26.
31. Herold I. Neregistrované (off ‑ label) indikace registrovaných farmak v regionální anestezii. Regionální anestezie 1999; 4 : 27–30.
32. Procházka J. Intrathecal midazolam as an analgesic in chronic back pain. In: Duncan LT. Advances in Health and Disease. Nova Science Publishers, Inc., New York, 2019; 9 : 85–104. (ISBN 978-1-53614-793-3 eBook).
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2021 Číslo 2- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol a jeho pozice v léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Aceklofenak v léčbě muskuloskeletálních onemocnění – srovnání s dalšími NSAIDs z hlediska účinnosti a bezpečnosti
- Neodolpasse v léčbě pooperační bolesti
-
Všechny články tohoto čísla
- Point of care ultrazvuk u kritických stavů
-
Bartonellová endokarditida jako příčina akutního srdečního selhání
Význam rutinního echokardiografického vyšetření u akutního respiračního selhání na jednotkách intenzivní péče - Co vše skrývá krevní obraz
- Perioperační diabetes insipidus
- Konsenzuální stanovisko: Univerzální definice a klasifikace srdečního selhání
- Léčba pacientů s onemocněním COVID-19
- Načasování operace po infekci SARS COVID-19, mezinárodní kohortová studie
- K článku: Odmítnutí převzetí pacienta z přednemocniční péče cílovým poskytovatelem akutní lůžkové péče
- Odpověď
-
Vyjádření k některým mediálním ohlasům na Stanovisko ČSARIM 13/2020
Rozhodování u pacientů v intenzivní péči v situaci nedostatku vzácných zdrojů - Odpověď
- Zajímavosti, tipy a triky, informace z jiných oborů
- Neinvazivní a invazivní monitorace hemodynamiky na jednotce intenzivní péče
- Premiéra akreditovaného kurzu Simulace kritických stavů proběhla v Brně
- Zhodnocení implementace simulační výuky do specializačního vzdělávání lékařů před absolvováním základního kmene
-
Diabetická neuropatie:
rizikový faktor těžkého průběhu COVID-19? - Hemodynamické změny v pronační poloze – neinvazivní fyziologická studie
-
Sto devadesát let od objevu chloroformu –
historie inhalačních anestetik. Část 2 - Náš článek po 10 letech: Intrathecal midazolam as supplementary analgesia for chronic lumbar pain – 15 years’experience
- Umělá plicní ventilace zvyšuje riziko zhoršení kognitivních funkcí a poškození mozku
- Blokády kožních nervů a uspořádání fascií v oblasti stehna
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Načasování operace po infekci SARS COVID-19, mezinárodní kohortová studie
- Blokády kožních nervů a uspořádání fascií v oblasti stehna
- Neinvazivní a invazivní monitorace hemodynamiky na jednotce intenzivní péče
- Hemodynamické změny v pronační poloze – neinvazivní fyziologická studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



