-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fentanyl – 60 let od syntézy, historie opioidních analgetik
Fentanyl – 60 years since synthesis, history of opioid analgesics
The article presents discovery of opioid analgesics, their marketing, as well as notable names connected with this history.
Keywords:
history – opioids – pain therapy – opioid abuse.
Autoři: J. Málek
Působiště autorů: Komise pro historii ČSARIM ; Klinika anesteziologie a resuscitace 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha
Vyšlo v časopise: Anest. intenziv. Med., 31, 2020, č. 5, s. 217-224
Kategorie: Přehledové články
Souhrn
Článek podává přehled objevů opioidních analgetik, jejich uvádění na trh a osoby, které se do této historie významně zapsaly.
Klíčová slova:
historie – opioidy – léčba bolesti – zneužití opioidů.
Opioidy
Prvá opioidní analgetika byly přírodní alkaloidy. Název této skupiny léků se v průběhu let měnil, například v anglické literatuře jsou označovány za narkotika, narkoanalgetika a podobně. Název opiáty a opioidy pochází z označení produktu mléčnic nezralých makovic – řecky opium – šťáva. Později došlo k rozdělení skupiny na opiáty – produkty získávané z opia (především morfin a kodein) a opioidy – látky podobné, ale semisyntetické či syntetické. Později všechny látky působící přes endogenní opioidní receptory dostaly jednotný název opioidy [1].
Opium
Opium bylo užíváno už v předhistorických časech. Z mnoha druhů máku poskytuje morfin ve významném množství jen mák setý (Papaver somniferum) a v malém množství mák listenatý (Papaver bracteatum), který obsahuje především thebain využitelný k výrobě kodeinu [2]. Je zajímavé, že podle většinového názoru je mák setý rostlinou výhradně pěstovanou, která neroste planě, pouze občas zplaňuje [3]. Předpokládá se, že mohl vzniknout z divokého máku štětinkatého (Papaver setigerum, Papaver somniferum subsp. setigerum) [1, 3], jenž roste ve Středozemí. Podle jiné teorie se však mák setý vyvinul jako samostatný druh již ve třetihorách. Jisté však je, že mák byl pěstován na území Evropy už v mladší době kamenné, což dokazují nálezy jeho semen na sídlištích z této doby např. ve Švýcarsku, severní Itálii, Francii či na jihu Německa. Nejstarší doklad pochází ze starého Sumeru před 5 000 lety, kde byl označen jako „rostlina štěstí“ [1]. Opium znali i staří Egypťané, zbytky opia byly nalezeny v hrobce z 15. století před naším letopočtem, Ebersův papyrus doporučoval směs obsahující opium k sedaci dětí a bohyně Isis jím konejšila syna Hóra. Egypťané mohli opium získávat od starých Řeků, protože ho nazývali Thébským opiem (odtud je také jeden z alkaloidů nazván thebain) [1]. Opium nebylo v té době používáno pravděpodobně jako analgetikum, ale jako sedativum a hypnotikum [4]. Bohyně Démétér tišila opiem žal po únosu své dcery Persephony. Jako prostředek k tišení bolesti byl využit pravděpodobně až Římany. Zmiňuje se o něm Celsius i Galén, který varuje před nežádoucími účinky. Po pádu Říma nebylo opium zapomenuto a je například v seznamu látek pro výrobu směsi pro uspávací houbu (spongia somnifera) [5]. Mezi mnoha recepty je asi nejslavnější „laudanum“ Thomase Sydenhama (1624–1689). Sydenhamův recept popsaný v návodu na léčbu dyzenterie v r. 1669 obsahoval 1 libru sherry, 2 unce opia, 1 unci šafránu, 1 unci mleté skořice a 1 unci mletého hřebíčku [5]. V 18. a 19. století bylo opium součástí řady dalších receptů: „Kvakerské (Lancasterské) černé kapky“ byly asi třikrát silnější než laudanum a obsahovaly opium, šťávu z kyselých nezralých hroznů, muškátový oříšek, šafrán a kvasnice. Anglický lékař a bukanýr Thomas Dover (1660–1742), který je znám i tím, že zachránil Alexandra Selkirka (Robinsona Crusoe) z ostrovů Juana Fernandéze v r. 1709, vyráběl prášek, který „zbaví člověka bolesti do 2 až 3 hodin“. Ten obsahoval opium, salnitr, kyselinu vinnou, lékořici a ipecacuanu [5].
Použití opia k pooperační analgezii popsal v r. 1784 londýnský chirurg James Moore (1763–1834), i když uvedl, že nijak nezmírní utrpení během vlastní operace [5].
Běžná dostupnost opia i morfinu vedla k jeho masovému rozšíření i pro rekreační účely (obr. 1–3). Je dokumentováno, že legendy Divokého západu, jako například „Divoký“ Bill Hickock, preferovali opium před alkoholem a kovbojové, místo aby leželi na zádech po nadměrném popíjení whisky v salloonech, trávili volný čas v pronační poloze s opiovou dýmkou u asijských prostitutek [6]. To vedlo jednak k zákazu volného prodeje, jednak k hledání látek, které by při stejné či lepší analgetické účinnosti měly minimální riziko vzniku závislosti a zneužívání.
Obr. 1. Opium kouřící Američané v New Yorku. Zdroj: Wikimedia Commons (CC BY 4.0) 
Obr. 2. Francouzské opiové doupě. Zdroj: Wikimedia Commons (CC BY 4.0) 
Obr. 3. Vybavení kuřárny opia (USA). Zdroj: Wikimedia Commons (CC BY 4.0) 
Morfin
O izolaci aktivní látky z opia se pokoušel začátkem 19. století německý lékárník Friedrich Sertürner (1783–1841). V roce 1805 objevil látku pojmenovanou mekonová kyselina, která ale v pokuse na psech neúčinkovala. Jeho dalším objevem byla krystalická látka rozpustná ve vodě s mírně alkalickým pH, kterou nazval „principium somniferum“, která skutečně obsahovala účinnou substanci [5]. Později ji nazval „morphium“ podle řeckého boha snění. Větší pozornosti se dostalo až jeho druhé publikaci z r. 1817, která byla přeložena do francouzštiny. Slavný chemik a fyzik Joseph Louis Gay-Lussac pak navrhl látku přejmenovat na morfin. Sertürnerova metoda poskytovala morfin acetát, ale tento proces byl náročný a drahý. V r. 1831 objevil William Gregory, lékař a chemik z Edinburghu, lacinější metodu. Morfin však měl málo předností před opiem do té doby, než byla k dispozici injekční jehla a stříkačka. Prvou injekční jehlu pro parenterální (podkožní) podání pravděpodobně vyrobil Francis Rynd v Dublinu v r. 1844 a prvá aplikace v r. 1853 je připisována Alexandru Woodovi z Edinburghu, který podal tímto způsobem pacientům morfin [7]. Prvé dokumentované subkutánní podání morfinu pro pooperační bolest provedl James Paget (1814–1899) v r. 1863 po amputaci dolní končetiny v chloroformové anestezii. Dvacet mg vedlo po probuzení „k úlevě od bolesti a osvobozujícímu spánku“ [5].
Kodein
Na rozdíl od morfinu a dalších látek je literatury o objevu kodeinu podstatně méně. Jde o další alkaloid, který byl izolován ze surového opia francouzským chemikem, Pierre-Jeanem Robiquetem (1780–1840), v r. 1832. Ten ho též pojmenoval kodein, z řeckého kódeia, makovice [8]. Téhož roku ho začala vyrábět chemická továrna Merck, založená v r. 1827 k výrobě morfinu a dalších látek. V současnosti se vyrábí O-metylací z morfinu. Dalšími analgetiky odvozenými od kodeinu je dihydrokodein syntetizovaný v Německu v r. 1908 a uvedený na trh v r. 1911 a hydrokodon připravený v r. 1920 Karl Mannichem a Helenou Löwenheimovou. Obě látky byly rovněž zneužívány k rekreačním účelům, mezi nejznámější osoby patří Hermann Göring, který konzumoval až 100 tablet (3 g) dihydrokodeinu denně a při zatčení Spojenci měl v kufříku více než 20 000 tablet, což mohlo představovat významnou část roční, resp. i světové produkce této látky vyráběné tou dobou pouze v Německu (kromě toho zneužíval i morfin a oxykodon) [9].
Heroin
Poprvé heroin syntetizoval v roce 1874 C. R. Alder Wright, britský chemik pracující v londýnské St. Mary’s Hospital Medical School [10]. Hledal náhražku morfinu, která by měla jeho analgetickou potenci bez vedlejších účinků. Několik hodin vařil morfin s různými kyselinami a získal tím silněji působící acetylovanou formu morfinu, kterou dnes nazýváme diacetylmorfin. Alder poslal svou substanci na analýzu do Manchesteru F.M. Piercovi. Pierce si zapsal do svého deníku, jak probíhaly pokusy. „Píchli jsme substanci mladým psům a králíkům. Byl pozorován velký úpadek, strach a nespavost. Oči byly citlivé, zorničky zúžené. U psů bylo pozorováno silné slinění“ [10, 11]. Ani Alder, ani Pierce ale s chemikálií nezískali pozornost žádného výrobce léčiv, a tak se dále syntéze heroinu nevěnovali. Látka upadla téměř v zapomnění, až se výzkumu ujal v roce 1897 Felix Hoffmann z německé farmaceutické společnosti Bayer v Elberfeldu, a to údajně 11 dní poté, co objevil aspirin [10]. Použil podobnou metodu úpravy morfinu, jako dříve u kyseliny salicylové, což výrobu diacetylmorfinu výrazně zjednodušilo. Vedoucím laboratoří firmy Bayer byl profesor Dreser, který primárně rozhodoval o tom, která látka je vhodná pro komerční využití. Je známo, že zatímco Dreser acylpyrin zprvu odmítnul jako látku obecně neužitečnou a navíc s možnou kardiotoxicitou, diacetylmorfin nadšeně přivítal z hlediska jeho obchodního potenciálu [6, 11, 12]. Veřejnost urgentně potřebovala nový lék především na potlačení kašle, který sužoval mnoho lidí v důsledku bronchitid, tuberkulózy, astmatu a pneumonie. Diacetylmorfin byl pojmenován podle německého výrazu pro hrdinský – heroisch. To byl pocit, který měli zaměstnanci Bayerovy továrny, když se na nich nový preparát testoval [10, 12]. Heroin byl považován za všelék, podobně jako před ním opium a morfin, pouze s tím rozdílem, že nebyl považován za návykový. Bayer již následující rok dodal na trh tunu heroinu a exportoval ho do 23 zemí. Již v listopadu 1898 látku prezentoval na kongresu německých přírodovědců a lékařů jako přípravek desetkrát účinnější proti kašli než kodein, ale pouze s jednou desetinou jeho toxicity, navíc lepší analgetikum než morfin, bezpečný a nenávykový – prostě zázračný lék. Ohlasy byly veskrze pozitivní a Bayer začal rozesílat tisíce bezplatných vzorků lékařům v Evropě i USA. V roce 1899 již byla vyrobena tuna heroinu ve formě pastilek, lízátek, elixíru i ve vodě rozpustného prášku (obr. 4) [10].
Obr. 4. Reklama na antitusikum s heroinem. Zdroj: Wikimedia Commons (CC BY 4.0) 
Heroin byl nabízen jako ideální odvykací látka, zejména po omezení dostupnosti opia a morfinu v USA v roce 1911. Byl skutečně vysoce účinný. Kdo ho začal užívat, neměl zájem se k morfinu vracet. Volně prodejné byly soupravy obsahující injekční jehlu, stříkačku a ampulku s heroinem. Firma Bayer měla obrovské zisky, ale již za několik let se prokázalo, že závislost na morfinu je nahrazena závislostí na heroinu, byla publikována řada odstrašujících příkladů zneužívání (obr. 5) a objevovaly se snahy o legislativní kontrolu široké dostupnosti opioidních látek. V USA byl heroin omezen již v roce 1914 a v r. 1924 zakázán zcela. První mezinárodní konvence týkající se obchodu s drogami byly podepsány v roce 1912 na konferenci v Haagu, další národní limity byly realizovány během 1. světové války a konečně se staly součástí podpisu mírové smlouvy ve Versailles v roce 1919. Bayer ukončil výrobu heroinu již v r. 1913 [10].
Obr. 5. Obrázek varující před injekčním zneužíváním morfinu – následky podkožních injekcí. Zdroj: Wikimedia Commons (CC BY 4.0) 
Oxykodon
Syntézu oxykodonu z thebainu popsali němečtí chemici Martin Freund a Edmund Speyer z univerzity ve Frankfurtu v r. 1916. Prvé klinické využití je z r. 1917, v r. 1919 byl uveden na trh pod názvem Eukodal. Oxykodon byl jednou ze součástí populárního léku uvedeného na trh firmou E. Merck v r. 1928 pod názvem SEE (skopolamin, efedrin a oxykodon, zvaný též eukodal), který byl považován za jeden ze zázračných léků 30. let. SEE byl velmi oblíbený v Německu, Střední Evropě a Skandinávii pro tzv. „bazální narkózu“, tj. jako velmi silnou premedikaci usnadňující úvod do éterové anestezie [13]. Jméno bylo změněno v r. 1942 na Scophedal (SCOpolamine, ePHEDrine and eukodAL). Preparát byl jistou dobu hlavním analgetikem Wehrmachtu během 2. světové války, protože podle propagačního letáku poskytoval „velmi hlubokou analgezii a významnou a intenzivní euforii“, což bylo na bitevním poli významným přínosem [14]. Injekce oxykodonu, Scophedalu, petidinu a též morfinu dostával pravidelně i Adolf Hitler [14]. Scophedal byl vyráběn v malém množství ještě po válce až do r. 1987, zatímco oxykodon se stal jedním z nejpoužívanějších opioidů v léčbě akutní i chronické bolesti. K premedikaci dětí byl v Československu využívaný kombinovaný preparát Benarcos (chráněná známka od r. 1942), který obsahoval vedle oxykodonu také skopolamin a efedrin. Byly dostupné také čípky, které obsahovaly oxykodon, skopolamin, efedrin a alkaloid spartein.
Hydromorfon
Hydromorfon je odvozený od morfinu, od kterého se liší přítomností 6-keto skupiny a hydrogenací dvojné vazby na 7. a 8. pozici v molekule morfinu. Syntetizován byl v Německu v r. 1921 a do klinické praxe byl uveden v r. 1926 [15]. Dlouho byl považován ve vztahu k morfinu za druhořadý preparát, až s poznáním vzniku tolerance a nutnosti rotace opioidů zejména při léčbě chronické bolesti nabyl na významu. V ČR je dostupný v tabletách s řízeným uvolňováním.
Petidin
Firma Hoechst se již koncem 19. století soustředila na syntetická antipyretika a analgetika (fenazon – Antipyrin 1884, aminofenazon – Pyramidon 1897 a metamizol/dipyron – Novalgin 1921). Koncem 20. let 20. století se výzkum firmy soustředil na hledání analgetik se spasmolytickými účinky a jejich prvním úspěchem byla syntéza petidinu (1-methyl-4-phenyl-4-carbaethoxypiperidinu) v r. 1937 (Otto Eisleb), který byl původně testován jako anticholinergikum, náhrada za atropin, a teprve Otto Schaumann z téže firmy objevil jeho analgetické účinky [16, 17]. Usilovný výzkum nových léků byl důsledkem snahy Adolfa Hitlera dosáhnout nezávislosti země na dovozu v rámci tak zvaného čtyřletého plánu z r. 1936 [16]. To se týkalo i nezávislosti na dovozu opia nutného k výrobě morfinu. V roce 1939 byl petidin uveden na trh pod názvem Dolantin. Jde o první syntetický opioid se strukturou odlišnou od morfinu, má vlastnosti analgetické, anticholinergní a lokálně anestetické [17]. Látka získala až nekritickou popularitu [18] a její produkce stoupala. Na vrcholu války v r. 1944 roční dodávka petidinu dosáhla 1 600 kg [16]. V současnosti je petidin považován za látku obsoletní.
Metadon
Metadon byl syntetizován mezi mnoha dalšími sloučeninami v r. 1939 v Německu v laboratořích koncernu IG Farben, dceřiné společnosti firmy Hoechst s cílem dosáhnout nezávislosti na dovozu (viz petidin). Mezi novými sloučeninami byla i látka s firemním názvem Va 10520 [19]. Vzhledem k množství nově syntetizovaných přípravků se dostala na testy až v r. 1942 pod názvem Amidon. Protože Hoechst se soustředil především na dodávky petidinu, nebyl Amidon během 2. světové války pravděpodobně jako analgetikum nikdy používán. Mýty o tom, že získal název Dolofin či dokonce Adolfin jako poctu Adolfu Hitlerovi jsou jen fámou. Název Dolofin získal metadon až v USA v 70. letech [16].
Po válce byly všechny německé patenty a obchodní názvy zabaveny. Záznamy z výzkumu v IG Farbenkonzern a Hoechst byly konfiskovány U. S. Department of Commerce Intelligence a přivezeny do USA. Teprve v r. 1947 získal Amidon generické jméno metadon. Protože patentová práva německých firem zanikla, byly výsledky dostupné za 1 dolar všem, kdo by je chtěli komerčně využít. Nejprve začala metadon vyrábět v r. 1947 americká firma Eli-Lilly pod názvem Dolophine (od latinského dolor – bolest a finis – konec). Připojily se pak další firmy, v Německu ho začala firma Hoechst AG vyrábět až v r. 1949 pod názvem Polamidon [16, 19].
Další méně známé opioidy před objevem fentanylu
Prodin (firemní název Nisentil) je analog petidinu, který byl syntetizovaný ve 40. letech v Německu. Trans-forma prodinu má dva isomery: alfaprodin a betaprodin. Alfaprodin je asi pětkrát méně účinný než betaprodin, ale má delší trvání účinku a méně nežádoucích účinků. Je podobně účinný jako petidin, má ale rychlejší nástup i odeznění účinku a nemá na rozdíl od petidinu toxické metabolity [20].
Ketobemidon, podobně jako řada dalších léků, byl syntetizován v Německu v laboratořích IG Farben a Hoechst v r. 1942 Eislebem a kol. Prvé studie na lidech byly prováděny v r. 1946 a záhy poté byl uveden do klinické praxe pod názvy Ketogan, Ketorax a Ketodur (Pfizer). Kromě působení na mí opioidních receptorech působí jako antagonista na NMDA receptorech. Je dostupný ve skandinávských zemích [21].
Desmetylprodin byl syntetizován v r. 1947 Albertem Zieringem a Johnem Lee v Hoffman – LaRoche Laboratories, s cílem najít analgetikum, které by bylo méně návykové než morfin. Látka nebyla lepší než petidin, proto se firemně nevyráběla, ale vzešlo z ní další analgetikum – prodin [22].
Fenadoxon patří mezi další opioidy příbuzné metadonu pocházející z firmy Hoechst v Německu. Byl objeven v r. 1947 a používán zhruba 20 let, pak zmizel z trhu [23].
Trimeperidin (Promedol) byl vyvinut v SSSR v 50. letech při výzkumu možných analogů petidinu. Je ve srovnání s morfinem asi dvakrát méně účinný [24]. Využívá se například v porodnictví a neonatologii [25].
Levorfanol (Levo-Dromoran, Valeant Pharmaceuticals International) je považován za „zapomenutý opioid“. Byl poprvé syntetizován jako racemická směs levorfanu a dextrorfanu v r. 1949 pod názvem D,L -metofinan [26]. Zatímco L (levotočivý) enantiomer měl analgetické vlastnosti, R enantiomer působil jako antagonista na NMDA receptoru a měl antitusické účinky. Levorfanol měl dlouhodobý účinek (terminální eliminační poločas 11–16 hodin byl v té době překonaný jen metadonem) a pozoruhodné vlastnosti: působil jako agonista na mí, kappa1, kappa2 a delta opioidním receptoru, antagonista na NMDA receptoru a blokoval zpětné vstřebávání serotoninu i noradrenalinu. Eliminace byla nezávislá na cytochromu P450 a metabolit je farmakologicky inaktivní a vylučován močí. Navíc je dobře vstřebáván po orálním podání, dávka je asi dvojnásobná oproti i.v. aplikaci. V USA se dostal do klinického užívání v r. 1956, ale s rozvojem dlouhodobě účinných forem jiných opioidů upadl částečně v zapomnění [26].
Dextromoramid byl objeven v r. 1956 Dr. Paulem Janssenem (1926 – 2003), belgickým lékařem, zakladatelem firmy Janssen Pharmaceuticals (obr. 6). Vyvolává silnou euforii a je vysoce návykový [27]. Vyrábí se pod firemním názvem Palfium, dostupný je pravděpodobně pouze v Nizozemsku.
Obr. 6. Paul Janssen (archiv firmy Janssen, použito se svolením) 
Buprenorfin
Buprenorfin byl objeven po 10letém úsilí modifikací molekuly thebainu v r. 1966 ve společnosti Reckitt a Colman v Anglii s nadějí, že „opioid tak složitý a komplexní oproti morfinu si selektivně zachová své žádoucí účinky, zatímco se zbaví účinků nežádoucích“ [28]. Klinické pokusy začaly v r. 1972, v r. 1978 začal být používán injekčně k potlačení silné bolesti a v r. 1982 bylo schváleno sublinguální použití. V současnosti je v ČR registrován pro substituční léčbu osob závislých na opioidech, čímž se částečně naplnila idea jeho tvůrců.
Fentanyl
Dr. Janssen se při hledání nového analgetika, které by mělo být účinnější a mít méně nežádoucích účinků, zaměřil na analogy petidinu, který měl jednodušší molekulu než morfin (obr. 7 a 8).
Obr. 7. Syntéza fentanylu. Zdroj: Wikimedia Commons (CC BY 4.0) 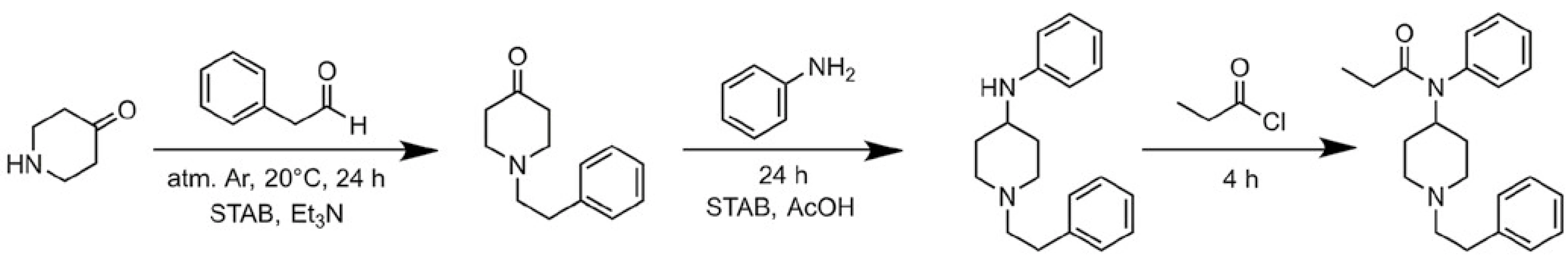
Obr. 8. Syntetické opioidy (podle Aktories K, Förstermann U, Hofmann F, Starke K. Allgemeine und spezielle Pharmakologie und Toxikologie. 11. Auflage, München 2013: 211). Zdroj: Wikimedia Commons (CC BY 4.0) 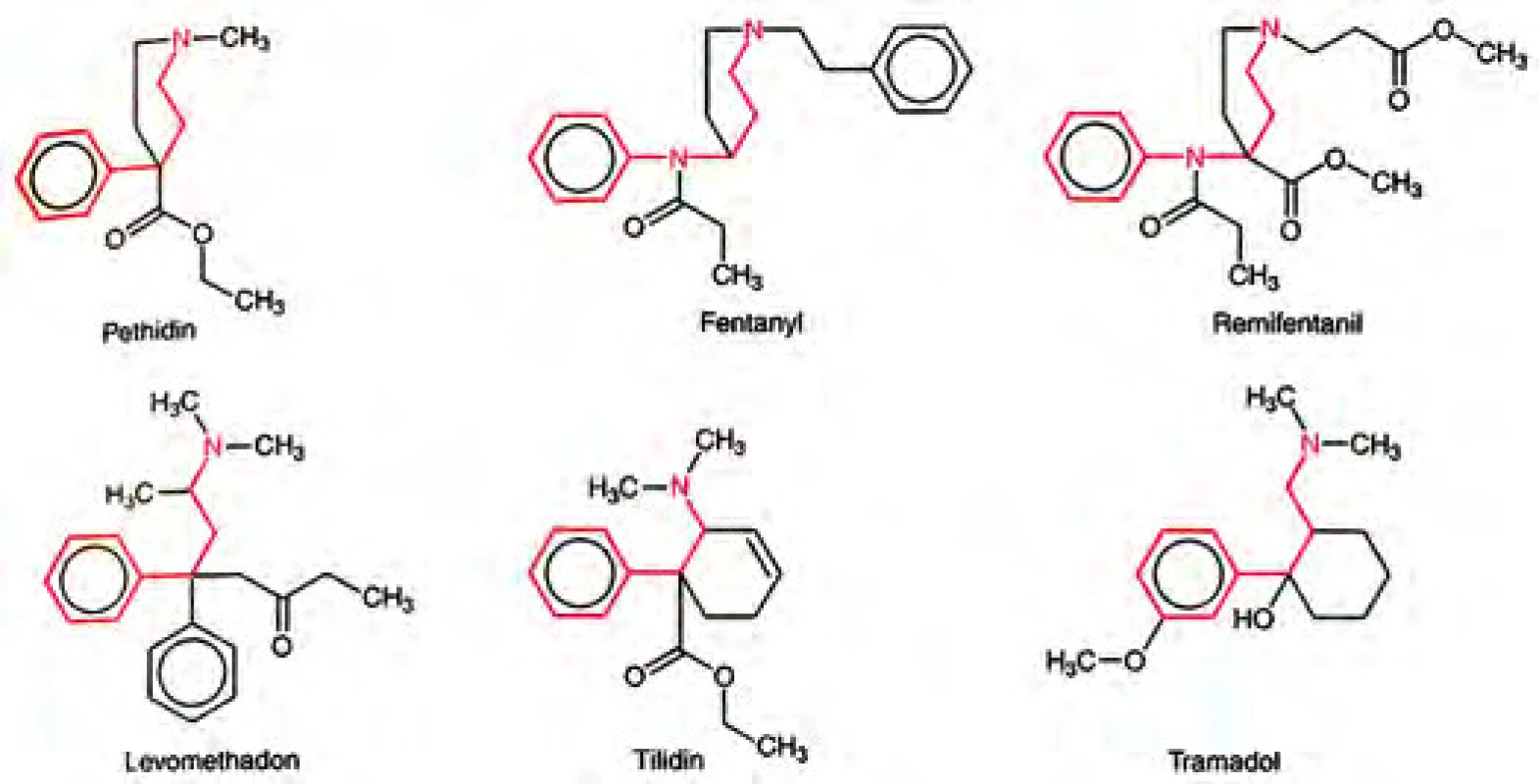
Vycházel z toho, že hlavní část molekuly, která je zodpovědná za analgetickou účinnost je piperidinový kruh (opioidní receptory tou dobou nebyly ještě známy) a z toho, že čím je molekula lipofilnější, tím bude lépe pronikat do CNS [29]. Mezi roky 1953–1957 bylo připraveno mnoho nových molekul k testování. Paul Janssen vycházel z postupu syntézy co největšího počtu nových molekul a testování nejjednodušším způsobem. Tímto postupem například v r. 1958 vzniklo velice úspěšné neuroleptikum – haloperidol [30]. Prvým úspěšným analgetikem byl fenoperidin v r. 1957, který byl vyráběn pod názvy Operidine a Lealgin a používán v mnoha zemích. Ve své době to byl nejpotentnější opioid: více než 50× účinnější než petidin a 25× než morfin [29]. Janssen pokračoval ve vývoji dalších molekul a v r. 1960 byl syntetizován fentanyl, který byl ještě účinnější, v pokusu na zvířeti 100–200× ve srovnání s morfinem. Do širokého klinického využití se v Evropě dostal v r. 1963, v USA až v r. 1968. Potentní účinek fentanylu byl využíván k různým anestetickým technikám. Kombinace s butyrofenonem droperidolem, vyrobeným opět ve firmě Janssen Pharmaceutica v r. 1961 (neuroleptanalgezie), případně ještě s oxidem dusným (neuroleptanestezie), byla jistou dobu oblíbenou náhradou potentních inhalačních anestetik [29, 31, 32]. V kardioanestezii byla populární metoda čisté opiátové anestezie (HDM – high dose morphine anaesthesia), poprvé publikována v New England Journal of Medicine v r. 1969. Megadávky morfinu bez inhalačních anestetik zachovávaly činnost myokardu při operacích chlopní. Dlouhodobý účinek morfinu a riziko histaminogenního účinku vedlo k hledání jiné ideální látky, kterou se v randomizované studii v r. 1978 stal fentanyl [32]. Nevýhodou metody byly případy bdělosti během operace. Pozdější studie prokázaly, že neexistuje ideální způsob anestezie a metoda byla opuštěna. V Belgii anesteziolog George (Jorge) de Castro byl propagátorem bezstresové analgezie (stress-free anaesthesia). Podával fentanyl v dávkách až 50 µg/kg s ventilací čistým kyslíkem pacientům při cholecystektomii, resekci žaludku a dalších operacích v dutině břišní. Pacienti sice neměli periody bdělosti během operace, ale často po ní museli být ventilováni několik hodin [29]. V 80. letech začal být fentanyl používán intrathekálně a zvyšující se spotřeba vedla firmu Janssen a později i další firmy jednak k vývoji dalších opioidů, jednak k vývoji dalších forem podání. Jedním z významných výzkumníků byl prof. Theodor H. Stanley (obr. 9), který se podílel na výzkumu netradičních způsobů podávání opioidů, jednak na výzkumu ultrapotentních opioidů (viz dále).
Obr. 9. prof. T. Stanley během pražské návštěvy u doc. L. Hesse (foto doc. MUDr. L. Hess, DrSc., publikováno se svolením) 
Po ukončení patentové ochrany v r. 1980 se spotřeba fentanylu zvýšila desetkrát [29, 31]. Bylo to dáno jednak jeho snadnou výrobou, jednak zvýšeným používáním v kardioanestezii. S cílem získat pro trh další nové léky vznikly ve firmě Janssen Pharmaceutica sufentanil (1974), alfentanil (1976) a ultrapotentní carfentanil (1974), používaný ve veterinární medicíně, případně ve fromě aerosolu pro imobilizaci [31]. Jedno z nejznámějších pravděpodobných použití carfentanilu je při protiteroristické akci v Moskvě v r. 2011 a při osvobozování rukojmí zajatých čečenskými separatisty v divadle Dubrovka v r. 2002 (pravděpodobně směsí carfentanilu a remifentanilu) [33, 34]. Modifikací fentanylu se ujaly i další firmy a výsledkem byly další ultrapotentní opioidy pro použití v imobilizaci a anestezii zvířat, při výzkumu receptorů nebo jako designerské drogy: thiafentanil (1984), lofentanil (2006) a řada dalších. Celkem bylo publikováno více, než 1 400 modifikací fentanylové molekuly, z nichž více než 90 lze najít ve volně dostupné literatuře [35, 36]. Nejpotentnější komerčně vyráběné opioidy, carfentanil a etorfin, jsou 10 000–20 000×, resp. 2 000–10 000× účinnější než morfin a jsou určeny k imobilizaci velkých zvířat [34]. Etorfin byl vyrobený v r. 1963 Bentleyem a Hardym v McFarlan-Smith and Co (Blane et al., 1967) [37]. Jeho molekula je odvozena od oripavinu, což je metabolit thebainu, a hlavním zdrojem jsou stébla makovic. Poslední klinicky používaný derivát fentanylu – ultrakrátce působící remifentanil – vyrobila skupina vědců firmy Glaxo v r. 1991 [38].
Mezitím pokračovaly studie s jinými aplikačními formami fentanylu. Úspěch transdermální formy skopolaminu přesvědčil malou firmu Alze Corporation v Severní Karolíně k výrobě transdermální formy fentanylu, později nazvané Duragesic (v ČR Durogesic, obr. 10). Vzhledem k potížím s proniknutím na trh se firma spojila s Janssen Company, tou dobou již částí firmy Johnson and Johnson, a transdermální fentanyl byl od poloviny 90. let jedním z nejúspěšnějších preparátů na léčbu bolesti u onkologického onemocnění [29]. Další pokusy o transdermální aplikaci pomocí iontoforézy (obr. 11) již takové popularity nedosáhly. T. H. Stanley v 80. letech na žádost Dr. Janssena studoval různé aplikační formy carfentanilu u zvířat (hlodavci, psi, fretky, opice). Při experimentu s poslední skupinou asistující veterinář navrhl, že by se carfentanil mohl opicím, které se jinak zuřivě s úzkostí bránily při imobilizaci v kleci, dát carfentanil do kostky cukru, kterou milují.
Obr. 10. Transdermální forma fentanylu. Zdroj: Wikimedia Commons (CC BY 4.0) 
Obr. 11. Pacientem kontrolovaný iontoforetický dávkovač fentanylu pro pooperační analgezii. Autor KSTA/Klaus Daub (použito se svolením) 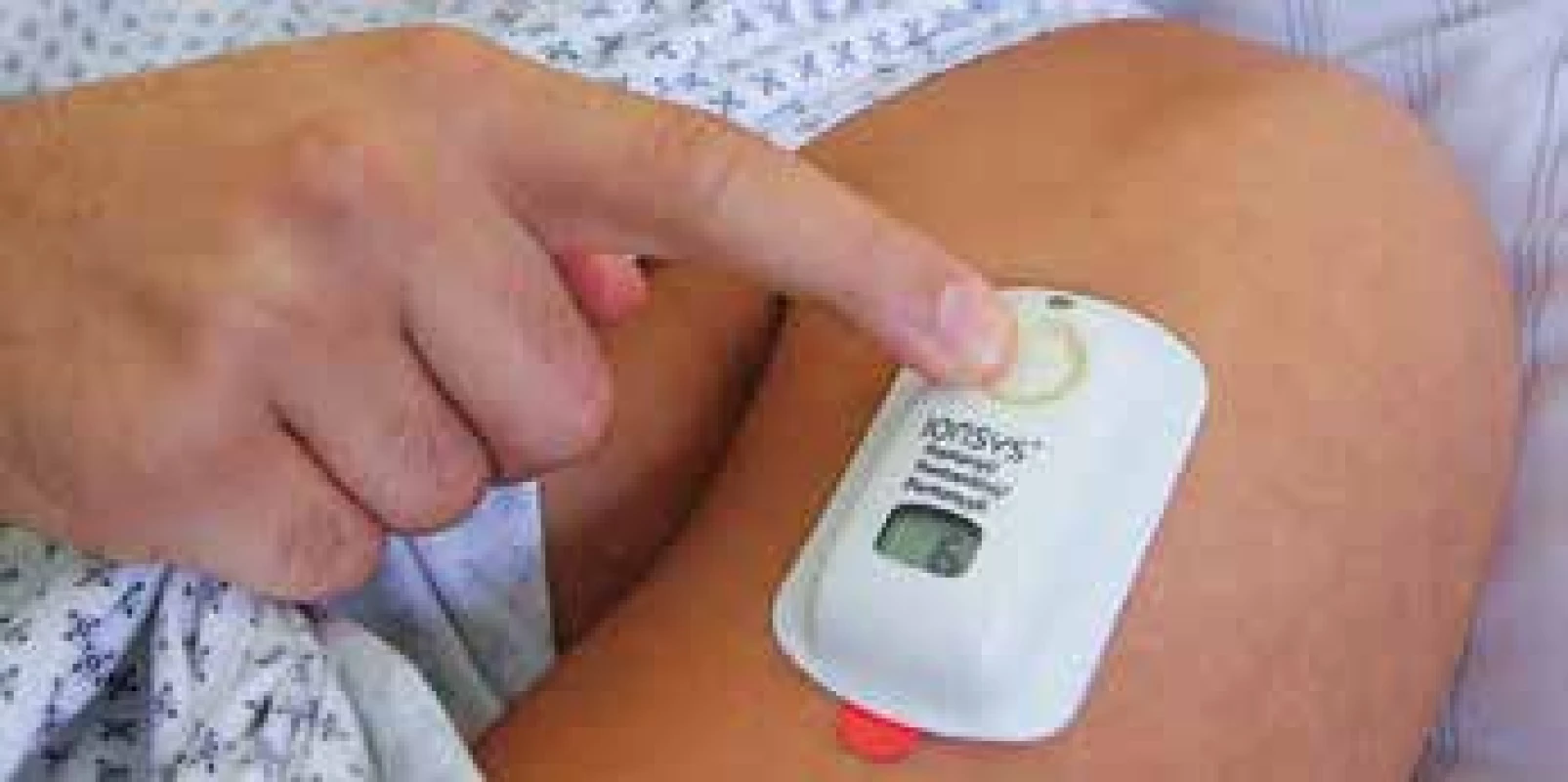
Pokusná zvířata dostala cukr s různou dávkou carfentanilu a účinek se projevil do 3–4 minut poté, co se jim cukr v ústech rozpustil. Velká dávka vedla ke kompletní imobilizaci, malá ke ztrátě agresivity – opice se nechaly vodit za horní končetiny po laboratoři (obr. 12) [29].
Obr. 12. Ztráta agresivity u makaka (archiv prof. Stanleyho, použito se svolením) 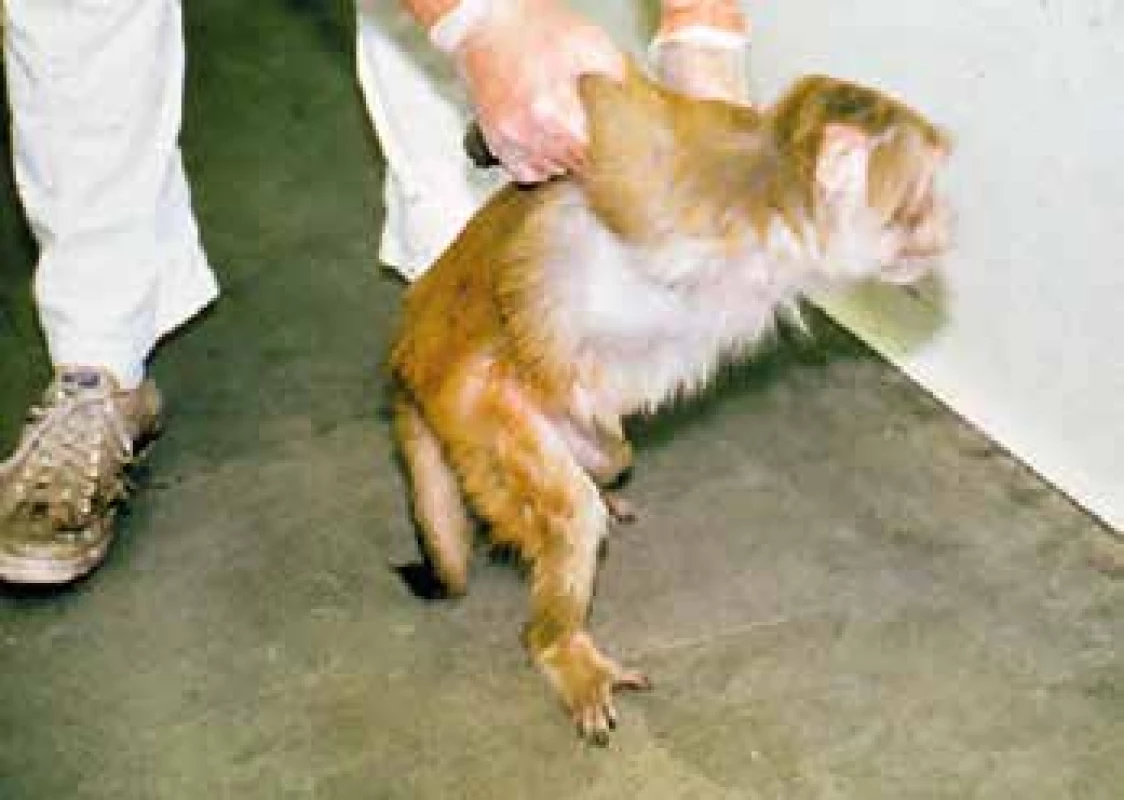
Výsledkem byl nápad využít lízátko s fentanylem k premedikaci před operací. V r. 1984 vznikl Oralet (obr. 13), který začala distribuovat firma Anesta v r. 1993, ale klinický úspěch nebyl příliš velký, proto se po změně designu Oralet změnil na Actic, který byl určen na průlomovou bolest pacientů s onkologickým onemocněním s již zavedenou léčbou opioidy [29] (obr. 14). To vedlo k významnému zvýšení prodeje a přimělo hledat další možnosti transmukózních forem fentanylu bez použití cukru jako nosiče.
Obr. 13. Fentanylové lízátko (archiv prof. Stanleyho, použito se svolením) 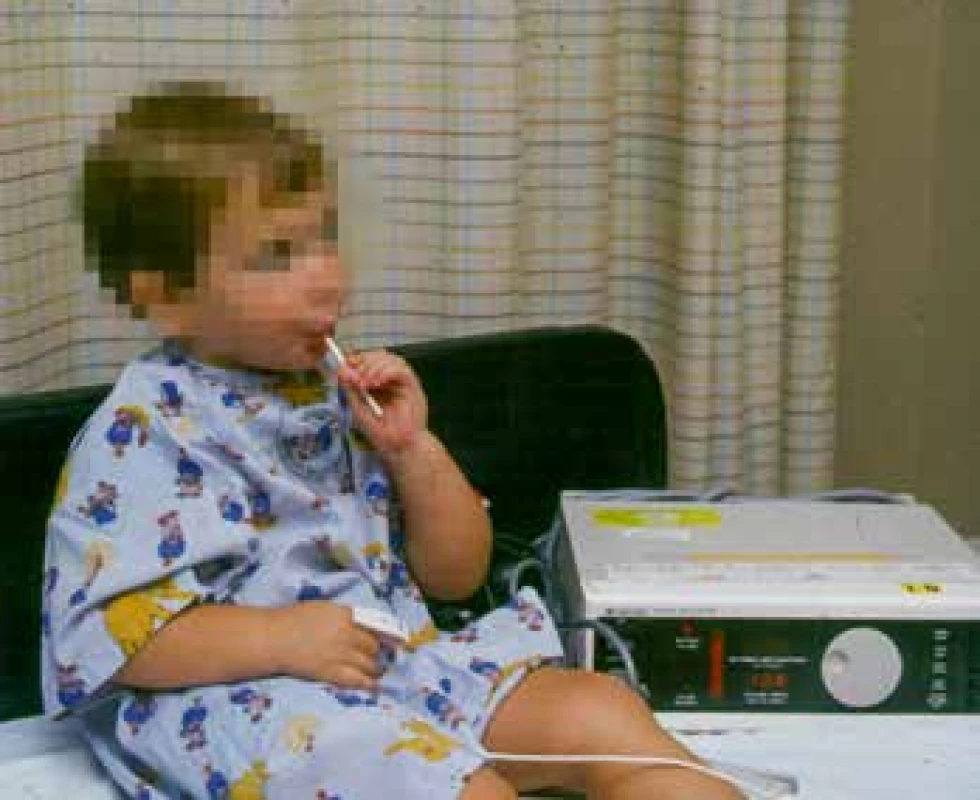
Obr. 14. Orální transmukózní fentanyl Actic pro onkologické pacienty. Zdroj: Wikimedia Commons (CC BY 4.0) 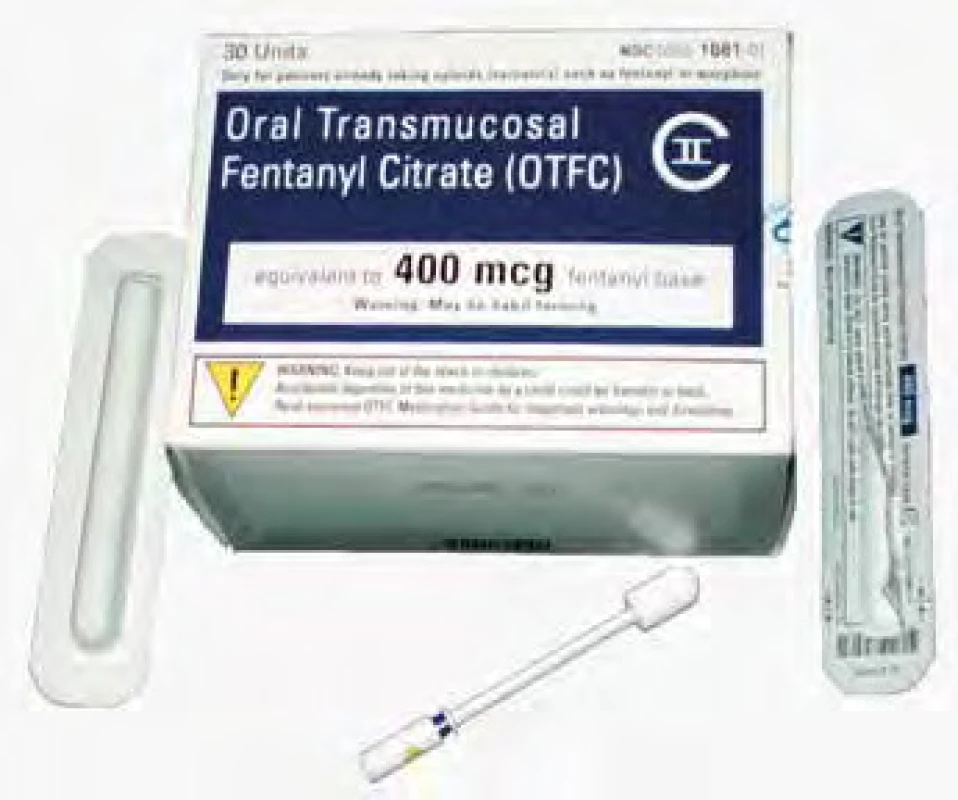
Od té doby se řada firem věnuje výrobě a vývoji sublinguálních, nazálních a bukálních forem aplikace fentanylu, v poslední době i sufentanilu. V roce 2018 americký úřad FDA schválil jednorázový aplikátor obsahující jednu sublinguální tabletu sufentanilu (DSUVIA) [39]. Temnou stránkou fentanylu je zvyšující se riziko jeho zneužívání. Především ve Spojených státech amerických jsou syntetické opioidy, a to především fentanyl, příčinou úmrtí při zneužívání (obr. 15).
Obr. 15. Úmrtí v USA způsobená syntetickými opioidy, převážně fentany‑ lem. Zdroj: Wikimedia Commons (CC BY 4.0) 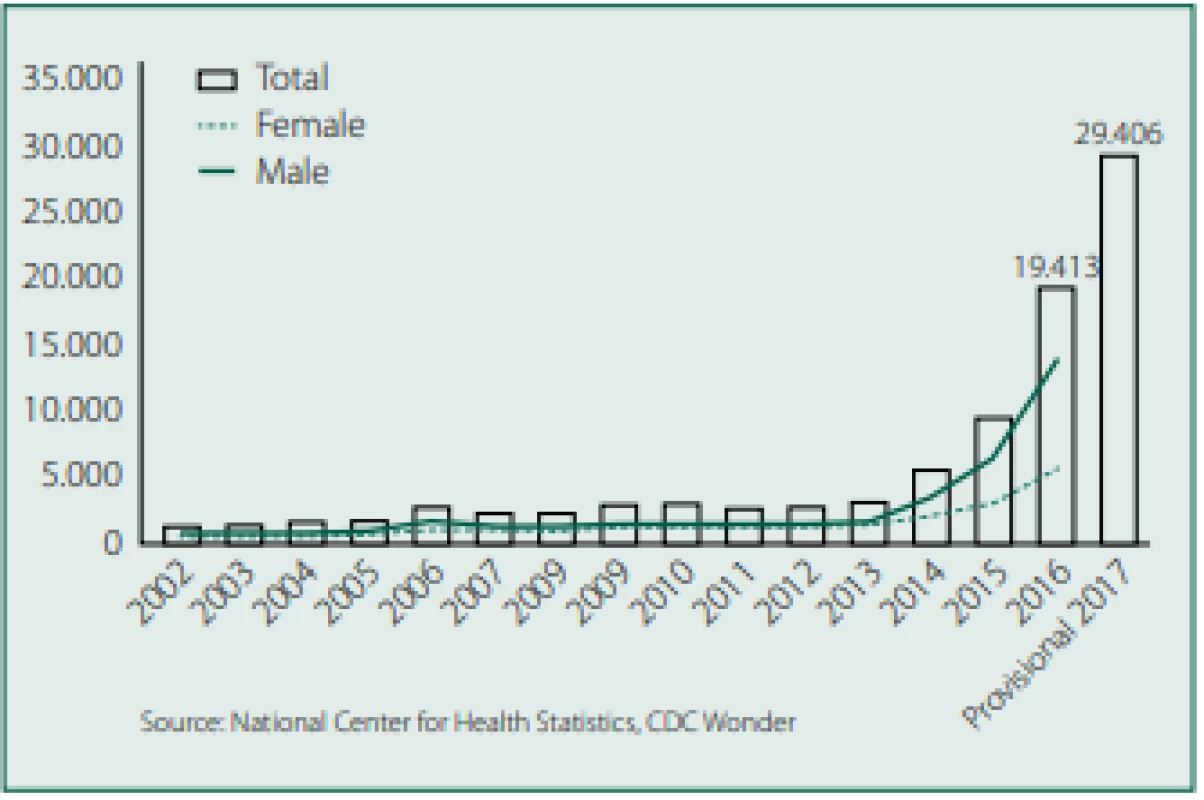
Další analgetika vzešlá z Janssen Pharmaceutica
Piritramid byl dalším analgetikem vyrobeným laboratořemi firmy Janssen v Belgii v r. 1960. Je užívaný převážně ve Střední Evropě a v Holandsku. Bezitramid (Burgodin) byl v Janssen Pharmaceutica syntetizován v r. 1961. Je pozoruhodné, že po komerčním úspěchu fentanylu v 60. letech, úspěch sufentanilu a alfentanilu koncem 80. a začátkem 90. let 20. století byl podstatně menší, než firma Janssen očekávala, což dovedlo její vedení k přesvědčení, že další výzkum opioidů pro anestezii již nemá cenu. Po podobně malém finančním přínosu etomidátu a droperidolu firma definitivně opustila anesteziologický program v polovině 90. let [32].
Závěr
Historie opioidů je dlouhá, střídají se v ní období, kdy byly považovány za boží dar, s obdobími, kdy byly zatracovány. Tento trend lze vysledovat i v současné době, kdy se původní apely na zvýšení spotřeby opioidů (koncept akutní bolesti jako 5. vitální známky) změnily na doporučení k jejich maximálnímu snižování („opioidní epidemie“ v USA) či dokonce vyřazení z praxe (koncept „opioid-free anaesthesia“). Opioidy však mají stále nezastupitelné místo v terapii silné bolesti a výzkum stále pokračuje. Sedmého srpna r. 2020 schválila FDA nový typ opioidu oliceridin (Olinvyk) vyvinutý firmou Trevena [40]. Jde o nový typ mí opioidního agonisty, který na receptoru působí převážně na G protein zprostředkovávající analgezii a podstatně méně na beta-arrestin zodpovědný za nežádoucí účinky opioidů na respiraci a trávicí trakt. Lék je určen pro intravenózní terapii střední až silné akutní bolesti pod lékařským dohledem v nemocnicích nebo podobných zařízeních (FDA) [41].
PROHLÁŠENÍ AUTORA:
Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Střet zájmů: Autor prohlašuje, že nemá střet zájmů v souvislosti s tématem práce.
Financování: Žádné
KORESPONDENČNÍ ADRESA AUTORA:
Článek přijat redakcí: 23. 10. 2020;
Článek přijat k tisku: 4. 11. 2020;
doc. MUDr. Jiří Málek, CSc.,
Cit. zkr: Anest intenziv Med. 2020; 31(5): 217–224
Zdroje
1. Duarte DF. Opium and opioids: a brief history. [cit. 2020-10-15]. Dostupné z: http://dcrark. com/dcrark/distilling/opium -and -opioids -a -brief -history/
2. Seddigh M, Jolliff GD, Calhoun W, Crane JM. Papaver bracteatum, potential commercial source of codeine. Economic Botany 1982; 36(4): 433–441.
3. Papaver somniferum – mák setý. Herbář Wendys. [cit. 2020-10-15]. Dostupné z: https:// botanika.wendys.cz/index.php/14-herbar -rostlin/487-papaver -somniferum -mak -sety).
4. Prioreschi P, Heaney RP, Brehm F. A quantitative assessment of ancient therapeutics: poppy and pain in Hippocratic Corpus. Med Hypothese, 1998; 51 : 325–331.
5. Hamilton GR, Baskett TF. In the arms of Morpheus the development of morphine for postoperative pain relief. Can J Anaesth. 2000; 47(4): 367–374. doi: 10.1007/BF03020955. PMID: 10764185.
6. Jay M. Císařové snů. Příběh drog v devatenáctém století. Praha: Volvox Globator; 2015.
7. Brunton D. A question of priority: Alexander Wood, Charles Hunter and the hypodermic method. Proc R Coll Physicians Edinb 2000; 30 : 349–351.
8. Codeine. Wikipedia. [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/wiki/Codeine
9. Dihydrocodeine. Wikipedia [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/ wiki/Dihydrocodeine
10. Sneader W. The discovery of heroin. Lancet 1998; 352 : 1697–1699.
11. Málek J. „Slavné osmičky“ v historii anesteziologie. Anest. intenziv. Med. 2018; 29(3): 175–179.
12. Askwith R. How aspirin turned hero. 1998 [cit. 2020-10-15]. Dostupné z: https://www. opioids.com/heroin/heroinhistory.html
13. Dafalque RJ, Wright AJ. Scophedal (SEE) Was it a Fad or a Miracle Drug? Bulletin of Anesthesia History 2003; 21(4): 12–14.
14. Oxycodone. Wikipedia. [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/wiki/ Oxycodone
15. Murray A, Hagen NA. Hydromorphone. Journal of Pain and Symptom Management, 2005; 26(5S): 57–66.
16. Gerlach R. A Brief overview on the discovery of methadone. INDRO e.V. Münster 2004. [cit. 2020-10-15]. Dostupné z: https://indro -online.de/en/the -history -of -methadone/
17. Hess L. Pethidin slaví 70 let. Remedia. 2009; 19(3): 213–214.
18. Latta KS, Ginsberg B, Barkin RL. Meperidine: a critical review. Am J Ther. 2002; 9(1): 53 – 68. doi: 10.1097/00045391-200201000-00010.
19. History of methadone [cit. 2020-10-15]. Dostupné z: https://www.methadone2.com/ history -of -methadone.htm
20. Prodine. Wikipedia: [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/wiki/Prodine
21. Ketobemidone. Wikipedia [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/ wiki/Ketobemidone
22. Desmethylprodine. Wikipedia [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/ wiki/Desmethylprodine
23. Phenadoxone. Wikipedia [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/wiki/ Phenadoxone
24. Trimeperidine. Wikipedia [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/wiki/ Trimeperidine
25. Zhirkova IV, Stepanenko SM, Butyleva OI, Zilbert EV, Manerova AF, Golodenko NV. Posleoperatsionnoe obezbolivanie metodom postoiannoĭ vnutrivennoĭ infuzii promedola u novorozhdennykh deteĭ [Method of continuous intravenous postoperative analgesia with promedol in newborn children]. Anesteziol Reanimatol. 2004 Jan-Feb; (1): 12–6. Russian.
26. Gudin J, Fudin J, Nalamachu S. Levorphanol use: past, present and future. Postgraduate Medicine. 2015; doi: 128. 10. 1080/00325481.2016.1128308.
27. Dextromoramide. Wikipedia. Dostupné z: https://en.wikipedia.org/wiki/Dextromoramide
28. Campbell ND, Lovell AM. The history of the development of buprenorphine as an addiction therapeutic. Ann N Y Acad Sci. 2012 Feb; 1248 : 124–139. doi: 10.1111/j. 1749-6632.2011.06352.x.
29. Stanley T. The Fentanyl Story. J Pain. 2014; 15 : 1215–1226.
30. Granger B, Albu S. The haloperidol story. Ann Clin Psychiatry. 2005; 17(3): 137–140. doi: 10.1080/10401230591002048.
31. The history of opioid use in anesthetic delivery. Anesthesia key. [cit. 2020-10-15]. Dostupné z: https://aneskey.com/the -history -of -opioid -use -in -anesthetic -delivery/
32. A history of cardiac anesthesiology. Anesthesia Key [cit. 2020-10-15]. Dostupné z: https:// aneskey.com/a -history -of -cardiac -anesthesiology/#CR39
33. Hess L. Carfentanil – nejsilnější známý opioid. Remedia 2017; 27(6): 582–586.
34. Hess L. Ultrapotentní opioidy. Remedia 2011; 21(3): 270–272.
35. List of fentanyl analogues. Wikipedia [cit. 2020-10-15]. Dostupné z: https://en.wikipedia.org/wiki/List_of_fentanyl_analogues
36. Fentanyl analogs. Wikimedia [cit. 2020-10-15]. Dostupné z: https://commons.wikimedia.org/wiki/Category:Fentanyl_analogs
37. Blane GF, Boura AL, Fitzgerald AE, Lister RE. Actions of etorphine hydrochloride, (M99): a potent morphine -like agent. British Journal of Pharmacology and Chemotherapy. 1967; 30(1): 11–22. doi: 10.1111/j.1476-5381.1967.tb02108.x.
38. Feldman PL. Insights into the Chemical Discovery of Remifentanil. Anesthesiology 2020; 132 : 1229–1234.
39. Center for drug evaluation and research. Approval package for: application number 209128Orig1s000 [cit. 2020-10-15]. Dostupné z: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/209128Orig1s000Approv.pdf
40. Olinvyk. Wikipedia [cit. 2020-10-15] Dostupné z: https://www.drugs.com/history/ olinvyk.html 41. FDA Advisory Committee Meeting Oliceridine Briefing Document: October 11, 2018 [cit. 2020-10-15]. Dostupné z: https://www.fda.gov/media/121230/download
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2020 Číslo 5- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Pandemie COVID-19: ještě neskončila, ale co z ní lze využít již nyní…
- Blok distální části nervus ischiadicus nízkým objemem (LVDSB) – srovnání s aplikací tekutiny do distální části adduktorového kanálu na zdravém dobrovolníku
- Změny výšky vrstvy endoteliálního glykokalyx po náhlé zástavě oběhu s kardiopulmonální resuscitací na experimentálním modelu srdeční zástavy u prasete domácího
- Ovlivňuje hloubka celkové inhalační anestezie jednoletou pooperační mortalitu rizikových seniorů?
- Fentanyl – 60 let od syntézy, historie opioidních analgetik
- Důležitost a možnosti peroperačního hodnocení nocicepce
- Současné i budoucí spektrum plicní fibrózy
- Odmítnutí převzetí pacienta z přednemocniční péče cílovým poskytovatelem akutní lůžkové péče
- Dva případy rocuroniem navozené anafylaxe/ anafylaktického šoku úspěšně léčené sugammadexem
- Využití rotační tromboelastometrie v perioperační medicíně a její porovnání se standardními koagulačními testy
- Využití pouhého vysokého přívodu kyslíku nebo v kombinaci s odsáváním z dýchacích cest pro úspěšnou dekanylaci?
- Ke 110. výročí založení zdravotnického záchranného sboru v Olomouci
- Stanovisko výboru ČSARIM 13/2020 Rozhodování u pacientů v intenzivní péči v situaci nedostatku vzácných zdrojů
- Příloha 1: Právní rozbor situace nedostatku vzácných zdrojů v systému zdravotní péče
- Zvláštnosti syndromu akutní dechové tísně dospělých u pacientů s COVID-19
- American Heart Association (AHA) vydává a elektronicky volně rozšiřuje dnem 15. října 2020 Highlights of the American Heart Association s názvem: GUIDELINES FOR CPR AND ECC – The Most Updated Science From the Leaders in Resuscitaion
- Zajímavosti, tipy a triky, informace z jiných oborů
- Autopiloti na operačním sále – významný nový prvek
- Dynamické proměnné pro perioperační management tekutin
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití rotační tromboelastometrie v perioperační medicíně a její porovnání se standardními koagulačními testy
- Odmítnutí převzetí pacienta z přednemocniční péče cílovým poskytovatelem akutní lůžkové péče
- Důležitost a možnosti peroperačního hodnocení nocicepce
- Fentanyl – 60 let od syntézy, historie opioidních analgetik
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



