-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
Contemporary treatment methods of adult patients with BCR/ABL1 positive chronic myeloid leukemia
Chronic myeloid leukemia (CML) is a clonal myeloproliferative neoplasia that is characterised by Philadelphia chromosome (Ph1 chromosome) and/or fusion gene BCR-ABL1 in bone marrow. Interpheron α and bone marrow transplantation used to be the main treatment modalities for patients with CML 20 years ago. Due to the introduction of imatinib mesylate since the year 2000 the outcome of CML patients has dramatically improved. The survival of both younger and elderly patients in the case of an optimal response has been prolonged and currently is close to survival of healthy population. Although, one third of patients does not respond well to first line imatinib and needs to change the treatment to second line tyrosine kinase inhibitors (TKI: bosutinib, dasatinib and nilotinib). Younger patients without cardiologic and metabolic disorders and those with poor risk profile score may have benefit from TKI of 2nd generation as a 1st line treatment option with the aim of reaching deeper molecular response and the chance of treatment free remission (TFR) in future. By older patients with severe comorbidities and in patients with good risk profile score imatinib as a 1st line treatment option can be used. For patients who are resistant simultaneously to 2nd generation TKI and for patients with mutation T315I ponatinib – TKI of 3rd generation can be used effectively. Intolerance and toxicity of TKI´s are the main barriers of effective CML treatment. TKI selection for each patient should be individual. Patient´s cooperation with medical team is crucial and inevitable in long time treatment process. The chance for TFR has become feasible for approximately 40–60 % CML patients in deep and durable molecular remission and represents a further important milestone in the management of CML patients.
Keywords:
remission – bosutinib – dasatinib – hematopoietic stem cell transplantation – chronic myeloid leukemia – imatinib – nilotinib – ponatinib – Tyrosine kinase inhibitors
Autoři: Katarína Slezáková; Martin Mistrík; Angelika Bátorová
Působiště autorů: Klinika hematológie a transfuziológie LF UK, SZU a UN Bratislava, Slovenská republika
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 214-224
Kategorie: Přehledové články
Souhrn
Chronická myelocytová leukémia (CML) je klonálne myeloproliferatívne ochorenie charakterizované dôkazom tzv. filadelfského chromozómu (Ph1 chromozóm) a/alebo patologickým fúznym génom BCR‑ABL1 v kostnej dreni. Liečba chronickej myelocytovej leukémie sa koncom 20. storočia opierala o interferón α a o transplantáciu kostnej drene, no po roku 2000 sa zavedením imatinibu liečebný prístup k pacientom s CML významne zmenil. Zlepšila sa prognóza nielen mladým, ale aj starším pacientom a predĺžilo sa ich prežívanie, ktoré je v prípade optimálnej liečebnej odpovede porovnateľné k bežnej populácii bez CML. Avšak približne 1/3 pacientov liečených imatinibom nedosahuje optimálne liečebné odpovede a vyžaduje zmenu liečby na inhibítory tyrozinkinázy 2. generácie (TKI: bosutinib, dasatinib a nilotinib). Mladší pacienti bez pridružených kardiovaskulárnych či metabolických ochorení a pacienti s vyšším rizikovým skóre pri stanovení diagnózy profitujú so zahájenia liečby TKI 2. generácie už do 1. línie s cieľom rýchlejšieho dosiahnutia hlbokej molekulovej odpovede a šance na možné prerušenie liečby v budúcnosti. U starších pacientov s komorbiditami a u pacientov s nižším rizikovým skóre má naďalej svoje miesto v 1. línii aj imatinib. Pre pacientov s rezistenciou aj na druhogeneračné TKI máme k dispozícii TKI 3. generácie ponatinib, ktorý je účinný aj u pacientov s mutáciou T315I. Najväčšou bariérou účinnej liečby TKI je intolerancia a toxicita a preto by mal byť výber TKI u každého pacienta individuálny. Nevyhnutnosťou dlhodobej liečby CML je adekvátna spolupráca pacienta. Na základe viacerých klinických štúdií má približne 40–60 % pacientov v štádiu hlbokej a trvácnej molekulovej odpovede šancu na bezpečné prerušenie liečby TKI, čo predstavuje ďalší prelomový úspech v manažmente pacientov s CML.
Klíčová slova:
bosutinib – dasatinib – chronická myelocytová leukémia – imatinib – inhibítory tyrozinkinázy – nilotinib – ponatinib – remisia – transplantácia krvotvorných buniek
Úvod
Chronická myelocytová leukémia (CML) je klonálne myeloproliferatívne ochorenie. Začína v nezrelých myeloidných bunkách kostnej drene vznikom BCR‑ABL1 onkogénu, ktorý produkuje tyrozínkinázové enzýmy, ktoré umožňujú proliferáciu nádorových buniek (1). Prebieha v 3 fázach: chronickej, akcelerovanej a blastovej. Väčšina pacientov je diagnostikovaná v chronickej fáze a vďaka cielenej modernej liečbe len zriedka progredujú do pokročilých fáz. Medzi najčastejšie klinické prejavy CML patrí splenomegália, zvýšená únava, schudnutie či strata fyzickej kondície. CML sa diagnostikuje na základe charakteristického nálezu v krvnom obraze (leukocytóza s typickým posunom doľava, s bazofíliou) a v aspiráte kostnej drene je zvýšené zastúpenie granulopoézy, prítomné zvyčajne býva aj zmnoženie megakaryocytov a potvrdzuje sa cytogenetickým a/alebo molekulovo genetickým vyšetrením vzorky kostnej drene či periférnej krvi, ktoré odhalí patologický Ph1 chromozóm a/alebo patologický fúzny gén BCR‑ABL1.
Incidencia CML je 10–15 prípadov/106 /rok bez väčších geografických alebo etnických rozdielov (2). Vekový medián v čase diagnózy je v Európe 60–65 rokov. Prevalencia CML má stúpajúci trend vďaka predĺženému prežívaniu, ktoré sa dosiahlo cielenou terapiou TKI (3).
Pred érou TKI bol vyšší vek pacienta považovaný za nepriaznivý prognostický faktor a bol súčasťou skórovacích systémov pre CML – skóre podľa Sokala a Euro skóre (4). V liečbe sa používali alkylačné látky, interferón α a u mladších pacientov s dostupným HLA zhodným darcom transplantácia krvotvorných buniek (TKB). Interferón sa v súčasnosti v liečbe CML uplatňuje najmä u mladých žien plánujúcich graviditu a u pacientov netolerujúcich žiaden z TKI. Alogénna TKB je rezervovaná ako liečebná možnosť pre mladších pacientov s vysokým rizikom transformácie do akcelerovanej alebo blastovej fázy, ktorí sú rezistentní na TKI a ktorí majú k dispozícii vhodného darcu krvotvorných buniek. V ére TKI vyšší vek pacienta už nie je nepriaznivým prognostickým faktorom (5). Prežívanie pacientov diagnostikovaných v chronickej fáze CML a dobre odpovedajúcich na TKI dosahuje po 5 rokoch 90 %, po 10 rokoch 83–84 %, čo dokumentuje okrem veľkých medzinárodných klinických štúdií (IRIS, DASISION, German IV study, ENEStTnd) aj práca autorov z ÚHKT (Obr. 1) (6–10). V súbore 260 pacientov liečených TKI v ÚHKT v rokoch 2005–2016 bola pravdepodobnosť 10-ročného prežívania 83 %. S cieľom zlepšiť okrem vynikajúceho celkového prežívania aj kvalitu života pacientov s CML prebiehajú v súčasnosti klinické štúdie, ktoré sa zaoberajú možným prerušením liečby TKI v štádiu hlbokej a trvácnej molekulovej remisie po niekoľkoročnom trvaní terapie – tzv. remisia bez liečby (treatment free remission – TFR) (11–13).
Obr. 1. Liečba pacientov s CML pomocou TKI v ÚHKT Praha v rokoch 2005–2016 (10). A. Pravdepodobnosť celkového prežívania. B. Pravdepodobnosť prežívania bez progresie 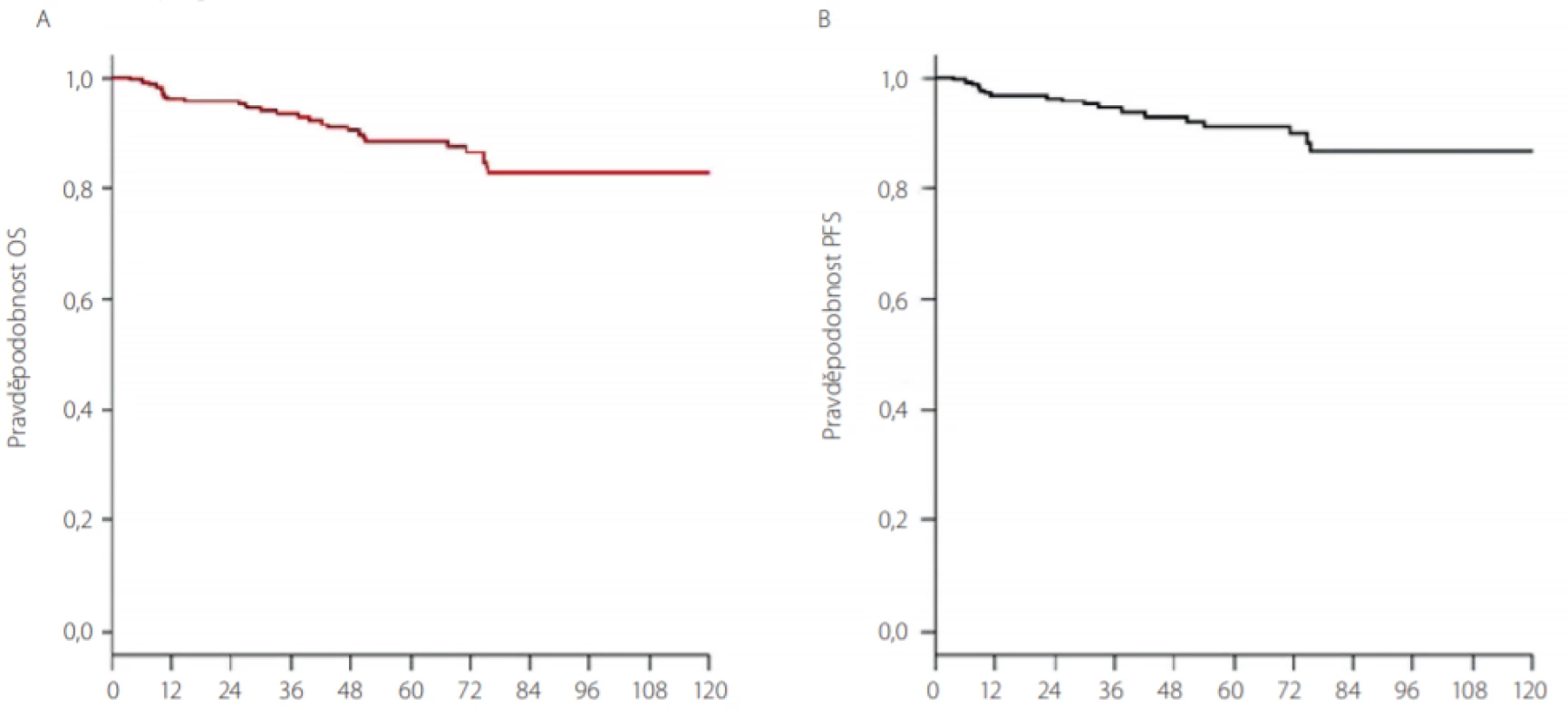
OS – celkové prežívanie
PFS – prežívanie bez progresie
TKI – inhibítory tyrozinkinázPacienti liečení TKI sú pravidelne monitorovaní v centrách pre liečbu CML – v určitých pravidelných intervaloch sa kontroluje liečebná odpoveď na TKI. V bežnej klinickej praxi používame na monitorovanie liečebnej odpovede kritéria podľa odporúčaní ELN z roku 2013 (Tab. 1) (14). V úvode liečby sa odporúča kontrolovať krvný obraz každých 14 dní, po 3 mesiacoch liečby v prípade dosiahnutia hematologickej remisie a v prípade, že pacient nemá vážnejšie prejavy hematologickej toxicity liečby kontrolujeme krvný obraz v 3-mesačných intervaloch. Monitorovanie liečebnej odpovede na TKI sa opiera okrem vyšetrenia krvného obrazu aj o vyšetrenie molekulovej genetiky zo vzorky periférnej krvi pacienta, kde sa v štandardizovaných laboratóriách genetiky pomocou tzv. kvantitatívnej RT‑PCR stanovuje hodnota BCR‑ABL1 transkriptov každé 3 mesiace. Za optimálnu liečebnú odpoveď považujeme dosiahnutie kompletnej hematologickej remisie po 3 mesiacoch liečby, po 6 mesiacoch liečby by mal pacient dosiahnuť kompletnú cytogenetickú remisiu (tzn. neprítomnosť Ph1 chromozómu v kostnej dreni pri cytogenetickom alebo FISH vyšetrení) a v 12. mesiaci liečby tzv. veľkú molekulovú remisiu (BCR‑ABL1 ≤ 0,1 % IS vyšetrením kvantitatívnej RT‑PCR zo vzorky periférnej krvi, IS – international scale). V prípade splnenia cieľa terapie v dôležitých časových míľnikoch podľa ELN odporúčaní (3., 6. a 12. mesiac a potom každé 3 mesiace) pacient v liečbe pokračuje ďalej a má perspektívu dosiahnuť dlhodobé prežívanie podobné celkovej populácii s nádejou na vysadenie liečby po určitom období s udržaním minimálnej reziduálnej choroby pod kontrolou. Vyšetrenie kostnej drene sa odporúča najmä v prípade straty hematologickej odpovede za účelom vylúčenia progresie do akcelerovanej či blastovej fázy a taktiež ak pacient stráca liečebnú odpoveď na úrovni molekulového relapsu a potrebujeme cytogenetickým vyšetrením karyotypu buniek kostnej drene vylúčiť tzv. prídavné cytogenetické zmeny (napr. -7, 7q - alebo +8, +19 či duplicitný Ph chromozóm), ktoré sa môžu spájať s nepriaznivou prognózou u pacienta (15). Ako zlyhanie liečby považujeme nedosiahnutie alebo stratu hematologickej a cytogenetickej remisie, konfirmovanú stratu molekulovej remisie a vznik klonálnych cytogenetických abnormalít v Ph pozitívnych bunkách. Pri strate alebo absencii liečebnej odpovede sa pred zmenou liečby odporúča vyšetrenie mutácií v BCR‑ABL1 géne, ktoré môžu spôsobovať rezistenciu na podávanú liečbu (Tab. 2) a predstavujú taktiež zlyhanie liečby. Odporúča sa aj preveriť pravidelné užívanie liečby zo strany pacienta (compliance). Intolerancia a toxicita podávanej liečby môže byť taktiež príčinou neadekvátnej liečebnej odpovede (napr. opakovane prerušovaná liečba, vynechávanie liečby) a môže byť preto dôvodom zmeny liečby na iný preparát.
Tab. 1. Definície odpovedí na prvolíniovú liečbu TKI a pre 2. líniu v prípade zmeny pre intoleranciu prvého TKI (podľa ELN odporúčaní z roku 2013) (14) 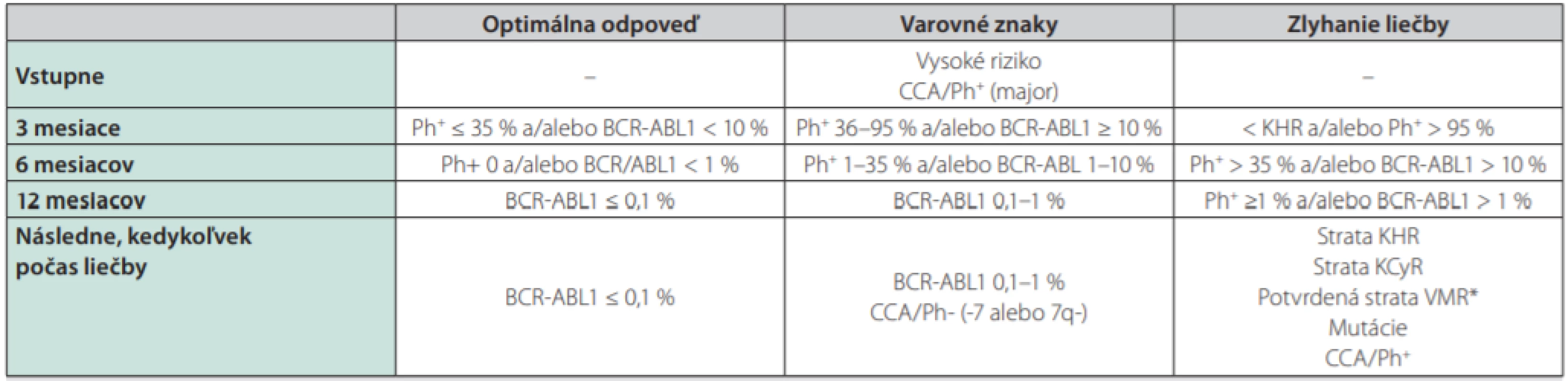
*Aspoň v jednom z dvoch nasledujúcich testov musí byť hladina BCR-ABL1 transkriptov ≥ 1 %
CCA – klonálne chromozomálne abnormality, KCyR – kompletná cytogenetická remisia, KHR – kompletná hematologická remisia, VMR – veľká molekulová remisiaTab. 2. Možnosti liečby CML v prípade výskytu BCR-ABL 1 mutácií (podľa NCCN odporúčaní 2018) (16) 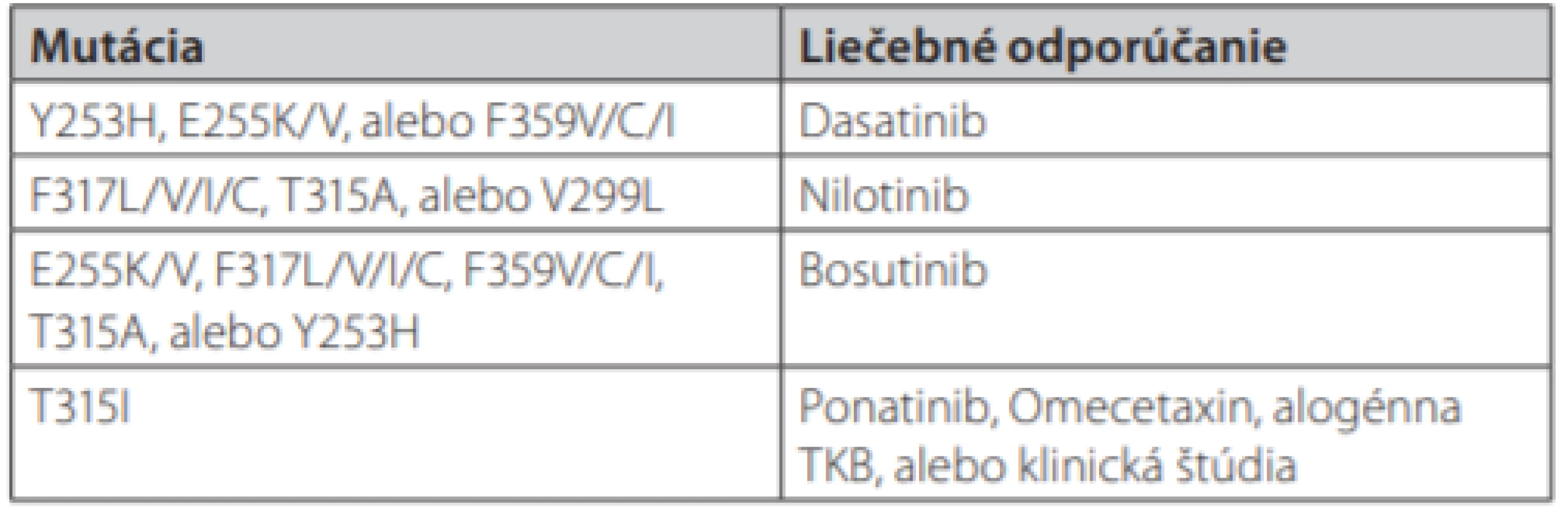
Imatinib
Imatinib je selektívny Bcr‑Abl1 kinázový inhibítor, ktorý sa prvýkrát použil v liečbe CML v roku 1998 a následne významne zmenil liečebný prístup a zlepšil prognózu pacientov s CML. Pôsobí prostredníctvom kompetitívnej inhibície ATP väzbového miesta Bcr‑Abl 1 onkoproteínu, ktorá má za následok inhibíciu fosforylácie proteínov involvovaných do vnútrobunkovej transdukcie signálov. Účinne inhibuje Bcr/Abl 1 kinázu a taktiež blokuje PDGF receptory a KIT tyrozínkinázu. V Európe bol imatinib mesylát registrovaný v roku 2002 aj na základe výsledkov fázy 2 klinických štúdií (17). Analýza účinnosti a bezpečnosti imatinibu bola realizovaná na základe viac ako 10-ročného sledovania pacientov s CML v otvorenej multicentrickej štúdii IRIS, ktorá zahŕňala pacientov s novodiagnostikovanou CML v chronickej fáze: tí dostávali buď imatinib v dávke 400 mg denne alebo interferón α (5 MU/m2 denne) plus cytarabín (20 mg/m2 10 dní v mesiaci) (6). Väčšina pacientov randomizovaných do ramena s interferónom a cytarabínom prešli zavčasu do ramena s imatinibom pre stratu liečebnej odpovede. Po 7 rokoch sa klinická štúdia rozšírila len na rameno s imatinibom a pacienti v ramene s interferónom mohli pokračovať v štúdii len ak prešli do ramena s imatinibom. Medián sledovania bol 10,9 rokov. V skupine pacientov liečených imatinibom bolo predpokladané celkové prežívanie po 10 rokoch 83,3 %. V ramene s imatinibom došlo u 38 z 553 pacientov (6,9 %) k progresii do akcelerovanej fázy alebo blastovej krízy (18). Počas viac ako 10-ročného sledovania v štúdii IRIS sa nepozorovali nové bezpečnostné signály a vážne nežiaduce účinky liečby imatinibom boli pomerne zriedkavé, podiel cytogenetických ako aj molekulových odpovedí bol vysoký. Výsledky dlhoročnej klinickej štúdie IRIS zdôrazňujú bezpečnosť a účinnosť liečby imatinibom najmä v porovnaní s pacientami, ktorí boli liečení na CML ešte pred érou TKI, keď bola štandardnou liečbou TKB a interferón α (19, 20). Schopnosť imatinibu redukovať progresiu ochorenia a úmrtia v súvislosti s CML a zlepšiť celkové prežívanie spravila z neho model cielenej liečby nádorov (21). V analýze novodiagnostikovaných pacientov s CML z databázy INFINITY (tyrosine kinase Inhibitors iN the FIrst aND followIng CML Treatment) z centier v Českej republike, ktorí boli liečení imatinibom v štandardnej dávke 400 mg denne v podmienkach každodennej klinickej praxe sa udáva po 12 mesiacoch liečby dosiahnutie kompletnej hematologickej remisie u 94 % pacientov, 70 % pacientov dosiahlo kompletnú cytoge ‑ netickú odpoveď, veľkú molekulovú odpoveď dosiahlo 42 % pacientov a 4 % pacientov boli molekulovo negatívni (22). Liečbu vysadilo 14,2 % pacientov, v IRIS štúdii 14,3 %. Analýza z databázy INFINITY odráža výsledky liečby imatinibom u tzv. neselektovanej skupiny pacientov – na rozdiel od prísnych vstupných kritérií klinickej štúdie IRIS. Zaradení boli aj starší pacienti (v IRIS štúdii bol medián veku 50 rokov a v štúdii databázy INFINITY 54 rokov), čo potvrdzuje dobrú účinnosť aj toleranciu u starších pacientov. Efektivita a bezpečnosť liečby imatinibom bola dokázaná aj vo významnej rozsiahlej nemeckej štúdii CML‑IV, kedy po mediáne sledovania 9,5 roka bola pravdepodobnosť 10-ročného celkového prežívania v súbore všetkých pacientov 82 % a prežívania bez progresie 80 % (8). Pacienti, ktorí dosiahli optimálne molekulové odpovede v kľúčových míľnikoch liečby (3., 6. a 12. mesiac) mali lepšie výsledky v prežívaní.
Ani po dlhodobej expozícii imatinibom sa u pacientov liečených imatinibom nepozorovali prejavy orgánovej toxicity a nepotvrdili sa ani obavy z možnej zvýšenej náchylnosti na vznik nádorov či kardiálnej toxicity (23).
Počas liečby imatinibom sa môžu u pacientov vyskytnúť muskuloskeletálne symptómy - najčastejšie kŕče, bolesti svalov, kostí a kĺbov, ktoré však u časti pacientov postupne ustúpia. V klinickej štúdii IRIS sa svalové kŕče udávali u 38,3 % pacientov liečených imatinibom v dávke 400 mg/deň (24). V prípade muskuloskeletálnych symptómov sa odporúča pacientom doplniť zásoby vápnika a horčíka a dobré skúsenosti sú s chinínom (napr. vypiť pohár toniku denne). U pacientov liečených imatinibom sa často vyskytujú prejavy retencie tekutín – prírastok na váhe, periorbitálne alebo perimaleolárne edémy. Perikardiálne a pleurálne efúzie sa však vyskytujú pomerne zriedkavo, a to najmä v prípade vyšších dávok imatinibu (25). Mierne prejavy retencie tekutín (napr. periorbitálne edémy) liečebnú intervenciu väčšinou nevyžadujú. V prípade klinicky vážnejších edémov sa odporúča obmedzenie soli v strave, diuretiká a redukcia dávky imatinibu. Opatrnosť je na mieste v prípade súčasnej medikácie blokátormi kalciových kanálov, ktoré môžu zhoršiť prejavy retencie tekutín.
Dasatinib
Dasatinib je TKI 2. generácie, ktorý účinkuje ako selektívny kompetitívny TKI Abl, Bcr‑Abl, c‑Kit, PDGFR‑α, a kináz rodiny Src. Je účinný u väčšiny mutovaných foriem kinázy Bcr‑Abl, ktoré sú rezistentné voči imatinibu (s výnimkou mutácie T315I). Má nižšiu účinnosť v prípade výskytu mutácií E379K, G250E, T315A, F317L, F317I a V299L. Hlavnou cestou jeho eliminácie z organizmu je metabolizmus pečene, močom je vylučovaný v 4 %. Výhodou je užívanie v jednej dennej dávke: v prípade chronickej fázy CML 100mg denne a v prípade pokročilých fáz (AF, BF) 140mg denne. Vstrebávanie nie je významne ovplyvnené jedlom, čo je výhodné pre pacienta.
Dasatinib bol odsúhlasený pre liečbu CML vo všetkých fázach choroby v roku 2006 na základe klinických štúdií, ktoré demonštrovali jeho schopnosť dosiahnuť vysoký podiel hematologických aj cytogenetických odpovedí u pacientov s rezistenciou alebo intoleranciou imatinibu (26, 27). V roku 2010 bol dasatinib odsúhlasený aj pre liečbu novodiagnostikovaných pacientov s CML v 1. línii (7). Vo fáze III randomizovanej klinickej štúdie DASISION sa porovnával dasatinib v dávke 100 mg denne s imatinibom v štandardnej dávke 400 mg u 519 novodiagnostikovaných pacientov s CML v chronickej fáze v pomere 1 : 1 (7). Primárnym cieľom štúdie bolo potvrdenie kompletnej cytogenetickej remisie (KCyR) v 12. mesiaci liečby. Po 1 roku dosiahlo KCyR 77 % v ramene s dasatinibom vs 66 % pacientov v ramene s imatinibom (p = 0,007 %). Transformácia do akcelerovanej alebo blastovej fázy bola nižšia v ramene s dasatinibom než s imatinibom (4,6 vs 7,3 %). Celkové prežívanie, resp. prežívanie bez progresie bolo 90,9 %, resp. 85,4 % v ramene s dasatinibom a 89,6 % resp. 85,5 % v ramene s imatinibom. V ramene s dasatinibom však viac pacientov muselo liečbu prerušiť pre nežiaduce účinky než v ramene s imatinibom. Medzi najčastejšie nežiaduce účinky hlásené v ramene s dasatinibom boli pleurálne výpotky, hnačka a bolesti hlavy. Aj 5-ročná analýza štúdie DASISION naďalej potvrdila dasatinib v dávke 100 mg denne ako bezpečnú a účinnú liečbu 1. línie pri dlhodobej terapii CML (28). Účinnosť a bezpečnosť prvolíniovej liečby dasatinibom bola potvrdená aj v práci talianskych autorov, ktorí v multicentrickej analýze 109 pacientov v tzv. „bežnej“ klinickej praxi mimo klinických štúdií dokázali optimálnu molekulovú odpoveď (BCR‑ABL1 < 0,1 %) po 12 mesiacoch liečby u 62 % pacientov (29). V roku 2016 boli publikované výsledky až 7-ročného sledovania pacientov s rezistenciou alebo intoleranciou imatinibu z fázy 3 klinickej štúdie CA180-034 (30). Na základe jej výsledkov bola odsúhlasená dávka dasatinibu 100 mg denne, ktorá sa aj v súčasnosti považuje za štandardnú pre pacientov v chronickej fáze CML. Štúdia je jedinečná práve z dôvodu až 7-ročného sledovania súboru – v čase publikácie išlo o najdlhší „follow up“ pacientov v rámci štúdií s druhogeneračnými TKI. Celkové prežívanie súboru pacientov bolo 65 %, tzv. veľká molekulová odpoveď (MMR) bola dosiahnutá u 46 % pacientov v čase sledovania 7 rokov.
Nilotinib
Nilotinib je TKI 2. generácie, ktorý pôsobí ako selektívny kompetitívny TKI Bcr‑Abl, PDGFR, Kit, CSF-1R, DDR a ephrin‑A4 receptorových kináz. Menej pôsobí na inhibíciu PDGFR a Kit v porovnaní s imatinibom.
Nilotinib nie je účinný v prípade výskytu mutácie T315I a jeho účinnosť je nižšia aj v prípade prítomnosti mutácií Y253H, E255V a F359V.
Nilotinib sa zaviedol do klinickej praxe spočiatku ako TKI 2. generácie pre pacientov s rezistenciou alebo intoleranciou imatinibu na základe výsledkov fázy 2 klinickej štúdie z roku 2010 (9). Na základe výsledkov fázy III randomizovanej multicentrickej štúdie s 846 pacientami s novodiagnostikovanou CML bol schválený aj do 1. línie liečby pre takmer dvojnásobný rozdiel v dosiahnutí veľkej molekulovej remisie po 12 mesiacoch liečby v ramenách s nilotinibom (600 mg a 800 mg denne) v porovnaní s pacientami v ramene s imatinibom 400 mg denne (44 %, 43 % a 22 %) (31). Najlepšie výsledky dosiahli pacienti v ramene s nilotinibom v dávkovaní 300 mg 2× denne. Kumulatívna incidencia molekulovej odpovede na úrovni MR 4,5 (≤ 0,0032 %) bola po 6 rokoch v ramene s nilotinibom 56 % v porovnaní s imatinibom 33 % (p < 0,0001) (32). Medián času do jej dosiahnutia bol 45,5 mesiacov na nilotinibe a 61,1 mesiacov na imatinibe (p < 0,0001) (32). V klinickej štúdii ENESTnd sa taktiež dokázalo, že včasnú molekulovú odpoveď v 3. mesiaci liečby dosiahlo v ramene s nilotinibom v 1. línii aj značné percento pacientov so stredným alebo vysokým rizikom indexu podľa Sokala v porovnaní s imatinibom (89 % vs 59 %) a aj tzv. veľkú molekulovú remisiu po 12 mesiacoch (47 % vs 20 %) (33). V oboch nilotinibových ramenách sprogredovalo menej pacientov do akcelerovanej alebo blastovej fázy ako v ramene s imatinibom (11/3,9 % a 6/2,1 % vs 21/7,4 %). Celkové prežívanie s úmrtiami súvisiacimi s CML bolo v ramene s nilotinibom v dávkovaní 300 mg 2× denne 97,7 %, s nilotinibom v dávkovaní 400 mg 2× denne 98,5 % a v ramene s imatinibom 93,9 %. V ramenách s nilotinibom sa vyskytlo menej tzv. „treatment emergent“ BCR/ABL1 mutácií (34). Castagnetti et al pracovnej skupiny GIMEMA analyzoval liečbu 130 novodiagnostikovaných pacientov s CML v chronickej fáze liečených nilotinibom v dávke 300 mg 2× denne v 1. línii: hlbokú molekulovú odpoveď po 24 mesiacoch liečby dosiahlo 63 % pacientov a v mediáne sledovania 29 mesiacov ostávalo na liečbe 77 % pacientov (35).
Vstrebávanie nilotinibu je významne ovplyvnené príjmom jedla a môže tak značne zvýšiť jeho systémovú expozíciu. Preto sa odporúča liek užívať nalačno. U pacientov v chronickej fáze CML sa v rámci 1. línie liečby odporúča dávka 300 mg 2× denne a v prípade 2. línie 400 mg 2× denne. Po užití lieku by mal pacient ešte 1 hod zostať nalačno. Hlavným spôsobom jeho eliminácie z organizmu je metabolizmus pečene. S nilotinibom sa neodporúča užívanie inhibítorov ani silných induktorov enzýmu P450 CYP3A4 (antacidá, blokátory H2 a inhibítory protónovej pumpy, antimykotiká ako napr. ketokonazol, itrakonazol, vorikonazol). Taktiež sa neodporúča užívať nilotinib s liekmi predlžujúcimi QTc interval vrátane antiarytmík, klaritromycínu alebo cyklických antidepresív. Počas celej liečby nilotinibom sa neodporúča konzumácia grapefruitu a výrobkov z neho. Odporúča sa pravidelne kontrolovať EKG záznam a monitorovať hladiny glykémie a elektrolytov v sére pacienta (najmä kálium a magnézium) a parametre metabolizmu lipidov.
Bosutinib
TKI 2. generácie bosutinib je duálnym inhibítorom Abl a Src kináz, ktorý vykazuje voči Bcr‑Abl kináze 100× vyššiu účinnosť v porovnaní s imatinibom pri in vitro testovaní. Vďaka minimálnemu účinku na PDGFR a c‑kit receptory má pomerne priaznivý bezpečnostný profil (nižšie riziko vzniku retencie tekutín pri jeho užívaní v porovnaní s imatinibom). Neúčinkuje však u pacientov s mutáciou T315I a V299L.
Od roku 2012 je indikovaný u pacientov s Ph pozitívnou CML, ktorí sú rezistentní alebo netolerujú predchádzajúcu liečbu TKI (36). V klinickej štúdii BFORE sa dokázalo vyššie percento dosiahnutých cytogenetických (77 % vs 66 %) a molekulových odpovedí (47 % vs. 37 %) v ramene s bosutinibom v porovnaní s imatinibom aj u novodiagnostikovaných pacientov s CML (37). Podľa odporúčaní NCCN pre rok 2019 je už aj bosutinib možné zaradiť ako možnosť 1. línie liečby CML (16). Odporúčaná iniciálna dávka bosutinibu je v 1. línii 400 mg a v 2. a vyššej línii 500 mg 1× denne a užíva sa pri jedle. Medzi najčastejšie nežiaduce účinky počas liečby bosutinibom patrí zvýšený výskyt hnačky (udáva sa až 83 %), ktorá sa objavuje najmä počas prvých týždňov liečby, nausea a zvracanie (38). Počas liečby bosutinibom sa nepozoroval zvýšený výskyt vážnych kardiovaskulárnych nežiaducich účinkov a preto sa zdá byť bezpečnou voľnou aj u starších pacientov s kardiologickými ochoreniami.
Ponatinib
Ponatinib je veľmi účinný TKI 3. generácie (multikinázový inhibítor, pan‑Bcr‑Abl), ktorý je schválený na liečbu Ph+ CML vo všet ‑ kých fázach ochorenia s rezistenciou alebo intoleranciou voči iným TKI (s rezistenciou a/alebo intoleranciou dasatinibu a nilotinibu, u ktorých klinicky nie je indikovaný imatinib) a u pacientov s identifikovanou mutáciou T315I alebo s Ph+ ALL a rezistenciou voči alebo intoleranciou dasatinibu, pre ktoré sa nehodí imatinib alebo u ktorých bola identifikovaná mutácia T315I. Hlavným klinickým významom ponatinibu je schopnosť prekonať rezistenciu spôsobenú prítomnosťou mutácie T315I Bcr‑Abl1 kinázy. Ponatinib je účinný aj v prípade prítomnosti ďalších mutácií BCR‑ABL1 a dokázal svoju účinnosť aj u pacientov s multi‑TKI‑rezistentnou CML. Ponatinib však cieli taktiež na receptor 2 pre cievny endoteliálny rastový faktor (VEGFR), PDGFR, FLT3 a c‑KIT, ktoré regulujú cievnu homeostázu (39). Vplyv tejto regulácie na možný vznik artériových cievnych oklúzií pri liečbe ponatinibom však dokázaný nie je.
Eliminácia lieku prebieha prostredníctvom CYP3A4, preto je pri hepatálnom poškodení nevyhnutná redukcia dávky. Opatrnosť je nutná pri súčasnom užívaní antimykotík zo skupiny azolov.
Účinnosť a bezpečnosť ponatinibu bola demonštrovaná v klinickej štúdii PACE (The pivotal phase 2 Ponatinib Ph+ ALL and CML Evaluation trial) (40). Finálne 5-ročné výsledky štúdie dokázali, že ponatinib má potenciál dosiahnuť klinicky významné liečebné odpovede nezávislé od redukcie dávky aj v populácii významne predliečených pacientov. Odhadované 5-ročné celkové prežívanie bolo v súbore 267 hodnotiteľných pacientov s CML 73 %. Kumulatívna incidencia nežiaducich artériových oklúzií však bola až 31 %. Analýzou prípadov artériových oklúzií sa zistila súvislosť s vyššou dávkou ponatinibu a kardiovaskulárnymi rizikovými faktormi (hypertenzia, hypercholesterolémia, diabetes a obezita).V štúdii sa nezistil vyšší výskyt príhod žilového tromboembolizmu v porovnaní s populáciou s inými nádorovými ochoreniami (41).
Publikované boli práce, v ktorých sa analyzujú výsledky liečby CML ponatinibom už v rámci 2. línie, tzn. pri rezistencii a/alebo intolerancii TKI 2. generácie alebo imatinibu s mutáciami rezistentnými na druhogeneračné TKI. Breccia et al uvádza skúsenosti s ponatinibom už v 2. línii u 29 pacientov s CML, z ktorých 45 % pacientov zahájilo liečbu pre sekundárnu a 38 % pre primárnu rezistenciu na TKI, 10 % pre intoleranciu a 7 % pre mutáciu T315I. 60 % pacientov začalo liečbu v dávke 45 mg denne, 38 % v dávke 30 mg denne a 2 % v dávke 15 mg denne. Po mediáne sledovania 12 mesiacov si 85 % pacientov zlepšilo liečebnú odpoveď a 10 pacientov dosiahlo hlbokú molekulovú odpoveď, celkové prežívanie bolo 100 %. Medzi najčastejšie nežiaduce účinky patrila elevácia lipázy (2 pacienti), kožné zmeny (5 pacientov) a trombocytopénia stupňa 3 (5 pacienti). V súbore sa nevyskytli žiadne trombotické príhody (42).
Odporúčaná iniciálna dávka ponatinibu je 45 mg 1× denne, avšak prebiehajú klinické štúdie (napr. OPTIC - Optimizing Ponatinib Treatment in ranging trial), ktoré majú za cieľ optimalizovať dávku za účelom zníženia rizika kardiovaskulárnych príhod (randomizácia do 3 ramien v dávke ponatinibu 45 mg vs 30 mg vs 15 mg 1× denne s možnosťou redukcie dávky na 15 mg denne v prípade dosiahnutia BCR/ABL IS ≤ 1 % v 12. mesiaci u pacientov v ramenách 30 a 45 mg denne) (43). Pred zahájením liečby sa odporúča dôsledné prehodnotenie kardiovaskulárneho rizika a ovplyvnenie možných rizikových faktorov (vysoký tlak krvi, hladina lipidov a cholesterolu v krvi atď.) za účelom zníženia rizika kardiovaskulárnych trombotických príhod. Na zváženie je preventívne podávanie antiagregačnej profylaxie kyselinou acetylsalicylovou.
Toxicita pri dlhodobej liečbe TKI
Liečba TKI je u väčšiny pacientov s CML dlhodobá a kontinuálna. Nežiadúce účinky dlhodobo podávanej terapie môžu spôsobiť opakované prerušovanie liečby, zhoršenie odpovede na TKI a nie zriedka pozorujeme aj závažnejšie komplikácie liečby TKI (tab. 3). Z dlhodobého hľadiska sa zdá byť najbezpečnejší imatinib, pri užívaní ktorého zatiaľ neboli pozorované vážnejšie prejavy toxicity.
Tab. 3. Odporúčania pre zváženie prerušenia liečby TKI (68) 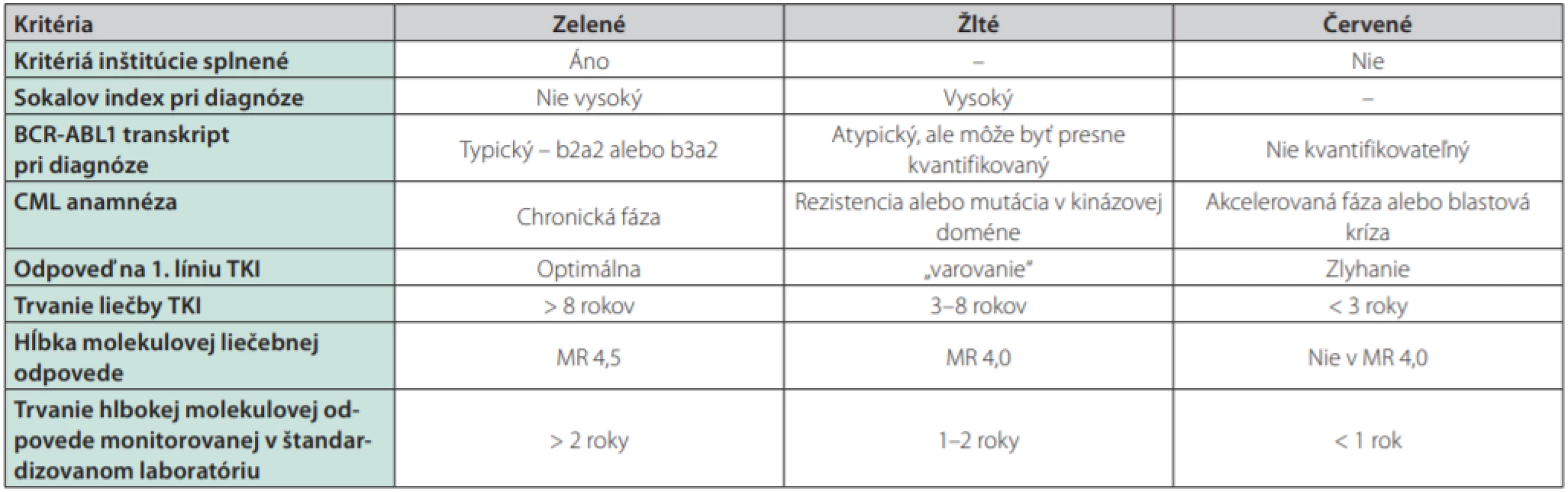
Najčastejším následkom dlhodobej liečby imatinibom môže byť zvýšenie kreatinínu v sére pacienta a zníženie glomerulárnej filtrácie (44). Ani po vyše 20 rokoch podávania imatinibu neboli pozorované závažné ireverzibilné nežiaduce účinky na rozdiel od TKI 2. a 3. generácie (dasatinib, nilotinib a ponatinib).
Medzi najčastejšie hematologické nežiadúce účinky liečby dasatinibom patrí anémia a trombocytopénia, ktoré sa pomerne dobre korigujú redukciou dávky alebo dočasným prerušením užívania lieku. Terapia dasatinibom sa môže u niektorých pacientov spájať so zvýšeným rizikom slizničného krvácania. Jeho príčinou môže byť okrem trombocytopénie aj zníženie funkcie krvných doštičiek podobné efektu kyseliny acetylsalicylovej (45). Liečbu dasatinibom by sme teda mali dôkladne zvážiť u pacientov užívajúcich antikoagulačnú alebo antiagregačnú liečbu. Z nehematologických účinkov patrí medzi najobávanejšie nežiaduce účinky vznik pleurálnych výpotkov a veľmi zriedkavý výskyt pľúcnej artériovej hypertenzie. Vo fáze III klinickej štúdie porovnávajúcej dasatinib a imatinib u novodiagnostikovaných pacientov s CML sa udáva 10 % (26/259) výskyt pleurálneho výpotku stupňa 1–2 u pacientov užívajúcich dasatinib (7). V 5-ročnom sledovaní pacientov v rámci fázy III štúdie DASISION sa udáva až 28 % výskyt pleurálneho výpotku pri dávkovaní 100 mg denne, pričom u pacientov starších ako 65 rokov sa pozoroval vyšší výskyt (28). Najmä u starších pacientov môže byť riziko vzniku pleurálneho výpotku vyššie aj v bežnej klinickej praxi, u väčšiny pacientov však ustúpia po prerušení alebo redukcii dávky, ale u symptomatických pacientov je nevyhnutné krátkodobé podávanie diuretík a kortikosteroidov. V publikácii Iurla et al z talianskych centier pre liečbu CML sa udáva 23% incidencia vzniku pleurálnych výpotkov u 853 pacientov liečených dasatinibom v štandardnej úvodnej dávke 100 mg denne u väčšiny pacientov, s mediánom času vzniku výpotku 16,6 mesiacov. 29,1 % pacientov muselo liečbu dasatinibom definitívne prerušiť (46). Medzi najzávažnejšie nežiaduce účinky dlhodobej liečby dasatinibom patrí pľúcna artériová hypertenzia, ktorá nemusí byť vždy reverzibilná (47). V štúdii DASISION sa pľúcna artériová hypertenzia vyskytovala len zriedkavo, u menej ako 3 % pacientov (28).
Zvýšené riziko artériových oklúzií sa spája s liečbou nilotinibom a ponatinibom (koronárna choroba srdca, cievne mozgové príhody, periférne artériové okluzívne ochorenie dolných končatín). U pacientov liečených bosutinibom, dasatinibom a imatinibom sa ischemické nežiaduce účinky nepozorovali. V klinickej štúdii PACE bola incidencia kardiálnych, mozgovo‑cievnych alebo periférnych artériových oklúzií u pacientov liečených ponatinibom 19 % po 12 mesiacoch a až 29 % po 24 mesiacoch podávania (48). Zvýšené riziko artériových oklúzií bolo najmä u starších pacientov, pacientov s artériovou hypertenziou, diabetom a anamnézou ischémie v minulosti. U pacientov po prekonaní akútneho infarktu myokardu alebo cievnej mozgovej príhody sa preto neodporúča liečba ponatinibom a v prípade vzniku ischemickej príhody počas liečby ponatinibom sa liečba musí prerušiť. V prípade nilotinibu bol pozorovaný zvýšený výskyt artériových oklúznych príhod v súvislosti s vyššou dávkou: v štúdii ENESTnd sa uvádza po 5 rokoch sledovania vyššia incidencia kardiovaskulárnych nežiaducich udalostí v ramenách s nilotinibom (6,8 % pri dávkovaní 300 mg 2× denne a 12,6 % pri dávkovaní 400 mg 2× denne) v porovnaní s imatinibom (2,1 %) v štandardnom dávkovaní 400 mg denne (49). Incidencia artériových oklúznych príhod sa zvyšuje so zvýšenou expozíciou nilotinibu a predpokladá sa viac ako 20 % po 10 rokoch liečby. Castagnetti et al z pracovnej skupiny GIMEMA udáva výskyt 13 trombotických artériových príhod u 12 pacientov zo súboru 130 pacientov po liečbe nilotinibom v 1. línii (35).
Vznik artériovej hypertenzie alebo zhoršenie hypertenzie už u liečeného hypertonika býva pomerne častým nežiaducim účinkom ponatinibu. Cortes et al uvádzajú 9% incidenciu hypertenzie po 12 mesiacoch liečby ponatinibom u pacientov, ktorým zlyhala liečba ostatnými TKI (48). U pacientov liečených ponatinibom so vznikom hypertenzie sa odporúča vylúčiť stenózu obličkovej tepny.
U pacientov liečených nilotinibom sa častejšie vyskytuje porucha metabolizmu glukózy, a to najmä u pacientov s rizikovými faktormi pre diabetes mellitus 2. typu. Ráčil et al predpokladá na základe analýzy súboru 51 pacientov liečených nilotinibom vznik inzulínovej rezistencie ako príčinu poruchy metabolizmu glukózy v tejto skupine pacientov (50). U 74,5 % pacientov došlo k signifikantnému zvýšeniu hladín glykémie nalačno po 3 a 12 mesiacoch liečby nilotinibom. U 72,5 % pacientov pozorovali zvýšenie hladiny inzulínu nalačno po 3 mesiacoch liečby nilotinibom a u 70,6 % pacientov došlo k zvýšeniu inzulínovej rezistencie. Liečba nilotinibom môže prispievať k vývoju metabolického syndrómu a tým zvyšovať riziko kardiovaskulárnych komplikácií. Pred a počas liečby nilotinibom sa preto odporúča pravidelné monitorovanie glykémií a u diabetikov sa, pokiaľ to je možné, odporúča zvoliť iný TKI. Počas liečby sa taktiež odporúča povzbudiť pacienta k primeranej fyzickej aktivite, redukcii hmotnosti v prípade nadváhy, pravidelnému meraniu tlaku krvi ako aj k racionálnej životospráve. Taktiež je v prípade liečby nilotinibom častým laboratórnym nálezom zvýšenie LDL cholesterolu. Vyšetrenie parametrov metabolizmu lipidov sa odporúča pred začatím liečby ako aj počas liečby týmto TKI 2. generácie.
Všetky TKI môžu spôsobiť eleváciu pankreatických enzýmov v závislosti na dávke preparátu. Najmä v prípade nilotinibu a ponatinibu treba byť obozretný a v prípade klinických príznakov akútnej pankreatitídy včas vyšetriť pankreatické enzýmy a zrealizovať zobrazovacie vyšetrenia (napr. CT vyšetrenie). Pri elevácii pankreatickej lipázy stupňa 3.–4. sa odporúča prerušenie liečby TKI až do úpravy stavu a následne je na zváženie obnovenie liečby nižšími dávkami. Pri rekurencii pankreatitídy je nevyhnutná zmena liečby na iný TKI. U pacientov s anamnézou pankreatitídy a/alebo nadmerného príjmu alkoholu sa neodporúča liečba nilotinibom. V prípade liečby bosutinibom sa môžeme u pacientov stretnúť s gastrointestinálnymi nežiaducimi účinkami (častý je výskyt hnačiek), ale problémom môže byť liekom indukovaná hepatitída, preto u pacientov s anamnézou hepatopatie sa odporúča pri jeho podávaní zvýšená opatrnosť.
U pacientov s CML nebola zatiaľ pozorovaná štatisticky významne zvýšená incidencia sekundárnych malígnych ochorení spájaných s liečbou TKI. V retrospektívnej analýze 1038 pacientov z registrov CAMELIA a INFINITY z centier Českej a Slovenskej republiky v rokoch 2000–2009 sa udáva výskyt sekundárnej malignity u 35 pacientov (3,37 %) pri liečbe TKI. Výskyt sekundárnych malignít u pacientov s CML pri liečbe TKI nebol štatisticky signifikantný v porovnaní s výskytom zhubných ochorení v bežnej populácii v Českej republike (6,76 vs. 9,84), hoci bol o niečo vyšší (51). Kolektív autorov z talianskej pracovnej skupiny pre CML (GIMEMA) zistil 5,8% incidenciu vzniku sekundárneho malígneho ochorenia u 514 pacientov s CML liečených imatinibom v 1. línii v mediáne sledovania 74 mesiacov, pričom nešlo o štatisticky významný rozdiel oproti výskytu malígnych ochorení v bežnej talianskej populácii (52). Sekundárne malígne ochorenia sú však vážnou komplikáciou liečby CML a zhoršujú prežívanie pacientov inak úspešnej liečených TKI.
Za účelom zníženia rizika možných nežiaducich účinkov dlhoročnej liečby TKI sa v klinickej praxi môže zvážiť redukcia dávky TKI u vybranej skupiny optimálne liečených pacientov. Aj na základe výsledkov niekoľkých publikovaných prác môžeme konštatovať, že mnohí pacienti si udržia optimálnu liečebnú odpoveď aj pri redukovaných dávkach TKI a deeskalácia dávky TKI je u pacientov v hlbokej molekulovej odpovedi bezpečná (53, 54).
Výber TKI v 1. a ďalšej línii liečby CML
V súčasnosti máme možnosť v súlade s aktuálne dostupnými odporúčaniami ELN z roku 2013 a ESMO z roku 2017 použiť v prvej línii liečby CML v chronickej fáze imatinib, dasatinib alebo nilotinib a odporúčania NCCN pred rok 2019 umožňujú v 1. línii použiť okrem imatinibu, dasatinibu a nilotinibu už aj bosutinib (14, 16, 55).
TKI 2. generácie (dasatinib, nilotinib a bosutinib) sa etablovali ako súčasť liečby CML 1. línie po roku 2010 na základe výsledkov klinických štúdií DASISION, ENESTnd a BFORE, ktoré potvrdili ich superioritu nad imatinibom u novodiagnostikovaných pacientov najmä v rýchlosti dosiahnutia cytogenetickej a molekulovej odpovede ako aj jej hĺbky (7, 9, 37).
Výber vhodného TKI závisí od veku pacienta, jeho pridružených ochorení, možných liekových interakcií, a v neposlednom rade od rizikového profilu pacienta a cieľa liečby (Obr. 2). V prípade mladšieho pacienta s menej priaznivými rizikovými ukazovateľmi pri stanovení diagnózy (napr. prídavné cytogenetické zmeny, zvýšené riziko akcelerácie ochorenia, akcelerovaná fáza CML, vysoké skóre podľa Sokala), ktorý nemá vážnejšie kardiologické alebo metabolické komorbidity sa môže už v 1. línii zvážiť liečba druhogeneračnými TKI (dasatinib, nilotinib alebo bosutinib) s cieľom rýchlejšieho dosiahnutia hlbokej molekulovej remisie. U pacientov stredného a vyššieho veku s komorbiditami alebo u mladších pacientov s nízkym rizikom akcelerácie a progresie ochorenia sa môže aj v ére druhogeneračných TKI zvážiť liečba imatinibom. Celkové prežívanie po 5 rokoch pri použití imatinibu, dasatinibu alebo nilotinibu je 85–95 % bez významnejšieho štatistického rozdielu voči imatinibu (23). Pacienti s vysokým skóre podľa Sokala pri diagnóze majú nižšiu pravdepodobnosť, že budú optimálne odpovedať na liečbu imatinibom v 1. línii (Obr. 3) (4, 56). Nilotinib nie je ideálnou voľbou TKI u novodiagnostikovaného pacienta s diabetom, hypercholesterolémiou a/alebo existujúcim artériovým ochorením pre nezanedbateľné riziko vzniku artériových obliterujúcich komplikácií (35, 49). Liečbu dasatinibom by sme mali dôkladne zvážiť u starších pacientov s chronickými ochoreniami pľúc a pleury z dôvodu zvýšeného rizika vzniku pleurálnych výpotkov, prípadne je na zváženie liečba nižšími dávkami (7, 28, 46).
Obr. 2. Schéma výberu TKI u novodiagnostikovaného pacienta s CML 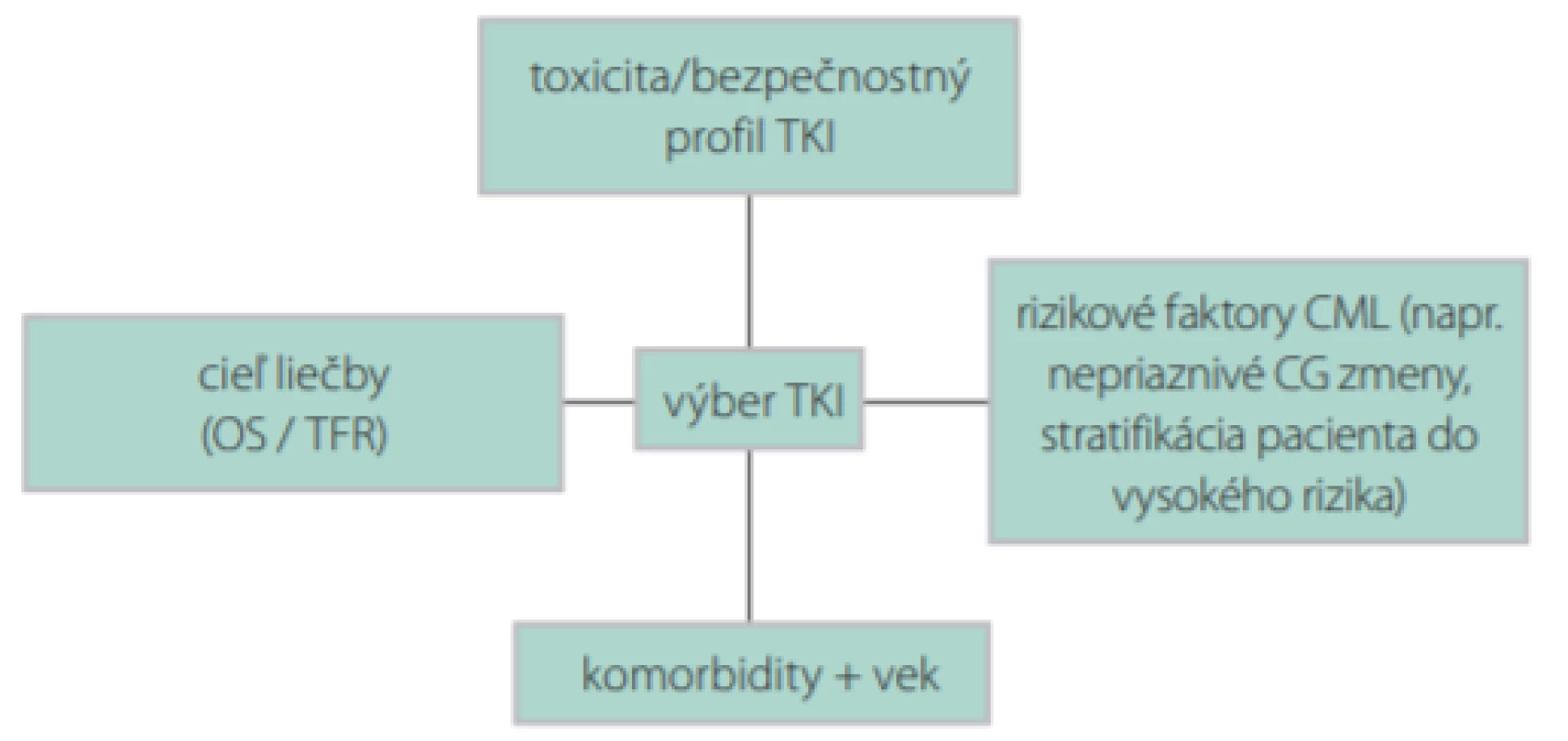
CG – cytogenetické
OS – celkové prežívanie
TFR – remisia bez liečby
TKI – inhibítory tyrozinkinázObr. 3. Horšia odpoveď na imatinib u pacientov s vysokým skóre podľa Sokala (4, 56). Údaje upravené podľa klinickej štúdie IRIS 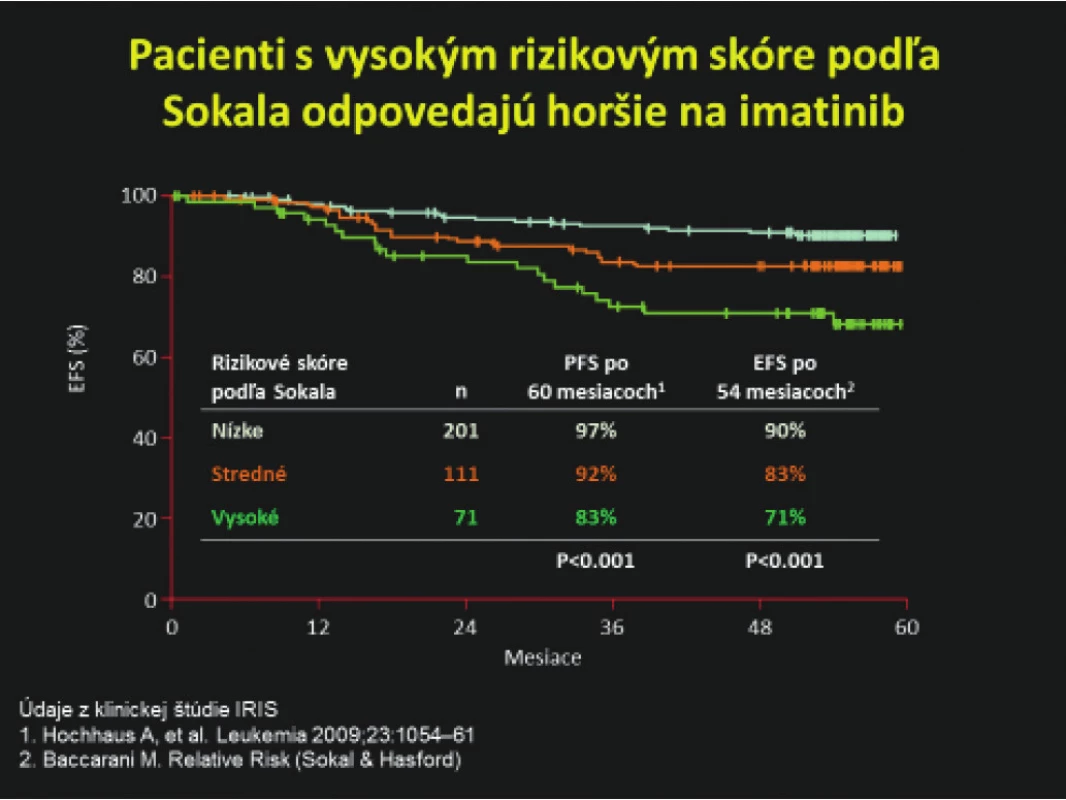
EFS – prežívanie bez udalosti
PFS – prežívanie bez progresieDôležitým míľnikom v liečbe TKI je miera poklesu BCR‑ABL1 transkriptu po 3 mesiacoch liečby. Toto vyšetrenie nám pomôže včas identifikovať skupinu pacientov, ktorí nemusia dosiahnuť optimálnu liečebnú odpoveď a zvážiť skôr zmenu na iný TKI. Jednou z prvých prác, ktoré sa zaoberali touto problematikou je aj práca kolektívu autorov Hemato‑onkologickej kliniky LF UP a FN v Olomouci, ktorí hodnotili hladinu molekulovej odpovede po 3 mesiacoch liečby imatinibom v štandardnej dávke 400 mg denne u 54 novodiagnostikovaných pacientov (57). Medián hladín BCR‑ABL1(IS) transkriptov bol u všetkých pacientov 4,354 (0,041–29,360). V práci sa potvrdili údaje z literatúry, že pacienti s hlbšou molekulovou odpoveďou po 3 mesiacoch liečby majú väčšiu pravdepodobnosť dosiahnuť kompletnú cytogenetickú remisiu po 12 mesiacoch liečby a lepšie prežívanie bez progresie (58). Hodnota BCR‑ABL1 (IS) po 3 mesiacoch liečby taktiež predpovedá následné dosiahnutie hlbokej molekulovej odpovede po 1 roku liečby.
U pacientov s rezistenciou na TKI v 1. línii sa výber ďalšej liečby riadi prítomnosťou mutácií v BCR/ABL doméne (tab. 2), dôkazom prídavných cytogenetických zmien v kostnej dreni, vekom pacienta a jeho súbežne prebiehajúcimi ochoreniami. Dôležité je pred zmenou liečby posúdiť compliance a toleranciu pacienta na TKI a vylúčiť nepravidelné užívanie liekov z jeho strany. U pacientov s chronickou obštrukčnou chorobou pľúc sa pokiaľ to je možné snažíme uprednostniť iný TKI než dasatinib a v prípade kardiologických ochorení dôkladne zvažujeme vhodnosť liečby nilotinibom a ponatinibom u starších pacientov s kardiovaskulárnymi rizikovými faktormi. Liečebnú odpoveď v 2. a vyššej línii opäť hodnotíme v pravidelných intervaloch podľa ELN odporúčaní (14).
Alogénna transplantácia krvotvorných buniek
Alogénna transplantácia krvotvorných buniek (TKB) predstavovala pred érou TKI jediný možný kuratívny prístup v liečbe pacientov s CML. Limitovaná však bola vekom pacienta (pacienti s vyšším vekom a pridruženými ochoreniami neboli vhodní kandidáti na TKB) a dostupnosťou HLA zhodného darcu. Prvá úspešná alogénna transplantácia kostnej drene u pacienta s CML bola realizovaná už v roku 1967 a išlo o transplantáciu od syngénneho darcu (59). Po roku 2002 zavedením imatinibu do liečby CML začínal počet pacientov transplantovaných pre CML v chronickej fáze významne klesať a v súčasnosti patrí CML medzi zriedkavé indikácie alogénnej TKB.
Craddock publikoval v roku 2018 indikačné kritériá pre zvažovanie alogénnej TKB u pacientov s CML: u pacientov v chronickej fáze sa odporúča zvážiť TKB pri zlyhaní TKI v 1. línii a významnej pravdepodobnosti neoptimálnej odpovede aj na TKI 2. línie; v prípade mutácie T315I ak pacient neodpovedá alebo zlyháva na liečbe ponatinibom a v prípade opakovaných cytopénií ťažkého stupňa, ktoré limitujú adekvátne dávkovanie TKI a neumožnia tak dosiahnuť u pacienta optimálnu liečebnú odpoveď (60). U pacientov v akcelerovanej a najmä v blastovej fáze je potrebné alogénnu TKB zvážiť včas u každého vhodného pacienta a čo najskôr realizovať HLA typizáciu pacienta a jeho súrodencov, a v prípade nedostupnosti HLA zhodného súrodenca začať vyhľadávanie nepríbuzného darcu v databáze registra darcov krvotvorných buniek. Alogénnu TKB sa v pokročilých štádiách CML odporúča realizovať až po dosiahnutí 2. chronickej fázy.
Problematika starších pacientov s CML
Medián veku pri diagnóze CML je na základe epidemiologických údajov 65 rokov (61). Vďaka úspešnej liečbe TKI sa predlžuje prežíva ‑ nie pacientov s CML, počet starších pacientov v ambulanciách hematológov sa zvyšuje a stúpajúci trend pozorujeme aj v prevalencii CML (Obr. 4). Problematika liečby starších pacientov s CML je preto veľmi aktuálna. U starších pacientov s CML sa častejšie v klinickej praxi stretávame s pridruženými ochoreniami, liekovými interakciami ako aj problémami s dodržiavaním liečebného režimu. Keďže liečba TKI je viazaná na klinické centrá (často vzdialené od miesta bydliska pacienta), môžu mať mnohí seniori problém dochádzať na pravidelné kontroly, čo zhoršuje spoluprácu pacienta pri liečbe a môže negatívne ovplyvniť jej výsledky.
Obr. 4. Prevalencia pacientov s CML liečených TKI k 20. 4. 2018 podľa analýzy registra CAMELIA SK 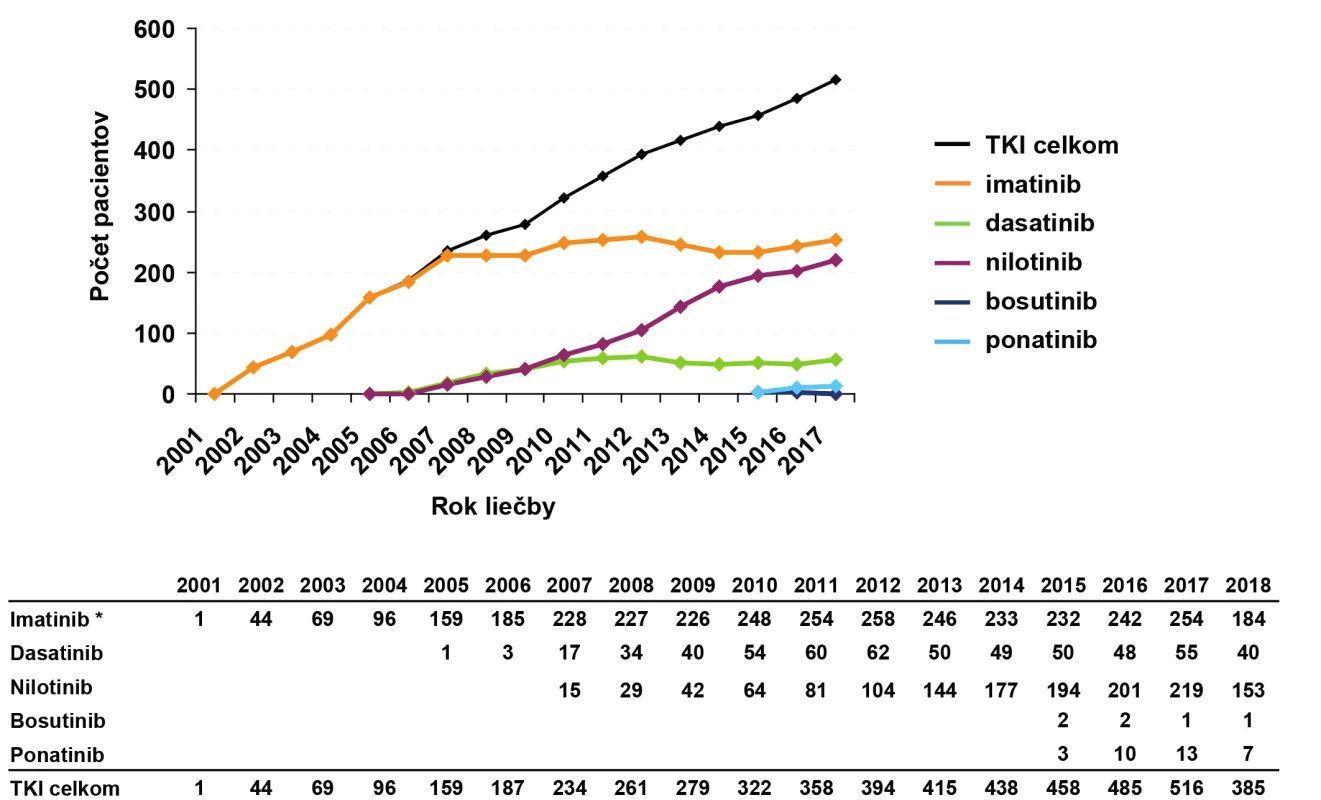
Pred érou TKI (pri liečbe chemoterapiou a interferónom) bol vyšší vek považovaný za nepriaznivý prognostický faktor (skóre podľa Sokala, Hasfordov index) (4). Starší pacienti boli diskriminovaní z možnosti alogénnej TKB. Starší pacienti a pacienti s pridruženými ochoreniami neboli zahrnutí do väčšiny klinických štúdií. S nástupom imatinibu do liečby CML začali pribúdať skúsenosti s liečbou starších pacientov TKI nielen v zahraničných centrách, ale aj v centrách v Českej a Slovenskej republike. Analýza 2 060 pacientov liečených imatinibom v 1. línii dokázala, že vyšší vek pacienta nezohráva takú dôležitú úlohu pri odhade prognózy a viedla k zavedeniu tzv. EUTOS skóre (uplatňuje percento bazofilov v náteri periférnej krvi a veľkosť sleziny) (62).
V retrospektívnej analýze výsledkov liečby pacientov s CML v registri CAMELIA sa nezistila horšia odpoveď na liečbu u starších pacientov ani pravdepodobnosť prežívania bez progresie nebola horšia v porovnaní s mladšími pacientami (63). Horšie výsledky mala menšia skupina pacientov (40 pacientov, 6,1 %), ktorí neboli liečení TKI v 1. línii: 25,2 % prežívanie po 5 rokoch vs. 88,9 %; p = 0,001. Kolektív autorov Bělohlávková et al nedokázal vplyv veku v čase diagnózy na dosiahnutie liečebnej odpovede u 103 pacientov s CML s mediánom veku 55 rokov liečených imatinibom (64). V skupine starších pacientov (35 pacientov s mediánom veku pri diagnóze 70 rokov) autori pozorovali častejší výskyt hematologickej toxicity (p = 0,0059) v porovnaní skupinou mladších pacientov (68 pacientov, medián veku pri diagnóze 43 rokov), no nedokázal sa štatisticky významný rozdiel horšej cytogenetickej a molekulovej odpovede v 12. a 18. mesiaci liečby (p = 0,1378 a p = 0,0974).
Vyšší vek by nemal byť prekážkou účinnej liečby TKI. Pred začatím liečby sa odporúča komplexné klinické vyšetrenie staršieho pacienta v spolupráci s internistami za účelom posúdenia pridružených ochorení a prevencie možných kardiovaskulárnych a metabolických komplikácií (najmä v prípade nilotinibu a ponatinibu) a liekových interakcií. Nevyhnutné je posúdiť aj sociálnu situáciu pacienta. Odopretie TKI staršiemu pacientovi zhoršuje jeho prognózu a skracuje prežívanie.
U starších pacientov sa zistil častejší výskyt prejavov hematologickej toxicity liečby TKI. Potrebné je preto zvážiť včas redukciu dávky TKI, aby sa znížilo riziko možnej hematologickej toxicity závažnejšieho stupňa. V prípade liečby imatinibom môžeme u starších pacientov častejšie očakávať zníženie glomerulárnej filtrácie, čo sa prejavuje zvýšenými hodnotami kreatinínu v sére - v tomto prípade môže byť opäť riešením včasná redukcia dávky a zvýšenie príjmu tekutín u pacienta. Z dlhodobého hľadiska možných neskorých komplikácií liečby sa najmä u starších pacientov zdá imatinib bezpečnejšou voľbou pri výbere iniciálnej liečby v porovnaní s TKI 2. generácie nilotinibom, kde je aj v kombinácií s ďalšími rizikovými faktormi kardiovaskulárnych chorôb (fajčenie, vysoký tlak krvi etc.) vyššie riziko vzniku artériových oklúzií (ischemická choroba dolných končatín, koronárna choroba) a hyperglykémií.
Interferón α v liečbe CML
Interferón α (IFNα) preukázal aktivitu pri liečbe mnohých onkologických ochorení a myeloidných neoplázií už v 70.–80. rokoch 20. storočia. V liečbe CML sa IFNα začal používať od roku 1981. Ako štandardná liečba CML bol odsúhlasený až po roku 1995 na základe výsledkov viacerých randomizovaných štúdií, ktoré preukázali lepšie prežívanie pri liečbe IFNα v porovnaní s konvenčnou chemoterapiou (65).
Po roku 2001 sa prvolíniová liečba IFNα nahradila imatinibom. V súčasnosti prebiehajú štúdie, ktoré sa zaoberajú kombináciou imatinibu s IFNα za účelom zlepšenia trvácnosti cytogenetických a molekulových odpovedí. Podstatou účinku je odlišný mechanizmus účinku oboch liekov, a tak sa od tejto kombinácie očakáva synergický alebo aditívny efekt. Taktiež prebiehajú klinické štúdie s pacientami s intoleranciou alebo rezistenciou na imatinib, ktorí by profitovali s konsolidačnej alebo udržiavacej liečby IFNα.
V súčasnosti má IFNα najdôležitejšie miesto v manažmente plánovania gravidity u pacientiek s CML. IFNα neprechádza placentárnou bariérou. Podľa doterajších skúseností je bezpečný v 2. a 3. trimestri gravidity (66). V 1. trimestri gravidity sa v prípade nevyhnutnej liečby (napr. významná leukocytóza nad 100 × 109 /l alebo trombocytóza nad 500 × 109 /l) odporúča zvážiť skôr leukaferéza, ktorá nemá negatívny vplyv na organogenézu a priebeh gravidity, hoci v štúdiách na zvieratách sa mutagénny a teratogénny vplyv IFNα nepozoroval. Gravidita pacientok s CML by mala byť plánovaná: v prípade kompletnej hematologickej a molekulovej remisie je možné liečbu TKI dočasne prerušiť z dôvodu želanej gravidity. V prípade suboptimálnej liečebnej odpovede a želania gravidity zo strany pacientky je na zváženie podávanie IFNα. Dojčenie sa počas liečby TKI a IFNα neodporúča.
Prerušenie alebo ukončenie liečby TKI u pacientov v hlbokej molekulovej remisii
Vďaka úspešnej liečbe TKI sa dožívajú pacienti s CML priemernej dĺžky života podobnej zdravej populácii. Dôležité je preto zohľadniť otázku kvality života, etické a ekonomické aspekty dlhodobej (až doživotnej) terapie TKI. Možnosť tzv. TFR (treatment free remission, v preklade remisia bez liečby) môže znížiť morbiditu spôsobenú toxicitou TKI a ekonomické náklady na finančne nákladnú terapiu. Problematika možného prerušenia liečby TKI je veľmi aktuálna a bola predmetom viacerých klinických štúdií (napr. STIM1, EURO‑SKI). V štúdii STIM1 bola TFR po 60 mesiacoch prerušenia liečby imatinibom u 100 pacientov 38 % (Obr. 5) (11). Kritériom opätovného začatia liečby bola strata hlbokej molekulovej remisie alebo zvýšenie BCR‑ABL1 transkriptov o ≥ 1 logaritmus. V najväčšej klinickej štúdii zaoberajúcej sa TFR EURO‑SKI (755 pacientov liečených imatinibom, dasatinibom a nilotinibom) si 50 % pacientov udržalo TFR po 24 mesiacoch prerušenia liečby (12). Podmienkou prerušenia liečby bola hlboká molekulová remisia na úrovni MR4, ktorá trvala viac ako 12 mesiacov. Kritériom opätovného začatia liečby bola strata hlbokej molekulovej remisie. Dostupné sú už prvé výsledky klinických štúdií zaoberajúcich sa prerušením liečby TKI 2. generácie nilotinibom a dasatinibom, od ktorých sa očakáva hlbšia a trvácnejšia molekulová remisia ako pri imatinibe, ktorá je predpokladom TFR. V multicentrickej observačnej štúdii STOP 2G‑TKI si udržalo TFR po 48 mesiacoch sledovania 53,7 % zo 60 analyzovaných pacientov liečených dasatinibom alebo nilotinibom (Obr. 6). Horšie výsledky sa pozorovali u pacientov s predchádzajúcou suboptimálnou odpoveďou na imatinib. Všetci pacienti s molekulovým relapsom dosiahli po opätovnom zahájení liečby opäť hlbokú molekulovú remisiu (13). V klinickej štúdii D‑STOP si udržalo TFR po 24 mesiacoch prerušenia liečby 57 % pacientov liečených dasatinibom (67).
Obr. 5. Prežívanie bez molekulového relapsu po prerušení liečby imatinibom (11) 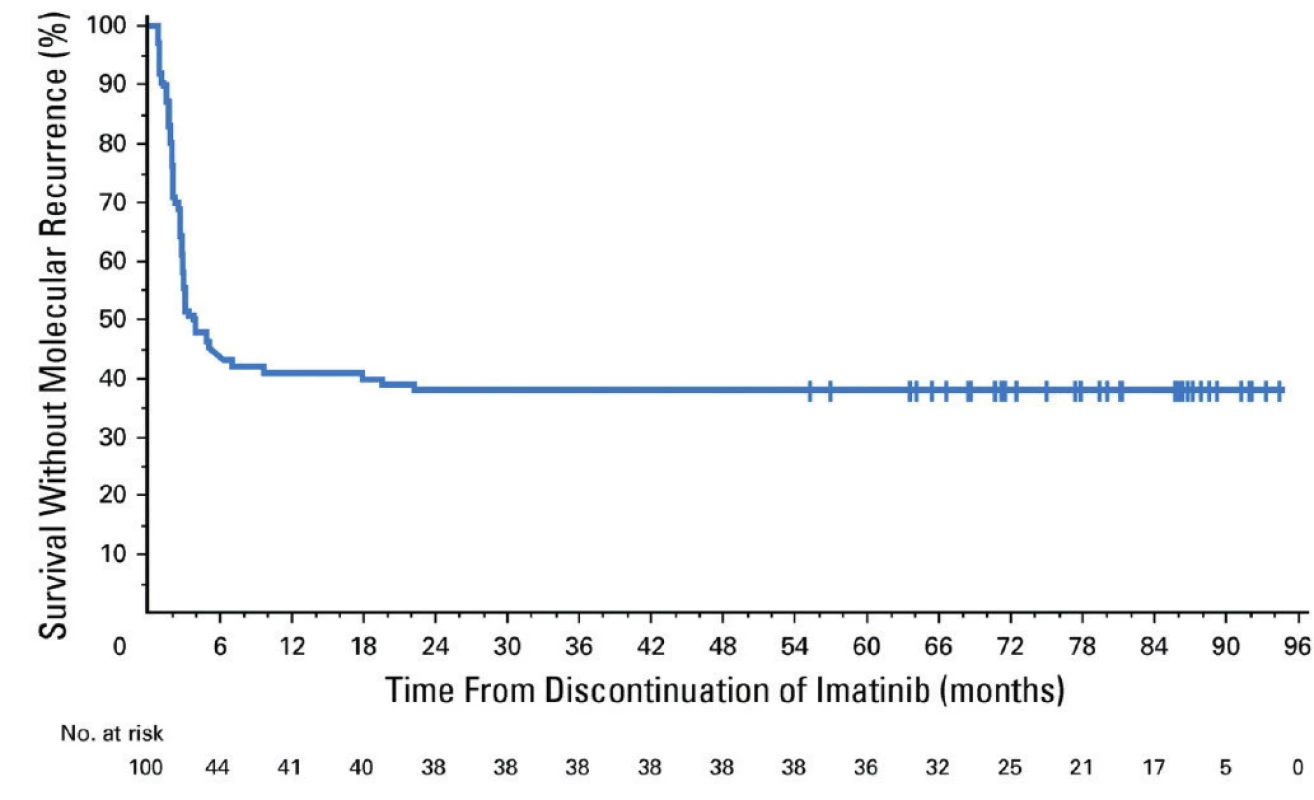
Obr. 6. Molekulové relapsy a TFR po prerušení liečby TKI 2. generácie (13) 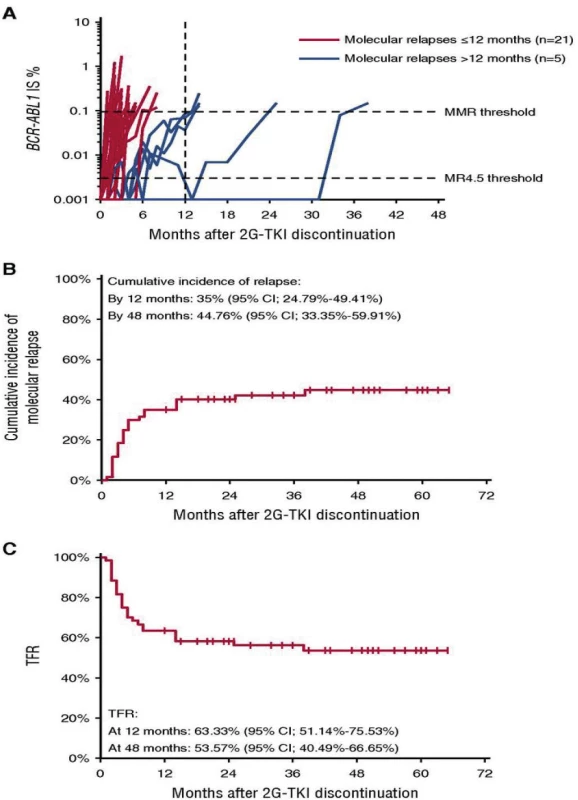
TFR – remisia bez liečby
2G-TKI – inhibítory tyrozinkináz 2. generácieNajdôležitejším kritériom možného prerušenia liečby TKI je dlhodobá, trvalá a zachovaná hlboká molekulová odpoveď (Tab. 4) (68). Počas prerušenia liečby TKI sa odporúča pravidelné molekulové monitorovanie RT‑qPCR. V klinických štúdiách boli pacienti monitorovaní v mesačných intervaloch počas prvých 6–12 mesiacoch a následne v 3-mesačných intervaloch. Najmä počas prvých 6 mesiacov sa odporúča pravidelné časté monitorovanie, keďže práve počas tohto obdobia boli zistené molekulové relapsy najčastejšie. U pacientov s atypickým BCR‑ABL1 transkriptom sa prerušenie liečby TKI neodporúča z dôvodu problematického molekulového monitorovania a rizika neskorého odhalenia relapsu. Podmienkou adekvátneho monitorovania pacienta po prerušení liečby TKI je úzka spolupráca hematológa s laboratóriom molekulovej genetiky a včasné doručenie výsledku (do 2–3 týždňov), aby pacient v prípade zisteného molekulového relapsu mohol opäť včas začať liečbu. Kľúčová je taktiež adherencia, edukácia a ochota pacienta dochádzať na časté kontroly do centier pre liečbu CML. Niektorí pacienti môžu prerušenie liečby vnímať negatívne a s obavami z možného relapsu leukémie a preto by mal byť výber vhodného pacienta veľmi starostlivý.
V klinickej štúdii EURO‑SKI boli u viacerých pacientov po prerušení liečby imatinibom hlásené muskuloskeletálne bolesti, ktoré sa objavili zvyčajne 1–6 týždňov po ukončení podávania imatinibu (69).
TFR sa stáva reálnou nádejou na úspešné prerušenie liečby u približne 40–60 % pacientov a posúva tak ďalej ciele terapie od doživotného užívania TKI k možnému ukončeniu liečby. Pri starostlivom výbere pacientov a pravidelnom molekulovom monitorovaní sa zdá byť prerušenie liečby TKI na základe dostupných výsledkov klinických štúdií bezpečné a aplikovatelné aj v klinickej praxi. V roku 2016 boli publikované jedny z viacerých odporúčaní, ktoré môžu byť akýmsi „návodom“ pri zvažovaní prerušenia liečby TKI u vhodných pacientov (68).
Záver
Ešte pred vyše 3 desaťročiami bola CML fatálnym ochorením s mediánom prežívania 4–6 rokov, s progresiou do blastovej fázy, ktorej prognóza je krajne nepriaznivá. Vývoj liečebných možností od alogénnych transplantácií krvotvorných buniek v 90. rokoch 20. storočia smerom k cielenej terapii TKI po roku 2000 spôsobil prevrat v liečebnej stratégii, keďže zásadne došlo k predĺženiu celkového prežívania ako aj k zlepšeniu prognózy pacientov. V súčasnej modernej ére liečby CML dochádza len zriedka k progresii ochorenia do blastovej krízy, väčšina pacientov veľmi dobre reaguje na TKI, no problémom môže byť vznik nežiaducich účinkov dlhodobo podávanej terapie, ktoré môžu v niektorých prípadoch limitovať adekvátne dávkovanie liekov.
Na základe odporúčaní odborných spoločností ELN z roku 2013, ESMO z roku 2017 a NCCN pre rok 2019 máme možnosť v 1. línii liečby zvážiť u novodiagnostikovaného pacienta imatinib, dasatinib, nilotinib alebo bosutinib (14, 16, 55). Výber TKI závisí od stratifikácie rizika CML u individuálneho pacienta, jeho veku, komorbidít ako aj profilu nežiaducich účinkov zvažovaného TKI. Imatinib je lacnejší než druhogeneračné TKI a k dispozícii sú už generiká imatinibu, ktoré môžu znížiť ekonomické náklady na inak finančné náročnú dlhodobú terapiu v mnohých krajinách.
Výzvou do budúcnosti je veľmi aktuálna problematika možnosti tzv. TFR, ktorá je nádejou aj pre mnohých pacientov s CML na možné vyliečenie ochorenia bez užívania TKI.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Katarína Slezáková, PhD.,
Klinika hematológie a transfuziológie LF UK, SZU a UN,
Antolská 11,
851 07 Bratislava
Cit. zkr: Vnitř Lék 2020; 66(4): 214–224
Článek přijat redakcí: 20. 11. 2018
Článek přijat k publikaci: 26. 4. 2019
Zdroje
1. O’Brien S, Berman E, Moore JO et al. NCCN Task Force report: tyrosine kinase inhibitor therapy selection in the management of patients with chronic myelogenous leukemia. J Natl Compr Cancer Netw 2011; 9: (Suppl. 2): S1–S25.
2. Hehlmann R, Hochhaus A, Baccarani M European Leukemia Net. Chronic myeloid leukaemia. Lancet 2007; 370 : 342–350.
3. Bower H, Björkholm M, Dickman PW et al. Life expectancy of patients with chronic myeloid leukemia approaches the life expectancy of the general population. J Clin Oncol 2016; 34 : 2851–2857.
4. Sokal JE, Cox EB, Baccarani M et al. Prognostic discrimination in „good‑risk“ chronic granulocytic leukemia. Blood 1984; 63 : 789–799.
5. Žáčková D Tyrozinkinázové inhibitory v léčbě starších pacientů s chronickou myeloidní leukémií - editorial. Vnitř Lék 2015; 61 : 760–761.
6. Hochhaus A, Larson RA, Guilhot MD et al. Long‑Term Outcomes of Imatinib Treatment for Chronic Myeloid Leukemia. N Engl J Med 2017; 376 : 917–927.
7. Kantarjian H, Shah NP, Hochhaus A et al. Dasatinib versus imatinib in newly diagnosed chronic‑phase chronic myeloid leukkemia. N Engl J Med 2010; 362 : 2260–2270.
8. Hehlmann R, Lauseker M, Saußele S et al. Assesment of imatinib as first‑line treatment of chronic myeloid leukemia: 10-year survival results of the randomized CML study IV and impact of non‑CML determinants. Leukemia 2017; 31 : 2398–2406.
9. Kantarjian HM, Giles F, Bhalla K et al. Nilotinib is effective in patients with chronic myeloid leukemia in chronic phase after imatinib resistance or intolerance: 24-month follow‑up results. Blood 2011; 117 : 1141–114.
10. Klamová H, Žižková H, Burda P et al. Současné trendy v léčbě a diagnostice chronické myeloidní leukemie. Transfuze Hematol dnes 2017; 23: (Suppl. 1): S34–S46.
11. Etienne G, Guilhot J, Rea D et al. Long‑Term Follow‑Up of the French Stop Imatinib (STIM1) Study in Patients With Chronic Myeloid Leukemia. J Clin Oncol 2017; 35 : 298–305.
12. Saussele S, Richter J, Gilhot J et al. Discontinuation of tyrosine kinase inhibitor therapy in chronic myeloid leukaemia (EURO‑SKI): a prespecified interim analysis of a prospective, multicentre, non‑randomised, trial. Lancet Oncol 2018; 19 : 747–757.
13. Réa D, Nicolini FE, Tulliez M et al. Discontinuation of dasatinib or nilotinib in chronic myeloid leukemia: interim analysis of the STOP 2G‑TKI study. Blood 2017; 129 : 846–854.
14. Baccarani M, Deininger MW, Rosti G et al. European LeukemiaNet Recommendations for the management of chronic myeloid leukemia 2013. Blood 2013; 122 : 872–884.
15. Alhuraiji A, Kantarjian H, Boddu P et al. Prognostic significance of additional chromozomal abnormalities at the time of diagnosis in patients with chronic myeloid leukemia treated with frontline tyrosine kinase inhibitors. Am J Hematol. 2018; 93 : 84–90.
16. Radich JP, Deininger M, Abboud CN et al. Chronic Myeloid Leukemia, Version 1.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Vanc Netw 2018; 16 : 1108–1135.
17. Cohen MH, Williams G, Johnson G et al. Approval summary for imatinib mesylate capsules in the treatment of chronic myelogenous leukemia. Clin Cancer Res 2002; 8 : 935–942.
18. Guilhot J, Baccarani M, Clark RE et al. Definitions, methodological and statictical issues for phase 3 clinical trials in chronic myeloid leukemia: a proposal by the European Leukemia Net. Blood 2012; 119 : 5963–5971.
19. Hehlman R, Berger U, Pfirrmann M et al. Drug treatment is superior to allografting as first‑line therapy in chronic myeloid leukemia. Blood 2007; 109 : 4686–4692.
20. Gratwohl A, Pfirrmann M, Zander A et al. Long‑term outcome of patients with newly diagnosed chronic myeloid leukemia: a randomized comparison of stem cell transplantation with drug treatment. Leukemia 2016; 30 : 562–569.
21. Westin JR, Kurzrock R It’s about time: lessons for solid tumors from chronic myelogenous leukemia therapy. Mol Cancer Ther 2012; 11 : 2549–2555.
22. Mayer J, Klamová H, Žáčková D et al. Imatinib v první linii léčby nemocných s nově diagnotikovanou chronickou myeloidní leukemií v chronické fázi. Transfuze Hematol dnes 2008; 14 : 150–158.
23. Hughes T, White D Which TKI? An embarrassment of riches for chronic myeloid leukemia patients. Hematology 2013; 2013 : 168–175.
24. O’Brien SG, Guilhot F, Larson RA et al. Imatinib compared with interferon and low‑dose cytarabine for newly diagnosed chronic‑phase chronic myeloid leukemia. N Engl J Med 2003; 348 : 994–1004.
25. Breccia M, Cannella L, Frustraci A et al. Pleural‑pericardial effusion as uncommon complication in CML patients treated with Imatinib. Eur J Haematol 2005; 74 : 89–90.
26. Hochhaus A, Baccarani M, Deininger M et al. Dasatinib induces durable cytogenetic responses in patients with chronic myelogenous leukemia in chronic phase with resistance or intolerance to imatinib. Leukemia 2008; 22 : 1200–1206.
27. Shah NP, Kim DW, Kantarjian H et al. Potent, transient inhibition of BCR‑ABL with dasatinib 100 mg daily achieves rapid and durable cytogenetic responses and high transformation‑free survival rates in chronic phase chronic myeloid leukemia patients with resistance, suboptimal response or intolerance to imatinib. Haematologica 2010; 95 : 232–240.
28. Cortes JE, Saglio G, Kantarjian HM et al. Final 5-year study results of DASISION: The dasatinib versus imatinib study in treatment‑naïve chronic myeloid patients trial. J Clin On ‑ col 2016; 34 : 2333–2340.
29. Breccia M, Stagno F, Luciano L et al. Dasatinib first‑line: Multicentric Italian experience outside clinical trials. Leuk Res 2016; 40 : 24–29.
30. Shah NP, Rousselot P, Schiffer Ch et al. Dasatinib in imatinib‑resistant or intolerant chronic‑phase, chronic myeloid leukemia patients: 7-year follow‑up of study CA180-034. Am J Hematol 2016; 91 : 869–874.
31. Saglio G, Kim DW, Issaragrisil S et al. Nilotinib verzus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med 2010; 362 : 2251–2259.
32. Saglio G, Hochhaus A, Hughes TP et al. ENESTnd Update: nilotinib (NIL) vs imatinib(IM) in patients (PTS) with newly diagnosed chronic myeloid leukemia in chronic phase (CML‑CP) and the impact of early molecular response (EMR) and Sokal risk at diagnosis on long‑term outcomes. Blood 2013; 122: abstract 92.
33. Hughes TP, Saglio G, Kantarjian HM et al. Early molecular response predicts outcomes in patients with chronic myeloid leukemia in chronic phase treated with frontline nilotinib or imatinib. Blood 2014; 123 : 1353-1360.
34. Hochhaus A, Saglio G, Larson RA et al. Nilotinib is associated with a reduced incidence of BCR‑ABL mutations vs imatinib in patients with newly diagnosed chronic myeloid leukemia in chronic phase. Blood 2013; 121 : 3703–3708.
35. Castagnetti F, Breccia M, Gugliotta G et al. Nilotinib 300 mg twice daily: an academic single‑arm study of newly diagnosed chronic phase chronic myeloid leukemia patients. Haematologica 2016; 101 : 1200–1207.
36. Cortes JE, Kantarjian HM, Brümmendorf TH et al. Safety and efficacy of bosutinib (SKI606) in chronic phase Philadelphia chromosome‑positive chronic myeloid leukemia patients with resistance or intolerance to imatinib. Blood 2011; 118 : 4567–4576.
37. Cortes JE, Gambacorti‑Passerini C, Deininger MW et al. Bosutinib versus imatinib for newly diagnosed chronic myeloid leukemia: results from the randomized BFORE trial. J Clin Oncol 2018; 36 : 231–237.
38. Cortes JE, Khoudry HJ, Kantarjian HM et al. Long‑term bosutinib for chronic phase chronic myeloid keukemia after failure of imatinib plus dasatinib and/or nilotinib. Am J Hematol 2016; 91 : 1206-1214.
39. O’Hare T, Shakespeare WC, Zhu X et al. AP24534, a pan‑BCR/ABL inhibitor for chronic myeloid leukemia, potently imhibits the T315I mutant and overcomes mutation‑based resistance. Cancer Cell 2009; 16 : 401–412.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Hyperurikemie z perspektivy nefrologického pacienta
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



