-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hyperurikemie z perspektivy nefrologického pacienta
Hyperuricemia in renal disease patients
Hyperuricemia is a common laboratory finding in different types of patients. Except of those with acute or chronic gout, it is frequently found in patients with metabolic syndrome, patients with malignancies or renal impairment – acute kidney injury (AKI) and chronic kidney disease (CKD). Hyperuricemia might cause renal dysfunction or might be a part of laboratory abnormalities associated with loss of renal function as well. There is also large body of evidence of hyperuricemia as a potential cardiovascular (CV) risk factor, which might even more increase CV risk in CKD patients. Association of asymptomatic hyperuricemia and progression of CKD remaines controversial, as well as indication for hypouricemic treatment in this clinical setting.
Keywords:
Uric acid – acute kidney injury (AKI) – cardiovascular risk – hyperuricemia – chronic kidney disease (CKD)
Autoři: Štěpán Bandúr
Působiště autorů: I. interní klinika 3. LF UK a FN Královské Vinohrady Praha
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 259-266
Kategorie: Diferenciálně-diagnostické okénko aneb na co se vás mohou zeptat u atestace
Souhrn
Hyperurikemie představuje častý laboratorní nález u pacientů s různými onemocněními. Kromě pacientů s akutními či chronickými formami dny ji nacházíme často u obézních pacientů s metabolickým syndromem, nádorovým onemocněním, ale také u pacientů s renální dysfunkcí – ať už s akutním renálním poškozením (AKI) nebo s chronickým onemocněním ledvin (CKD). Hyperurikemie může být jak příčinou, tak i následkem snížení renální funkce. Je zodpovědná za akutní i chronické formy renálních onemocnění a nepříznivě zřejmě také ovlivňuje kardiovaskulární riziko, u pacientů s renální dysfunkcí již tak zvýšené. Nevyjasněným zůstává vztah hyperurikemie a progrese chronického onemocnění ledvin, a tedy i potencionálně významná indikace k léčbě tzv. asymptomatické hyperurikemie.
Klíčová slova:
akutní renální poškození (AKI) – hyperurikemie – chronické onemocnění ledvin (CKD) – kardiovaskulární riziko – kyselina močová
Úvod
Je všeobecně známo, že u člověka představuje kyselina močová konečný produkt metabolismu endogenních i exogenních purinů. Je také již více než 150 let znám kauzální vztah hyperurikemie a onemocnění především kloubů a měkkých tkání, tedy dnou. Alfred Baring Garrod byl tím, kdo v roce 1848 prokázal přítomnost kyseliny močové v krvi u pacientů s akutním dnavým záchvatem a jako první postuloval etiologickou souvislost těchto dvou nálezů (1).
0–25 %. Dnou trpí přibližně 5,9 % mužů a 2 % žen (2). V celosvětovém měřítku lze sledovat jednoznačný trend vzestupu prevalence hyperurikemie a komplikací s ní souvisejících, včetně výrazných ekonomických dopadů. Tyto problémy jsou způsobeny stárnutím populace a masovým rozšířením rizikových faktorů hyperurikemie, tedy obezity, zvýšeným dietním příjem purinů, sacharidy slazených nápojů a alkoholu (3–5).
Patofyziologie
Kyselina močová je slabá kyselina (pKa = 5,75), relativně dobře rozpustná v plazmě, volně filtrovatelná v glomerulech do primární moči. Kyselina močová vzniká přeměnou xantinu a hypoxantinu enzymem xantinoxidázou (oxidoreduktázou). U lidí, respektive primátů, došlo během evoluce ke ztrátové mutaci v genu kódujícím enzym urikázu (urátoxidázu), a proto nedochází k její další přeměně na hydrofilnější, tedy ve vodě rozpustnější, alantoin (6, 7). Právě následky tohoto pozoruhodného evolučního fenoménu budou obsahem předkládaného textu.
K výše zmíněné mutaci došlo zřejmě ve 2 krocích – jednak v oblasti promotoru a dále v exonech 3 a 5, jejichž výsledkem je úplná ztráta příslušné enzymatické aktivity (6). Otázkou je, jaký evoluční význam tato ztrátová mutace měla mít. Lze spekulovat o protektivním významu z hlediska poškození buněk oxidativním stresem (8, 9), případně o novém nastavení fyziologického krevního tlaku na vyšší hodnoty za podmínek diety s nízkým obsahem NaCl (10) či o souvislosti s evolučně novou, vzpřímenou polohou těla primátů (11). Je také nepochybně významným faktem fyziologicky více než 50násobně vyšší urikemie u člověka ve srovnání s jinými savci (12).
Kyselina močová je vylučována především glomerulární filtrací, přičemž v prostředí fyziologického pH moči (5–6,5) je tato, z důvodů diskutovaných níže, méně rozpustná než v plazmě (13). 2/3 množství kyseliny močové přítomné v extracelulárním kompartmentu představuje urát vytvořený endogenní produkcí. Zdrojem zbývající 1/3 urátu je kyselina močová vzniklá metabolismem v dietě obsažených purinů.
Vylučování kyseliny močové je z 30 % zajišťováno gastrointestinálním traktem (vč. biliární exkrece) a ze 70 % ledvinami (14). Již nyní je možno v souvislosti s nefrologickým zaměřením předkládaného textu konstatovat, že podíl střevní eliminace urátu signifikantně roste u pacientů s chronickým onemocněním ledvin (chronic kidney disease – CKD). Sérová koncentrace kyseliny močové těsně koreluje s úrovní její renální exkrece.
Než budou podrobněji popsány mechanismy zodpovědné za eliminaci urátu ledvinami, je nutno připomenout z klinického hlediska velmi praktický postulát, a sice že snížená exkrece kyseliny močové ledvinami je příčinou většiny (60 %) případů hyperurikemie.
Na vylučování urátu ledvinami se podílejí 4 základní procesy:
- glomerulární filtrace,
- tubulární reabsorbce,
- tubulární sekrece,
- postsekretorická tubulární reabsorbce, vše dominantně probíhající v proximálním tubulu (15)
Z celkového profiltrovaného množství urátu je v proximálním tubulu reabsorbováno 98–100 % a následně je 6–10 % do tubulu secernováno a tedy definitivně vyloučeno.
Přehled transportních mechanismů, které se na těchto procesech účastní, je shrnut v Tab. 1. Jejich aktivitu ovlivňuje celá řada vnějších faktorů – především farmakoterapie a objem extracelulární tekutiny, tedy klinicky vzato, stav hydratace pacienta. Hodnotu urikemie do značné míry ovlivňují také genetické faktory, přičemž heritabilita (dědivost) urikemie je odhadována až na 40 % (16). Doposud bylo popsáno více než 25 genů, respektive jejich jednonukleotidových polymorfismů (single nucleotide polymorphisms – SNPs), které se podílejí na regulaci urikemie (17).
Tab. 1. Hlavní transportní mechanismy pro kyselinu močovou 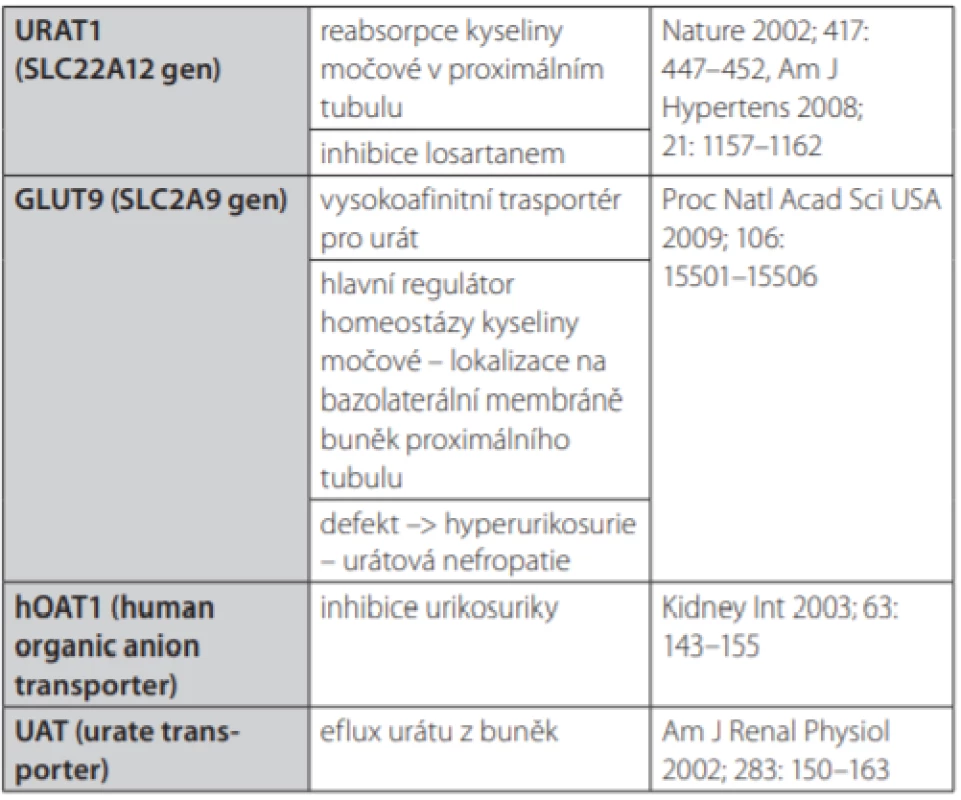
Zřejmě nejdůležitější transportní mechanismus představuje transportér organických aniontů URAT1 (Solute carrier family 22; OMIM – *607096) lokalizovaný na apikální straně buněk proximálního tubulu (18). Tento transportér je především zodpovědný za reabsorpci urátu v proximálním tubulu a jeho inaktivace (inaktivační mutace genu pro URAT1) lokalizovaného na chromozomu 11 (11q13) je zodpovědná za rozvoj vzácného onemocnění zvaného idiopatická renální hypourikemie. Tato choroba je charakterizována abnormálně nízkou urikemií způsobenou zvýšeným vylučováním urátu močí (19).
V následující, klinické části textu bude podrobněji zkoumána asociace hyperurikemie a „kardiorenální“ problematiky. Jak však může hyperurikemie vést ke kardiovaskulárnímu či renálnímu onemocnění? Z doposud popsaných mechanismů tkáňového poškození urátem lze jmenovat oxidativní stres způsobený volnými kyslíkovými radikály vznikajícími působením xantinoxidázy (20, 21), přímé působení endoteliální dysfunkce (22), respektive prozánětlivé působení urátu, zejména u pacientů s chronickou tofózní dnou, u kterých byl tento zánětlivý stav asociován se zvýšenou mortalitou (23).
Opakovaně bude v souvislosti s hyperurikemií akcentován význam indukce zánětu. V této souvislosti stojí za připomenutí patofyziologický mechanismus vzniku zánětu u dnavé artritidy. Dle současných znalostí jsou krystaly nátriumurátu schopny aktivace intracelulárního makromolekulárního proteinového komplexu zvaného kryopyrinový inflamasom (NALP3) (OMIM 606416 – http://omim.org/entry/606416). Výsledkem této interakce je produkce prozánětlivých cytokinů, zejména interleukinu 1(IL1) a interleukinu 18 (IL18) (24, 25). C terminální, tzv. CARD doména tohoto proteinu aktivuje enzymy zvané kaspázy (CASP1, CASP5). Tyto zároveň s dalšími intracelulárními proteiny (ASC a dalšími) vedou ke vzniku makromolekulárního komplexu, který je schopen štěpit inaktivní prekurzor proIL1B na aktivní formu cytokinu IL1B, který je zodpovědný za rozvoj lokálního zánětu měkkých tkání (26).
Patobiochemie
Kyselina močová (2,6,8-trihydroxypurin) je díky své disociační konstantě (pKa = 5,75) za fyziologického pH extracelulární tekutiny (7,4) v plazmě přítomna z 98 % v disociované formě, tedy jako urátový aniont. V mnohem kyselejším prostředí renálních tubulů (např. ve sběrném kanálku je pH 5) převažuje nedisociovaná forma kyseliny močové (27). Protože je nedisociovaná kyselina močová méně rozpustná než urát, dochází zde s vyšší pravděpodobností k precipitaci krystalů s rizikem rozvojem akutní či chronické urátové nefropatie.
V prostředí extracelulárního kompartmentu, charakterizovaného vyšším pH, rozhoduje o rozpustnosti urátu jeho koncentrace. Při fyziologickém pH je kyselina močová v krvi přítomna ve formě urátového aniontu (28). Z fyziologických studií je známo, že roztok plazmy s pH 7,4 lze považovat za saturovaný při koncentraci urátu 416,395 μmol/l. Za fyziologické koncentrace kyseliny močové jsou považovány hladiny 178–416 μmol/l u mužů a 119–357 μmol/ u žen, tedy hladiny, které se mohou blížit koncentraci, která již představuje nasycený roztok s rizikem precipitace krystalů. Koncentrace kyseliny močové převyšující její součin rozpustnosti ve vodě činí 407,252 μmol/l. Horní hranice rozpustnosti je při koncentraci 419,23 μmol/l (29).
Pro lepší zapamatování v běžné klinické praxi lze výše uvedené hodnoty zaokrouhlit na následující fyziologické horní referenční meze pro děti: 300 μmol /l, muže: 420 μmol/l a ženy: 360 μmol/l.
Správný klinický přístup k pacientovi s hyperurikemií vyžaduje etiologické upřesnění hyperurikemie.
Lze uvažovat následující 3 situace:
- nadprodukci kyseliny močové,
- nedostatečné vylučování kyseliny močové,
- kombinaci těchto stavů.
Nedostatečné vylučování kyseliny močové je způsobeno následujícími příčinami:
- Vrozené poruchy: familiární juvenilní dnavá nefropatie – autozomálně dominantní (AD) onemocnění asociované s progresí renální dysfunkce do selhání. Onemocnění je charakteristické snížením exkreční frakce pro urát (pod 4 %). Histologicky prokazujeme v ledvinách tubulointersticiální postižení a glomerulosklerózu, ale bez depozice krystalů urátu sodného v parenchymu ledviny.
- Chronické onemocnění ledvin (CKD): zvláště pokud glomerulární filtrace (GF) klesne pod 0,5 ml/s. Zde se uplatňuje rovněž vliv kompetitivní inhibice tubulární sekrece urátu v proximálním tubulu daný retencí organických kyselin.
- Metabolický syndrom: charakterizovaný snížením exkreční frakce pro urát.
- Poléková postižení: diuretika, salicyláty, cyklosporin A, levodopa, etambutol a další.
- Arteriální hypertenze.
- Metabolická acidóza: laktátová, ketoacidóza – diabetická, z hladovění i alkoholová.
- Hypotyreóza.
- Hyperparatyreóza.
- Sarkoidóza.
- Preeklampsie a eklampsie: z klinického hlediska je nález hyperurikemie velmi užitečný a také podstatný pro diagnózu, protože fyziologicky je koncentrace kyseliny močové u gravidních pacientek nízká.
- Downův syndrom.
- Otrava olovem (kazuisticky).
- Idiopatické stavy
Nadprodukce kyseliny močové je způsobena následujícími příčinami:
- Vrozené poruchy metabolismu (enzymatické defekty): všechny gonozomálně dědičné:
- Lesch -Nyhanův syndrom: deficit hypoxantin -guanin -fosforibozil transferázy (HGPRT), které vede k akumulaci 5-fosfo -α-d -ribosyl pyrofosfátu (PRPP). Onemocnění je charakterizováno dnou, renální insuficiencí vzniklou na podkladě nefrolitiázy, mentální a růstovou retardací a v některých případech sklony k automutilaci.
- Kelley -Seegmillerův syndrom: částečný deficit hypoxantin - -guanin -fosforiboziltransferázy (HGPRT). Pro onemocnění je typický rozvoj dny ve 2.–3. dekádě života pacientů. Urátová nefrolitiáza je rovněž častá, neurologické postižení již méně.
- Mutace genu PRPP syntetázy vedoucí k její zvýšené aktivitě. Onemocnění je typické rozvojem dny mezi 15. a 30. rokem života pacienta, urátová nefrolitiáza je opět velmi častá.
- Dieta bohatá na puriny: maso, vnitřnosti (játra), „mořské plody“, luštěniny, rebarbora a další.
- Vysoký buněčný obrat: hemolytická anémie, hematologické malignity (lymfomy, myelom, leukemie).
- Syndrom nádorové lýzy.
- Střádavá onemocnění: glykogenózy typu III, V a VII.
- Idiopatické stavy.
Kombinované příčiny hyperurikemie:
- Abúzus alkoholu. (Poznámka: mechanismus účinku: metabolismem alkoholu v játrech dochází k akcelerované degradaci ATP a syntéze organických kyselin, které kompetují s urátem o transportní mechanismu zodpovědné za jeho tubulární sekreci (30).)
- Fruktózou přislazované nápoje: fruktóza se podílí na zrychlení metabolismu purinů, ale také snižuje exkreční frakci urátu v ledvinách (31).
- Excesivní fyzická aktivita: cvičení.
- Deficit aldolázy B (fruktóza-1-fosfát aldolázy).
- Deficit glukóza-6-fosfátázy: glykogenóza typu I (von Gierkeho nemoc), kde kromě hepatomegalie a symptomatické hypoglykemie v časném věku dítěte (již v 1. roce života) nacházíme také hyperurikemii.
- Idiopatické stavy.
Aktuální terminologické ukotvení pojmu renální dysfunkce
Ještě než budou vymezeny základní patologické stavy ledvin asociované s hyperurikemií, je nutno definovat pojmy charakterizující snížení renální funkce. Jsou rozlišovány 2 základní situace:
- akutní renální poškození (AKI) a
- chronické onemocnění ledvin (CKD), protože tyto pojmy budou v dalším textu často užívány a z hlediska novější nefrologické terminologie nahrazují dříve užívaný a méně přesný termín renální insuficience.
Akutní renální poškození je definováno jako stav, při kterém dochází v horizontu kratším než 3 měsíce k vzestupu sérového kreatininu o více než 26,5 μmol/l nebo 1,5násobek vstupní hodnoty kreatininu, respektive k poklesu diurézy pod 0,5ml/kg/hod. po dobu 6 hod. AKI je dle závažnosti stratifikováno na 3 stadia, přičemž 3. stadium znamená akutní renální selhání. Tento stav je dle definice charakterizován konsenzuálně vzestupem kreatininu nad 353,6 μmol/l nebo 3násobným vzestupem vstupní hodnoty sérového kreatininu nebo anurií trvající déle než 12 hod. (32, 33) (Tab. 2).
Tab. 2. AKI – akutní renální poškození (klasifikace). Převzato z https:// kdigo.org 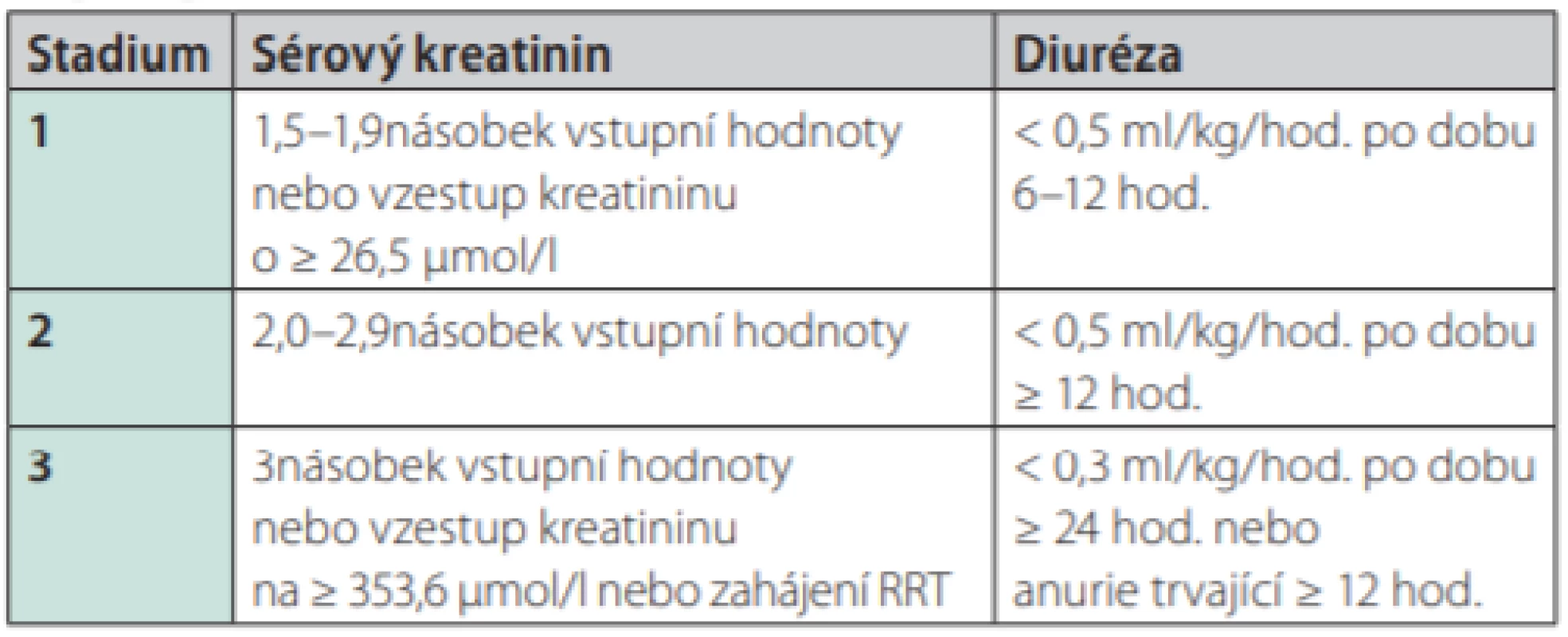
Chronické onemocnění ledvin je stav charakterizovaný poklesem glomerulární filtrace pod hodnoty fyziologické normy, tedy 1,5 ml/s, s nebo bez evidence o jiném funkčním či strukturálním poškození ledvin, které představují patologické laboratorní (proteinurie, erytrocyturie apod.), zobrazovací (SONO, CT apod.) či histologické nálezy (renální biopsie). CKD je dle hodnoty odhadované glomerulární filtrace (eGFR) členěno na 5 stadií (G1–G5), přičemž selhání je definováno poklesem glomerulární filtrace pod 0,25 ml/s (32) (Tab. 3).
Tab. 3. CKD – chronické onemocnění ledvin (klasifikace). Převzato z https:// kdigo.org 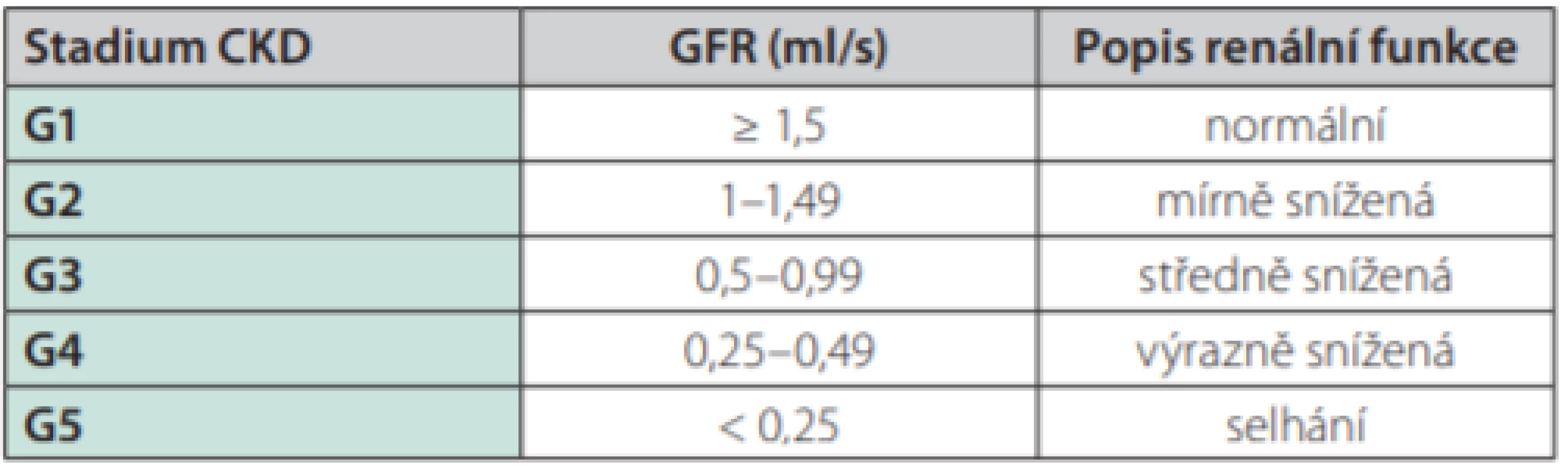
Přímé postižení ledvin při hyperurikemii – urátová nefropatie
Urátová nefropatie se klinicky nejčastěji manifestuje jako urátová nefrolitiáza. Mezi klinické projevy, které lékaře vedou k suspekci na toto onemocnění, nepochybně patří hematurie (včetně mikroskopické), bolest v bederní oblasti, bolest břicha nebo v třísle, ale také nauzea či vomitus.
Urátovou nefropatii lze podle klinického obrazu dělit na 3 základní jednotky (34):
- akutní urátová nefropatie,
- chronická urátová nefropatie,
- urátová nefrolitiáza.
Všechna výše uvedená onemocnění lze z hlediska etiopatogeneze charakterizovat ukládáním urátu, klinický obraz se však výrazně liší.
Akutní urátová nefropatie
Akutní urátová nefropatie je onemocnění způsobené obstrukcí renálních tubulů krystaly kyseliny močové. Vzniká v případech akutní nadprodukce urátu při výrazném tkáňovém, respektive buněčném obratu, jak jej lze vídat v případě hematologických malignit – leukemií (akutní myeloidní či lymfatická leukemie) a lymfomů a dále za situace syndromu nádorového rozpadu (tumor lysis syndrome) u onkologicky nemocných pacientů léčených chemoterapií či radioterapií (např. hepatoblastom či neuroblastom) (13).
V těchto situacích dochází k excesivnímu uvolňování DNA, respektive nukleotidů z jader rozpadlých buněk a k jejich metabolismu na kyselinu močovou. Ta je následně vylučována do tubulárního systému ledvin, kde za situace klesajícího pH (acidifikace) dochází k precipitaci urátových krystalů s následnou obstrukcí tubulů. Nejvíce je tímto procesem postižen sběrací kanálek. Důsledkem zvýšení intratubulárního hydrostatického tlaku je jednak snížení a zástava glomerulární filtrace, ale také celkové zvýšení intrarenálního tlaku s útlakem peritubulárních cévních pletení. Tento fenomén vede ke zvýšení renální cévní rezistence s následným snížením průtoku krve ledvinou, který se rovněž významně podílí na poklesu renální funkce (35).
Klinickým projevem akutní urátové nefropatie je tedy typicky oligurické akutní renální poškození (AKI), respektive v krajním případě selhání ledvin (36, 37). Akutní renální poškození může být způsobeno také akutní nefrokalcinózou z precipitace kalcium fosfátových krystalů v tkáni ledviny – v tubulointersticiálním kompartmentu (kalciumfosfátové krystaly jsou méně rozpustné v prostředí s vyšším pH, které může představovat moč pacientů léčených alkalizujícími prostředky právě z indikace probíhajícího syndromu nádorové lýzy).
Syndrom nádorové lýzy je potencionálně život ohrožující stav, a proto musí být u rizikových pacientů indikována preventivní opatření, a vznikne -li již, musí být včas diagnostikován a adekvátně léčen. Nejčastěji onemocnění vzniká 48–72 hod po zahájení protinádorové léčby, hlavními laboratorními nálezy jsou hyperurikemie, hyperkalemie (zpravidla nejčasnější nález) a hyperfosfatemie, často asociovaná sekundárně s hypokalcemií (precipitace kalciumfosfátu v měkkých tkáních). Hlavními rizikovými faktory syndromu nádorové lýzy jsou vysoké hladiny LDH před terapií (koreluje s objemem nádorové masy), prerexistující renální onemocnění (dysfunkce) či vyšší věk pacienta.
Terapie syndromu nádorové lýzy s AKI se zaměřuje na komplikace, tedy na léčbu hyperkalemie, hyperfosfatemie, hypokalcemie, z nich vyplývajících komplikací, jako jsou křeče či arytmie, dále na poruchy acidobazické rovnováhy, hyperhydrataci či riziko infekce. Důležité je v diferenciální diagnostice pomýšlet na jiné příčiny AKI – u hematologických pacientů na myelomovou ledvinu, u pacientů léčených chemoterapií na polékové poškození, na možnost kontrastové nefropatie vzniklé po podání jodové kontrastní látky při CT vyšetření, méně často na možnou infiltraci ledvin nádorem či paraneoplastické projevy v podobě vaskulitidy či glomerulonefritidy.
Léčba akutní urátové nefropatie, způsobené nejen syndromem nádorové lýzy, se zaměřuje na alkalizaci moči intravenózním či perorálním podáním bikarbonátu s cílem dosažení pH moči 7,0 (maximalizuje rozpustnost urátu, může však zvýšit pravděpodobnost precipitace kalciumfosfátu v tubulech) s pravidelnými kontrolami pH moči, zajištění dostatečné diurézy infuzní terapií, event. s přídavkem diuretik (u pacientů s hyperkalemií či známkami volumového přetížení), s cílem dosažení diurézy asi 1 ml/kg/ hod. U pacientů bez přidružených kardiovaskulárních chorob, a tedy bez rizika srdečního selhání, je doporučován celkový objem infuzí 4–5 l denně (3 l/m2) s cílem dosažení nejméně 3 l diurézy. Pro riziko vzniku arytmií lze doporučit monitoraci EKG, časté kontroly biochemických parametrů, zvážení zavedení centrálního žilního katétru a včasnou indikaci hemodialýzy.
Preventivní podání Alopurinolu u pacientů s vysokým rizikem akutní urátové nefropatie je indikováno (38). Podává se 600 mg Alopurinolu denně jako prevence, respektive 600–900 mg denně jako terapie již rozvinutého syndromu nádorové lýzy. Alternativu k Alopurinolu představuje Febuxostat, nepurinový inhibitor xantinoxidázy, s výhodnějším bezpečnostním profilem, jehož dávku není potřeba redukovat při snížené renální funkci a který je dle současné evidence (studie FLORENCE) také efektivnější v léčbě hyperurikemie než Alopurinol (39). Pokud je tato terapie neúspěšná, lze podat rekombinantní xantinoxidázu, Rasburikázu, v dávce 50–100 IU/kg denně intravenózně či intramuskulárně. Tato je kontraindikována u těhotných a u pacientů s defektem glukóza-6-fosfát dehydrogenázy (40). Lék je v České republice registrován pod názvem Fasturtec a je možno jeho podání indikovat.
Indikace k dialýze představují „klasické“ laboratorní a klinické abnormality – hyperkalemie, hyperfosfatemie, symptomatická hypokalcemie, hyperhydratace, které se nepodařilo zvládnout konzervativní léčbou.
Chronická urátová nefropatie
Chronická urátová nefropatie představuje celé spektrum nemocí jak vrozených, tak získaných. Velmi specifickou problematiku představují vzácná dědičná onemocnění ledvin charakterizovaná poruchami tubulárního transportu urátu, která vedou k rozvoji chronické tubulointersticiální nefritidy. Příkladem za všechny může být familiární juvenilní hyperurikemická nefropatie (FJHN – MIM 162000). Jedná se o autozomálně dominantní onemocnění, jehož podstatou je mutace genu pro uromodulin (UMOD), tedy genu kódujícího Tamm -Horsfallův protein (uromodulin). Tento gen se nachází na 16. chromozomu (16g12) a je v genetické vazbě s lokusem MCKD2, který je zodpovědný za vznik jiné autozomálně dominantní choroby ledvin – dřeňového cystického onemocnění ledvin (MCKD2) (41). Etiologicky se na vzniku FJHN podílí zvýšená exprese mutovaného UMOD genu a následná akumulace uromodulinu v tubulárních buňkách. Onemocnění je charakterizováno hyperurikemií ze sníženého vylučováním kyseliny močové močí a progresí renální dysfunkce do selhání.
Chronická urátová nefropatie je stav charakterizovaný jak primárním postižením renálního parenchymu hyperurikemií v podobě zánětlivých a dystrofických změn na tubulárních či endoteliálních buňkách, tak také postižením vyplývajícím s urátové nefrolitiázy či urolitiázy s následným rozvojem chronické tubulointersticiální nefritidy. Je rozdíl, zda je vystaven působení hyperurikemie intaktní ledvinný parenchym či zda je u pacienta již přítomno preexistující onemocnění ledvin. Na renálním poškození se zde podílí akcelerovaná glomerulární hypertenze a cévní změny, progrese proteinurie, která sama dále akceleruje postižení tubulointersticia ledviny (intersticiální fibrózu a tubulární atrofii – IF/TA) (42). Zvláště u pacientů s preexistujícím renálním poškozením se zdá negativní vliv hyperurikemie více vyjádřen. Tento fakt byl potvrzen např. u pacientů s diabetickým onemocněním ledvin či IgA nefropatií (43, 44). V těchto případech je pochopitelně, především z metodologických a statistických důvodů, hůře prokazatelné, zda je hyperurikemie nezávislým rizikovým faktorem progrese chronické nefropatie, neboť se zřejmě mnohem silněji uplatňuje vliv základního renálního onemocnění.
Urátová nefrolitiáza
Urátová nefrolitiáza či urolitiáza je 3. klinickou jednotkou, kterou lze přímo etiologicky asociovat s hyperurikemií. Urolitiáza (nejen urátová) se v průběhu života vyskytne přibližně u 4 % populace. Navzdory jistým geografickým variabilitám lze konstatovat, že urátová nefrolitiáza představuje 3. nejčastější typ litiázy (5–10 % případů) (45). Základní patofyziologické a patobiochemické předpoklady vzniku tzv. přesyceného roztoku s následnou formací krystalů již byly diskutovány. Z praktického hlediska je vhodné připomenout, že se na formaci krystalů urátu v tubulech podílí nejen hyperurikosurie, ale také pokles pH moči při onemocněních s ledvinami primárně nesouvisejícími, jako je ztráta bikarbonátu a dehydratace se snížením objemu moči např. při chronickém průjmu či po operacích na gastrointestinálním traktu (např. jejunoileální bypass). Nefrolitiáza a urolitiáza představují onemocnění, která jsou asociována s různým stupněm snížení renální funkce, ať už v souvislosti s rozvojem tzv. obstrukční uropatie či chronické tubulointersticiální nefritidy (TIN).
Specifická laboratorní vyšetření u pacientů se zvýšeným rizikem renálního poškození způsobeného kyselinou močovou
Kromě klasických laboratorních stanovení používaných rutinně pro diagnostiku vnitřních nemocí (krevní obraz, elektrolyty – včetně kalcemie a fosfatemie (posouzení případné hyperparatyreózy, sarkoidózy, mnohočetného myelomu), jaterní testy (bilirubin, ALT, AST, ALP, GMT), parametry renální funkce (kreatinin, urea, eGFR), lipidogram (cholesterol – dle uvážení i jednotlivé frakce, triacylglycerol), TSH, moč chemicky a sediment), lze doporučit provedení ještě následujících doplňujících vyšetření:
- vylučování kyseliny močové do moči – koncentrace urátu v moči,
- exkreční frakce urátu,
- urát/albuminový poměr (uric acid/albumin ratio).
Přesnější vyšetření vylučování kyseliny močové ledvinami je indikováno zejména u mladých pacientů s hyperurikemií, žen v premenopauzálním období, u pacientů s dnou a také u pacientů s urikemií vyšší než 600–650 μmol/l.
Vyšetření močové exkrece urátu je obzvláště důležité provést za stavu normálního, pro pacienta běžného dietního příjmu purinů a po jejich eliminaci v dietě (obvykle na 6–7 dnů), resp. za stavu úplné abstinence alkoholu. Zároveň s měřením močových koncentrací urátu je vhodné spočítat/změřit clearance kreatininu (eGFR/ClCr), resp. vylučování kreatininu do moči.
Na základě provedených měření mohou být pacienti kategorizováni do následujících 3 skupin:
- vysoký příjem purinů – urikosurie před dietou > 6 mmol/den, po dietě < 4 mmol/den,
- vysoká produkce purinů – urikosurie před dietou > 6 mmol/den, po dietě > 4,5 mmol/den,
- snížené vylučování purinů – urikosurie před dietou < 6 mmol/den, po dietě < 2 mmol/den.
Exkreční frakce urátu vyjadřuje poměr do moči definitivně vyloučeného urátu k množství urátu vyloučeného glomerulární filtrací do primární moči (moč v tubulárním systému ledviny). Lze ji vypočítat podle vzorce: ((Uurát × Skreatinin) × 100 %)/(Surát × Ukreatinin).
Referenční meze činí 7–9,5 % pro muže a 10–14 % pro ženy. Hodnoty nižší než tyto referenční meze svědčí pro sníženou exkreci urátu do moči.
Podobně jako byl v nefrologii zaveden koncept kvantifikace proteinurie měřené nikoli z 24hodinového sběru moči, ale z poměru vylučování albuminu, respektive celkové bílkoviny a kreatininu do moči (albumin/kreatinin ratio – ACR, protein/creatinin ratio – PCR) ve vzorku ranní moči, může být kvantifikováno i vylučování urátu do moči jako urát/kreatininový index s příslušnými referenčními mezemi, aniž by pacient musel provádět sběr moči za 24 hod.
Zřejmě zásadním významem tohoto indexu je možnost odlišit etiologicky akutní urátovou nefropatii od hyperurikemie způsobené renálním selháním. Z hodnoty vyšší než 0,9 lze usuzovat na akutní urátovou nefropatii a při hodnotách menších než 0,7 lze pomýšlet spíše na renální selhání jako příčinu hyperurikemie. Obecně vzato hodnoty poměru vyšší než 0,8 svědčí pro nadprodukci urátu.
Hyperurikemie a renální a kardiovaskulární riziko – problém interpretace klinických dat
Zdrojem nejednoznačností ve výsledcích dostupných klinických studií zkoumajících vztah hyperurikemie a kardiovaskulárních a renálních onemocnění jsou nepochybně metodologické problémy. Jedná se o problematiku statistické analýzy tzv. složitých proměnných (např. absenci či neúplné provedení multivariantní analýzy), problém reverzní kauzality (hyperurikemie je následkem renální dysfunkce a zároveň má být etiologickým faktorem vzniku a progrese renální dysfunkce), podhodnocení vlivu klasických rizikových faktorů příslušných onemocnění, včetně případného genetického substrátu (46). Navíc jen část analyzovaných dat pochází z intervenčních randomizovaných klinických studií (Randomized Control Trials – RCT), které lze považovat za „zlatý standard“ provádění klinického výzkumu. Podstatné je, že z hlediska síly klinické evidence je zásadní reflektovat nálezy systematických review a metaanalýz jednotlivých RCT. Systematická review představují nejsilnější a nejužitečnější dostupnou „evidenci“. Svým zaměřením na veškerou dostupnou literaturu na dané téma snižují riziko systematické chyby (bias) a analýzou dat pocházejících od velkých kohort pacientů snižují riziko náhodných chyb (confounding). Podmnožinou tohoto typu studií jsou metaanalýzy, které použitím definovaných statistických metod umožňují kombinovat a hlavně agregovat nálezy celé řady RCT do jedné studie, jejíž hlavní výhodou je tedy dosažení velkého počtu sledovaných pacientů (47).
Hyperurikemie a renální a kardiovaskulární riziko – aktuální stav znalostí
Již dlouho je známo, že hyperurikemie je přímým důsledkem poklesu glomerulární filtrace (48), avšak hyperurikemie byla dle novějších poznatků také asociovaná s nově vzniklou renální dysfunkcí, respektive s progresí renální dysfunkce (49). Nověji je však zkoumán nejen vliv hyperurikemie na incidenci kardiovaskulárních příhod (ICHS, srdeční selhání), kardiovaskulární mortalitu, kompenzaci arteriální hypertenze, ale také na progresi chronického onemocnění ledvin (CKD) do selhání (ESRD).
Lze říci, že až u 1/4 pacientů s dnou je zároveň přítomno chronické onemocnění ledvin III. (CKD G3; eGFR 0,5–1 ml/s) a vyššího stadia (50). Z opačného úhlu pohledu lze odhadovat incidenci dny na 16 % u pacientů s CKD G1-2 (eGFR > 1, resp. 1,5 ml/s) a 35,6 % u pacientů s CKD G4 (eGFR < 0,5 ml/s) (51). Nejen dna, ale i asymptomatická hyperurikemie byly dle některých analýz asociovány s rizikem vzniku chronického onemocnění ledvin (52–54). Za nejsignifikantnější lze považovat asociaci dny a renální dysfunkce, ať už akutní či chronické, s ohledem na jasně definovaný kauzální patofyziologický rámec v podobě precipitace krystalů urátu v renálních tubulech, tubulointersticiální nefritidu asociovanou s nefrokalcinózou i nefrolitiázou, ale také o sekundární poškození asociované s terapií nesteroidními antirevmatiky (NSAIDs), poškození z arteriální hypertenze či přímou cytotoxicitu kyseliny močové (55, 56).
Rozhodně nemůže být podceňována možná role hyperurikemie jako možného modifikovatelného rizikového faktoru jak kardiovaskulárních onemocnění, tak progrese chronického onemocnění ledvin, které je samo asociováno s výrazně zvýšeným kardiovaskulárním rizikem (57).
Klasickými se i v kontextu jeví data z následné analýzy (post hoc analýzy) studie RENAAL, která se zaměřila právě na vliv snížení urikemie na funkci ledvin (58). Byla zkoumána data od 1 342 pacientů s diabetes mellitus 2. typu po dobu 6 měsíců. Vstupní urikemie činila 398,55 μmol/l. Terapie inhibitorem receptoru pro angiotenzin II, losartanem, došlo k poklesu urikemie o 9,52 μmol/l (95% CI: -0,30 – -0,01; p = 0,031). Riziko renálního poškození definované jako zdvojnásobení sérového kreatininu, respektive renální selhání, bylo sníženo u pacientů léčených losartanem o 6 % (95% CI: 10–3 %) na každých 29,74 μmol/l poklesu urikemie během 6 měsíců léčby. Tento efekt byl nezávislý na vstupní hodnotě eGFR a albuminurie. Celkový kalkulovaný renoprotektivní efekt léčby losartanem se statistickým přepočtem snížil z 22 % (95% CI: 6–35 %) na 17 % (95% CI: 1–31 %), jinými slovy asi 1/5 renoprotektivního efektu losartanu představuje snížení hladiny kyseliny močové. Urikemii tedy lze s určitými limitacemi považovat za potencionální modifikovatelný rizikový faktor renální dysfunkce.
Také řadou jiných epidemiologických studií byla prokázána asociace hyperurikemie, resp. dny, s kardiovaskulárními a renálními onemocněními (59, 60). V mnoha z těchto studií také představovala hyperurikemie nezávislý rizikový faktor kardiovaskulárních a renálních onemocnění (20). V tomto směru byla nalezena patofyziologická souvislost mezi hyperurikemií a kardiovaskulárním a renálním postižením i na zvířecím modelu, ve kterém byla prokázána toxicita urátu pro endoteliální buňky a cévy obecně (22).
Řada, avšak rozhodně ne všechny dostupné studie (61–63) či jejich metaanalýzy, prokázaly vliv hyperurikemie, resp. její léčby, na kardiovaskulární morbiditu (64, 65) či chronické onemocnění ledvin (66). Metaanalýza z roku 2015 srovnávající výsledky 19 RCT s celkovým množstvím 992 pacientů, konstatovala vzestup odhadované glomerulární filtrace (eGFR) o 3,2 ml/min (0,053 ml/s) (95% CI 0,16–6,12 ml/min, p = 0,039), respektive statisticky signifikantní pokles urikemie a lepší korekci arteriální hypertenze u pacientů léčených alopurinolem (67).
Lze tedy aktuálně užívanou farmakoterapii hyperurikemie spojovat s renoprotektivním působením? Dle některých starších dat i recentní metaanalýzy, která srovnávala působení alopurinolu a nepurinového inhibitoru xantinoxydázy – Febuxostatu, lze určité renoprotektivní účinky pozorovat. Navzdory nejednoznačným nálezům ve smyslu signifikantního rozdílu v renální funkci (kreatinin, eGFR) byla u pacientů léčených Febuxostatem pozorována nižší albuminurie (-80,47 mg/gCr, 95% CI -149,29 – -11,64, p = 0,02). Febuxostat byl také u pacientů s CKD efektivnější ve svém hypourikemickém efektu než alopurinol (-0,92 mg/dl, 95% CI -1,29 – -0,56, p < 0,001) (68). V jiné placebem kontrolované RCT byl prokázán sice nesignifikantní vzestup eGFR u pacientů léčených 40 mg Febuxostatu denně, nicméně v kontrolní skupině došlo v 6. měsíci ke statisticky signifikantnímu poklesu eGFR o 0,12 ml/s/1,73 m2 , 95% CI 0,001–0,213 (p = 0,05) (69). Byť nebyly výsledky této studie provedené na kohortě pouze 93 pacientů potvrzeny jinou, srovnatelnou studií, lze i zde vidět možný nový rozměr renoprotektivní léčby (70).
Specifickou problematiku představuje asymptomatická hyperurikemie, která byla rovněž asociována s problematikou kardiovaskulárních a kardiometabolických chorob. Na kohortě 5 899 pacientů s asymptomatickou hyperurikemií byla během 5letého sledování zjištěna vyšší incidence arteriální hypertenze, dyslipidemie, obezity, ale také chronického onemocnění ledvin. Vyšší pravděpodobnost rozvoje diabetes mellitus nebyla statisticky signifikantní, ale i zde byl patrný trend směrem k vyššímu riziku (53).
Hyperurikemie jakožto biomarker oxidativního stresu může být spoluodpovědná za horší prognózou pacientů se srdečním selháním (71). Může však být považována za jeden z potencionálních etiologických faktorů srdečního selhávání? Tuto otázku zatím nelze zodpovědět zcela jednoznačně, ale je velmi pravděpodobné, že hyperurikemie představuje, kromě klasických rizikových faktorů, jako je mužské pohlaví, arteriální hypertenze, onemocnění srdečních chlopní, ICHS a obezity, nezávislý rizikový faktor vzniku srdečního selhání (72). Na druhou stranu příznivý vliv léčby vyššími dávkami alopurinolu (600 mg/den) u pacientů se srdečním selháním (sledovanými klinickými parametry bylo přežití pacientů a progrese onemocnění) nebyl v podmínkách velmi kvalitně provedené multicentrické RCT studie prokázán (73).
Hyperurikemie možná ovlivňuje také manifestaci ischemické choroby srdeční, avšak u pacientů nejenom se zvýšenou koncentrací kyseliny močové v krvi, ale také s prokázanou depozicí krystalů natriumurátu v tkáních, pokud byli srovnáváni s pacienty s normální urikemií či hyperurikemií bez depozit urátových krystalů (74). Tento nález potvrzuje hypotézu o vaskulárním postižení způsobeném krystaly natriumurátu. Ve shodě s tímto jsou pozorování o protektivním vlivu inhibitorů xantinoxidázy na rozvoj endoteliální dysfunkce či oxidativní stres u pacientů s ICHS (75) učiněná v podmínkách nerandomizovaných klinických studií. K dispozici jsou také data, která naznačují snížení rizika manifestace ischemické choroby srdeční – akutního infarktu myokardu u pacientů léčených inhibitory xantioxidázy (76–78).
Za velmi problematický lze považovat vztah hyperurikemie a arteriální hypertenze, resp. terapii hyperurikemie a její příznivý vliv na kompenzaci arteriální hypertenze. Navzdory některým pozorováním provedeným u obézních adolescentů s arteriální hypertenzí, kde terapie asymptomatické hyperurikemie měla příznivý vliv na tlak krve, nelze podobné souvislosti nalézat v populaci dospělých hypertoniků. Dle aktuálních znalostí tedy není možno od terapie asymptomatické hyperurikemie očekávat zlepšení kompenzace arteriální hypertenze (79).
Jinou specifickou oblastí v už tak dosti komplikované problematice terapie hyperurikemie je její indikace u pacientů s diabetes mellitus. Zde je totiž k dispozici třída perorálních antidiabetik s urikosurickým efektem. Jsou jimi inhibitory natrium -glukózového kotransportéru 2 (Sodium - -Glucose co -transporter 2 – SGLT2) neboli glifloziny. Terapie těmito preparáty, a jedná se nepochybně o efekt třídy léčiv, který byl pozorován u všech dostupných gliflozinů (empagliflozinu, depagliflozinu, tofogliflozinu, luseogliflozinu a ipragliflozinu), byla spojena se signifikantním poklesem urikemie ve srovnání s kontrolní skupinou (-37,79 μmol/l, 95% CI -40,51 – -34,95) pacientů s diabetes mellitus 2. typu. Největší hypourikemický efekt bylo lze pozorovat při terapii empagliflozinem (-45,83 μmol/l, 95% CI -53,03 – -338,63). Hypourikemický efekt gliflozinů byl poněkud snížený u pacientů s renální dysfunkcí (eGFR < 1 ml/s). Zdá se tedy, že právě glifloziny představují lék volby u pacientů s diabetes mellitus 2. typu a hyperurikemií (80).
S rostoucím množstvím znalostí o vlivu hyperurikemie a dny na kardiovaskulární a renální dysfunkci je však především nutno kriticky zhodnotit ovlivnění mortality pacientů, protože její snížení je nepochybně hlavním cílem každé léčebné intervence. Asociaci dny a kardiovaskulárního rizika, včetně mortality, lze považovat za prokázanou (20, 81, 82). Pravděpodobně nejcennější jsou v této souvislosti závěry studie National Examination Survey trial, která zkoumala asociaci dny a kardiovaskulární mortality u 15773 pacientů. Riziko úmrtí z kardiovaskulárních příčin bylo o 50 % vyšší u pacientů s dnou než u kontrolní skupiny. Zároveň bylo spočítáno, že s každým vzestupem urikemie o 60 μmol/l (59,485 μmol/l) vzrostla kardiovaskulární mortalita o 28 % (83). Podobně impresivní data rozhodně nejsou k dispozici v případě asymptomatické hyperurikemie. Např. ve skupině 2221 pacientů (z celkem 8 placebem kontrolovaných RCT analyzovaných v recentní metaanalýze) nedošlo k statisticky signifikantnímu poklesu celkové mortality u pacientů léčených alopurinolem nebo Febuxostatem (84). Příznivý vliv snížení urikemie nebyl prokázán ani v recentní metaanalýze 12 RCT zahrnujících celkem 1187 pacientů. Zde byl patrný nesignifikantní nebo žádný vliv hypourikemické terapie na přežití pacientů v 6 měsících (RR 1,66, 95% CI 0,61–4,48), resp. 2 letech (RR 0,13, 95% CI 0,02–1,06). Stejně tak terapie hyperurikemie neměla vliv na incidenci chronického renálního nemocnění, respektive selhání ve 2 letech. Byl pozorován již významný pokles kreatininu, tedy zlepšení renální funkce v prvním roce, který však již nebyl patrný ve 2. roce sledování (MD GF 0,066ml/s/1,73m2 , 95% CI 0,054–0,188) navzdory poklesu hodnot urikemie v intervalu 3–24 měsíců. Ve zkoumaných studiích nebyl prokazatelný příznivý vliv poklesu urikemie na kompenzaci arteriální hypertenze či pokles proteinurie (85). Jiná aktuálně publikovaná metaanalýza hodnotící výsledky 6 randomizovaných klinických studií zkoumajících vliv Febuxostatu (urikosurikum) na renální funkci prokázala, že u pacientů léčených Febuxostatem došlo k vzestupu glomerulární filtrace ((SMD, 95% CI 0,24 (-0,17 – -0,43)) (86). Lze tedy předběžně dovozovat, že z dostupných hypourikemických léků může právě Febuxostat zpomalovat progresi CKD.
Terapie hyperurikemie
K terapii hyperurikemie bylo již průběžně mnoho řečeno v textu článku. Jako určité shrnutí lze použít výsledky analýzy dat z databází Medline, Embase, Cochrane CENTRAL, abstrakta z kongresů EULAR a ACR z let 2010–2011, tedy kombinaci klinické evidence (evidence based medicine – EBM) a expertýzy, na základě kterých bylo definováno celkem 10 „mezinárodních doporučení“ týkajících se terapie hyperurikemie nazvaných The 3e (Evidence, Expertise, Exchange) Initiative (87). Za nejpodstatnější lze považovat doporučení číslo 2 týkající se „komorbidit“. Zde se konstatuje, že hyperurikemie nepředstavuje rizikový faktor chronického renálního selhání. Doporučení číslo 8 týkající se „monitorace“ hladin kyseliny močové definuje cílové hladiny urikemie jako < 360 µmol/l (< 300 µmol/l, jsou -li přítomny tofy). Doporučení číslo 10 reflektující problematiku „asymptomatické hyperurikemie“ konstatuje, že terapii tohoto stavu nelze doporučit a že taková terapie nevede k zlepšení renální prognózy (poklesu sérového kreatininu a proteinurie) (88, 89).
Britská revmatologická společnost (The British Society for Rheumatology) navrhuje terapii hyperurikemie k cílové hodnotě 356,91 μmol/l (6,0 mg/dl) pro pacienty s nekomplikovanou, respektive 297,425 μmol/l (5,0 mg/dl) u pacientů s komplikovanou, tedy tofózní dnou (5). Indikací k terapii Febuxostatem či ke kombinaci inhibitorů xantinoxidázy a urikosurik je zde přítomnost komorbidit limitujících možnost podání vyšších dávek inhibitorů xantinoxidázy (renální a srdeční selhávání), opakované dnavé záchvaty, chronická tofózní dna a dna s destruktivní artritidou.
Indikaci k terapii asymptomatické hyperurikemie v doporučeních Evropské odborné revmatologické společnosti EULAR (Europen League Against Rheumatism) (90), Americké odborné revmatologické společnosti ACR (American College of Rheumatology) (91) ani výše uvedené Britské odborné revmatologické společnosti (The British Society for Rheumatology) (92) nenacházíme.
Terapii asymptomatické hyperurikemie lze však doporučit u onkologicky nemocných pacientů, zvláště pokud je u nich plánována chemoterapie, jako prevenci rozvoje akutní urátové nefropatie související se syndromem nádorové lýzy.
Kompletní citace jsou k dispozici u autora textu.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Štěpán Bandúr, Ph.D.,
I. interní klinika 3. LF UK a FN Královské Vinohrady,
Šrobárova 50,
100 34 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(4): 259–266
Článek přijat redakcí: 22. 10. 2018
Článek přijat k publikaci: 15. 11. 2019
Zdroje
1. McCrudden F. Uric Acid: The Chemistry, Physiology, and Pathology of Uric Acid and the Physiologically Important Purine Bodies, With a Discussion of the Metabolism in Gout. New York, NY: Paul Hoeber Medical Books 1905.
2. Maesaka JK, Fishbane S. Regulation of renal urate excretion: a critical review. Am J Kidney Dis 1998; 32 : 917–933.
3. Desideri G, Puig JG, Richette P. The management of hyperuricemia with urate deposition. Curr Med Res Opin 2015; 31: (Suppl. 2): 27–32.
4. Shields GE, Beard SM. A Systematic Review of the Economic and Humanistic Burden of Gout. Pharmacoeconomics 2015; 33 : 1029–1047.
5. Lee H, Hall A, Nathan N, et al. Mechanisms of implementing public health interventions: a pooled causal mediation analysis of randomised trials. Implement Sci 2018; 13 : 42.
6. Oda M, Satta Y, Takenaka O, et al. Loss of urate oxidase activity in hominoids and its evolutionary implications. Mol Biol Evol 2002; 19 : 640–653.
7. Voet D, Voet J. Biochemistry. 4. Ed. (s.l.): John Wiley & Sons.
8. Whiteman M, Halliwell B. Protection against peroxynitrite -dependent tyrosine nitration and alpha 1-antiproteinase inactivation by ascorbic acid. A comparison with other biological antioxidants. Free Radic Res 1996; 25 : 275–283.
9. Ames BN, Cathcart R, Schwiers E, et al. Uric acid provides an antioxidant defense in humans against oxidant - and radical -caused aging and cancer: a hypothesis. Proc Natl Acad Sci USA 1981; 78 : 6858–6862.
10. Wu XW, Muzny DM, Lee CC et al. Two independent mutational events in the loss of urate oxidase during hominoid evolution. J Mol Evol 1992; 34 : 78–84.
11. Susumu W, Duk -Hee K, Lili F, et al. Uric Acid, Hominoid Evolution, and the Pathogenesis of Salt -Sensitivity Originally published. Hypertension 2002; 40 : 355–360.
12. Keilin J. The biological significance of uric acid and guanine excretion. Biol Rev 1959; 34 : 265–296.
13. Conger JD. Acute uric acid nephropathy. Med Clin North Am 1990; 74 : 859–871.
14. Seldin DW, Giebisch G (eds). The Kidney, Physiology and Pathophysiology. Philadelphia, Lippincott Williams & Wilkins 2000, 193–222.
15. Roch -Ramel F, Guisan B. Renal Transport of Urate in Humans. News Physiol Sci 1999; 14 : 80–84.
16. Rice T, Vogler GP, Perry TS, et al. Heterogeneity in the familial aggregation of fasting serum uric acid level in five North American populations: the Lipid Research Clinics Family Study. Am J Med Genet 1990; 36 : 219–225.
17. Köttgen A, Albrecht E, Teumer A, et al. Genome -wide association analyses identify 18 new loci associated with serum urate concentrations. Nat Genet 2013; 45 : 145–154.
18. Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels. Nature 2002; 417 : 447–452.
19. Igarashi T, Sekine T, Sugimura H, et al. Acute renal failure after exercise in a child with renal hypouricaemia. Pediatr Nephrol 1993; 7 : 292–293.
20. Richette P, Perez -Ruiz F, Doherty M, et al. Improving cardiovascular and renal outcomes in gout: what should we target? Nat Rev Rheumatol 2014; 10 : 654–661.
21. Okafor O. Allopurinol as a therapeutic option in cardiovascular disease. Pharmacol Ther 2017; 172 : 139–150.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázyČlánek Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientovČlánek Mikroskopická polyangiitídaČlánek Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvinČlánek Jaterní fibróza
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Hyperurikemie z perspektivy nefrologického pacienta
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



