-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAntikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
Anticoagulation therapy in cancer associated thromboembolism – new studies, new guidelines
Low molecular weight heparin (LMWH) has become a standard of treatment of cancer-associated thromboembolism (CAT). Until recently, direct oral anticoagulants (DOAC) have not had data about efficacy and safety in cancer patients. However, in the last two years, four randomized open-label studies comparing DOAC and LMWH in the treatment of CAT have been published. The first one was a large trial with edoxaban, followed by two smaller studies with rivaroxaban and apixaban, and, recently, by another large trial with apixaban. There are some differences among the studies concerning design, inclusion and exclusion criteria, length of treatment. In summary, DOAC are associated with a trend to the reduction of the risk of recurrence of venous thromboembolism; however, this is at the expense of some increase in bleeding risk. This risk is differential; the prevailing site of bleeding is the upper part of gastrointestinal tract, and, to a lesser extent, genitourinary tract. The updated guidelines for the treatment of CAT suggest DOAC as an alternative, however with careful consideration of the risk of bleeding and the risk of drug interactions. So far, the guidelines have mentioned edoxaban and rivaroxaban. With emerging evidence, apixaban is expected to play a role as well.
Keywords:
Venous thromboembolism – cancer – anticoagulation – low molecular weight heparin – direct oral anticoagulants
Autoři: Jana Hirmerová
Působiště autorů: II. interní klinka FN Plzeň
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 225-231
Kategorie: Přehledové články
Souhrn
Standardem v léčbě žilní tromboembolické nemoci (TEN) u onkologických nemocných se stal nízkomolekulární heparin (LMWH), obvykle po dobu 3–6 měsíců. Přímá orální antikoagulancia (DOAC) jako komfortnější varianta léčby neměla donedávna data o účinnosti a bezpečnosti u pacientů s nádory. V posledních dvou letech však byly publikovány čtyři randomizované otevřené studie porovnávající DOAC a LMWH v léčbě TEN asociované s malignitou. První byla velká studie s edoxabanem, následovaly menší studie s rivaroxabanem a apixabanem a nejnověji velká studie s apixabanem. Mezi studiemi jsou jisté rozdíly v designu, zařazovacích či vyřazovacích kritériích, délce léčby. Lze shrnout, že léčba DOAC je spojena s trendem k redukci rizika recidivy TEN, ale také s určitým zvýšením rizika krvácení. Toto riziko je diferencované – převládá krvácení z horní části gastrointestinálního traktu, případně též z urogenitálního traktu. Podle nedávno aktualizovaných odborných doporučení jsou DOAC lékem volby pro TEN asociovanou s malignitou, ovšem při zohlednění rizika krvácení a lékových interakcí. Zatím doporučení uvádějí edoxaban a rivaroxaban, avšak díky novým datům lze očekávat i uplatnění apixabanu.
Klíčová slova:
tromboembolická nemoc – malignita – antikoagulační léčba – nízkomolekulární heparin – přímá orální antikoagulancia
Úvod
V první dekádě 21. století jsme byli svědky zásadní změny v přístupu k žilní tromboembolické nemoci (TEN) u pacientů s maligním onemocněním. Do té doby se léčebné algoritmy příliš nelišily od postupu u pacientů neonkologických, tedy spočívaly v iniciální léčbě heparinem či nízkomolekulárním heparinem (low molecular weight heparin, LMWH) s převodem na warfarin, přičemž následná léčba warfarinem obvykle trvala 3–12 měsíců. Právě počátkem 21. století se objevily práce prokazující výrazně vyšší riziko komplikací u onkologických pacientů s TEN oproti neonkologickým – např. 10× vyšší riziko úmrtí a 3× vyšší riziko závažného krvácení či recidivy TEN během prvních 3–6 měsíců antikoagulační léčby (1, 2). Objevily se hypotézy, že volba jiné antikoagulační terapie v této specifické skupině pacientů s TEN by mohla zmenšit výskyt závažných komplikací. Vzápětí bylo publikováno několik otevřených („open‑label“) randomizovaných studií, porovnávající LMWH oproti antagonistům vitaminu K (VKA) v dlouhodobé léčbě (3–6 měsíců) u TEN asociované s malignitou. Výsledky konzistentně potvrdily lepší účinnost LMWH ve srovnání s VKA při srovnatelné bezpečnosti, podobně jako následná metaanalýza, dokumentující snížení relativního rizika recidivy TEN o 53 % (3). Preference LMWH k iniciální i dlouhodobé léčbě TEN u onkologických pacientů byla poté zdůrazněna i v doporučeních mezinárodních odborných společností a stala se standardním postupem (2).
Nástup nových antikoagulancií do praxe
V posledních letech se však rovněž rozšířilo naše armamentárium orální antikoagulační léčby. Postupně byla v léčbě TEN schválena 4 orální antikoagulancia výrazně se lišící od warfarinu. Jejich mechanismus účinku spočívá v přímé inhibici určitého koagulačního faktoru, proto jsou nazývána přímá orální antikoagulancia (direct oral anticoagulants, DOAC). Patří sem apixaban, edoxaban, rivaroxaban (inhibitory aktivovaného faktoru X) a dabigatran (inhibitor trombinu). V „registračních“ randomizovaných klinických studiích prokázala DOAC srovnatelnou účinnost a srovnatelnou či lepší bezpečnost oproti standardní léčbě TEN (LMWH následovaný VKA). Vzhledem k jejich výhodám (příznivý bezpečnostní profil, komfortnější užití pro většinu pacientů díky fixnímu dávkování bez nutnosti laboratorní monitorace) se stala v reálné praxi často preferovanou volbou v léčbě TEN, podpořenou i v odborných doporučeních (4).
Z důvodů velmi malého zastoupení onkologických pacientů ve zmíněných studiích však v léčbě TEN asociované s malignitou ještě před několika lety stále platilo doporučení preference LMWH.
Výhody a nevýhody LMWH
Léčba LMWH je podpořena kvalitními důkazy a dlouhou klinickou zkušeností. Obvykle nevyžaduje laboratorní kontroly, vzhledem ke krátkému poločasu LMWH umožňuje krátké přerušení např. z důvodů invazivního výkonu. LMWH nemají významnější interakce s jinými léky či s potravou. V případě potřeby (např. kolísání renálních funkcí či počtu trombocytů) lze dávku snadno upravit, resp. titrovat.
Z možných nežádoucích účinků lze zmínit riziko heparinem indukované trombocytopenie (HIT), byť relativně vzácné, případně osteopenie či osteoporózy při delším užívání. Nevýhodou je nutnost denní subkutánní (s.c.) aplikace a s tím spojený diskomfort pro pacienta (často udávaná bolestivost, tvorba hematomů či alergické kožní reakce v místě vpichu). Někteří autoři sice argumentují dobrou spoluprací onkologických pacientů při dlouhodobé léčbě LMWH (5), v jiné studii však 21 % nemocných LMWH předčasně vynechalo pro nežádoucí účinky (6).
S nástupem DOAC do léčby TEN a příznivými zkušenostmi z reálné praxe se tak lékaři i pacienti začali zajímat o možnost orální terapie jako komfortnější varianty dlouhodobé léčby TEN i u onkologických nemocných.
Během posledních 2 let byly publikovány celkem 4 studie srovnávající DOAC s LMWH, tedy s dosavadním léčebným standardem v léčbě TEN asociované s malignitou. Před zavedením DOAC v této indikaci je důležité znát detaily o designu i výsledcích těchto studií.
Studie s edoxabanem
Jako první proběhla velká studie HOKUSAI -VTE Cancer. Od poloviny roku 2015 do konce 2016 zařadila celkem 1 050 pacientů, výsledky byly publikovány na počátku roku 2018 (6).
Design a zařazovací kritéria uvádí podrobně tabulka 1.
Tab. 1. Randomizované studie srovnávající DOAC s LMWH v léčbě TEN asociované s malignitou 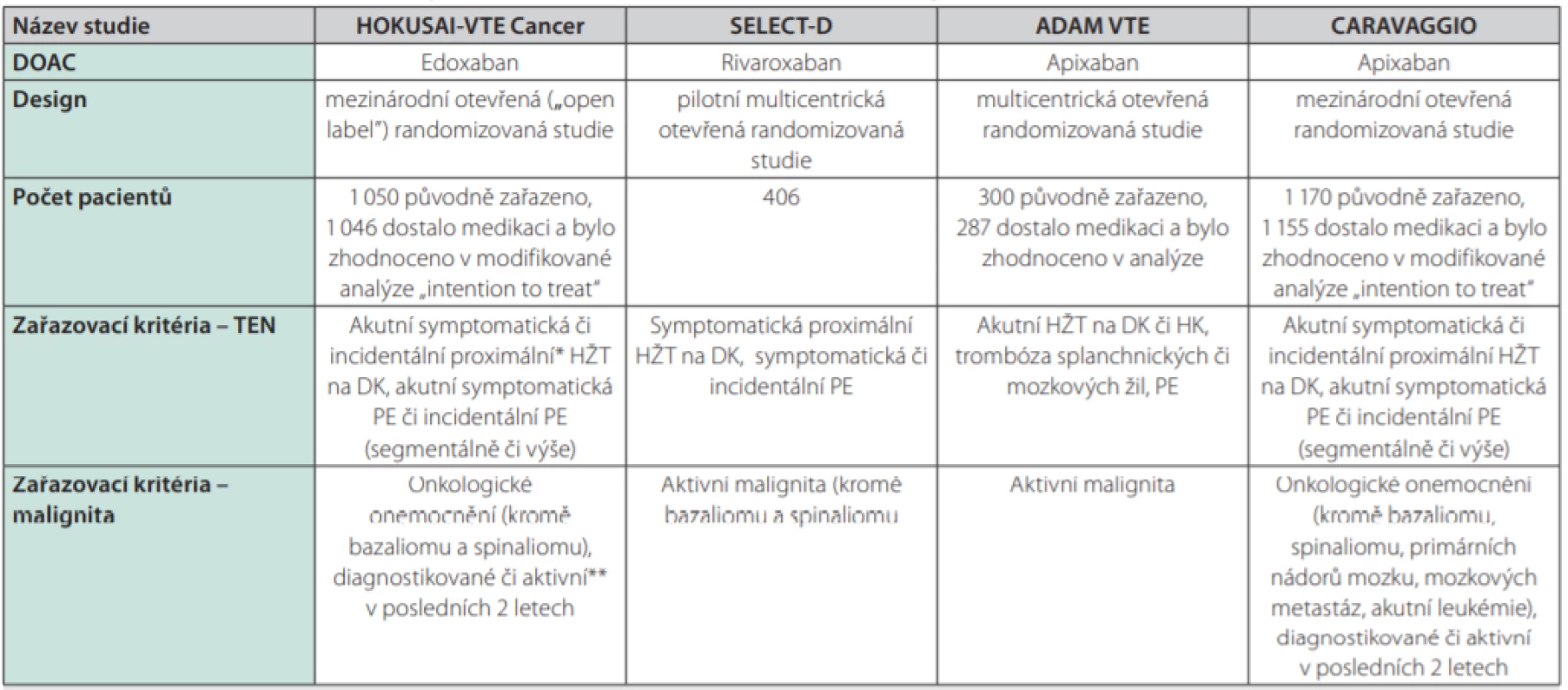
DOAC – přímá orální antikoagulancia; LMWH – nízkomolekulární heparin; TEN – tromboembolická nemoc; HŽT – hluboká žilní trombóza; DK – dolní končetina; PE – plicní embolie; HK – horní končetina
* tj. postihující popliteální, femorální, ilickou žílu či dolní dutou žílu
**tj. onkologické onemocnění diagnostikované v posledních 6 měsících; léčené v posledních 6 měsících; recidivující, lokálně pokročilý či metastazující zhoubný nádor; hematoonkologické onemocnění, u nějž nebylo dosaženo kompletní remiseVyřazovací kritéria zahrnovala kromě obvyklých a očekávatelných kritérií (trombektomie, implantace kaválního filtru, trombolýza; podávání antikoagulační léčby z jiné indikace; krátká očekávaná délka života, resp. < 3 měsíce; závažné jaterní poškození; nekontrolovaná hypertenze; ženy v reprodukčním věku bez řádné antikoncepce; aktivní krvácení či kontraindikace antikoagulační léčby) také:
- špatnou celkovou výkonnost, resp. hodnotu 3–4 na tzv. ECOG škále (Eastern Cooperative Oncology Group Performance status), tj. pacient jen velmi omezeně schopen či zcela neschopen sebepéče
- renální insuficienci s hodnotou kalkulované kreatininové clearance < 30 ml/min
- trombocytopenii s počtem krevních destiček < 50 × 109 /l
- déletrvající léčbu nesteroidními antiflogistiky, duální antiagregační medikací, kyselinou acetylsalicylovou (ASA) v dávce > 100 mg denně či inhibitory glykoproteinu P (Pgp)
Podávaná medikace: 522 pacientů bylo léčeno edoxabanem v dáv ‑ ce 60 mg denně (edoxabanu předcházela počáteční, alespoň pětidenní léčba LMWH; redukovaná dávka edoxabanu 30 mg denně byla zvolena v případě renální insuficience, resp. kreatininové clearance 30–50 ml/min či v případě hmotnosti < 60 kg nebo přechodně při nutnosti užívání silných inhibitorů Pgp v průběhu studie) a 524 dalteparinem (v dávce 200 IU/kg s.c. 1 měsíc, poté 150 IU/kg). Léčba trvala 6–12 měsíců (medián 211 dní ve skupině edoxabanové a 184 dní ve skupině dalteparinové) a celkové sledování 12 měsíců.Výsledky: Byla použita tzv. modifikovaná analýza „intention to treat“, tj. se zahrnutím pacientů, kteří užili alespoň 1 dávku medikace, k níž byli randomizováni. Studie byla zaměřena na průkaz noninferiority edoxabanu ve srovnání s dalteparinem co do výskytu primárního výsledku, tedy recidivy TEN či závažného krvácení. Výskyt tohoto souhrnného ukazatele byl srovnatelný v obou skupinách – 12,8 % při léčbě edoxabanem a 13,5 % při LMWH (poměr rizik – hazard ratio HR 0,97; 95% interval spolehlivosti – konfidenční interval CI 0,70–1,36).Autoři zhodnotili i sekundární ukazatele
- Recidiva TEN byla méně častá ve skupině edoxabanové, avšak statisticky nevýznamně – 7,9 % ve skupině edoxabanové a 11,3 % ve skupině dalteparinové (HR 0,71; 95% CI 0,48–1,06). Z toho výskyt HŽT při léčbě edoxabanem oproti dalteparinu byl významně nižší – 3,6 % versus 6,7 %; výskyt PE srovnatelný – 5,2 % versus 5,3 %.
- K závažnému krvácení došlo významně častěji po edoxabanu – 6,9 % versus 4,0 % po dalteparinu (HR 1,77; 95% CI 1,03–3,04).
- Klinicky relevantní nezávažné krvácení (clinically relevant non‑major bleeding, CRNMB) bylo rovněž častější po edoxabanu, avšak statisticky nevýznamně – 14,6 % versus 11,1 % (HR 1,38; 95% CI 0,98–1,94). Definice závažného krvácení a CRNMB je uvedena v tabulce 2.
- K úmrtí (z jakékoli příčiny) došlo u 39,5 % v edoxabanové a u 36,6 % v dalteparinové skupině (HR 1,12; 95% CI 0,77–1,11). Naprostá většina úmrtí nastala v souvislosti s onkologickým onemocněním (34,7 % versus 32,8 %).
Tab. 2. Definice závažného krvácení a klinicky relevantního nezávažného krvácení 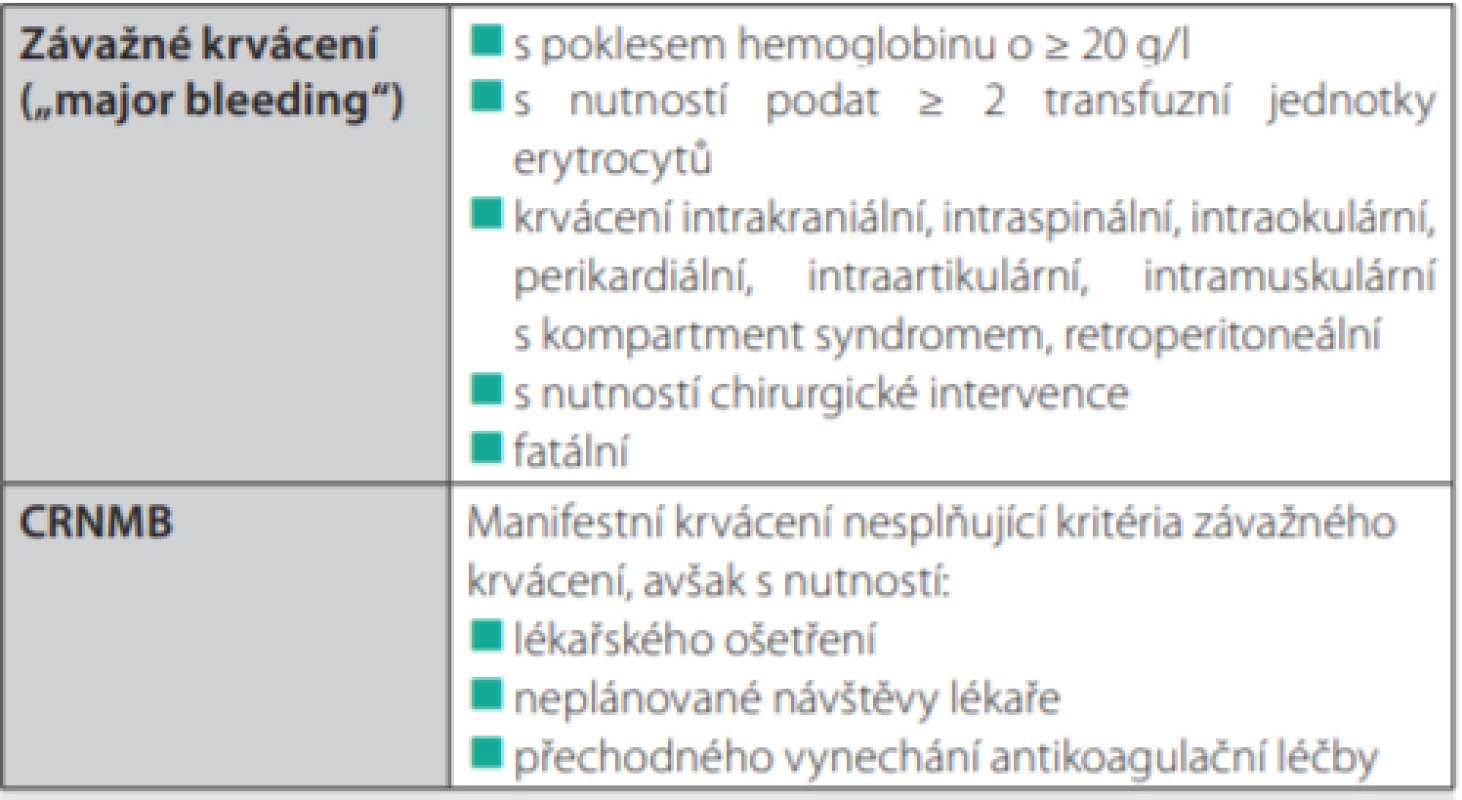
CRNMB – klinicky relevantní nezávažné krvácení („clinically relevant non-major bleeding“) Analýza podskupin: Sledované ukazatele nebyly výrazně rozdílné v jednotlivých podskupinách s výjimkou podskupiny nemocných s karcinomem gastrointestinálního traktu (GIT). Ti přestavovali zhruba třetinu studijní populace. Při léčbě edoxabanem měli výrazně vyšší riziko závažného krvácení. Rozdělením na podskupiny podle jednotlivých typů malignit bylo zjištěno, že edoxaban má u většiny typů malignit podobný poměr rizika ku prospěchu, avšak u karcinomu GIT je nižší riziko recidivy převáženo vyšším rizikem závažného krvácení (8).
Limitace a přednosti studie: Zřejmou limitací je design „open‑label“, ten je ale ospravedlnitelný (dvojitě slepá studie s podáváním placeba v s.c. injekcích nebyla považována za vhodnou). Původní studie, prokazující superioritu LMWH nad warfarinem měly však rovněž tento design. Dále autoři upozorňují na fakt, že kratší trvání léčby dalteparinem oproti léčbě edoxabanem (medián 184 versus 211 dní) mohlo ovlivnit srovnání účinnosti v obou větvích. Nicméně rozdíl v trvání medikace byl dán hlavně častějším přerušením medikace v dalteparinové skupině z důvodu diskomfortu pacientů. To vlastně potvrdilo, že umožnění orální léčby TEN u onkologických pacientů je velmi žádoucí.
Předností studie je, že zahrnula široké spektrum pacientů s různými typy malignit i různými typy protinádorové léčby.
Dodatečná („post -hoc“) analýza extendované léčby se soustředila na ty pacienty ze studie, kteří pokračovali ve studijní medikaci od 6. do 12. měsíce. Jednalo se o 273 nemocných na dalteparinu a 294 na edoxabanu. Sledovaný primární výsledek byl rovněž složen z recidivy TEN a závažného krvácení a jeho výskyt byl srovnatelný v obou skupinách – 2,2 % u dalteparinu versus 2,4 % u edoxabanu (recidiva TEN 1,1 % versus 0,7 %; závažné krvácení 1,1 % versus 1,7 %). Autoři zhodnotili extendovanou léčbu edoxabanem jako srovnatelnou s dalteparinem (9).
Studie s rivaroxabanem
Pilotní studie SELECT‑D byla uskutečněna ve Velké Británii, nábor probíhal od září 2013 do konce roku 2016, zařadila 406 pacientů a výsledky byly publikovány v polovině roku 2018 (10).
Design studie a zařazovací kritéria – viz tabulka 1.
Vyřazovací kritéria byla podobná jako ve studii HOKUSAI‑VTE Cancer, i když s mírnými rozdíly. Nebyli zařazeni pacienti mladší než 18 let; s tělesnou hmotností < 40 kg; s hodnotou ECOG ≥ 3; s jaterní či renální insuficiencí; s pozitivní osobní anamnézou TEN; s velkým rizikem krvácení či s aktivním krvácením; nekontrolovanou hypertenzí; bakteriální endokarditidou; s antikoagulační medikací zahájenou již před vstupem do studie (resp. před > 96 hodinami) a s konkomitantní medikací ASA v dávce > 75 mg; dále ženy v reprodukčním věku bez řádné antikoncepce. Během studie nesměly být používání silné inhibitory či induktory cytochromu P450 CYP-3A4 či Pgp.
Během studie přibylo ještě jedno vyřazovací kritérium. Předběžná analýza bezpečnosti (po zařazení prvních 220 pacientů) totiž odhalila rozdíl v krvácivých komplikacích mezi oběma větvemi studie, a to v podskupině 19 nemocných s karcinomem jícnu či gastroesofageálního spojení. Monitorující komise poté jako bezpečnostní opatření vyřadila případné další pacienty s touto lokalizací karcinomu z náboru do studie.
Podávaná medikace: k léčbě dalteparinem bylo randomizováno 203 nemocných, v obvyklém dávkovacím schématu (200 IU/kg s.c. 1 měsíc, poté 150 IU/kg po dalších 5 měsíců) s případnou redukcí dávky či přerušením léčby při poklesu počtu trombocytů či zhoršení renálních funkcí. Rivaroxaban užívalo rovněž 203 nemocných, v dávce 15 mg 2× denně po 3 týdny a poté 20 mg 1× denně, v celkové délce 6 měsíců, tato dávka byla přechodně snížena v případě zhoršení renálních funkcí. Léčba rivaroxabanem byla přerušena, pokud došlo k poklesu počtu trombocytů < 50 × 109 /l. Medián trvání léčby byl 5,8 měsíců ve skupině dalteparinové a 5,9 měsíců ve skupině rivaroxabanové. Nemocní byli sledováni až po dobu 24 měsíců, a to v intervalech 3 měsíců během prvního roku a poté v intervalech 6 měsíců.
Výsledky
Byla použita analýza „intention to treat“ se zařazením 406 pacientů (z nich bylo 11 vyřazeno z různých důvodů na začátku studie a jen 216 nemocných dokončilo 6 měsíců studijní léčby, nejčastějším důvodem předčasného ukončení bylo úmrtí, a to v obou větvích studie).
Primárním výsledkem byl výskyt recidivy TEN, definované jako proximální HŽT, symptomatická či incidentální PE, ale také trombóza v jiných lokalizacích – trombóza podklíčkové, jaterní či dolní duté žíly. Kumulativní výskyt recidivy TEN po 6 měsících byl 11 % ve skupině dalteparinové a 4 % ve skupině rivaroxabanové (HR 0,43; 95% CI 0,19-0,99). Co do typu recidivy, v obou větvích nebyl významný rozdíl ve srovnání výskytu HŽT, PE či trombózy v jiné lokalizaci, ve skupině dalteparinové bylo výrazně více incidentální PE. Prediktory recidivy TEN v obou skupinách byla lokalizace tumoru (nejvyšší riziko recidivy TEN měli nemocní s karcinomem pankreatu a žaludku; poté s karcinomem plic, lymfomem, gynekologickými nádory a tumory močového měchýře; vyšší riziko také bylo spojeno se symptomatickou TEN oproti incidentální).
Sekundárním sledovaným výsledkem byly ukazatele bezpečnosti.
- Kumulativní výskyt závažného krvácení po 6 měsících byl po rivaroxabanu nevýznamně zvýšen – dalteparin versus rivaroxaban – 4 % versus 6 % (HR 1,83; 95% CI 0,68–4,96). Převládalo krvácení z GIT, nedošlo ke krvácení v oblasti centrálního nervového systému (CNS).
- CRNMB bylo významně častější po rivaroxabanu – 13 % versus 4 % po dalteparinu (HR 3,76; 95% CI 1,63–8,69), většina těchto krvácení byla z GIT či urotraktu.
- Během 6 měsíců zemřelo celkem 104 pacientů, ve skupině dalteparinové 56 a ve skupině rivaroxabanové 48.
Limitace a přednosti studie: Studie SELECT‑D měla stejně jako HOKUSAI‑VTE Cancer design „open‑label“, byla však svým rozsahem menší. Nábor probíhal pomaleji, než autoři předpokládali; původně bylo zamýšleno zařadit vyšší počet pacientů. Během studie byla z bezpečnostních důvodů změněna vyřazovací kritéria (resp. přestali být zařazováni nemocní s karcinomem jícnu či gastroesofageálního spojení). Jako přínosný detail lze hodnotit, že do hodnocení primárního výsledku byly zahrnuty i trombózy v jiných lokalizacích.
Studie extendované léčby rivaroxabanem (SELECT -D: 12 m): Již při zahájení studie SELECT‑D bylo v plánu u části pacientů provést po dokončení 6 měsíců navazující studii s extenzí léčby po dalších 6 měsíců. Měli být zařazeni nemocní buď se vstupní PE nebo s HŽT, pokud na kontrolní sonografii byla zjištěna reziduální trombotická okluze. Tito měli být randomizováni k další léčbě buď rivaroxabanem nebo placebem. Nicméně nábor do této pokračující studie probíhal pomalu a byl předčasně ukončen, zařazeno bylo jen 92 pacientů. V prvních 6 měsících studie SELECT‑D zemřelo 25 % pacientů a u možných kandidátů pokračující studie jistě proběhla ze strany ošetřujících kliniků určitá selekce. Výsledky studie SELECT‑D: 12 m sice prokázaly redukci rizika recidivy TEN při léčbě rivaroxabanem oproti placebu (4 % versus 14 %; HR 0,32, 95% CI 0,06–1,58), avšak bez statistické významnosti. Závažné krvácení a CRNMB bylo 0 % a 0 % na placebu; 5 % a 4 % na rivaroxabanu (11).
Studie s apixabanem
ADAM‑VTE
Tato rovněž menší studie probíhala v USA od listopadu 2015 do října 2017 a výsledky byly publikovány v roce 2020 (12). Bylo zařazeno 300 nemocných.
Design studie a zařazovací kritéria – viz tabulka 1.
Vyřazovací kritéria: opět zahrnují věk < 18 let; očekávanou délku přežití ≤ 60 dní; hodnotu ECOG ≥ 3; jaterní či renální insuficienci; aktivní krvácení; počet trombocytů < 50 × 109 /l; zahájení antikoagulační medikace již před vstupem do studie (resp. před> 7 dny); předchozí selhání antikoagulace; HIT v minulosti; graviditu; užívání silných induktorů CYP 3A4.
Podávaná medikace: 142 nemocných užívalo dalteparin (200 IU/kg s.c. 1 měsíc, poté 150 IU/kg po dalších 5 měsíců) s případnou úpravou dávky při výrazné změně váhy (> 10%), při poklesu kreatininové clearance na 15–30 ml/min (při poklesu < 15 ml/min byl dalteparin přechodně vynechán až do úpravy stavu). K léčbě apixabanem bylo randomizováno 145 nemocných, a to v dávce 10 mg 2× denně po 7 dní a poté 5 mg 2× denně po 6 měsíců, s případnou redukcí dávky na 2,5 mg 2× denně při nutnosti užití silných inhibitorů CYP 3A4 či Pgp. Dávky dalteparinu i apixabanu byly sníženy na profylaktické při poklesu počtu trombocytů na 25–50 × 109 /l a oba léky byly vynechány při snížení < 25 × 109 /l. Léčba byla rovněž přerušována na nezbytnou dobu v případě nutnosti invazivních výkonů. Medián trvání léčby byl 5,65 měsíců u dalteparinu a 5,78 měsíců u apixabanu. Pacienti byli sledováni po dobu 6 měsíců v měsíčních intervalech.
Výsledky
Na rozdíl od předchozích 2 studií, v této byl primárním výsledkem výskyt závažného krvácení a studie byla zaměřena na průkaz superiority apixabanu. Výskyt závažného krvácení byl nízký – 0 ve skupině apixabanové a 1,4 % ve skupině dalteparinové.
Sekundární sledovaný výsledek, resp. výskyt recidivy TEN, byl signifikantně snížen při léčbě apixabanem – 0,7 % oproti 6,3 % při dalteparinu (HR 0,099; 95% CI 0,013–0,780). Hodnocen byl i výskyt arteriální trombózy, ten tvořil 0,7 % v obou skupinách.
Výskyt CRNMB byl 6,2 % po apixabanu a 4,2 % po dalteparinu.
Hodnocena byla také kvalita života, ta byla významně lepší u pacientů na apixabanu. Léčbu dalteparinem přerušilo 22 nemocných, apixabanem 6 nemocných.
Během studie došlo k úmrtí v 16 % v apixabanové skupině a 11 % v dalteparinové. Rozdíl nebyl statisticky významný a úmrtí nebyla v souvislosti ani s recidivou TEN ani s krvácením.
Limitace a přednosti studie: Studie byla poměrně malá, výskyt závažného krvácení i recidivy TEN byl menší než očekávaný a 6 % pacientů bylo ztraceno ze sledování. Bylo zařazeno méně nemocných s karcinomem horní části GIT než ve studii HOKUSAI‑VTE Cancer, takže výsledky nejsou zcela porovnatelné.
Studie poskytla data o použití DOAC v onkologii i při trombózách v jiných lokalizacích a také o periprocedurální úpravě antikoagulační léčby. Důležitým přínosem bylo také zhodnocení kvality života v obou léčebných větvích.
CARAVAGGIO
Jedná se o velkou a zatím poslední v řadě randomizovaných studií porovnávajících DOAC s LMWH v léčbě TEN asociované s malignitou. Nábor pacientů probíhal od dubna 2017 do poloviny loňského roku, se zařazením celkem 1170 pacientů, výsledky byly publikovány v dubnu 2020 (13).
Design studie a zařazovací kritéria – viz tabulka 1.
Vyřazovací kritéria byla jen lehce odlišná než v předchozích studiích – trombektomie, implantace kaválního filtru, trombolýza; podávání antikoagulační léčby z jiné indikace či zahájení antikoagulační léčby již před randomizací; očekávaná doba dožití < 6 měsíců; hodnota ECOG 3–4; závažné jaterní poškození; nekontrolovaná hypertenze; bakteriální endokarditis; aktivní krvácení či kontraindikace antikoagulační léčby; kreatininová clearance < 30 ml/min; počet krevních destiček < 75 × 109 /l; hemoglobin < 80 g/l; anamnéza HIT; ženy v reprodukčním věku bez řádné antikoncepce; současné užívání thienopyridinů, ASA > 165 mg, duální antiagregační medikace, silných inhibitorů či induktorů CYP3A4 či Pgp; nedávná operace mozku, páteře či očí.
Podávaná medikace: k léčbě apixabanem bylo randomizováno 576 (10 mg 2× denně po 7 dní a poté 5 mg 2× denně po 6 měsíců), k dalteparinu 579 nemocných (200 IU/kg s.c. 1 měsíc, poté 150 IU/kg po dalších 5 měsíců). Přerušení léčby bylo možné z důvodů invazivních výkonů či poklesu počtu trombocytů pod 50 × 109 /l. Medián trvání léčby byl 178 dní u apixabanu a 175 u dalteparinu. Pacienti byli kontrolováni za 1, 3, 6 a 7 měsíců od randomizace.
Výsledky
Jako primární ukazatel účinnosti byl hodnocen výskyt recidivy TEN (definovaná jako symptomatická či incidentální proximální HŽT dolní končetiny, symptomatická HŽT horní končetiny, symptomatická, incidentální či fatální PE) během 6 měsíců. Recidiva TEN byla méně častá po apixabanu, statisticky však nevýznamně (HR 0,63; 95% CI 0,37–1,07 – prokázána noninferiorita).
Primárním ukazatelem bezpečnosti byl výskyt závažného krvácení, tento se významně nelišil ve skupině apixabanové oproti dalteparinové – 3,8 % versus 4,0 % (HR 0,82; 95% CI 0,40–1,69), přičemž závažné krvácení z GIT se vyskytlo v 1,9 % versus 1,7 %.
Sekundárním výsledkem byl složený ukazatel recidivy TEN a závažného krvácení, v tomto opět nebyl významný rozdíl – apixaban versus dalteparin 8,9 % versus 11,4 % (HR 0,70; 95% CI 0,45–1,07). CRNMB se vyskytlo v 9 % versus 6 % (HR 1,42; 95% CI 0,88–2,30); ve skupině apixabanové se jednalo převážně o krvácení z urogenitálního traktu a horních cest dýchacích. CRNMB z GIT po apixabanu bylo sice častější, avšak statisticky nevýznamně. Počet úmrtí v obou skupinách se také významněji nelišil – 23,4 % versus 26,4 % (v naprosté většině příčina souvisela s onkologickým onemocněním – v 85,2 %, resp. v 88,2 %).
Analýza podskupin: V podskupině pacientů mladších než 65 let byla účinnost apixabanu podstatně vyšší než dalteparinu (recidiva TEN v 3,5 % versus 12,9 %; p = 0,0065).
Limitace a přednosti studie: Jako u předchozích studií, i zde byl ze zřejmých důvodů zvolen design „open‑label“. Krvácení z GIT nebylo předem specifikováno jako sledovaný cíl. Vyřazeni byli pacienti s tumory mozku, s mozkovými metastázami a akutní leukémií, na tyto diagnózy nelze tedy výsledky vztahovat.
Předností je, že byli zahrnuti pacienti s širokou škálou onkologických diagnóz, převážně v pokročilém stadiu; rovněž s širokým spektrem protinádorové léčby. Přibližně 1/3 nemocných měla nádor GIT.
Doporučení odborných společností
Na nová data rychle zareagovaly mezinárodní odborné společnosti aktualizací doporučení v roce 2018 a 2019 (14–16).
Oproti předchozím doporučením (jednoznačně zdůrazňujícím preferenci LMWH v léčbě TEN asociované s malignitou) jsou nyní jako lék volby uváděna rovněž DOAC s tím, že zvláštní důraz je kladen na:
- individualizaci léčby a respektování přání pacienta,
- volbu DOAC především u nemocných s nízkým rizikem krvácení,
- zhodnocení možných interakcí DOAC s probíhající onkologickou léčbou,
- preferenci LMWH u pacientů s vysokým rizikem krvácení a zejména v případě luminálního nádoru GIT, nádorů urogenitálního traktu s předpokládaným rizikem krvácení, přítomnosti cystostomie či nefrostomie, aktivní slizniční patologie GIT (duodenální vřed, gastritis, esofagitis, colitis).
Autoři uvedených dokumentů z let 2018 a 2019 zdůraznili, že zatím pouze edoxaban a rivaroxaban mají data o porovnání s LMWH z randomizovaných studií.
Je pravděpodobné, že také nově publikovaná studie CARAVAGGIO nyní ovlivní odborná doporučení a následně i naše klinické rozhodování. V další verzi aktualizovaných doporučení bude jistě jako volba zmíněn i apixaban. Ukazatele účinnosti i bezpečnosti byly příznivé, výskyt závažného krvácení srovnatelný s LMWH, a to včetně krvácení z GIT i při poměrně velkém zastoupení tumorů GIT ve studii.
Jistě bude třeba velké opatrnosti při lokalizaci tumoru v horní části GIT (těch byl ve studiích jen malý podíl). U všech DOAC je nutno pomýšlet na riziko krvácení z urogenitálního traktu (častá příčina CRNMB). Nedostatek informací máme o typech malignit, které byly ve studiích zastoupeny jen málo či vůbec, např. hematoonkologická onemocnění, tumory mozku aj. Detaily o zastoupení jednotlivých typů malignit a o lokalizaci závažného krvácení ukazují tabulky 3 a 4.
Tab. 3. Zastoupení jednotlivých typů malignit ve studiích srovnávajících DOAC s LMWH v léčbě TEN asociované s malignitou 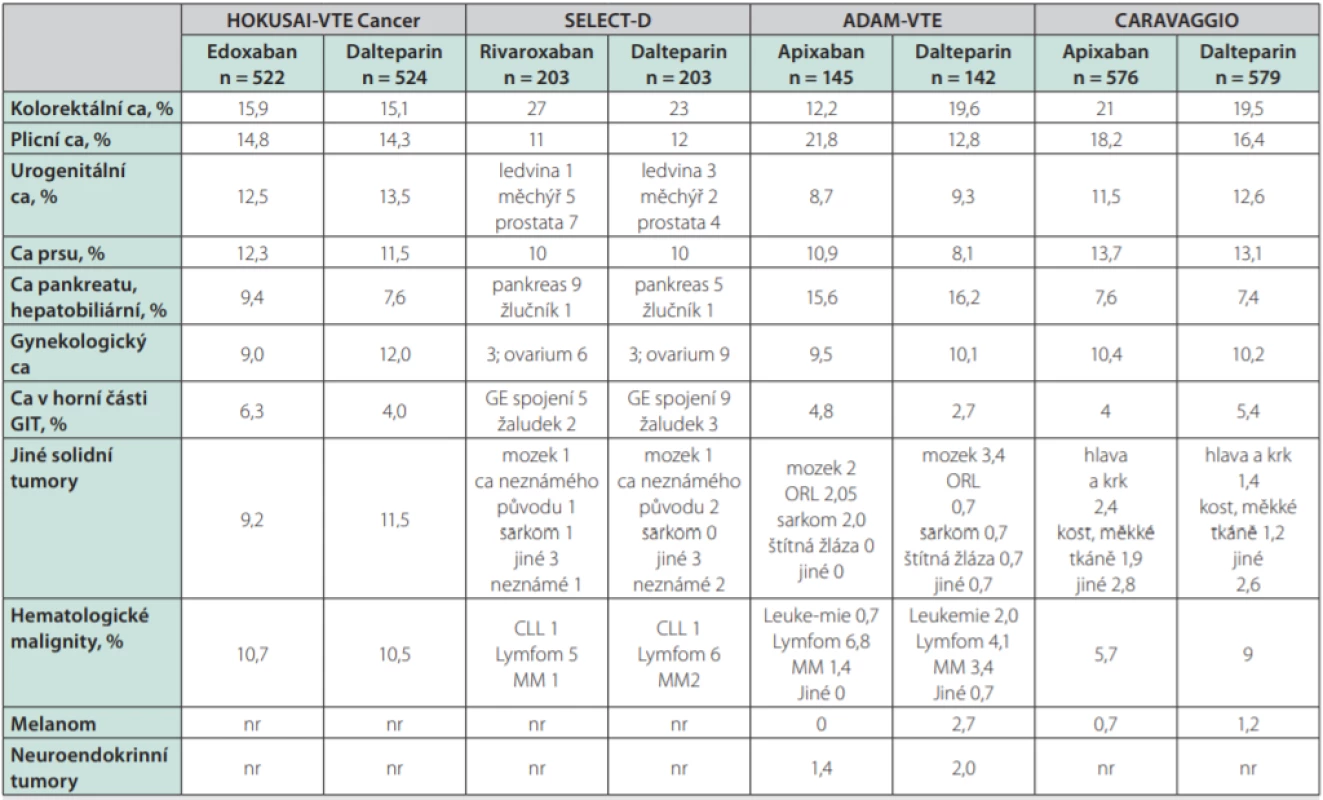
DOAC – přímá orální antikoagulancia; LMWH – nízkomolekulární heparin; TEN – tromboembolická nemoc;
Ca – karcinom; GIT – gastrointestinální trakt; CLL – chronická lymfocytární leukémie; MM – mnohočetný myelom; ORL – nádory v oblasti ucha, krku a nosu; nr – not reported – neuvedenoTab. 4. Lokalizace závažného krvácení ve studiích srovnávajících DOAC s LMWH v léčbě TEN asociované s malignitou 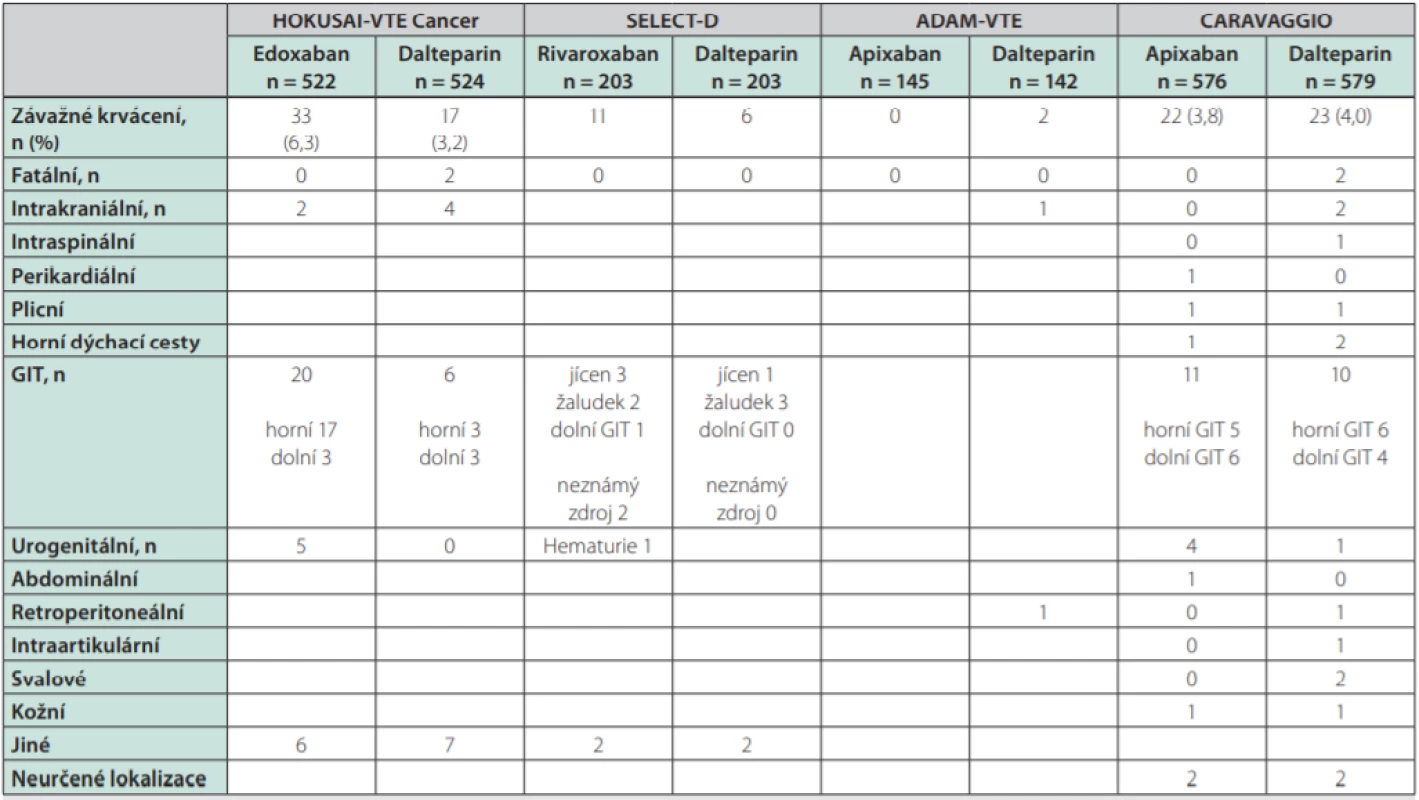
DOAC – přímá orální antikoagulancia; LMWH – nízkomolekulární heparin; TEN – tromboembolická nemoc; GIT – gastrointestinální trakt Dále musíme mít na zřeteli lékové interakce (zejména současnou léčbu induktory nebo inhibitory CYP3A4 či Pgp).
Nemáme ani důkazy o bezpečnosti DOAC u pacientů vyřazených z náboru do studie, tedy např. se závažnější insuficiencí jater nebo ledvin, s těžší trombocytopenií či anémií, se zvýšeným rizikem krvácení. Problémem bude i použití DOAC v případě omezení či nemožnosti perorální léčby (nauzea, zvracení, mucositis, stavy po operacích na GIT) (17).
Závěr
Nové studie s DOAC v léčbě TEN asociované s malignitou přinášejí naději pacientům postiženým nejen svým základním onemocněním, ale i závažnou tromboembolickou komplikací, přinejmenším naději na lepší kvalitu života bez nutnosti každodenní injekční léčby. Výsledky navíc naznačují i trend k lepší účinnosti DOAC v prevenci recidivy TEN. DOAC však nebudou volbou pro každého onkologického nemocného s TEN, u značné části z nich bude bezpečnější LMWH. Individualizace léčby a pečlivé zhodnocení poměru rizik a benefitu v tomto kontextu ještě nabývá na důležitosti.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Jana Hirmerová, Ph.D.,
II. interní klinka FN Plzeň,
Edvarda Beneše 1128/13,
305 99 Plzeň-Bory
Cit. zkr: Vnitř Lék 2020; 66(4): 225–231
Článek přijat redakcí: 6. 5. 2020
Článek přijat k publikaci: 29. 5. 2020
Zdroje
1. Prandoni P, Lensing AW, Piccioli, et al. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis. Blood 2002; 100 (10): 3484–3488.
2. Kearon C, Kahn SR, Agnelli G, et al. Antithrombotic therapy for venous thomboembolic disease: American College of Chest Physicians Evidence‑Based Clinical Practice Guidelines (8th Edition). Chest. 2008 Jun; 133(6 Suppl): 454S–545S.
3. Lee AY, Peterson EA. Treatment of cancer‑associated thrombosis. Blood. 2013; 122(14): 2310–2317
4. Kearon C, Akl EA, Omelas J, et al.Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest 2016; 149 : 315–352.
5. Noble SI, Finlay IG. Is long‑term low‑molecular‑weight heparin acceptable to palliative care patients in the treatment of cancer related venous thromboembolism? A qualitative study. Palliat Med. 2005; 19(3): 197–201.
6. van der Wall SJ, Klok FA, den Exter PL, Barrios D, Morillo R, Cannegieter SC, et al. Continuation of low‑molecular‑weight heparin treatment for cancer‑related venous thromboembolism: a prospective cohort study in daily clinical practice. J Thromb Haemost. 2017; 15(1): 74–79.
7. Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D, et al. Edoxaban for the Treatment of Cancer‑Associated Venous Thromboembolism. N Engl J Med. 2018; 378(7): 615–624.
8. Mulder FI, van Es N, Kraaijpoel N, et al. Edoxaban for treatment of venous thromboem ‑ bolism in patient groups with different types of cancer: Results from the Hokusai VTE Cancer study. Thromb Res. 2020; 185 : 13–19.
9. Di Nisio M, van Es N, Carrier M, et al. Extended treatment with edoxaban in cancer patients with venous thromboembolism: A post‑hoc analysis of the Hokusai‑VTE Cancer study. J Thromb Haemost. 2019; 17(11): 1866–1874.
10. Young AM, Marshall A, Thirlwall J, et al. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT‑D). J Clin Oncol. 2018; 36(20): 2017–2023.
11. Marshall A, Levine M, Hill C, et al.Treatment of cancer‑associated venous thromboembolism: 12-month outcomes of the placebo versus rivaroxaban randomization of the SELECT‑D Trial (SELECT‑D: 12 m). J Thromb Haemost. 2020; 18(4): 905–915.
12. McBane RD 2nd, Wysokinski WE, Le‑Rademacher JG, et al. Apixaban and dalteparin in active malignancy‑associated venous thromboembolism: The ADAM VTE trial. J Thromb Haemost. 2020; 18(2): 411–421.
13. Agnelli G, Becattini C, Meyer G. Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. N Engl J Med. 2020; 23; 382(17): 1599–1607.
14. Khorana AA, Noble S, Lee AYY, et al. Role of direct oral anticoagulants in the treatment of cancer‑associated venous thromboembolism: guidance from the SSC of the ISTH. J Thromb Haemost 2018; 16(9): 1891–1894.
15. Key NS, Khorana AA, Kuderer NM, et al. Venous Thromboembolism Prophylaxis and Treatment in Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2020; 38(5): 496–520.
16. Farge D, Frere C, Connors JM, et al. 2019 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. Lancet Oncol. 2019; 20(10): e566–e581.
17. Moik F, Pabinger I, Ay C. How I treat cancer‑associated thrombosis. ESMO Open. 2020;5(1):e000610. doi:10.1136/esmoopen-2019-000610.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázyČlánek Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientovČlánek Mikroskopická polyangiitídaČlánek Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvinČlánek Jaterní fibróza
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 4- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Existují rozdíly v dlouhodobé účinnosti různých trojkombinací v léčbě hypertenze?
- Prevalence a prediktory deficitu vitaminu B12 u pacientů s DM2 dlouhodobě léčených metforminem – poznatky z čerstvé průřezové studie
-
Všechny články tohoto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Hyperurikemie z perspektivy nefrologického pacienta
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



