-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
Heparin-induced thrombocytopenia: a case report and literature overview
Heparin-induced thrombocytopenia (HIT) is an immunologically-mediated complication, which usually follows heparin exposition, less frequently exposition to other drugs or even occurs spontaneously. The type of heparin, its dose and mode of application as well as the exposition time, major trauma or operation, and obesity represent the main risk factors for HIT. The probability of HIT correlates with so-called 4T-score. A confirmatory laboratory diagnostic should be exclusively reserved for patients with a medium to a high probability of HIT development (more than 3 points in 4T-score). The screening method is based on serological detection of antibodies against heparin-platelet factor-4 complexes; confirmation tests aim to identify the activation of platelets. The treatment of HIT requires an immediate interruption of heparin application and rigorous antithrombotic treatment with an alternative agent. Herein authors describe a clinical case of HIT manifested as an extreme urticarial reaction in the location of nadroparin application as well as thrombosis of deep subcutaneous veins in a polymorbid obese patient with an extensive and infected burn. Due to timely diagnosis and fondaparinux treatment, no more severe thrombotic events occurred in this patient.
Keywords:
thrombosis – direct oral anticoagulants – fondaparinux – heparin‑induced thrombocytopenia – 4T-scores
Autoři: Pavel Polák 1; Yvona Kaloudová 2; Hana Krupicová 2; Pavel Coufal 2; Břetislav Lipový 2; Jiřina Zavřelová 1,3; Marie Prudková 1,3; Andrea Štěpařová 1,3; Lucie Říhová 1,3; Renata Bezděková 1; Romana Králová 1; Lukáš Frola 4; Miroslav Penka 1,3
Působiště autorů: Oddělení klinické hematologie FN Brno, pracoviště Bohunice 1; Klinika popálenin a plastické chirurgie LF MU a FN Brno, pracoviště Bohunice 2; Katedra laboratorních metod LF MU Brno 3; Ústav patologie LF MU a FN Brno, pracoviště Bohunice 4
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 242-248
Kategorie: Kazuistika
Souhrn
Heparinem indukovaná trombocytopenie (HIT) je imunologicky zprostředkovaná komplikace navazující zpravidla na expozici heparinu, méně často se rozvíjí po expozici jiným léčivům anebo spontánně. Mezi rizikové faktory rozvoje HIT patří typ použitého heparinu, jeho dávka a způsob aplikace i doba expozice, velké trauma či operace a obezita. Pravděpodobnost HIT dobře koreluje s tzv. 4 T‑skóre. Laboratorní testy k potvrzení či vyloučení HIT se mají provádět u pacientů se střední až vysokou pravděpodobností HIT (4 T‑skóre více než 3 body). Screeningové testy jsou založeny na průkazu protilátek proti komplexům heparinu a destičkového faktoru 4, cílem konfirmačních testů je průkaz aktivace trombocytů. Léčba HIT spočívá v okamžitém ukončení aplikace heparinu a v důsledné antitrombotické léčbě alternativními modalitami. Autoři popisují případ HIT u interně polymorbidní obézní pacientky s rozsáhlou infikovanou popáleninou projevující se extrémní urtikariální reakcí v místě aplikace nadroparinu a trombotizací žil podkoží. Díky včasné diagnostice a léčbě fondaparinuxem nedošlo k rozvoji závažnějších tromboembolických příhod.
Klíčová slova:
fondaparinux – heparinem indukovaná trombocytopenie – přímá perorální antikoagulancia – trombóza – 4 T‑skóre
Úvod
Heparinem indukovaná trombocytopenie (HIT) je klinicko patologický syndrom charakterizovaný trombocytopenií a trombotickými komplikacemi. Patofyziologicky se rozlišuje tzv. HIT-1, též zvané jako heparinem asociovaná trombocytopenie (HAT), kdy dochází k přechodnému poklesu počtu trombocytů v důsledku přímého účinku heparinu, a to zpravidla již v prvních 2 dnech léčby (tedy neimunitním mechanismem), přičemž minimální počet trombocytů zpravidla neklesá pod 80,0 × 109 /l a léčbu heparinem není třeba přerušit. Oproti tomu je HIT-2 imunitním onemocněním, kdy dochází ke vzniku specifických protilátek IgG, nejčastěji proti komplexu destičkového faktoru 4 (platelet factor 4, PF-4) uvolňovaného z α granulí trombocytů a heparinu u pacientů léčených buď nefrakcionovaným, nebo nízkomolekulárním heparinem (Obr. 1); méně často se jedná o nežádoucí účinek jiných léčiv či dokonce o spontánní onemocnění bez zjištěného spouštěcího faktoru (1–3). V dalším textu je pojednáváno již pouze o problematice HIT-2. Mezi rizikové faktory rozvoje HIT patří mj. obezita a velký chirurgický (především ortopedický) zákrok (4, 5). Incidence HIT se odhaduje mezi 0,1–7,0 %/rok a je závislá na době léčby heparinem, na typu použitého heparinu (vyšší riziko při použití nefrakcionovaného heparinu) i na charakteristikách pacientů. U třetiny až poloviny pacientů s HIT se rozvíjí trombotické komplikace kdekoli v cévním řečišti (nejčastěji se jedná o žilní trombózy s možným postižením i mozkových splavů, může však jít i o rozsáhlou mikrovaskulární trombotizaci anebo méně často o akutní tepenné trombotické uzávěry) – přibližně 1/3 nemocných na komplikace HIT umírá, u 1/5 je během léčby HIT třeba amputovat končetinu pro nezvratnou poruchu cirkulace (3). K vyjádření klinického podezření na HIT se používá tzv. 4 T‑skóre, jež se vypočítává dle aktuální hodnoty trombocytů, dle času uplynulého od zahájení terapie heparinem, dle trombotických projevů a vyloučení jiných možných příčin (Tab. 1) (2, 3, 6–8). K laboratorní diagnostice se používají nejdříve screeningové testy založené na sérologickém průkazu cirkulujících protilátek třídy IgG proti komplexu PF-4/heparin metodou ELISA (v časné fázi HIT přesahuje senzitivita i specificita těchto testů 90,0 %, přičemž specificita je vztahována ke klinickému stavu). Je však známo, že cirkulující protilátky proti komplexu PF-4/heparin se u pacientů léčených heparinem vyskytují poměrně pravidelně a ne vždy nutně aktivují trombocyty s následnými devastujícími důsledky. Proto je vždy při pozitivním sérologickém testu nutno doplnit konfirmační vyšetření prokazující zvýšenou aktivitu trombocytů po stimulaci imunokomplexy tvořenými IgG, PF-4 a heparinem. V současnosti je zlatým standardem ke konfirmaci test uvolnění serotoninu (serotonin‑release assay – SRA), v němž jsou nejdříve trombocyty zdravého dárce inkubovány s radionuklidem značeným serotoninem, posléze je přidáno sérum pacienta se suspektní HIT a stejná šarže heparinu, kterou byl pacient dosud léčen (v nízké a ve vysoké koncentraci). Nález je pozitivní v případě průkazu uvolnění radionuklidem značeného serotoninu z trombocytů po expozici nízké koncentraci heparinu (senzitivita 90–98 %, specificita ≥ 95 %). Test SRA však není běžně dostupný, a proto se provádí i další funkční testy, mezi něž patří testy agregace trombocytů a průtoková cytometrie (3, 6, 7–12). V níže uvedené kazuistice byly provedeny testy agregace trombocytů v přítomnosti heparinu (konkrétně příslušné šarže nadroparinu, která byla u pacientky použita v profylaxi tromboembolických komplikací) s průkazem patologicky excesivní agregace trombocytů v přítomnosti jeho nízké koncentrace. Diagnóza HIT byla potvrzena rovněž pomocí průtokové cytometrie prokazující zvýšenou expresi fosfatidylserinu na zevní membráně aktivovaných trombocytů pomocí annexinu.
Tab. 1. Výpočet 4T-skóre a jeho interpretace 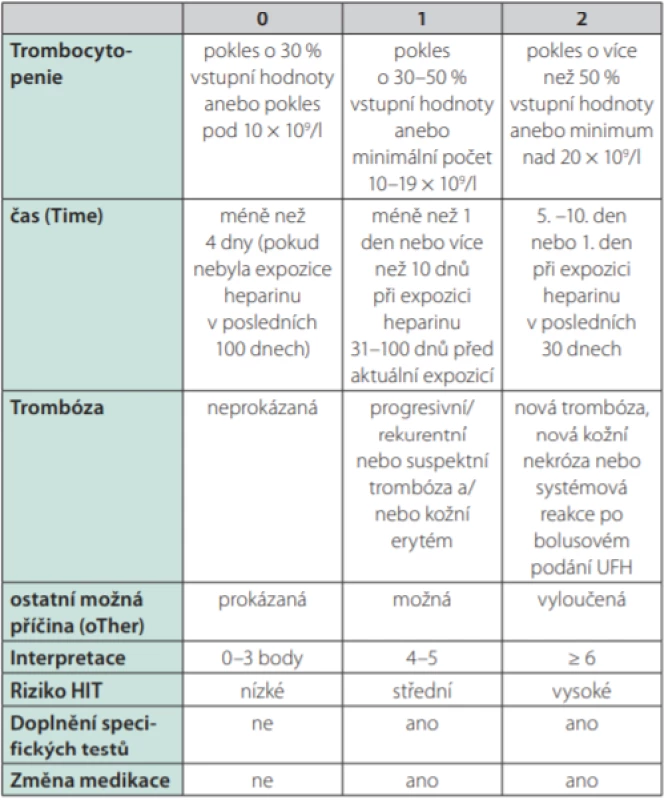
Obr. 1. Mechanismus aktivace trombocytů a rozvoje trombocytopenie u pacientů s heparinem indukovanou trombocytopenií (HIT) 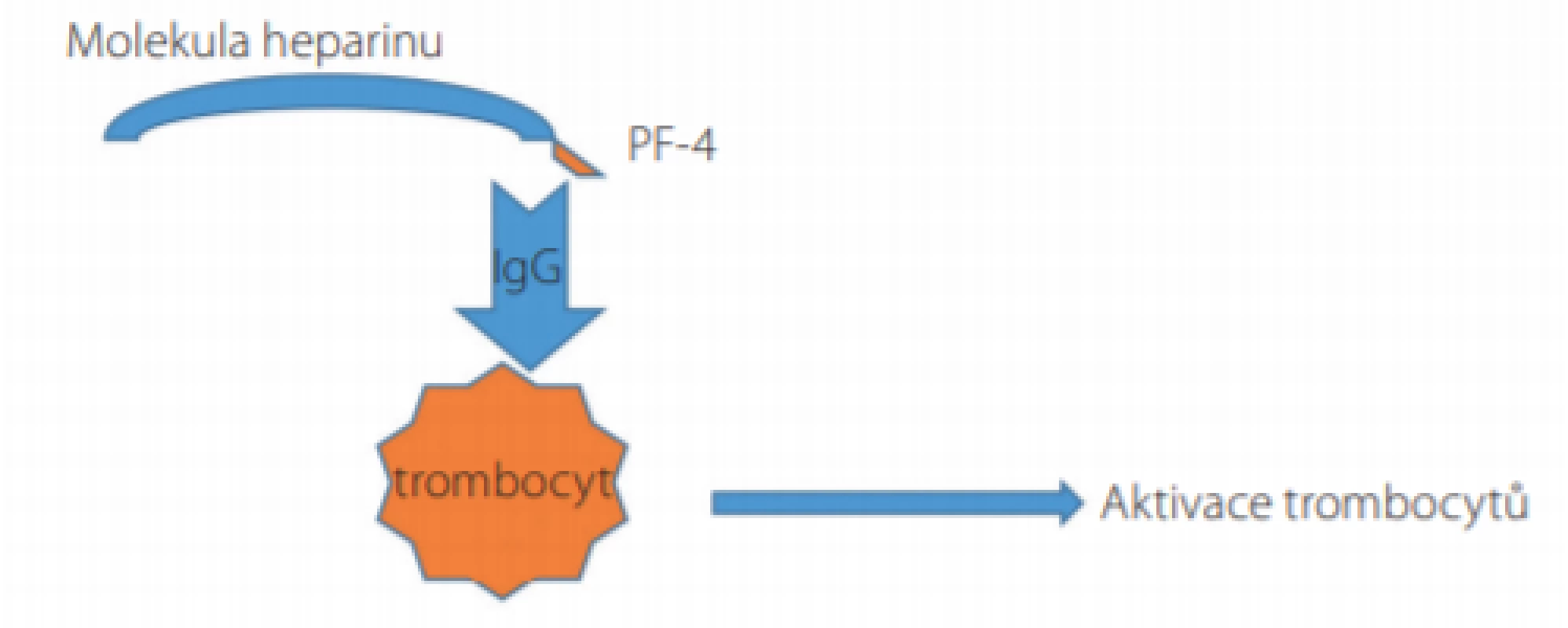
Komplex sestávající z molekuly heparinu a z molekuly destičkového faktoru-4 (PF-4) představuje imunogenní podnět s následnou syntézou imunoglobulinů třídy IgG. Tzv. Fc fragment molekuly IgG takto vzniklého ternárního komplexu je vázán na receptory FcγRIIA na povrchu trombocytů, čímž dochází k intenzivní aktivaci trombocytů, jejich degranulaci, adhezi a agregaci s rychlým vznikem tzv. destičkových trombů a se sekundární trombocytopenií. Samotný průběh HIT lze dle laboratorních nálezů rozdělit do 5 fází:
- suspektní fáze je charakterizována poklesem počtu trombocytů a nejednoznačným výsledkem funkčního i sérologického testu;
- akutní fáze je charakterizována trombocytopenií a pozitivitou sérologických i funkčních testů;
- subakutní fáze A se vyznačuje již normalizací počtu trombocytů a přetrvávající pozitivitou sérologických i funkčních testů;
- v subakutní fázi B je již funkční test negativní (navzdory perzistenci protilátek v séru prokazatelných metodou ELISA v sérologickém testu);
- poslední fází je odeznělá HIT, kdy již nejsou v séru nemocného více prokazatelné specifické protilátky.
Pokud nedochází k obnově počtu trombocytů během 4 týdnů, hovoříme o perzistující HIT. Z klinického hlediska je významné, že riziko trombotických komplikací (tzv. HITT – HIT s trombózou) trvá do doby, než je upraven počet trombocytů k normě (2, 3, 7).Po vysazení heparinu dochází u více než 90,0 % pacientů k restituci počtu trombocytů během 7 dnů; negativity funkčních testů je dosaženo v mediánu 50 dnů a cirkulující protilátky proti komplexu PF4-heparin lze v séru pacientů detekovat v mediánu ještě 85 dnů. V budoucnu je však vysoká pravděpodobnost, že po reexpozici heparinu, i třeba jednorázové, dojde k obnovené tvorbě protilátek IgG aktivujících trombocyty (sérokonverze) – tento jev bývá pozorován za 5–10 dnů od reexpozice a je nazýván jako rekurentní HIT (2, 3, 7).Heparinem indukovaná trombocytopenie je klinicky velmi variabilní onemocnění a vzhledem ke své nízké incidenci vyžaduje především bdělost ošetřujících lékařů. Autoři předkládají kazuistiku HIT diagnostikované v akutní fázi na základě abnormální kožní reakce v místě aplikace nízkomolekulárního heparinu nadroparinu.Popis případu
Žena ve věku 62 let, morbidně obézní (hmotnost 120 kg při výšce 165 cm, body mass index 44,1 kg/m2 ), hypertonička s diabetes mellitus 2. typu, byla přijata na Kliniku popálenin a plastické chirurgie FN Brno (KPPCH FN Brno) dne 10. 1. 2019 pro inveterovanou neošetřenou popáleninu pravého prsu. Dlouhodobá medikace pacientky sestávala z antidiabetik (glimepirid, metformin, dapagliflozin, inzulin lisprum), antihypertenziv (indapamid, urapidil, spironolakton, lercanidipin), kyseliny acetylsalicylové, rosuvastatinu a z kombinovaného preparátu hořčíku a kalia. Pacientka udávala alergii na penicilinová antibiotika. Fyzikálnímu vyšetření dominovala putridně páchnoucí flegmóna pravého prsu v terénu popáleniny III. stupně zasahující přibližně 5,0 % celkového tělesného povrchu a další menší ložisko popáleniny III. stupně v pravém mezogastriu. V laboratorních parametrech byla nápadná leukocytóza (diferenciální rozpočet bílých krvinek vstupně neproveden), výrazně zvýšená hodnota C‑reaktivního proteinu a retence dusíkatých katabolitů v séru (Tab. 2). Již v den přijetí do nemocnice byla zahájena antitrombotická léčba nadroparinem v dávce přibližně 50 U/kg hmotnosti, současně byla zahájena kombinovaná antibiotická léčba vankomycinem a meropenemem. Dne 11. 1. 2019 byla provedena rozsáhlá nekrektomie s evakuací množství purulentního obsahu z hlubších tkání pravého prsu. Bakteriologické vyšetření hnisu prokázalo masivní přítomnost grampozitivních koků Streptococcus pyogenes a Staphylococcus aureus, anaerobní kultivace byla negativní. Pro riziko krvácení z plošných ran byla antitrombotická profylaxe převedena na kontinuální nitrožilní aplikaci nadroparinu v dávce přibližně 32 U/kg hmotnosti. Přechodně byla zaznamenána tendence k regresi flegmóny, nicméně při revizi dne 17. 1. 2019 byl z oblasti pravého prsu evakuován další absces. V dalším průběhu bylo dne 25. 1. 2019 přistoupeno k débridementu, nekrektomii a přenesení autologního kožního štěpu z oblasti pravého stehna. Při operační revizi dne 30. 1. 2019 byla provedena incize v celkové délce 14 cm rapidně se zvětšující lividně zbarvené nodozity v levém mezogastriu, se serózní (!) sekrecí z rány, v jejíž hloubce byla resekována kompletně trombotizovaná žíla průměru přibližně 4 mm i se svými odstupy (celková délka resekované žíly přibližně 13 cm). Vzhledem k tomuto jinak naprosto nezvyklému nálezu bylo přivoláno hematologické konzilium – místo incize bylo kompletně kryto, na kontralaterální straně v pravém podbřišku však byla nápadná lividně probarvená nodozita velikosti přibližně 5 × 5 cm se širokým erytematózním lemem (Obr. 2), dále byl přítomen asymetrický těstovitý otok levé dolní končetiny s četnými petechiemi především v oblasti kontaktu pokožky s podložkou. V rámci diferenciální diagnostiky byla zvažována flegmóna, současně bylo vyjádřeno i podezření na možnou HIT, a proto bylo doporučeno okamžité provedení screeningového testu, jenž vyšel jednoznačně pozitivně. Akutně bylo doplněno sonografické vyšetření levé dolní končetiny i levé horní končetiny (z důvodu zcela čerstvě zavedené kanyly do v. jugularis interna vlevo) – bez průkazu trombotického žilního uzávěru. Bezprostředně po získání výsledku screeningového testu HIT byla ukončena aplikace nadroparinu a byla zahájena aplikace profylaktické dávky fondaparinuxu (Arixtra®) 2,5 mg s.c. 1× za 24 hod. (1. dávka byla aplikována za 12 hod. od poslední dávky nadroparinu). Profylaktická dávka fondaparinuxu byla volena záměrně vzhledem k čerstvému a poměrně rozsáhlému operačnímu poranění i vzhledem k renální insuficienci. Následující pracovní den byl doplněn funkční test agregace trombocytů a flowcytometrické vyšetření s jednoznačně pozitivním nálezem, čímž byla diagnóza HIT potvrzena, laboratorně byl již zaznamenán mírný vzestup počtu trombocytů. K úplné restituci počtu trombocytů došlo 4. den od ukončení aplikace nadroparinu, bez krvácivých či trombotických komplikací. Nebyla však zaznamenána tendence ke spontánnímu hojení rozsáhlé incize v levém mezogastriu (pravděpodobně v důsledku trombotické okluze mikrocirkulace zřetelné makroskopicky perioperačně) a proto bylo nutno v odstupu 2 týdnů její okraje resekovat a readaptovat. Histologicky byly v resekátu zachyceny pokročilé regresivní a reparativní změny s venulární trombotizací v okrajích (Obr. 3). Po propuštění z hospitalizace dne 11. 3. 2019 užívala pacientka ještě 2 měsíce rivaroxaban 20 mg denně, operační rány se zhojily bez komplikací, nebyly zaznamenány nové tromboembolické komplikace.
Tab. 2. Vývoj laboratorních parametrů 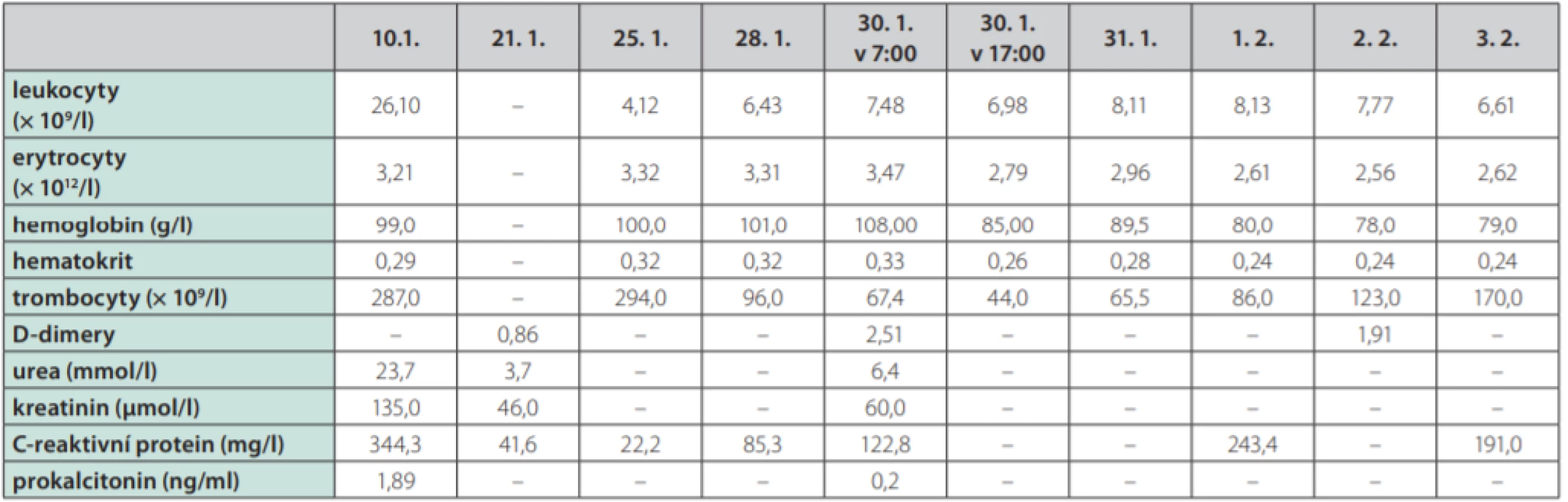
Obr. 2. Kožní reakce v místě aplikace nadroparinu (rozvoj pozorován v řádu minut od aplikace) 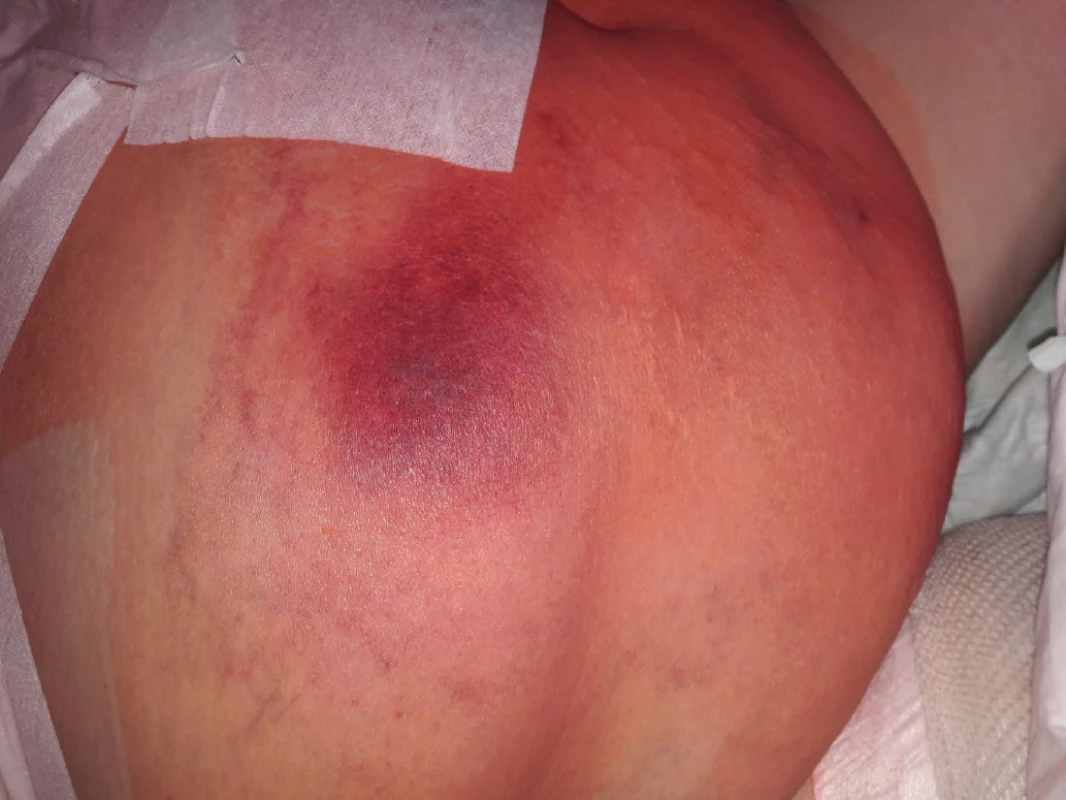
Obr. 3. Trombóza podkožních cév v mikroskopickém obraze 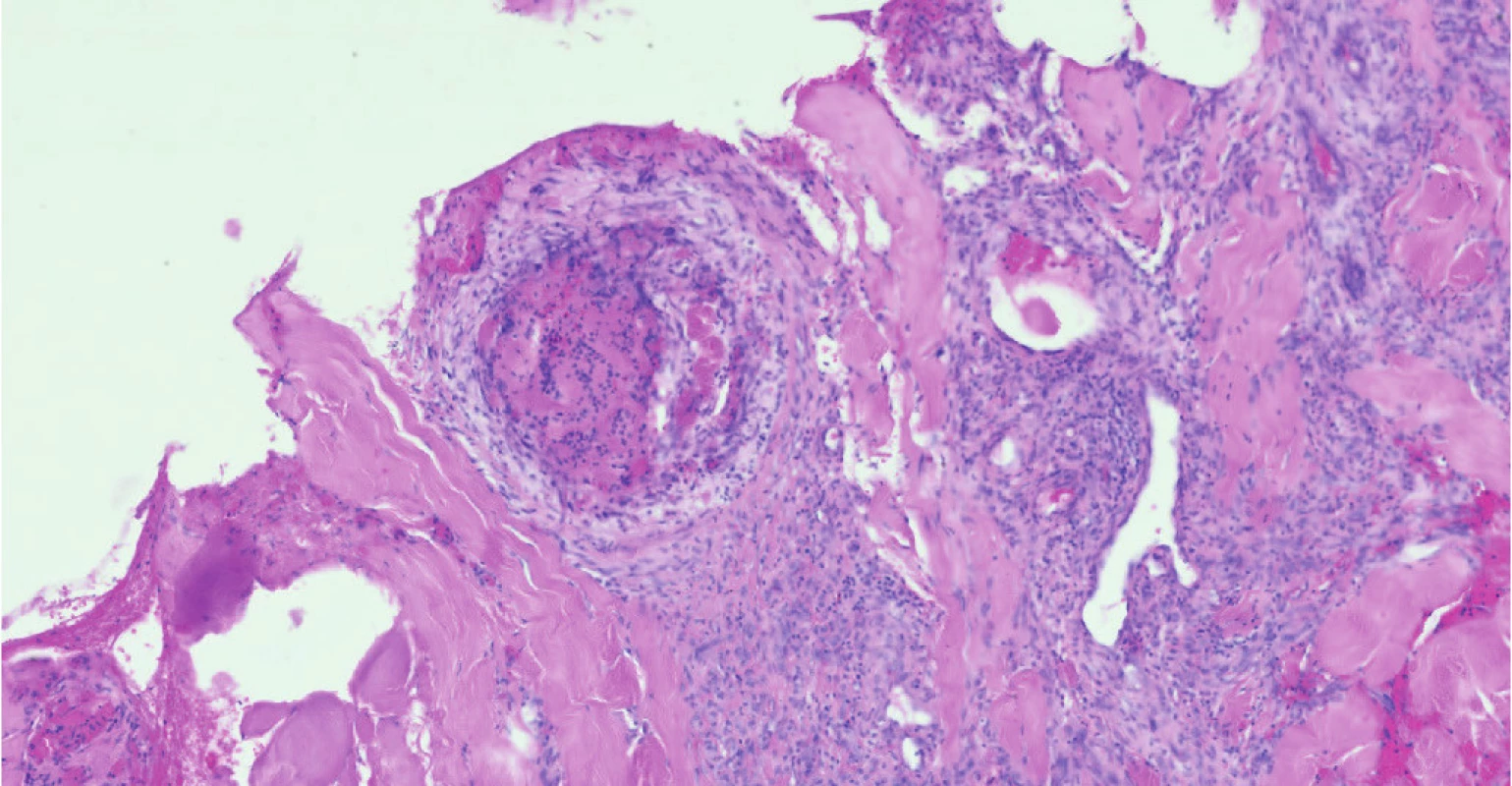
Diskuze
Heparinem indukovaná trombocytopenie je sice vzácné onemocnění, nicméně vzhledem k vysokému procentu tromboembolických komplikací i riziku fatálního vyústění se vždy jedná o emergentní stav vyžadující promptní korekci medikace (2, 3, 7, 13). Pro výše popsanou pacientku byl životně významný správný medicínský instinkt ošetřujících chirurgů. V době první hematologické konzultace byla pravděpodobnost HIT vysoká (4 T‑skóre 6 bodů), což si vyžádalo bezprostřední ukončení aplikace nízkomolekulárního heparinu (low molecular weight heparin – LMWH) s převedením na syntetický pentasacharid fondaparinux v dávce adjustované klinickému stavu. Pozitivita sérologických i funkčních testů a další prohlubování trombocytopenie i dokumentované žilní trombózy plně zapadají do stadia akutní HIT (2, 3). Jelikož již byly jednoznačné klinické známky trombotických komplikací, vnucuje se otázka, zda neměla být první dávka fondaparinuxu aplikována ihned po obdržení pozitivního výsledku screeningového testu HIT – molekuly nadroparinu byly v té době jistě z velké míry vyvázány, a tedy neutralizovány v imunokomplexech. Bylo by sice možno pokusit se odhadnout případnou reziduální aktivitu LMWH vyšetřením aktivity anti‑Xa‑LMWH, nicméně dynamika HIT může být natolik fulminantní, že by samotná hodnota anti‑Xa‑LMWH nemusela být vypovídající, a to jednak kvůli již zmíněné vazbě nadroparinu v imunitních komplexech, jednak z důvodu rychlého vývoje onemocnění v čase. Kritickým tedy zůstává okamžité přerušení aplikace heparinu (a to včetně tzv. heparinové zátky v centrálních žilních katetrech) a aplikace a nástup účinku alternativní antitrombotické profylaxe (13, 14).
Z popsaných případů a jejich sérií vyplývá, že stanovení diagnózy HIT bývá často komplikováno rozličnými klinickými i laboratorními fenomény – např. španělští autoři recentně popsali případ HIT po tinzaparinu manifestující se pouze jako plošné kožní nekrózy v místě aplikace, ale bez doprovodné trombocytopenie (15). Jsou popsány i případy spontánně vzniklé HIT (zcela bez expozice heparinu) (16) či případy tzv. opožděné HIT, která se rozvíjí až v odstupu dnů či týdnů od poslední aplikace heparinu (6–8, 10, 11).
Falešně negativní výsledky screeningového sérologického testu mohou být na samém počátku onemocnění, u pacientů s defektem buněčné či protilátkové imunity, po masivní transfuzní terapii nebo po plazmaferéze. Proto je při trvajícím klinickém podezření nezbytné 4 T‑skóre stanovovat opakovaně a opakovat i laboratorní diagnostiku. Naopak bylo zaznamenáno signifikantně vyšší procento pozitivit screeningových sérologických testů HIT u pacientů se systémovou infekcí (16–18).
Dle Americké hematologické společnosti není u asymptomatických pacientů s nízkou pravděpodobností HIT doporučena rutinní monitorace počtu trombocytů. Při středním a vysokém riziku je doporučeno počet trombocytů monitorovat následovně: u pacientů exponovaných heparinu v posledních 30 dnech již ode dne 0; u pacientů, kteří nebyli v posledních 30 dnech heparinu exponováni ode dne 4 do dne 14, respektive do ukončení léčby heparinem a to v pravidelných 2–3denních intervalech; rovněž je doporučeno monitorovat počet trombocytů u pacientů léčených nefrakcionovaným heparinem, (unfracitonated heparin – UFH) či LMWH, kteří mají střední až vysokou pravděpodobnost HIT po velkém traumatu, po velké operaci či po porodu (2).
Duplexní sonografie žil dolních končetin k vyloučení skryté flebotrombózy je doporučena u všech pacientů s prokázanou HIT, duplexní sonografie žil horních končetin by se měla provádět pouze v případě, že je v daném povodí zaveden centrální žilní katétr – tak bylo postupováno i v popsaném případě (2).
Antitrombotickou/antikoagulační profylaxi je třeba podávat alespoň do doby, než je restituován počet trombocytů alespoň na 150,0 × 109 /l (nebo dle některých autorů do doby dosažení stabilního plateau počtu trombocytů s vzestupem jejich počtu alespoň o 10,0 % po 3 dny po sobě), ale pokud nejsou známky pokračující HIT, tak by léčba neměla trvat déle než 3 měsíce. Doba léčby nekomplikované HIT se však zpravidla pohybuje mezi 4–6 týdny. Oproti tomu je nutno antikoagulační terapii prolongovat alespoň na 3 měsíce v případě prokázané trombózy (2, 3, 13).
Aplikace trombocytárních koncentrátů je u HIT vyhrazena pro pacienty s velmi vysokým rizikem krvácení (např. po kardiochirurgické operaci), při manifestním krvácení a při poklesu počtu trombocytů pod 20,0 × 109 /l (2, 3, 13).
Přehled léčiv používaných jako alternativy k heparinu je uveden v Tab. 3. Dříve dostupný lepirudin není od roku 2012 registrován. V našich podmínkách zůstává nejdostupnější alternativou syntetický pentasacharid s aktivitou anti‑Xa dependentní na antitrombinu: fondaparinux (Arixtra®). Jeho použití je dokumentováno spíše jednotlivými kazuistikami či menšími soubory, paradoxně nebyl jeho účinek při léčbě HIT dosud potvrzen randomizovanými studiemi (19).
Tab. 3. Alternativní možnosti antitrombotické profylaxe 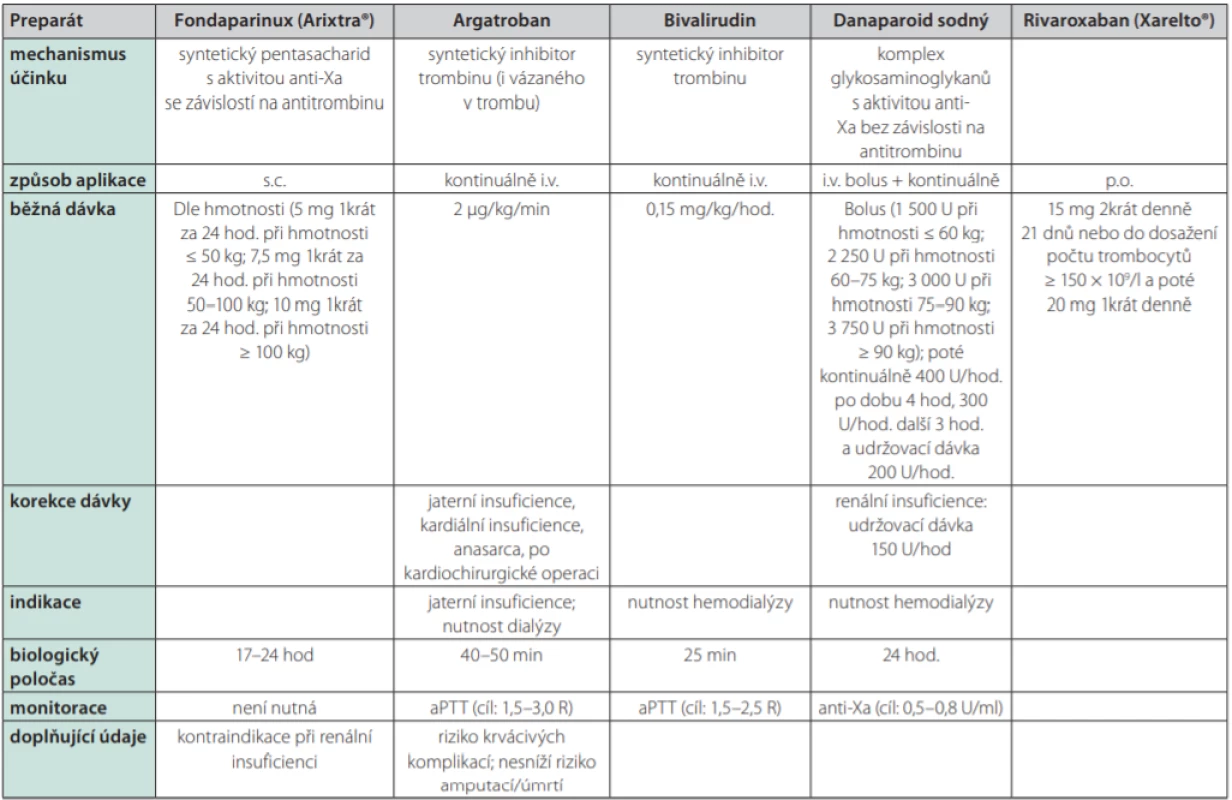
Argatroban, bivalirudin ani danaparoid sodný nejsou v ČR v době publikace běžně dostupné U HIT v subakutní fázi A je v současnosti upřednostňováno použití přímých perorálních antikoagulancií před antagonisty vitaminu K – nejvíce dat má v této indikaci rivaroxaban. Převedení na DOAC probíhá bez překryvu s parenterální antitrombotickou terapií (20, 21). V případě nutnosti hemodialyzační terapie se preferenčně užívají léky s krátkým biologickým poločasem typu argatroban, danaparoid sodný či bivalirudin; alternativou zůstává citrátová hemodialýza, která by se však neměla provádět během akutní HIT. Případnou léčbu antagonisty vitaminy K (vitamin K antagonist – VKA) nelze zahájit před restitucí počtu trombocytů alespoň na 150,0 × 109 /l pro riziko končetinové gangrény při současném poklesu aktivity proteinu C. Při zahájení léčby VKA se doporučují spíše malé nasycovací dávky a překrytí s parenterální antitrombotickou terapií alespoň po dobu 5 dnů. Probíhá‑li terapie antagonisty vitaminu K v době stanovení diagnózy HIT, pak je třeba tyto léky okamžitě přestat podávat a neutralizovat jejich účinek aplikací vitaminu K. Problematická je konverze z argartobanu na VKA, jelikož argatroban sám o sobě zvyšuje hodnotu INR a hrozí tedy poddávkování VKA. Překrytí argatrobanu s VKA by mělo trvat alespoň 5 dnů. Aplikaci argatrobanu je možno ukončit při hodnotách INR ≥ 4 s tím, že za 4–6 hod po jeho vysazení je třeba provést další kontrolu INR a je‑li tato pod 2, pak to svědčí pro dosud neúčinnou antikoagulační léčbu VKA a pro nutnost opětného zahájení konkomitantní terapie argatrobanem (2, 3, 13). Za jistých okolností lze zvážit i nitrožilní aplikaci vysokých dávek imunoglobulinů IgG (IVIG) (22).
Problematickou zůstává i případná možnost expozice heparinu v budoucnosti – např. při nezbytném kardiochirurgickém výkonu. Přesto není u pacientů s anamnézou HIT kontraindikace heparinu absolutní. Hlavním důvodem je dobře dokumentovaná skutečnost, že vytvořené protilátky ve třídě IgG nevykazují dlouhodobou perzistenci a za 3 měsíce již zpravidla nejsou prokazatelné (medián 85 dnů) (13). Pokud je v době ještě perzistujících protilátek v séru podán heparin, dochází prakticky bezprostředně k rozvoji HIT. Naopak po jejich vymizení (tzv. séroreverzi) musí po reexpozici heparinu uplynout několik dnů (v mediánu 4), aby byly protilátky opět sérologicky prokazatelné, a HIT se zpravidla rozvíjí ještě o den později. Těchto poznatků lze s výhodou využít v situacích, kdy lze jen obtížně heparin nahradit jinou alternativou. Kanadští autoři takto připravují pacienty s anamnézou HIT proběhlou před více než 3 měsíci na akutní kardiochirurgické výkony s doporučením standardní perioperační terapie nefrakcionovaným heparinem s přechodem na danaparoid v postoperačním období. Pokud je třeba operační výkon provést u pacientů s pozitivním sérologickým i funkčním testem HIT, pak se jako účinná alternativa jeví použití výměnné plazmaferézy během samotné operace. Použití bivalirudinu v perioperačním období je zatíženo vysokým rizikem trombotických komplikací v klampovaných cévách či cévních vacích a přidání protidestičkové terapie (iloprost) k UFH bývá komplikováno závažnou hypotenzí. Každopádně u pacientů s anamnézou HIT podstupujících operační výkon je pro rizika rekurence HIT zapotřebí provádět každodenní kontroly krevního obrazu, především v období mezi 5. a 10. postoperačním dnem, a to i pokud nebyli reexponováni heparinu. Pokud je plánován elektivní kardiochirurgický výkon (náhrada srdeční chlopně mechanickou protézou) u pacienta užívajícího VKA, lze postupovat následovně: 2 dny před výkonem vysadit VKA, v den operace podat koncentrát protrombinového komplexu (obsahuje malé množství heparinu!) a vitamin K, perioperačně podávat standardně UFH a koncem operace jeho účinek neutralizovat protaminem, první 4 pooperační dny podávat UFH a od večera 4. pooperačního dne převést pacienta na fondaparinux. V případě nutnosti hemodialýzy lze použít s jistou dávkou opatrnosti i UFH, který by se měl podávat raději pomalu kontinuálně než bolusem, a před i po dialýze je nutno zkontrolovat počet trombocytů a sérologii HIT (13, 23).
Pacient, jenž prodělal HIT v posledních 3 měsících, by měl mít tento údaj pečlivě veden a zdůrazněn ve své zdravotnické dokumentaci (2, 3).
Závěr
Autoři popisují heparinem indukovanou trombocytopenii vzniklou v návaznosti na aplikaci nadroparinu u obézní pacientky s rozsáhlým tkáňovým postižením a diagnostikovanou v akutní fázi onemocnění.
Podpořeno MZ ČR – RVO (FNBr, 65269705)
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Pavel Polák, Ph.D.,
Oddělení klinické hematologie FN Brno,
Jihlavská 20,
625 00 Brno
Cit. zkr: Vnitř Lék 2020; 66(4): 242–248
Článek přijat redakcí: 14. 10. 2019
Článek přijat k publikaci: 18. 11. 2019
Zdroje
1. Králová S, Klodová D, Gumulec J, et al. Heparinem indukovaná trombocytopenie. Vnitř Lék 2006; 52: (Suppl. 1): 98–106.
2. Cuker A, Arepally GM, Chong BH, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin‑induced thrombocytopenia. Blood Adv 2018; 2 : 3360–3392.
3. Fathi M. Heparin‑induced thrombocytopenia (HIT): Identification and treatment pathways. Glob Cardiol Sci Pract 2018; 2018 : 15.
4. Bloom MB, Zaw AA, Hoang DM, et al. Body mass index strongly impacts the diagnosis and incidence of heparin‑induced thrombocytopenia in the surgical intensive care unit. J Trauma Acute Care Surg 2016; 80 : 398–403.
5. Mattioli AV, Manenti A, Farinetti A. Impact of obesity on heparin‑induced thrombocytopenia in cardiac surgery patients. Blood Coagul Fibrinolysis 2018; 29 : 661.
6. Linkins LA, Bates SM, Lee AY, et al. Combination of 4Ts score and PF4/H‑PaGIA for diagnosis and management of heparin‑induced thrombocytopenia: prospective cohort study. Blood 2015; 126 : 597–603.
7. Thomson J, Kuriakose P, To L, et al. Development of an algorithm for the systematic evaluation of patients with suspected heparin‑induced thrombocytopenia. J Thromb Thrombolysis 2019; 478–480.
8. Zheng G, Streiff MB, Allison D, et al. A novel diagnostic algorithm for heparin‑induced thrombocytopenia. Int J Lab Hematol 2018; 527–532.
9. Dhakal B, Kreuziger LB, Rein L, et al. Disease burden, complication rates, and health‑care costs of heparin‑induced thrombocytopenia in the USA: a population‑based study. Lancet Haematol 2018; 5: e220–e231.
10. Favaloro EJ. Laboratory tests for identification or exclusion of heparin induced thrombocytopenia: HIT or miss? Am J Hematol 2018; 93 : 308–314.
11. Warkentin TE, Sheppard JI, Linkins LA, et al. High sensitivity and specificity of an automated IgG‑specific chemiluminescence immunoassay for diagnosis of HIT. Blood 2018; 132 : 1345–1349.
12. Warkentin TE, Arnold DM, Nazi I, et al. The platelet serotonin‑release assay. Am J Hematol 2015; 90 : 564–572.
13. Warkentin TE, Anderson JA. How I treat patients with a history of heparin‑induced thrombocytopenia. Blood 2016; 128 : 348–359.
14. Riegerová B, Malý R, Lojík M, et al. Heparinem indukovaná trombocytopenie II. typu u komplikované ileofemorální flebotrombózy léčené katétrem řízenou trombolýzou. Interv Akut Kardiol 2007; 7 : 74–77.
15. Bosch‑Amate X, Fustà‑Novell X, Mascaró‑Gally JM. Trombocitopenia trombótica inducida por heparina: una entidad rara potencialmente grave. Aten Primaria 2019; article in press (available from: https://www.sciencedirect.com/science/article/pii/S0212656718306681; accessed Feb 5th, 2019).
16. Omer T, Mullaguri N, George P et al. False‑negative platelet factor 4 antibodies and serotonin release assay and the utility of repeat testing in the diagnosis of heparin‑induced thrombocytopenia and thrombosis. Case Rep Hematol 2019; 2019 : 1585014.
17. Maharaj S, Chang S. Anti‑PF4/heparin antibodies are increased in hospitalized patients with bacterial sepsis. Thromb Res 2018; 171 : 111–113.
18. Lo GK, Sigouin CS, Warkentin TE. What is the potential for overdiagnosis of heparin induced thrombocytopenia? Am J Hematol 2007; 82 : 1037–1043.
19. Schindewolf M. Fondaparinux in heparin‑induced thrombocytopenia: A decade’s worth of clinical experience. Res Pract Thromb Haemost 2019; 3 : 9–11.
20. Warkentin TE, Pai M, Linkins LA. Direct oral anticoagulants for treatment of HIT: update of Hamilton experience and literature review. Blood 2017; 130 : 1104–1113.
21. Linkins LA, Warkentin TE, Pai M, et al. Rivaroxaban for treatment of suspected or confirmed heparin‑induced thrombocytopenia study. J Thromb Haemost 2016; 14 : 1206–1210.
22. Mohanty E, Nazir S, Sheppard JI, et al. High‑dose intravenous immunoglobulin to treat spontaneous heparin‑induced thrombocytopenia syndrome. J Thromb Haemost 2019; XXX: XXX–XXX.
23. Zapletal O, Blatný J, Štarha J Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat? Vnitř Lék 2010; 56: (Suppl. 1): S55–S57.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázyČlánek Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientovČlánek Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvinČlánek Jaterní fibrózaČlánek Mikroskopická polyangiitída
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Hyperurikemie z perspektivy nefrologického pacienta
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



