-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní lymfoblastická leukemie dospělých – případ dlouhého došetřování bolestí kyčlí s překvapivým závěrem: kazuistika
Acute lymphoblastic leukemia of adults – a case of prolonged hip pain diagnostics with a surprising conclusion: case report
Though acute lymphoblastic leukemia (ALL) is the most common malignancy of childhood age, it is a rare diagnosis in adults. This disease often manifests with common and nonspecific symptoms, so it can easily escape an early diagnostics without a proper blood count examination. We present a case of an adult ALL patient suffering only from severe hips and thighs pain, without any significant blood count abnormities leading to the diagnostics. In the second part of the article, we summarize current highlights regarding this disease.
Key words:
acute lymphoblastic leukemia – adult – biological treatment – bone pain – CAR T-cells – osteolysis – symptoms
Autoři: Štěpán Hrabovský 1; František Folber 1; Barbora Jurová 2; Zdeněk Řehák 3; Michael Doubek 1,4
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 1; Klinika radiologie a nukleární medicíny LF MU a FN Brno, pracoviště Bohunice 2; Oddělení nukleární medicíny, PET centrum, RECAMO, MOÚ, Brno 3; Středoevropský technologický institut (CEITEC), Brno 4
Vyšlo v časopise: Vnitř Lék 2017; 63(5): 348-353
Kategorie: Kazuistiky
Souhrn
Akutní lymfoblastická leukemie (ALL) je nejčastějším maligním onemocněním v dětském věku, u dospělých se jedná o vzácnou diagnózu. Choroba je o to zákeřnější, že se prezentuje často zcela běžnými a nespecifickými symptomy a bez vyšetření krevního obrazu může snadno uniknout včasné diagnostice. V tomto článku popisujeme kazuistiku pacienta, u něhož se nemoc projevila z počátku pouze silnou bolestí kyčlí a stehen, bez jakýchkoli signifikantnějších změn v krevním obraze, které by navedly diagnostiku správným směrem. Ve druhé polovině článku ve stručnosti uvádíme přehled aktuálních poznatků a novinek týkajících se této choroby.
Klíčová slova:
akutní lymfoblastická leukemie – biologická léčba – bolest kostí – CAR T-lymfocyty – dospělí – osteolýza – příznakyÚvod
Hematologické malignity se projevují běžnými a velmi nespecifickými příznaky, jako jsou únava, bolesti, subfebrilie, pocení, infekce, nechutenství, hubnutí nebo zvětšení periferních mízních uzlin. Na závažnější problém pak upozorní často až hrubé odchylky hodnot krevního obrazu, ani ty však nemusí být pravidlem. V této práci popisujeme případ akutní lymfoblastické leukemie, která se v počátku projevila pouze neobvykle silným algickým syndromem a elevací laboratorních zánětlivých parametrů, téměř bez jakýchkoli změn v krevním obraze, které by napověděly více o původu potíží pacienta a navedly diagnostický proces správným směrem.
Kazuistika
Začátek potíží
V září roku 2016 byl k došetření torpidní bolesti kyčlí a stehen na naši kliniku přijat 50letý muž. Pacient byl do té doby zcela zdráv a bez chronické medikace, trpěl jen mírnou obezitou, v jeho rodinné anamnéze se rovněž nevyskytovaly žádné pozoruhodnosti.
Potíže pacienta začaly asi o měsíc dříve, kdy byl vyšetřen na neurologické ambulanci pro bolesti levého ramene. Potíže byly uzavřeny jako impingement syndrom a pacient po analgetickém obstřiku s úlevou odešel domů. Za měsíc přichází na službu první pomoci pro 3 dny trvající silné bodavé bolesti kyčlí a stehen. Jsou mu intramuskulárně podána analgetika, dochází však jen k malé úlevě od bolesti. Další den se opakuje návštěva lékaře pro pokračující potíže, opět se stejným neuspokojivým výsledkem. Třetí den se pacient rozhodne navštívit neurologickou ambulanci, neurolog však neshledává žádnou objektivní patologii a odesílá pacienta k došetření na interní ambulanci naší kliniky.
Při klinickém vyšetření internistou je zjištěna těžká arteriální hypertenze 230/100 mm Hg, v laboratorních výsledcích výrazná elevace CRP 174 mg/l, mírná mikrocytární anémie s hemoglobinem 113 g/l, mírná koagulopatie s prodlouženým INR 1,36, elevací D-dimerů 0,85 mg/l a fibrinogenem > 7 g/l. Pacient má hladiny kreatinkinázy i myoglobinu v normálních mezích, negativní revmatoidní faktor a antistreptolyzin O (ASLO). Je provedena screeningová skiagrafie hrudníku, ultrasonografie břicha a EKG, vše bez průkazu patologických změn. Vzhledem k intenzitě bolesti udávané pacientem jako 9/10 na vizuální analogové stupnici (VAS) a neúčinnosti parenterálních nesteroidních analgetik/antiflogistik je pacient přijat k dalšímu řešení za hospitalizace na interním lůžku oddělení naší kliniky.
Hospitalizace
Nově zjištěná arteriální hypertenze si postupně vyžádá léčbu kombinací až 4 antihypertenziv, bolesti kyčlí se daří kompenzovat teprve vysokými dávkami opioidních transdermálních náplastí v kombinaci s NSAID, i tak ale úleva od bolesti není úplná. Pro elevaci CRP a nově vzniklé subfebrilie jsou pacientovi empiricky nasazena antibiotika, fokus domnělé infekce však není zřejmý, hladina prokalcitoninu je nízká a efekt antibiotické léčby není v podstatě žádný. Dále je odebrán základní screeningový panel autoprotilátek, všechny výsledky jsou však negativní. Mikroskopické vyšetření nátěru periferní krve kromě již známé mírné anémie odhaluje jen ojedinělé atypické lymfocyty a mikrocyty, odběry na metabolizmus železa, folát a vitamin B12 svědčí nejspíše pro nespecifickou anémii chronických chorob.
Za několik dní od začátku hospitalizace si pacient začíná stěžovat na nové bolesti v bederní oblasti. Skiagrafie páteře odhaluje parciální lumbalizaci obratle S1 s retrolistézou L5, při neurologickém vyšetření ale nejsou patrné známky radikulopatie. V dalším kroku došetřování je provedeno zobrazení magnetickou rezonancí (MRI) bederní páteře, na jejímž základě je zjištěn difuzně nehomogenní patologický signál skeletu s edémem paravertebrálních tkání (obr. 1).
Obr. 1. MRI bederní páteře, sagitální řez. 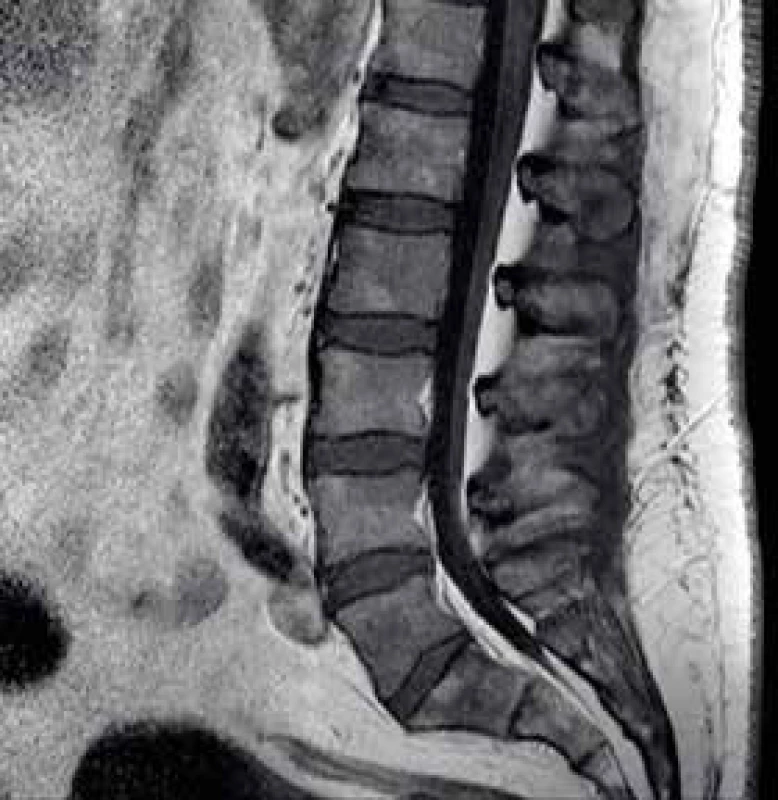
Signál skeletu je výrazně difuzně nehomogenní se sníženým signálem v T1 Onkologické onemocnění?
Tento nález ukazuje na možnost onkologické etiologie potíží a navádí došetřování novým směrem. Endoskopická vyšetření jsou bez patologického nálezu, CT hrudníku a břicha prokazuje pouze hraniční velikost několika mediastinálních uzlin, z onkomarkerů je mírně pozitivní jen laktátdehydrogenáza 4,8 µkat/l a nadále trvá elevace CRP > 100 mg/l. Vzhledem k difuznímu postižení osového skeletu na MRI je indikována necílená trepanobiopsie kostní dřeně z kyčelní kosti, tu však pacient odmítá.
Asi 10 dní od začátku hospitalizace se náhle objevuje silná bolest v hrudní etáži zad provázená dušností. Je provedena akutní CT angiografie, která neprokazuje embolizaci plicnice ani disekci aorty, ale překvapivě prokazuje patologickou frakturu těla obratle Th6 a osteolytické ložisko úhlu pravé lopatky velikosti asi 30 mm dohledatelné zpětně již na předchozím CT hrudníku (obr. 2). Ortoped doporučuje konzervativní postup s Jewettovou ortézou, podání bisfosfonátů a doplnění MRI hrudní páteře, na níž ale nejsou popsány nové patologie, jen již známá difuzní patologická infiltrace osového skeletu (obr. 3).
Obr. 2. CT hrudníku, koronární řez. 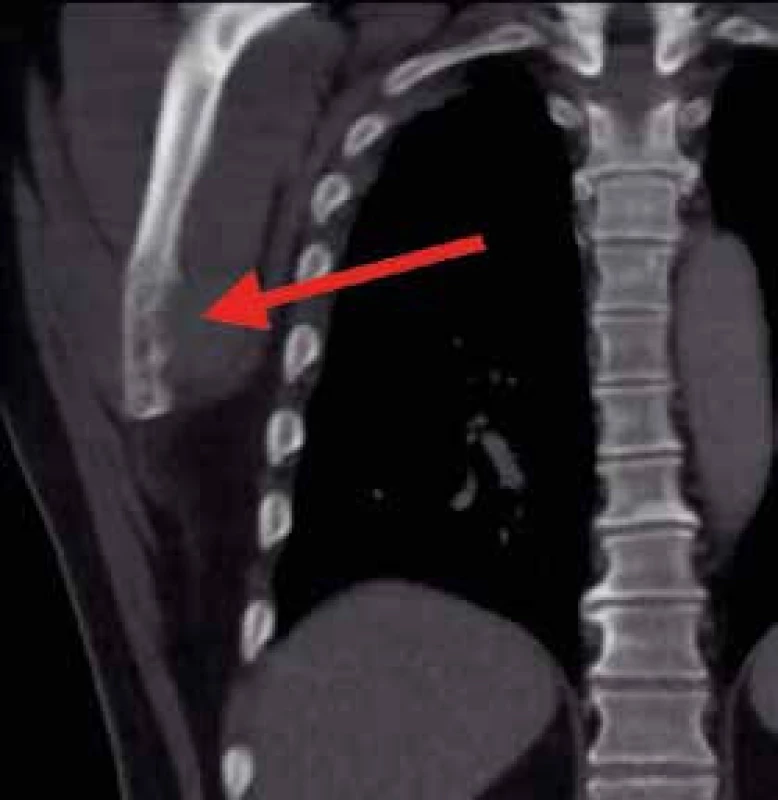
Osteolytické změny v oblasti dolního úhlu pravé lopatky Obr. 3. MRI hrudní páteře, sagitální řez. 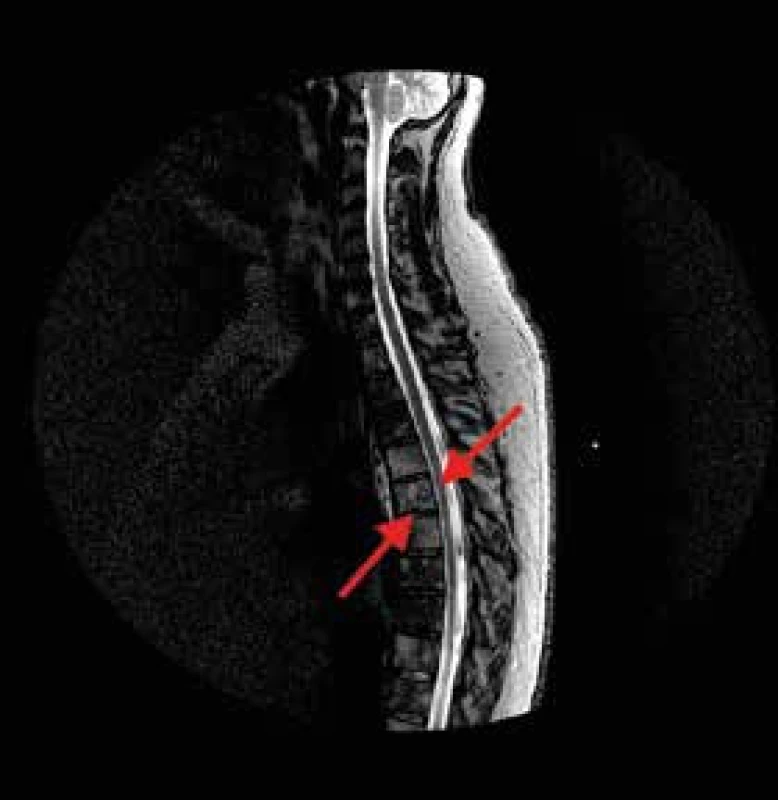
Signál skeletu je výrazně difuzně nehomogenní s mapovitě zvýšeným signálem ve STIR. Recentní fraktura těla Th6 se schodkem na dolní krycí ploše. Jemný pruh hematomu prevertebrálně v etáži Th4–7 Nyní je už nutnost histologického vyšetření zřejmá a vzhledem k nepolevujícím potížím pacient souhlasí s punkční biopsií ložiska lopatky i s provedením trepanobiopsie z kosti kyčelní. Mezitím je ještě provedena pozitronová emisní tomografie s low-dose CT (PET/CT) s průkazem patologicky zvýšené akumulace 18fluorodeoxyglukózy (18FDG) v celém skeletu, ve slezině a uzlině pravé axily (obr. 4). V myelogramu, histologii kostní dřeně i punktátu ložiska lopatky je po 4 týdnech došetřování prokázána infiltrace akutní lymfoblastickou leukemií (ALL).
Obr. 4. 18F-FDG PET/low-dose CT vyšetření. 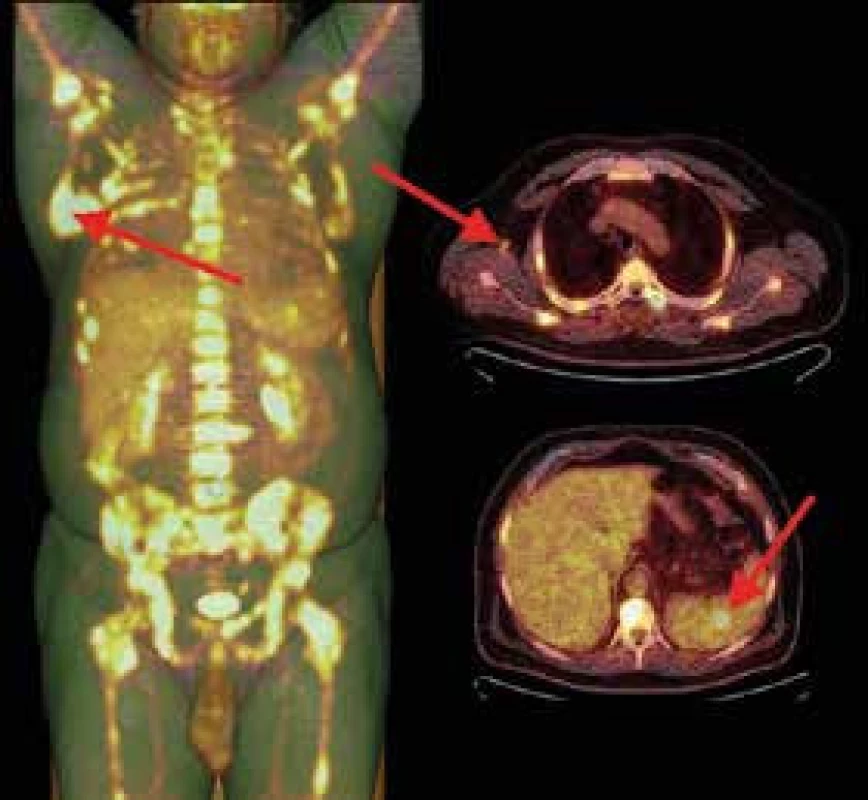
Biodistribuci značené glukózy v zobrazené části těla dokumentuje sumovaný VRT-MIP obraz (vlevo). U pacienta je patrné mnohočetné postižení kostní dřeně hypermetabolickými ložisky s maximem v dolním úhlu pravé lopatky a v pánvi. Mimo skelet jsou patrna akumulující ložiska v uzlinách pravé axily (vpravo nahoře) a ložisko ve slezině (vpravo dole). Akumulaci radiofarmaka ve vzestupném tračníku lze považovat za variantu fyziologického zobrazení a aktivní moč v ledvinách a močovém měchýři je projevem vylučování radiofarmaka Další osud pacienta
Pacient je tedy již shodou okolností hospitalizován v hematoonkologickém centru a je ihned zahájena prefáze dexametazonem, po které do 2 dnů dochází k úplnému vymizení bolestí i subfebrilií. Z provedených vstupních odběrů je určen imunofenotyp pre-B ALL, v cytogenetickém vyšetření prokázány komplexní změny karyotypu, avšak bez průkazu specifických genetických přestaveb vyskytujících se u této choroby. Na základě zjištěných charakteristik je pacient zařazen do skupiny standardního rizika a po prefázi kortikoidů pokračuje léčba indukční chemoterapií pro dospělé pacienty mladší 55 let podle protokolu České leukemické skupiny – pro život (CELL). Po dalších 2 měsících je pacient propuštěn domů v kompletní remisi onemocnění. Po necelých 5 týdnech však dochází k relapsu onemocnění doprovázenému opět bolestmi kyčlí a suspektní patologickou frakturou 4. žebra vpravo (obr. 5). Pacientovi je podána záchranná chemoterapie, vyšetření kostní dřeně po tomto cyklu léčby však prokazuje refrakterní chorobu. V době sepisování článku pacient zahajuje druhou linii záchranné léčby bispecifickou monoklonální protilátkou blinatumomab. V případě dosažení remise je v plánu alogenní transplantace krvetvorných buněk od nepříbuzného dárce.
Obr. 5. CT hrudníku, sagitální řez. 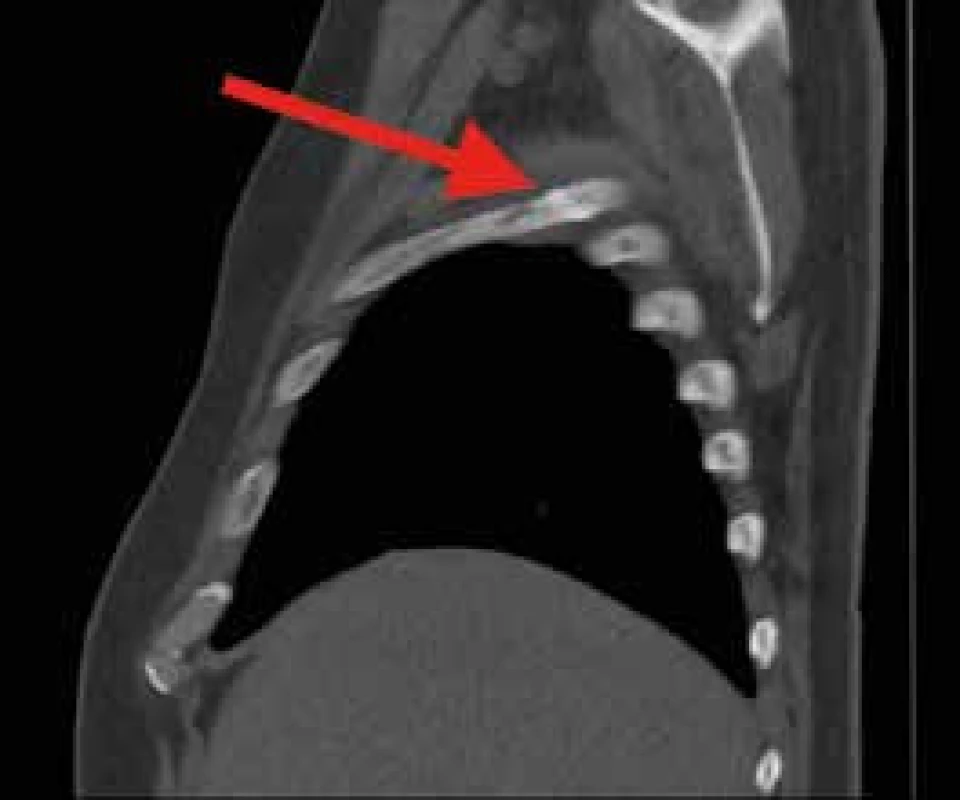
Tvořící se svalek na 4. žebru vpravo axilárně, nelze vyloučit patologickou frakturu Diskuse případu a přehled aktuálních poznatků o ALL
Ačkoli je ALL nejčastější malignitou dětského věku, v dospělé populaci patří ke vzácným onemocněním s roční incidencí asi 1/100 000 s mírnou predominancí u mužů (1,4 : 1). V ČR je tedy při počtu 8,6 milionu dospělých obyvatel každý rok diagnostikováno zhruba 80–90 nových dospělých pacientů. Jedná se o onemocnění ze skupiny agresivních lymfoproliferací, jehož etiopatogenetickým podkladem je klonální expanze maligně změněné prekurzorové lymfoidní buňky (lymfoblastu) s útlakem zdravé krvetvorby.
Příznaky a laboratorní známky
Příznaky této nemoci jsou zvláště v jejím počátku velmi nespecifické. U dospělých i u dětí se projeví ALL často muskuloskeletárními bolestmi v různých lokalizacích, subfebriliemi až febriliemi, které mohou být paraneoplastické etiologie, ale i příznakem probíhající infekce, únavou, nechutenstvím nebo hubnutím. V pokročilejší fázi onemocnění se přidávají další komplikace z prohlubující se pancytopenie, jako jsou těžké infekce nereagující na standardní antibiotickou léčbu, krvácení ze sliznic nebo do kůže, typicky petechie na dolních končetinách, komplikace anémie v podobě dušnosti nebo v krajním případě infarktu myokardu či ischemického iktu. Část pacientů má lymfadenopatii, splenomegalii nebo hepatomegalii, relativně častá je infiltrace CNS, postižen ale může být v podstatě jakýkoli orgán, příznaky jsou pak specifické pro konkrétní lokalizaci. V případě extrémní leukocytózy může výjimečně u ALL nastat i syndrom leukostázy, který se projeví dušností, neurologickou symptomatologií nebo poruchami zraku.
Některé z příznaků našeho pacienta tedy jsou pro ALL zcela běžné, překvapující byla jen intenzita bolestí. Oproti tomu osteolytické postižení u dospělých nemocných příliš často nevídáme. U dětských ALL pacientů jsou symptomy a komplikace spojené se skeletem v literatuře velmi dobře popsány. V době diagnózy má bolesti 30–40 % dětí s ALL, změny skeletu viditelné na radiodiagnostických metodách 40–65 %, osteolytická ložiska 13–33 %, osteopenii 9–13 % a patologické fraktury 1–5 % [1–6]. Naproti tomu o problematice kostního postižení nebo vůbec četnosti výskytu symptomů u ALL dospělých nejsou v literatuře téměř žádné údaje. Frekvenci jednotlivých příznaků v době diagnózy podle retrospektivní analýzy 150 pacientů z naší kliniky uvádí graf 1. Nejčastějším intervalem od začátku příznaků do stanovení diagnózy byly 2–4 týdny [7].
Graf 1. Příznaky v době diagnózy ALL u dospělých. 
Upraveno podle [7] V laboratorních odběrech nacházíme různé odchylky v krevním obraze, jejich četnost podle další analýzy 190 pacientů z našeho pracoviště ukazuje tab. 1, [8]. Ne vždy musí být v periferní krvi přítomny blasty, a jak ukazuje případ našeho pacienta, hodnoty krevního obrazu mohou být v podstatě i v normálním rozmezí. Dále v laboratorních vyšetřeních nalézáme u 91 % případů elevaci laktátdehydrogenázy jako hlavního onkomarkeru lymfoproliferativních chorob (medián 9,6 µkat/l), u 84 % případů elevaci CRP a asi u třetiny pacientů je přítomna renální insuficience s retencí dusíkatých katabolitů a elevace kyseliny močové jako projevů spontánního syndromu tumorlýzy [8].
Tab. 1. Hodnoty krevního obrazu v době diagnózy ALL u dospělých. 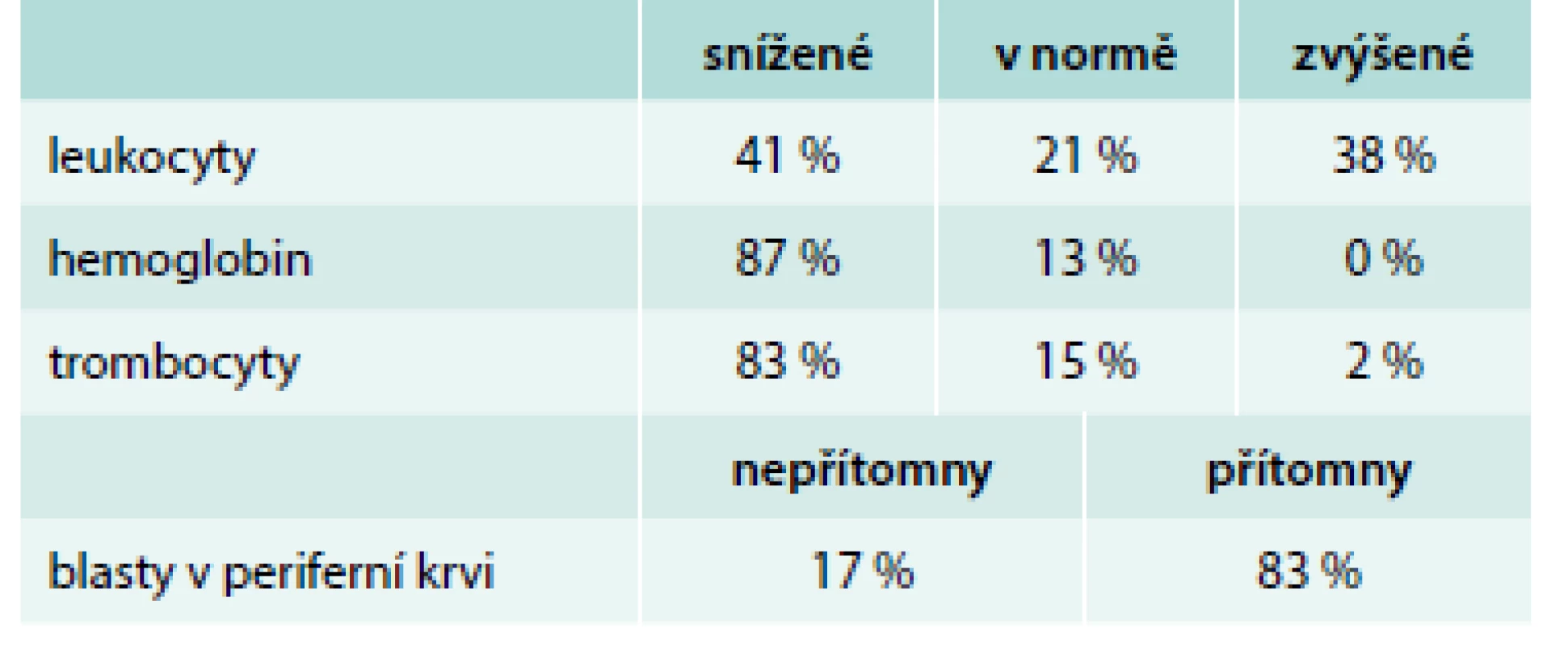
referenční normální hodnoty: leukocyty 4–10 × 109/l, hemoglobin ženy 120–160 g/l, hemoglobin muži 135–175 g/l, trombocyty 150–350 × 109/l Upraveno podle [8] Diagnostika
Základním kamenem diagnostiky ALL je morfologický průkaz myeloperoxidáza-negativních blastů v myelogramu (tj. nátěru aspirátu kostní dřeně nejčastěji ze sternální punkce), histologii kostní dřeně (trepanobioptický váleček kyčelní kosti) nebo histologie jiného infiltrovaného orgánu (nejčastěji lymfatických uzlin). Dalším nezbytným krokem je vyšetření buněk kostní dřeně nebo periferní krve průtokovou cytometrií, které definitivně odliší ALL od jiných hematologických malignit, určí linii lymfoidních prekurzorů, ze které choroba vychází (B-ALL nebo T-ALL) a stanoví tzv. imunofenotyp choroby podle klasifikace EGIL (European group for the immunological characterization of leukemias), který je jedním z faktorů v rozhodování o intenzitě léčebného režimu. Klasifikace WHO (World health organisation) z roku 2016 rozděluje ALL na skupinu B lymfoblastických leukemií/lymfomů s rekurentními genetickými abnormitami, B lymfoblastickou leukemii/lymfom „not otherwise specified“ a T lymfoblastickou leukemii/lymfom. Do klasifikace bylo nově zařazeno i několik dočasných jednotek, jejichž klinický význam zatím není jasně definován (BCR-ABL1-like B-ALL, iAMP21 B-ALL, early T-cell precursor ALL), tato problematika však již přesahuje rámec sdělení práce [9].
Dále je prováděno cytogenetické vyšetření včetně fluorescenční in situ hybridizace (FISH) ke stanovení specifických genetických aberací spojených s ALL, u dospělých pacientů je to nejčastěji filadelfský chromozom t(9;22) s fúzním genem BCR-ABL (tzv. Ph+ ALL, až 25 % případů) a translokace t(4;11) tvořící fúzní gen MLL-AF4. Specifičtější molekulárně-genetické analýzy pomocí polymerázové řetězové reakce (PCR) umožní konfirmaci těchto genetických změn.
Léčba a prognóza
Léčba pacientů s ALL je díky své komplexitě doménou specializovaných hematoonkologických center. Terapeutický přístup u ALL dospělých se odvíjí od více faktorů. Každý pacient do věku asi 65 let je zařazen do jedné ze 3 rizikových skupin na základě imunofenotypu, genetických aberací, počtu leukocytů v době diagnózy a především dynamiky tzv. minimální reziduální choroby (MRD). Jedná se o podíl leukemických a zdravých jaderných buněk v kostní dřeni nebo periferní krvi měřený pomocí průtokové cytometrie nebo real-time kvantitativní PCR na úrovni o 2–3 řády vyšší než při klasickém morfologickém hodnocení mikroskopem. MRD je nejvýznamnějším prognostickým faktorem u ALL a nedosažení MRD negativity po indukční fázi léčby je spojeno se špatnou prognózou a nutností intenzifikace léčebného režimu [10–12].
Nejintenzivnější léčbu založenou na pediatrických protokolech obdrží pacienti do 55 let, skupina 55–65letých pacientů je léčena podle šetrnějších protokolů, které však mají stále kurativní potenciál. Skupina standardního rizika je léčena kombinovanou sekvenční chemoterapií, která sestává z indukční, konzolidační a udržovací fáze. Celková doba léčby těchto pacientů je 24–30 měsíců v kombinovaném hospitalizačním a ambulantním režimu. Jednotlivé cykly léčby se skládají z různých kombinací cytostatik, glukokortikoidů, asparaginázy (enzym štěpící plazmatický asparagin, lymfoblasty na rozdíl od zdravých buněk nedokáží tuto aminokyselinu syntetizovat a jsou závislé na její dodávce z krevní plazmy) a u některých případů i monoklonálních protilátek (rituximab). Pacientům s Ph+ ALL jsou po celou dobu léčby podávány tyrozinkinázové inhibitory (imatinib). Součástí terapie je pravidelná intratekální aplikace cytostatik v rámci profylaxe nebo léčby infiltrace CNS, při reziduálním postižení uzlin po indukční léčbě je prováděna radioterapie postižené oblasti. Pacienti ze skupin vysokého a velmi vysokého rizika jsou v případě dostupnosti vhodného dárce směrováni k alogenní transplantaci krvetvorných buněk, která se provádí po 4–6 měsících úvodní léčby.
Pacienti starší 65 let jsou léčeni převážně paliativními režimy. Ke každému nemocnému je však nutno přistupovat individuálně a v rozhodování o intenzitě léčby se řídit spíše věkem biologickým a komorbiditami než věkem kalendářním. U pacientů s hraničním věkem přihlížíme při intenzitě vedení léčby i k jejich individuálnímu přání.
Prognóza dětských ALL pacientů je v dnešní době velmi dobrá, dlouhodobého přežití jich dosahuje přes 90 % [13]. Oproti tomu výsledky léčby dospělých pacientů jsou i přes výrazné pokroky v posledních desetiletích srovnatelné s výsledky léčby dětí před 40 lety. Jen asi 50 % dospělých ve věku 18–55 let, kteří jsou schopni podstoupit intenzivní léčbu, se dožívá 5 let od stanovení diagnózy. Věková skupina 55–65 let dosahuje při klasické chemoterapii 3letého přežití ve 20 %. Starší pacienti léčení paliativně mají prognózu velmi nepříznivou s přežitím v řádu týdnů až měsíců [12,14,15].
Nové léky
I když kompletní remise ALL po indukční léčbě dosáhne 90 % dospělých pacientů, relapsy onemocnění jsou časté a jejich riziko klesá až po uplynutí asi 5 let remise. Spíše než o vyléčení hovoříme o dlouhodobé remisi choroby.
Léčba relapsů ALL je velmi obtížná a výsledky záchranných chemoterapeutických režimů jsou neuspokojivé a zatížené vysokou toxicitou. V posledních letech se naštěstí na scéně objevuje řada nových léků ze skupiny monoklonálních protilátek, které oproti chemoterapii dosahují i v monoterapii lepších výsledků při nižší toxicitě. Léčba relapsu pacientů do 65 let v případě dostupnosti vhodného dárce vždy zahrnuje alogenní transplantaci krvetvorných buněk po dosažení 2. kompletní remise.
Mezi tyto nové léky v současnosti nebo blízké budoucnosti dostupné v ČR patří blinatumomab (bispecifická monoklonální protilátka anti-CD19/anti-CD3, nedávno registrován v ČR), inotuzumab ozogamicin (imunokonjugát anti-CD22/kalicheamicin, očekávána registrace do konce roku 2017), AFM-11 (tetravalentní monoklonální protilátka anti-CD19/anti-CD3, probíhá studie 1. fáze) [16–18].
Převratnou experimentální metodou v léčbě nejen ALL, ale i jiných malignit, jsou T-lymfocyty s chimérickým receptorem, tzv. CAR T-lymfocyty (chimeric antigen receptor T-cells). Jsou to lymfocyty odebrané z periferní krve nemocného, do kterých je in vitro pomocí virového vektoru vpraven gen pro chimerický T-buněčný receptor specificky se vázající na konkrétní antigen nádorové buňky, u B-ALL většinou CD19. Tyto lymfocyty jsou poté kultivovány, namnoženy a infuzí podány nazpět nemocnému. Imunitním mechanizmem poté dochází k destrukci lymfoblastů. Tato metoda je zatím zatížena velkým množstvím nežádoucích účinků vyžadujících především optimalizaci podpůrné léčby, ale výsledky jsou motivující – přes 90 % navozených kompletních remisí u dětských i dospělých pacientů s relapsem ALL [19–22].
Závěr
Akutní lymfoblastická leukemie je maligním onemocněním typickým pro dětský věk, vyskytuje se však i v dospělé populaci. Ač se u dospělých jedná o vzácnou diagnózu, je dobré si na ni vzpomenout u pacientů s anémií nebo trombocytopenií, rychle progredujícím uzlinovým syndromem, muskuloskeletárními bolestmi, recidivujícími infekty nebo subfebriliemi/febriliemi nejasného původu. Diagnózu stanoví vyšetření aspirátu kostní dřeně, nejlépe už přímo v nejbližším hematoonkologickém centru. Léčba i diagnostika této choroby zaznamenávají v současnosti významné pokroky, v klinických studiích je zkoušeno množství nových léků i zcela inovativních terapeutických postupů. Díky těmto lékům, dostupným nyní především v rámci klinických studií, je možno nabídnout kvalitní účinnou léčbu i starším pacientům, pro které by byla standardní chemoterapie příliš toxická. Rovněž transplantace krvetvorných buněk se v posledních dvou desetiletích stala víceméně zavedenou (i když stále rizikovou) léčebnou metodou. Prognóza dospělých pacientů s ALL sice zůstává závažná, pravděpodobně se ale již blýská na lepší časy.
Práce byla podpořena granty a projekty: MU – MUNI/A/1106/2016; MZ ČR – RVO (MOÚ, 00209805 a FNBr, 65269705); RECAMO – LO 1413.
MUDr. Štěpán Hrabovský
hrabovsky.stepan@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno,
pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 5. 4. 2017
Přijato po recenzi 22. 5. 2017
Zdroje
1. Hann IM, Gupta S, Palmer MK et al. The prognostic significance of radiological and symptomatic bone involvement in childhood acute lymphoblastic leukaemia. Med Pediatr Oncol 1979; 6(1): 51–55.
2. Ribeiro RC, Pui CH, Schell MJ. Vertebral compression fracture as a presenting feature of acute lymphoblastic leukemia in children. Cancer 1988; 61(3): 589–592.
3. Jonsson OG, Sartain P, Ducore JM et al. Bone pain as an initial symptom of childhood acute lymphoblastic leukemia: association with nearly normal hematologic indexes. J Pediatr 1990; 117(2 Pt 1): 233–237.
4. Müller HL, Horwitz AE, Kühl J. Acute lymphoblastic leukemia with severe skeletal involvement: a subset of childhood leukemia with a good prognosis. Pediatr Hematol Oncol 1998; 15(2): 121–133.
5. Sinigaglia R, Gigante C, Bisinella G et al. Musculoskeletal manifestations in pediatric acute leukemia. J Pediatr Orthop 2008; 28(7): 20–28. Dostupné z DOI: <http://dx.doi.org/10.1097/BPO.0b013e318186eb99>.
6. Riccio I, Marcarelli M, Del Regno N et al. Musculoskeletal problems in pediatric acute leukemia. J Pediatr Orthop B 2013; 22(3): 264–269. Dostupné z DOI: <http://dx.doi.org/10.1097/BPB.0b013e32835d731c>.
7. Azorová L, Folber F. Epidemiológia akutnej lymfoblastickej leukémie dospelých v Juhomoravskom kraji. LF MU: Brno 2016. Samostatná studentská práce.
8. Adamovičová D, Bližňáková M, Folber F. Laboratorní parametry u nově diagnostikované akutní lymfoblastické leukemie dospělých. LF MU: Brno 2016. Samostatná studentská práce.
9. Arber DA, Orazi A, Hasserjian R et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127(20): 2391–2405. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2016–03–643544>.
10. Šálek C, Folber F, Froňková E et al. Early MRD response as a prognostic factor in adult patients with acute lymphoblastic leukemia. Eur J Haematol 2016; 96(3): 276–284. Dostupné z DOI: <http://dx.doi.org/10.1111/ejh.12587>.
11. Brüggemann M, Raff T, Flohr T et al. Clinical significance of minimal residual disease quantification in adult patients with standard-risk acute lymphoblastic leukemia. Blood 2006; 107(3): 1116–1123.
12. Gökbuget N, Kneba M, Raff T et al. Adult patients with acute lymphoblastic leukemia and molecular failure display a poor prognosis and are candidates for stem cell transplantation and targeted therapies. Blood 2012; 120(9): 1868–1876.
13. Cole CH. Lessons from 50 years of curing childhood leukaemia. J Paediatr Child Health 2015; 51(1): 78–81. Dostupné z DOI: <http://dx.doi.org/10.1111/jpc.12803>.
14. O‘Brien S, Thomas DA, Ravandi F et al. Results of the hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone regimen in elderly patients with acute lymphocytic leukemia. Cancer 2008; 113(8): 2097–2101. Dostupné z DOI: <http://dx.doi.org/10.1002/cncr.23819>.
15. Šálek C, Šponerová D, Soukupová Maaloufová J. Akutní lymfoblastová leukemie: historie a současnost. Vnitř Lék 2012; 58(Suppl 2): 20–26.
16. Kantarjian H, Stein A, Gökbuget N et al. Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia. N Engl J Med 2017; 376(9): 836–847. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1609783>.
17. Kantarjian HM, DeAngelo DJ, Stelljes M et al. Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia. N Engl J Med 2016; 375(8): 740–753. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1509277>.
18. Safety Study to Assess AFM11 in Patients With Relapsed or Refractory Adult B-precursor ALL. ClinicalTrials.gov Identifier: NCT02848911. Dostupné z WWW: <https://clinicaltrials.gov/ct2/show/NCT02848911>.
19. Maude SL, Frey N, Shaw PA et al. Chimeric Antigen Receptor T Cells for Sustained Remissions in Leukemia. N Engl J Med 2014; 371(16): 1507–1517. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1407222>.
20. Davila ML, Riviere I, Wang X et al. Efficacy and Toxicity Management of 19–28z CAR T Cell Therapy in B Cell Acute Lymphoblastic Leukemia. Sci Transl Med 2014; 6(224): 224ra25. Dostupné z DOI: <http://dx.doi.org/10.1126/scitranslmed.3008226>.
21. Chang LJ, Dong L, Liu YC et al. Safety and Efficacy Evaluation of 4SCAR19 Chimeric Antigen Receptor-Modified T Cells Targeting B Cell Acute Lymphoblastic Leukemia – Three-Year Follow-up of a Multicenter Phase I/II Study. Blood 2016; 128 : 587. Dostupné z WWW: <http://www.bloodjournal.org/content/128/22/587>.
22. Gardner R, Leger KJ, Annesley CE et al. Decreased Rates of Severe CRS Seen with Early Intervention Strategies for CD19 CAR-T Cell Toxicity Management. Blood 2016; 128 : 586. Dostupné z WWW: <http://www.bloodjournal.org/content/128/22/586>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Prof. MUDr. Richard Češka, CSc., FACP, FEFIM, předseda České internistické společnosti České lékařské společnosti Jana Evangelisty Purkyně, šedesátiletý
- K šedesátinám Richarda Češky
- Poznámky ke střevní tuberkulóze – editorial
- Současný pohled na ivabradin v léčbě kardiovaskulárních onemocnění
- Osteoprotektivní léčba bisfosfonáty nebo denosumabem u nemocných s mnohočetným myelomem: přínos a rizika
- Zamyšlení nad chlopenními vadami včera a dnes
- Čo nám hovorí klinická štúdia GLAGOV?
- Novinky v léčbě hypertenze a dyslipidemie
- Cévní ektázie žaludečního antra a syndrom solitárního rektálního vředu – dvě vzácné diagnózy jako příčina anémie u téhož pacienta: kazuistika
- Záchrana diabetické nohy komplexní individualizovanou léčbou diabetika 2. typu: kazuistika
- Akutní lymfoblastická leukemie dospělých – případ dlouhého došetřování bolestí kyčlí s překvapivým závěrem: kazuistika
- Je to znovu střevní tuberkulóza? Kazuistika
- Stanovisko panelu expertů odborných společností k použití tikagreloru v léčbě akutních koronárních syndromů u nemocných se sníženou renální funkcí
- Mezioborové panelové diskuse společnosti Boehringer Ingelheim v rámci XXV. výročního sjezdu České kardiologické společnosti
- Doc. MUDr. Jozef Kollár, DrSc., osemdesiatpäťročný
- Korespondence ke článku
- Korespondence ke článku
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteoprotektivní léčba bisfosfonáty nebo denosumabem u nemocných s mnohočetným myelomem: přínos a rizika
- Akutní lymfoblastická leukemie dospělých – případ dlouhého došetřování bolestí kyčlí s překvapivým závěrem: kazuistika
- Je to znovu střevní tuberkulóza? Kazuistika
- Zamyšlení nad chlopenními vadami včera a dnes
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



