-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaÚčinnost léčby anagrelidem u nemocných s Ph‑ negativními myeloproliferativními chorobami: ovlivnění výskytu trombózy ve výstupech Registru pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® ke konci roku 2012
The effectiveness of anagrelide treatment in patients with Ph ‑ negative myeloproliferative diseases: influence on the incidence of thrombosis in the data from the Registry of patients with essential thrombocythemia and thrombocythemia associated with other myeloproliferative diseases treated with Thromboreductin® to the end of 2012
In the Czech Republic, anagrelide (Thromboreductin®) [29] is used according to the recommendations of the Czech Working Group on Myeloproliferative Disorders (CZEMP) for treatment of thrombocythemia associated with Ph ‑ negative myeloproliferative disorders (MPDs). The patient data are collected in the Registry of patients with essential thrombocythemia (ET) and thrombocythemia associated with other MPDs treated with Thromboreductin®. At the end of 2012, the Registry contained data on 1,161 patients. Out of these, 1,159 patients with the diagnosis of a Ph ‑ negative MPD were evaluated. In 844 patients, precise WHO based diagnosis was known at start of therapy: 442 (52.4%) had ET, 108 (12.8%) had polycythaemia vera (PV) and 243 had primary myelofibrosis (PMF). The median age was 51 years at the time of diagnosis. At the time of the evaluation of the population, the median was 59 years. Every year, the proportion of patients newly treated with anagrelide as a first‑line treatment in accordance with the CZEMP guidelines has been increasing. A growing proportion of patients has been treated with an additional cytoreducing drug, such as hydroxyurea and interferon. The majority of the patients received also an antiaggregant (or anticoagulant). More than a half of patients harbors the JAK2 mutation. A prompt decrease of platelet counts (as the response to Thromboreductin® treatment) was documented in most of the patients. After one year, 86.9% of patients had a full or partial reponse. In poorer responders, combination cytoreductive treatment was administered rather then the escalation of the Thromboreductin® dosage. There were 461 thrombotic manifestations in 363 patients and 61 haemorrhagic events in 57 patients recorded in the patients’ history. In the course of treatment (follow‑up; F ‑ U), thrombosis was diagnosed only 179-times in 136 patients. There were more haemorrhagic events during F ‑ U: 109 events in 83 patients. Upon comparison of the number of events during F ‑ U to their numbers in history, we found a two‑fold decrease in arterial thrombosis, an almost two‑fold decrease in microvascular thrombosis and even a 6.6 - fold decrease in venous thromboembolism events. Bleeding episodes increased 1.8-fold during F ‑ U. However, the vast majority of these hemorrhagic events were clinically insignificant. In conclusion, the treatment strategy according to the CZEMP guidelines incorporating anagrelide is highly effective in reducing the platelet counts, strongly prevents venous events, reduces arterial events, and leads to an increase of minor hemorrhages.
Key words:
myeloproliferative disorders – anagrelide (Thromboreductin®) – thrombosis – patient registry
Autoři: M. Penka 1; J. Schwarz 2; P. Ovesná 3; L. Červinek 4; P. Ďulíček 5; D. Pospíšilová 6; J. Kissová 1; T. Pavlík 3; Kolektiv České Pracovní Skupiny Pro Myeloproliferativní Choroby (czemp)
Působiště autorů: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Miroslav Penka, CSc. 2 Ústav hematologie a krevní transfuze Praha, ředitel prof. MU Dr. Marek Trněný, CSc. 3 Institut biostatistiky a analýz Lékařské a přírodovědecké faku 1
Vyšlo v časopise: Vnitř Lék 2013; 59(6): 516-531
Kategorie: Původní práce
Souhrn
Anagrelid (Thromboreductin®) [29] je v ČR používán dle doporučení České pracovní skupiny pro myeloproliferativní choroby (CZEMP) k léčbě trombocytemie provázející Ph-negativní chronické myeloproliferace (MPO). Údaje o nemocných jsou shromažďovány v Registru pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® (dále jen Registr). Jeho výstupy byly opakovaně publikovány, naposledy v roce 2010 (Vnitř Lék 2010; 56 : 503) [28]. Zmíněný Registr je veden od roku 2001 a od počátku je jeho cílem stanovení podrobného klinického, laboratorního a bezpečnostního profilu nemocných. Během svého užívání doznala jeho struktura některých změn, které reagují na výstupy získávané z dosavadních analýz. Také vyplněnost databáze se rok od roku zvyšovala a v některých položkách dosáhla až 100 %. Doba sledování u nejdéle sledovaných nemocných činí 138 měsíců. V databázi Registru jsou ke konci roku 2012 údaje o 1 161 nemocných. Z toho bylo hodnoceno 1 159 nemocných s diagnózou chronické Ph-negativní myeloproliferativní choroby a analýza byla zaměřena na nemocné s esenciální trombocytemií, pravou polycytemií a primární myelofibrózou. Jedná se o 697 žen a 462 mužů s věkovým mediánem 51 let v době stanovení diagnózy, v době hodnocení souboru byl pak medián 59 let. Každým rokem vzrůstá podíl nově zaléčených pacientů anagrelidem jako lékem první volby v souladu s doporučenými postupy CZEMP schválenými Českou hematologickou společností. Asi nejvýznamnějším důvodem tohoto trendu je doporučený posun věkové hranice pro léčbu nemocných anagrelidem jako lékem první volby z 60 na 65 let. Častěji se také setkáváme s kombinovanou léčbou, a to zejména u starších nemocných a u pacientů s primární myelofibrózou a pravou polycytemií. Ze sledovaných rizikových parametrů předchorobí narůstá výskyt hypertenze, z laboratorních ukazatelů se u sledovaných zjišťuje u více než poloviny případů JAK2 mutace. Zatímco všech trombotických projevů bylo ve sledované skupině nemocných zjištěno v anamnéze 461 u 363 nemocných, krvácivých projevů bylo dokladováno 61 u 57 pacientů. V průběhu léčby byla trombóza diagnostikována 179krát u 136 pacientů. Krvácivých projevů bylo ve sledovaném (a lépe již podchyceném) souboru zjištěno více, a to 109 u 83 nemocných. Z hlediska léčby dosahujeme po 3 měsících odpovědi u 76 % a po půl roce u 83 % sledovaných, přesto však po 12 měsících nedosahuje odpovědi ještě 13,1 % pacientů. Podíl na tom může mít i relativně pomalu navyšovaná dávka Thromboreductinu®, která ani v této skupině nepřesahuje v průměru denní dávku 2,36 mg. Jedním z nejvýznamnějších ukazatelů úspěšnosti léčby je ovlivnění výskytu klinické symptomatologie, především výskytu trombotických projevů. O úspěšnosti léčby, resp. komplexní péče o nemocné, svědčí dvojnásobný pokles arteriální trombózy, takřka dvojnásobný pokles mikrovaskulární trombózy a dokonce 6,6násobný pokles příhod žilního tromboembolizmu. Krvácení je zjišťováno u asi o 1/ 2 vyššího počtu pacientů v porovnání s dobou před zařazením do systematického sledování, jedná se přitom o krvácení klinicky nevýznamná.
Klíčová slova:
myeloproliferativní choroby – anagrelid (Thromboreductin®) – trombóza – registrÚvod
Ph-negativním myeloproliferacím se Česká pracovní skupina pro Ph-negativní myeloproliferace (CZEMP), či aktivity, které jejímu vzniku předcházely, věnují od roku 2001 a od roku 2005 je aktivní i Registr pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® (dále jen Registr). Databáze Registru se pochopitelně od počátku vyvíjela a měnila. Soubor se rozrůstal, co se týče množství a spektra sledovaných dat.
MPO s trombocytemií mají monoklonální povahu [11,37]. Diagnostika prošla řadou klasifikací – PVSG [23], WHO z roku 2001 [13], ECMP z roku 2007 [22], WHO z roku 2008 [37]. Některé klasifikace umožňují odlišení hraničních případů [např. časné fáze primární myelofibrózy – PMF či prepolycytemického stadia polycythaemia vera (PV)]. Některé z dosavadních klasifikačních schémat jsou právě za účelem odhalení rozhodujících rozdílů detailně propracovány (WHO z roku 2001, ECMP z roku 2007). Rozdíl je spatřován zejména v odlišnosti histologického nálezu v kostní dřeni [36]. Poslední klasifikace využívají komplexního prošetření nemocných, které vždy zahrnuje i molekulárně biologické vyšetření, především stanovení JAK2 mutace V617F, případně další (např. exon 12 genu JAK2, MPL, TET2, CBL, ASXL1, EZH2) [12,30]. V současné době se tedy do popředí pozornosti dostává vyšetření molekulárně biologické, především mutace JAK2V617F, která je nalézána až u 95 % případů PV, u 34 – 67 % případů PMF a u 23 – 57 % ET. JAK2 mutace je patrně sekundární aberací, neboť k ní dochází při klonální hematopoéze [14 – 16].
Požadavky na léčbu jednotlivých myeloproliferativních onemocnění jsou z hlediska především cytoredukční léčby odlišné. Jedná se např. o odlišný požadavek cíleného účinku, dále o odstupňovanou míru agresivity léčby nebo výhody použití kombinované léčby [8,21]. Je proto nutné upřednostnit klasifikaci, která vychází z vyšetření histologie kostní dřeně [37] a vyšetření klonality onemocnění, neboť za klinicky zásadní se považuje co nejpřesnější určení diferenciální diagnózy hned od počátku [2].
Trombocytemie může být provázena závažnými trombotickými či krvácivými projevy [4,10]. K nim disponují nemocní z celé řady důvodů – v závislosti na samotném počtu krevních destiček, ale také v závislosti na výskytu souběžných predispozičních faktorů. Těmi může být preexistující nebo získaná trombofilní či krvácivá zátěž nebo zvýšené kardiovaskulární riziko. Mezi významné trombotické dispozice patří JAK2 mutace [32,33]. Podrobné další vyšetření trombofilní dispozice provádíme z důvodu indikace účinné antitrombotické, méně často protikrvácivé profylaxe [19]. Tam, kde je přítomna trombocytemie přesahující 1 000 × 109/ l, kde dochází k nárůstu počtu trombocytů do 2 měsíců o více než 200 × 109/ l, nebo při výskytu jiného rizikového faktoru či více faktorů souběžně (viz výše), doporučujeme léčbu vedoucí ke snížení, resp. normalizaci počtu destiček – anagrelidem, interferonem či hydroxyureou [25,33]. Především u mladších nemocných (< 65 let) je lékem první volby anagrelid (případně interferon). Průměrná dávka anagrelidu při zavedené léčbě činí asi 2,0 – 2,5 mg denně [27], přičemž se nedoporučuje překračovat denní dávku 5 mg [25].
Léčbu anagrelidem [34,35] lze ve vybraných případech také kombinovat; s interferonem [6] či hydroxyureou [5], čímž se dosáhne možnosti redukce dávky obou léků proti dávce léku při monoterapii každým z nich. V některých případech je vhodné kombinovat léčbu cytoreduktivní, resp. tromboreduktivní s antiagregační léčbou – nejčastěji s kyselinou acetylsalicylovou (ASA) [17]. Jedná se o případy s počtem destiček do 1 000, popř. 1 500 × 109/ l, kdy je vyšší riziko trombózy, a/ nebo o případy zvýšeného kardiovaskulárního rizika – tedy hrozby tepenné (kardiaci, pacienti s cévním onemocněním mozku apod.) a mikrovaskulární trombózy. Některé výsledky ale naznačují, že léčba ASA může mít vliv u nemocných s myeloproliferací provázenou trombocytemií i na snížení výskytu žilní trombózy [18]. V případech podávání ASA je však nutno vyloučit možnou současně se vyskytující prokrvácivou dispozici – ať již z důvodu možné trombocytopatie provázející choroby samotné, nebo náchylnosti spojené s výskytem jiné choroby či patologického stavu (např. von Willebrandova choroba nebo získaný von Willebrandův syndrom [20]). Požadavek opatrnosti při současném podávání ASA či jiných antitrombocytárních léků (thienopyridiny, nesteroidní antiflogistika apod.) je tedy dán možnou přítomností funkční poruchy krevních destiček u nemocných s trombocytemií, které se klinicky manifestují především při počtu destiček nad 1 200 × 109/ l. Tento fenomén popisuje velmi trefně známý Michielsův model „doutníku a klínu“ [21,33] a je dán především výskytem právě von Willebrandova syndromu u velmi vysokých počtů destiček.
Cílem této analýzy bylo vyhodnotit vliv komplexní, dle doporučení CZEMP „na míru šité“ léčby na vznik trombotických projevů a ty porovnat s jejich výskytem v době před zařazením nemocných do Registru, tedy před zavedením léčby.
Soubor nemocných
V současné době jsou k dispozici data od 1 159 nemocných, z toho 442 s ET (52,4 %), 243 s PMF (28,8 %), 108 s PV (12,8 %) a 51 (6 %) s jinou diagnózou dle WHO klasifikace při zahájení léčby anagrelidem, přičemž 315 nemocných nemělo diagnózu při zahájení léčby stanovenou dle WHO. V souboru je 697 (60,1 %) žen a 462 (39,9 %) mužů s věkovým mediánem 51 let v době určení diagnózy (6 – 91 let), v době hodnocení souboru byl pak medián 59 let (graf 1). V Registru jsou shromažďovány údaje o základních laboratorních ukazatelích, rizikových dispozicích žilního tromboembolizmu a kardiovaskulárních komplikací včetně rodinné anamnézy i získaných přitěžujících okolností. Data od jednotlivých pacientů jsou zaznamenávána ve čtvrtletních intervalech, v prvním pololetí jednou za měsíc. Medián doby sledování (od zařazení do Registru) byl 38 měsíců. Celková doba sledování činí již 138 měsíců a vyplněnost záznamů o přítomnosti rizikových faktorů kolísá mezi 62 a 100 %.
Graf 1. Popis souboru pacientů (n = 1 159). 
Mezinárodní registr nemocných s ET a dalšími MPO s trombocystemií byl založen v roce 2001, jeho česká část s podrobnějšími údaji pak existuje od roku 2005 [26].
Metoda
Klinické vyšetření bylo zaměřeno na anamnézu – výskyt trombotických a krvácivých projevů v anamnéze nemocného, dále se zaměřilo na zjištění přítomnosti hypertenze, diabetes mellitus, nadváhy, kuřáctví. Z hlediska léčby se zaznamenávaly podávané cytoreduktivní a antitrombotické léky a jejich dávka.
Laboratorní vyšetření sestávalo z několika panelů. Základní hematologický soubor obsahoval krevní obraz a fibrinogen, biochemický soubor posuzoval cholesterol, triglyceridy, homocystein, ukazatele jaterních a renálních funkcí. Speciální hematologické vyšetření zahrnovalo vyšetření inhibitorů krevního srážení – antitrombinu, proteinu C, proteinu S, stanovení trombofilních mutací – faktoru V Leiden (F VL) a mutaci genu protrombinu (PT G20210A), lupus antikoagulans (LA) a antifosfolipidové protilátky, hladinu faktoru VIII (F VIII) a v neposlední řadě vyšetření JAK2 mutace. Všechna vyšetření byla prováděna klasickými běžně používanými metodami.
Statistické zpracování
K sumarizaci kategoriálních dat byly použity frekvenční tabulky. Vzhledem k tomu, že jeden pacient může prodělat více událostí (různých typů), byl kromě počtu pacientů s událostí prezentován i počet zaznamenaných událostí.
Vztah trombotických dispozic k trombotickým událostem (v anamnéze nebo při léčbě Thromboreductinem®) je hodnocen zvlášť pro jednotlivé rizikové faktory pomocí MV χ2 testu. Dále byly vytvořeny modely pro predikci výskytu trombóz v závislosti na všech potenciálně významných faktorech pomocí vícerozměrné logistické regrese. Do modelu byly vloženy všechny faktory s p-hodnotou < 0,1 v jednorozměrném modelu a ty byly vzájemně porovnány vzhledem ke svému trombotickému potenciálu. Získané OR vyjadřuje zvýšení (OR > 1) či snížení (OR < 1) šance pro vznik trombotické události při přítomnosti sledovaného rizikového faktoru.
Srovnání četnosti podání antiagregancií před zaznamenanou událostí s průměrným podáním ve všech zbývajících záznamech bez výskytu této události bylo provedeno binomickým testem. Ke srovnání (spojitých) hodnot krevního obrazu před zaznamenanou událostí s celkovým mediánem získaným ze všech záznamů bez výskytu události byl použit Wilcoxonův test.
Výsledky
Vliv léčby Thromboreductinem® na výskyt trombózy a krvácení
V souboru bylo zjištěno celkem 522 příhod trombózy či krvácení u 395 pacientů před jejich zařazením do sledování, což činí 34,1 % z celkového počtu hodnocených pacientů (tab. 1). V průběhu sledování (léčby) byla jakákoliv příhoda diagnostikována 288krát u 190 – tedy u 16,4 % z celkového počtu našich nemocných (tab. 2). Zatímco všech trombotických projevů bylo ve sledované skupině nemocných zjištěno v anamnéze 461 u 363 nemocných, krvácivých projevů bylo dokladováno 61 u 57 nemocných. V průběhu léčby byla trombóza diagnostikována 179krát u 136 pacientů. Krvácivých projevů bylo ve sledovaném (a lépe již podchyceném) souboru zjištěno více, a to 109 u 83 nemocných (tab. 3). Co do samotného výskytu zmíněných příhod dosahuje jejich součet 55,2 % celkového počtu příhod zjištěných u sledovaných nemocných v jejich anamnéze.
Tab. 1. Počty zaznamenaných událostí a pacientů s událostí v anamnéze a při léčbě Thromboreductinem<sup>®</sup>. 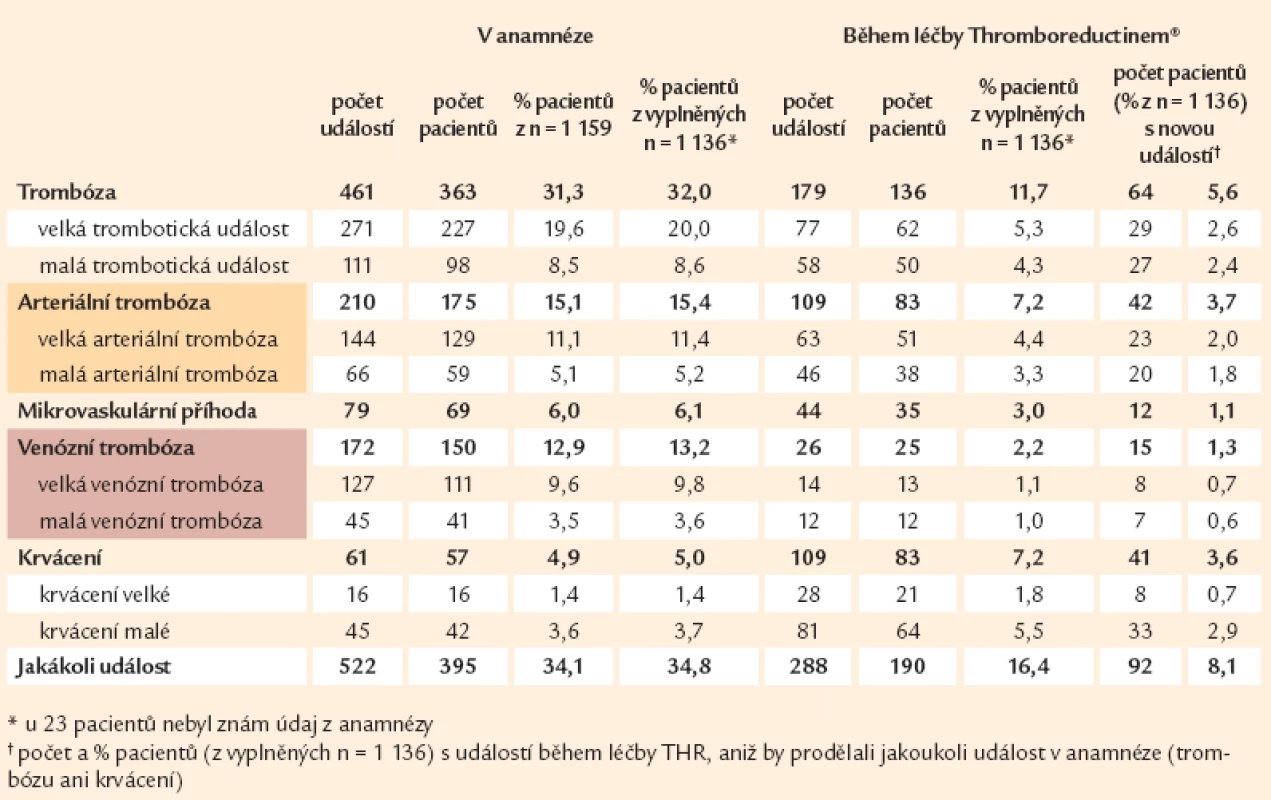
Tab. 2. Komplikace spojené s MPN v anamnéze a během léčby Thromboreductinem<sup>®</sup>. 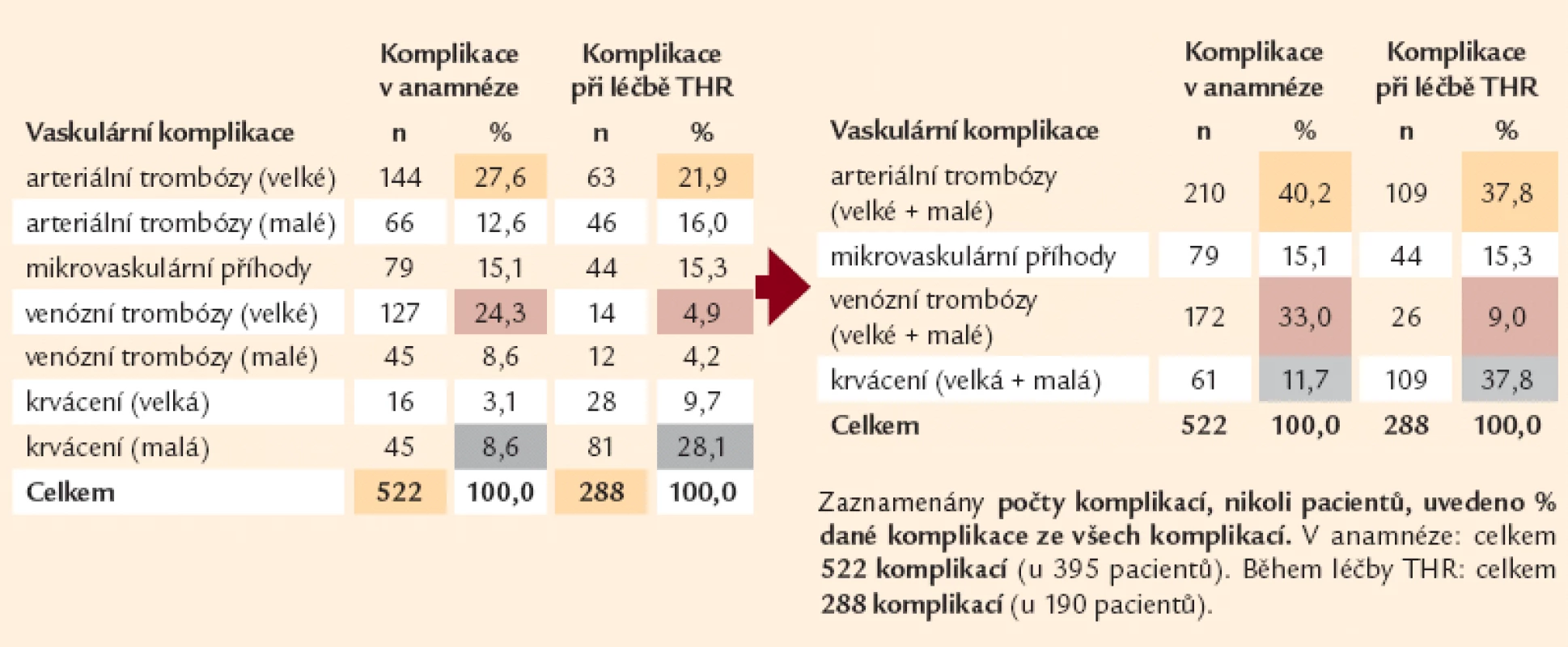
Tab. 3. Incidence komplikací spojených s MPN v anamnéze a během léčby Thromboreductinem<sup>®</sup>. 
Z hlediska stanoveného cíle bude další pozornost upřena na trombotické příhody. Pro podrobnější hodnocení jsme trombotické projevy rozdělili na velké tepenné a žilní trombózy, malé tepenné a žilní trombózy a mikrotrombózy. Velikost příhody byla dána velikostí okludované cévy.
Ke vzniku tepenné trombózy došlo u 175 nemocných s celkovým počtem 210 událostí před zařazením do sledování (tedy jako anamnestického údaje) proti 109 tepenným trombózám u 83 nemocných v průběhu sledování a léčby, tedy po zařazení do registrační databáze. Rozdíl mezi údajem o výskytu tepenné trombózy v anamnéze a údajem o výskytu tepenné trombózy z období léčby byl podobný rozdílu z pohledu výskytu všech trombóz. V případě žilní trombózy to bylo v rámci anamnézy 172 příhod u 150 nemocných proti 26 trombózám u 25 nemocných v době sledování (tab. 3).
Velmi zajímavý je údaj o průměrném časovém intervalu pro vznik trombotické příhody při sledování na léčbě. Zatímco ke vzniku arteriální trombózy by byla nutná doba 23 let, pak pro vznik žilní trombózy činí tato propočtená doba 158 let (tab. 4).
Tab. 4. Incidence trombóz při léčbě Thromboreductinem<sup>®</sup> (n = 1 159). 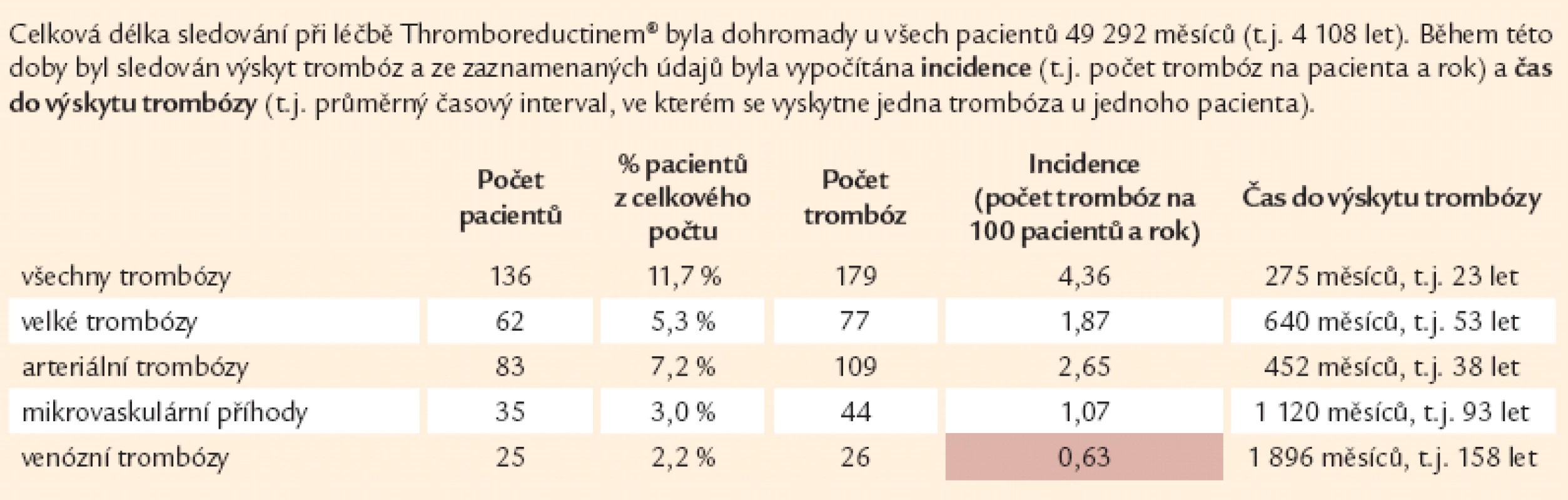
Vliv prognostických faktorů na vznik trombózy
Z námi sledovaných trombofilních dispozic je jedním z nejvýznamnějších kauzálních ukazatelů údaj o prodělané trombóze v anamnéze. Tato souvislost se týká především tepenné trombózy (tab. 5). Tepenná trombóza se statisticky významně častěji vyskytuje u nemocných s věkem vyšším než 65 let, podobně jako i u nemocných s vysokým tlakem. Statisticky významně se projevuje ve vztahu k arteriální trombóze také kouření (tab. 6, 7).
Tab. 5. Vliv rizikových parametrů na vznik trombotických událostí při léčbě Thromboreductinem<sup>®</sup> (n = 1 136*). Tabulka uvádí p-hodnoty, které přísluší rozdílům v četnosti vaskulárních komplikací během léčby Thromboreductinem<sup>®</sup> mezi pacienty, kteří měli a kteří neměli komplikaci v anamnéze (MV chí-kvadrát test). Barevně je vyjádřen trend: □ hnědá: pacienti s komplikací v anamnéze měli nižší četnost komplikace během léčby THR než pacienti bez komplikace v anamnéze. □ žlutá: pacienti s komplikací v anamnéze měli vyšší četnost komplikace během léčby THR než pacienti bez komplikace v anamnéze. 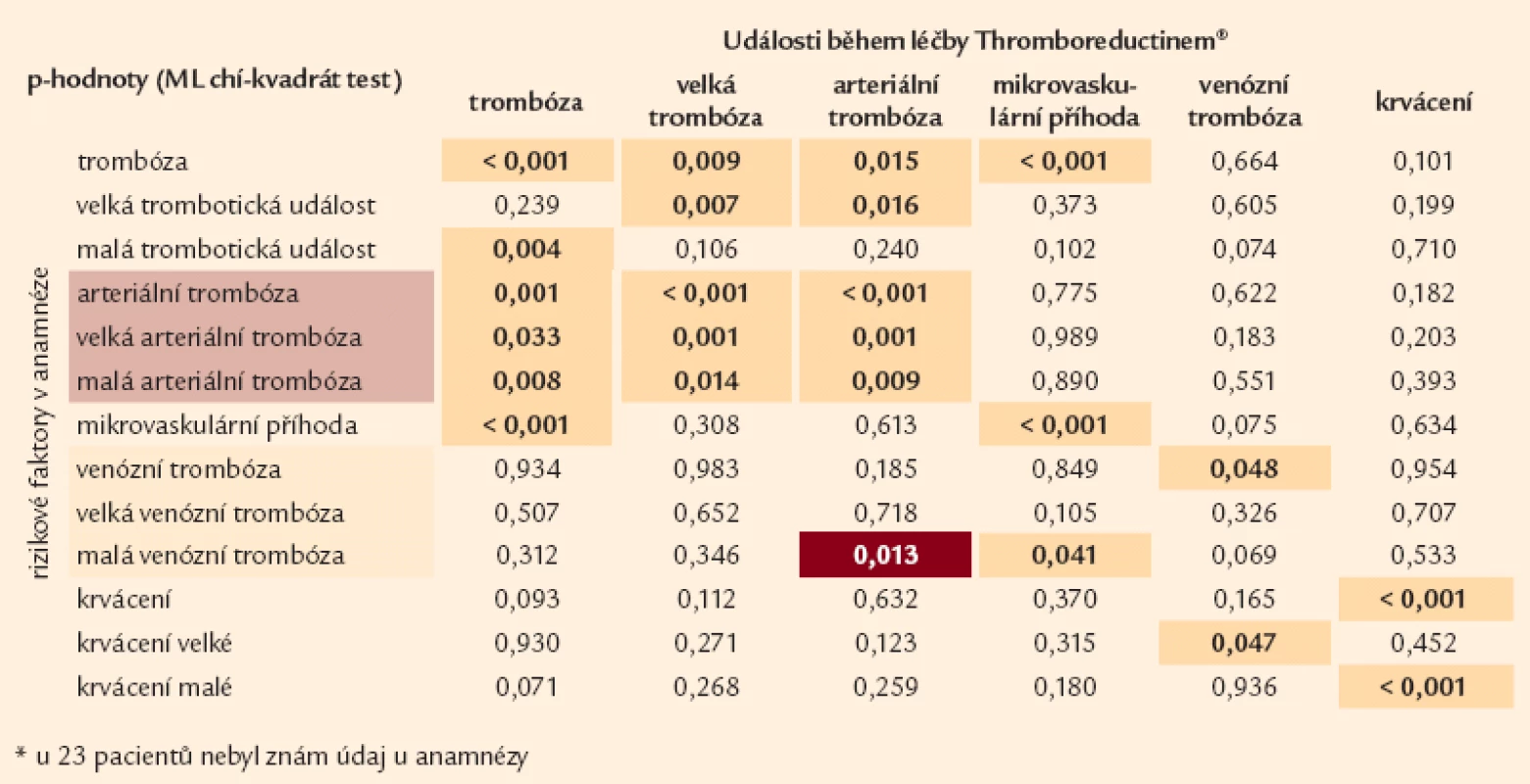
Tab. 6. Vliv rizikových parametrů na vznik trombotických událostí při léčbě Thromboreductinem<sup>®</sup> (n = 1 159). Tabulka uvádí p-hodnoty, které přísluší rozdílům v četnosti vaskulárních komplikací během léčby Thromboreductinem<sup>®</sup> mezi pacienty, kteří měli a kteří neměli rizikový faktor (MV chí-kvadrát test). Barevně je vyjádřen trend: □ hnědá: pacienti s rizikovým faktorem měli nižší četnost komplikace během léčby THR než pacienti bez rizikového faktoru □ žlutá: pacienti s rizikovým faktorem měli vyšší četnost komplikace během léčby THR než pacienti bez rizikového faktoru 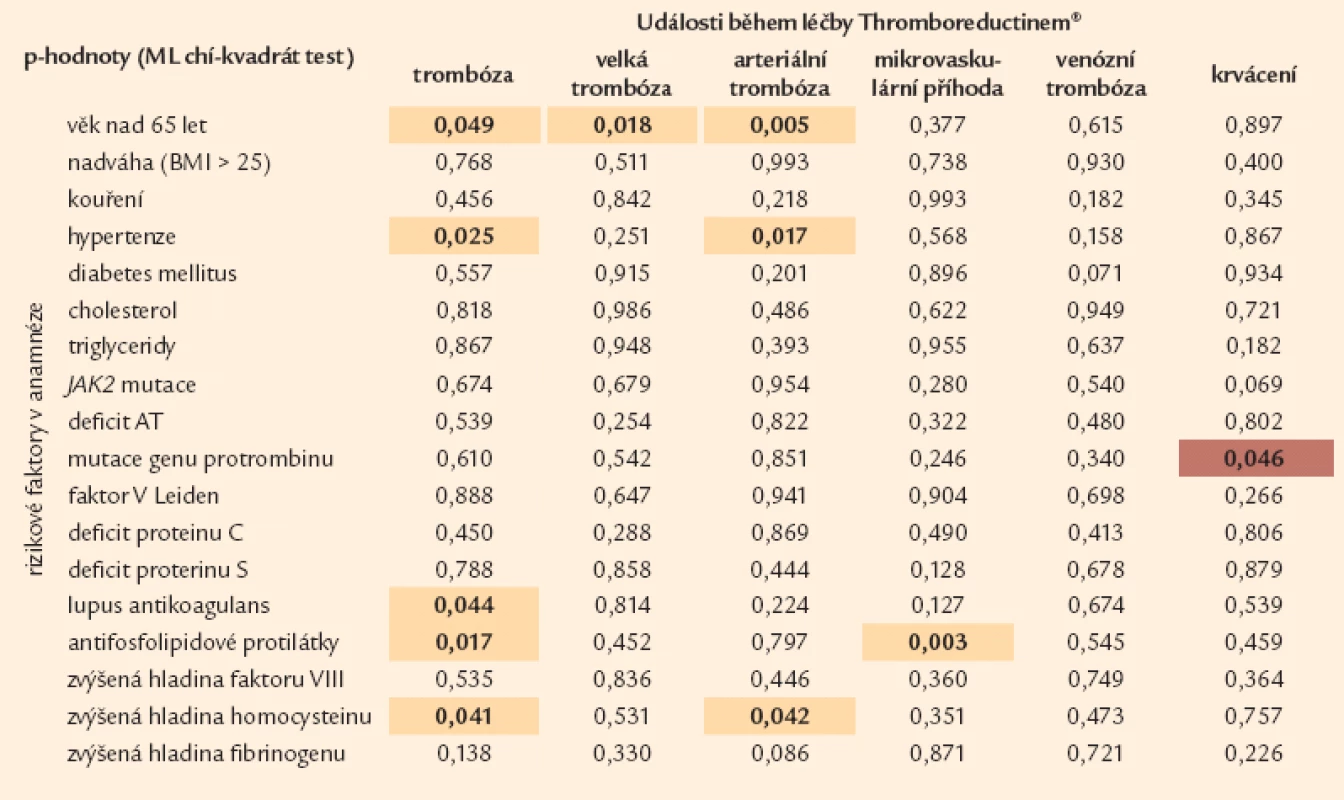
Tab. 7. Vliv rizikových parametrů na vznik trombotických událostí (n = 1 159). Tabulka hodnotí vliv rizikových faktorů na vznik trombóz, a to dohromady v anamnéze nebo při léčbě Thromboreductinem<sup>®</sup>. 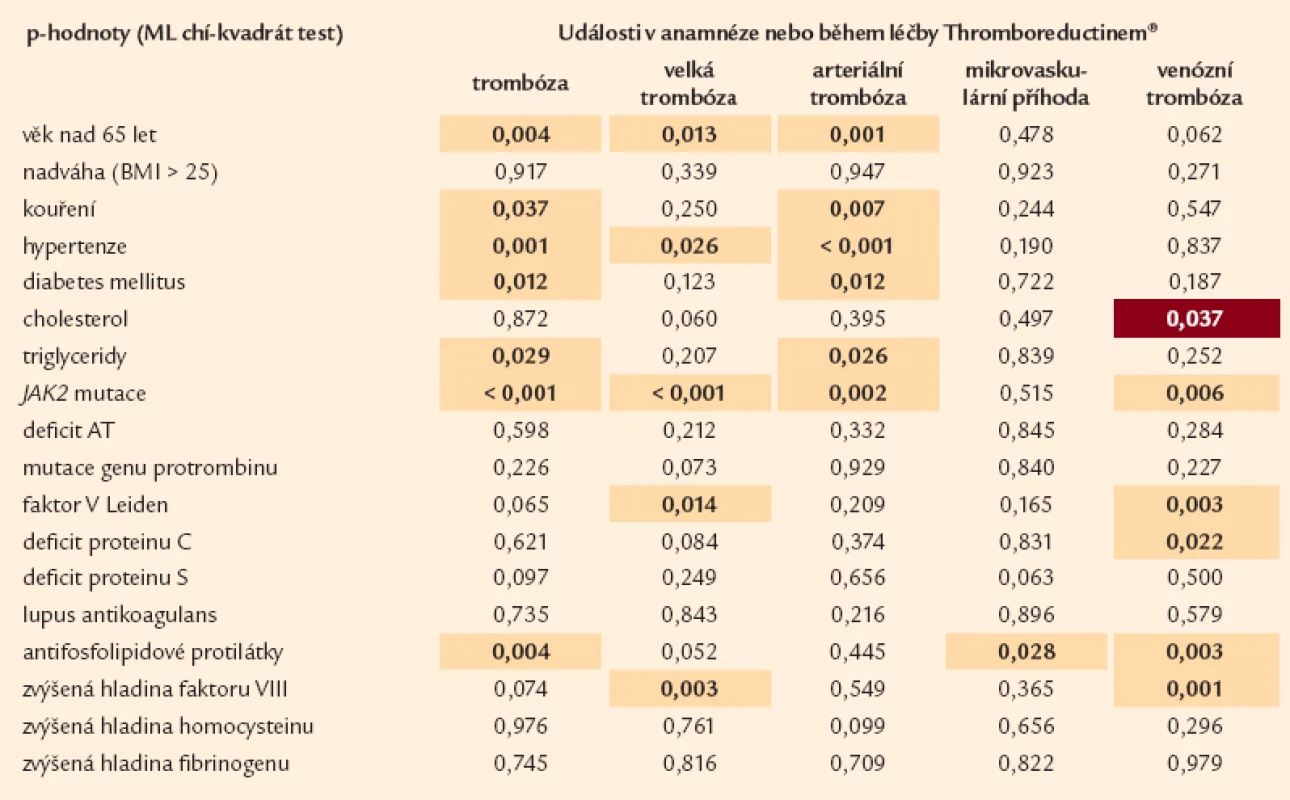
Z laboratorních ukazatelů se v našich výsledcích prokazuje (statisticky) významná role – vedle nálezu JAK2 mutace pro všechny typy trombózy (graf 2) – i přítomnost FVL a defektu PC a antifosfolipidových protilátek u trombóz venózních (tab. 7).
Graf 2. Trombóza v anamnéze nebo během léčby THR ve vztahu k JAK2<sup>V617F</sup> mutaci (n = 1 061*). 
Co se týče léčby během sledování pacientů po jejich zařazení do Registru – u pacientů, kteří v této době prodělali arteriální trombózu – byla antiagregační terapie podávána před vznikem 65 příhod (63,1 %), což nebylo statisticky významné ve srovnání s podáváním u pacientů, kteří tuto příhodu na antiagregační léčbě neprodělali (56 %), avšak jejich podávání po proběhlé události (66 %) již statistickou významnost ve prospěch léčených pacientů získalo. U nemocných na antiagregační léčbě, kteří prodělali 19 příhod žilní trombózy, jsou tyto rozdíly statisticky významné před vznikem této události (tab. 8). Po prodělané žilní trombóze se podíl antiagregační léčby u těchto pacientů snížil na podání u 13 příhod a statistickou významnost ztratil (tab. 9). Významně se ale zvýšilo podávání antikoagulancií (z 8 na 50 %).
Tab. 8. MPN komplikace a podávání antiagregancií/antikoagulancií PŘED vznikem trombózy nebo krvácení – detailní pohled. 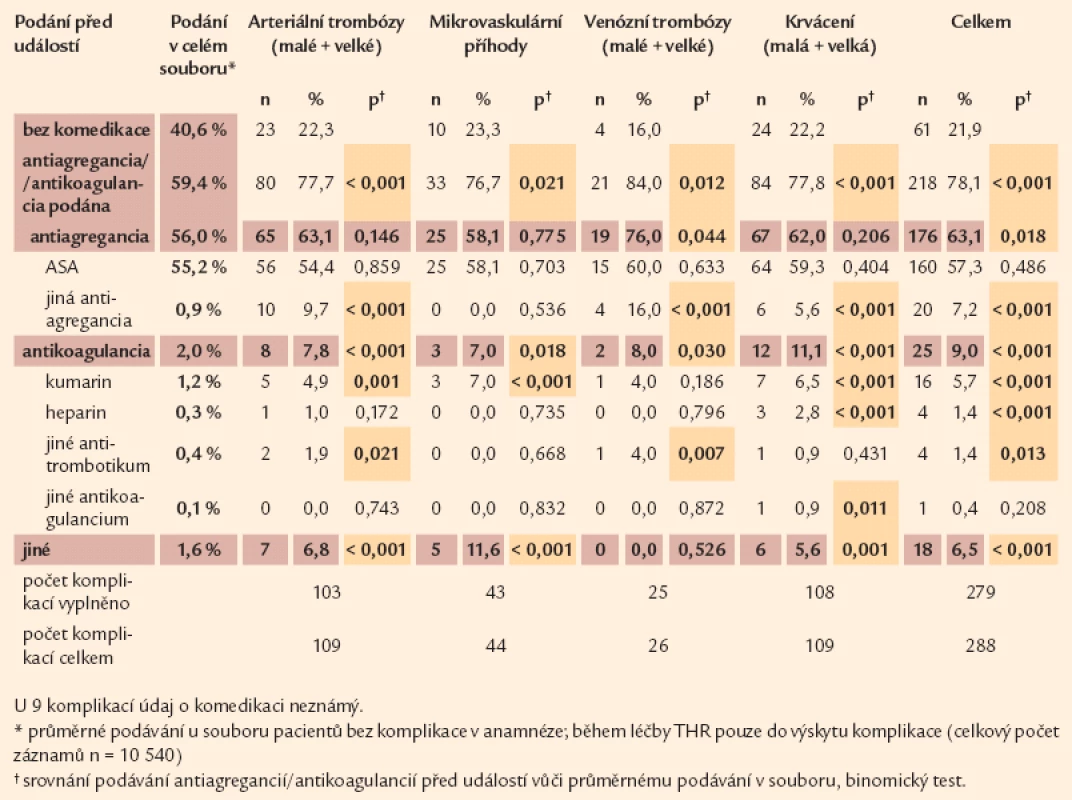
Tab. 9. MPN komplikace a podávání antiagregancií/antikoagulancií PO vzniku trombózy nebo krvácení. 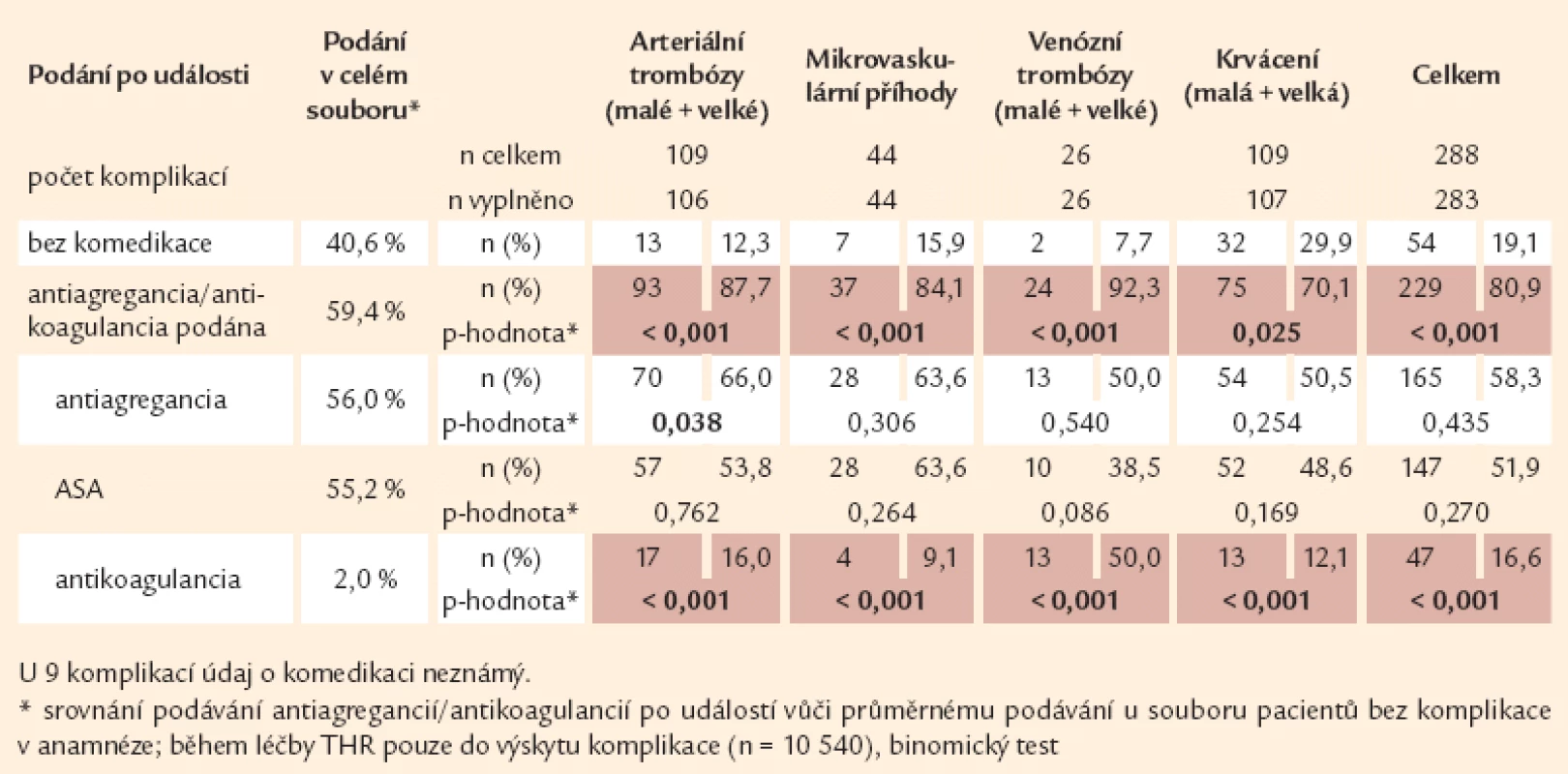
Dalším parametrem, jenž je z hlediska výskytu tromboembolických komplikací popisován – leukocytóza [10,39] – i když se v našem souboru po celou dobu sledování pohybuje v průměru v normálních nebo nadnormálních hodnotách nepřesahujících 13,3 × 109/ l, vykazuje statisticky významnou spojitost s arteriálními a mikrovaskulárními příhodami (tab. 13).
Tab. 10. Parametry krevního obrazu po výskytu trombózy (n = 179). 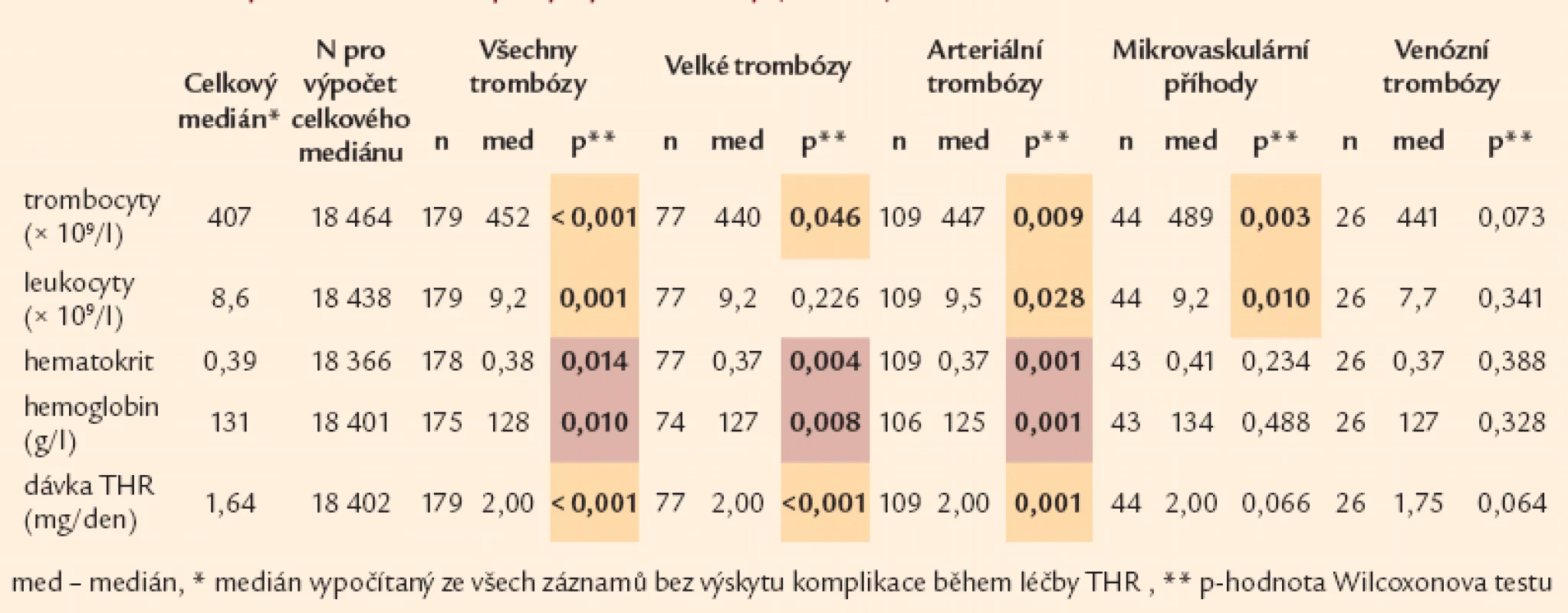
Hodnota hemoglobinu a hematokritu vykazuje statisticky významně nižší hodnotu v souvislosti především s arteriální trombózou (tab. 13).
Význam vyššího počtu krevních destiček a jeho role pro snazší vznik trombózy (především žilní) je patrný a je předmětem nově připravované publikace CZEMP, proto zde nebude podrobněji rozebírán.
Podrobnější analýzou jednotlivých skupin trombotických příhod jsme došli při jejich statistickém zpracování k následujícím výsledkům: výskyt velkých trombóz se ukazuje být závislý na přítomnosti JAK2 mutace, F VL a zvýšené hodnotě faktoru VIII (tab. 10).
Tab. 11. Výskyt velkých trombóz v závislosti na rizikových faktorech (n = 689). 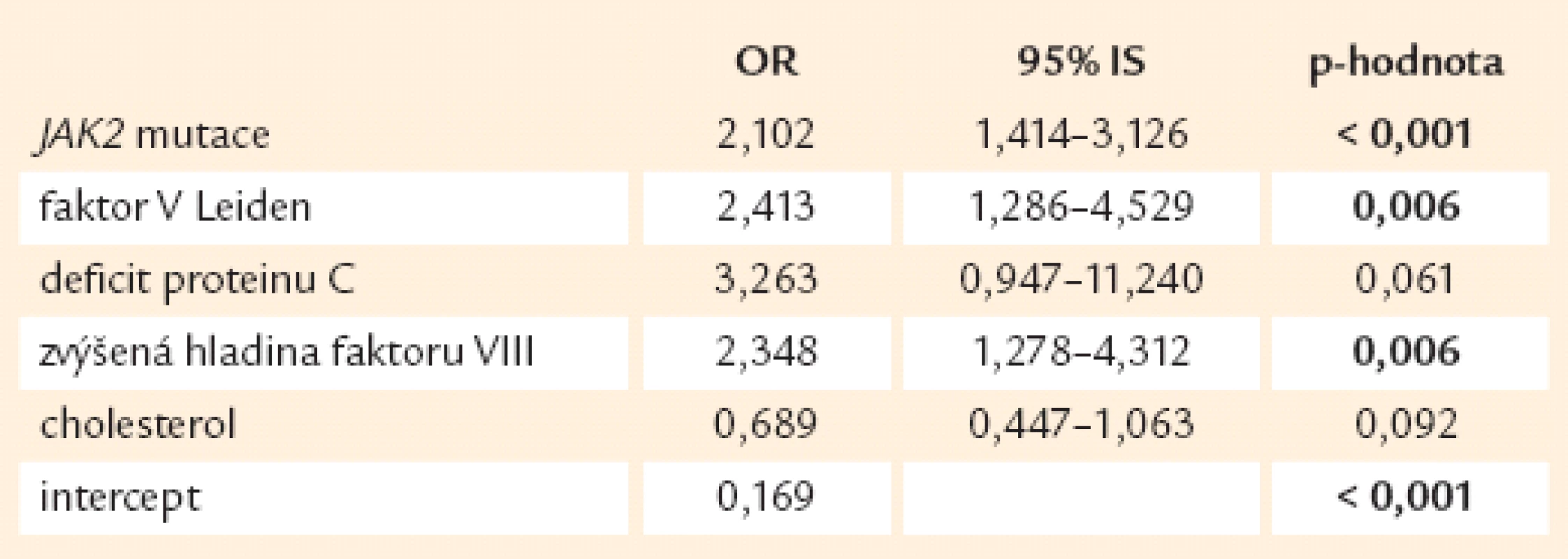
U tepenné trombózy, jak se dalo předpokládat, hraje nejvýznamnější roli výskyt JAK2 mutace z laboratorních ukazatelů a vliv kouření, hypertenze a diabetes mellitus z klinických ukazatelů (tab. 11), jakož i věk nad 65 let.
Tab. 12. Výskyt arteriálních trombóz v závislosti na rizikových faktorech (n = 871). 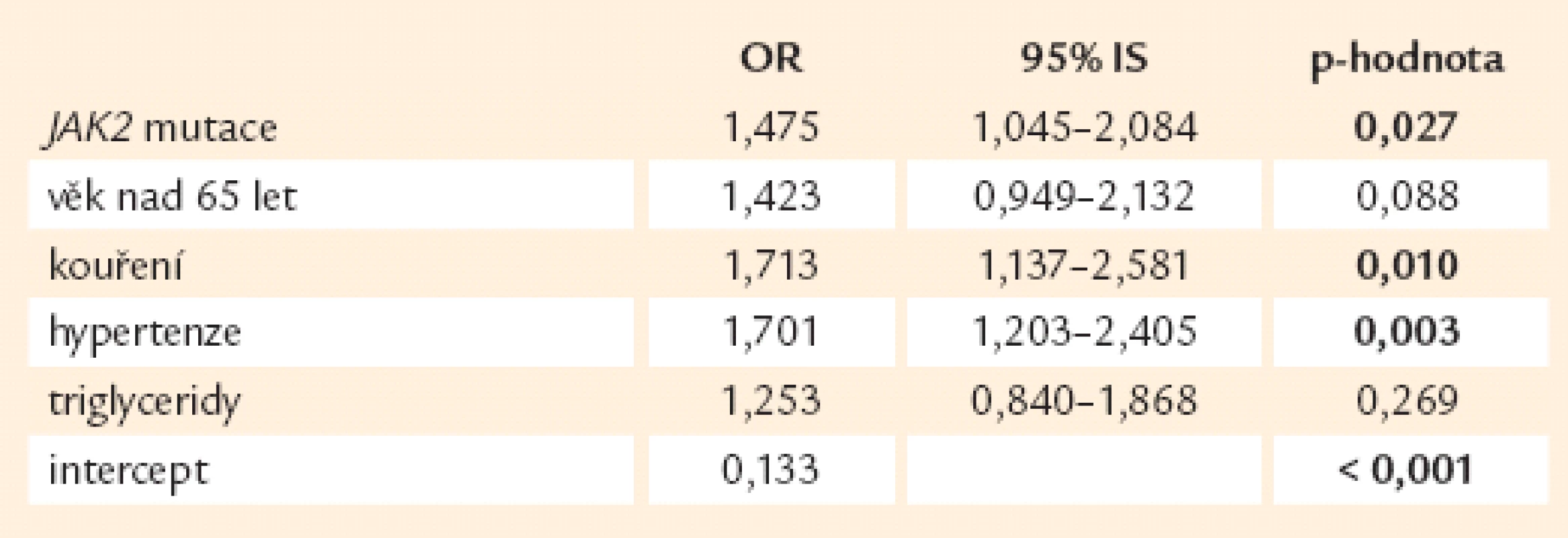
U mikrovaskulárních příhod se jeví všeobecně jako hraničně významný nález defektu proteinu S a antifosfolipidové protilátky – jako jediné statisticky významné, u dalších je jejich významnost předmětem zkoumání.
V případě žilních trombóz je nejvýznamnějším nálezem tato pětice dispozic – přítomnost JAK2 mutace, F VL, defektu proteinu C, antifosfolipidových protilátek a zvýšené hladiny faktoru VIII (tab. 12).
Tab. 13. Výskyt venózních trombóz v závislosti na rizikových faktorech (n = 684). 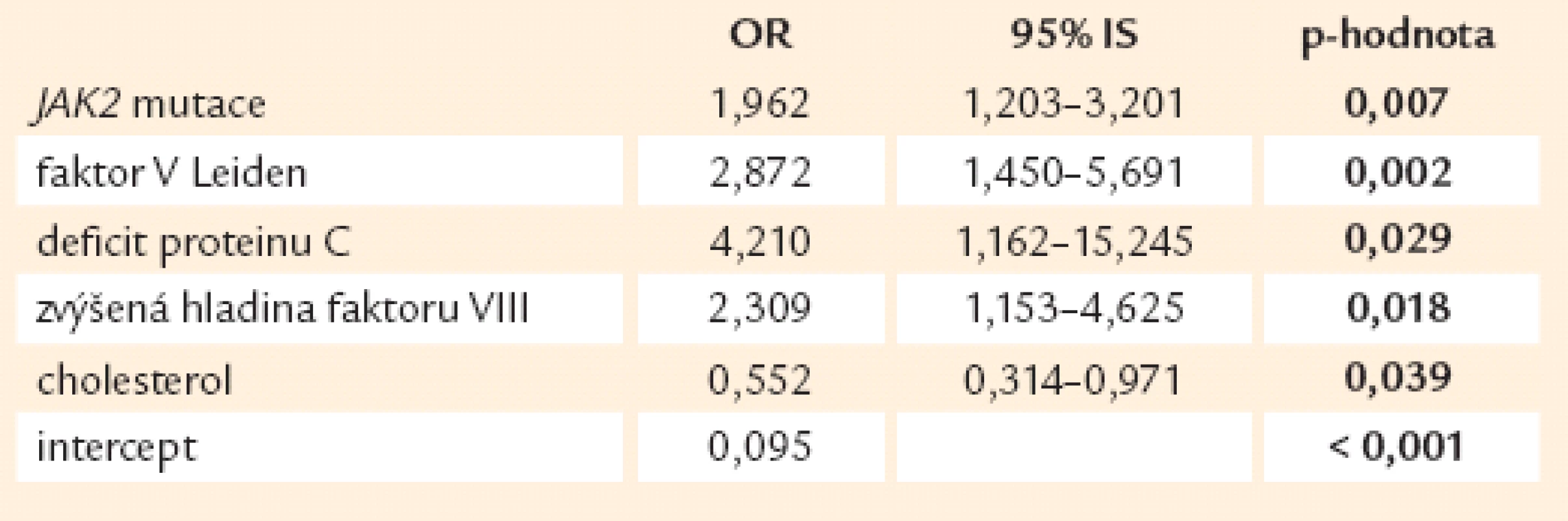
Vliv léčby Thromboreductinem® na hodnoty krevního obrazu
U sledovaných nemocných našeho souboru se dosahuje rychlé odpovědi co do počtu krevních destiček. Po 3 měsících léčby je dosahováno léčebné odpovědi (pod 600 × 109/ l) u 78,2 % pacientů a z toho kompletní odpovědi – tedy poklesu počtu destiček u nemocných s vysokým rizikem pod 400 × 109/ l, jak je dáno doporučením CZEMP – u 33,7 % pacientů. Po 1 roce terapie se dosahuje léčebné odpovědi u 87 % nemocných, z toho kompletní u 48 % nemocných s rizikem – tedy u necelé 1/ 2 nemocných, u nichž by kompletní odpovědi dosaženo být mělo (tab. 14), ačkoli se dávka Thromboreductinu® zvyšuje. Ani v této skupině nepřesahuje v průměru denní dávku 2,36 mg (graf 3), což znamená vlastně necelou 1/ 2 maximální doporučené denní dávky. Lze však říci, že od roku 2010 došlo u rizikových nemocných k významnému posunu efektivity léčby (graf 4).
Tab. 14. Srovnání vývoje počtu trombocytů v prvních 12 měsících dle cíle terapie (n = 750). 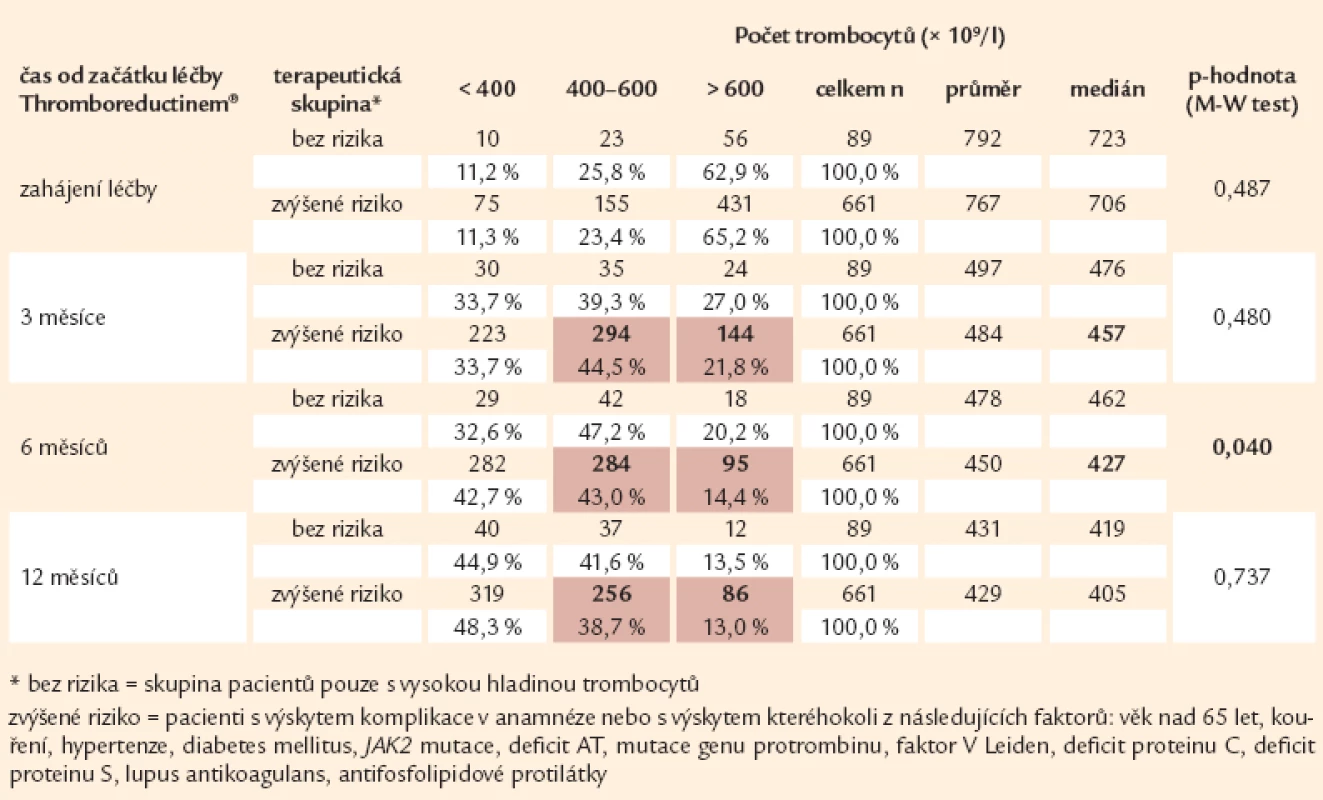
Graf 3. Vývoj počtu trombocytů a dávkování v prvních 12 měsících (n = 750). 
Graf 4. Vývoj počtu trombocytů v čase dle roku začátku léčby (n = 1 159). 
Diskuze
U nemocných s rizikovými faktory je snahou zavedení trombocytoreduktivní léčby [1] ke snížení počtu destiček do mezí odpovídajících kompletní léčebné odpovědi (dle doporučených postupů CZEMP – [25]), tedy k hodnotám nepřesahujícím počet destiček 400 × 109/ l.
V případě rizikových faktorů je další snahou komplexní péče eliminace rizikových faktorů, které lze odstranit – kouření, obezita, hypertenze a podávání specifických léků k dosažení zmíněného efektu. Souběžně se také podávají antiagregancia, v zátěžových situacích nebo vyžaduje‑li to celkový stav nemocného, i dlouhodobě. Naopak u nemocných, kdy nejsou zmíněné léky indikovány, je nepodáváme paušálně.
U nemocných s leukocytózou se nabízí podávat léky, které ji snižují, což se děje v souvislosti především s primární myelofibrózou, kdy je součástí nebo základním lékem onemocnění v daném případě hydroxyurea.
Sumarizujeme‑li úsilí dané systematickým uplatňováním diagnostických a terapeutických doporučených postupů CZEMP, pak jeho výsledkem vycházejícím z údajů Registru je dvojnásobný pokles arteriální trombózy, takřka dvojnásobný pokles mikrovaskulární trombózy a dokonce 6,6násobný pokles příhod žilního tromboembolizmu.
Jako dispoziční faktory k trombóze jsou z laboratorních ukazatelů nejčastěji zjišťovány JAK2 mutace, F VL, defekt proteinu C a zvýšení koncentrace faktoru VIII plazmatického systému krevního srážení. Za některých okolností je významným faktorem přítomnost antifosfolipidových protilátek. V našich výsledcích se také potvrzuje, že v souvislosti nejspíše s tvorbou leukocytárně‑trombocytárních agregátů může být i leukocytóza rizikovým faktorem. Jak vysoká se leukocytóza jako rizikový faktor uplatní, je studováno [9]. Podobně i změny červených parametrů – pravděpodobně vlivem na reologické vlastnosti krve a její proudění – mohou vznik trombózy také ovlivnit.
Problémem poruchy krevního srážení a vznikem klinické symptomatologie se u nemocných s Ph-negativními myeloproliferacemi zabýváme opakovaně [25 – 28]. V jedné z prvních analýz Registru [26] jsme publikovali význam přítomnosti JAK2 mutace z hlediska trombofilní dispozice a potvrdili jsme i v našem souboru, co se objevovalo v literatuře [5]. Již tehdy byly diskutovány aspekty protrombotických faktorů, ale nebyly jasně postulovány žádné další klinicky relevantní dispozice k trombóze než obecně přijímané nespecifické faktory, jako jsou vyšší věk, obezita, hypertenze, kouření, a to především pokud jde o arteriální trombózy. Přesto Finazzi a Barbui [7] doporučují v roce 2005 dle rizika trombózy stratifikovanou terapii se zaměřením na využití cytoredukční léčby u nemocných pouze s vysokým rizikem. K cytoredukci pak doporučují hydroxyureu s letmou zmínkou o její diskutované leukemogenicitě.
Prognostické faktory analyzovali Passamonti et al [24] ve své práci z roku 2008 a analyzují soubor 605 nemocných přepočtený na 4 596 paciento/ roků, přičemž potvrzují jako nejvýznamnější rizikový ukazatel vyšší věk (nad 60 let) a anamnestický údaj o prodělané trombóze.
Definici trombotického rizika poskytují Vianello et al [39] a problém shledávají na úrovni trombocytů, leukocytů, endotelia, selektinů, NO a konstatují, že leukocytóza a nález JAK2 mutace budou mít z hlediska léčebné intervence významný vliv na úspěšnost v zábraně vzniku tromboembolických komplikací.
Reilly [31] poskytuje přehled cytoredukční léčby u nemocných ET v 9 evropských zemích a konstatuje, že její indikací je prevence klinické symptomatologie především tromboembolických či trombohemoragických příhod. Zmiňuje význam rizikových faktorů bez jejich podrobnějšího rozboru.
Dá se tedy konstatovat, že většina prací se zabývá spíše indikací léčby z obecných principů, i když je právě tromboembolická symptomatologie vždy zmiňována. Barbui v roce 2012 [3] zaměřuje svoji pozornost na tento fenomén a podrobuje kritickému hodnocení rizikové faktory trombózy, za něž je považován věk nad 60 let a výskyt trombózy v anamnéze a zmiňuje kontroverzní roli diabetu, hypertenze, kouření a snad i JAK2 mutace v literatuře. Vyslovuje přitom domněnku, že relativní hodnocení rizika postrádá svou možnost posuzovat individuální riziko hrozby trombózy a že k ní je třeba mnohočetné analýzy. Skupina prof. Barbuiho vyvinula vysoce diskriminativní Mezinárodní prognostické skóre (International Prognostic Score – IPS) k odhadu rizika trombózy analýzou 891 striktně dle WHO diagnostikovaných ET a autor je nazval IPSET ‑ thrombosis. Jedná se o multivariační Cox regresní analýzu, v níž hodnotí 4 prvky – věk, trombóza v anamnéze, kardiovaskulární riziko a přítomnost JAK2 mutace. Riziko rozděluje na 3 stupně – nízké (0 – 1), střední (2) a vysoké (3), které přinášejí signifikantně rozdílné výsledky ve výskytu trombózy. Tento systém pak doporučuje k využití v rutinní praxi.
Sami jsme tento návrh velmi přivítali a můžeme říci, že se potvrzuje i v naší práci, že se jedná o skutečně rozhodující položky, které jsme právě z hlediska „kardiovaskulárního“, včetně trombofilního rizika podrobněji rozebrali.
I když naše výsledky nebyly shrnuty do skórovacího systému, jak je jednoduše, a tím i velmi efektivně využil Barbui, pak význam jednotlivých položek z našeho spektra analyzovaných prvků má ambice a schopnost individualizovat riziko tromboembolických příhod v konkrétních případech.
O úspěšnosti přístupu a jím modifikované léčby, resp. komplexní péče o nemocné, svědčí v našem souboru dvojnásobný pokles arteriální trombózy, takřka dvojnásobný pokles mikrovaskulární trombózy a dokonce 6,6násobný pokles příhod žilního tromboembolizmu u nemocných od převzetí pacientů do péče a sběru dat do Registru. Přitom krvácení je zjišťováno u asi o 1/ 2 vyššího počtu pacientů v porovnání s dobou před zařazením do systematického sledování (graf 5), což lze pokládat rovněž spíše za příznivý údaj, vezmeme‑li v potaz, že se jedná o daleko citlivější podchycení všech komplikací, tedy i jakékoliv formy krvácení, pacientů, než před jejich specializovaným sledováním a léčbou.
Graf 5. Incidence komplikací spojených s MPN v anamnéze a během léčby Thromboreductinem<sup>®</sup>. 
S ohledem na zmíněné souvislosti by se měla efektivita léčby nastavovat dle odpovídajících doporučených postupů CZEMP schválených Českou hematologickou společností. V tomto směru je však stále dosti problémů na jedné straně a rezerv na straně druhé.
Proč není zvyšována dávka léčby v případě, že se nedosahuje požadované odpovědi, je dáno řadou faktorů. Důvodem nedosažení odpovědi nebo kompletní odpovědi mohou být vedlejší účinky, které se u našich nemocných vyskytly ve 163 případech, tedy u 14,1 % sledovaných (graf 6), nedostatečná odpověď i při použití nejvyšší povolené dávky, což je v našem souboru minimálně zastoupeno (celkem 18 případů – 1,55 %). Může jím být i požadavek dočasného přerušení terapie (graf 7), ale i nedostatečné využití možností léčby a snahy dosáhnout požadovaného snížení počtu krevních destiček. Přesto setrvání na léčbě je v našem souboru značně vysoké a dosahuje i po 6 letech dle diagnózy vysokého procenta (graf 8).
Graf 6. Sledované nežádoucí účinky léčby (n = 1 159). 
Graf 7. Přerušení terapie a jeho důvody (n = 1 159). 
Graf 8. Setrvání na léčbě v čase dle diagnózy (WHO) při zahájení léčby (n = 844). 
Je třeba, aby byly všechny důvody nedostatečné léčebné odpovědi analyzovány a bylo učiněno vždy vše pro dosažení léčebného efektu i s hledáním řešení, které vyplývá z možnosti velmi detailního individuálního posouzení každého případu [38].
Závěr
Analýza, kterou jsme zpracovali, poskytuje v našem souboru doporučení k léčbě těch nemocných, kteří jsou z hlediska výskytu dispozic k trombóze významně ohrožení. Jestliže se prokáže některý z rizikových faktorů, je třeba nemocným snížit riziko vzniku trombotické komplikace zajištěním komplexní léčby. Ta pak sestává jak z cytoredukčních opatření, tak i léčby antitrombotické – v souladu s doporučeními CZEMP [25]. K ní je teoretickou indikací každá trombofilní dispozice. I když se daří velmi příznivě ovlivňovat trombotickou symptomatologii onemocnění, zůstávají stále rezervy zejména u nemocných, u nichž se požadované odpovědi nedosahuje.
Závěrem lze shrnout, že podrobná analýza dat Registru potvrdila anagrelid jako lék volby v léčbě esenciální trombocytemie a trombocytemie provázející Ph-negativní myeloproliferativní onemocnění pro jeho vysokou účinnost s následným snížením všech typů trombotických komplikací na léčbě oproti anamnéze. O jeho dobré snášenlivosti a příznivém bezpečnostním profilu svědčí vysoké procento (72 %) pacientů pokračujících v léčbě přes 6 let.
prof. MU Dr. Miroslav Penka, CSc.
www.fnbrno.cz
e‑mail: m.penka@volny.cz
Doručeno do redakce: 24. 5. 2013
Přijato po recenzi: 31. 5. 2013
Zdroje
1. Barbui T, Barosi G, Grossi A et al. Practice guidelines for the therapy of essential thrombocythemia. A statement from the Italian Society of Hematology, the Italian Society of Experimental Hematology and Italian Group for Bone Marrow Transplantation. Haematologica 2004; 89 : 215 – 232.
2. Barbui T, Thiele J, Passamonti F et al. Survival and Disease Progression in Essential Thrombocythemia Are Significantly Influenced by Accurate Morphologic Diagnosis: An International Study. J Clin Oncol 2011; 34 : 5298 – 5303.
3. Barbui T. Development of a new multiple variables model to predict thrombosis in Essential Thrombocythemia. ESH International Conference on Myeloproliferative Neoplasma Vienna, Austria, October 4 – 6, 2012.
4. Brière JB. Essential thrombocythemia. Orphanet J Rare Dis 2007; 2 – 3 : 1 – 17.
5. Cortelazzo S, Finazzi G, Ruggeri M et al. Hydoxyurea for patients with Essential Thrombocythemia and a high risk of thrombosis. N Engl J Med 1995; 332 : 113.
6. Elliott MA, Tefferi A. Interferon‑alfa therapy in Polycythemia Vera and essential Thrombocythemia. Semin Thromb Hemost 1997; 23 : 463 – 472.
7. Finazzi G, Barbui T. Risk‑adapted therapy in essential trombocythemia and polycythemia vera. Blood Rev 2005; 19 : 243 – 252.
8. Fruchtman SM, Petitt RM, Gilbert HS et al. Anagrelide Study Group: Anagrelide: analysis of long‑term efficacy, safety and leukemogenic potential in myeloproliferative disorders. Leuk Res 2005; 29 : 481 – 491.
9. Gangat N, Wolanskyj AP, Schwager SM et al. Leukocytosis at Diagnosis and the Risk of Subsequent Thrombosis in Patients With Low ‑ Risk Essential Thrombocythemia an Polycythemia Vera. Cancer 2009; 115 : 5740 – 5745.
10. Gisslinger H, Kralovics R, Gotic M et al. Non ‑ Inferiority of Anagrelide Compared to Hydroxyurea in Newly Diagnose Patiens with Essential Thrombocythemia. The ANAHYDRET ‑ Study. Blood 2007; 110 : 1038A. Abstract 3547.
11. Green A, Campbell P, Buck G et al. The Medical Research Council PT1 Trial in Essentials Thrombocythemia. Blood 2004; 104 : 5a – 6a. Abstract 6.
12. Hoffman R, Prchal JT, Samuelson S et al. Philadelphia Chromosome ‑ Negative Myeloproliferative Disorders: Biology and Treatment. Biol Blood Marrow Transplant 2007; 13 : 64 – 72.
13. Jaffe ES, Harris NL, Stein H et al. World health organization classification of tumours. Pathology and genetics of tumours of haematopoietic and lymphoid tissues. Lyon: IARC Press 2001.
14. Kaushansky K. The chronic myeloproliferative disorders and mutation of JAK2: Damesek’s 54 year old speculation comes of age. Best Pract Res Clin Haematol 2007; 20 : 5 – 12.
15. Kralovics R, Passamonti F, Buser AS et al. A Gain‑of ‑ Function Mutation of JAK2 in Myeloproliferative Disorders. N Engl J Med 2005; 352 : 1779 – 1790.
16. Kralovics R, Skoda RC. Molecular pathogenesis of Philadelphia chromosome negative myeloproliferative disorders. Blood Rev 2005; 19 : 1 – 13.
17. Landolfi R, Rocca B, Patrono C. Bleeding and thrombosis in myeloproliferative disorders: mechanism and treatment. Crit Rev Oncol Hematol 1995; 20 : 203 – 222.
18. Landolfi R, Marchioli R, Kutti J et al. Efficacy and safety of low‑dose aspirin in polycythemia vera. N Engl J Med 2004; 350 : 114 – 124.
19. Michiels JJ, Kutti J, Stark P et al. Diagnosis, pathogenesis and treatment of the myeloproliferative disorders essential thrombocythemia, polycythemia vera and essential megakaryocytic granulocytic metaplasia and myelofibrosis. Netherlands J Med 1999; 54 : 46 – 62.
20. Michiels JJ, Barbui T, Finazzi G et al. Diagnosis and treatment of Polycythemia Vera and possible future study designs of the PVSG. Leuk Lymphoma 2000; 36 : 239 – 253.
21. Michiels JJ, Thiele J. Clinical and pathological criteria for the diagnosis of essential thrombocythemia, polycythemia vera and idiopathic myelofibrosis (agnogenic myeloid metaplasia). Int J Hematol 2002; 76 : 133 – 145.
22. Michiels JJ, DeRaeve H, Hebeda K et al. WHO bone marrow features and European clinical, molecular, and pathological (ECMP) criteria for the diagnosis of myeloproliferative disorders. Leukemia Res 2007; 31 : 1031 – 1038.
23. Murphy S, Peterson P, Iland H et al. Experience of the Polycythemia Vera Study Group with essential thrombocythemia: a final report on diagnostic criteria, survival, and leukemic transition by treatment. Semin Hematol 1997; 34 : 29 – 39.
24. Passamonti F, Rumi E, Arcaini L et al. Prognostic factors for thrombosis, myelofibrosis, and leukemia in essential thrombocythemia: a study of 605 patients. Haematologica 2008; 93 : 1645 – 1651.
25. Penka M, Schwarz J, Pytlík R et al. Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející myeloproliferativní onemocnění. Vnitř Lék 2005; 51 : 741 – 751.
26. Penka M, Schwarz J, Pavlík T et al. Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2007. Vnitř Lék 2008; 54 : 775 – 782.
27. Penka M, Schwarz J, Pavlík T et al. Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem. Vnitř Lék 2009; 55 : 1 – 12.
28. Penka M, Schwarz J, Ovesná P et al. Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k prvnímu čtvrtletí roku 2010. Vnitř Lék 2010; 56 : 503 – 512.
29. Petrides PE. Anagrelid: decade of clinical experiences with its use for the treatment of primary thrombocythaemia. Expert Opin Pharmacother 2004; 5 : 1781 – 1798.
30. Puigdecanet E, Spinet B, Villa O et al. Detection of abnormalities of PRV ‑ 1, TPO, and c‑MPL genes detected by fluorescence in situ hybridization in essencial thrombocythemia. Cancer Genet Cytogenet 2006; 167 : 39 – 42.
31. Reilly JT. Current treatment practices for essential thrombocythemia: survey results from European hematologist/ oncologists. Hematology 2012; 17 : 187 – 192
32. Schwarz J, Hrachovinova I, Vorlova Z et al. Thromboembolism in thrombocythemia patients with an additional thrombophilic state. Hematol J 2004; 5 (Suppl 2): S321. Abstract 974.
33. Schwarz J, Penka M, Doubek M et al. JAK2 mutation and an additional thrombophilic state are major prothrombotic risk factors in myeloproliferations with thrombocythemia – data from a registry of anagrelide‑treated patients. 13th Congress of the European Hematology Association, Kopenhagen, Denmark, June 12 – 15, 2008. Haematologica, Hematol J 2008; 1 : 93. Abstract 0144.
34. Silverstein MN, Tefferi A. Treatment of Essen-tial Thrombocythemia with anagrelid. Semin Hematol 1999; 36 : 23 – 25.
35. Steurer M, Gastl G, Jedrzejczak W et al. Anagrelide for Thrombocytosis in myeloproliferative disorders: a prospective study to assess efficacy and adverse event profile. Cancer 2004; 101 : 2239 – 2246.
36. Thiele J, Kvasnicka HM, Vardiman J. Bone marrow histopathology in the diagnosis of chronic myeloproliferative disorders. A forgotten pearl. Best Pract Res Clin Haematol 2006; 19 : 413 – 437.
37. Tefferi A, Thiele J, Orazi A et al. Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera, Essential thrombocythemia, and primary myelofibrosis: recommendations from an ad hoc international expert panel. Blood 2007; 110 : 1092 – 1097.
38. Tsimberidou MA, Colburn DE, Welch MA et al. Anagrelide and imatinib mesylate combination therapy in patients with chronic myeloproliferative disorders. Cancer Chemother Pharmacol 2003; 52 : 229 – 234.
39. Vianello F, Battisti A, Cerlla G et al. Defining the Thrombotic Risk in Patients with Myeloproliferatove Neoplams. Scientific World J 2011; 11 : 1131 – 1137.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 6- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Významné životní jubileum prof. MU Dr. Karla Horkého, DrSc.
- Národní Program Komplexní Interní Péče (NPKIP). Interna jako páteřní obor zdravotního systému ČR
- Počátky České kardiologické společnosti a české kardiologie
- Moderní trendy v inzulinoterapii
- Vplyv tuhosti aorty na centrálnu hemodynamiku a na kardiovaskulárny systém
- Lipidy a veľkosť lipoproteínových častíc u pacientov s novozisteným a doposiaľ neliečeným diabetes mellitus 2. typu
- Metabolický syndróm a prediabetické stavy
- Rezistentná hypertenzia v staršom veku
- Epigenetická cytostatika a jejich role v protinádorové léčbě
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diferenciálna diagnóza a liečba hyponatriémie
- Adherence a perzistence se zaměřením na léčbu hypertenzních pacientů
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Hypertenze u pacientů s polycystickými ledvinami – incidence, patogeneze, prognóza, terapie
- Primární hyperaldosteronizmus: častá forma sekundární hypertenze s vyšším kardiovaskulárním rizikem
- Chronická obstrukční plicní nemoc pohledem nových doporučení – souhrn aktuálního fenotypově zaměřeného standardu České pneumologické a ftizeologické společnosti pro internisty
- Účinnost léčby anagrelidem u nemocných s Ph‑ negativními myeloproliferativními chorobami: ovlivnění výskytu trombózy ve výstupech Registru pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® ke konci roku 2012
- Recept na individualizaci antikoagulační léčby
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciálna diagnóza a liečba hyponatriémie
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



