-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaÚloha kardiálnych biomarkerov v monitorovaní kardiotoxicity po transplantácii kmeňových krvotvorných buniek
Role of cardiac biomarkers in monitoring of cardiotoxicity after hematopoietic stem cell transplantation
Advances in hematopoietic stem cell transplantation (HSCT) have increased survival in hematologic diseases. However, HSCT survivors are at risk of developing acute and long‑term complications. Cardiac events, such as heart failure, myocardial ischemia and arrhythmias may represent potentially life ‑ threatening conditions. Acute cardiotoxicity can occur during the first 100 days after HSCT. Conditioning regimens, including total body irradiation and high‑dose chemotherapy, previous chemoradiotherapy, including anthracyclines and chest irradiation, are known to be associated with an increased risk of cardiac complications after HSCT. Infectious complications resulting in sepsis due to post‑transplant granulocytopenia may also impair myocardial function. Therefore the main strategy for minimizing cardiotoxicity is early detection of high‑risk patients and prompt prophylactic treatment. Measurement of cardiospecific biomarkers can be a valid diagnostic tool for early identification, assessment, and monitoring of cardiotoxicity. In the present article, we review the usefulness of cardiac troponins and natriuretic peptides, the most commonly used biomarkers of myocardial ischemia and ventricular dysfunction, to detect and to predict the development of cardiotoxicity after HSCT.
Key words:
cardiac biomarkers – cardiotoxicity – hematopoietic stem cell transplantation
Autoři: Ľ. Roziaková 1,2; B. Mladosievičová 1
Působiště autorů: Oddelenie klinickej patofyziológie Ústavu patologickej fyziológie Lekárskej fakulty UK Bratislava, Slovenská republika, prednosta prof. MU Dr. Marián Bernadič, CSc. 1; Klinika hematológie a transfuziológie Lekárskej fakulty UK a UN Bratislava, Slovenská republika, prednosta doc. MU Dr. Martin Mistrík, PhD. 2
Vyšlo v časopise: Vnitř Lék 2013; 59(11): 996-1002
Kategorie: Přehledný referát
Souhrn
Pokroky v transplantáciách kmeňových krvotvorných buniek (TKB) vyústili do zlepšeného prežívania pacientov s hematologickými ochoreniami. Dlhodobo prežívajúci pacienti však majú zvýšené riziko rozvoja akútnych a neskorých komplikácií. Kardiálne komplikácie, ako sú srdcové zlyhanie, myokardiálna ischémia a arytmie, patria medzi život ohrozujúce. Akútna kardiotoxicita sa môže objaviť už v priebehu prvých 100 dní od TKB. Medzi známe rizikové faktory týchto komplikácií patrí liečba v rámci prípravného režimu zahrňujúca celotelové ožiarenie a vysokodávkovanú chemoterapiu, predchádzajúca liečba s použitím antracyklínov a ožiarenie mediastina. Infekčné komplikácie vyúsťujúce do septických stavov v dôsledku potransplantačnej agranulocytózy môžu tiež poškodiť funkciu myokardu. Preto hlavnou stratégiou minimalizovania kardiotoxicity je včasná detekcia rizikových pacientov a promptná profylaktická liečba. Meranie kardiošpecifických biomarkerov môže byť vhodnou diagnostickou metódou na včasnú identifikáciu, hodnotenie a monitorovanie kardiotoxicity. V predloženej práci sumarizujeme použitie kardiálnych troponínov a natriuretických peptidov ako biomarkerov myokardiálnej ischémie a ventrikulárnej dysfunkcie v detekcii a predikcii rozvoja kardiotoxicity po TKB.
Kľúčové slová:
kardiálne biomarkery – kardiotoxicita – transplantácia kmeňových krvotvorných buniekÚvod
Pokrok v liečbe a podpornej starostlivosti o pacientov s malígnymi a nemalígnymi hematologickými ochoreniami vyústil nielen do ich zlepšeného celkového prežívania, ale aj do zvyšujúceho sa počtu prežívajúcich pacientov. Transplantácia kmeňových krvotvorných buniek (TKB) má nezastupiteľné miesto v liečbe závažných hematologických ochorení a stala sa jedinou potenciálne kuratívnou liečebnou modalitou. Až 80 % pacientov, ktorí prežijú prvé 2 roky po TKB, sa stanú dlhodobo prežívajúcimi pacientmi [1]. Očakáva sa, že v roku 2020 bude celosvetovo viac ako 0,5 milióna pacientov po tejto liečebnej modalite [2].
Snahou súčasnej hematológie je nielen vyliečenie pacienta zo závažného základného ochorenia, ale aj zabezpečenie kvalitného života po jeho vyliečení. Správa z najnovšej Bone Marrow Transplant Survivor Study udáva, že až 66 % pacientov po TKB má aspoň 1 chronický zdravotný problém a až u 18 % dlhodobo prežívajúcich pacientov sa vyvinie závažný, život ohrozujúci zdravotný problém [3]. Medzi komplikácie tejto liečebnej modality patrí imunodeficiencia, očné, endokrinné, respiračné, kostné, neurologické komplikácie a ďalšie. Kardiálne komplikácie a sekundárne malignity patria medzi život ohrozujúce.
Hoci výskyt kardiovaskulárnych kom-plikácií nie je vysoký, ich priebeh môže byť často až fatálny. Najnovšia analýza 2 455 pacientov, ktorí podstúpili alogénnu TKB, zistila srdcové zlyhanie u 42 pacientov s časovým odstupom 5 mesiacov od TKB a až 85,7 % týchto pacientov zomrelo, pričom kardiálne zlyhanie bolo príčinou úmrtia až u 22,2 % pacientov [4]. V porovnaní s ostatnou populáciou majú pacienti po alogénnej TKB 2,3-násobne vyššie riziko neskorej smrti spôsobenej kardiálnou komplikáciou. Kardiálna toxicita bola príčinou úmrtia po alogénnej TKB u 3 % pacientov a po autológnej TKB u 2,4 % dlhodobo prežívajúcich pacientov [1]. Nakoľko existuje možnosť zníženia týchto následkov – ich prevenciou, včasnou diagnostikou a liečbou, je potrebné venovať týmto pacientom celoživotnú starostlivosť.
Údaje z posledných štúdií ukazujú, že čas od poslednej chemoterapie do rozvoja ľavokomorovej dysfunkcie a začiatku liečby srdcového zlyhávania je dôležitým determinantom určujúcim obnovu kardiálnych funkcií. V prípade, že sa už objaví kardiálna dysfunkcia, kompletné obnovenie kardiálnej funkcie sa objaví len u 42 % pacientov aj napriek optimálnej farmakologickej terapii [5]. Preto sa hľadajú nové diagnostické postupy, ako včas odhaliť kardiálnu dysfunkciu už na subklinickej úrovni. Meranie kardiošpecifických biomarkerov by mohlo byť vhodnou diagnostickou metódou na včasnú identifikáciu a monitorovanie kardiotoxicity [6].
V tomto prehľadovom článku sa venujeme možnostiam včasnej detekcie kardiotoxicity už na subklinickej úrovni a identifikácii rizikových pacientov z hľadiska možného rozvoja kardiálnych komplikácií po TKB.
Včasná detekcia kardiotoxicity a identifikácia rizikových pacientov
Včasná identifikácia rizikových pacientov z hľadiska možného rozvoja kardiotoxicity predstavuje primárny cieľ hematoonkológov, kardiológov, prípadne praktických lekárov. Medzi rizikové faktory kardiálnych komplikácií patrí vek viac ako 65 rokov, predchádzajúce kardiálne ochorenie, hypertenzia, hyperlipidémia, obezita, predchádzajúca liečba antracyklínmi a ožiarenie mediastina [7].
Najvhodnejšia metóda, ktorá by dokázala detekovať a monitorovať progresiu kardiotoxicity, by mala mať vysokú špecificitu a senzitivitu, neinvazívnosť, precíznosť, pravdivosť a finančnú nenáročnosť. V súčasnosti používané neinvazívne diagnostické postupy zahrňajú hodnotenie ejekčnej frakcie ľavej komory (EF ĽK) pomocou echokardiografického vyšetrenia a rádionuklidovú ventrikulografiu [8,9]. Pilotné práce poukazujú na to, že parametre tkanivovej dopplerovskej echokardiografie kopírujúce rýchlosť pohybu a deformáciu steny myokardu (tzv. strain, strain rate) by mohli spoľahlivo detegovať včasnú dysfunkciu myokardu v priebehu a po ukončení chemoterapie. V nedávno uverejnenej štúdii autori Sawaya et al z Harvard Medical School sledovali pacientky s karcinómom prsníka liečené antracyklínom a trastuzumabom. Pacientky, u ktorých sa po liečbe zistilo zníženie longitudinálnej deformácie o 10 % alebo zvýšenie hodnôt cTnI, mali 9-násobne vyššie riziko kardiotoxicity 6 mesiacov po ukončení liečby. Špecificita súčasne pozitívnych obidvoch prediktorov bola vyššia ako len v prípade pozitivity longitudinálnej deformácie alebo zvýšeného cTnI, kým naopak senzitivita bola podstatne nižšia. Odhalenie subklinických foriem kardiotoxicity si vyžaduje pravidelné sledovanie pacientov a monitorovanie parametrov, ktoré môžu včas upozorniť na postihnutie srdca [10 – 12].
Natriuretické peptidy a kardiálne troponíny sa už používajú u onkologických pacientov na rizikovú stratifikáciu pacientov s amyloidózou s následnou voľbou terapeutickej metódy na základe zisteného kardiálneho rizika [13]. Medzi ďalšie perspektívne kardiomarkery patria endotelín ‑ 1, big endotelín ‑ 1, ultrasenzitívny C ‑ reaktívny proteín, ischémiou modifikovaný albumín, srdcovo ‑ špecifický väzbový proteín pre mastné kyseliny, ST2 a galectin‑3 ako markery fibrózy [11,14 – 16]. Iba málo prác sa doteraz zaoberalo vyšetrovaním kardiálnych biomarkerov po TKB alebo HD ‑ CY (vysokodávkovanom cyklofosfamide) a iba 2 práce zisťovali prediktívnu hodnotu kardiomarkerov v rizikovej stratifikácii pacientov po vysokodávkovanej chemoterapii [33,34]. Prehľad prác sledujúcich kardiálne biomarkery v detekcii kardiotoxicity uvádza tab. 1.
Tab. 1. Prehľad prác sledujúcich kardiálne biomarkery v detekcii kardiotoxicity po TKB. 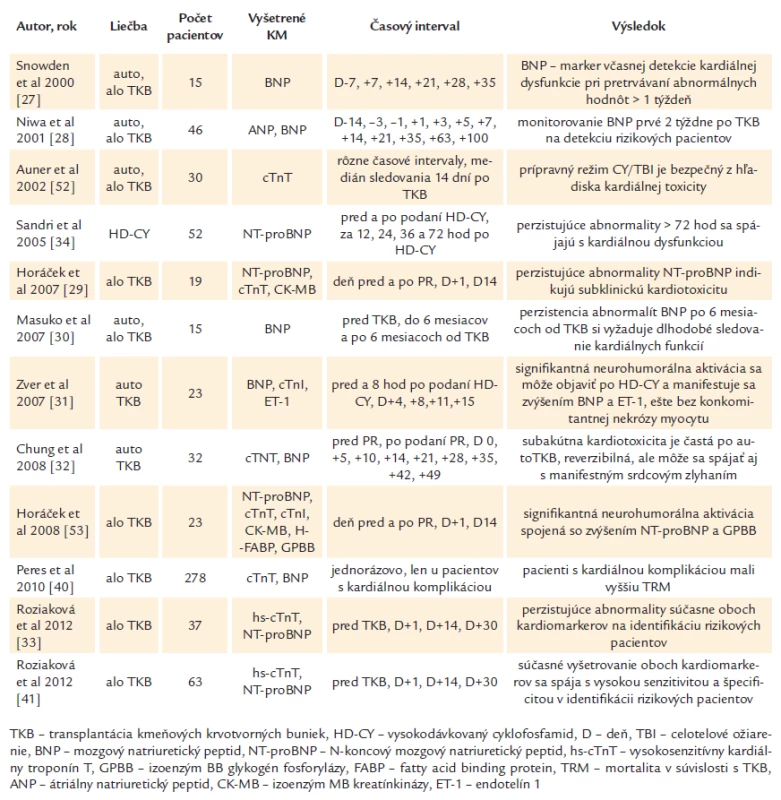
Meranie kardiálnych troponínov môže byť vhodnou diagnostickou metódou na včasnú identifikáciu a monitorovanie kardiotoxicity. Limitáciou však môže byť ich biologická variabilita, ktorá sa uvádza aj v súvislosti s hs ‑ cTnT (vysokosenzitívny kardiálny troponín T) [17]. Napriek tomu, že tieto biomarkery poskytujú informácie o včasnom poškodení, zatiaľ neexistujú presvedčivé dôkazy, aby sa na základe týchto poznatkov menila efektívna liečba. Niektorí lekári využívajú markery na identifikáciu rizikových pacientov, u ktorých by mohlo byť vhodné podávanie kardioprotektívnych látok. Hodnoty „cut-off“ pre abnormálne zvýšenie biochemických kardiomarkerov bývajú v štúdiách s onkologickými pacientmi stanovené nejednotne. Coghlan et al vo svojich odporúčaniach definovali pacientov s perzistujúcim zvýšením hladiny N ‑ koncového prekurzora mozgového natriuretického peptidu (NT ‑ proBNP) nad dvojnásobok normy za vysokorizikových z hľadiska možného rozvoja kardiotoxicity. Preto sa odporúča screening vysokorizikových pacientov pre detekciu včasnej subklinickej kardiotoxicity [11,18].
Natriuretické peptidy
Natriuretické peptidy (NP) – BNP alebo NT ‑ proBNP – sú tvorené a uvoľňované z kardiomyocytov pri ich tlakovom a objemovom preťažení. Signalizujú preťaženie srdca, ktoré nie je bezpodmienečne asociované s bunkovým poškodením (ako v prípade kardiálnych troponínov). Natriuretický peptid typu B (BNP) a jeho N‑terminálny fragment (NT ‑ proBNP) môžu byť zvýšené obzvlášť u pacientov so zlyhaním srdca. Neplatí však, že by ich elevácie boli špecifické iba pre toto ochorenie. Bývajú zvýšené aj napr. u pacientov s hypertrofiou ľavej komory (ĽK), akútnym koronárnym syndrómom, stabilnou koronárnou chorobou, mitrálnou a aortálnou stenózou/ regurgitáciou, cor pulmonale, predsieňovými arytmiami (flutterom, fibriláciou predsiení), šokom, renálnou a hepatálnou insuficienciou, preeklampsiou, anémiou, amyloidózou, kardiotoxicitou protinádorovej liečby (osobitne antracyklínovou) [19 – 21].
Už od roku 2005 sa na základe odporúčaní Európskej kardiologickej spoločnosti (ESC) považuje hladina mozgového natriuretického peptidu (BNP) a NT ‑ proBNP za užitočný marker v diagnostike a diferenciálnej diagnostike srdcového zlyhávania [22] a už viac rokov medzi tieto indikácie patrí aj detekcia antracyklínovej kardiotoxicity [23,24].
Úskalím je stanovenie správnej diskriminačnej hodnoty pre NT ‑ proBNP. Autori Januzzi et al stanovili hraničné hodnoty na vylúčenie akútneho a chronického zlyhávania s ohľadom na vek pacienta (tab. 2) [25,26].
Tab. 2. Doporučené cut-off hodnoty NT-proBNP na stanovenie diagnózy akútneho a chronického srdcového zlyhania [25,26]. ![Doporučené cut-off hodnoty NT-proBNP na stanovenie diagnózy akútneho a chronického srdcového zlyhania [25,26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f882526f921e7913ff80f4526c0297df.png)
V ostatnom období sa uskutočňuje intenzívny výskum týkajúci sa natriuretických peptidov (NP) ako včasných markerov subklinickej kardiotoxicity u onkologických pacientov liečených chemoterapiou. V súčasnosti je iba málo prác zaoberajúcich sa vyšetrovaním NP ako kardiomarkera po TKB [27 – 33] alebo po vysokodávkovanom cyklofosfamide [34].
V prácach sledujúcich vplyv kardiotoxickej chemoterapie na hladinu NP bolo do roku 2010 vyšetrených asi 1 000 pacientov a väčšina autorov našla asociáciu medzi vzostupom NP a kardiálnou dysfunkciou [5]. V týchto štúdiách boli preukázané kardiálne komplikácie a následky rôzneho stupňa – od minimálnych prechodných zmien kardiálnych biomarkerov cez perzistujúce abnormality biomarkerov, až po život ohrozujúcu kardiotoxicitu. Viacerí autori zistili, že prípravný režim pred TKB môže navodiť subklinické poškodenie srdca sprevádzané zvýšením NT ‑ proBNP, a to najmä u pacientov s vyššími kumulatívnymi dávkami antracyklínov pred TKB a u pacientov, ktorí boli liečení rádioterapiou a vysokodávkovaným cyklofosfamidom v rámci prípravného režimu [29,31]. Autori Horacek et al zaznamenali zvýšené hodnoty NT ‑ proBNP u 21 % pacientov už pred podaním prípravného režimu, čo si vysvetlili predchádzajúcim podaním antracyklínov v rámci indukčnej chemoterapie (CHT) [29]. Vzostup hladín NT ‑ proBNP po podaní prípravného režimu môže byť odrazom poškodenia srdca následkom CHT a rádioterapie a akútneho objemového preťaženia v dôsledku masívnej hydratácie. Bolo zistené, že prípravný režim spôsobuje aktiváciu endotelových buniek a makrofágov príjemcu s následným uvoľnením zápalových cytokínov, ako sú tumor nekrotizujúci faktor a (TNFa) alebo interleukíny IL‑1 a IL‑6 [35]. Zápalové cytokíny môžu hrať dôležitú úlohu v patogenéze srdcového zlyhávania potlačením kontraktility, navodením hypertrofie myokardu a apoptózy kardiomyocytu [36,37].
V 5 štúdiách, ktoré sa zaoberali kardiotoxicitou po vysokodávkovanom cyklofosfamide a TKB, boli pozorované perzistujúce zvýšenia hladín BNP/ NT ‑ proBNP u 33 – 63 % pacientov [27,28,30,34,38]. Po 14 dňoch od TKB zaznamenali autori Horacek et al zvýšené hladiny NT ‑ proBNP u 63,2 % pacientov oproti 45,6 % pacientov v štúdii Niwu et al. Tento rozdiel autori Horacek et al vysvetlili vyššou predliečenosťou pacientov antracyklínmi pred TKB [29]. Hodnoty NP po TKB kulminovali na 14. deň po TKB s ďalším pozvoľným poklesom, avšak bez normalizácie na východiskovú hodnotu [38]. Počas ďalšieho sledovania sa u pacientov s perzistujúcim zvýšením hladín BNP/ NT ‑ proBNP oveľa častejšie objavila kardiálna dysfunkcia. Výsledky štúdií ukázali, že monitorovanie BNP/ NT ‑ proBNP by mohlo identifikovať rizikových pacientov z hľadiska rozvoja kardiálnej dysfunkcie po vysokodávkovanom cyklofosfamide a TKB [27,38,30,34,39], avšak na ich zavedenie do rutinnej praxe sú potrebné ešte ďalšie štúdie.
Naproti tomu iba málo prác sa zaoberalo možným využitím NP ako markera včasnej identifikácie rizikových pacientov. Autori Sandri et al vo svojej práci sledovali prediktívnu úlohu NP u pacientov liečených vysokodávkovanou chemoterapiou [34]. U 31 % pacientov neboli pozorované žiadne zmeny v hodnotách NT ‑ proBNP, u 35 % pacientov došlo len k prechodnej zmene v hodnote NT ‑ proBNP, ktorá sa normalizovala v priebehu 72 hod po chemoterapii. Zvyšných 33 % pacientov malo perzistujúce zvýšenie hladiny NT ‑ proBNP aj po 72 hod so súčasným zhoršením parametrov systolickej a diastolickej kardiálnej funkcie v priebehu nasledujúcich mesiacov. Súčasne v tejto skupine pacientov klesla EF ĽK z 63 % na 45 %.
Podobne aj v nedávno publikovanej práci autorov Roziaková et al sa u pacientov so zvýšenými hladinami NT ‑ proBNP pretrvávajúcimi minimálne 14 dní po alogénnej TKB pozorovalo signifikantné zhoršenie parametrov systolickej a diastolickej funkcie. Až u takmer polovice pacientov s perzistujúcimi abnormálnymi hodnotami NT ‑ proBNP došlo k rozvoju klinicky manifestnej kardiotoxicity [33].
Podľa dostupných informácií doteraz bola publikovaná iba 1 práca, ktorá sledovala kardiálne komplikácie u pacientov po nemyeloablatívnej alogénnej TKB. Autori Peres et al sledovali kardiálne komplikácie po TKB s redukovaným prípravným režimom u starších a komorbídnych pacientov. U 25 (9 %) z 278 pacientov vznikla arytmia v mediáne 3 dní od TKB. Rizikovým faktorom bola kumulatívna dávka antracyklínu pred TKB > 400 mg/ m2 alebo EF ĽK< 45 % [40].
Výhodou vyšetrovania NP je ich vysoká negatívna prediktívna hodnota. Autori Roziaková et al vo svojej práci potvrdili vysokú senzitivitu aj špecificitu tohto biomarkera aj u pacientov po alogénnej TKB [41]. Nakoľko sa doteraz iba málo prác zaoberalo rizikovou stratifikáciou pacientov z hľadiska rozvoja kardiálnych komplikácií po TKB na základe abnormalít NT ‑ proBNP, sú potrebné ešte ďalšie prospektívne multicentrické štúdie s väčším počtom pacientov (> 100), s použitím dobre štandardizovaných metód detekcie NP a dobre definovaným časom vyšetrenia NP.
Kardiálne troponíny
Kardiálne troponíny (cTn) sú významným biomarkerom štrukturálneho poškodenia kardiomyocytov. Používajú sa v rôznych klinických indikáciách, najčastejšie v diagnostike akútneho koronárneho syndrómu. Medzi ďalšie stavy spojené so zvýšenou hladinou kardiálnych troponínov patrí myokarditída, pľúcna embólia, šok, hypertrofia ľavej komory, kongestívne srdcové zlyhávanie, sepsa, renálna insuficiencia, subarachnoidálne krvácanie, diabetes mellitus, supraventrikulárna tachykardia, kardioverzia, kontúzia, kardiotoxicita po protinádorovej liečbe, anémia a ďalšie [42].
Na základe výsledkov viacerých štúdií sa predpokladá neischemická etiológia uvoľnenia troponínu po CHT [43]. Pretrvávanie zvýšenej hladiny troponínu T (cTnT) sa zisťuje 1 alebo viac mesiacov po jej ukončení [44].
Podľa najnovších odporúčaní ESC je pre diagnostiku akútneho koronárneho syndrómu postačujúca detekcia vzostupu a/ alebo poklesu kardiálnych biomarkerov – prednostne troponínov s aspoň jednou hodnotou nad 99. percentil horného referenčného limitu s aspoň ešte jedným dôkazom myokardiálnej ischémie. V klinickej praxi môže byť občas zložité odlíšiť pacientov so zvýšenou hladinou troponínov na podklade akútneho koronárneho syndrómu a nekoronárnej príčiny. Pre poškodenie myokardu účinkom protinádorovej liečby sú typické nízke elevácie cTn v sére (napr. 1 000 až 10 000-násobne menšie ako pri veľkých a stredne veľkých infarktoch myokardu) [45]. K spoľahlivej identifikácii cTn je nevyhnutné použiť vysokosenzitívne testy [46].
Na potenciálny prínos vyšetrovania kardiálnych troponínov u pacientov po protinádorovej liečbe upozornili viaceré štúdie [43,44,47 – 51]. V súčasnosti existuje málo vedeckých prác zaoberajúcich sa hodnotením kardiotoxicity po TKB s využitím kardiálnych troponínov [15,29,33,38 – 40,52]. Autori Peres et al sledovali kardiotoxicitu u pacientov, ktorí pre vyšší vek a komorbidity podstúpili alogénnu TKB s redukovaným režimom. U 25 (9 %) z 278 pacientov sa objavila arytmia. Troponín T bol zvýšený u 12 z 25 pacientov. V skupine pacientov s kardiálnou komplikáciou bola aj vyššia mortalita v súvislosti s transplantáciou oproti skupine pacientov bez kardiotoxicity (40 % vs 10 %) [40]. Naproti tomu práce iných autorov nepozorovali signifikantný vzostup v hladine kardiálnych troponínov po prípravnom režime a TKB [15,29,52].
Pri poškodení kardiomyocytu sa troponín uvoľňuje z cytoplazmy do séra a je ľahko detekovateľný. Väčšina troponínu je však naviazaná na aktín a uvoľňuje sa pomaly, čo umožňuje detekovať nielen akútne, ale aj prebiehajúce poškodenie [53]. V našej práci uverejnenej v Bratislavských lekárskych listoch roku 2012 sme preukázali perzistujúce abnormality v hodnotách hs ‑ cTnT po TKB, ktoré mohli odrážať prolongovaný účinok chemorádioterapie na myofibrilárny systém kardiomyocytu [38]. Pretrvávajúce abnormality hs ‑ cTnT s časovým odstupom 14 dní po TKB boli silným prediktorom kardiovaskulárnych komplikácií so 100% senzitivitou a 83,9% špecificitou. Súčasne bola zistená pozitívna korelácia medzi hodnotami hs ‑ cTnT a NT ‑ proBNP, čo by mohlo indikovať vzťah medzi štrukturálnym poškodením myocytu a funkčným poškodením myokardu. Súčasné vyšetrovanie obidvoch kardiomarkerov malo vyššiu prediktívnu hodnotu v diagnostike kardiálnych komplikácií ako vyšetrovanie len jedného z nich [41].
Odporúčania pre prax
Podľa najnovších odporúčaní by malo byť u pacientov po TKB realizované raz ročne vyšetrenie a zhodnotenie kardiovaskulárnych rizikových faktorov a následne v prípade zistených abnormalít včasné zahájenie liečby. Vysokorizikoví pacienti (napr. pacienti s Hodgkinovým lymfómom po rádioterapii na mediastinum, pacienti s amyloidózou a pacienti s preexistujúcimi kardiálnymi komorbiditami) by mali byť sledovaní častejšie a súčasne by mali byť u nich realizované ďalšie vyšetrenia, ako sú elektrokardiografia a echokardiografia. Hoci prediktívna úloha kardiálnych biomarkerov ešte nie je presne definovaná, perzistujúce abnormality kardiálnych troponínov a natriuretických peptidov by mohli identifikovať rizikových pacientov z hľadiska rozvoja kardiotoxicity. Podľa Európskej spoločnosti pre klinickú onkológiu sa odporúča stanovenie troponínu I pred a po podaní chemoterapie, následne s odstupom 12, 24, 36, 72 hod a 1 mesiac od ukončenia liečby. Vyšetrenie NT ‑ proBNP sa odporúča pred a po podaní chemoterapie a 72 hod od ukončenia liečby. Carver et al vo svojej najnovšej práci odporúčajú vyšetrenie BNP u všetkých pacientov, ktorí boli v minulosti liečení antracyklínmi a/ alebo ožiarením. Vyšetrenie kardiálnych biomarkerov zatiaľ s výnimkou špecifických prípadov (napr. u pacientov s AL ‑ amyloidózou) nepatrí do rutinnej praxe. Neodmysliteľnou súčasťou prevencie je aj správna edukácia pacienta, eventuálne jeho rodinných príslušníkov [54 – 57].
Záver
Cieľom súčasnej hematoonkológie je nielen vyliečenie pacienta zo základného ochorenia, ale aj zabezpečenie primeranej kvality života po jeho vyliečení. Preto je potrebné celoživotné sledovanie týchto pacientov s primeranou pozornosťou venovanou aj včasnej detekcii a liečbe potenciálnej kardiotoxicity po transplantácii. Užitočným markerom vo včasnej diagnostike kardiotoxicity by mohli byť kardiálne biomarkery. Perzistujúce abnormality kardiálnych markerov môžu odrážať zníženie funkčnej rezervy myokardu alebo jeho zníženú toleranciu na kardiálnu záťaž. Niekedy nie je možné pravidelne sledovať všetkých vyliečených pacientov. Vtedy môže byť užitočná riziková stratifikácia pacientov. Takýmto vhodným markerom na rizikovú stratifikáciu pacientov z hľadiska možného rozvoja kardiovaskulárnych komplikácií by mohli byť NT ‑ proBNP, cTnT a cTnI. Nakoľko na zvýšení hodnôt kardiálnych biomarkerov sa môže podieľať množstvo ďalších stavov vedúcich k ischemickému a neischemickému poškodeniu myokardu, sú potrebné ešte ďalšie štúdie s väčším počtom pacientov a dlhšou dobou sledovania pred ich zavedením do rutinnej praxe.
Práca bola čiastočne financovaná z grantu MZ SR 2007/ 42 – UK ‑ 18.
MU Dr. Ľubica Roziaková, PhD.
www.fmed.uniba.sk/ index.php?id=patfyz
e‑mail: lubica.roziakova@gmail.com
Doručeno do redakce: 28. 4. 2013
Přijato po recenzi: 16. 7. 2013
Zdroje
1. Bhatia S, Francisco L, Carter A et al. Late mortality after hematopietic stem cell transplantation and functional status of long‑term survivors: report from the Bone Marrow Transplant Survivor Study. Blood 2007; 110 : 3784 – 3791.
2. Savani BN, Griffith ML, Jagasia S et al. How I treat late effects in adults after allogeneic stem cell transplantation. Blood 2011; 117 : 3002 – 3009.
3. Sun CL, Francisco L, Kawashima T et al. Prevalence and predictors of chronic health conditions after hematopoietic cell transplantation: a report from the Bone Marrow Transplant Survivor Study. Blood 2010; 116 : 3129 – 3139.
4. Mo XD, Xu LP, Liu DH et al. Heart failure after allogeneic hematopoietic stem cell transplantation. Int J Cardiol 2013; 167 : 2502 – 2506.
5. Cardinale D, Sandri MT. Role of biomarkers in chemotherapy‑induced cardiotoxicity. Prog Cardiovasc Dis 2010; 53 : 121 – 129.
6. Colombo A, Cardinale D. Using cardiac biomarkers and treating cardiotoxicity in cancer. Future Cardiol 2013; 9 : 105 – 118.
7. Monsuez JJ, Charniot JC, Vignat N et al. Cardiac side ‑ effects of cancer chemotherapy. Int J Cardiol 2010; 144 : 3 – 15.
8. Goncalvesová E, Šimková I, Roziaková Ľ et al. Diagnostické možnosti kardiotoxicity protinádorovej liečby. In: Mladosievičová B et al (eds). Kardioonkológia. Bratislava: SAP 2012 : 133 – 163.
9. Elbl L, Hrstková H, Chaloupka V et al. Diagnostic possibilities of late cardiotoxic sequelae of chemotherapy with anthracyclines. Vnitř Lék 2002; 48 : 981 – 988.
10. Anderson B, Sawyer DB. Predicting and preventing the cardiotoxicity of cancer therapy. Expert Rev Cardiovasc Ther 2008; 6 : 1023 – 1033.
11. Dolci A, Dominici R, Cardinale D et al. Biochemical markers for prediction of chemotherapy‑induced cardiotoxicity: systematic review of the literature and recommendations for use. Am J Clin Pathol 2008; 130 : 688 – 695.
12. Sawaya H, Sebag IA, Plana JC et al. Early detection and prediction of cardiotoxicity in chemotherapy‑treated patients. Am J Cardiol 2011; 107 : 1375 – 1380.
13. Palladini G, Merlini G. Transplantation vs conventional‑dose therapy for amyloidosis. Curr Opin Oncol 2011; 23 : 214 – 220.
14. Bryant J, Picot J, Baxter L et al. Use of cardiac markers to assess the toxic effects of anthracyclines given to children with cancer: a systematic review. Eur J Cancer 2007; 43 : 1959 – 1966.
15. Horacek JM, Tichy M, Pudil R et al. Multimarker approach to evaluation of cardiac toxicity during preparative regimen and hematopoietic cell transplantation. Neoplasma 2008; 55 : 532 – 537.
16. Clerico A, Vittorini S, Passino C et al. New and emerging biomarkers of heart failure. Crit Rev Clin Lab Sci 2009; 46 : 107 – 128.
17. Vasile VC, Saenger AK, Kroning JM et al. Biological and analytical variability of a novel high‑sensitivity cardiac troponin T assay. Clin Chem 2010; 56 : 1086 – 1090.
18. Coghlan JG, Handler CE, Kottaridis PD. Cardiac assessment of patients for haematopoietic stem cell transplantation. Best Pract Res Clin Haematol 2007; 20 : 247 – 263.
19. Špirková Z, Daňová K, Pecháň I et al. Kardiomarkery. Bratislava: Phonec Agency 2005.
20. Clerico A, Carlo Zucchelli G, Pilo A et al. Clinical relevance of biological variation: the lesson of brain natriuretic peptide (BNP) and NT ‑ proBNP assay. Clin Chem Lab Med 2006; 44 : 366 – 378.
21. Bálková O. Mezinárodní panel expertů: stanovení NT ‑ proBNP v klinické praxi. Labor Aktuell 2008; 2 : 14 – 21.
22. McMurray JJ, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Eur Heart J 2012; 33 : 1787 – 1847.
23. Carver JR, Shapiro CL, Jacobs L et al. American Society of Clinical Oncology clinical evidence review on the ongoing care of adult cancer survivors: cardiac and pulmonary late effects. J Clin Oncol 2007; 25 : 3991 – 4008.
24. Baggish AL, Van Kimmenade RR, Januzzi JL Jr. The differential diagnosis of an elevated amino‑terminal pro‑B‑type natriuretic peptide level. Am J Cardiol 2008; 101 : 43 – 48.
25. Januzzi JL Jr, Camargo CA, Anwaruddin S et al. The N‑terminal Pro‑BNP investigation of dyspnea in the emergency department (PRIDE) study. Am J Cardiol 2005; 95 : 948 – 954.
26. Januzzi JL, Van Kimmenade R, Lainchbury J et al. NT ‑ proBNP testing for diagnosis and short‑term prognosis in acute destabilized heart failure: an international pooled analysis of 1256 patients: the International Collaborative of NT ‑ proBNP Study. Eur Heart J 2006; 27 : 330 – 337.
27. Snowden JA, Hill GR, Hunt P et al. Assessment of cardiotoxicity during haemopoietic stem cell transplantation with plasma brain natriuretic peptide. Bone Marrow Transplant 2000; 26 : 309 – 313.
28. Niwa N, Watanabe E, Hamaguchi M et al. Early and late elevation of plasma atrial and brain natriuretic peptides in patients after bone marrow transplantation. Ann Hematol 2001; 80 : 460 – 465.
29. Horacek JM, Pudil R, Tichy M et al. Biochemical markers and assessment of cardiotoxicity during preparative regimen and hematopoietic cell transplantation in acute leukemia. Exp Oncol 2007; 29 : 343 – 347.
30. Masuko M, Ito M, Kurasaki T et al. Plasma brain natriuretic peptide during myeloablative stem cell transplantation. Intern Med 2007; 46 : 551 – 555.
31. Zver S, Zadnik V, Bunc M et al. Cardiac toxicity of high‑dose cyclophosphamide in patients with multiple myeloma undergoing autologous hematopoietic stem cell transplantation. Int J Hematol 2007; 85 : 408 – 414.
32. Chung T, Lim WC, Sy R et al. Subacute cardiac toxicity following autologous haematopoietic stem cell transplantation in patients with normal cardiac function. Heart 2008; 94 : 911 – 918.
33. Roziakova L, Bojtarova E, Mistrik M et al. Serial measurements of cardiac biomarkers in patients after allogeneic hematopoietic stem cell transplantation. J Exp Clin Cancer Res 2012; 31 : 13.
34. Sandri MT, Salvatici M, Cardinale D et al. N‑terminal pro‑B‑type natriuretic peptide after high‑dose chemotherapy: a marker predictive of cardiac dysfunction? Clin Chem 2005; 51 : 1405 – 1410.
35. Xun CQ, Thompson JS, Jennings CD et al. Effect of total body irradiation, busulfan ‑ cyclophosphamide, or cyclophosphamide conditioning on inflammatory cytokine release and development of acute and chronic graft ‑ versus ‑ host disease in H ‑ 2 – incompatible transplanted SCID mice. Blood 1994; 83 : 2360 – 2367.
36. Packard RR, Libby P. Inflammation in atherosclerosis: from vascular biology to biomarker discovery and risk prediction. Clin Chem 2008; 54 : 24 – 38.
37. Bujak M, Frangogiannis NG. The role of IL‑1 in the pathogenesis of heart disease. Arch Immunol Ther Exp (Warsz) 2009; 57 : 165 – 176.
38. Roziakova L, Bojtarova E, Mistrik M et al. Abnormal cardiomarkers in leukemia patients treated with allogeneic hematopoietic stem cell transplantation. Bratisl Lek Listy 2012; 113 : 159 – 162.
39. Roziakova L, Bojtarova E, Mistrik M et al. The role of cardiac biomarkers after allogeneic haematopoietic stem cell transplantation: can we predict cardiac dysfunction? Bone Marrow Transplant 2012; 47 (Supl 1): S191.
40. Peres E, Levine JE, Khaled YA et al. Cardiac complications in patients undergoing a reduced ‑ intensity conditioning hematopoietic stem cell transplantation. Bone Marrow Transplant 2010; 45 : 149 – 151.
41. Roziakova L, Mistrik M, Bojtarova E et al. Biochemical markers for early detection and prediction of cardiotoxicity in patients after hematopoietic stem cell transplantation. Haematologica 2012; 97 (Suppl 1): S412.
42. O’Brien PJ. Cardiac troponin is the most effective translational safety biomarker for myocardial injury in cardiotoxicity. Toxicology 2008; 245 : 206 – 218.
43. Cardinale D, Sandri MT, Colombo A et al. Prognostic value of Troponin I in cardiac risk stratification of cancer patients undergoing high‑dose chemotherapy. Circulation 2004; 109 : 2749 – 2754.
44. Auner HW, Tinchon C, Linkesch W et al. Prolonged monitoring of troponin T for the detection of anthracycline cardiotoxicity in adults with hematological malignancies. Ann Hematol 2003; 82 : 218 – 221.
45. Adamcová M, Štěrba M, Šimůnek T et al. Myocardial regulatory proteins and heart failure. Eur J Heart Fail 2006; 8 : 333 – 341.
46. Agewall S, Giannitsis E, Jernberg T et al. Troponin elevations in coronary vs. Non ‑ coronary disease. Eur Heart J 2011; 32 : 404 – 411.
47. Cardinale D, Sandri MT, Martinoni A et al. Left ventricular dysfunction predicted by early troponin l release after high‑dose chemotherapy. J Am Coll Cardiol 2000; 36 : 517 – 521.
48. Cardinale D, Sandri MT, Martinoni A et al. Myocardial injury revealed by plasma troponin I in breast cancer treated with high‑dose chemotherapy. Ann Oncol 2002; 13 : 710 – 715.
49. Sandri MT, Cardinale D, Zorzino L et al. Minor increases in plasma troponin I predict decreased left ventricular ejection fraction after high‑dose chemotherapy. Clin Chem 2003; 49 : 248 – 251.
50. Lipshultz SE, Rifai N, Dalton VM et al. The effect of dexrazoxane on myocardial injury in doxorubicin‑treated children with acute lymphoblastic leukemia. N Engl J Med 2004; 351 : 145 – 153.
51. Kilickap S, Barista I, Akgul E et al. CTnT can be a useful marker for early detection of anthracycline cardiotoxicity. Ann Oncol 2005; 16 : 798 – 804.
52. Auner HW, Tinchon C, Brezinschek RI et al. Monitoring of cardiac function by serum cardiac troponin T levels, ventricular repolarisation indices, and echocardiography after conditioning with fractionated total body irradiation and high‑dose cyclophosphamide. Eur J Haematol 2002; 69 : 1 – 6.
53. Schully R, Lipschultz SE. Cardiovascular toxicity of antitumor drugs: dimensions of the problem in children. In: Minotti G (ed). Cardiotoxicity of non‑cardiovascular drugs. Chichester: Wiley 2010 : 97 – 126.
54. Bovelli D, Plataniotis G, Roila F. Cardiotoxicity of chemoterapeutic agents and radiotherapy‑related heart disease: ESMO Clinical Practice Guidelines. Ann Oncol 2010; 21 (Suppl 5): 277 – 282.
55. Majhail NS, Rizzo JD, Lee SJ. Recommended screening and preventive practices in long‑term survivors after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2012; 18 : 348 – 371.
56. Majhail NS, Rizzo JD Surviving the cure: long term followup of hematopoietic cell transplant recipients. Bone Marrow Transplant 2013; 48 : 1145 – 1151.
57. Carver JR, Szalda D, Ky B. Asymptomatic cardiac toxicity in long term cardiac survivors: defining the populations and recommendations for surveillance. Semin Oncol 2013; 40 : 229 – 238.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 11- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- SAVOR-TIMI 53 – Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Atypická fraktura metatarzální kosti u pacienta s mnohočetným myelomem, který byl dlouhodobě léčen bisfosfonáty
- Úloha biomarkerů v časné diagnostice kardiotoxicity onkologické léčby – editorial
- Kardiální biomarkery – editorial
- Prevalencia diabetickej retinopatie, distálnej symetrickej diabetickej polyneuropatie a screening glomerulárnej filtrácie v čase diagnózy diabetes mellitus 2. typu – kohortná štúdia
- Léčba těžké sepse na pracovištích intenzivní péče v České republice – pilotní výsledky projektu EPOSS
- Nový krevní test biomarkeru SEPT9 a screening kolorektálního karcinomu
- Možnosti genetickej diagnostiky nádorových a zápalových ochorení čriev na Slovensku
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Tyreostatická liečba a jej nežiadúce účinky
- Úloha kardiálnych biomarkerov v monitorovaní kardiotoxicity po transplantácii kmeňových krvotvorných buniek
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Tyreostatická liečba a jej nežiadúce účinky
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



