-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNový krevní test biomarkeru SEPT9 a screening kolorektálního karcinomu
The new blood test biomarker SEPT9 and colorectal carcinoma screening
Due to its high incidence and mortality rates, the colorectal carcinoma represents a crucial medical issue. However, when it is detected in early stage there is high rate of successful treatment. That’s why, early stage cancer screening programmes were introduced into the clinical practice. They focus on the finding of hidden bleeding, using various laboratory techniques, sigmoidoscopy, and, primarily, colonoscopy. However, screening programmes have not yet reached the effect required. New techniques are therefore being developed, such as the detection of blood biomarkers. This group includes also methylated SEPT9 (mSEPT9) detection in blood. We applied this test on 57 patients; we divided the group into two parts. There were 33 asymptomatic individuals in the first group. In this group, we were got only one positive mSEPT9 result. The consequent colonoscopies were negative. The other group had 24 proven carcinomas. Of them, two had negative mSEPT9 results. The remaining in all 22 patients was tested mSEPT9 positive. After its efficiency is tested by further studies, this test may be used especially for patients with low compliance, as it only requires routine blood drawing.
Key words:
colorectal carcinoma – screening programmes – SEPT9
Autoři: Z. Beneš 1; M. Šedivcová 2; Z. Antoš 1; P. Kohout 1; G. Puškárová 1; M. Černík 1; M. Rozmahel 1; M. Shánělová 3; Jiří Dolina 3
; A. Hep 3; M. Trubač 4; J. Stehlík 2; T. Vaněček 2; M. Michal 2; J. Šimša 4; Z. Kala 5
Působiště autorů: Interní oddělení Thomayerovy nemocnice Praha, přednosta doc. MU Dr. Zdeněk Beneš, CSc. 1; Bioptická laboratoř s. r. o., Plzeň, vedoucí pracoviště prof. MU Dr. Alena Skálová, CSc. 2; Interní gastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Aleš Hep, CSc. 3; Chirurgická klinika Thomayerovy nemocnice a 1. lékařské fakulty UK Praha, přednosta doc. MU Dr. Jaromír Šimša, CSc. 4; Chirurgická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Zdeněk Kala, CSc. 5
Vyšlo v časopise: Vnitř Lék 2013; 59(11): 971-976
Kategorie: Původní práce
Souhrn
Kolorektální karcinom představuje svou vysokou incidencí a mortalitou veliký medicínský problém. Přitom je prevencí velmi dobře ovlivnitelný. Je nutné detekovat časná stadia tohoto nádoru ke snížení úmrtnosti na tuto neoplazii. O to se snaží screeningové programy. Ty se opírají hlavně o záchyt skrytého krvácení pomocí různých laboratorních technik, sigmoideoskopii a hlavně kolonoskopii. Nicméně screeningové programy zatím nedosahují požadované účinnosti. Proto se vyvíjejí nové techniky, jako jsou např. detekce krevních biomarkerů. Do této skupiny patří detekce SEPT9 v krvi. Pomocí tohoto testu jsme vyšetřili 57 pacientů. Rozdělili jsme skupinu do 2 částí, v jedné bylo 33 asymptomatických jedinců. V této skupině jsme zachytili jenom 1 SEPT9 pozitivní výsledek, přičemž následné kolonoskopie byly vždy negativní. V další skupině bylo 24 prokázaných karcinomů a u 2 byl SEPT9 negativní výsledek. U dalších 22 pacientů byl výsledek na SEPT9 pozitivní. Test se v budoucnu, po ověření jeho účinnosti dalšími studiemi, může použít zvláště u jedinců s malou compliencí. Pro nemocného totiž vyžaduje pouze rutinní krevní odběr.
Klíčová slova:
kolorektální karcinom – screeningové programy – SEPT9Úvod
Kolorektální karcinom (KRK) představuje velmi častý maligní nádor s vysokou incidencí a mortalitou. V USA bylo zaznamenáno v roce 2008 přibližně 150 000 nových nádorů a na toto onemocnění zde zemře asi 50 000 pacientů ročně. V Evropě se ročně vyskytuje onemocnění KRK u více než 413 000 nemocných, z nichž 207 000 zemře [1]. ČR patří dlouhodobě mezi země s největším výskytem této malignity. Incidence představuje 94,4 nových případů na 100 000 obyvatel u mužů a 46 u žen. V posledních letech se tak zachytí ročně přibližně více než 8 000 nových případů KRK a 4 000 pacientů na toto onemocnění v průběhu roku zemřou [2].
Kolorektální karcinom má ve svých pozdějších stadiích velmi špatnou prognózu. Pokud se jej však podaří zachytit časně, je velmi dobře ovlivnitelný a léčitelný. Pokusem o časný záchyt tohoto nádorového onemocnění v populaci bylo zavedení celostátního dvouetapového programu screeningu sporadického KRK. Tento program je založen na detekci okultního krvácení ve stolici (FOBT) u asymptomatických jedinců nad 50 let, kdy při jeho pozitivitě následuje kolonoskopie. Na detekci okultního krvácení se nyní prosazují modernější kvantitativní imunochemické testy. Bezpříznakový jedinec nad 55 let však může podstoupit primární screeningovou kolonoskopii (provedenou bez předchozího testu FOBT), která se může opakovat za 10 let.
Celosvětově jsou v detekčních programech zaváděny do praxe různé postupy – vedle FOBT testů jsou to flexibilní sigmoideoskopie, kolonoskopie, CT kolografie apod. Nicméně tyto programy mají svá úskalí a mnohdy nevedou k očekávanému snížení mortality. Z tohoto důvodu vyvstala potřeba zavést do klinické praxe nové metody, které jsou schopny zachytit KRK i ve velmi časném stadiu. Mezi nové, v tomto směru perspektivní postupy, patří detekce molekulárních biomarkerů v krvi pacienta [3 – 5].
Jedním z takovýchto biomarkerů mohou být volně cirkulující nukleové kyseliny (cfDNA), jejichž zvýšená hladina byla pozorována např. u pacientů s chronickými záněty, autoimunitním onemocněním, benigními lézemi i maligní progresí [6]. Předpokládá se, že uvolňování nádorové DNA do krve úzce souvisí především s procesem apoptózy, popř. nekrózy nádorových buněk cirkulujících v krevním řečišti. Hladina volně cirkulující DNA (cfDNA) uvolněná z nádorových buněk závisí na typu a velikosti nádoru, rychlosti jejího odbourávání z krve a dalších fyziologických procesech organizmu. Onkologičtí pacienti tak mají obecně vyšší úroveň cfDNA než zdraví jedinci. Protože se však hodnoty její koncentrace u obou těchto skupin částečně překrývají [7,8], kvantifikace celkové volně cirkulující nukleové kyseliny v krvi není dostatečně průkaznou metodou diagnostiky nádorového onemocnění. Díky pokrokům v molekulární biologii byly ale objeveny a otestovány markery, které mají signifikantně rozdílné hladiny u populace zdravých a onkologických pacientů a které lze využít pro časný screening vzniku nádorového onemocnění (zejména u asymptomatických jedinců), nebo pro prognózu či sledování účinnosti protinádorové léčby. Těmito markery jsou v současné době především aberantně metylované geny, které lze detekovat s vysokou specificitou a senzitivitou (obr. 1) [9,10].
Obr. 1. Epigenetické změny SEPT9 v krvi. 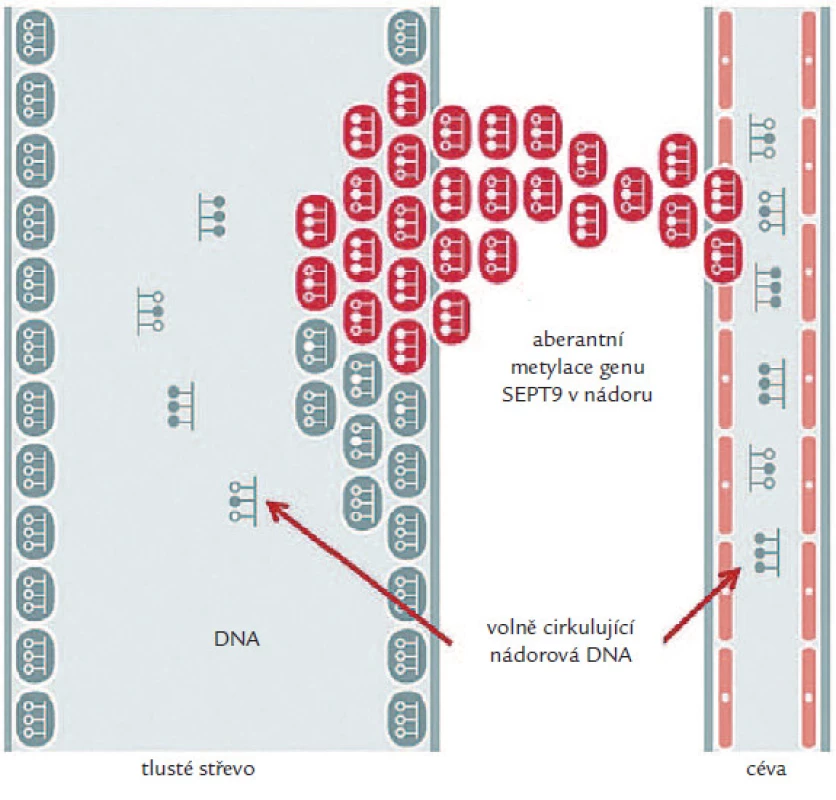
Metylací savčí DNA se rozumí navázání metylové skupiny ( – CH3) na 5‘ uhlík baze cytozin [11]. V somatických buňkách se takováto metylace vyskytuje v CpG dinukleotidech. Tento epigenetický proces (tj. nejedná se o změny v sekvenci DNA) je přirozený jev, který je nepostradatelný v řadě důležitých procesů, jako jsou např. genetický imprinting, inaktivace chromozomu X, stabilita chromozomů, transkripce genů a zachování buněčné homeostázy [12]. Část CpG dinukleotidů však zůstává nemetylovaná a tvoří tzv. CpG ostrůvky, které jsou umístěny v promotorové (regulační) oblasti genů [13]. Případná aberantní metylace těchto oblastí znemožní nasednutí transkripčních faktorů na promotor, což vede k inhibici transkripce příslušných genů. Tato inhibice exprese pak může přispět ke vzniku a progresi nádorového onemocnění.
K detekci metylované DNA lze využít řadu technik. Jednou z nejpoužívanějších metod stanovení metylovaných CpG je metylačně specifická PCR a její varianty [14]. U této metody se využívá konverze DNA hydrogensiřičitanem sodným (Sodium bisulfite, v textu dále bisulfit sodný), při které se nemetylované cytoziny deaminují na uracily, jež se v následných fázích testu chovají jako klasická baze DNA thymin, a párují se tak s adeniny. Metylované cytoziny zůstávají nezměněné a při vlastní detekční reakci se dle klasických zákonitostí molekulární genetiky párují s guaniny (obr. 2). Následuje vlastní PCR se specifickými primery (popř., v její variantě, s komplementárními próbami), které jsou schopné rozlišit metylovanou a nemetylovanou sekvenci v bisulfiticky konvertované DNA. Další často používanou metodou je štěpení DNA metylačně senzitivními restrikčními enzymy. Tohoto štěpení se využívá např. při tzv. „methylation specific multiplex ligation ‑ dependent probe amplification“ testu (MS ‑ MLPA) [15]. Méně používané metody jsou např. COBRA (combined bisulfite restriction analysis) [16], BGS (bisulfite genomic sequencing) [17], pyrosekvenování a metody PCR založené na detekci denaturovaných sekvencí prostřednictvím fluorescence, např. MethyLight [18] nebo HeavyMethyl, popř. kvantitativní analýza denaturovaných alel (QAMA) [19].
Obr. 2. Změny v nukleotidové sekvenci po konverzi bisulfitem sodným/změna nemetylovaného cytozinu na uracil a jeho párování s adeninem a zachování párování u metylovaného cytozinus guaninem. 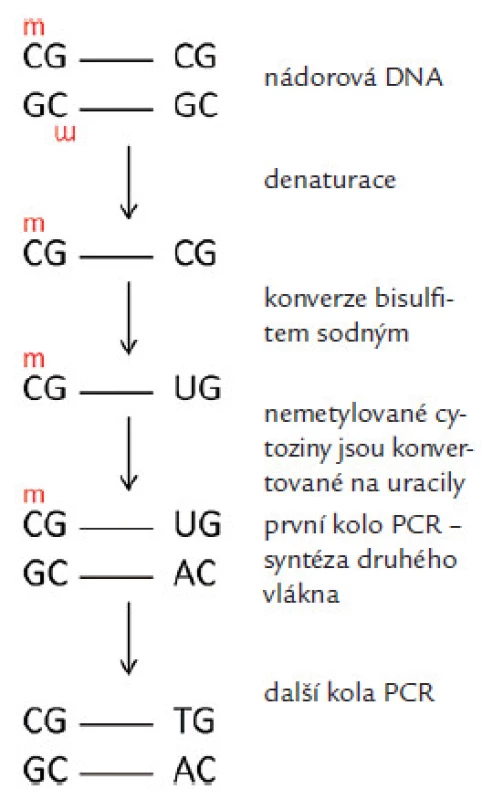
V naší studii se zabýváme detekcí aberantně metylovaného genu SEPT9 (septin 9), jehož výskyt v krevní plazmě koreluje s výskytem KRK [20,21]. Gen SEPT9 je lokalizovaný na dlouhém raménku chromozomu 17 (17q25), kóduje protein septin 9, který je součástí skupiny bílkovin zvaných septiny. SEPT9 je zapojen především do procesů cytokineze, apoptózy a regulace růstu buněk. Detekce metylovaného SEPT9 (mSEPT9) v krvi má dle dosavadních studií vysoké potenciální využití, zejména kvůli přítomnosti mSEPT9 v krvi ve všech fázích KRK nezávisle na jeho lokalizaci (obr. 3) [20,22 – 26].
Obr. 3. Schematické znázornění laboratorních kroků u vyšetření SEPT9. 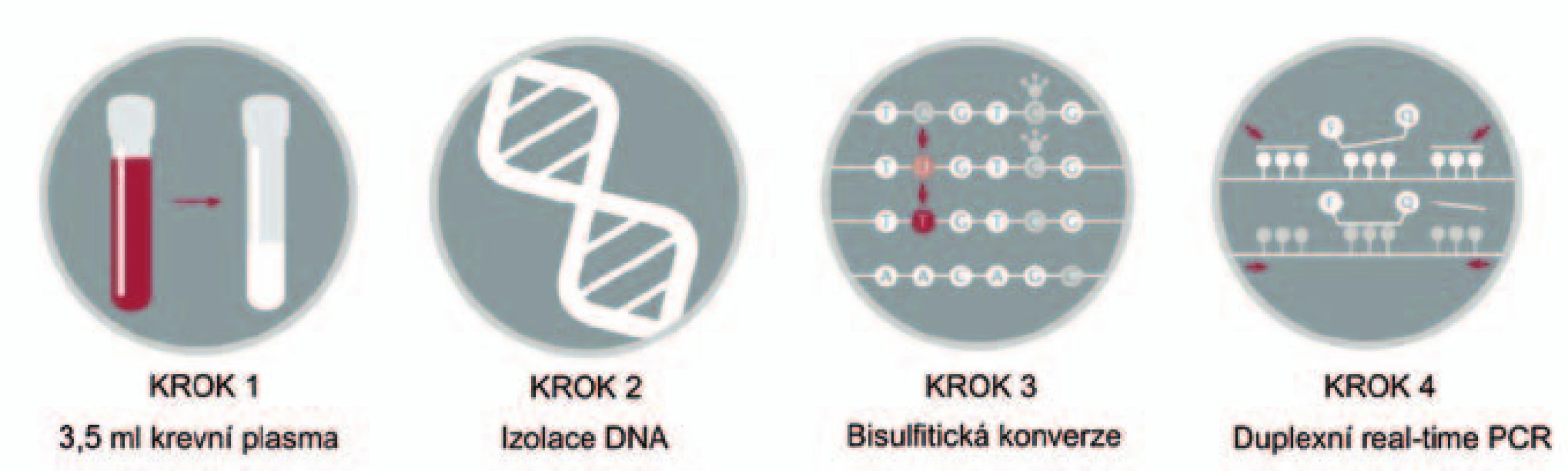
Materiál a metody
Materiál
Do studie jsme zahrnuli celkem 65 pacientů průměrného věku 62 let, 49 mužů a 16 žen. Z toho jsme pro hemolýzu vzorku krve vyřadili 8 jedinců. Do vlastní sestavy bylo tedy posléze zařazeno 57 jedinců.
Metody
Zpracování krve: Vzorky periferní krve byly odebrané do odběrových zkumavek Vacutainer® EDTA Tube (Becton Dickinson) a centrifugované při 1 350 ± 150 g po dobu 12 min. Veškerá získaná plazma byla přenesena pipetou do 15 ml centrifugační zkumavky a opět centrifugovaná při 1 350 ± 150 g po dobu 12 min. Z horní části vzorku bylo přeneseno 3,5 ml plazmy do nové 15 ml zkumavky a tento vzorek byl zamražen při – 20 °C (maximálně 1 měsíc). Hemolytické vzorky byly z analýzy vyřazeny.
Detekce metylace SEPT9
Princip: K detekci aberantně metylované DNA genu SEPT9 byla použita diagnostická souprava Epi proColon 2.0 CE (Epigenomics AG, Germany), která umožňuje detekovat výskyt kolorektálního karcinomu z krevní plazmy i v časné fázi onemocnění. Na rozdíl od testů okultního krvácení ve stolici výrobce uvádí vyšší citlivost a nezávislost na lokalizaci karcinomu. Uváděná analytická specificita testu je 91 %, senzitivita 80 %; klinická specificita 99 %, senzitivita 72 – 87 %. Prvním krokem tohoto testu je extrakce DNA z plazmy a konverze bisulfitem sodným, následuje detekce DNA sekvence obsahující metylovaná CpG místa genu SEPT9 pomocí metody real ‑ time PCR (obr. 4). V reakci jsou použity sondy a blokátory, které rozlišují metylované a nemetylované sekvence DNA. Test dále sestává z primerů, které jsou umístěné v oblastech bez CpG dinukleotidů. Přítomné specifické blokátory pro bisulfitem konvertované nemetylované sekvence umožňují přednostní amplifikaci metylovaných sekvencí genu SEPT9. Pro jejich identifikaci jsou v reakci použité specifické detekční próby. Test zahrnuje soupravu pro extrakci a bisulfitickou konverzi DNA (Epi proColon Plasma Quick Kit), real ‑ time PCR (Epi proColon Sensitive PCR Kit) a kontrolní DNA (Epi proColon Control Kit).
Postup: Jedna pozitivní a jedna negativní kontrolní DNA (Epi proColon Control Kit) a analyzované vzorky plazmy byly vytemperovány na pokojovou teplotu 0,5 hod před začátkem izolace DNA. Obě kontrolní DNA byly použity vždy současně s analyzovanými vzorky. Izolace DNA, bisulfitická konverze a real ‑ time PCR byly provedeny v jeden den a dle manuálu výrobce. Real ‑ time PCR byla provedena u všech vzorků a kontrol v triplikátu v přístroji LightCycler 480 Instrument II (Roche Diagnostics, Switzerland). Vlastní real ‑ time PCR se skládala z několika kroků: 1. denaturace: 94 °C/ 20 min, 2. amplifikace: 50 cyklů (62 °C/ 5 s, 56 °C/ 35 s – měření fluorescence, 93 °C/ 30 s) a 3. chlazení: 40 °C/ 30 s; reakční objem byl 30 µl.
Analýza dat real ‑ time PCR: Všechny parametry analýzy byly nastaveny dle manuálu výrobce. Pro amplifikaci byl použit detekční systém formát Dual Color Hydrolysis Probe/ UPL Probe, kombinace filtrů 465 – 510 nm pro gen SEPT9 a 533 – 580 nm pro kontrolní gen ACTB (actin, b). Byla odečtena hodnota CP („crossing point“) každé PCR reakce a pro analýzu byla použita metoda Abs Quant/ Fit Points. Hodnota CP představuje číslo cyklu PCR, při kterém narůstající fluorescence PCR produktu v reakci překročila hodnotu 2 (stanovena výrobcem). Získané CP hodnoty byly uznány jako validní, pokud nepřekročily meze stanovené výrobcem. U pozitivních kontrol byla tato mez 40,5 pro gen SEPT9 a 30,3 pro gen ACTB. U negativních kontrol byla tato mez 37,1 pro gen ACTB, zatímco v reakci detekující gen SEPT9 nesmí vzniknout žádný produkt. U analyzovaných vzorků byla pro gen ACTB stanovena mez 33,7. Následně byl hodnocen gen SEPT9 u analyzovaných vzorků (obr. 4). Vzorek byl označen za pozitivní, pokud hodnota jeho CP byla < 50. Výsledek vyšetření byl hodnocen jako pozitivní, pokud nejméně 2 ze 3 vzorků triplikátu byly hodnoceny jako pozitivní. Aplikace tohoto modelu vede ke zvýšení specifity. Výsledek byl hodnocen jako negativní s poznámkou snížené specificity testu, pokud 1 ze 3 vzorků triplikátu byl analyzován jako pozitivní. Výsledek byl hodnocen jako negativní, pokud všechny vzorky triplikátu byly analyzovány jako negativní.
Obr. 4. Analýza genu SEPT9: dva amplifikované vzorky, pozitivní a negativní kontrola. 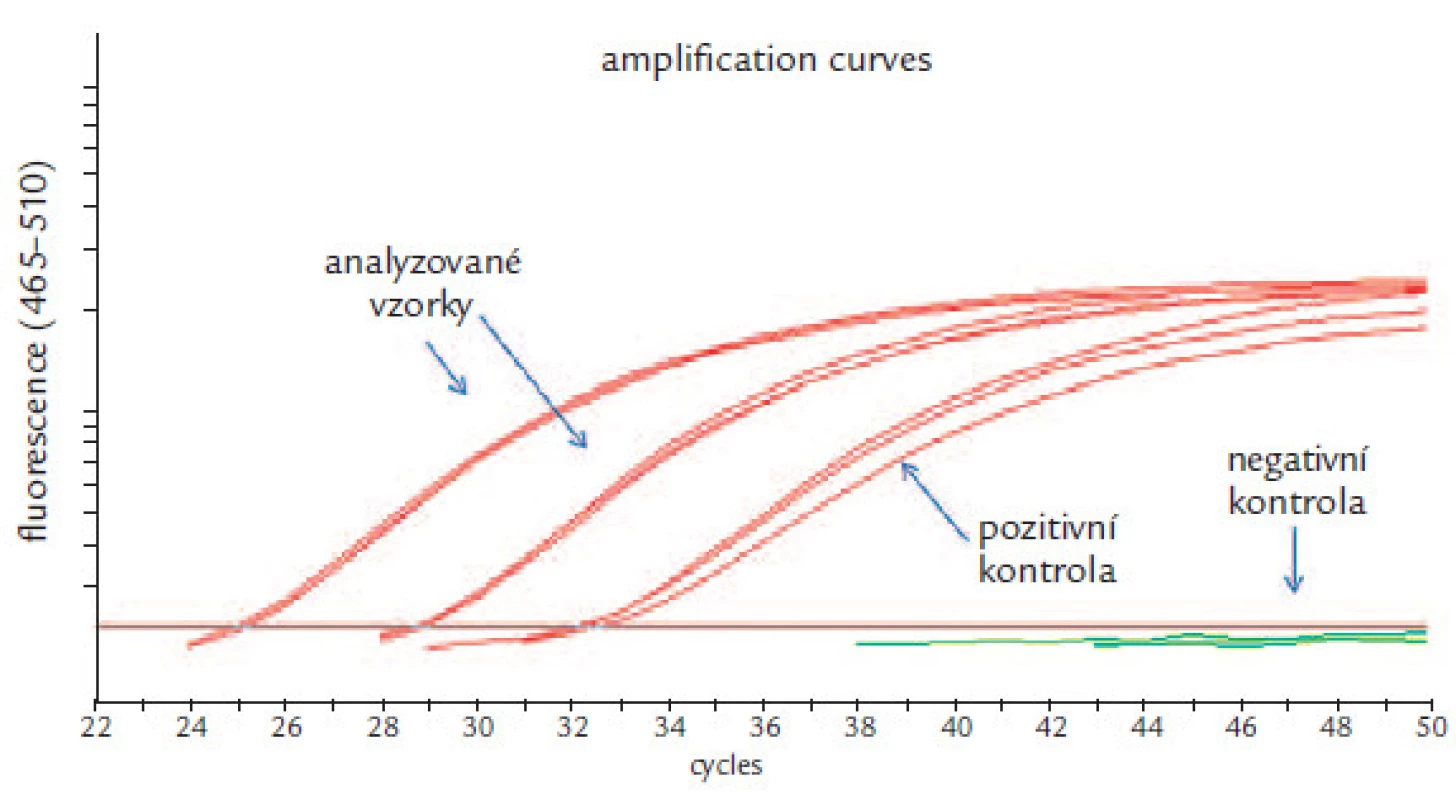
Výsledky
V letech 2011 a 2012 jsme vyšetřili pomocí testu Epi proColon 2.0 CE (Epigenomics AG, Germany) celkem 57 jedinců. Tuto skupinu jsme rozdělili na 2 části. U 33 asymptomatických pacientů jsme provedli testování krve na mSEPT9 a následně jsme u nich provedli kolonoskopické vyšetření. Druhá část představovala skupinu 24 pacientů, u kterých již byl verifikován kolorektální adenokarcinom. Tyto nemocné jsme pak vyšetřili testem na mSEPT9 k potvrzení diagnózy.
U souboru asymptomatických jedinců jsme v 33 pozorováních zaznamenali 1 pozitivní výsledek na přítomnost mSEPT9. Tento pacient měl pozitivní 2 ze 3 měření. V následných totálních kolonoskopiích jsme však u žádného z pacientů kolorektální karcinom nezachytili.
Ve druhé skupině 24 adenokarcinomů byl výsledek detekce mSEPT9 pozitivní v 22 případech. U 2 zbývajících pacientů byl vždy 1 vzorek z triplikátu pozitivní. V souladu s výše zmíněnými kritérii však byli pacienti určeni jako negativní na přítomnost mSEPT9. U těchto 2 falešně negativních výsledků šlo o časný karcinom umístěný v oblasti colon transversum. Výsledky obou skupin jsou sumarizovány v tab. 1 a 2.
Tab. 1. Asymptomatičtí jedinci. 
Tab. 2. Nemocní s kolorektálním karcinomem. 
Diskuze a závěr
Vzhledem k častému výskytu KRK se stále hledají cesty, jak detekovat tuto neoplazii v různých screeningových programech pokud možno v co nejčasnějším stadiu rozvoje onemocnění. Nejčastěji je užíván FOBT, a to pomocí různých laboratorních technik. Nicméně tato testování nepřinášejí očekávané významné snížení morbidity a zejména mortality. Také spolupráce pacientů a praktických lékařů a gynekologů s gastroenterology má ještě určité rezervy. Kupříkladu v Německu je compliance s FOBT testováním 20 % a v USA dokonce jenom 13 % [1]. V ČR se také provádí testování s quajakulovým či imunochemickým FOBT testem a pokrytí populace nad 50 let bylo v roce 2010 pouze 22,7 % [27]. Testování na FOBT není organizačně jednoduché a testování z krve by mohlo být pro populaci přijatelnější než manipulace se stolicí.
Pro tyto ne zcela přesvědčivé výsledky se hledají cesty k zlepšování záchytu KRK. Z krevních testů se pak právě detekce metylace genu SEPT9 v krevní plazmě zdá být velmi nadějnou. V naší klinické praxi jsme k detekci tohoto markeru použili soupravu Epi proColon 2.0 kit.
Dosud publikované výsledky testování mSEPT9 pomocí Epi proColon kitu jsou dosud poměrně rozdílné zejména s ohledem na nehomogenní sestavy a použitou generaci kitu. Další míru heterogenity vnáší do výsledků také rozdílný přístup k vyhodnocování dat. Zatímco někteří autoři hodnotí jako pozitivní pacienty s jednou pozitivní reakcí v triplikátu, jiní hodnotí jako pozitivní pacienty, u nichž proběhla amplifikace mSEPT genu nejméně ve 2 reakcích z triplikátu. Tyto rozdílné přístupy pak pochopitelně ovlivňují klinickou specificitu a senzitivitu analýz [1,28]. Obecně se však klinická senzitivita u KRK v závislosti na stadiu pohybuje v rozmezí 70 – 95 % při specificitě nad 90 %, což je v souladu s našimi výsledky. Určité úskalí u tohoto testu sice představuje detekce střevních polypů (v současné době se provádějí testy mSEPT9 v tkáni pokročilého adenomu a pozitivita mSEPT9 v jeho tkáni je 100 % a v plazmě 75 %) [22,28], nicméně ani testy na okultní krvácení nejsou zcela dokonalé a jejich úspěšnost je také podmíněna krvácivými projevy polypů, které jsou často intermitentní.
Z výše uvedeného tedy vyplývá, že tyto testy mohou být vhodnou alternativou ostatních screeningových programů, kde zásadní roli má rozšiřování a dostupnost kolonoskopického vyšetření. Zásadní výhodou tohoto testu je pak zejména skutečnost, že nemocní nemusejí držet speciální dietu a u noncompliantních osob lze tedy oprávněně očekávat zvýšení záchytu onemocnění v časném stadiu choroby. Obdobně jako u ostatních testů je pak z pochopitelných důvodů vhodné test opakovat 1krát za 1 – 2 roky (obr. 5).
Obr. 5. Navrhovaný postup detekce KRK pomocí SEPT9. 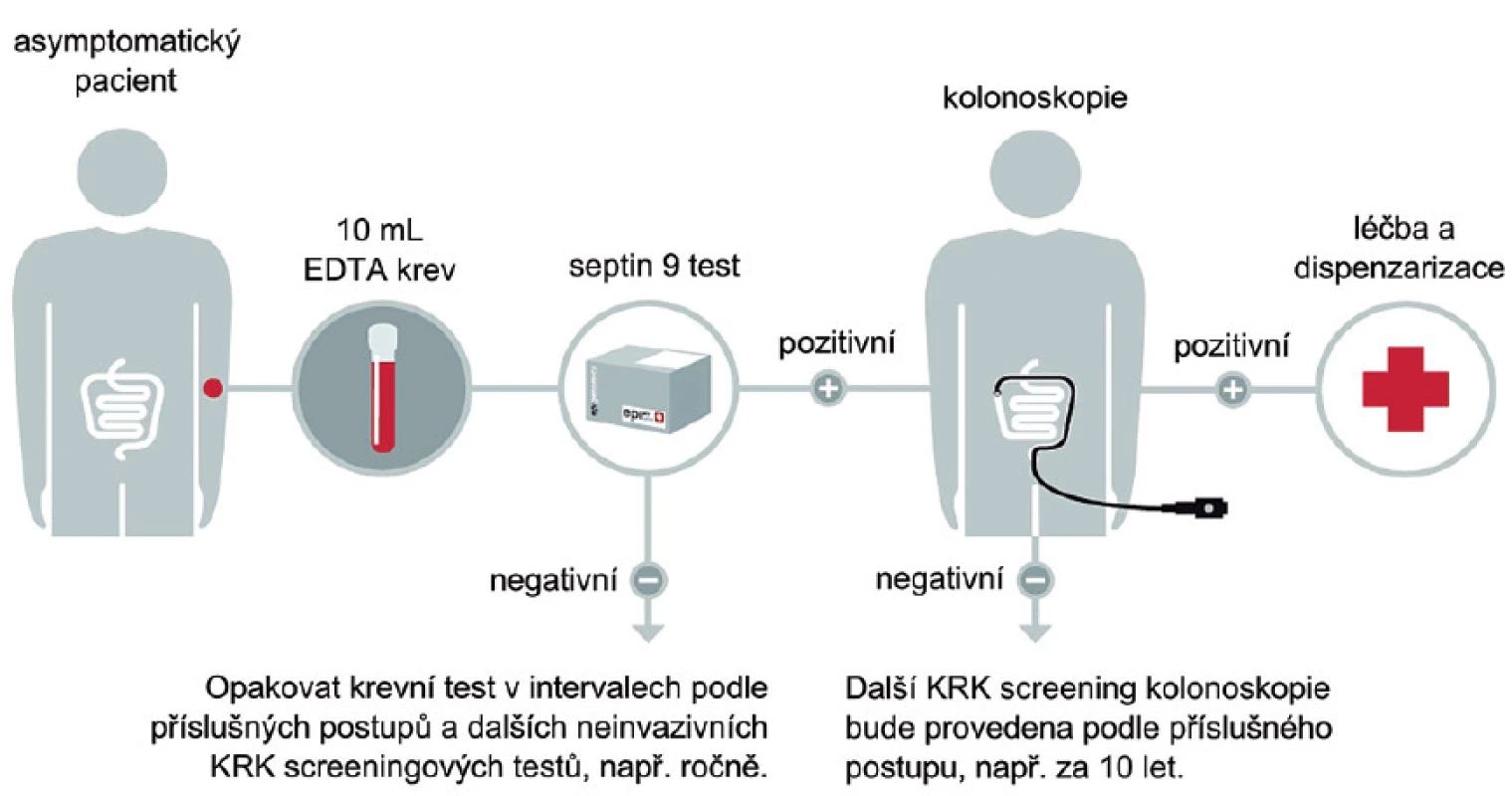
V detekci tak závažného onkologického onemocnění, jaké představuje KRK, je nutné hledat další alternativní postupy, jak toto onemocnění zachytit co nejdříve. Vyšetření markeru mSEPT9 přináší další variantu, zvláště u špatně spolupracujících pacientů. Bude však nutné provedení dalších kontrolovaných studií, které jako u každého nově zavedeného diagnostického postupu přesněji zhodnotí všechny jeho klady a zápory.
doc. MU Dr. Zdeněk Beneš, CSc.
www.ftn.cz
e‑mail: zdenek.benes@ftn.cz
Doručeno do redakce: 17. 6. 2013
Přijato po recenzi: 17. 8. 2013
Zdroje
1. Weiss G, Rösch T. Potential of new Blood Test for Colorectal Cancer S ‑ The Septin 9 Gene Biomarker. Eur Oncol 2010; 6 : 51 – 54.
2. Dušek L, Mužík J, Hájek O et al. Kolorektální karcinom v ČR – data minulá a budoucí. Rozhl chir 2012; 91 : 39 – 43.
3. Schekenburger M, Dietrich M. Epigenetics Offer New Horizons for Colorectal Cancer Prevention. Curr Colorectal Cancer Rep 2012; 8 : 66 – 61.
4. Kim MS, Lee J, Sidarsky D. DNA methylation markers colorectal cancer. Cancer Metastasis Rev 2010; 29 : 181 – 206.
5. Grutzmann R, Molnar B, Pilarsky Ch et al. Sensitive Detection of Colorectal Cancer in Peripheral Blood by Septin 9 DNA Methylation Assay. PLoS ONE 2008; 3: e3759.
6. Shapiro B, Chakrabarty M, Cohn EM et al. Determination of circulating DNA levels in patients with benign or malignit gastrointestinal disease. Cancer 1983; 51 : 2116 – 2120.
7. Kamat AA, Baldwin M, Urbauer D et al. Plasma cell‑free DNA in ovarian cancer: an independent prognostic biomarker. Cancer 2010; 116 : 1918 – 1925.
8. Gormally E, Hainaut P, Caboux E et al. Amount of DNA in plasma and cancer risk: a prospective study. Int J Cancer 2004; 111 : 746 – 749.
9. Diehl F, Li M, Dressman D et al. Detection and quantification of mutations in the plasma of patients with colorectal tumors. Proc Natl Acad Sci USA 2005; 102 : 16368 – 16373.
10. Herrera LJ, Raja S, Gooding WE et al. Quantitative analysis of circulating plasma DNA as a tumormarker in thoracic malignancies. Clin Chem 2005; 51 : 113 – 118.
11. Robertson KD. DNA methylation and chromatin: Unraveling the tangled web. Oncogene 2002; 21 : 5361 – 5379.
12. Szyf M. Targeting DNA methylation in cancer. Ageing Res Rev 2003; 2 : 299 – 328.
13. Herman JG, Baylin SB. Gene silencing in cancer in association with promoter hypermetylation. N Engl J Med 2003; 349 : 2042 – 2054.
14. Ku JL, Jeon YK, Park JG. Methylation ‑ specific PCR. Methods Mol Biol 2011; 791 : 23 – 32.
15. Nygren AO, Ameziane N, Duarte HM et al. Methylation ‑ Specific MLPA (MS ‑ MLPA): simultaneous detection of CpG methylation and copy number changes of up to 40 sequences. Nucleic Acids Res 2005; 33: e128.
16. Eads CA, Laird PW. Combined bisulfite restriction analysis (COBRA). Methods Mol Biol 2002; 200 : 71 – 85.
17. Li Y, Tollefsbol TO. DNA methylation detection: bisulfite genomic sequencing analysis. Methods Mol Biol 2011; 791 : 11 – 21.
18. Eads CA, Danenberg KD, Kawakami K et al. MethyLight: a high‑throughput assay to measure DNA methylation. Nucleic Acids Res 2000; 28: E32.
19. Zeschnigk M, Bohringer S, Price EA et al. A novel real ‑ time PCR assay for quantitative analysis of methylated alleles (QAMA): analysis of the retinoblastoma locus. Nucleic Acids Res 2004; 32: E125.
20. Lofton ‑ Day C, Model F, deVos T et al. DNA Metylation Biomarkers for Blood ‑ Based Colorectal Cancer Screening. Clin Chem 2008; 54 : 414 – 423.
21. Li XQ, Guo YY, Wei D. DNA methylation and microRNAs in cancer. World J Gastroenterol 2012; 18 : 882 – 888.
22. deVos T, Tetzner R, Model F et al. Circulating Metylated SEPT9 DNA in Plasma Is a Biomarker for Colorectal Cancer. Clin Chem 2009; 55 : 1337 – 1346.
23. Grützmann R, Molnar B, Pilarsky C et al. Sensitive detection of colorectal cancer in peripheral blood by septin 9 DNA methylation assay. PLoS ONE 2008; 3: e3759.
24. Warren JD, Xiong W, Bunker AM et al. Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer. BMC Med 2011; 14 : 133.
25. Tóth K, Sipos F, Kalmár A et al. Detection of Methylated SEPT9 in Plasma Is a Reliable Screening Method for Both Left ‑ and Right ‑ Sided Colon Cancers. PLoS ONE 2012; 7: e46000.
26. Lofton ‑ Day C, Model F, De Vos T et al. DNA ‑ -Methylation Biomarkers for ‑ Based Colorectal Cancer Screening. Clin Chem 2008; 54 : 1 – 10.
27. Zavoral M, Frič P. Národní program screeningu sporadického kolorektálního karcinomu (KR ‑ CA): Vývoj, současnost, perspektiva. Zdravotnické noviny, Lékařské listy 28.1.2013.
28. Tóth K, Galamb O, Spisák S et al. The influence of methylated septin 9 gene on RNA and protein level in colorectal cancer. Pathol Oncol Res 2011; 17 : 503 – 509.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 11- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- SAVOR-TIMI 53 – Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Atypická fraktura metatarzální kosti u pacienta s mnohočetným myelomem, který byl dlouhodobě léčen bisfosfonáty
- Úloha biomarkerů v časné diagnostice kardiotoxicity onkologické léčby – editorial
- Kardiální biomarkery – editorial
- Prevalencia diabetickej retinopatie, distálnej symetrickej diabetickej polyneuropatie a screening glomerulárnej filtrácie v čase diagnózy diabetes mellitus 2. typu – kohortná štúdia
- Léčba těžké sepse na pracovištích intenzivní péče v České republice – pilotní výsledky projektu EPOSS
- Nový krevní test biomarkeru SEPT9 a screening kolorektálního karcinomu
- Možnosti genetickej diagnostiky nádorových a zápalových ochorení čriev na Slovensku
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Tyreostatická liečba a jej nežiadúce účinky
- Úloha kardiálnych biomarkerov v monitorovaní kardiotoxicity po transplantácii kmeňových krvotvorných buniek
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Tyreostatická liečba a jej nežiadúce účinky
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



