-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaStratifikace rizika u pacientů s Brugada syndromem
Risk stratification in patients with Brugada syndrome
Brugada syndrome (BrS), one of the most frequently diagnosed inherited arrhythmogenic syndromes, is responsible for more than 4% of all sudden deaths and at least 20% of sudden deaths in patients with structurally normal hearts. The sudden death is often the first symptom of BrS and appears most often already during the fourth decade of life of BrS patients. Implantation of cardioverter--defibrillator was proved to be the only effective treatment, i.e. prevention of the sudden death, in BrS. Thus, it is uniquely determined to be used in case of symptomatic BrS patients. On the contrary, the individual risk of life-threathening arrhythmias has to be thoroughly considered in case of asymptomatic BrS patients due to substantial side effects of implantation of cardioverter-defibrillator. This review first provides a summary of factors recommended for the risk stratification in BrS patients in 2005 including their support or rejection in the following studies. Subsequently, we focused on the most important risk factors newly suggested after 2005.
Key words:
Brugada syndrome – sudden death – risk stratification – risk factors – prognosis
Autoři: M. Bébarová 1; P. Lokaj 1,2
Působiště autorů: Fyziologický ústav Lékařské fakulty MU Brno, přednostka prof. MUDr. Nataša Honzíková, CSc. 1; Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 2
Vyšlo v časopise: Vnitř Lék 2012; 58(4): 280-285
Kategorie: Přehledné referáty
Souhrn
Brugada syndrom (BrS) coby jeden z nejčastěji diagnostikovaných geneticky podmíněných arytmogenních syndromů je zodpovědný za více než 4 % všech případů náhlé smrti a až za 20 % případů náhlé smrti u pacientů bez strukturálního poškození srdce. Náhlá smrt je často prvním příznakem tohoto onemocnění a nastává nejčastěji již ve 4. dekádě života pacientů s BrS. Jedinou prokazatelně účinnou metodou léčby BrS, např. prevence náhlé srdeční smrti, je implantace kardioverteru-defibrilátoru. Ta je jednoznačně metodou volby u symptomatických pacientů. Oproti tomu u asymptomatických pacientů je vzhledem k možným významným nežádoucím účinkům implantace kardioverteru-defibrilátoru nutné individuálně důkladně zvážit riziko vzniku život ohrožujících arytmií, tedy provést stratifikaci rizika. Tato přehledová práce podává přehled rizikových faktorů doporučených pro stratifikaci rizika u pacientů s BrS v roce 2005, a to včetně jejich podpory či odmítnutí ve studiích publikovaných v následujících letech. Dále jsme se zaměřili na výčet hlavních rizikových faktorů nově navržených po roce 2005.
Klíčová slova:
Brugada syndrom – náhlá smrt – stratifikace rizika – rizikové faktory – prognózaÚvod
Geneticky podmíněné syndromy vyznačující se poruchami elektrické činnosti srdce včetně život ohrožujících arytmií dnes představují neopominutelnou součást kardiologie. Vedle syndromu dlouhého intervalu QT je jedním z nejčastěji diagnostikovaných tzv. Brugada syndrom (BrS), který byl poprvé popsán v roce 1992 bratry Pedrem a Josepem Brugadovými [1]. Je definován jako primární porucha elektrické srdeční činnosti projevující se typickým elektrokardiografickým (EKG) obrazem, který se vyznačuje elevací úseku ST v pravém prekordiu. BrS je zodpovědný za více než 4 % všech případů náhlé srdeční smrti (NSS) a až za 20 % případů NSS u pacientů bez strukturálního poškození srdce [2]. NSS bývá přitom poměrně často prvním příznakem tohoto onemocnění [3]. Na druhé straně, implantace kardioverteru-defibrilátoru (ICD), která je u pacientů s BrS doposud jedinou prokazatelně účinnou prevencí NSS [4,5], s sebou nese nepříjemné vedlejší účinky zahrnující např. riziko infekční endokarditidy a perforace srdce [6] či neadekvátní výboje u tachykardií se širokým QRS [7–9]. Toto je zvláště alarmující vzhledem k tomu, že k NSS dochází u pacientů s BrS v poměrně nízkém věku, nejčastěji v období 4. dekády života [10], a pacienti tedy prožívají s ICD značnou část života. Po stanovení diagnózy BrS u doposud asymptomatického pacienta hraje proto zásadní roli zodpovědné posouzení rizika vzniku život ohrožujících arytmií, tzv. stratifikace rizika, u tohoto jedince. V české literatuře byla problematika BrS několikrát zpracována [11,12]. Zcela nedávno byla publikována práce, v níž jsem podala aktualizovaný přehled klinických a patofyziologických aspektů BrS [13], avšak s opominutím oblasti týkající se právě stratifikace rizika u pacientů s BrS. Tomuto významnému tématu je samostatně věnována tato přehledová práce.
Postup doporučený pro stratifikaci rizika u pacientů s BrS v roce 2005 a jeho podpora či zpochybnění v pozdějších pracích
V roce 2005 byla publikována rozsáhlá studie zpracovaná kolektivem Antzelevitch et al [2] představující souhrnnou zprávu z 2. konference podporované americkou Heart Rhythm Society a její evropskou obdobou European Heart Rhythm Association. Tato konference byla uspořádána v září roku 2003 za účelem dosažení jednotného aktuálního pohledu na diagnostiku, stratifikaci rizika a léčbu u pacientů s BrS, a to na základě dostupných dat z klinického i základního výzkumu. Z pokynů obsažených v tomto dokumentu lze vycházet při posuzování rizika vzniku život ohrožujících (neboli maligních) arytmií (komorová tachykardie, fibrilace komor), např. rizika NSS, u pacientů s BrS.
Jak ukazuje obr. 1, pacienty s BrS je možné rozdělit na 2 základní podskupiny. Jednak se jedná o pacienty symptomatické – ať už po prodělané příhodě NSS, ze které byli úspěšně resuscitováni, či s méně závažnými klinickými příznaky typu synkopy, u kterých však byla vyloučena nekardiální příčina – a pak o pacienty asymptomatické. V případě diagnózy BrS u symptomatického pacienta je, jak již bylo zmíněno, jediným prokazatelně efektivním způsobem léčby BrS, tedy v podstatě prevence NSS, implantace ICD [4,5]. Jde tedy o jednoznačně doporučený postup [2].
Obr. 1. Doporučený postup při indikaci implantace implantabilního kardioverteru-defibrilátoru u pacientů s Brugada syndromem. NSS – náhlá srdeční smrt, PSK – programovaná stimulace komor, ICD – implantabilní kardioverter-defibrilátor. 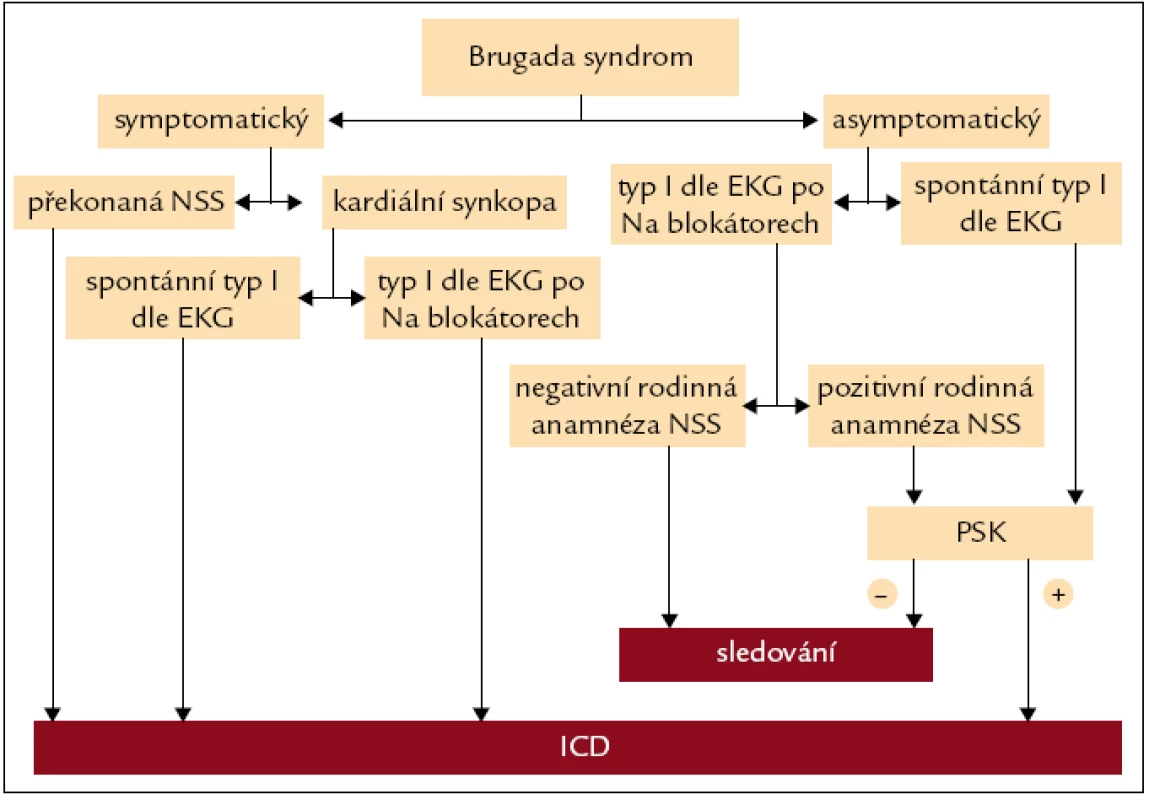
Mnoho pacientů s BrS zůstává bez zjevných klinických příznaků, zvláště pokud se vyvarují provokujících faktorů (např. horečka [14], aplikace určitých léčiv [15]). V některých pracích je frekvence výskytu příznaků u původně asymptomatických pacientů s BrS během dlouhodobého sledování prakticky nulová (Letsas et al [16] – 33 asymptomatických pacientů, průměrná délka sledování 5,3 let), jindy nízká až velmi nízká (Probst et al [17] – 0,5 % za rok sledování, 654 asymptomatických pacientů, 2,6 roku; Eckardt et al [18] – 0,8 % celkem, 123 asymptomatických pacientů, 3,3 roku; Sacher et al [7] – 4,3 % celkem, 114 asymptomatických pacientů, 2,6 roku). Vzhledem k tomu, že NSS bývá často prvním příznakem BrS [3], je však nutné asymptomatické pacienty podrobit důkladnému procesu stratifikace rizika, jak již bylo zmíněno.
Antzelevitch et al [2] zařadili mezi hlavní parametry určující riziko konkrétního pacienta s BrS osobní anamnézu NSS nebo synkopy, spontánní výskyt EKG obrazu typu I a komorovou fibrilaci vyvolanou během programované stimulace komor (PSK) z hrotu pravé komory (3 extrastimuly, délka cyklu ≥ 200 ms). Zdůraznili především výsledky studie zpracované kolektivem Brugada J et al [19], která poskytuje výstup z pozorování 547 pacientů s BrS, což představuje největší vzorek pacientů s BrS do té doby. Riziko NSS je podle těchto autorů významně vyšší u jedinců se spontánně se vyskytujícím EKG obrazem typu I (7,7krát), u mužů (5,5krát v porovnání s ženami) či po vyvolání trvalé komorové arytmie během PSK (8krát). V této studii nebyla naopak pozorována žádná závislost rizika na rodinné anamnéze BrS.
Význam mnohých výše uvedených rizikových faktorů byl potvrzen v pracích publikovaných po roce 2005. Např. významně horší prognózu mužů pozorovali v poměrně velké studii na 384 pacientech s BrS Benito et al [20]. Doposud asi nejrozsáhlejší studii věnující se dlouhodobé prognóze pacientů s BrS provedli Probst et al [17], kteří analyzovali klinická data 1 029 po sobě jdoucích pacientů z tzv. FINGER (France, Italy, Netherlands, Germany) registru pacientů s BrS. Tato práce, v souladu s doporučeními vydanými v roce 2005 [2], podpořila význam detekce spontánního výskytu EKG obrazu typu I a osobní anamnézy NSS a synkopy u pacientů s BrS pro stratifikaci jejich rizika. Nakano et al [21] rovněž pozorovali, že spontánní výskyt EKG obrazu typu I umožňuje předpovídat výskyt epizod komorové fibrilace u pacientů s BrS, avšak specificky pouze ve svodu V2. Mimocho-dem hlavní význam výskytu klinických příznaků a spontánního EKG obrazu typu I se zdá hrát zásadní roli i při stratifikaci rizika u pacientů s BrS v dětském věku [22]. Na základě získaných dat Probst et al [17] naopak zpochybnili roli mnohých uvažovaných rizikových faktorů (jako je pohlaví pacienta, pozitivní rodinná anamnéza NSS či přítomnost SCN5A mutace), a to včetně jednoho z hlavních parametrů doporučených pro stratifikaci rizika u pacientů s BrS Antzelevitchem et al [2], možnosti vyvolání komorových tachyarytmií během elektrofyziologického vyšetření, jelikož tyto faktory nevykazovaly významnou vazbu na zvýšené riziko vzniku arytmií.
Zcela nedávno byla publikována studie zpracovaná Delise et al [23], kteří na 320 pacientech s EKG obrazem typu I ukázali, že jednotlivý rizikový faktor není dostatečný k identifikaci nejrizikovějších pacientů s BrS. Doporučili použít přístup využívající více parametrů současně (a to předchozí výskyt synkopy, pozitivní rodinnou anamnézu NSS a pozitivní výsledek elektrofyziologického vyšetření). Pacienti s nejvyšším rizikem jsou podle nich ti, kteří vykazují EKG obraz typu I a minimálně 2 další rizikové faktory z této skupiny.
Význam PSK při stratifikaci rizika u pacientů s BrS
Již Antzelevitch et al ve své práci z roku 2005 [2] diskutovali prognostickou hodnotu zjištění možnosti vyvolat komorové arytmie během PSK u asymptomatických pacientů s BrS. Jak uvedli, publikovány byly doposud jak studie, které jeho význam podpořily [3,24], tak jiné, které ho popřely [25–27]. Komorovou fibrilaci je během PSK možné vyvolat i u 6–9 % zdravých jedinců [2]. Rozporné výsledky mohou pramenit z ne zcela standardizovaných, a tedy těžko srovnatelných stimulačních protokolů, které jsou občas možná až příliš agresivní [2].
Studie publikované po roce 2005 prozatím nepřinesly jednoznačnou odpověď týkající se užitečnosti PSK v procesu stratifikace rizika u pacientů s BrS. Delise et al [23] nedávno doporučili brát výsledky elektrofyziologického vyšetření v potaz jako součást přístupu využívajícího současnou detekci několika rizikových faktorů najednou. Oproti tomu jiné studie dokumentovaly velmi nízkou pozitivní prediktivní hodnotu možnosti vyvolat komorovou tachykardii/fibrilaci během PSK při stratifikaci rizika u pacientů s BrS, např. studie zpracovaná kolektivem Eckardt et al [18] a také 2 studie zahrnující skutečně vysoké počty pacientů s BrS (Paul et al [28] – 1 217 pacientů; Probst et al [17] – 1 029 pacientů). Lze předpokládat, že u asymptomatických pacientů je přítomen arytmogenní substrát, ale chybí spouštěcí impulz pro vyvolání maligní arytmie. Již v roce 2002 Gasparini et al [29] uvedli, že PSK u BrS by měla sloužit spíše k odhalení arytmogenního substrátu než k predikci výskytu maligní arytmie. Otázkou zůstává, zda pacienty s BrS vystavovat nesporně rizikovému vyšetření, které navíc, jak se zdá, nepřináší relevantní informace pro další léčebný postup. Kromě pozitivní prediktivní hodnoty možnosti vyvolat maligní arytmie, která se zdá být u PSK poměrně nízká, je však toto vyšetření v klinické praxi ceněno pro svoji významnou negativní prediktivní hodnotu.
Rizikové faktory nově navržené po roce 2005
Rizikové faktory odhalitelné pomocí základního EKG vyšetření a jeho modifikací
První skupina těchto rizikových faktorů se vztahuje k narušenému průběhu srdeční depolarizace (tab. 1). Není to překvapivé vzhledem ke známé roli poruch srdečního sodíkového kanálu u BrS (podrobně popsáno v [13]) a nezastupitelné úloze sodíkového proudu INa na fyziologickém průběhu vedení vzruchu srdcem. Zpoždění vedení vzruchu srdcem bylo zmíněno již v článku poprvé popisujícím BrS [1] a u pacientů s BrS bylo i později opakovaně pozorováno, zejména ve výtokovém traktu pravé komory (right ventricular outflow tract – RVOT) [30,31]. Doi et al [32] nedávno ukázali, že detekce zpoždění vedení srdečního vzruchu v RVOT může u BrS pomoci identifikovat pacienty s vyšším rizikem život ohrožujících komplikací. Obdobně bylo prokázáno, že vyšší riziko je u pacientů s BrS možné předpokládat na základě zjištění některých abnormit EKG parametrů, konkrétně prodlouženého komplexu QRS v pravém prekordiu [33,34], fragmentovaného komplexu QRS [35] a pozdních potenciálů (LP) na zprůměrovaném EKG záznamu [36]. To je zvláště významné vzhledem k neinvazivnímu charakteru EKG vyšetření. Již v roce 2001 Ikeda et al [37] v retrospektivní studii zaměřené na pacienty s BrS a anamnézou NSS prokázali vysoké procento pozitivních výsledků LP (92,6 %) s relativně vysokou pozitivní i negativní předpovědní hodnotou rizika NSS přesahující 70 %. Na druhé straně pozitivita LP ve skupině pacientů s asymptomatickou formou BrS nepřevyšuje 50 %. Proto byla snaha nalézt další přesvědčivější parametry zprůměrovaného EKG záznamu. Jak ukázali Tatsumi et al [38], denní kolísání parametrů popisujících srdeční depolarizaci (EKG: interval r-J – interval od začátku QRS komplexu po vlnu J; zprůměrované EKG: filtrovaná délka komplexu QRS a LAS40 – délka signálů o nízké amplitudě < 40 µV v terminální části filtrovaného komplexu QRS) je významně vyšší u symptomatických pacientů s BrS, a jeho detekce by tedy rovněž mohla pomoci identifikovat rizikové pacienty. Obdobně pozorovali vztah mezi spontánním kolísáním změn na EKG záznamu a výskytem epizod komorové fibrilace u pacientů s BrS i Take et al [39]. Na tkáňovém modelu BrS tito autoři současně prokázali, že pozorovaným spontánním změnám EKG odpovídá nárůst heterogenity konfigurace akčního napětí, která může vést ke vzniku reentry ve fázi 2 akčního napětí, jak je pro BrS typické, a tedy ke vzniku komorové tachykardie/fibrilace.
Tab. 1. Nově navržené rizikové faktory u BrS vycházející z EKG vyšetření. 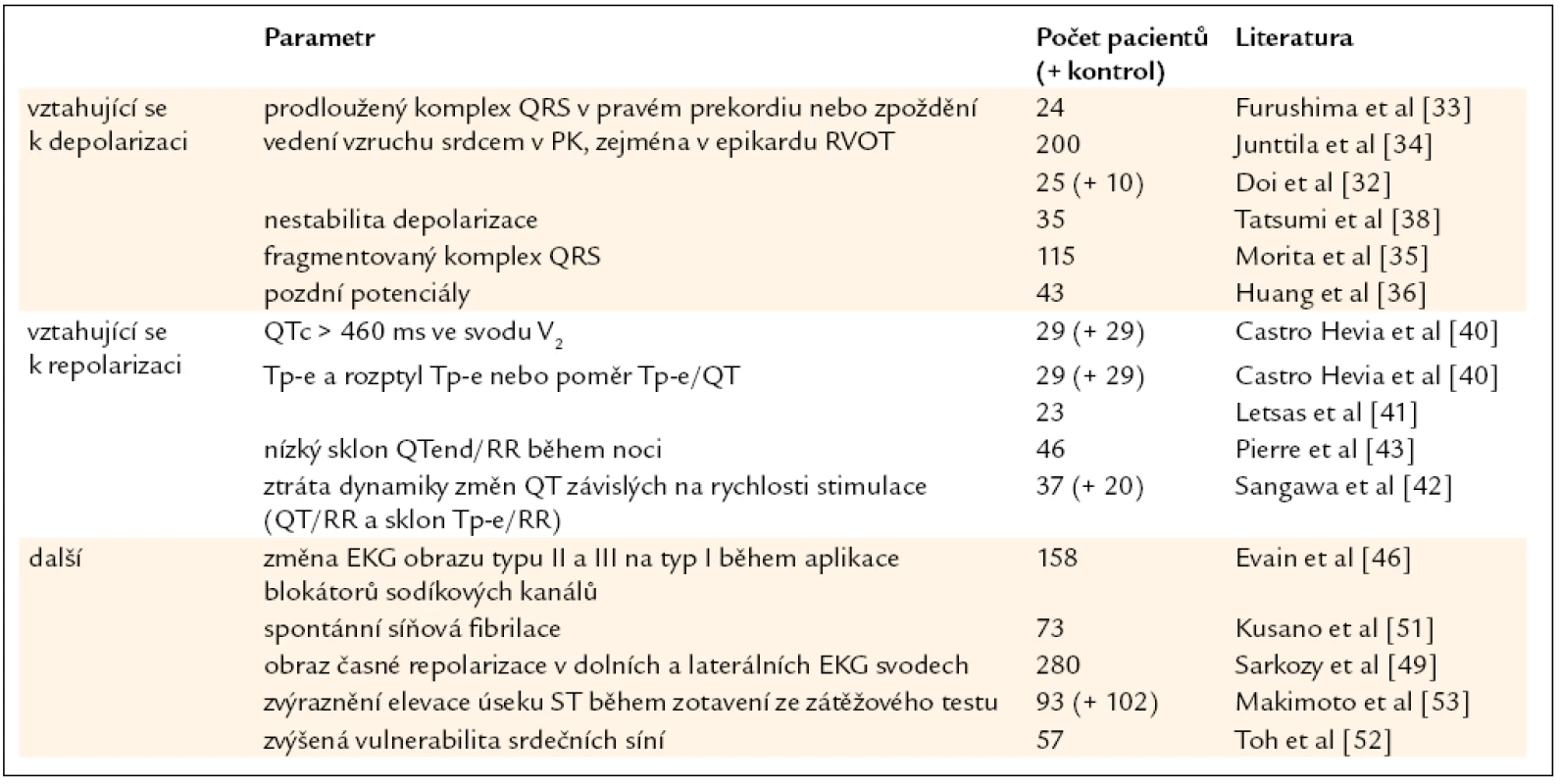
Jak je dobře známo, v mechanizmu vzniku arytmií u BrS hrají významnou roli i poruchy srdeční repolarizace (podrobně popsáno v [13]). Z parametrů vztahujících se k průběhu repolarizace byly jako rizikové z hlediska možnosti vzniku arytmií identifikovány např. prodloužený interval QT korigovaný na srdeční frekvenci (QTc; použita Bazettova korekce), prodloužený interval mezi vrcholem a koncem vlny T (Tp-e) a zvýšený rozptyl hodnot intervalu Tp-e. Významný nárůst těchto parametrů byl totiž pozorován u 9 symptomatických pacientů s BrS a opakujícími se záchvaty arytmií ve srovnání s pacienty bez těchto opakovaných záchvatů a kontrolní skupinou [40]. Kromě již zmíněného prodloužení Tp-e, Letsas et al [41] navrhli jako nový parametr poměr Tp-e/QT, protože byl zvýšen u 17 pacientů s vyvolatelnou komorovou tachykardií, případně fibrilací. Vzhledem k výše diskutovanému spornému významu výsledků PSK pro stratifikaci rizika u pacientů s BrS bude však nutné použitelnost tohoto parametru ověřit. Rovněž byla popsána ztráta dynamiky změn délky intervalu QT v závislosti na rychlosti stimulace u pacientů s dokumentovanými epizodami komorové fibrilace [42], případně její snížení, zejména v noci, u pacientů se spontánně se vyskytujícím obrazem typu I [43]. Další možnost neinvazivní stratifikace rizika NSS u pacientů s BrS odhalující poruchu repolarizace na základě kolísání amplitu-dy a/nebo morfologie vlny T během bicyklové ergometrie je mikrovolt T wave alternans (MTWA). MTWA je na rozdíl od dosud používaných parametrů spojena s vysokou negativní předpovědní hodnotou rizika NSS dosahující téměř 98 % [44]. Tato neinvazivní metoda prokázala vynikající výsledky v negativní predikci rizika NSS u pacientů s dysfunkcí levé komory, bez ohledu na etiologii. Kirchof et al [45] bohužel neprokázali možnost detekce výskytu maligní arytmie u rizikových pacientů s BrS pomocí této metody, včetně negativní predikce rizika NSS, avšak pouze na malém souboru pacientů.
Kromě již zmíněného a dávno známého významu spontánního výskytu EKG obrazu typu I pro prognózu pacientů s BrS [2] byly nově navrženy i některé další rizikové faktory vycházející z EKG křivky, ale bez izolované souvislosti pouze s poruchou depolarizace či repolarizace srdeční svaloviny. Jde např. o změnu EKG obrazu typu II a III v typ I po aplikaci blokátorů sodíkových kanálů [46]. Richter et al [47] zase ukázali, že klinické projevy a riziko arytmií se významně neliší u pacientů s BrS vykazujících diagnostické EKG změny v jednom a ve více prekordiálních svodech. V posledních letech se objevilo několik studií popisujících u pacientů s BrS poměrně častý výskyt obrazu časné repolarizace v dolních a laterálních svodech. Rozcházejí se však ve svých závěrech ohledně významu tohoto EKG nálezu pro prognózu pacientů. Zatímco Letsas et al [48] nepozorovali jeho spojení s častějším spontánním výskytem EKG obrazu typu I či klinických příznaků, Sarkozy et al [49] zjistili, že jeho výskyt byl u pacientů s BrS spojen s výraznějšími klinickými příznaky.
Co se týká srdečních arytmií, je známo, že u pacientů s BrS se ve zvýšené míře vyskytují nejen komorové, ale rovněž supraventrikulární arytmie, z nich nejčastěji paroxyzmální fibrilace síní (v průměru u 24 % pacientů) [50]. V posledních letech byl dokonce dokumentován významně vyšší výskyt paroxyzmální fibrilace síní [51] a zvýšená vulnerabilita srdečních síní bez detekované síňové fibrilace [52] u pacientů s BrS a výskytem komorové fibrilace.
Kromě využití nejrůznějších parametrů klidového EKG vyšetření byla nedávno v rámci stratifikace rizika u pacientů s BrS popsána i možnost analýzy EKG záznamu během zátěžového testu. Makimoto et al [53] totiž pozorovali zvýraznění elevace úseku ST během časné fáze zotavení ze zátěžového testu u skupiny 34 pacientů s BrS vykazujících významně vyšší výskyt epizod komorové fibrilace během následného v průměru více než 6letého sledování těchto pacientů oproti dalším 59 pacientům s BrS bez tohoto navýšení elevace úseku ST a 102 kontrolním jedincům.
Další nově navržené rizikové faktory u BrS
Nedávno byla jako významný indikátor zvýšeného rizika vzniku arytmií u BrS označena i srdeční autonomní neuropatie. Bigi et al [54] totiž detekovali její příznaky výhradně u pacientů s BrS vykazujících EKG obraz typu I (mimochodem pouze u mužů); 84 % z nich bylo symptomatických.
Babaee Bigi et al [55] zase navrhli využití Dopplerovy echokardiografie a parametrů popisujících mechanickou činnost srdce. Konkrétně pozorovali tzv. interventrikulární dyssynchronii, tedy významně delší zpoždění začátku kontrakce mezi pravou a levou srdeční komorou, u pacientů s BrS a spontánním EKG obrazem typu I, a to zejména u těch, u kterých byly dokumentovány opakované srdeční příhody.
Původně se předpokládalo, že výsledky genetické analýzy nemají u pacientů s BrS velkou prognostickou hodnotu [2]. V roce 2009 však Meregalli et al [56] ve své studii zahrnující 147 pacientů s BrS a 32 různými mutacemi v genu SCN5A kódujícím strukturu α-podjednotky srdečních sodíkových kanálů prokázali, že závažnější klinické příznaky včetně výraznějších poruch vedení vzruchu srdcem jsou přítomny u pacientů s mutacemi způsobujícími > 90% snížení či úplnou absenci INa vedeného mutovanými sodíkovými kanály (v případě absence INa díky předčasnému ukončení tvorby bílkoviny tvořící α-podjednotku sodíkového kanálu).
Závěr
Z této přehledové práce je zřejmé, že základní rizikové faktory doporučené pro stratifikaci rizika u pacientů s BrS v roce 2005 kolektivem Antzelevitch et al [2] se v podstatě nemění. S výjimkou sporného významu výsledků PSK je tedy možné i nadále brát v úvahu zejména osobní anamnézu NSS či synkopy a spontánní výskyt EKG obrazu typu I. Každopádně můžeme pozorovat odklon stratifikace rizika NSS od invazivních vyšetřovacích metod k neinvazivním parametrům, poskytující stejnou, ne-li vyšší pozitivní, a především vyšší negativní předpovědní hodnotu k vyloučení těch pacientů, kteří pro nízké riziko NSS z implantace ICD profitovat nebudou. Skutečný význam nově navržených rizikových faktorů bude nutné prověřit ve studiích zahrnujících rozsáhlejší populaci pacientů s BrS. Atraktivní budou jistě zejména parametry vycházející ze základního klidového EKG vyšetření vzhledem k tomu, že toto je u každého pacienta s BrS k dispozici, a je ho tedy jednoduché získat bez další zátěže pacienta.
Práce vznikla za podpory výzkumného záměru Ministerstva školství, mládeže a tělovýchovy MSM0021622402.
MUDr. Markéta Bébarová, Ph.D.
www.med.muni.cz
e-mail: bebarova.lfmu@centrum.cz
Doručeno do redakce: 2. 8. 2011
Přijato po recenzi: 12. 10. 2011
Zdroje
1. Brugada P, Brugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome. A multicenter report.J Am Coll Cardiol 1992; 20 : 1391–1396.
2. Antzelevitch C, Brugada P, Borggrefe M et al. Brugada syndrome: report of the second consensus conference: endorsed by the Heart Rhythm Society and the European Heart Rhythm Association. Circulation 2005; 111 : 659–670.
3. Brugada J, Brugada R, Antzelevitch C et al. Long-term follow-up of individuals with the electrocardiographic pattern of right bundle--branch block and ST-segment elevation in precordial leads V1 to V3. Circulation 2002; 105 : 73–78.
4. Brugada J, Brugada R, Brugada P. Pharmacological and device approach to therapy of inherited cardiac diseases associated with cardiac arrhythmias and sudden death. J Electrocardiol 2000; 33 (Suppl): 41–47.
5. Nademanee K, Veerakul G, Mower M et al. Defibrillator Versus beta-Blockers for Unexplained Death in Thailand (DEBUT): a randomized clinical trial. Circulation 2003; 107 : 2221–2226.
6. Bailey SM, Wilkoff BL. Complications of pacemakers and defibrillators in the elderly. Am J Geriatr Cardiol 2006; 15 : 102–107.
7. Sacher F, Probst V, Iesaka Y et al. Outcome after implantation of a cardioverter-defibrillator in patients with Brugada syndrome: a multicenter study. Circulation 2006; 114 : 2317–2324.
8. Sarkozy A, Boussy T, Kourgiannides G et al. Long-term follow-up of primary prophylactic implantable cardioverter-defibrillator therapy in Brugada syndrome. Eur Heart J 2007; 28 : 334–344.
9. Rosso R, Glick A, Glikson M et al. Israeli Working Group on Cardiac Pacing and Electrophysiology. Outcome after implantation of cardioverter defibrillator in patients with Brugada syndrome: a multicenter Israeli study (ISRABRU). Isr Med Assoc J 2008; 10 : 435–439.
10. Benito B, Brugada J, Brugada R et al. Brugada syndrome. Rev Esp Cardiol 2009; 62 : 1297–1315.
11. Mádle A, Kratochvíl Z, Polívková A. The Brugada syndrome. Vnitř Lék 2002; 48 : 255–258.
12. Veiser T, Laurent G, Wolf JE. Brugada syndrome. Čas Lék Česk 2005; 144 : 219–223.
13. Bébarová M. Brugada syndrom. Vnitř Lék 2011; 57 : 551–560.
14. Amin AS, Klemens CA, Verkerk AO et al. Fever-triggered ventricular arrhythmias in Brugada syndrome and type 2 long-QT syndrome. Neth Heart J 2010; 18 : 165–169.
15. Postema PG, Wolpert C, Amin AS et al. Drugs and Brugada syndrome patients: review of the literature, recommendations, and an up-to-date website (www.brugadadrugs.org). Heart Rhythm 2009; 6 : 1335–1341.
16. Letsas KP, Weber R, Efremidis M et al. Long-term prognosis of asymptomatic individuals with spontaneous or drug-induced type 1 electrocardiographic phenotype of Brugada syndrome. J Electrocardiol 2011; 44 : 346–349.
17. Probst V, Veltmann C, Eckardt L et al. Long--term prognosis of patients diagnosed with Brugada syndrome: Results from the FINGER Brugada Syndrome Registry. Circulation 2010; 121 : 635–643.
18. Eckardt L, Probst V, Smits JP et al. Long-term prognosis of individuals with right precordial ST-segment-elevation Brugada syndrome. Circulation 2005; 111 : 257–263.
19. Brugada J, Brugada R, Brugada P. Determinants of sudden cardiac death in individuals with the electrocardiographic pattern of Brugada syndrome and no previous cardiac arrest. Circulation 2003; 108 : 3092–3096.
20. Benito B, Sarkozy A, Mont L et al. Gender differences in clinical manifestations of Brugada syndrome. J Am Coll Cardiol 2008; 52 : 1567–1573.
21. Nakano Y, Shimizu W, Ogi H et al. A spontaneous Type 1 electrocardiogram pattern in lead V2 is an independent predictor of ventricular fibrillation in Brugada syndrome. Europace 2010; 12 : 410–416.
22. Probst V, Denjoy I, Meregalli PG et al. Clinical aspects and prognosis of Brugada syndrome in children. Circulation 2007; 115 : 2042–2048.
23. Delise P, Allocca G, Marras E et al. Risk stratification in individuals with the Brugada type 1 ECG pattern without previous cardiac arrest: usefulness of a combined clinical and electrophysiologic approach. Eur Heart J 2011; 32 : 169–176.
24. Brugada P, Brugada R, Mont L et al. Natural history of Brugada syndrome: the prognostic value of programmed electrical stimulation of the heart. J Cardiovasc Electrophysiol 2003; 14 : 455–457.
25. Priori SG, Napolitano C, Gasparini M et al. Natural history of Brugada syndrome: insights for risk stratification and management. Circulation 2002; 105 : 1342–1347.
26. Kanda M, Shimizu W, Matsuo K et al. Electrophysiologic characteristics and implications of induced ventricular fibrillation in symptomatic patients with Brugada syndrome. J Am Coll Cardiol 2002; 39 : 1799–1805.
27. Eckardt L, Kirchhof P, Schulze-Bahr E et al. Electrophysiologic investigation in Brugada syndrome; yield of programmed ventricular stimulation at two ventricular sites with up to three premature beats. Eur Heart J 2002; 23 : 1394–1401.
28. Paul M, Gerss J, Schulze-Bahr E et al. Role of programmed ventricular stimulation in patients with Brugada syndrome: a meta-analysis of worldwide published data. Eur Heart J 2007; 28 : 2126–2133.
29. Gasparini M, Priori SG, Mantica M et al. Programmed electrical stimulation in Brugada syndrome: How reproducible are the results? J Cardiovasc Electrophysiol 2002; 13 : 880–887.
30. Nagase S, Kusano KF, Morita H et al. Epicardial electrogram of the right ventricular outflow tract in patients with the Brugada syndrome: using the epicardial lead. J Am Coll Cardiol 2002; 39 : 1992–1995.
31. Tukkie R, Sogaard P, Vleugels J et al. Delay in right ventricular activation contributes to Brugada syndrome. Circulation 2004; 109 : 1272–1277.
32. Doi A, Takagi M, Maeda K et al. Conduction delay in right ventricle as a marker for identifying high-risk patients with Brugada syndrome. J Cardiovasc Electrophysiol 2010; 21 : 688–696.
33. Furushima H, Chinushi M, Hirono T et al. Relationship between dominant prolongation of the filtered QRS duration in the right precordial leads and clinical characteristics in Brugada syndrome. J Cardiovasc Electrophysiol 2005; 16 : 1311–1317.
34. Junttila MJ, Brugada P, Hong K et al. Differences in 12-lead electrocardiogram between symptomatic and asymptomatic Brugada syndrome patients. J Cardiovasc Electrophysiol 2008; 19 : 380–383.
35. Morita H, Kusano KF, Miura D et al. Fragmented QRS as a marker of conduction abnormality and a predictor of prognosis of Brugada syndrome. Circulation 2008; 118 : 1697–1704.
36. Huang Z, Patel C, Li W et al. Role of signal-averaged electrocardiograms in arrhythmic risk stratification of patients with Brugada syndrome: a prospective study. Heart Rhythm 2009; 6 : 1156–1162.
37. Ikeda T, Sakurada H, Sakabe K et al. Assessment of noninvasive markers in identifying patients at risk in the Brugada syndrome: Insight into risk stratification. J Am Coll Cardiol 2001; 37 : 1628–1634.
38. Tatsumi H, Takagi M, Nakagawa E et al. Risk stratification in patients with Brugada syndrome: analysis of daily fluctuations in 12-lead electrocardiogram (ECG) and signal-averaged electrocardiogram (SAECG). J Cardiovasc Electrophysiol 2006; 17 : 705–711.
39. Take Y, Morita H, Wu J et al. Spontaneous ECG alterations predict ventricular fibrillation in Brugada syndrome. Heart Rhythm 2011; 8 : 1014–1021.
40. Castro Hevia J, Antzelevitch C, Tornés Bárzaga F et al. Tpeak-Tend and Tpeak-Tend dispersion as risk factors for ventricular tachycardia//ventricular fibrillation in patients with the Brugada syndrome. J Am Coll Cardiol 2006; 47 : 1828–1834.
41. Letsas KP, Weber R, Astheimer K et al. Tpeak-Tend interval and Tpeak-Tend/QT ratio as markers of ventricular tachycardia inducibility in subjects with Brugada ECG phenotype. Europace 2010; 12 : 271–274.
42. Sangawa M, Morita H, Nakatsu T et al. Abnormal transmural repolarization process in patients with Brugada syndrome. Heart Rhythm 2009; 6 : 1163–1169.
43. Pierre B, Babuty D, Poret P et al. Abnormal nocturnal heart rate variability and QT dynamics in patients with Brugada syndrome. Pacing Clin Electrophysiol 2007; 30 (Suppl 1): S188–S191.
44. Rosenbaum DC, Jackson LE, Smith JH et al. Electrical alternans and vulnerability to ventricular arrhythmias. N Engl J Med 1994; 330 : 235–241.
45. Kirchof P, Eckardt L, Rolf S et al. T Wave Alternans Does Not Assess Arrhythmic Risk in Patients with Brugada Syndrome. Ann Noninvas Electrophysiol 2004; 9 : 162–165.
46. Evain S, Briec F, Kyndt F et al. Sodium channel blocker tests allow a clear distinction of electrophysiological characteristics and prognosis in patients with a type 2 or 3 Brugada electrocardiogram pattern. Heart Rhythm 2008; 5 : 1561–1564.
47. Richter S, Sarkozy A, Paparella G et al. Number of electrocardiogram leads displaying the diagnostic coved-type pattern in Brugada syndrome: a diagnostic consensus criterion to be revised. Eur Heart J 2010; 31 : 1357–1364.
48. Letsas KP, Sacher F, Probst V et al. Prevalence of early repolarization pattern in inferolateral leads in patients with Brugada syndrome. Heart Rhythm 2008; 5 : 1685–1689.
49. Sarkozy A, Chierchia GB, Paparella G et al. Inferior and lateral electrocardiographic repolarization abnormalities in Brugada syndrome. Circ Arrhythm Electrophysiol 2009; 2 : 154–161.
50. Francis J, Antzelevitch C. Atrial fibrillation and Brugada syndrome. J Am Coll Cardiol 2008; 51 : 1149–1153.
51. Kusano KF, Taniyama M, Nakamura K et al. Atrial fibrillation in patients with Brugada syndrome relationships of gene mutation, electrophysiology, and clinical backgrounds. J Am Coll Cardiol 2008; 51 : 1169–1175.
52. Toh N, Morita H, Nagase S et al. Atrial electrophysiological and structural remodeling in high-risk patients with Brugada syndrome: assessment with electrophysiology and echocardiography. Heart Rhythm 2010; 7 : 218–224.
53. Makimoto H, Nakagawa E, Takaki H et al. Augmented ST-segment elevation during recovery from exercise predicts cardiac events in patients with Brugada syndrome. J Am Coll Cardiol 2010; 56 : 1576–1584.
54. Bigi MA, Aslani A, Aslani A. Significance of cardiac autonomic neuropathy in risk stratification of Brugada syndrome. Europace 2008; 10 : 821–824.
55. Babaee Bigi MA, Moaref AR, Aslani A. Interventricular mechanical dyssynchrony: a novel marker of cardiac events in Brugada syndrome. Heart Rhythm 2008; 5 : 79–82.
56. Meregalli PG, Tan HL, Probst V et al. Type of SCN5A mutation determines clinical severity and degree of conduction slowing in loss-of-function sodium channelopathies. Heart Rhythm 2009; 6 : 341–348.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Diabetes mellitus a demence
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 4- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Predikce neurologické prognózy po srdeční zástavě – editorial
- Význam biomarkerů NGAL a cystatin C u kardiovaskulárních onemocnění – editorial
- Gastrin bez gastrinomu – editorial
- Elevace proteinu S-100B u pacientů s akutním koronárním syndromem po resuscitaci je prediktorem nepříznivé neurologické prognózy
- Krátkodobá prognóza a léčba pacientů hospitalizovaných pro akutní srdeční selhání v regionální nemocnici bez kardiocentra
- Stratifikace rizika u pacientů s Brugada syndromem
- Význam biomarkerů NGAL a cystatinu C u kardiovaskulárních onemocnění
- Nové poznatky v patogenezi Crohnovy choroby
- Lékové interakce u starších diabetiků
- Diabetes mellitus a demence
- Specifika diabetické edukace u dětí
- Blokáda receptoru pro interleukin-1 preparátem anakinra vedla u pacienta s Erdheimovou-Chesterovou nemocí k vymizení patologické únavy, k poklesu markerů zánětu a ústupu fibrózy v retroperitoneu – popis případu a přehled literárních údajů
- Akutní infarkt myokardu navozený požitím drogy pervitin
- Hypergastrinemie bez detekce gastrinomu
- Akutní intoxikace mědí při suicidiálním pokusu
- Skrytá cystická fibróza u nemocného se sarkoidózou
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní infarkt myokardu navozený požitím drogy pervitin
- Význam biomarkerů NGAL a cystatinu C u kardiovaskulárních onemocnění
- Akutní intoxikace mědí při suicidiálním pokusu
- Nové poznatky v patogenezi Crohnovy choroby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



