-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prevalence anémie a vliv na hospitalizační mortalitu pacientů přijatých pro akutní srdeční selhání
The prevalence of anemia and its impact on hospitalization mortality in patients with acute heart failure
Aim of study:
To evaluate the influence of entry hemoglobin level on the hospitalization mortality of the patients admitted with AHF caused by 4 major etiologies – acute coronary syndrome with ST elevation (STEMI, n = 325) and without ST elevation (nonSTEMI, n = 210), decompensated chronic ischaemic heart disease (IHD, n = 206) and dilated cardiomyopathy (CMP, n = 88).Results:
We analyzed 1,253 consecutive 1st ‑ time hospitalizations of AHF patients of whom 1,212 had their entry hemoglobin known. Out of these, 829 subjects were of STEMI (1), nonSTEMI (2), IHD (3) and CMP (4) etiology and were included in further analyses. We devided these patients into subgroups according to hemoglobin levels: I – no anemia, II – minor and III – severe anemia. The hospitalization mortality in subgroups (I – II – III) of each etiology was 16.9 – 24.5 – 35.3% (1); 12.4 – 9.8 – 35.7% (2); 9.0 – 9.7 – 18.2% (3); 1.5 – 21.4 – 33.3% (4); all etiologies together 12.4 – 15.0 – 28.8%, total rate 14.1%. Univariate analysis (χ2) showed significant differencies in hospitalization mortality depending on etiology and hemoglobin level but not type of failure (de novo/ decompensation). Other parametres (comorbidities, laboratory and hemodynamic values, medication at entry) had a very variable impact on mortality throughout etiologies and hemoglobin subgroups.Conclusion:
The presence of anemia increases hospitalization mortality of patients with acute heart failure. The relation between hemoglobin level and mortality seems to be linear, we did not observe „U shape“ type of relation. It is necessary to distinguish etiologies of AHF as well as consider effects of laboratory and anamnestic variables when interpreting the results.Key words:
prevalence – anemia – haemoglobin – acute heart failure – hospitalization mortality
Autoři: R. Miklík 1; M. Felšöci 1; J. Pařenica 1; D. Tomčíková 2; Jiří Jarkovský 2
; J. Špinar 1
Působiště autorů: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jindřich Špinar, CSc., FESC 1; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 2
Vyšlo v časopise: Vnitř Lék 2010; 56(5): 382-391
Kategorie: Původní práce
Souhrn
Cíl práce:
Zjistit vliv vstupního hemoglobinu na hospitalizační mortalitu pacientů přijatých s akutním srdečním selháním (ASS), způsobeným 4 nejčastějšími etiologiemi – akutním koronárním syndromem s ST elevacemi (STEMI, n = 325) a bez ST elevací (nonSTEMI, n = 210), dekompenzovanou chronickou ischemickou chorobou srdeční (CHICHS, n = 206) a dilatační kardiomyopatií (KMP, n = 88).Výsledky:
Z 1 253 konsekutivních primohospitalizací pro ASS mělo 1 212 známý vstupní hemoglobin. Prevalence anémie byla 31,9 %. 829 subjektů se STEMI (1), nonSTEMI (2), CHICHS (3) a KMP (4) bylo podrobně analyzováno. Pacienti byli rozděleni do podskupin dle hladiny hemoglobinu na I – bez anémie, II – lehká anémie a III – těžká anémie. Hospitalizační mortalita v podskupinách (I – II – III) jednotlivých etiologií byla 16,9 – 24,5 – 35,3 % (1); 12,4 – 9,8 – 35,7 % (2); 9,0 – 9,7 – 18,2 % (3); 1,5 – 21,4 – 33,3 % (4); celkově 12,4 – 15,0 – 28,8 % pro všechny etiologie, globálně 14,1 %. Dle univariantní analýzy (χ2) se mortalita významně lišila v závislosti na etiologii a hladině hemoglobinu, typ selhání (de novo/ dekompenzace) mortalitu významně neovlivnil. Další sledované parametry (komorbidity, laboratorní a hemodynamické hodnoty, vstupní medikace) měly velmi variabilní vliv na mortalitu mezi jednotlivými etiologiemi a podskupinami dle hladin hemoglobinu.Závěr:
Vstupní anémie zvyšuje hospitalizační úmrtnost pacientů přijatých pro akutní srdeční selhání. Z výsledků vyplývá negativní lineární závislost mezi vstupním hemoglobinem a hospitalizační mortalitou. Neprokázali jsme závislost typu „U shape“. Při interpretaci výsledků je třeba vzít v úvahu jednotlivé etiologie srdečního selhání a hodnoty dalších vstupních laboratorních i anamnestických údajů.Klíčová slova:
prevalence – anémie – hemoglobin – akutní srdeční selhání – hospitalizační mortalitaÚvod
Diagnóza akutního srdečního selhání (ASS) zahrnuje širokou škálu etiologií a syndromů, se kterými jsou pacienti do nemocnice přijímáni. Z registrů z různých zemí světa (Japonsko – HIJC HF [1]; Argentina – CONAREC 2004, IC SAC 2004 [2]; USA – ADHERE [3]; Česká republika – AHEAD [4]; Finsko – FINN AKVA [5], Francie – EFICA [6], dále mezinárodní registry EuroHeart Survey I + II [7,8] a ALARM HF [9]) je patrné, že nejčastějšími příčinami selhání jsou ischemická choroba srdeční (zavzaty i akutní koronární syndromy), chlopenní vady, akutní arytmie (fibrilace/flutter síní) a dilatační kardiomyopatie. Hypertenze je nejčastější přidruženou komorbiditou. Počet akutně přijatých pacientů se v ČR pohybuje kolem 2 900/milion obyvatel ročně [10]. Hospitalizační mortalita těchto pacientů je udávána mezi 4 a 15% (nejnižší úmrtnost udává ADHERE), pilotní výsledky v databázi AHEAD uvádí 12,5%. Přežití pacienta závisí na mnoha faktorech – věku, pohlaví, typu a tíži selhání, etiologii, komorbiditách, způsobu léčby atd. Autoři registru ADHERE již nastínili jednoduchý algoritmus využívající hladiny urey, kreatininu a hodnoty vstupního krevního tlaku k predikci hospitalizačního úmrtí [11]. Jedním z cílů databáze AHEAD (v současné době zahrnující 12 center z celé ČR) je vytvořit stratifikační model na základě několika běžně zadávaných vstupních proměnných (pohlaví, věk, laboratorní parametry, typ selhání aj.), jejichž kombinace by u daného pacienta mohla predikovat riziko hospitalizačního a ročního úmrtí ihned při přijetí do nemocnice. První takový pokus nedávno publikoval Špinar et al [4] s použitím kombinace syndromů a etiologie srdečního selhání.
V této práci se věnujeme hladině hemoglobinu (Hb) jako možnému stratifikačnímu markeru hospitalizačního přežití/úmrtí. Již ve Framinghamské studii byla nalezena asociace mezi anémií a vyšší incidencí srdečního selhání oproti neanemickým pacientům [12]. Poté, co Silverberg et al [13] zveřejnili výsledky o pozitivním účinku subkutánně aplikovaného erytropoetinu na zlepšení ledvinných a srdečních parametrů pacientů s anémií a srdečním selháváním při plné medikaci, bylo publikováno mnoho prací, které popisují vztah mezi vstupní hladinou Hb, zejména pak přítomností anémie, a dlouhodobou mortalitou těchto pacientů. V databázích Scopus, ScienceDirect a PubMed je možné nalézt jen velmi málo prací zabývajících se vlivem vstupního hemoglobinu na mortalitu těchto pacientů v průběhu „index“ hospitalizace [14,15]. Autoři těchto článků do svých analýz zahrnuli vysoce selektovanou skupinu pacientů s dysfunkcí levé komory [14] nebo pacienty vyhledali dle ICD 9 kódů z propouštěcích diagnóz [15]. Nenalezli jsme žádnou práci, která by popisovala vztah mezi vstupním hemoglobinem, etiologií srdečního selhání a hospitalizační mortalitou.
Cíl práce
Určit prevalenci anémie u pacientů přijatých pro akutní srdeční selhání. U jednotlivých skupin pacientů rozdělených dle etiologie selhání zjistit vliv vstupního hemoglobinu na mortalitu těchto pacientů v průběhu hospitalizace, popsat a porovnat rozdíly mezi jednotlivými etiologiemi (biochemické, hemodynamické parametry, anamnestická data, medikaci) a stanovit potenciální rozdíly v rizikovosti různých vstupních hladin hemoglobinu na hospitalizační výstup.
Metodika
Pro analýzu jsme použili data z databáze AHEAD kardiologické kliniky FN Brno Bohunice v období prosinec roku 2004 až srpen roku 2007 (33 konsekutivních měsíců). Kritérii pro zařazení byly: primohospitalizace, známá hladina vstupního hemoglobinu a klinické projevy srdečního selhání z jakékoli příčiny vyžadující terapii; u levostranného selhání vstupní Killip ≥ 2, u pravostranného selhání kardiální otoky dolních končetin s plicním výpotkem přítomným na RTG snímku plic nebo bez něj a s dušností NYHA ≥ III (pacient nevyjde jedno patro schodů bez nutnosti zastavení). Zahrnuti byli i pacienti s akutní plicní embolií nebo s infarktem pravé komory provázeným hyposaturací, hypotenzí a tachykardií. Do studie nebyli zařazeni pacienti z jiných nemocnic nebo klinik, kteří byli přeloženi v již stabilizovaném stavu. Pro další výpočty jsme vybrali 4 nejčastější etiologie akutního selhání:
- akutní STEMI
- akutní nonSTEMI
- dekompenzace chronické ICHS
- dilatační kardiomyopatie
Zařazeni byli všichni pacienti splňující kritéria, vlastní výběr byl prováděn systémem osobní kontroly všech propouštěcích zpráv z kliniky, nikoli dle číselníku diagnóz. Anémii jsme definovali jako hladinu vstupního Hb < 120g/l u žen a Hb < 130g/l u mužů (kritéria The World Health Organization). Studie byla schválena Etickou komisí FN Brno a všichni pacienti podepsali informovaný souhlas se sběrem medicínských dat, který je standardní součástí souhlasu s hospitalizací.
Při statistickém zpracování byli pacienti rozděleni dle etiologie srdečního selhání a též dle hladiny hemoglobinu (g/l) do 3 skupin s ohledem na pohlaví: bez anémie (muži Hb ≥ 130g/l, ženy Hb ≥ 120g/l), lehká forma anémie (muži 110g/l ≤ Hb < 130g/l, ženy100g/l ≤ Hb < 120g/l) a těžká forma anémie (muži Hb < 110g/l, ženy Hb < 100g/l). V popisné statistice jsou kategoriální proměnné vyjádřené procentuálním zastoupením, spojité průměrem, směrodatnou odchylkou, mediánem, 5procentním a 95procentním percentilem. Některé parametry byly logaritmicky transformovány, u nich je uveden geometrický průměr, medián, 5procentní a 95procentní percentil. Při testování rozdílů mezi skupinami byly použity neparametrické testy Mann -Whitney U test a Kruskal-Wallisův test pro spojité proměnné a χ2 pro kategoriální proměnné. Pro vybrané klinické a demografické parametry jsme zjišťovali vztah k riziku hospitalizačního úmrtí a vyjádřili ho poměrem šancí (odds ratio – OR) s 95procentním intervalem spolehlivosti (IS) a testovali Waldovým testem. Za statisticky významný byl považován rozdíl na hladině významnosti p < 0,05.
Výsledky
Charakteristika souboru
Z celkem 1 253 konsekutivních primohospitalizací pro akutní srdeční selhání z jakékoli příčiny byla vstupní hladina Hb známa u 1 212 subjektů (96,7%).Graf 1 znázorňuje rozložení hladin hemoglobinu dle pohlaví. Prevalenci anémie v tomto souboru pacientů, včetně srovnání s publikovanými daty, zobrazuje tab. 1. Pohlaví, věkové rozložení pacientů a zastoupení v podskupinách lehké nebo těžké anémie a bez anémie udává tab. 2. Je nutné dodat, že hladiny hemoglobinu byly stanoveny z odběrů při přijetí do nemocnice a nemohly být ovlivněny následnými invazivními výkony (např. koronarografie, implantace stimulátoru). Do další analýzy bylo zahrnuto celkem 829/1 212 subjektů (68,4%), u nichž byla známa vstupní hladina hemoglobinu a dominantními etiologiemi selhání byly akutní koronární syndrom (AKS) STEMI, nonSTEMI, dekompenzace chronické ICHS (CHICHS) a dilatační kardiomyopatie (KMP). Hlavní rozdíly mezi skupinami popisuje tab. 3. Testovány byly rozdíly mezi všemi etiologiemi dohromady i navzájem mezi sebou. Jsou patrné signifikantní odlišnosti ve všech srovnávaných parametrech kromě vstupního sodíku, což podporuje významnost rozdělení pacientů se syndromem srdečního selhání dle jednotlivých etiologií a důležitost individuálního hodnocení vlivu hemoglobinu a dalších proměnných ve vztahu k prognóze pacientů. Nejdůležitější charakteristiky a rozdíly mezi jednotlivými skupinami lze shrnout takto:
- STEMI pacienti byli přijati převážně s de novo selháním (93,2%), měli nejnižší zastoupení vstupní farmakoterapie ze všech skupin. Téměř 1/4 pacientů měla kardiogenní šok za hospitalizace.
- NonSTEMI pacienti měli již v 1/3 případů srdeční selhání v anamnéze, měli větší zastoupení farmakoterapie než skupina nonSTEMI, také byli starší a prezentovali se s horšími renálními parametry nežli STEMI pacienti. EF LK byla ve skupinách s AKS podobná (kolem 40%). V nonSTEMI skupině bylo nejvíce plicních edémů ze všech skupin.
- Pacienti s dekompenzací CHICHS byli nejstarší (spolu s nonSTEMI), s nejvyšším kreatininem a nejnižším hemoglobinem, měli největší zastoupení farmakoterapie, což odráží fakt, že 90% z nich již mělo chronické selhávání v anamnéze.
- Pacienti s KMP byli v průměru o 10 let mladší než ostatní, s nejlepšími laboratorními výsledky, ale s nejnižší EF LK (medián 20%). 2/3 pacientů byli přijati jako dekompenzace již známého selhávání, nejčastěji ve třídě Killip II, čemuž ale neodpovídalo zastoupení základní farmakoterapie ACEI/ATII (59,1%) a beta blokátory (pouze 37,5%).
Tab. 1. Prevalence anémie v našem souboru a porovnání s publikovanými daty (upraveno dle Tang et al [16]. Převzaty práce s počtem pacientů N > 600 a známým vstupním hemoglobinem odebraným za hospitalizace). ![Prevalence anémie v našem souboru a porovnání s publikovanými daty (upraveno dle Tang et al [16]. Převzaty práce s počtem pacientů N > 600 a známým vstupním hemoglobinem odebraným za hospitalizace).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2e5921023eea486382897aad391676cc.jpg)
Hct – hematokrit, WHO – Světová zdravotnická organizace # průměr ± SD (pokud známa), *median (5 %; 95 %) Graf 1. Hladiny vstupního hemoglobinu dle pohlaví. 
Hospitalizační mortalita
Celková úmrtnost v našem souboru dosáhla 14,1%. Rozdělení pacientů dle hladin vstupního hemoglobinu a hospitalizační mortalitu v jednotlivých podskupinách zobrazuje tab. 4. Mortalitní data lze shrnout následovně:
- STEMI pacienti měli nejvyšší a pacienti s KMP nejnižší mortalitu ze všech 4 skupin, což jsme předpokládali. Tento fakt může falešně prodlužovat hospitalizační dobu KMP pacientů a statisticky ji zkracovat u STEMI pacientů, protože 50% pacientů zemře do dvou dnů od přijetí (graf 2).
- U STEMI a CHICHS pacientů je patrný trend k vyšší úmrtnosti se snižováním hladiny hemoglobinu, ale toto nedosáhlo statistické významnosti. U nonSTEMI pacientů bylo hospitalizační přežití signifikantně nejnižší v podskupině s těžkou anémií při přijetí, pacienti bez anémie nebo s lehkou formou se nelišili. U subjektů s dilatační KMP byl vliv anémie nejmarkantnější: pacientů s anémií zemřelo asi 20krát více než neanemických pacientů. I zde je zachován trend k vyšší úmrtnosti při nejnižší hladině hemoglobinu i přes celkově nízký počet nemocných v anemických podskupinách. Naše výsledky tedy nenaznačují přítomnost „U shape“ závislosti mezi vstupním hemoglobinem a hospitalizační mortalitou pacientů s akutním srdečním selháním.
Tab. 2. Hospitalizační mortalita vzhledem k tíži anémie, χ2 test. 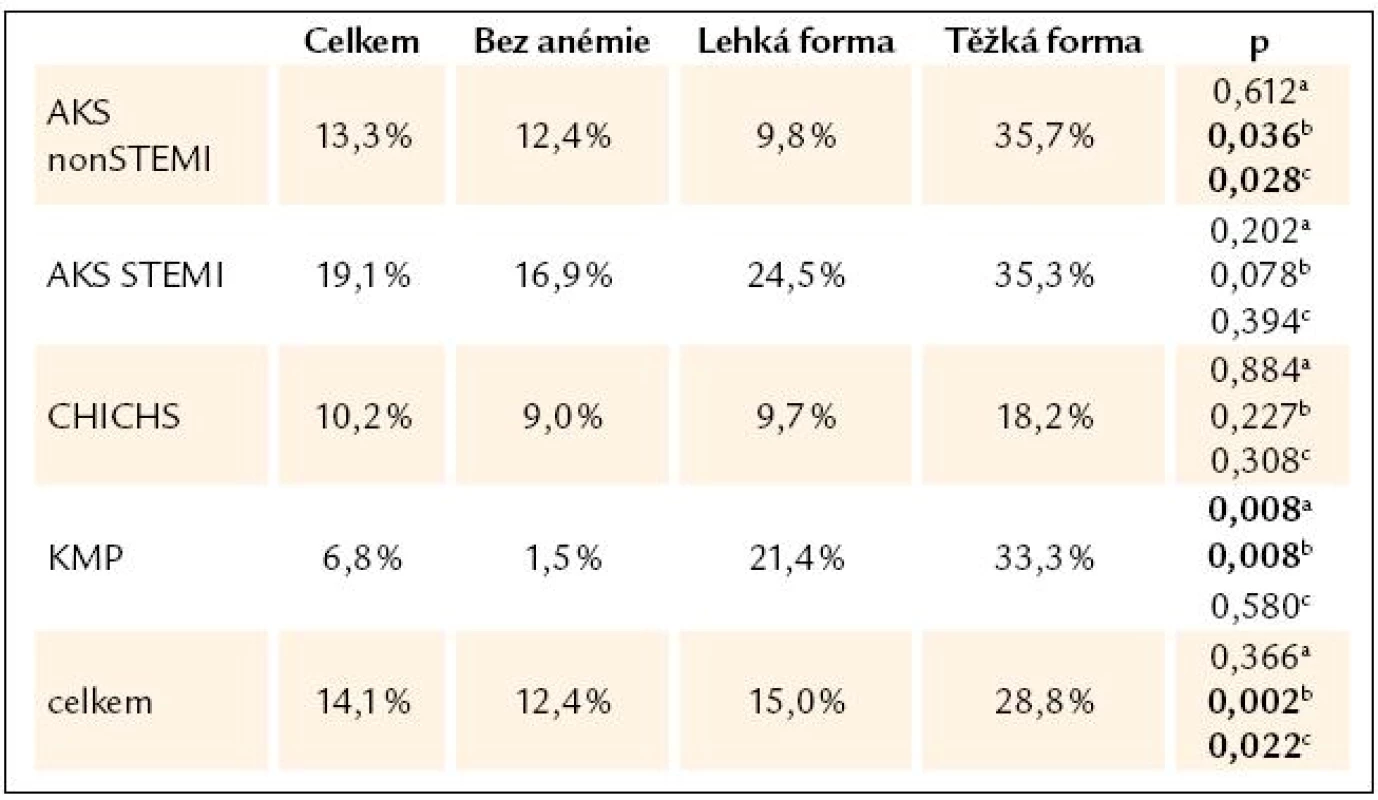
a hodnota p pro testování rozdílu mezi hospitalizační mortalitou pacientů bez anémie a s lehkou formou anémie, b hodnota p pro testování rozdílu mezi hospitalizační mortalitou pacientů bez anémie a s těžkou formou anémie, c hodnota p pro testování rozdílu mezi hospitalizační mortalitou pacientů s lehkou a těžkou formou anémie Graf 2. Mortalita pacientů s akutním srdečním selháním v registru AHEAD, N = 2 245. Medián doby hospitalizace je 2 dny u zemřelých pacientů a 8 dní u pacientů propuštěných, p < 0,05. 
V našem souboru jsme neprokázali vztah mezi typem srdečního selhání (de novo/dekompenzace), etiologií selhání a hospitalizační mortalitou pacientů (p = 0,219). Významný byl negativní vztah mezi přítomností anémie, etiologií selhání a hospitalizační mortalitou (p = 0,027).
Pomocí univariantní logistické regrese jsme zjišťovali sílu vztahu vyjádřenou jako poměr šancí (odds ratio – OR) mezi vstupními anamnestickými údaji (věkem, pohlavím, přítomností diabetes mellitus, předchozího infarktu myokardu a hypertenzí), hemodynamickými parametry (systolickým a diastolickým krevním tlakem, tepovou frekvencí), echokardiografickými parametry (ejekční frakcí levé komory, přítomností minimálně středně významné mitrální a aortální vady), laboratorními hodnotami (hemoglobinem, kreatinininem, sodíkem a C reaktivním proteinem), vstupní medikací (ACEI/sartany, beta blokátory, diuretiky, antiagregací a antikoagulací) a hospitalizační mortalitou těchto pacientů, zvlášť pro jednotlivé etiologie selhání a skupiny s anémií a bez ní (tab. 5). Nejsou zobrazeny ty proměnné, u kterých jsme neprokázali signifikantní vliv na přežití/úmrtí pacientů ani v jedné skupině (anamnéza diabetes mellitus a předchozího infarktu myokardu, pohlaví, změna tepové frekvence o 10/min, antikoagulace). U některých podskupin nešlo vztah určit pro nízký počet pacientů (N.S.).
Tab. 3. Analýza vztahu mezi hospitalizační mortalitou a změnou vybraných klinických parametrů dle etiologie a přítomnosti anémie, vyjádřená jako poměr šancí (odds ratio – OR). Rizikovost spojitých proměnných je vyjádřena pro nárůst hladiny (změnu) daného parametru o hodnotu v závorce oproti vstupní hodnotě. Statisticky významné hodnoty (p < 0,05) jsou zvýrazněny. 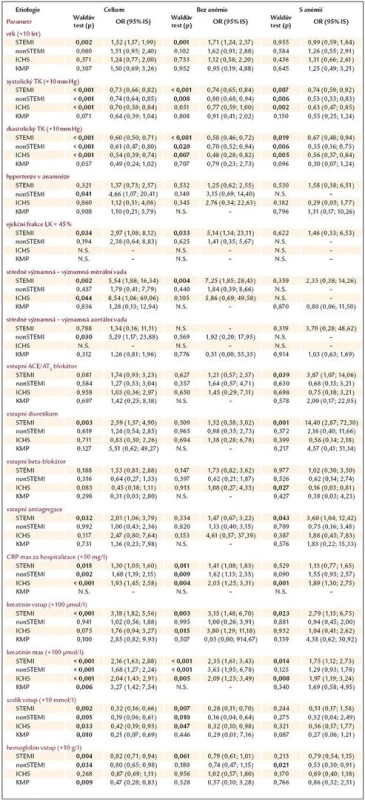
Diskuze
Prevalence anémie u pacientů se srdečním selháním je udávána mezi 4 a 55% [16]. Tento rozptyl je způsoben mnoha faktory: různými definicemi anémie, které autoři použili (WHO [17], NKF [18], vlastní definice); selekcí pacientů zahrnutých do analýz (studie, registry, zdravotnické databáze [19]); stavem kompenzace pacienta (podíl hemodiluce na anémii [20]); pokročilostí selhávání (de novo vs opakovaná dekompenzace srdečního selhání); zastoupením přidružených onemocnění. Výskyt anémie u 31,9% akutních pacientů v našem souboru je srovnatelný s nálezy jiných autorů rozsáhlejších prací (tab. 1). Podíl anemických žen a mužů byl v našem souboru stejný, což popisují i další autoři [21,22], většina jiných prací ale uvádí významně vyšší zastoupení anémie u žen než u mužů [14,23–25]. Předpokládaný pokles hemoglobinu s narůstajícím věkem [26] byl v našem souboru statisticky významný (tab. 2).
Tab. 4. Rozdělení pacientů dle pohlaví a stupně anémie při přijetí a zastoupení stupně anémie u jednotlivých věkových skupin pacientů. 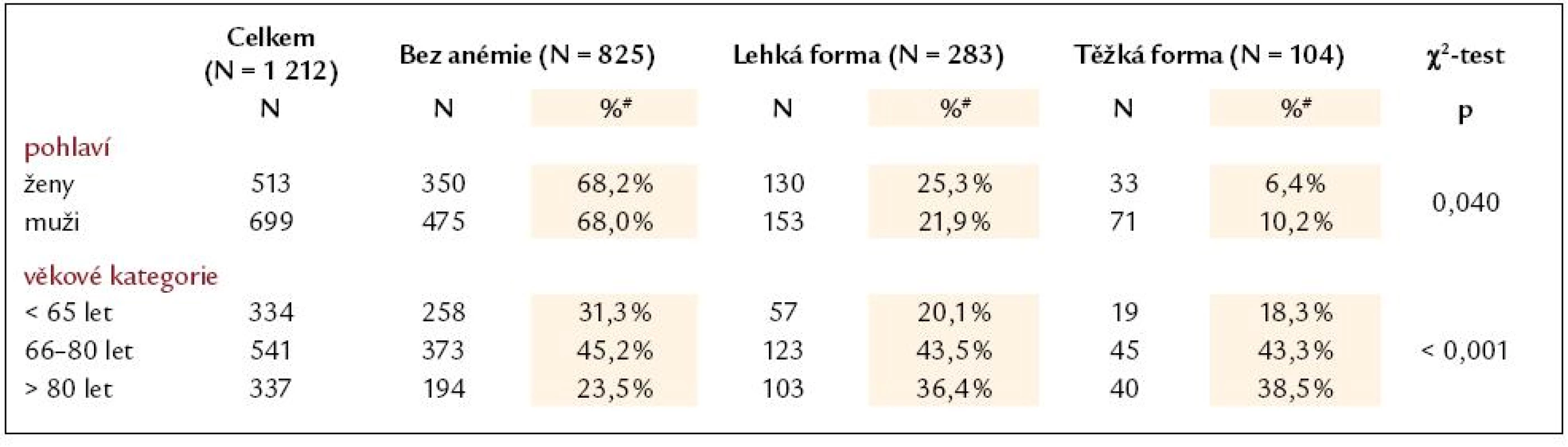
Cut‑off hodnoty dle pohlaví: lehká forma anémie muži Hb < 130 g/ l, ženy Hb < 120 g/ l; těžká forma anémie muži Hb < 110 g/ l, ženy Hb < 100 g/ l # Procentuální zastoupení forem anémie je uváděno pro jednotlivé kategorie v rámci pohlaví a věkových kategorií. Tab. 5. Základní vstupní charakteristika pacientů (N = 829) se známým hemoglobinem při přijetí, rozdělení dle nejčastějších etiologií akutního srdečního selhání. Hodnoty jsou vyjádřeny jako medián (5%; 95%) nebo jako procentuální zastoupení pro testování rozdílů mezi všemi čtyřmi kategoriemi. 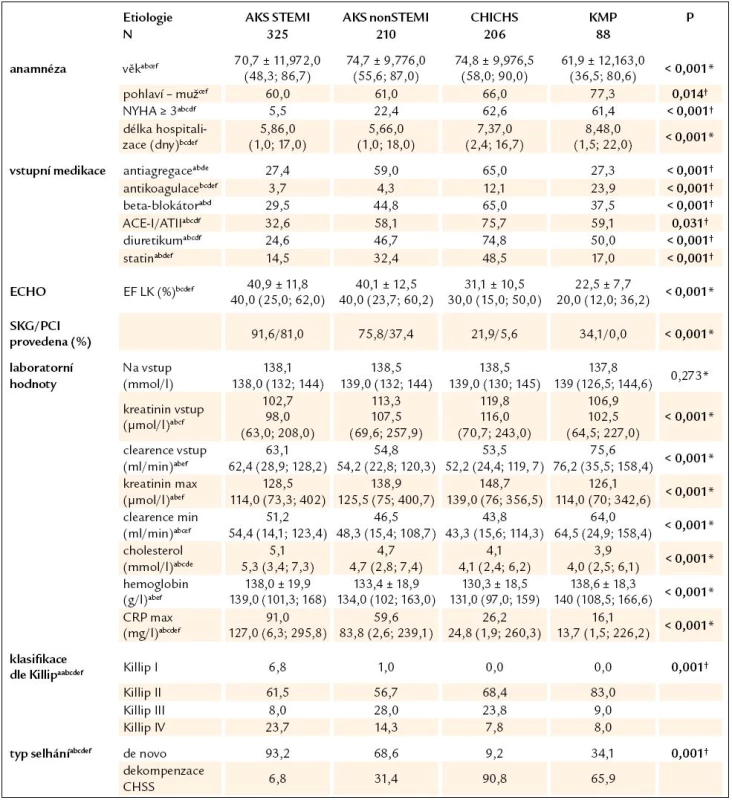
*Kruskal-Wallisův test † χ2 test, výrazně vyznačeny statisticky významné rozdíly na hladině p < 0,05 a–f statisticky významný rozdíl na hladině p < 0,05 (Mann‑Whitney U test, resp. χ2 test) pro testování rozdílů mezi: a = STEMI a nonSTEMI, b = STEMI a CHICHS, c = STEMI a KMP, d = nonSTEMI a CHICHS, e = nonSTEMI a KMP, f = CHICHS a KMP SKG – selektivní koronarografie, další viz text Clearence kreatininu je počítána dle Cockroft-Gaultovy formule, vstupní hodnota je odvozena od vstupního kreatininu, vypočítaná minimální hodnota je odvozena z maximálního kreatininu za hospitalizace. Tíže levostranného selhání dle Killipovy klasifikace (II– IV) je udávána jako nejhorší dosažená za hospitalizace. Pacienti ve skupině Killip I jsou pacienti s čistě pravostranným selháváním. Akutní srdeční selhání je komplexní syndrom, na jehož finálním klinickém projevu se podílí mnoho faktorů [27,28]. Silverberg v roce 2002 definoval pojem „The cardio renal anemia syndrome“, kterým dobře vystihl bludný kruh mezi vzájemným nepříznivým ovlivňováním všech tří obsažených klinických syndromů [29]. Na myokard působí negativně kombinace nedostatečné dodávky kyslíku při poklesu hemoglobinu, zvýšená spotřeba selhávajícího srdce ve snaze o zachování dostatečného tepového objemu a vyšší míra oxidačního stresu, který je u anémie přítomen [30,31]. Periferní vazodilatace, která je důsledkem zvýšené dostupnosti oxidu dusnatého [32], působí pokles středního tlaku krve, což má za následek vazokonstrikci v ledvinách, aktivaci RAAS sytému a zvýšení produkce vazopresinu, které způsobují retenci sodíku a vody. Důsledkem této aktivace je zvýšení cirkulujícího objemu plazmy a další prohlubování vazokonstrikce v ledvinách. Zvýšené nároky na srdeční myokard způsobují jeho hypertrofii a dilataci, která opět zhoršuje srdeční selhání. Zhoršení renálních funkcí a celková zánětlivá reakce, která srdeční selhání provází [33] a která způsobuje rezistenci na endogenní erytropoetin [23,34], prohlubují již přítomnou anémii. Cyklus se uzavírá.
Výše popsané interakce ale nemusí platit pro všechny pacienty, zejména ne pro ty akutně přijaté s de novo selháním, kteří nebyli doposud s ničím léčeni. U těchto subjektů je příliš krátká doba na rozvoj celého syndromu. To by mohl být důvod (kromě nízkého počtu pacientů 108), proč Formigovi et al [21] vstupní hemoglobin u de novo pacientů se srdečním selháním nevyšel jako prognostický marker. U de novo selhání se na výskytu anémie podílí spíše jiné přidružené faktory: věk, akutní retence tekutin, preexistující renální insuficience, např. diabetická, sideropenie, myelodysplazie, kachexie aj. [21]. Dle zjištění Cromieho et al [35] je většina anemických pacientů normocytárních a jejich sérové hladiny ferritinu, folátu a vitaminu B12 jsou normální. Jako etiologii anémie uvádí přítomnou renální insuficienci a hypotyreózu (obojí kolem 40%). Jiní autoři prováděli aspiraci kostní dřeně a zjistili, že sideropenie jako příčina anémie je přítomna u 73% anemických pacientů, ačkoliv jejich sérový ferritin je v normálním rozmezí [36]. Androne et al [20] zjistili, že 46% pacientů má anémii hemodiluční a pouze 54% má „pravou“ anémii. Ezekowitz et al zjistili 58% podíl anémie chronických chorob jako dominující etiologii [23]. Někteří autoři poukazují na negativní vliv ACE inhibitorů na hladinu hemoglobinu [37,38], který je reverzibilní a nezhoršuje prognózu pacientů. Užívání carvediolu ve studii Comet bylo také spojeno s vyšším výskytem anémie oproti metoprololové skupině [39]. Negativní vliv nesteroidních antiflogistik na hladinu hemoglobinu (možné chronické ztráty) byl také popsán [40]. Naše data pocházejí z registru, který neobsahuje informace o příčinách anémie. Nebylo by ani technicky možné během index hospitalizace provést všechna nutná vyšetření, včetně endoskopických.
Ze zaznamenaných dat je ale možné stanovit vliv vstupní medikace, laboratorních, hemodynamických i anamnestických parametrů na hospitalizační mortalitu (tab. 5). Výsledky jsou velmi variabilní, naznačují jisté trendy, které ale nedosahují vzhledem k nízkému n statistické významnosti. Výjimkou je nejpočetnější STEMI skupina, kde předléčení diuretikem, antiagregací a u těžce anemické skupiny i ACEI/sartanem bylo spojeno s vyšší hospitalizační mortalitou. Pacienti s touto medikací měli významně nižší hladinu hemoglobinu při přijetí (Hb 137,8 vs 132,9g/l, p < 0,001), což je v souladu s publikovanými daty. U chronické ICHS jsme u těžce anemické skupiny prokázali vysoce preventivní vliv beta blokátorů (OR 0,16). Při porovnání hladin hemoglobinu ale zjistíme, že u subjektů předléčených beta blokátorem byly i zde hodnoty nižší (136,7 vs 133,3g/l, p = 0,004). Z uvedeného vyplývá, že vztah mezi hladinou hemoglobinu a rizikem úmrtí za hospitalizace je velice komplexní. Naše tvrzení podporují i provedené korelace mezi hladinou Hb a věkem (–0,296), EF LK (–0,084), vstupní a minimální kreatininovou clearence (+0,364 a +0,344), cholesterolem (+0,233) a maximální hodnotou C reaktivního proteinu (–0,131), vše p < 0,05. Rovněž při rozdělení pacientů dle Killipovy škály se ukázalo, že pacienti s pravostranným městnáním (hepatomegalie, otoky DKK, plicní výpotky) a plicním edémem mají nižší hemoglobin než pacienti Killip II (Hb 132,9 a 132,1 vs 137,2g/l, p < 0,001), což svědčí o přítomné hemodiluci. Zda je anémie pouze markerem pokročilosti srdečního selhání, nebo je jedním z přímým etiologických faktorů, se dosud nepodařilo nikomu přesně určit.
Ve srovnání s publikovanými pracemi Felkera [14] a Nordyka [15] jsme se zaměřili více na vztah mezi hladinou hemoglobinu a etiologií selhání, kterou tyto práce nezohlednily. Felker et al analyzovali 906 pacientů s ejekční frakcí levé komory pod 25%, s dekompenzací CHSS, s vyloučením pacientů s AKS v posledních 3 měsících a pacientů s těžkým renálním selháním. Průměrný Hb byl 126g/l, věk 66 let. Hospitalizační mortalita pro skupiny pacientů s Hb (g/l) < 113, Hb = 114–139 a Hb > 139 byla 6,1%, 2,4% a 1,4% (p < 0,05). Nordyke et al zahrnuli 8 569 subjektů, s průměrným Hb 124g/l, věkem 76 let. Mortalita souboru ve skupinách s Hb (g/l) < 100, Hb = 101–119 a Hb > 120 dosáhla 10,1%, 7,4% a 6,1% (p < 0,001). Vypočtené OR pro pokles Hb o 10g/l bylo 1,087 (8,7% zvýšení rizika úmrtí, multivariantní analýza). V našem souboru byla celková mortalita 4 nejčastějších etiologických skupin mnohem vyšší, dosáhla 28,8–15,0–12,4% pro pacienty těžce, lehce anemické a neanemické, což je dáno specializací našeho centra na akutní koronární syndromy, a tedy jistou selekcí populace. V univariantní analýze jsme pro vzestup Hb o 10g/l zjistili významné snížení rizika hospitalizačního úmrtí u STEMI o 18%, nonSTEMI o 20% a dilatační KMP o 53% (tab. 5). Chronická ICHS vykazovala pouze trend k lepší prognóze.
Limitace
Naše analýzy jsou univariantní, proto výsledný vliv hemoglobinu na úmrtnost může být nadhodnocen, neboť nebyly zahrnuty proměnné jako hladina kreatininu, etiologie, stupeň NYHA, EF LK aj., které sekundárně ovlivňují jak hladinu Hb, tak i přímo mortalitu [19,37,41], což jsme pozorovali také u našich pacientů. Data pocházející z jednoho specializovaného kardiologického centra tedy nezahrnují všeobecnou populaci. Použili jsme jen první stanovený hemoglobin, nemůžeme tedy rozlišit anémii akutní, přechodnou nebo chronickou [42]. Přesné příčiny anémie jsme u našeho souboru nezkoumali.
Na rozdíl od jiných autorů naše práce zahrnuje 100% konsekutivních pacientů přijatých na naši kliniku v průběhu 33 měsíců, zařazených dle definovaných kritérií a systémem osobní kontroly propouštěcích zpráv. Nedochází zde tedy k takovému selekčnímu bias jako u výběrů dle zdravotnických kódů.
Závěr
Vstupní hladina hemoglobinu u pacientů hospitalizovaných pro akutní srdeční selhání je dalším možným stratifikačním markerem hospitalizační mortality. Ve skupině 4 nejčastějších etiologií selhání – STEMI, nonSTEMI, chronická ICHS a dilatační KMP –, reprezentujících 69% všech pacientů, je patrný trend k vyšší mortalitě u nižšího hemoglobinu. Nejvýznamnější je u dilatační KMP, kde za hospitalizace umírá pouze 1,5% pacientů bez anémie, ale 33% těžce anemických pacientů. „U shape“ závislost jsme neprokázali. Vzhledem k variabilitě pacientů se srdečním selháním a možným příčinným vztahům mezi hladinou hemoglobinu a přidruženými faktory (malnutrice, renální nedostatečnost, míra zavodnění, hormonální změny, chronická onemocnění, medikace) bude nutné k definitivnímu určení vlivu hemoglobinu na mortalitu provést multivariační analýzy s vyšším počtem pacientů.
Podpořeno výzkumným záměrem MSM 0021622402 a grantem IGA MZ ČR NS 9880-3.
MU Dr. Roman Miklík
www.fnbrno.cz
e-mail: romanmiklik@yahoo.com
Zdroje
1. Kawashiro N, Kasanuki H, Ogawa H et al. Clinical characteristics and outcome of hospitalized patients with congestive heart failure – results of the HIJC ‑ HF registry. Circ J 2008; 72 : 2015 – 2020.
2. Perna ER, Barbagelata A, Grinfeld L et al. Overview of acute decompensated heart failure in Argentina: lessons learned from 5 registries during the last decade. Am Heart J 2006; 151 : 84 – 91.
3. Adams KF Jr, Fonarow GC, Emerman CL et al. Characteristics and outcomes of patients hospitalized for heart failure in the United States: Rationale, design, and preliminary observations from the first 100,000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE). Am Heart J 2005; 149 : 209 – 216.
4. Špinar J, Aschermann M, Al ‑ Hiti H et al. Acute heart failure databases in specialist departments of cardiology (AHEAD registry). Cor Vasa 2008; 50 : 12 – 21.
5. Siirilä ‑ Waris K, Lassus J, Melin J et al. Characteristics, outcomes, and predictors of 1‑year mortality in patients hospitalized for acute heart failure. Eur Heart J 2006; 27 : 3011 – 3017.
6. Zannad F, Mebazaa A, Juillière Y et al. Clinical profile, contemporary management and one‑year mortality in patients with severe acute heart failure syndromes: The EFICA study. Eur J Heart Fail 2006; 8 : 697 – 705.
7. Cleland JG, Swedberg K, Follath F et al. The EuroHeart Failure survey programme – A survey on the quality of care among patients with heart failure in Europe. Part 1: Patient characteristics and diagnosis. Eur Heart J 2003; 24 : 442 – 463.
8. Nieminen MS, Brutsaert D, Dickstein K et al. EuroHeart Failure Survey II (EHFS II): A survey on hospitalized acute heart failure patients: Description of population. Eur Heart J 2006; 27 : 2725 – 2736.
9. Follath F, Delgado JF, Mebazaa A et al. Classifying patients with acute heart failure: Presentation, treatment and outcome. A ten country survey of acute heart failure management (ALARM ‑ HF). Eur J Heart Fail Suppl 2008; 7 : 64.
10. Miklík R, Pařenica J, Felšoci M et al. Levosimendan v léčbě akutního srdečního selhání – zkušenosti z kardiologické kliniky. Cor Vasa 2009; 51 : 507 – 512.
11. Fonarow GC, Adams KF Jr, Abraham WT et al. ADHERE Scientific Advisory Committee SGaI. Risk Stratification for in‑hospital mortality in acutely cecompensated heart failure: classification and regression rree analysis. JAMA 2005; 293 : 572 – 580.
12. Gagnon DR, Zhang TJ, Brand FN et al. Hematocrit and the risk of cardiovascular disease – The Framingham study: a 34‑year follow‑up. Am Heart J 1994; 127 : 674 – 682.
13. Silverberg DS, Wexler D, Blum M et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function and functional cardiac class, and markedly reduces hospitalizations. J Am Coll Cardiol 2000; 35 : 1737 – 1744.
14. Felker GM, Gattis WA, Leimberger JD et al. Usefulness of anemia as a predictor of death and rehospitalization in patients with decompensated heart failure. Am J Cardiol 2003; 92 : 625 – 628.
15. Nordyke RJ, Kim JJ, Goldberg GA et al. Impact of anemia on hospitalization time, charges, and mortality in patients with heart failure. Value Health 2004; 7 : 464 – 471.
16. Tang YD, Katz SD. The prevalence of anemia in chronic heart failure and its impact on the clinical outcomes. Heart Fail Rev 2008; 13 : 387 – 392.
17. World Health Organization. Nutritional anaemias: report of a WHO Scienific Group. Geneva: World Health Organization 1968.
18. IV. NKF ‑ K/ DOQI Clinical Practice Guidelines for Anemia of Chronic Kidney Disease: update 2000. Am J Kidney Dis 2001; 37 (Suppl 1): S182 – S235.
19. Maggioni AP, Opasich C, Anand I et al. Anemia in patients with heart failure: prevalence and prognostic role in a controlled trial and in clinical practice. J Card Fail 2005; 11 : 91 – 98.
20. Androne AS, Katz SD, Lund L et al. Hemodilution is common in patients with advanced heart failure. Circulation 2003; 107 : 226 – 229.
21. Formiga F, Chivite D, Castañer O et al. Anemia in new‑onset congestive heart failure inpatients admitted for acute decompensation. Eur J Intern Med 2006; 17 : 179 – 184.
22. Dunlay SM, Weston SA, Redfield MM at al. Anemia and heart failure: a community study. Am J Med 2008; 121 : 726 – 732.
23. Ezekowitz JA, McAlister FA, Armstrong PW. Anemia is common in heart failure and is associated with poor outcomes: Insights from a cohort of 12 065 patients with new‑onset heart failure. Circulation 2003; 107 : 223 – 225.
24. Kosiborod M, Curtis JP, Wang Y et al. Anemia and outcomes in patients with heart failure: a study from the National Heart Care Project. Arch Intern Med 2005; 165 : 2237 – 2244.
25. Kosiborod M, Smith GL, Radford MJ et al. The prognostic importance of anemia in patients with heart failure. Am J Med 2003; 114 : 112 – 119.
26. Nilsson ‑ Ehle H, Jagenburg R, Landahl S et al. Blood haemoglobin declines in the elderly: Implications for reference intervals from age 70 to 88. Eur J Haematol 2000; 65 : 297 – 305.
27. Dickstein K, Cohen ‑ Solal A, Filippatos Get al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. Eur Heart J 2008; 29 : 3069.
28. Špinar J, Špinarová L, Vítovec J. The diagnosis, epidemiology, and prognosis of acute heart failure. Cor Vasa 2008; 50 : 171 – 175.
29. Silverberg DS, Wexler D, Blum M et al. The correction of anemia in severe resistant heart failure with erythropoietin and intravenous iron prevents the progression of both the heart and the renal failure and markedly reduces hospitalization. Clin Nephrol 2002; 58 (Suppl 1): S37 – S45.
30. Grune T, Sommerburg O, Siems WG. Oxidative stress in anemia. Clin Nephrol 2000; 53 (Suppl 1): S18 – S22.
31. Siems WG, Sommerburg O, Grune T. Erythrocyte free radical and energy metabolism. Clin Nephrol 2000; 53 (Suppl 1): S9 – S17.
32. Anand IS, Chandrashekhar Y, Wander GS et al. Endothellium ‑ derived relaxing factor is important in mediating the high output state in chronic severe anemia. J Am Coll Cardiol 1995; 25 : 1402 – 1407.
33. Opasich C, Cazzola M, Scelsi L et al. Blunted erythropoietin production and defective iron supply for erythropoiesis as major causes of anaemia in patients with chronic heart failure. Eur Heart J 2005; 26 : 2232 – 2237.
34. Volpe M, Tritto C, Testa U et al. Blood levels of erythropoietin in congestive heart failure and correlation with clinical, hemodynamic, and hormonal profiles. Am J Cardiol 1994; 74 : 468 – 473.
35. Cromie N, Lee C, Struthers AD. Anaemia in chronic heart failure: What is its frequency in the UK and its underlying causes? Heart 2002; 87 : 377 – 378.
36. Nanas JN, Matsouka C, Karageorgo-poulos D et al. Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol 2006; 48 : 2485 – 2489.
37. Anand IS, Kuskowski MA, Rector TS et al. Anemia and change in hemoglobin over time related to mortality and morbidity in patients with chronic heart failure: Results from Val ‑ HeFT. Circulation 2005; 112 : 1121 – 1127.
38. Ishani A, Weinhandl E, Zhao Z et al. Angiotensin‑converting enzyme inhibitor as a risk factor for the development of anemia, and the impact of incident anemia on mortality in patients with left ventricular dysfunction. J Am Coll Cardiol 2005; 45 : 391 – 399.
39. Komajda M, Anker SD, Charlesworth A et al. The impact of new onset anaemia on morbidity and mortality in chronic heart failure: results from COMET. Eur Heart J 2006; 27 : 1440 – 1446.
40. Caramelo C, Just S, Gil P. Anemia in heart failure: pathophysiology, pathogenesis, treatment, and incognitae. Rev Esp Cardiol 2007; 60 : 848 – 860.
41. Sharma R, Francis DP, Pitt B et al. Haemoglobin predicts survival in patients with chronic heart failure: a substudy of the ELITE II trial. Eur Heart J 2004; 25 : 1021 – 1028.
42. Tang WH, Tong W, Jain A et al. Evaluation and long‑term prognosis of new‑onset, transient, and persistent anemia in ambulatory patients with chronic heart failure. J Am Coll Cardiol 2008; 51 : 569 – 576.
43. McClellan WM, Flanders WD, Langston RD et al. Anemia and renal insufficiency are independent risk factors for death among patients with congestive heart failure admitted to community hospitals: a population‑based study. J Am Soc Nephrol 2002; 13 : 1928 – 1936.
44. Ceresa M, Capomolla S, Pinna G et al. Anemia in chronic heart failure patients: Comparison between invasive and non-invasive prognostic markers. Monaldi Archives for Chest Disease – Cardiac Series 2005; 64 : 124–133.
45. Baggish AL, van Kimmenade R, Bayes-Genis A et al. Hemoglobin and N-terminal pro-brain natriuretic peptide: Independent and synergistic predictors of mortality in patients with acute heart failure. Results from the International Collaborative of NT-proBNP (ICON) Study. Clin Chim Acta 2007; 381 : 145–150.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Je syndrom polycystických ovarií součástí autoimunitních onemocnění? – editorial
- Problematika časné defibrilace – editorial
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
- Evaluation of cardiovascular high risk population in Specialists Ambulance: ESA
- Prevalence anémie a vliv na hospitalizační mortalitu pacientů přijatých pro akutní srdeční selhání
- Vývoj autonomních parametrů u pacientů po infarktu myokardu s ST elevacemi
- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Srdce nemocného s diabetem 1. typu
- Rozdiely medzi pohlaviami v nefarmakologickej liečbe chronického srdcového zlyhávania
- Doporučení ILCOR pro označení automatizovaných externích defibrilátorů (AED)
- Angiologické dny 2010
- Prof. MU Dr. Jiří Widimský, DrSc., FESC, FAHA, člen České lékařské akademie, se dožívá 85 let
-
Müllerová D et al. Obezita – prevence a léčba. Praha: Mladá fronta, a.s. 2009. 261 stran.
ISBN 978- 80- 204- 2146- 3. -
Cetkovský P, Kouba M et al. Diferenciální diagnostika plicních infiltrátů a pokroky v léčbě mykotických infekcí u imunokompromitovaných pacientů. Praha: Triton 2009. 259 stran.
ISBN 978- 80- 7378- 343- 1. -
XXIX. dni mladých internistov Martin, Slovenská republika, 27.– 28. 5. 2010
Zborník abstraktov
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



