-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLéčba chronické myeloidní leukemie (CML) v éře imatinibu
Treatment of chronic myeloid leukemia in era of imatinib
Authors introduce their review with description of historic achievements that enabled to reach the actual stage of knowledge on ethiopathogenesis of chronic myeloid leukemia (CML), to synthetize first tyrosine kinase inhibitor – imatinib (Glivec, IM) and to develop the revolutionary targeted treatment of CML. Targeted therapy has both completely changed prognosis of patients with CML and stimulated further discoveries in ethiopathogenesis of other malignancies that was followed also by introduction of specific targeted treatment. Authors explain basic terms of cytogenetic and molecular evaluation of treatment results, determination of optimal therapeutic response and failure during targeted treatment of CML. They provide overview of imatinib failure management, experience with second generation tyrosine kinase inhibitors and review the actual role of allogeneic hematopoietic stem cell transplantation in CML. According to the recent recommendations for CML treatment issued by National Comprehensive Cancer Network (NCCN 1/2009) regular monitoring using highly sofisticated laboratory methods every 3 months is necessary. In case of failure monitoring should be even more frequent and possibility of participation in international trials may play an important role. Finaly, pitfalls of targeted treatment mainly treatment failure, intolerance and leukemic stem cell resistance to tyrosine kinase inhibitors are discussed. Continual research of mechanisms of resistance, development of new and reintroduction of „older“ drugs like interferon alpha provide substantial hope for the future CML management.
Key words:
chronic myeloid leukemia – Philadelphia chromosom – tyrosine kinase inhibitor – imatinib – dasatinib – nilotinib – cytogenetic response – molecular response – allogeneic hematopoietic stem cell transplantation
Autoři: K. Indrák; E. Faber; M. Jarošová
Působiště autorů: Hemato-onkologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Karel Indrák, DrSc.
Vyšlo v časopise: Vnitř Lék 2009; 55(Suppl 1)(Supplementum 1): 65-73
Souhrn
V úvodu přehledného článku se autoři věnují historickému sledu zásadních vědeckých výsledků, které umožnily dosáhnout současný stupeň poznatků o etiopatogenezi chronické myeloidní leukemie (CML), syntetizovat první inhibitor tyrozinových kináz – imatinib (Glivec, IM) a rozvinout revoluční koncepci cílené léčby CML. Tato léčba zásadně změnila nejen prognózu nemocných s CML, ale poskytla i návod k objasňování etiopatogeneze a využití cílené léčby u řady dalších nádorových chorob. Autoři vysvětlují základní pojmy genetického a molekulárně genetického hodnocení výsledků léčby, hodnocení optimální léčebné odpovědi a selhání léčby. Zmiňují nové možnosti léčby po selhání terapie inhibitorem tyrozinových kináz 1. generace imatinibem (IM), stručně informují o dosavadních zkušenostech s léčbou inhibitory tyrozinových kináz 2. generace a aktualizují pohled na místo alogenních transplantací krvetvorných buněk v léčbě CML. Na příkladu současných nejmodernějších léčebných doporučení pro léčbu CML z National Comprehensive Cancer Network (NCCN 1/2009) zdůrazňují skutečnost, že léčba CML inhibitory TK vyžaduje monitorování léčebné odpovědi pomocí vysoce sofistikovaných laboratorních metod, sledování nemocných v pravidelných 3měsíčních intervalech, resp. v případě selhání léčebné odpovědi i častěji, a to ve vysoce specializovaných centrech s mezinárodní spoluprací a možností zařazení nemocných do mezinárodních studií. Přes kladné hodnocení dosažených úspěchů zmiňují autoři i rezervy současné léčby – vznik lékové rezistence či intolerance a u signifikantní části nemocných neschopnost dosáhnout eradikace nádorového klonu. Naději na překonání těchto nedostatků přináší další výzkum zaměřený na objasnění mechanizmů rezistence, vývoj nových a renesance staronových léků, ke kterým patří interferon a, resp. zpřesnění indikace alogenní transplantace krvetvorných buněk.
Klíčová slova:
chronická myeloidní leukemie – Filadelfský chromozom – inhibitor tyrozinových kináz – imatinib – dasatinib – nilotinib – cytogenetická remise – molekulárně genetická remise – alogenní transplantace krvetvorných buněkÚvod
Ke klonální kumulaci leukocytů v krvi a v krvetvorných orgánech (kostní dřeň, slezina) dochází u nemocných s chronickou myeloidní leukemií (CML) v důsledku zvýšené proliferace a zpomalené maturace především neutrofilních granulocytů, inhibice jejich apoptózy a poruchy adhezivity k endotelu. Charakteristický obraz CML jako chronického onemocnění představují při diagnóze nevýrazné projevy nádorového bujení (pocení, váhový úbytek, zvýšená teplota). V laboratorním nálezu bývá v krevním obraze (KO) leukocytóza přesahující někdy až 200 × 109/l, posun v diferenciálním rozpočtu leukocytů doleva – někdy až po blasty, často basofilie, trombocytemie a vzácněji anémie. Téměř u poloviny nemocných je diagnóza stanovena náhodně, v rámci preventivního vyšetření KO.
Jedinou dosud potvrzenou patogenetickou příčinou CML je radiace – po výbuchu atomových bomb v Japonsku zde stoupl výskyt CML na dvojnásobek. Onemocnění má v Evropě incidenci kolem 1,0/100 000 nových případů ročně a medián věku nemocných při diagnóze se pohybuje kolem 60 let.
Onemocnění probíhá ve 3 fázích:
- Chronická fáze (CF) CML – je charakterizována zmnožením neutrofilních leukocytů s posunem doleva, někdy trombocytemií a mírnou splenomegalií. V této fázi mají nemocní většinou normální kvalitu života. Délka trvání CF CML se dá očekávat v rozsahu roků.
- Pokročilejším stadiem je akcelerovaná fáze (AF) CML, která bývá charakterizována zvětšováním sleziny, zvyšováním podílu blastů a promyelocytů v diferenciálním rozpočtu leukocytů, anemizací a někdy i poklesem počtu trombocytů. V AF nemocní s CML přežívají většinou jen měsíce a léčba této fáze CML je méně úspěšná než léčba nemocných v CF CML.
- Nejkritičtější, resp. terminální fází CML je její transformace do blastického zvratu (BZ), který se laboratorním nálezem v KO či v kostní dřeni neliší od obrazu akutní leukemie (≥ 20 % blastů). Prognóza BZ CML je ale výrazně horší než prognóza de novo akutní myeloidní leukemie (AML) s nadějí na přežití v rozpětí týdnů až měsíců. Mírně lepší prognózu mají nemocní s lymfoblastickým zvratem CML (asi 20 %) než nemocní s myeloblastickým zvratem CML (asi 80 %).
Historické poznatky o etiopatogenezi CML – odrazový můstek moderní cílené léčby
CML je možno označit za prominentní onkologické onemocnění. Roku 1960 publikovali P. Nowel a D. Hungerford v časopise Science článek s názvem „A minute chromosome in human granulocytic leukemia“ [1]. Jako první v něm popsali, že u nemocných s CML se v G-skupině chromozomů vyskytuje abnormálně malý chromozom. Tomuto chromozomu se od té doby říká chromozom Filadelfský (Ph1). Identifikace Ph1 chromozomu u nemocných s CML byla vůbec prvním popisem souvislosti mezi cytogenetickou změnou a nádorem u člověka. Můžeme proto s mírnou nadsázkou říci, že nález Ph1 chromozomu fakticky odstartoval i éru nádorové cytogenetiky.
Pokud se soustředíme jen na problematiku CML, byl nález Ph1 chromozomu základním stavebním kamenem dnešní mozaiky poznatků o etiopatogenezi CML. Další poznatky umožnil prudký rozvoj vysoce sofistikovaných technologií a jejich aplikace v cytogenetice, molekulární cytogenetice, molekulární biologii, tkáňových kulturách, pokusech na zvířatech atd. Jen ve zkratce si dovolíme vyjmenovat některé dílčí kameny tvořící základ mozaiky dnešního poznání o etiopatogenezi CML:
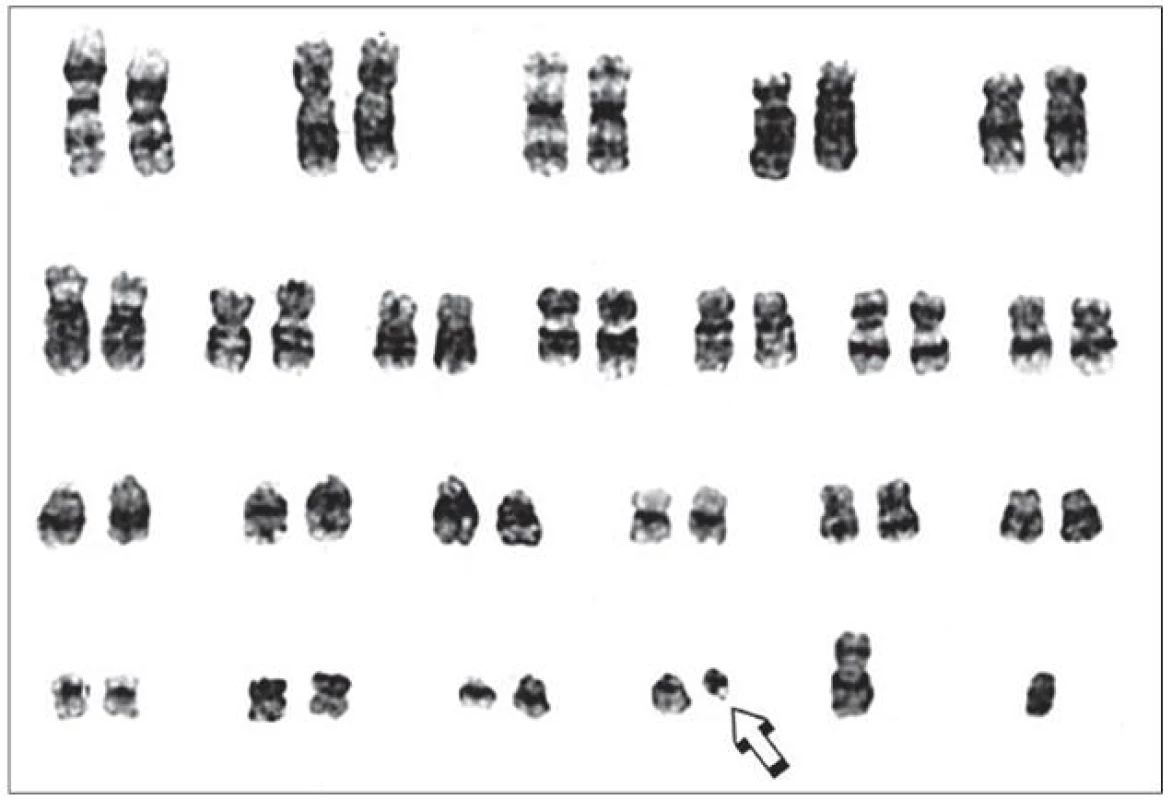
- V roce 1973 publikovala J. Rowley v časopise Nature „Letter“: „A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining“ [2]. V něm přesně identifikovala, že Ph1 chromozom je výsledkem reciproké translokace mezi chromozomy 9 a 22 – t(9;22)(q34;q11) (obr. 1).
- V roce 1982 byl na lidském chromozomu 9 identifikován gen ABL, který je lidským homologem virového onkogenu Abelsonovi myší leukemie.
- V letech 1982–1985 zjistili Heisterkamp, Ben-Neriah a Canaani, že translokací genetického materiálu mezi geny 9 a 22 vzniká na chromozomu 22 fúzní gen BCR-ABL produkující protein Bcr-Abl s konstitutivní tyrozinkinázovou aktivitou.
- Zásadní článek publikoval v časopise Science Daley GQ et al v roce 1990: „Induction of chronic myelogenous leukemia in mice by the P210bcr/abl gene of the Philadelphia chromosome.“ [3]. V něm přesvědčivě ukázal, že gen BCR-ABL přenesený pomocí retroviru do myši je schopen vyvolat myší CML.
- V letech 2003–2004 bylo zjištěno, že tyrozinkinázová aktivita BCR-ABL se podílí na nitrobuněčném signálním přenosu [4] a hraje významnou roli v růstovém zvýhodnění leukemických buněk [5–7]. Ph1 chromozom a fúzní gen BCR-ABL se staly rozhodujícím diagnostickým znakem, který identifikuje 95 % nemocných s CML a poznatky o jeho působení vedly k syntetizaci účinných léčiv schopných blokovat konstitutivní tyrozinkinázovou aktivitu Bcr-Abl vyvolávající CML.
Vývoj léčby CML
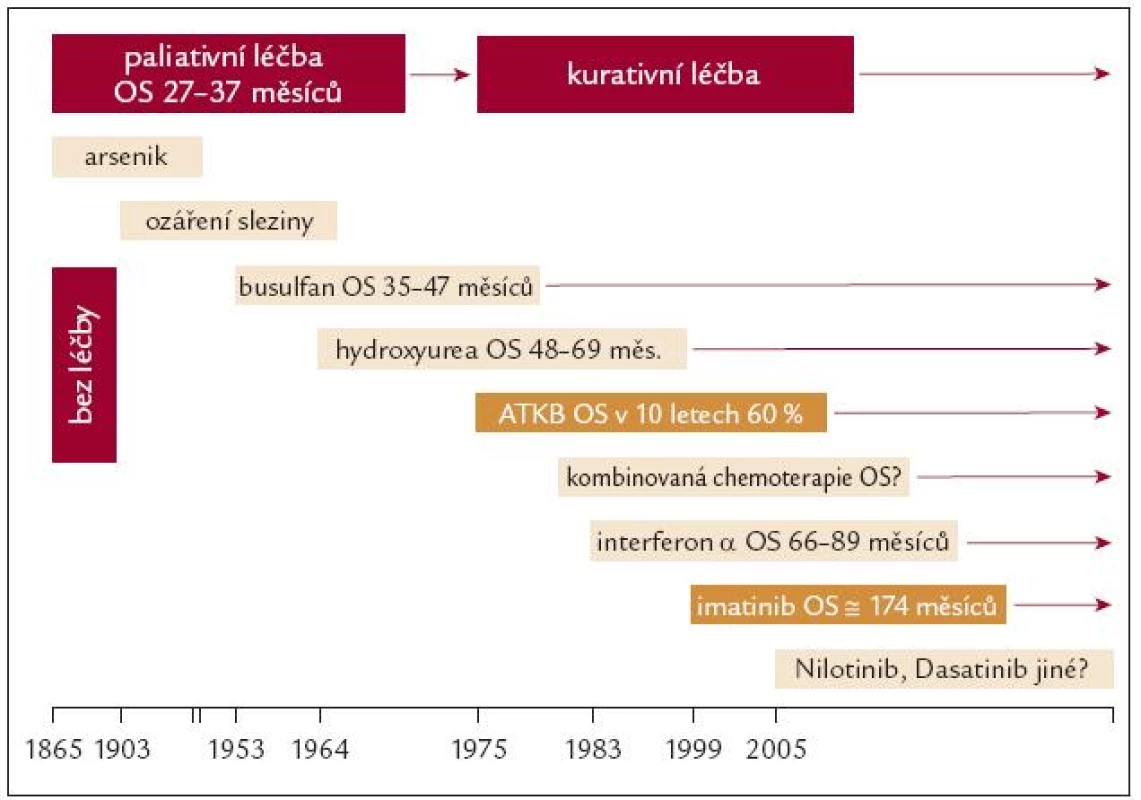
Do 60. let minulého století byla léčba CML pouze paliativní (arsenik, ozáření sleziny, busulfan) s mediánem celkového přežití (OS) nemocných 27–47 měsíců (obr. 2). Mírné prodloužení OS s mediánem 48–69 měsíců přinesla koncem 70. let minulého století hydroxyurea. Ta přechodně umožnila normalizovat nemocným v CF CML hodnoty KO, ale většinou neměla zásadnější vliv na podíl Ph1 klonu v krvetvorné populaci. Naději na vyléčení přinesla pro 60 % nemocných z úzce indikačně vymezené skupiny pacientů v polovině 70. let minulého století alogenní transplantace krvetvorných buněk (ATKB). Kolem 40 % nemocných však tento zákrok přes přísná indikační kritéria a maximální dostupnou podpůrnou léčbu nepřežilo! K základním indikačním omezením pro ATKB patřila dostupnost vhodného dárce v rodině nebo v registrech dárců a také věk nemocného (≤ 45–55 roků) – zde je nutno si uvědomit, že medián věku nemocných při diagnóze CML je 60 let! Absolutní většina nemocných (asi 85 %) buď nesplňovala indikační kritéria, nebo nenašla vhodného HLA identického dárce KB! Pokrok pro léčbu části nemocných s CML přineslo odhalení léčebné účinnosti interferonu a (IFN), který byl na rozdíl od hydroxyurey schopen navodit vedle normalizace hodnot KO i cytogenetickou odpověď a prodloužil medián OS nemocných v CF CML na 66–89 měsíců. Léčba však byla provázena řadou známých nežádoucích účinků IFN.
Roku 1992 byl ve firmě Ciba-Geigy syntetizován účinný ABL kinázový inhibitor CGP57148, později nazvaný STI571, imatinib (IM), u nás v současnosti komerčně dostupný pod názvem Glivec. Ten se specificky váže na inaktivní konformaci Bcr-Abl tyrozinové kinázy (TK), stabilizuje ji v neaktivní podobě, a blokuje tím její konstitutivní aktivitu [8] (obr. 3). Imatinib tak blokuje patologickou aktivaci signálních drah podílejících se na patogenezi CML. Klinické studie iniciované B. Drukerem ukázaly, že se jedná o vysoce účinnou látku. Pragmatickým potvrzením její účinnosti byla neuvěřitelná rychlost, s jakou byl IM po svém objevení převeden z fáze in vitro testů do klinických studií fáze I a II, do nejzávažnější a do dnešního dne nejsledovanější mezinárodní randomizované studie fáze III – IRIS (International Randomized Study of Interferon Versus STI571) a konečně do klinické praxe. Zásadní změny v léčbě CML, které IM počátkem 21. století odstartoval, daly této etapě léčby CML název „éra imatinibu“.
Obr. 3. Imatinib blokuje vazbu ATP k abl tyrozinové kináze. 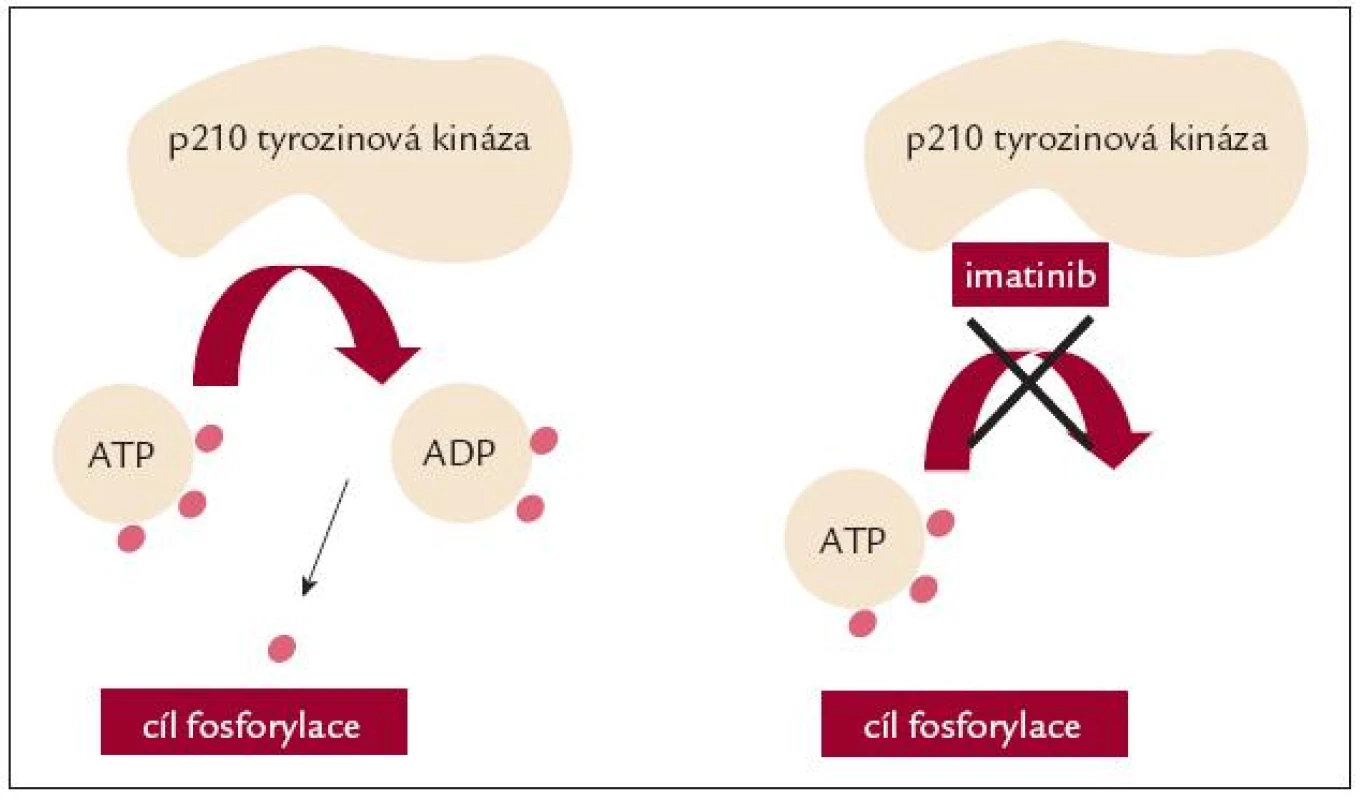
Éra imatinibu
Do 2 ramen studie fáze III IRIS bylo od června roku 2000 do ledna roku 2001 randomizováno 1 106 pacientů v CF CML prakticky z celého světa. Pro nemocné v rameni s IM byla plánována dávka IM 400 mg/den (obr. 4).
Obr. 4. Schéma studie IRIS a stav nemocných po 6 letech. 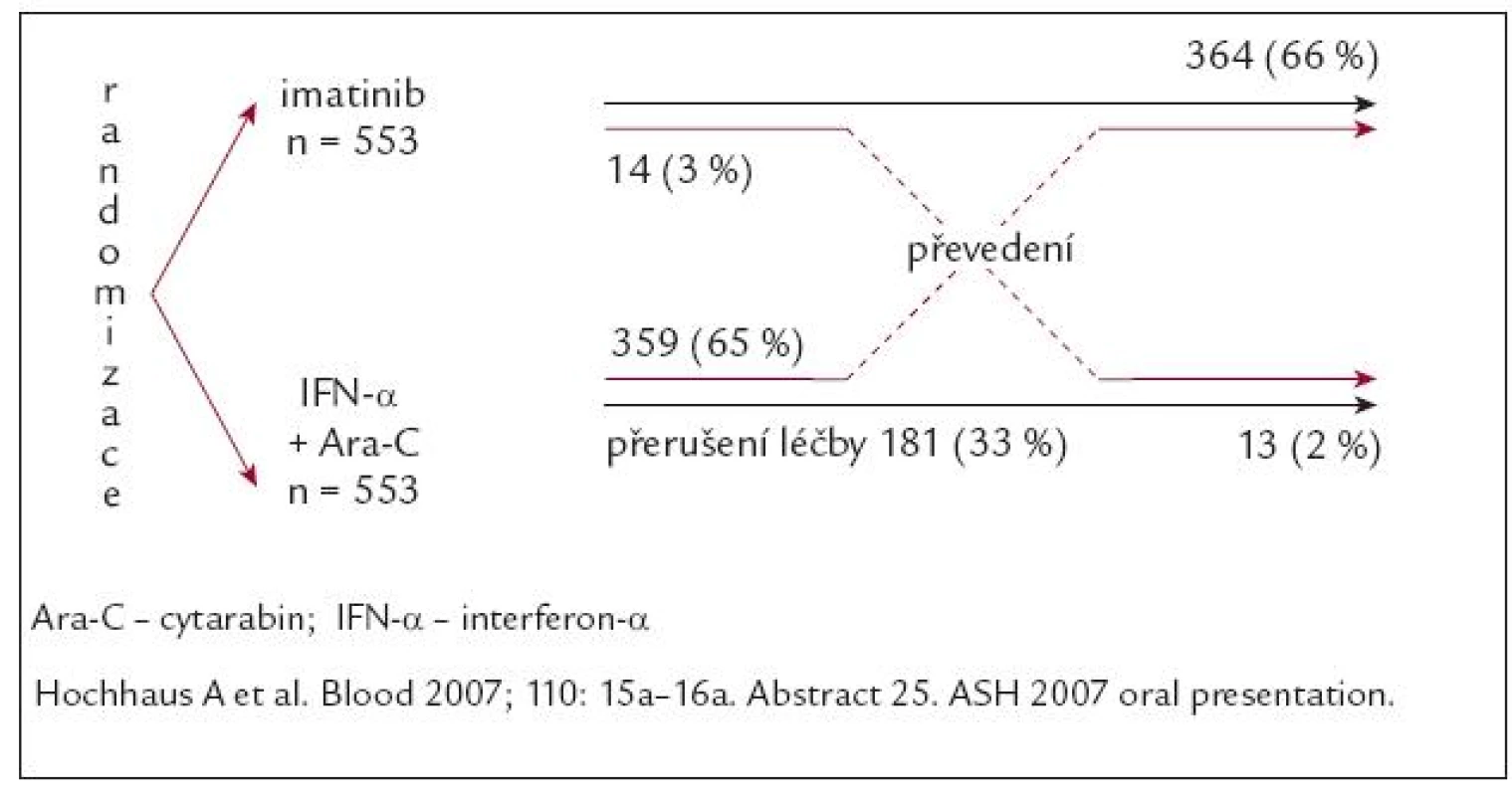
S ohledem na chronický průběh CML a medián přežití nemocných léčených IFN 66–89 měsíců, resp. s ohledem na 5leté přežívání 60 % nemocných po ATKB, jsou výsledky studie IRIS i nadále sledovány s velkou pozorností. Aktualizované výsledky studie IRIS po 7 letech sledování ukázaly [9], že pravděpodobnost celkového přežití (OS) nemocných v CF CML je 86 % (obr. 5) a pravděpodobnost přežití bez progrese choroby do AF/BZ nebo úmrtí (EFS) je 81 %. Pokud se hodnotí pouze progrese CF CML do AF/BZ, lze konstatovat, že k akceleraci nemoci došlo po 7 letech jen u 7 % nemocných! V rámci programu rozšířené dostupnosti byl IM koncem roku 2000 uvolněn pro léčbu českých nemocných na 2 českých pracovištích. Dosažené výsledky byly publikovány v letech 2003 a 2004 [10,11].
Obr. 5. Studie IRIS – 7 let sledování. Celkové přežití (OS) pacientů léčených imatinibem. 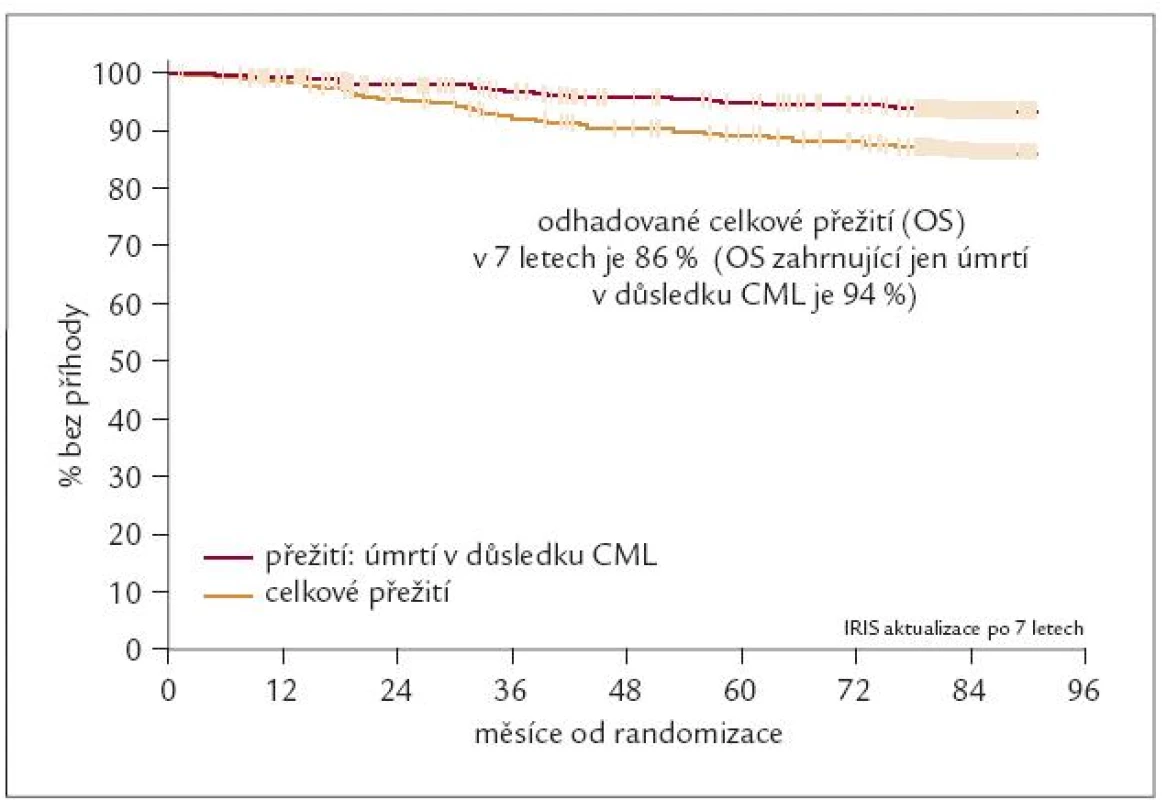
Analýzy klinických a laboratorních výsledků studie IRIS a dalších studií fáze I a II s léčbou nemocných v AF a v BZ umožnily skupině expertů z celého světa sdružených v rámci Evropské leukemické sítě (ELN) již po 5 letech sledování nemocných v CF CML ve studii IRIS formulovat v roce 2006 návrh ucelené, ale novým poznatkům otevřené koncepce léčby CML [12]. Doporučení pro diagnostiku, léčbu a sledování CML publikovala podobná skupina autorů i v rámci European Society for Medical Oncology (ESMO) [13], doporučení opírající se o podrobné průběžné analýzy jsou implementovány i do každoročně aktualizovaných diagnostických a léčebných doporučení National Comprehensive Cancer Network (NCCN) [14] a v roce 2008 byla zahrnuta i do doporučených diagnostických a léčebných postupů pro CML Českou hematologickou společností ČLS JEP [15].
Všechna současná česká i mezinárodní doporučení se shodují v závěru, že léčba CML imatinibem je vysoce účinná a bezpečná. Všeobecná shoda je i v doporučení, že IM je lékem první volby v léčbě CF CML, kde má přednost před ostatními alternativními léčebnými postupy – nevyjímaje alogenní transplantace krvetvorných buněk (ATKB). Toto doporučení a léčebná očekávání IM se téměř okamžitě projevila v reakci všech evropských pracovišť léčících CML v CF poklesem alogenních transplantací u CML (obr. 6).
Obr. 6. Pokles transplantační aktivity u CML v éře Glivecu. 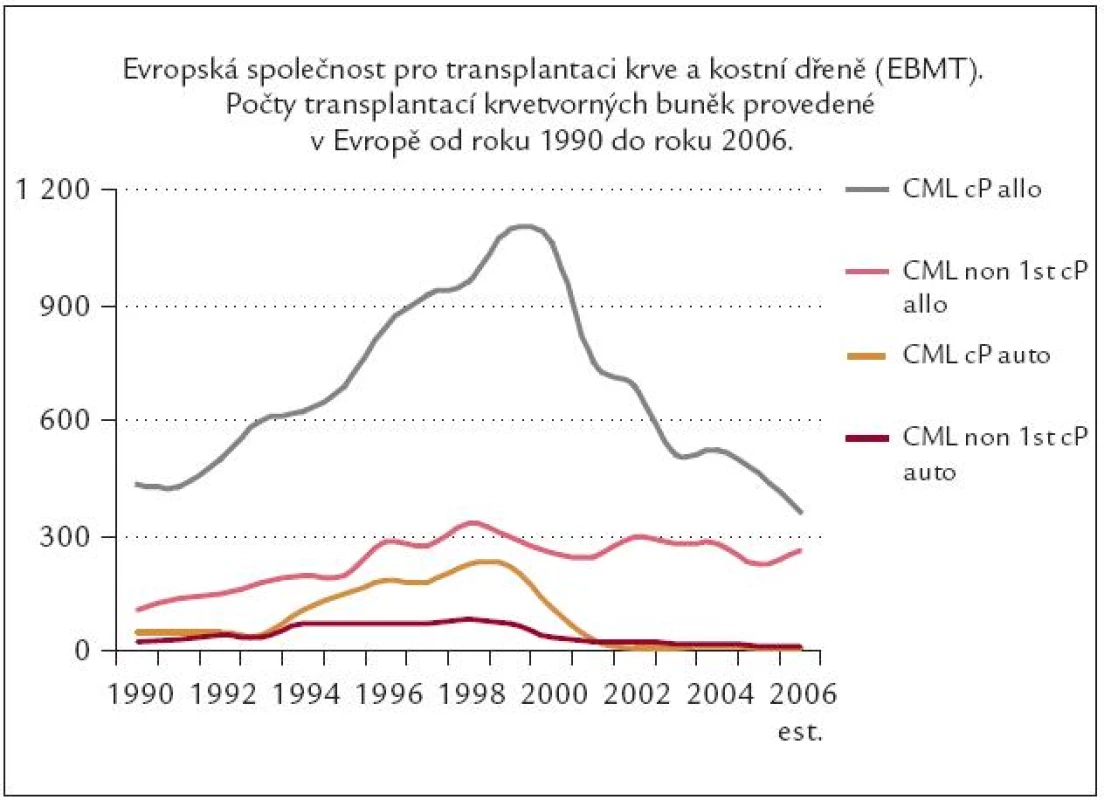
Zásadní řešená problematika léčby CML v éře imatinibu (IM)
1. U 25 % nemocných v CF CML léčba IM z nejrůznějších důvodů v různém časovém odstupu pravděpodobně selže nebo je nezbytné ji ukončit pro její netoleranci. Pro tyto nemocné je nezbytné hledat další léčebné možnosti. Proto je nutno pečlivě sledovat, zda je léčebná odpověď na imatinib v časové ose optimální, a pokud ne, pečlivě zvážit další léčebný postup. Mezinárodní doporučení se v hodnocení optimální léčebné odpovědi, resp. selhání léčby v časové ose od zahájení léčby, vcelku shodují.
Pozn.: Vysvětlení pojmů hematologická remise (HR), minimální (mCyR), parciální (PCyR), velká (VCyR) a kompletní (KCyR) cytogenetická remise a velké (VMR) a kompletní (KMR) molekulární remise přináší tab. 1a, kvantitativní počty leukemických buněk při diagnóze, cytogenetické a molekulární remisi a relapsu CML ukazuje schematicky obr. 7, současné názory na hodnocení účinnosti léčby, resp. selhání léčby v časovém intervalu od jejího zahájení, ukazuje tab. 1b.
Tab. 1a. Hematologické, cytogenetické a molekulárně genetické hodnocení léčebné odpovědi. 
Tab. 1b. Nedosažení optimální léčebné odpovědi v čase od zahájení léčby imatinibem nebo ztráta léčebné odpovědi. 
Obr. 7. Schematické znázornění celkového počtu Ph<sup>1</sup> pozitivních buněk v těle nemocného s CML v jednotlivých fázích choroby. 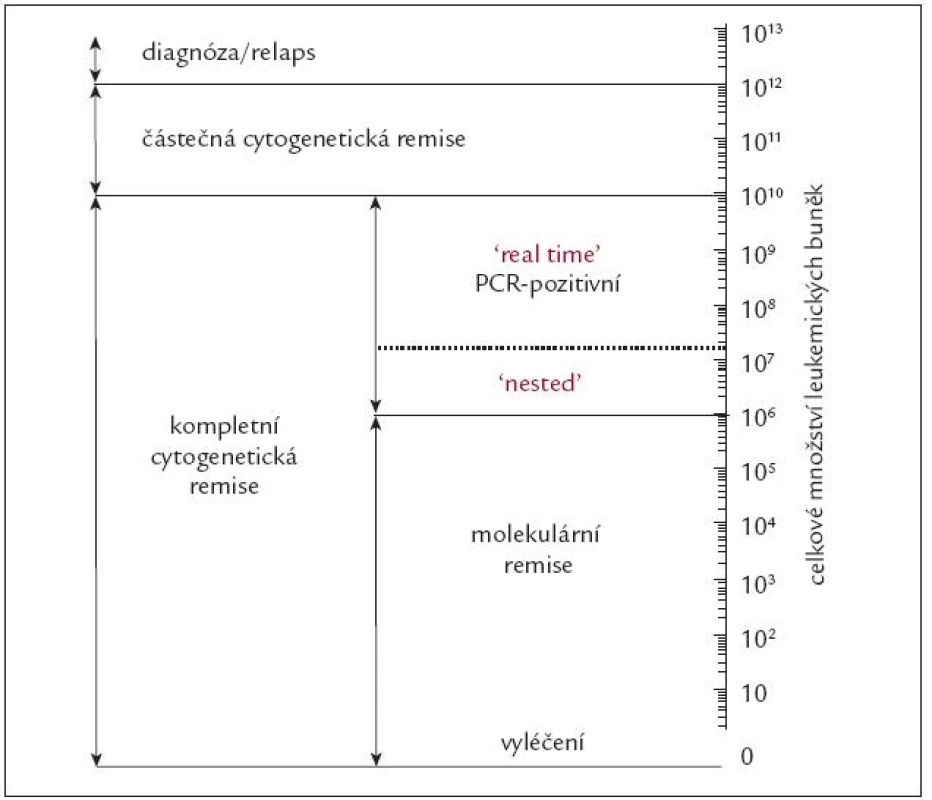
Z uvedeného je patrné, že základní podmínkou správně vedené cílené léčby CML inhibitory TK je dostupnost vysoce sofistikovaných a mezinárodně standardizovaných laboratorních vyšetření, průběžná kontrola nemocných v daných časových intervalech, správné vyhodnocení léčebné odpovědi a rozhodnutí o pokračování v další léčbě dle nejmodernějších, ale stále se ještě vyvíjejících léčebných doporučení (obr. 8). Důležitá je i účast příslušného centra léčícího nemocné s CML v národních, resp. mezinárodních randomizovaných studiích a možnost zařazení neadekvátně odpovídajících nemocných do klinických studií nebo alogenního transplantačního programu.
Obr. 8. Sledování nemocných s CML léčených inhibitory tyrozinových kináz. 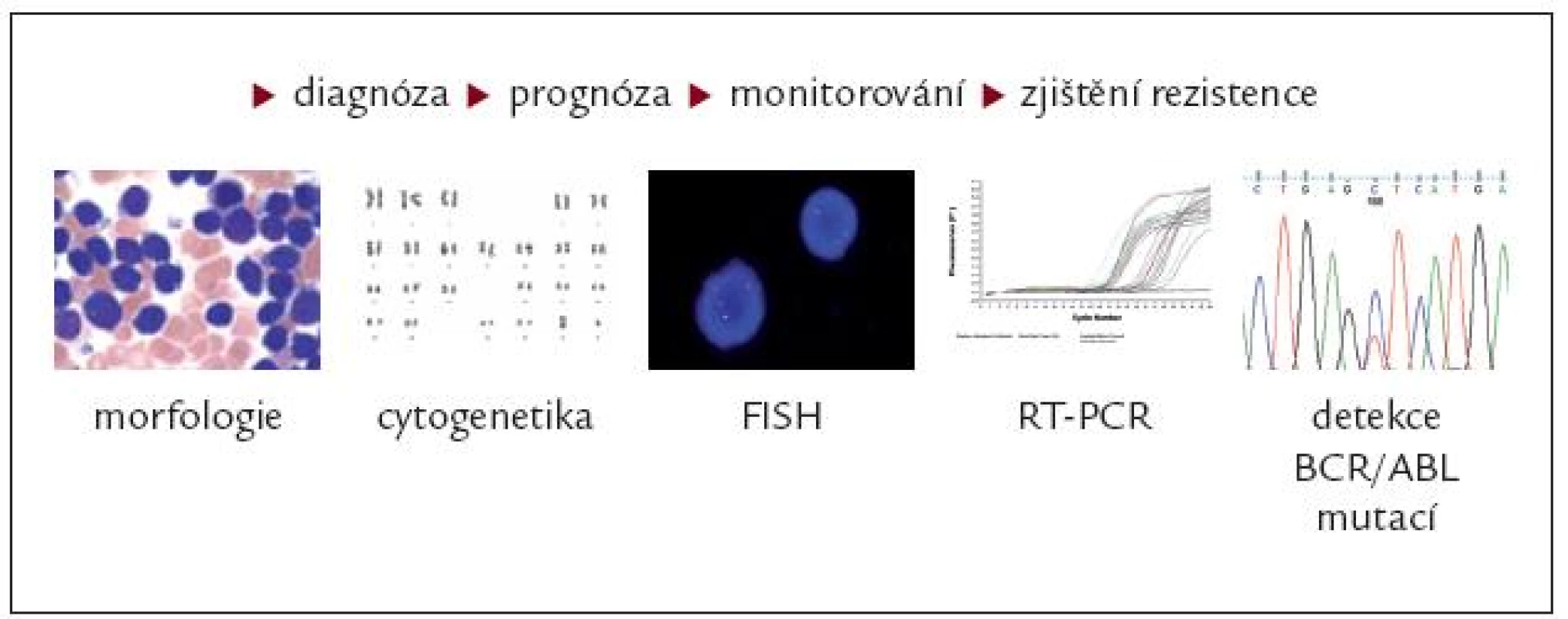
2. IM ve srovnání s léčbou IFN výrazně prodlužuje OS a EFS nemocných v CF CML (řádově o více než 10 roků), ale u signifikantní části nemocných pravděpodobně není schopen dosáhnout úplné eradikace nádorového klonu, a dosáhnout tak jejich definitivní vyléčení. Ve studii STIM (Stop Imatinib) byla analyzována možnost ukončení léčby IM na sestavě 50 nemocných s CML léčených nejméně 3 roky IM, kteří byli nejméně 2 roky v trvající KMR [16]. Cílem studie bylo zjistit, zda existují faktory, které by umožnily identifikovat nemocné s větším rizikem molekulárního relapsu choroby. Před zahájením léčby IM byla 1/2 nemocných předléčena IFN. U 18 nemocných došlo k molekulárnímu relapsu během prvních 6 měsíců, jen u jednoho nemocného nastal relaps po více než 6 měsících trvání KMR. Z 19 nemocných, u nichž došlo k relapsu, 11 nebylo předléčeno IFN. U žádného nemocného předléčeného IFN nevznikl molekulární relaps po 6 měsících od vysazení IM. Studie ukázala, že část nemocných v dlouhodobé KMR může zůstat v remisi i po vysazení IM. Úlohu předešlé léčby IFN pro udržení KMR bude nezbytné ověřit.
Neuspokojivé jsou výsledky léčby IM u nemocných v BZ CML. Na druhé straně ATKB sice vede u většiny nemocných k eradikaci nádorového klonu a dosahuje lepších výsledků u CML v AF či BZ, ale je vysoce toxická a je provázena významným rizikem mortality (obr. 9) (podle posledních publikovaných výsledků z nejúspěšnějších transplantačních center ve světě přežívá 5 let více než 70 % nemocných transplantovaných v 1. roce od diagnózy v CF CML). ATKB je ale indikována jen pro limitovaný počet nemocných splňujících především výše zmíněná věková indikační omezení a majících dostupného HLA identického dárce.
Obr. 9. Celkové přežívání nemocných rezistentních nebo netolerujících imatinib po různých dávkách tyrozinových kináz 2. generace – po dasatinibu. 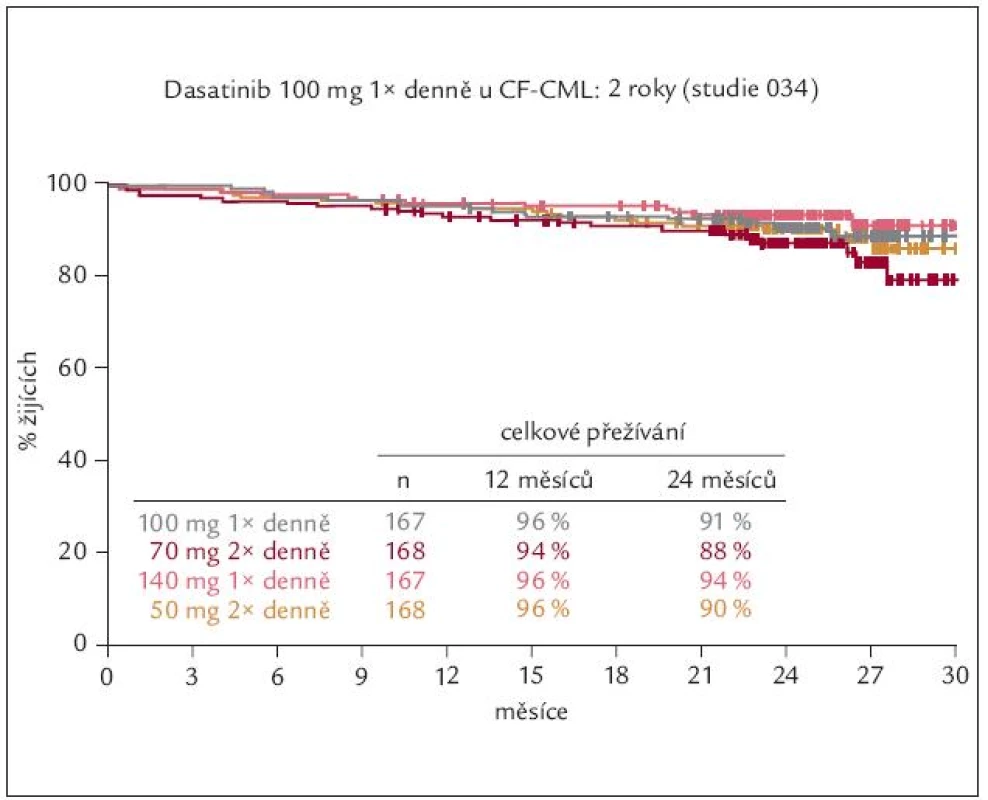
Další cíle v léčbě CML
- A) syntetizovat nové účinné cílené léky pro nemocné, u nichž selhala léčba IM
- B) najít cestu k úplné eradikaci nádorového klonu a vyléčení nemocných s CML
Inhibitory tyrozinových kináz 2. generace – nové účinné cílené léky pro léčbu nemocných, u nichž selhala léčba IM nebo kteří IM netolerují
1. Dasatinib (Sprycel) ve 2. linii léčby CML
Dasatinib (Sprycel®) je duální inhibitor Bcr-Abl a SRC kinázové rodiny (Lck, Fyn, Hck, Src). Aktivace SRC kináz se významně podílí i na vzniku řady dalších neoplazií. Dasatinib má v tkáňových kulturách asi 300krát vyšší inhibiční aktivitu na Abl kinázu než IM. Účinnost dasatinibu u 1 158 IM rezistentních nebo IM netolerujících nemocných v CF CML analyzovaly studie fáze II START-C a R [17,18]. V obou byla léčebná odpověď a délka jejího trvání podobné. Studie prokázaly, že dasatinibem lze u IM rezistentních nebo IM netolerujících nemocných dosáhnout během krátké doby vysoké procento VCyR a KCyR. Studie STAR-R navíc prokázala, že podání dasatinibu je u nemocných rezistentních ke standardním dávkám IM účinnější než eskalace dávky IM. Následná studie fáze III CA180-034 prokázala, že dasatinib v dávce 100 mg podávané jednou denně si uchovává plnou léčebnou účinnost při výrazné redukci nežádoucích účinků [19] (obr. 10). Medián doby do dosažení VCyR byl 12,4 týdne a medián doby do dosažení KCyR byl 13 týdnů. Po 24 měsících dosáhlo 63 % nemocných VCyR a 50 % nemocných KCyR a VCyR si udrželo 87 % a KCyR 89 % nemocných [20]. Po 2 letech přežívalo 91 % nemocných. Léčbu dasatinibem ukončilo pro toxicitu 12 % nemocných.
Obr. 10. Celkové přežívání nemocných rezistentních nebo netolerujících imatinib po různých dávkách tyrozinových kináz 2. generace – po nilotinibu. 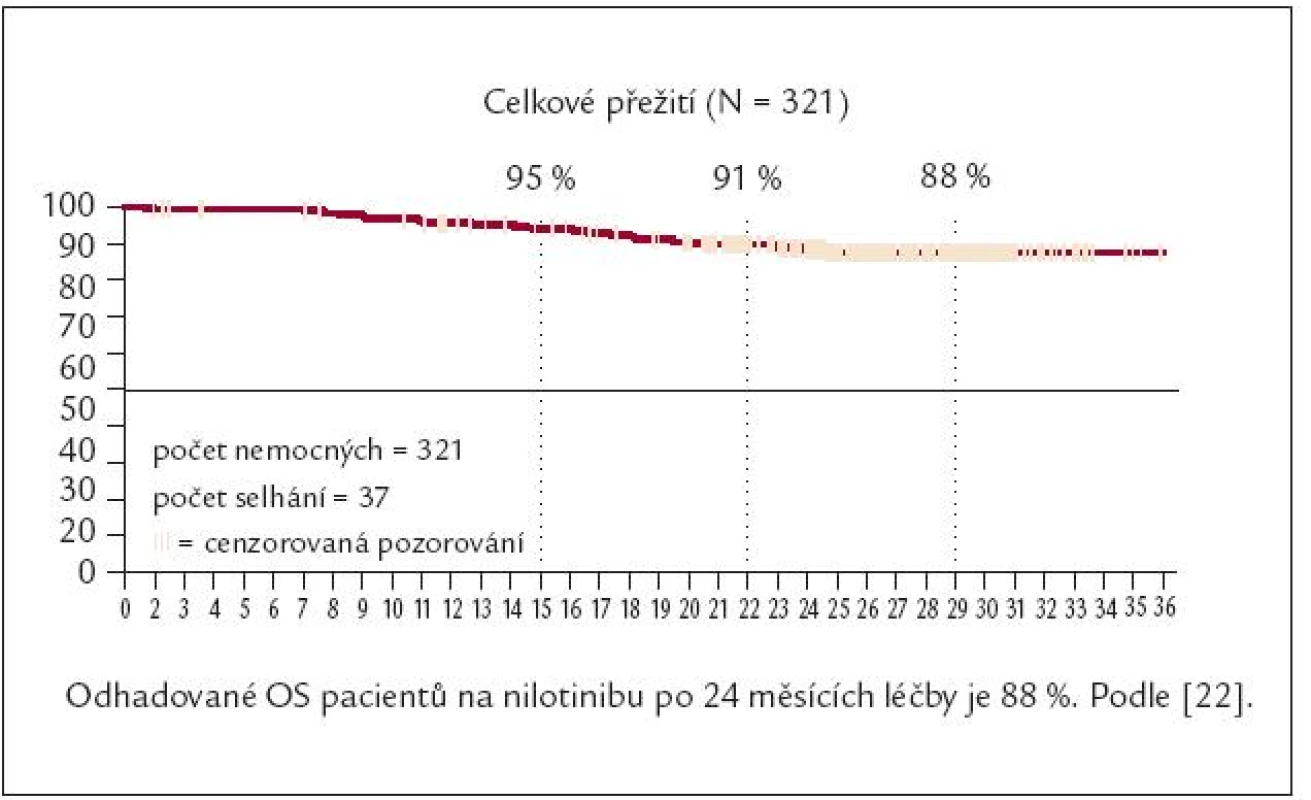
Analýza mutačních stavů provedená u 1 150 nemocných před zahájením léčby dasatinibem [21] odhalila 64 různých BCR-ABL mutací postihujících 49 aminokyselin. Ukázala, že dasatinib je vysoce účinný u všech BCR-ABL mutací s výjimkou mutace T315I.
2. Nilotinib (Tasigna) ve 2. linii léčby CML
Nilotinib (Tasigna®) je aminopyrimidinový derivát strukturou podobný IM. Jeho prostorové uspořádání a interakce nilotinibu s Abl kinázovou doménou zvyšují selektivitu inhibice a současně snižují blokádu jiných tyrozinových kináz (c-kit, PDGFR). Účinnost nilotinibu je v tkáňových kulturách ve srovnání s IM asi 25krát větší. Ve studii fáze II byla u 321 nemocných v CF CML rezistentních na IM nebo netolerujících IM analyzována účinnost a bezpečnost nilotinibu podávaného v dávce 2krát 400 mg denně [22]. V mediánu jednoho měsíce dosáhlo 58 % nemocných VCyR a 42 % dosáhlo KCyR. 84 % nemocných zůstává v VCyR po 18 měsících. Předpokládané přežití po 12 měsících je 95 % a po 18 měsících 91 % (obr. 11). Téměř polovina nemocných nilotinib dosud užívá.
Vzhledem k podobné struktuře IM a nilotinibu měla analýza 122 nemocných v CF CML a v AF CML nesnášejících IM po převedení na léčbu nilotinibem odpovědět na otázku, zda mezi oběma léky neexistuje zkřížená nesnášenlivost [23]. Studie potvrdila vysokou léčebnou efektivitu nilotinibu a minimální zkříženou nesnášenlivost IM a nilotinibu. Malá, ale statisticky signifikantní zkřížená nesnášenlivost byla zjištěna jen pro trombocytopenii.
Dasatinib i nilotinib byly v klinických studiích fáze 2 v poslední době zkoušeny se slibnými výsledky i v 1. linii léčby CML [24–26].
Hledání cesty k úplné eradikaci nádorového klonu a vyléčení nemocných s CML
1. Alogenní transplantace krvetvorných buněk (ATKB) po selhání IM
Analýzy výsledků léčby CF CML IM a ATKB v 1. linii ukázaly, že ATKB není v „éře imainibu“ u CF CML léčbou 1. linie [27]. Nemyeloablativní ATKB by měly být dle NCCN doporučení pro léčbu CML prováděny pouze v rámci klinických studií [14].
2. Nové léky v cílené léčbě CML
Hlavním důvodem vedoucím k hledání nových léčebných možností u CML je skutečnost, že přes dosažené revoluční úspěchy cílené léčby IM s časem vzniká u signifikantní části nemocných rezistence k IM a pravděpodobně i dalším inhibitorům TK a také neschopnost dosud známých inhibitorů TK nádorový klon u většiny nemocných úplně eradikovat. Vedle již zmíněných inhibitorů TK 2. generace (dasatinib a nilotinib) je v poslední době syntetizována a ověřována účinnost celé řady dalších ATP kompetitivních a non ATP kompetitivních BCR-ABL TKI. Dále jsou syntetizovány inhibitory, které cíleně působí na signální dráhy za místem působení BCR-ABL [např. inhibitory Ras-Raf-MAPK (mitogen aktivující proteinová kináza) dráhy a PI3K (phosphatidyl - inositol-3 kináza)-Akt-mTOR („mammalian target of rapamycin” kináza)] dráhy a také na cíle, jejichž souvislost s BCR-ABL nebyla zjištěna [28].
Lékem 1. léčebné linie je u nemocných v CF CML imatinib v dávce 400 mg/den. Další postup a zde uvedená léčebná doporučení vycházejí z novelizovaných doporučení NCCN [14]. Ta se opírají o hodnocení, zda byla v přesně stanovené časové ose od zahájení léčby dosažena optimální léčebná odpověď nebo zda léčba IM selhává:
- U nemocných v CF CML, kteří po 3 měsících nedosáhli KHR nebo jsou v hematologickém relapsu nebo kteří po 6 měsících nedosáhli cytogenetickou odpověď nebo po 12 měsících nedosáhli cytogenetickou odpověď nebo dosáhli minimální cytogenetickou odpověď nebo jsou v cytogenetickém relapsu, můžeme uvažovat o jejich převedení na TKI 2. generace (dasatinib, nilotinib), ale můžeme zvážit (a s nemocným probrat) rizika provedení ATKB či zařazení nemocného do klinických studií.
- U nemocných, kteří po 18 měsících nedosáhli cytogenetickou remisi, kteří dosáhli jen minimální cytogenetickou remisi nebo u nichž byl zjištěn cytogenetický relaps, musíme uvažovat o jejich převedení na TKI 2. generace (dasatinib, nilotinib), zvážit rizika a diskutovat s nemocným možnost provedení ATKB či zařazení nemocného do klinických studií.
- U nemocných v AF CML zvažujeme jejich převedení na TKI 2. generace (dasatinib, nilotinib) a následnou ATKB, je li možná, nebo o zařazení nemocného do klinických studií.
- U pacientů v BZ
CML:
- V lymfoblastickém zvratu CML léčíme nemocné v indukční fázi jako akutní lymfoblastickou leukemii (ALL) s přidáním dasatinibu a následně se snažíme provést ATKB (možností je i podání dasatinibu v indukci bez chemoterapie a následná ATKB) nebo zařazení nemocného do klinických studií – zvláště není li možno provést ATKB.
- V myeloidním BZ CML léčíme nemocné indukční chemoterapií pro AML s přidáním dasatinibu a snažíme se dospět k ATKB (nebo je léčíme v indukci jen dasatinibem bez chemoterapie s následnou ATKB) nebo se je snažíme zařadit do klinických studií – zvláště není li možno ATKB provést.
U pacientů, kteří dosáhli KCyR, provádíme každé 3 měsíce vedle vyšetření KO i kvantitativní PCR vyšetření (Q-RT PCR) na BCR-ABL.
Z předchozího stručného souhrnu léčebných doporučení je patrné, že léčba nemocného s CML se opírá o výsledky pravidelně prováděných vysoce sofistikovaných cytogenetických a molekulárně genetických vyšetření. Adekvátní léčba CML dnes tedy vyžaduje jejich dostupnost, průběžné sledování nemocných a zvláště, není li léčebná odpověď adekvátní, velké zkušenosti s léčbou CML, přehled moderních poznatků a týmové rozhodování. Vzhledem k rychlosti, s jakou jsou do praxe uváděny nové poznatky o patogenezi a léčbě CML a s jakou se objevují nové léky, i s ohledem na jejich cenu je také nezbytné, aby se nemocní s CML soustředili ve specializovaných centrech, kde je jejich léčba vedena odborníky na tuto problematiku. Je nezbytné, aby tito odborníci spolupracovali v národních a mezinárodních týmech, účastnili se mezinárodních studií a umožnili nemocným léčbu podle moderních poznatků. Nezbytný je i těsný kontakt lékaře s pacientem a podrobná diskuze o event. nutnosti změny léčebné strategie v souvislosti se změněnými výsledky především hematologických a genetických vyšetření.
Závěr
Revoluční éra imatinibu, jak můžeme první dekádu nového tisíciletí nesporně nazývat, přinesla zásadní změny do léčebné strategie a zásadně změnila prognózu nemocných s CML. Přes výjimečné úspěchy, které se podařilo díky IM a TKI 2. generace (dasatinib a nilotinib) v léčbě CML dosáhnout, se u signifikantní části nemocných dosud nedaří nádorový klon zcela eradikovat a časem vzniká až u 1/4 nemocných rezistence na léčbu IM či jeho intolerance. Nové poznatky, nové léky a jejich kombinace jsou příslibem do budoucna. Konečným cílem je úplné vyléčení nemocných s CML při minimální toxicitě cílené léčby a omezení časového období, po které bude muset být tato léčba podávána.
Práce je podporována projektem MSMT 6198959205, projektem CAMELIA ČHS ČLS JEP a grantem IGA MZ ČR NS 9949-3.
prof. MUDr. Karel Indrák, DrSc.
www.fnol.cz
e mail: karel.indrak@fnol.czDoručeno do redakce: 17. 4. 2009
Zdroje
1. Nowell P, Hungerford D. A minute chromosome in human chronic granulocytic leukemia. Science 1960; 132 : 1497.
2. Rowley JD. Letter: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature 1973; 243 : 290–293.
3. Daley GQ, Van Etten RA, Baltimore D. Induction of chronic myelogenous leukemia in mice by the P210bcr/abl gene of the Philadelphia chromosome. Science 1990; 247 : 824–830.
4. Goldman JM, Melo JV. Chronic myeloid leukemia – advances in biology a new approches to treatment. N Engl J Med 2003; 349 : 1451–1464.
5. Deininger MW, Goldman JM, Melo JV. The molecular biology of chronic myeloid leukemia. Blood 2000; 96 : 3343–3356.
6. van Etten RA. Mechanism of transformation by the BCR-ABL oncogene: new perspectives in the post‑imatinib era. Leuk Res 2004; 28 (Suppl 1): 21–28.
7. Sawyers CL. Chronic myeloid leukemia. N Engl J Med 1999; 340 : 1330–1340.
8. Schindler T, Bornmann W, Pellicena P et al. Structural mechanism for STI-571 inhibition of Abelson Tyrosine Kinase. Science 2000; 289 : 1938–1942.
9. O’Brien SG, Guilhot F, Goldman JM et al. International Randomized Study of Interferon Versus STI571 (IRIS) 7-Year Follow‑up: Sustained Survival, Low Rate of Transformation and Increased Rate of Major Molecular Response (MMR) in Patients (pts) with Newly Diagnosed Chronic Myeloid Leukemia in Chronic Phase (CML‑CP) Treated with Imatinib (IM). ASH Annual Meeting 2008; 112. Abstract 186.
10. Faber E, Hluší A, Indrák K et al. Imatinib (Glivec®) v léčbě nemocných s akcelerovanou fází chronické myeloidní leukemie a Ph pozitivní akutní lymfoblastické leukemie. Trans Hemat dnes 2003; 9 : 159–165.
11. Voglová J, Poznarová A, Chrobák L et al. Imatinib mesylát (Glivec®) v léčbě chronické fáze chronické myeloidní leukemie.Vnitř Lék 2004; 50 : 21–29.
12. Baccarani M, Saglio G, Goldman J et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2006; 108 : 1809–1820.
13. Hochhaus A, Dreyling M. ESMO Guidelines Working Group. Chronic myelogenous leukemia: ESMO clinical recommendations for the diagnosis, treatment and follow‑up. Ann Oncol 2008; 19 (Suppl 2): i63–i64.
14. NCCN Clinical Practice Guidelines in Oncology TM: Chronic Myelogenous Leukemia. Updated Version V. I. 2009 (www.ncccn.org).
15. Klamová H, Voglová J. Diagnostické a léčebné postupy u chronické myeloidní leukemie dospělých v roce 2008. Trans Hemat dnes 2008; 14 (Suppl 1): 87–90.
16. Mahon FX, Huguet F, Guilhot F et al. Is it possible to stop imatinib in patients with chronic myeloid leukemia? An update from a french pilot study and first results from the multicentre “Stop imatinib” (STIM) study. Program and abstracts of the 50th american society of hematology annual meeting and exposition. ASH Annual Meeting 2008 : 112: Abstract 187.
17. Hochhaus A, Muller MC, Radich J et al. Dasatinib‑associated major molecular responses are rapidly achieved in patients with chronic myeloid leukemia in chronic phase (CML‑CP) following resistance, suboptimal response or intolerance on imatinib. ASH Annual Meeting 2008; 112: Abstract 1095.
18. Baccarani M, Rosti G, Saglio G et al. Dasatinib time to and durability of major and complete cytogenetic response (MCyR and CCyR) in patients with chronic myeloid leukemia in chronic phase (CML‑CP). ASH Annual Meeting 2008; 112. Abstract 450.
19. Shah NP, Kantarjian HM, Kim DW et al. Intermittent target inhibition with dasatinib 100 mg once daily preserves efficacy and improves tolerability in imatinib‑resistant and imatinib-intolerant chronic-phase chronic myeloid leukemia. J Clin Oncol 2008; 26 : 3204–3212.
20. Shah NP, Kim DW, Kantarjian HM et al. Dasatinib dose‑optimization in chronic phase chronic myeloid leukemia (CML‑CP): two‑year data from CA180-034 show equivalent long term efficacy and improved safety with 100 mg once daily dose. ASH Annual Meeting) 2008; 112. Abstract 3225.
21. Muller MC, Cortes J, Kim DW et al. Dasatinib efficacy in patients with chronic myeloid leukemia in chronic phase (CML‑CP) and pre‑existing BCR-ABL mutations. ASH Annual Meeting 2008; 112. Abstract 449.
22. Kantarjian HM, Giles F, Bhalla KN et al. Nilotinib in chronic myeloid leukemia patients in vhronic phase (CML‑CP) with imatinib resistance or intolerance: 2-year rollow‑up results of a phase 2 study. ASH Annual Meeting 2008; 112. Abstract 3238.
23. Jabbour E, Kantarjian HM, Baccarani M et al. Minimal cross-intolerance between nilotinib and imatinib in patients with imatinib-intolerant chronic myeloid leukemia in chronic phase (CML‑CP) or accelerated phase (CML‑AP). ASH Annual Meeting 2008; 112. Abstract 3215.
24. Cortes J, O’Brien S, Borthakur G et al. Efficacy of dasatinib in patients with previously untreated chronic myelogenous leukemia (CML) in early chronic phase (CML‑CP). ASH Annual Meeting 2008; 112. Abstract 182.
25. Cortes J, O’Brien S, Jones D et al. Efficacy of nilotinib (formerly AMN107) in patients (pts) with newly diagnosed previously untreated philadelphia chromosome (Ph)-positive chronic myelogenous leukemia in early chronic phase (CML‑CP). ASH Annual Meeting 2008; 112. Abstract 446.
26. Rosti G, Castagnetti F, Poerio A et al. High and early rates of cytogenetic and molecular response with nilotinib 800 mg daily as first line treatment of ph-positive chronic myeloid leukemia in chronic phase of a phase 2 trial of the gimema CML working party. ASH Annual Meeting 2008; 112. Abstract 181.
27. Hehlmann R, Berger U, Pfirmann M et al. Drug treatment is superior to allografting as first‑line therapy in chronic myeloid leukemia. Blood 2007; 109 : 4686–4692.
28. Melo JV, Chuah C. Novel Agents in CML Therapy: Tyrosine Kinase Inhibitors and Beyond. Hematology Am Soc Hematol Edu Program 2008; 2008 : 427–435.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Léčba hypertenze u obezityČlánek Histiocytární choroby
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo Supplementum 1- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Zmeny vo funkčnom renálnom náleze po maratónskom behu, po 100-kilometrovom behu a po 24-hodinovom dlhotrvajúcom behu
- Zájem pana doc. MUDr. Dušana Mrkose, CSc., o vzácné choroby předběhl o mnoho let program EU zaměřený na vzácné nemoci
- Histiocytární choroby
- Diferenciální diagnostika eozinofilie
- Léčba hypertenze u obezity
- Zahraniční styky Československé hematologické společnosti v letech 1951– 1989
- Vývoj oboru klinické hematologie dospělých v Brně do 90. let minulého století (vzpomínky klinického hematologa)
-
XXVIII. dny mladých internistů
Olomouc, 4.–5. 6. 2009 - Rozdíly mezi muži a ženami u akutního srdečního selhání
- Nová klasifikace Ph negativních chronických myeloproliferativních nemocí v přehledu
- Akutní krvácení z horní části gastro intestinálního traktu
- K významnému životnímu jubileu emeritního editora časopisu Vnitřní lékařství doc. MUDr. Dušana Mrkose, CSc.,
- Di abetik, paci ent internisty
- Indikace k vyšetření rizikových faktorů žilní trombózy
- Hemofili e z pohledu vývoje zajištění péče o nemocné
- Dětské nádory metastazující do kostní dřeně a jejich hematologický obraz
- Přetížení železem – novinky v patogenezi a léčbě
- Koloběhy života aneb doc. MU Dr. Dušan Mrkos, CSc., devadesátníkem
- Léčba chronické myeloidní leukemie (CML) v éře imatinibu
- Maligní lymfomy trávicího traktu
- Současné možnosti diagnostiky a léčby systémové AL-amyloidózy
- Problematika porúch hemostázy pri metabolickom syndróme
- Léčba chronického srdečního selhání v interní ambulanci
- Protrombotický stav pri NAFLD a jeho dôsledky
- Liečba diabetika s ischemickou chorobou srdca
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika eozinofilie
- Přetížení železem – novinky v patogenezi a léčbě
- Histiocytární choroby
- Akutní krvácení z horní části gastro intestinálního traktu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání