-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDětské nádory metastazující do kostní dřeně a jejich hematologický obraz
Paedi atric tumo urs metastasizing to bone marrow and their haematological characterisati on
The paper provides an overvi ew of paedi atric tumo urs most frequently metastasizing to bone marrow, revi ews bri efly possible clinical and laboratory signs of metastases and lists and evalu ates morphological methods of their di agnosis with particular focus on haematological investigati ons of bone marrow aspirati ons. The paper bri efly to uches upon the morphology of the most important tumo urs in this gro up and, in attachments, presents their microphotographs with explanatory notes. Possible difficulti es faced by the clinici ans when evalu ating the tumo urs are highlighted. The a uthors cite published literature and share experi ences from their own practice.
Key words:
paedi atric tumo urs – bone marrow metastases – morphology – bone marrow aspirati on
Autoři: S. Valníček 1; J. Zapletal 1; J. Blatný 1; B. Jordanová 1; M. Kokeszová 1; D. Kodýtková 2
Působiště autorů: Oddělení klinické hematologi e FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Miroslav Penka, CSc., pracoviště Dětská nemocnice, vedo ucí lékař MU Dr. Jan Blatný, Ph. D. 1; Klinika dětské onkologi e Lékařské fakulty MU a FN Brno, pracoviště Dětská nemocnice, přednosta prof. MU Dr. Jaroslav Štěrba, Ph. D. 2
Vyšlo v časopise: Vnitř Lék 2009; 55(Suppl 1)(Supplementum 1): 52-58
Souhrn
Práce uvádí přehled dětských nádorů, nejčastěji metastazujících do kostní dřeně, ve stručnosti také možné klinické a laboratorní projevy metastáz, vypočítává a hodnotí morfologické způsoby jejich průkazu, zejména při hematologickém vyšetřování aspirací kostní dřeně. Stručně si všímá morfologi e hlavních z těchto nádorů a v přílohách představuje jejich mikrofotografi e s popisem. Zmiňuje se i o možných nesnázích, k nimž může při hodnocení docházet. Cituje literární údaje a uvádí zkušenosti z vlastního pracoviště.
Klíčová slova:
dětské nádory – metastázy do kostní dřeně – morfologi e – aspirace kostní dřeněÚvod
Nádory dětského věku se odlišují od nádorů dospělých na prvém místě histogenetickým původem. Zatímco v dospělosti se vyskytují zejména malignity epiteliální, setkáváme se u dětí hlavně s nádory krvetvorného systému a se solidními tumory mezodermu a ne uroektodermu. Dětské nádory často rychle rosto u a časně metastazují. Kromě klinických a laboratorních známek, které vedo u k indikaci vyšetření kostní dřeně (KD) u nemocných dětskými nádory, je v dnešní době provedení této di agnostické metody také so učástí stagingu maligních tumorů a požadují je pa ušálně i příslušné léčebné protokoly. Druhy nádorů, které metastazují do KD, jso u rozdílné u dětí a dospělých. Zatímco u dospělých metastazují do KD kromě jiných maligních nádorů zejména karcinom plic, karcinom prostaty u mužů a karcinom prsní žlázy u žen, u dětí jso u to zejména ne uroblastom, alve olární rhabdomyosarkom (aRMS), Ewingův sarkom (ES), PNET (primitivní ne uroektodermální tumory) a retinoblastom [1,3,4].
Ačkoliv nitrolební nádory metastazují zřídka mimo klenbu lební, můžeme se dosti vzácně setkat s ložisky metastáz embryonálních CNS tumorů, zejména medulloblastomu [1,5,10].
Klinické a laboratorní projevy, které mohou vést u nádorů k podezření na metastázy do kostní dřeně
- bolesti v kostech (nejsou specifické, nelze je hodnotit u kojenců a malých dětí, moho u se objevit jako první subjektivní potíže např. i u le ukemi í)
- změny na skeletu při zobrazovacích vyšetřeních
- zvýšení kalci a a/ nebo alkalické fosfatázy v séru; v některých případech
- výskyt jaderných červených krvinek (erytroblastů) v nátěrech z periferní krve, popřípadě so učasně nález určitého počtu mladých forem granulocytů. Je‑li tento obraz provázen anémi í, mluvíme o le uko - erytroblastové anémii [1]. Tyto změny se však vyskytují hlavně u dospělých, u dětí je vidíme vzácně.
- nemusí se projevit žádná z uvedených známek
Techniky používané k průkazu metastáz do KD a jejich citlivost
Jso u to aspirace KD a trepanobiopsie KD.
Postup je následující: trepanobi opsi e i aspirace se provádí obvykle z obo u lopat kostí kyčelních, spina ilica ventralis, popřípadě z tibi e. Z aspirace se zhotovuje co největší počet nátěrů, z trepanobi optického válečku se provádí otisk nebo roztěr, pak se trepanobi optický vzorek předává patologům ke zhotovení a vyhodnocení co největšího počtu řezů. Barbara Bainová et al [1] citují několik prací, které srovnávají a hodnotí záchytnost metastáz a citlivost uvedených metodik: při přítomnosti kostních metastáz byl ve 28 % pozitivní nález infiltrace KD v nátěrech ze vzorků získaných aspirací. V preparátech z jedné trepanobi opsi e byla pozitivita u 35 – 45 % [1,6]. Jestliže jso u metastázy prokázány v trepanobi optických preparátech, jso u pak také nalezeny ve 3/ 4 i v nátěrech z aspirace. Trepanobi opsi e je tedy citlivější metodo u a její senzitivita se ještě zvětší, odebíráme‑li vzorky z obo u stran. Citlivost aspirace KD je tím vyšší, čím větší je počet vyšetřených nátěrů KD. Zvyšuje se i vyšetřením řezů ze sraženiny, získané z aspiračního vzorku [1].
V naší laboratoři speci ální morfologi e Oddělení klinické hematologi e ve Fakultní dětské nemocnici Brno hodnotíme vždy 4 nátěry z aspirace KD z levé kosti kyčelní a 4 z pravé strany. So učasně prohlížíme otisk nebo stěr z trepanobi optických vzorků, a to rovněž z obo u kostí kyčelních. Preparáty hodnotí nezávisle vždy minimálně 2 hematologové speci alisté. V některých případech se prohlíží i aspirační punktát jiných míst. Může být položena otázka, proč se vyšetřují i nátěry z aspirace, jestliže je známo, že bi optická vyšetření KD prokazují metastázy častěji a že v některých případech se najdo u metastázy jen v bi optických preparátech a v aspirátech nikoliv. Aspiráty se vyšetřují proto, že někdy je tomu opačně a pozitivní nález metastáz zjistíme jen v nátěrech z aspirací [7,8]. Za důležitý považujeme i fakt, že výsledek vyšetření aspirátu je dostupný během několika hodin, zatímco výsledek vyšetření trepanobi opsi e v řádu dnů až týdnů. Vzhledem k významnosti pozitivity či negativity průkazu metastáz je tedy nutné provádět obě metody so učasně. Je tomu tak zejména u stagingu v době stanovení di agnózy u solidních tumorů, u dětí např. u ne uroblastomu (u dospělých u karcinomu prsu a plic). Obě vyšetření paralelně jso u indikována také tehdy, je‑li velmi pravděpodobné, že jso u metastázy přítomny, a jestliže jejich průkaz ovlivní výběr bezprostřední léčby [1].
Hodnocení aspirátů KD při pátrání po metastázách
Nejprve hodnotíme nátěr jako obvykle, přehledným zvětšením, prohlížíme jeho okraje, poněvadž na nich bývají přítomny větší buňky, což moho u být některé buňky nádorové, nebo shluky tumorózních buněk, např. rozety. Ty nacházíme nejčastěji u ne uroblastomu, méně často u Ewingova sarkomu a ostatních PNET. Pozorné prohlížení je nutné, zejména není‑li na první pohled, tj. např. již v přehledném zvětšení, patrná masivní infiltrace nádorem [9]. Nasajeme‑li při aspiraci velké množství KD, moho u být jednotlivé nádorové buňky rozptýleny mezi buňkami krvetvorné dřeně. Samozřejmě záchytnost hematologické di agnostiky dřeňových metastáz se zvyšuje s počtem prohlédnutých nátěrů KD. Na našem pracovišti toto hodnocení provádí, jak shora řečeno, minimálně 2 lékaři hematologové, kteří mají zkušenosti ve speci ální morfologii. U metastáz některých dětských nádorů může být v určení druhu nádoru důležité cytochemické vyšetření. Je‑li k dispozici otisk z primárního nádorového ložiska, může být srovnání jeho morfologi e cenno u pomocí v di agnostice metastáz, i když morfologi e metastatických buněk se může v praxi od morfologi e základního tumoru lišit. Je to způsobeno mezi jiným i techniko u otisku a rozprostřením buněk v nátěru z aspirace.
Jednotlivé shora jmenované dětské nádory metastazující do KD a morfologie jejich metastáz
Neuroblastom
Postihuje nejčastěji děti do 1 roku věku. Patří společně s rhabdomyosarkomem a Ewingovým sarkomem (ES) k maligním tumorům, nejčastěji infiltrujícím kostní dřen. Je vůbec nejčastější nehematologicko u malignito u, která u dětí infiltruje KD [10]. V systematice nádorů je uváděn spolu s gangli one uromem a gangli one uroblastomem ve skupině ne uroblastomových nádorů. Jeho histologické typy jso u: nediferencovaný, málo diferencovaný a diferencovaný. Buňky ne uroblastomu (obr. 1 a 2) jso u malé, s kulatým nebo oválným jádrem a malým množstvím cytoplazmy. Někdy k jejich poznání pomůže i excentrické uložení jádra, ale jednotlivé buňky tohoto nádoru jso u v KD téměř neidentifikovatelné. Mají obvykle vysoký N/ C poměr a často se podobají malým blastům ALL (L 1, resp. L 2), což může činit potíže, zejména jestliže infiltrace KD ne uroblastomem je masivní. Tehdy se zmíněná di agnóza může vnucovat, obzvláště pokud byla punkce KD prováděna jako jedno z prvních vyšetření, např. pro periferní anémii a trombocytopenii, a neznáme‑li ještě výsledky ostatních vyšetření. Pro odlišení však obvykle pomůže radi ologický obraz a průkaz katecholaminů v moči, většino u i klinický nález. Ne uroblasty tvoří často rozety, které nacházíme nejčastěji na okrajích preparátu, kde po nich pátráme nejprve přehledným zvětšením, stejně jako to děláme při hledání megakaryocytů. Tvorba rozet není u jiných malobuněčných nádorů dětského věku obvyklá (ojediněle u ES). Buňky ne uroblastomu mají, stejně jako buňky medulloblastomu, pozitivní re akci na a - naftylacetátesterázu (ANAE), ale mají odlišno u morfologii od buněk monocytární lini e a pro monocytární linii specifická butyrátesterása (BE) je u nich negativní [10,14]. Di agnosticky významný je nález ne urofibril, obvykle u shuku ne uroblastů nebo v rozetách, občas i samostatně. Při panoptickém barvení se ne urofibrily jeví jako světle růžová až růžově fi alová vláknitá hmota.
Obr. 1. Neuroblastom: velký svazek růžovofialových neurofibril, obklopujících metastázu neuroblastomových buněk v KD. U některých není patrná cytoplazma. V okolí několik malých lymfocytů, u levého okraje myelocyt, nad ním metamyelocyt (na obrázku četné erytrocyty v rouleaux). 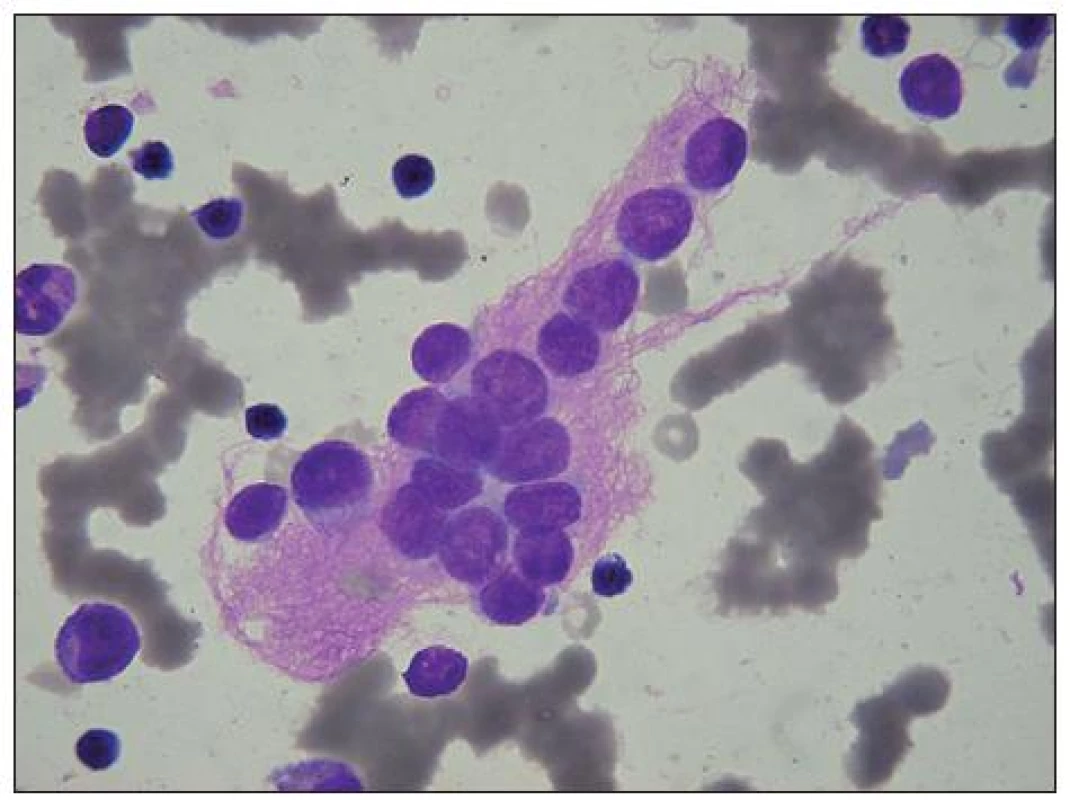
Obr. 2. Neuroblastom – pro srovnání otisk primárního tumoru. Rozetovitý útvar neuroblastomových buněk s ganglioidní diferenciací. Velká světlá, částečně excentricky uložená jádra, s velkými jadérky. Místy vakuoly v cytoplazmě. V pravé horní části rozetky ojedinělé fagocytované erytrocyty. 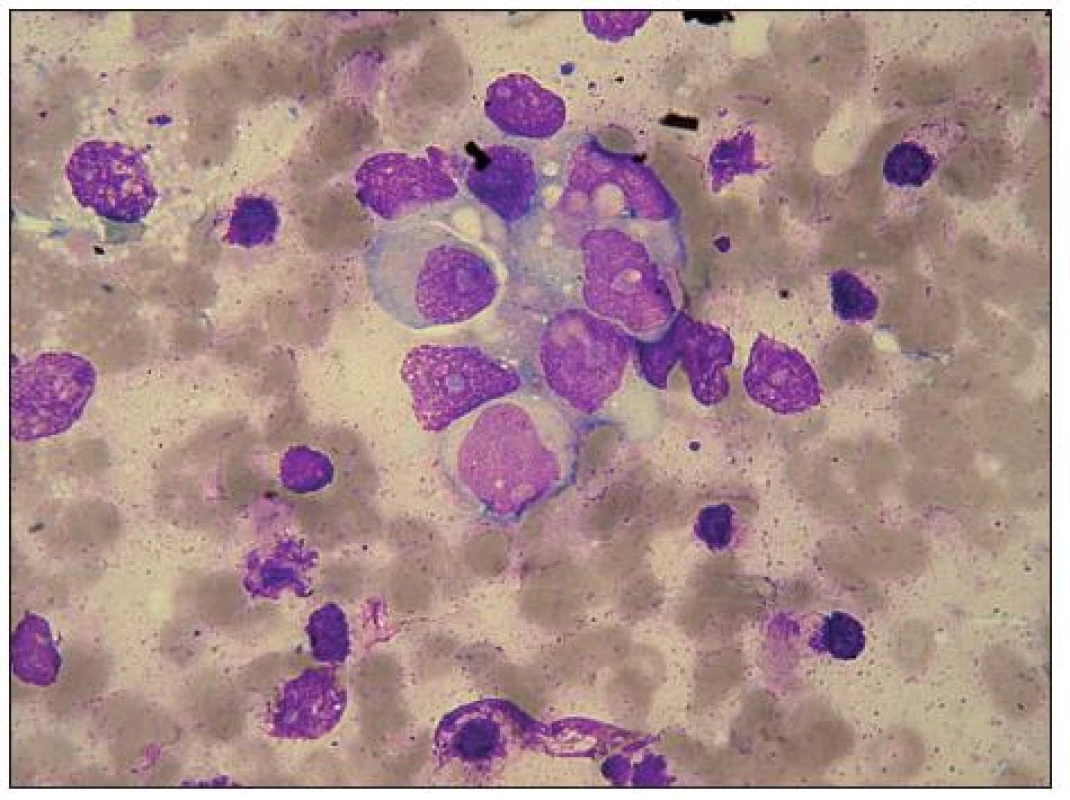
Sarkomy měkkých tkání (STS) a nejčastější z nich – rhabdomyosarkom (RMS) – alveolární typ
Tvoří 5 – 8 % pedi atrických malignit. Vyskytuje se nejčastěji u dětí do 5 let [20]. U RMS, di agnostikovaných ve IV. stadi u, má dřeňové metastázy již 30 % postižených dětí [10]. V nátěrech z aspirátů KD jeho metastázy pozůstávají z buněk značně vari abilního tvaru (obr. 5). Jádra bývají kulatá, oválná až mírně laločnatá, jaderný chromatin v malých buňkách hutnější, ve větších řidší, ale hrubě zrnitý až hrubě trámčitý. Cytoplazma středně bazofilní, s acidofilním perinukle árním projasněním. Nacházíme i buňky dvo ujaderné a vícejaderné buňky s „nafo uklo u“ cytoplazmo u nebo rhabdomyoblasty vřetenovitého tvaru. Periferní cytoplazma je obvykle vyplněna vakuolovitými, při panoptickém barvení prázdnými prostůrky [14,16,20], které moho u splývat a vytvářet tzv. „jezírka“ („lakes“) (obr. 6, 7 a 8). Cytochemicky PAS re akcí je ve vakuolách a „lakes“ prokazován glykogen (obr. 9). To může být di agnosticko u pomůcko u. V některých případech buňky RMS fagocytují, zejména erytrocyty, ale i např. buněčná jádra. Tvorba rozet v nátěrech se u RMS ne uvádí. Mezi našimi nemocnými jsme občas našli malé buněčné skupiny, které rozety připomínaly (obr. 5). Alve olární RMS bývá spojen s translokacemi t(2;13)(q37;q14) nebo t(1;13)(p13;q14) [10].
Obr. 3. Malý rozetoidní trs rhabdomyoblastů v KD. Buňky s velkým jádrem, cytoplazma je vakuolisovaná a stejně jako na předchozím obrázku je na periferii bazofilní, perinukleárně acidofilní. Buňky v horní části splývají, snad jde o jednu vícejadernou buňku. V levé dolní části shluku je dvoujaderná buňka, v levém dolním rohu holé jádro, plazmocyt a bazofilní normoblast. 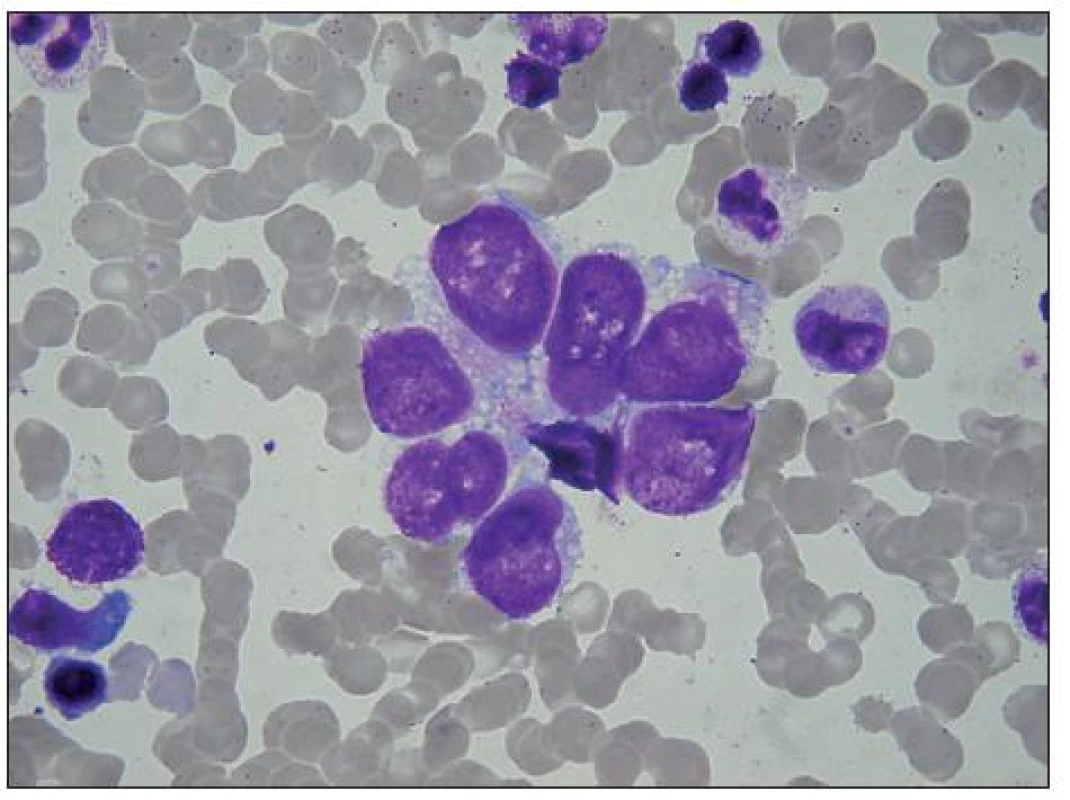
Obr. 4. Velké ložisko RMS buněk v KD, prostoupené četnými vakuolami, které místy splývají a vytvářejí tak tzv. „jezírka“ (lakes). Místy je naznačena fagocytóza erytrocytů. 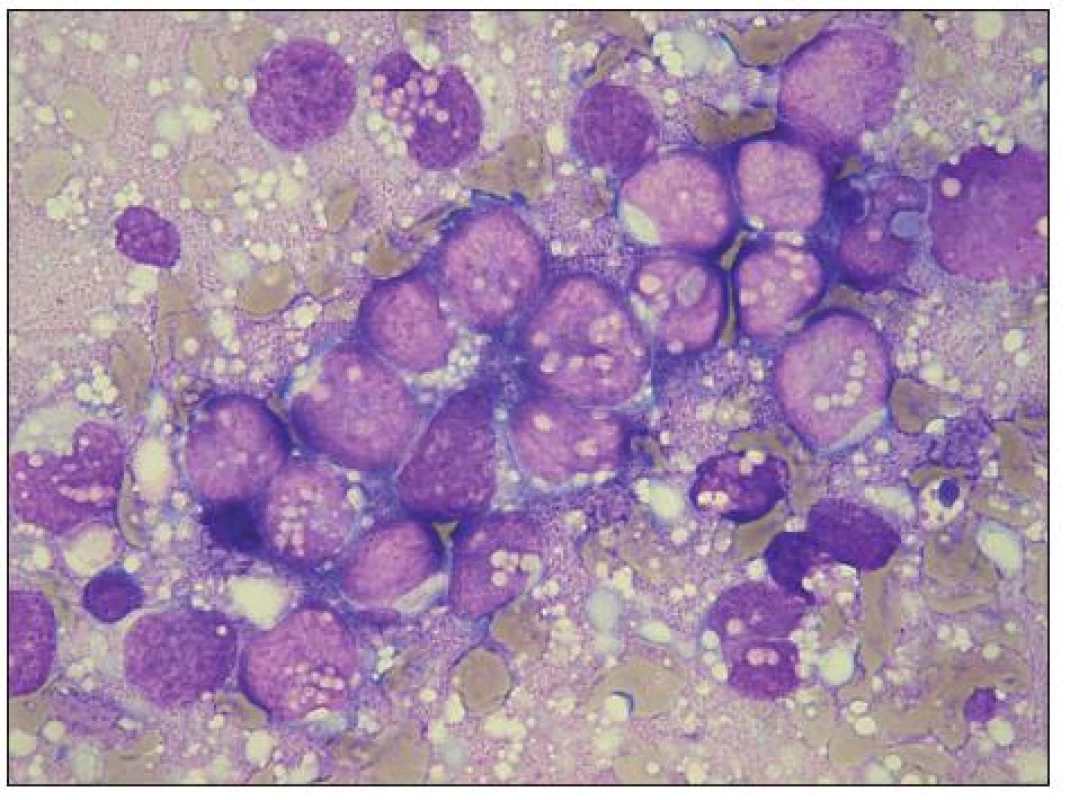
Obr. 5. Centrálně velká vícejaderná rhabdomyosarkomová buňka s nepravidelnou jadernou membránou a řidším, hrubším chromatinem. Obsahuje vakuoly, „jezírka“, fagocytuje erytrocyty. Vlevo tři RMS buňky s vakuolami a malými „jezírky“, vpravo malá buňka s hutným chromatinem, ale velkými vakuolami (netypická). Nad ní malý nahojaderný lymfocyt, dole uprostřed svraštělý eosinofil. 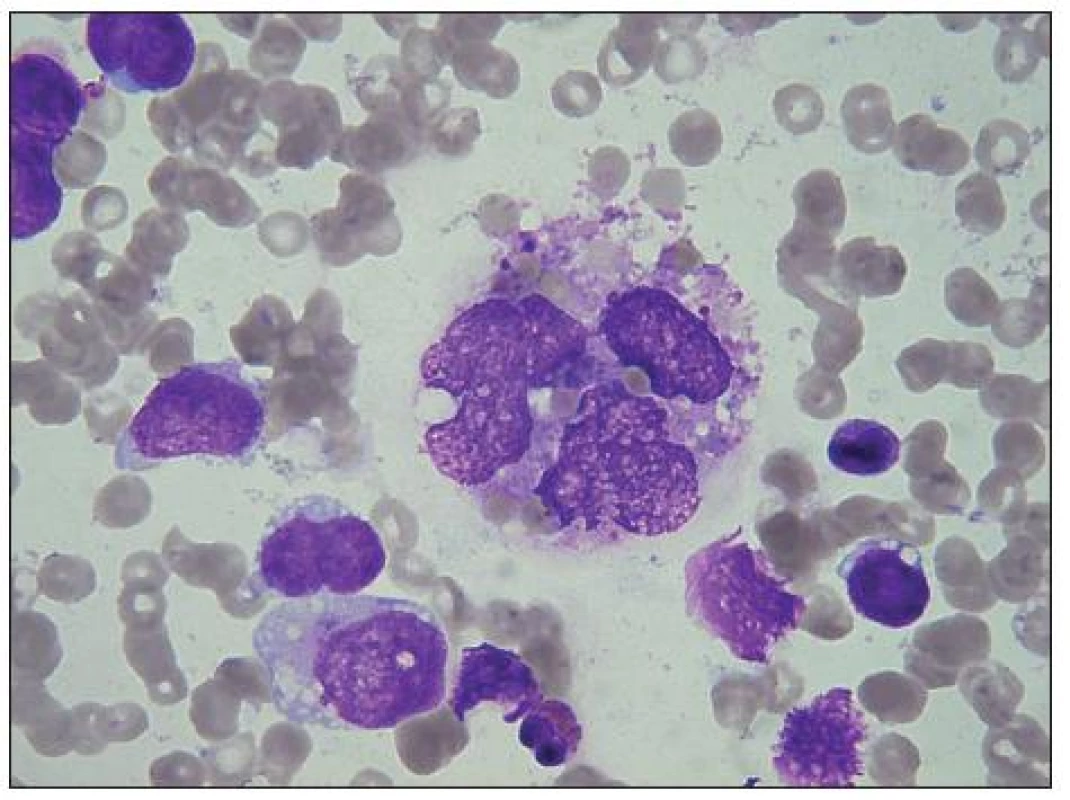
Obr. 6. Centrálně a uprostřed dole dvě buňky RMS, fagocytující zbytky buněk, buněčných jader a fragmenty erytrocytů. Nejde o fagocytující histiocyty. Dále v těchto buňkách vidíme, velké vakuoly, nápadná jsou zde hlavně „jezírka“, „lakes“ (viz šipky), vzniklá splynutím vakuol, velmi častá u buněk RMS, takže jsou diagnostickou pomůckou. Na snímku jsou ještě další buňky RMS a jejich holá jádra, vlevo segmentovaný neutrofil a na dolním okraji je viditelná ½ neutrofilního segmentu. 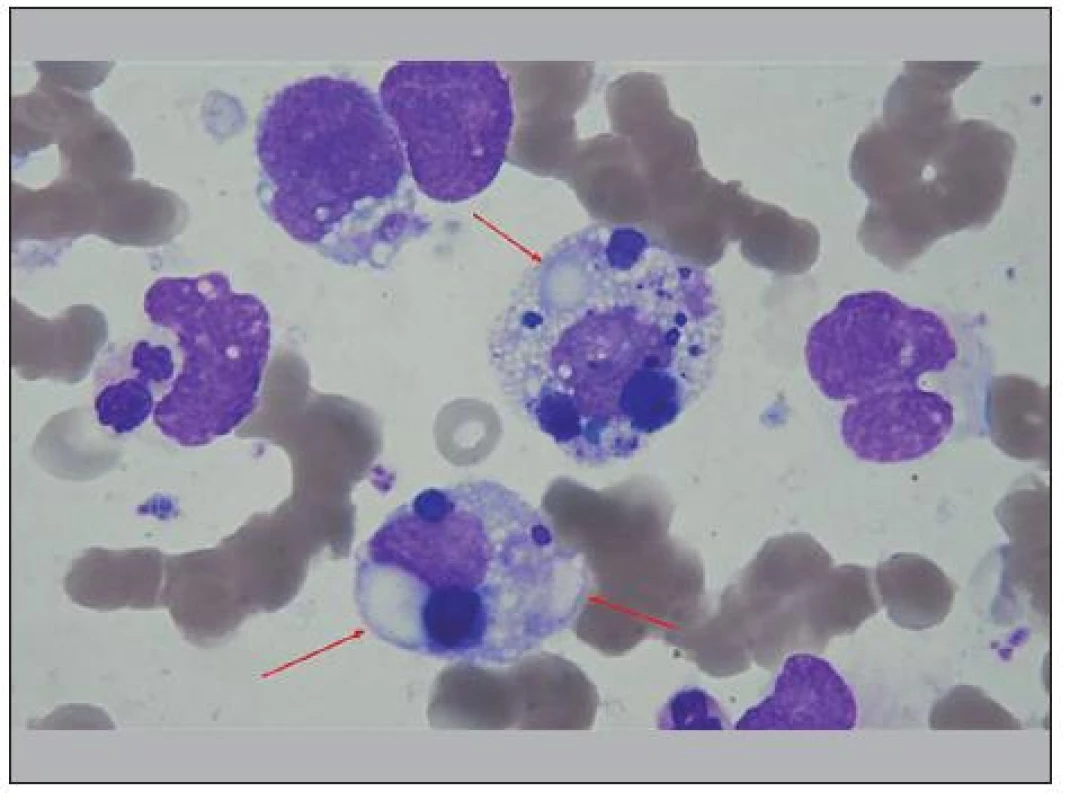
Obr. 7. Vakuoly a „jezírka“ v buňkách RMS nejsou ve skutečnosti prázdné prostory, jsou vyplněny glykogenem, což potvrzuje silně positivní PAS reakce. 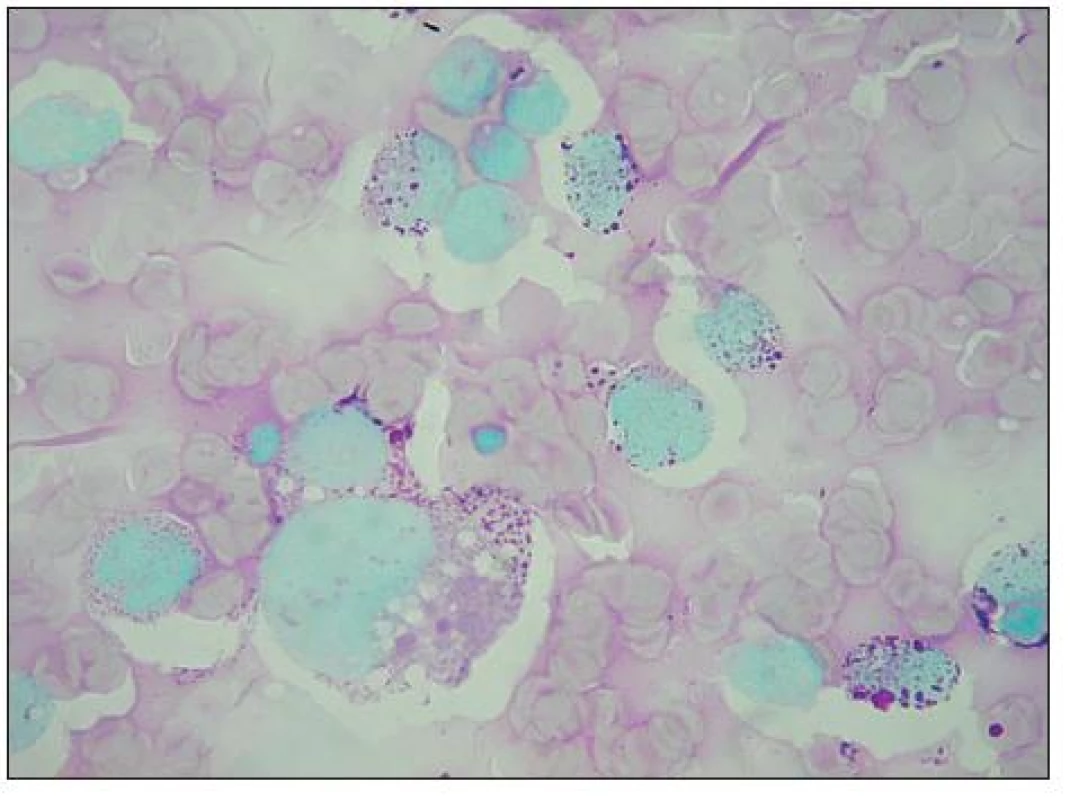
Ewingův sarkom (ES) a primitivní neuroektodermální tumory (PNET)
ES je primitivním, vysoce maligním nádorem měkkých tkání a kostí, obyčejně metastazujícím do KD, kostí a plic. Vyskytuje se převážně u dětí a mladistvých. Skupina nádorů ES je histologicky tvořena malými uniformními buňkami s minimální morfologickou diferenci ací, nebo většími, méně uniformními s různým stupněm ne uroektodermální diferenci ace, přitom ES bývá méně diferencován. ES a PNET se překrývají do značné míry po stránce histologické, sdílejí tutéž translokaci t(11;22)(q24;q12) a téměř všechny buňky exprimují membránový antigen CD 99 [1,10,11]. Zatímco ES bývá v kostech, PNET nacházíme v měkkých tkáních. Nyní jso u většino u považovány za odlišno u expresi téhož nádorového typu. Z hlediska morfohematologického (obr. 10) vidíme u ES v hematologických nátěrech KD při nálezu metastáz někdy buněčno u anizocytózu, jadérka bývají patrná ve velkých buňkách, v malých obvykle zřetelná nejso u, nepravidelně vybarvená cytoplazma je šedomodrá, resp. světle bazofilní, v některých buňkách bývají drobné vakuoly. U ES a PNET můžeme buněčné rozety najít zřídka (udává se 10% výskyt), zatímco u ne uroblastomu tvoří nádorové buňky rozety často. U ostatních jmenovaných metastazujících dětských nádorů se rozety údajně nenacházejí.
Obr. 8. Ložisko buněk Ewingova sarkomu v KD s výraznou anisocytózou. Větší buňky s řidším trámčitým chromatinem mají patrná modravá jadérka, která nevidíme v menších jádrech s chromatinem tmavěji se barvícím. Světlá, modrošedá cytoplazma, nepravidelně vybarvená, hranice mezi buňkami splývají. Ve dvoubuňkách s bazofilnější cytoplazmou a ohraničenou buněčnou membránou jsou patrné vakuoly. V několika buňkách bazofilní inkluze. Vlevo nahoře malý lymfocyt, ve střední části pole vlevo dva neutrofilní segmenty a polychromní normoblast, v dolní části od leva lymfocyt, polychromní normoblast a metamyelocyt. 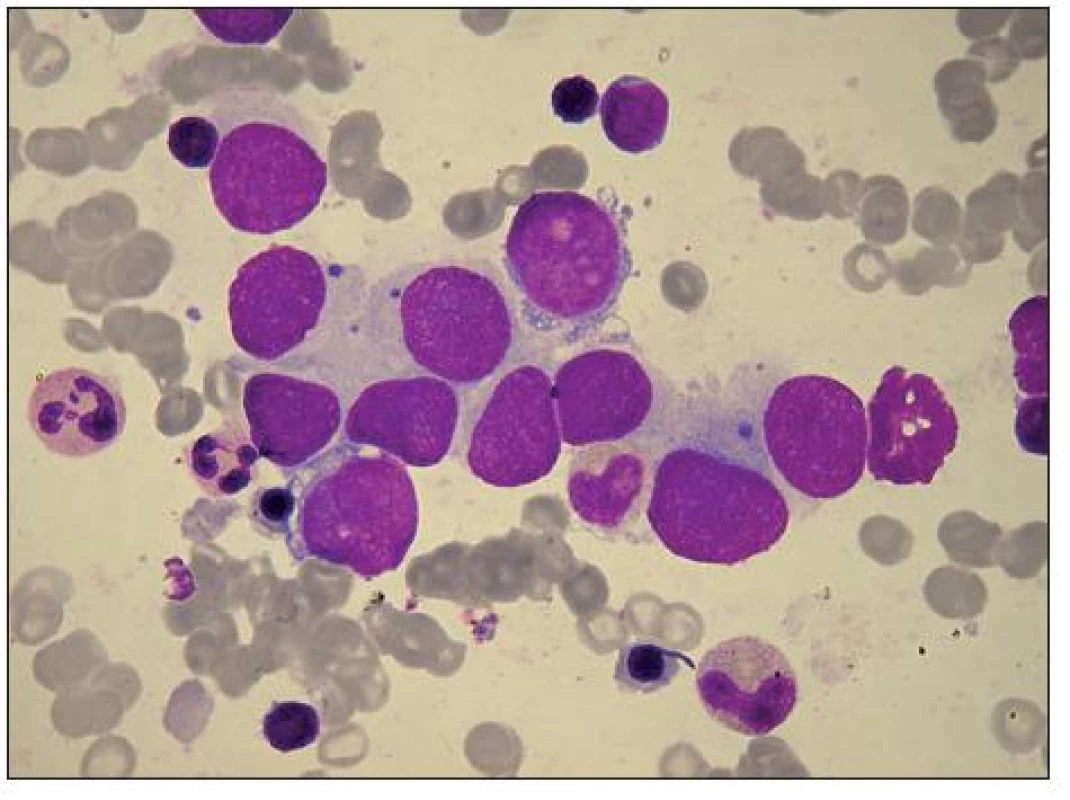
Medulloblastom
Tento maligní, invazivní embryonální tumor je tumorem intrakrani álním (vermis, čtvrtá komora, mozeček) [15]. Ty tak často do kostní dřeně nemetastazují [1,10]. Bývá lokalizován v zadní jámě lební, po stránce patologické je považován za nádor ne urogenní, stejně jako ne uroblastom, s nímž má podobno u mikroskopicko u skladbu. Některými patology je také považován za formu ne uroblastomu. Tvořívá někdy buněčné rozety. Má s ním také stejné cytochemické vlastnosti, které pomáhají určit jeho metastázy v KD, tj. pozitivitu ANAE (obr. 4) a negativitu BE. Má však pestřejší morfologii v hematologických preparátech, jak vidíme na fotografi ích (obr. 3), tj. jádra nejen kulatá, ale i laločnatá, nepravidelná, o něco menší N/ C poměr, u některých buněk i poměrně dosti široko u cytoplazmu, mívá vakuoly jádra i cytoplazmy. Tato větší morfologická pestrost činí nepravděpodobno u záměnu infiltrace KD jeho buňkami za ALL (snad jen s výjimko u L 3), což činí ještě nepravděpodobnějším nitrolební lokalizace jeho primárního ložiska.
Obr. 9. Medulloblastom, velký shluk maligních buněk, metastáza v kostní dřeni. Zejména ve srovnání s neuroblastomem je zřetelná polymorfie tvaru i velikosti buněk i jader, ta jsou spíše excentricky uložená, nepravidelná, až laločnatá, ojediněle s velkými jadérky. Výrazná vakuolizace bazofilní cytoplazmy, zčásti i jádra. Vlevo nahoře segmentovaný neutrofil a hypogranulární myelocyt. 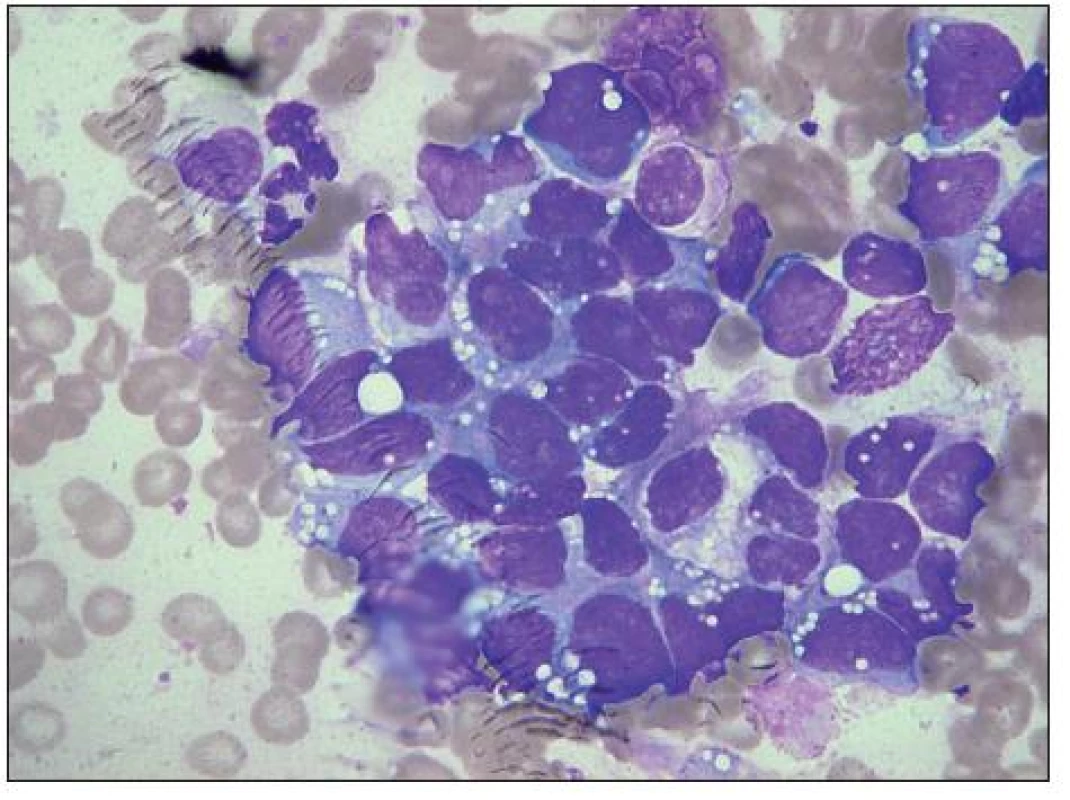
Obr. 10. Reakce na nespecifickou alfa-naftylacetát-esterázu (ANAE) je u buněk medulloblastomu stejně jako u neuroblastomu pozitivní. 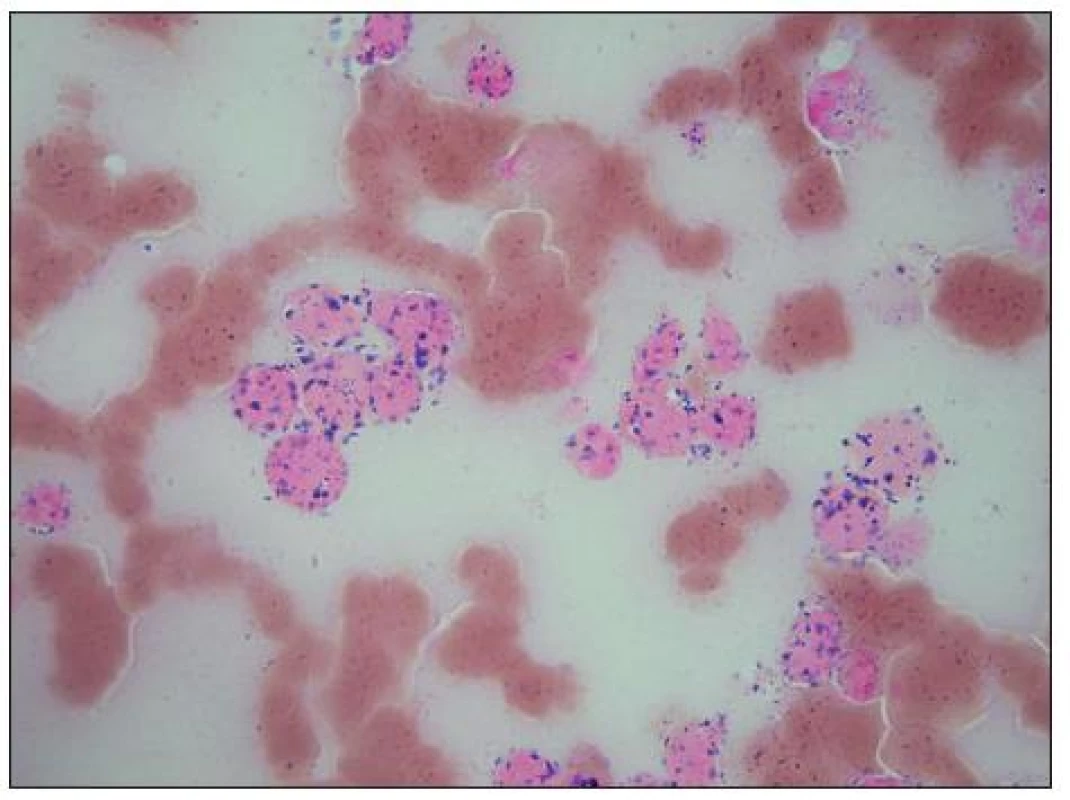
Retinoblastom
Je to další z dětských malobuněčných nádorů, s relativně malým kulatým jádrem. O tomto tumoru je nutno se zde zmínit, poněvadž se uvádí mezi tumory metastazujícími u dětí do KD, metastazuje ale velmi vzácně [20]. I když se vyskytoval mezi našimi nemocnými, nenašli jsme žádný případ dřeňových metastáz. Retinoblastom bývá spojen s chromozomální abnormalito u 13q– [10].
Význam vyšetřování KDve stagingu solidních tumorů
Vyšetření a hodnocení aspirace a trepanobi opsi e KD u dětí je na onkologických pracovištích samozřejmo u so učástí komplexního vstupního vyšetření, např. u ne uroblastomu [1]. Uvádí se [12], že v čase stanovení vstupní di agnózy je infiltrace ne uroblastomem v KD pozitivní asi u 1/ 2 těch dětí, které mají metastatická ložiska v jiných lokalizacích. Při tom je častá neshoda mezi nálezem v nátěrech z aspirace KD a trepanobi opsi emi. Byla např. nalezena pozitivita jen v trepanobi opsii ve 20 %, zatímco v aspirátu byly nalezeny metastázy u 7 % dětí, u nichž byla trepanobi opsi e negativní. Pokud se vyšetřovaly aspirační i trepanobi optické vzorky z levé i z pravé kosti kyčelní, sto upla při stagingu pozitivita asi o 10 %, což není zdaleka zanedbatelné. I tak musí být prohlížení velmi pozorné, protože nádorové buňky můžeme najít často jen v ojedinělých ložiscích [9,13]. Z toho vyplývá, že nelze zanedbat ani jeden z těchto dvo u způsobů. V so učasnosti by byl jiný postup již di agnostickým opomenutím. Vždy musí být vyšetřena jak trepanobi opsi e, tak aspirace. Pracoviště bi optická mají ještě možnost, aby v případech, kdy nálezy nelze považovat za přímo di agnostické, ale jen podezřelé, po užila vyšetření imunohistochemická, např. u ne uroblastomu průkaz NB - 84, chromograninu - A, jehož negativita však výskyt ne uroblastomu údajně nevylučuje [15], nebo rozporně hodnocené ne uron - specifické enolázy [15,16]. U alve olárního RMS je doporučováno vyšetření na desmin, myogenin, myo D1 [15], u ES vyšetření membránového CD 99 [15]. Širší pojednávání bi optických metod je však mimo rámec tohoto referátu. Jak zde bylo již na jiných místech zmíněno, hematolog má jako pomůcku při vyšetření na metastázy v nátěrech po užití různých vyšetření cytochemických, což ovšem nepomůže např. u nálezu jednotlivé podezřelé buňky v nátěru KD. Zatímco cytochemické metody jso u na hematologických pracovištích běžné, po užívání imunocytochemických vyšetření nátěrů z aspirace KD u nás zatím zavedeno není. Ale některé zahraniční práce je doporučují. Je to např. po užití protilátek proti ne uro‑ektodermálním antigenům UJ13A a UJ127.11 u ne uroblastomu [17,18].
Úskalí a možné nesrovnalosti
Při hodnocení hematologických vzorků by u zkušeného pracovníka nemělo dojít k záměně např. komponent normální kostní dřeně za metastatické nádorové buňky. Literatura však upozorňuje na nesnáze se záměno u megakaryocytů, rozmačkaných erytrocytů, oste oblastů, oste oklastů, makrofágů, endoteli í a fibroblastů [1]. Nicméně, a utorům tohoto článku se zdá nepravděpodobné, že by erudovaný hematolog mohl většinu uvedených elementů zaměnit s maligními buňkami, které zde byly uvedeny. Připo uštíme možnost pochyb snad u některých nezralých, malých dysplastických megakaryocytů, nebo megakyryoblastů a některých atypických histi ocytů, např. při srovnání se solitární buňko u rhabdomyocytu, Ewingova sarkomu, nebo u ne uroblastomu při srovnání s lymfocyty, s blasty akutní le ukemi e, případně možnost pochyb při srovnání vakuolizované buňky medulloblastomu s buňko u Burkitttova lymfomu, nebo blastem L3, samozřejmě u všech také vice versa. Maligní buňka by mohla být takto zaměněna za buňku, která se může vyskytno ut v normální KD, nebo za buňku některé hematologické malignity. Za metastázu maligních elementů může být považován např. přebarvený trs slepených oste oblastů [1]. Pochyby a záměny moho u nastat zejména u buněk poškozených, částečně rozdrcených při natírání preparátu, nebo při posuzování nátěru KD v tlusté, nerozetřené a přebarvené počáteční části, což by se proto nemělo dít. V knize [1] Barbary J. Bainové et al (str. 456) se např. upozorňuje, že v případě, je‑li před vpichem bi optické jehly protínána kůže malým řezem a po užije se jednorázová jehla, může se dostat do získaného materi álu částečka kůže, potní žlázy,vlasového váčku nebo kosterního svalu. Zde je připomínáno, že při podezření na nepatřično u příměs, zalito u do parafinového bloku při histologickém vyšetření, je možno po užít k rozlišení molekulární analýzu (PCR) nebo vyšetření histokompatibilitních antigenů (HLA typizace) [19], resp. povrchových CD markerů. To ovšem není možné při hodnocení hematologického preparátu nátěru KD. Stalo se naším zvykem, že ke každému preparátu pořizujeme paralelně s hodnocením mikroskopicko u fotodokumentaci, ktero u archivujeme, a takto dokumentujeme i každo u významno u solitární buňku nejasného původu, aby ji mohlo poso udit více pracovníků, popřípadě aby mohla taková fotografi e být odeslána e‑mailem na jiné pracoviště ke konzultaci. Pokud je to možné, barvíme a srovnáváme při hodnocení metastáz v KD otisk primárního tumoru, jak to doporučují i jiná pracoviště [20].
Tab. 1. Počty pacientů s jednotlivými diagnózami, kteří byli léčeni na Klinice dětské onkologie FN Brno v letech 1998–2007, a uvádí frekvenci infiltací KD nádorovými buňkami. 
Závěr
Víceleté zkušenosti v pátrání po metastázách solidních dětských nádorů, často metastazujících do kostní dřeně, je platno u metodo u jak pro staging na počátku di agnózy, tak pro sledování výskytu metastáz průběhu léčby, popřípadě po ní. Toto vyšetření musí být u dětí prováděno minimálně z obo ustranných aspirací KD z hřebenů kostí kyčelních. Hodnocení by měli provádět minimálně 2 erudovaní lékaři hematologové s dostatečně dlo uho u morfologicko u erudicí v hodnocení patologických kostních dření, popřípadě ještě jeden supervisor. Je‑li k dispozici nátěr nebo otisk z povrchu trepanobi optického válečku, je jeho poso uzení vhodným způsobem ke zvýšení citlivosti vyšetření. Bezpodmínečné je so učasné hodnocení histologické z trepanobi opsi í, které provádí zkušený histopatolog.
MUDr. Svatopluk Valníček
www.fnbrno.cz
e-mail: valnicek.s@seznam.czDoručeno do redakce: 10. 4. 2009
Zdroje
1. Bain BJ, Clark DM, Lampert IA et al. Bone Marrow Pathology. Oxford: Blackwell Sci ence 2001; 430 – 447, 456 – 457.
2. Finkelstein JZ, Ekert H, Isaacs H et al. Bone marrow metastases in children with solid tumo urs. Am J Dis Child 1970; 119 : 49 – 52.
3. Delta BG, Pinkel D. Bone marrow aspirati on in children with malignant tumo urs. J Paedi atr 1964; 64 : 542 – 546.
4. Kleinschmid - Demasters BK. Bone marrow metastases from gli oblastoma multiforme. Cum Pathol 1997; 27 : 197 – 202.
5. Hoffmann M, Heinrich D, Dingeldein Det al. Medulloblastoma with oste oblastic metastasis and bone marrow fibrosis. Bone Marrow Transplant 1999; 23 : 631.
6. Suprun H, Ryvlin AM. Metastatic carcinoma in histologic secti ons of aspirated bone marrow: a comparative a utopsy study. So uth Med J 1976; 69 : 438 – 439.
7. Savage RA, Hoffman GC, Shaker K. Di agnostic problems involved in detecti on of metastatic ne oplasms by bone marrow aspirate compared with needel bi opsy. Am J Clin Pathol 1978; 70 : 623 – 627.
8. Singh G, Kra use JR, Breitfeld V. Bone marrow examinati on for metasatatic tumo ur. Cancer 1977; 40 : 2317 – 2321.
9. Che ung NKV, Heller G, Kushner BH et al. Detecti on of metastatic ne uroblastoma in bone marrow: when is ro utine marrow histology insensitive? J Clin Oncol 1997; 15 : 2807 – 217.
10. Mufti GJ, Flandrin G, Schaefer HE et al. Atlas of malignant haematology London: Martin Dunitz Ltd. Reprint 1997; 356, 366 – 368.
11. Toretzky JA, Kalebic T, Blahasley V et al. The insulin like growth factor - 1 receptor is required for EWS/ FLI - 1 transformati on o fibroblasts. J Bi ol Chem 1997; 272 : 30822 – 30827.
12. Franklin IM, Pritchard J. Detecti on of bone marrow invasi on by ne uroblastoma is improved by sampling at two sites with aspirates and bi opsi es. J Clin Pathol 1983; 36 : 1215 – 1218.
13. Reid MM. Detecti on of bone marrow infiltrati on by ne uroblastoma in clinical practice: how far have we come? Eur J Cancer A Gen Top 1994; 30 : 134 – 135.
14. Kačírková P, Campr V. Hematologický atlas krve a kostní dřeně. Praha: Grada 2007; 251 – 252.
15. Gi angaspero F, Bigner SH, Kleihues P et al. Medulloblastoma. In: Kleihues P, Cavenee WK World He alth Organisati on Classificati on of Tumo urs. Pathology & Genetics Tumo urs of the Nervo us System. Oxord University Press, IARC Press, Lyon 2000; 6 – 7, 129, 141, 153.
16. Reid MM, Sa unders PWG, Bown N et al. Alve olar rhabdomyosarcoma infiltrating bone marrow at presentati on: the value to di agnosis of bone marrow trephine bi opsy specimens. J Clin Pathol 1992; 45 : 759 – 762.
17. Rogers DW, Trele avan JG, Kemshe ad JT et al. Monoclonal antibodi es for detecting bone marrow invasi on by ne uroblastoma. J Clin Pathol 1989; 42 : 422 – 426.
18. Carey PJ, Thomas I, Buckle G et al. Immunocytochemical examinati on of bone marrow in disseminated ne uroblastoma. J Clin Pathol 1999; 43 : 9 – 12.
19. Salisbury J, Byers P. The staging of ne oplasi a. In: Salisbury J, Wo ods C, Byers P(eds). Dise ases of Bones and Jo ints: Cell Bi ology, Mechanisms, Pathology. London: Chapmann and Hall 1994.
20. Collins RD, Swerdlow SH. Pedi atric Hematopathology. New York, Edinburgh, London, Philadelphi a: Churchill Livingstone 2001; 18, 162.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Histiocytární chorobyČlánek Léčba hypertenze u obezity
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo Supplementum 1- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Zmeny vo funkčnom renálnom náleze po maratónskom behu, po 100-kilometrovom behu a po 24-hodinovom dlhotrvajúcom behu
- Zájem pana doc. MUDr. Dušana Mrkose, CSc., o vzácné choroby předběhl o mnoho let program EU zaměřený na vzácné nemoci
- Histiocytární choroby
- Diferenciální diagnostika eozinofilie
- Léčba hypertenze u obezity
- Zahraniční styky Československé hematologické společnosti v letech 1951– 1989
- Vývoj oboru klinické hematologie dospělých v Brně do 90. let minulého století (vzpomínky klinického hematologa)
-
XXVIII. dny mladých internistů
Olomouc, 4.–5. 6. 2009 - Rozdíly mezi muži a ženami u akutního srdečního selhání
- Nová klasifikace Ph negativních chronických myeloproliferativních nemocí v přehledu
- Akutní krvácení z horní části gastro intestinálního traktu
- K významnému životnímu jubileu emeritního editora časopisu Vnitřní lékařství doc. MUDr. Dušana Mrkose, CSc.,
- Di abetik, paci ent internisty
- Indikace k vyšetření rizikových faktorů žilní trombózy
- Hemofili e z pohledu vývoje zajištění péče o nemocné
- Dětské nádory metastazující do kostní dřeně a jejich hematologický obraz
- Přetížení železem – novinky v patogenezi a léčbě
- Koloběhy života aneb doc. MU Dr. Dušan Mrkos, CSc., devadesátníkem
- Léčba chronické myeloidní leukemie (CML) v éře imatinibu
- Maligní lymfomy trávicího traktu
- Současné možnosti diagnostiky a léčby systémové AL-amyloidózy
- Problematika porúch hemostázy pri metabolickom syndróme
- Léčba chronického srdečního selhání v interní ambulanci
- Protrombotický stav pri NAFLD a jeho dôsledky
- Liečba diabetika s ischemickou chorobou srdca
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika eozinofilie
- Přetížení železem – novinky v patogenezi a léčbě
- Histiocytární choroby
- Akutní krvácení z horní části gastro intestinálního traktu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



