-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pokroky v antitrombotickej liečbe – antitrombotiká s anti‑Xa účinkom
Advances in antithrombotic treatment – antithrombotics with anti‑Xa effect
The use of anticoagulants in the prophylaxis and treatment of arterial and venous thrombosis has substantially expanded during the last years. Increasing knowledge about the inherited and acquired thrombophilia and the risk factors predisposing to the recurrency of thromboembolic events result in a new indications for primary and secondary thromboprophylaxis with prolonged or even life-long duration. The limitations of classical anticoagulans, heparin and vitamin K antagonists support the development of medicaments with a specific antithrombotic action. The new generation anticoagulants inhibit in a specific way either particular coagulation enzyme or hemostasis activation step. Based on the in vitro studies and extensive clinical observations the activated factor Xa (F Xa) seems to be one of the most advantageous targets for a specific action of perspective antithrombotic agents. Two selective F Xa inhibitors have been approved for clinical use: fondaparinux is an indirect parenteral F Xa inhibitor, and most recently approved rivaroxaban is the first oral anti‑Xa inhibitor. Other anti‑Xa molecules are under development for either parenteral (idraparinux, DX-9065a) or oral use (razaxaban, apixaban, rivaroxaban, LY-51, 7717, BMS-56247 a DU-176b).
Key words:
new anticoagulants – factor Xa – selective anti‑factor Xa inhibitors
Autoři: A. Bátorová
Působiště autorů: Národné hemofilické centrum, Klinika hematológie a transfuziológie Lekárskej fakulty UK a FN Bratislava, Slovenská republika, prednosta doc. MUDr. Martin Mistrík, Ph. D.
Vyšlo v časopise: Vnitř Lék 2009; 55(3): 295-301
Kategorie: XV. Pařízkovy dny, Nový Jičín, 26.–27. březen 2009
Souhrn
V posledných rokoch sme svedkami rozširujúceho sa použitia antitrombotických liekov v prevencii a liečbe venóznej i arteriálnej trombózy. V súvislosti s rastúcimi vedomosťami o vrodených a získaných trombofilných stavoch a faktoroch predisponujúcich k rekurencii tromboembolizmu pribúdajú indikácie pre primárnu, ale aj dlhotrvajúcu až neohraničenú sekundárnu tromboprofylaxiu. Limitácie klasických antikoagulancií – antagonistov vitamínu K a heparínu – podporili snahy o vývoj účinnejších a bezpečnejších liekov so špecifickým antitrombotickým účinkom. Antitrombotiká novej generácie sú namierené proti konkrétnemu koagulačnému enzýmu, prípadne špecifickému stupňu koagulačnej reakcie. Na základe súčasných poznatkov, výsledkov in vitro štúdií a rozsiahlych klinických pozorovaní sa ukazuje, že jedným z najvýhodnejších cieľov pre inhibičný zásah perspektívnych antitrombotických liekov je aktívny faktor Xa (F Xa). V súčasnosti sú pre klinické použitie registrované 2 selektívne inhibítory F Xa: parenterálny prípravok fondaparinux má nepriamy anti‑Xa účinok a nedávno registrovaný rivaroxaban je prvým perorálnym inhibítorom faktora Xa. Vo vývoji sú aj ďalšie selektívne anti‑Xa inhibítory na pareterálne (idraparinux a DX-9065a) aj na orálne užívanie (apixaban, razaxaban, betrixaban, LY-517717, YM150 a DU-176b).
Kľúčové slová:
nové antikoagulanciá – faktor Xa – selektívne inhibítora faktora XaÚvod
Arteriálna a venózna trombóza je multifaktoriálne ochorenie, ktoré je častou príčinou úmrtia a invalidizácie. Venózna trombóza vedie k pľúcnej embólii (PE), ktorá môže byť fatálna, a k posttrombotickému syndrómu, ktorý vzniká až u 20 % chorých s hlbokou žilovou trombózou [1]. Nemenej závažnými sú prejavy arteriálnej trombózy ako akútne koronárne syndrómy či následky kardioembolických príhod. Napriek stále širšiemu použitiu tromboprofylaxie sa ročná incidencia venóznej trombózy za posledných 25 rokov nezmenila [2,3]. Zvyšuje sa podiel diagnostikovanej PE ako aj priemerný vek pacientov s venóznym tromboembolizmom (VTE) [1,4] a so zlepšením diagnostiky trombofílií sa rozširujú indikácie pre dlhodobú a celoživotnú tromboprofylaxiu. Tieto skutočnosti spolu s existujúcimi limitáciami klasických antikoagulačných liekov odôvodňujú potrebu nových účinnejších, ale aj bezpečnejších antitrombotík najmä na dlhodobú orálnu tromboprofylaxiu.
Vývoj antikoagulancií novej generácie sa opiera o najnovšie poznatky o účinkoch a interakciách koagulačných enzýmov a regulácii hemostázy [5]. Pomocou bunkového in vitro modelu aktivácie hemostázy boli nedávno presne definované jednotlivé fázy koagulačného procesu, v ktorom zohrávajú kľúčovú úlohu dve enzymatické aktivity – F Xa a trombín (obr. 1) [6]. Faktor Xa, vznikajúci ako výsledok iniciálnej fázy aktivácie koagulácie, spôsobuje spočiatku konverziu malého množstva protrombínu na trombín, ktorý zabezpečuje amplifikáciu a tým aj ďalšiu propagáciu koagulačných reakcií s výslednou mohutnou aktiváciou F Xa, generáciou trombínu a formáciou fibrínu. Zatiaľ čo F Xa má kľúčový význam v generácii trombínu, trombín má okrem prokoagulačného účinku aj ďalšie účinky: antikoagulačný (väzbou na receptor endotelových buniek trombomodulín aktivuje inhibičný systém proteínu C), antifibrinolytický (pri dostatočnej koncentrácii trombín aktivuje TAFI – thrombin activatable fibrinolysis inhibitor) a prozápalový (podporuje adhéziu a chemotaxiu leukocytov, bunkovú proliferáciu a angiogenézu). Rozsah aktivácie koagulácie kontrolujú fyziologické inhibítory, ako sú TFPI – tissue factor pathway inhibitor, antitrombín a systém proteínu C,zahrňujúci trombín, trombomodulín a proteíny C a S [6].
Obr. 1. Kľúčová úloha faktora Xa a trombínu v aktivácii hemostázy. Podľa [6,7]. ![Kľúčová úloha faktora Xa a trombínu v aktivácii hemostázy. Podľa [6,7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/278089ea3a81235f573c767b3b802aef.jpeg)
Nové antitrombotiká sú namierené proti špecifickému stupňu koagulačnej reakcie, prípadne konkrétnemu koagulačnému faktoru (obr. 2) [7]. Faktor Xa predstavuje jeden z najvýhodnejších cieľov pre inhibičný zásah perspektívnych antitrombotických liekov, keďže jedna molekula F Xa spôsobí generáciu 1 000 molekúl trombínu. Ukazuje sa, že inhibícia F Xa znižuje potenciál endogénneho trombínu účinnejšie ako priame inhibítory trombínu, pričom zachovaná tvorba malého množstva trombínu stačí na aktiváciu systému proteínu C. Nízke dávky priamych inhibítorov trombínu potláčajú aktivitu trombínu, ale nebránia jeho zvýšenej generácii, keďže neinhibujú predchádzajúce stupne koagulácie, t.j. fázu iniciácie a propagácie. Z pohľadu pôsobenia rôznych koncentrácií týchto 2 dôležitých enzýmov koagulácie sa zdá, že nové antitrombotiká s anti‑Xa účinkom by mohli mať širší terapeutický potenciál, ako majú inhibítory trombínu [8,9].
Obr. 2. Nové antikoagulanciá a miesto ich inhibičného účinku. Podľa [6,7]. ![Nové antikoagulanciá a miesto ich inhibičného účinku. Podľa [6,7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6d9138d13a0023b07afefcb55f631097.jpeg)
Nové antitrombotiká by mali spĺňať nasledovné požiadavky:
- predvídateľný účinok
- vyššiu bezpečnosť, najmä pri dlhodobom užívaní
- nižšie riziko krvácania
- perorálnu aplikáciu
- jednoduché dávkovanie bez potreby monitorovania a
- v konečnom dôsledku by mali znížiť reziduálny výskyt VTE
Vývoj antitrombotík s anti‑Xa účinkom
V širšom slova zmysle historickým základom pre vývoj prvých selektívnych antitrombotík s anti‑Xa účinkom bolo už objavenie heparínu v roku 1916 a neskoršie objasnenie jeho antikoagulačného účinku, viazaného na prítomnosť kofaktora, antitrombínu [10]. Mechanizmus interakcie heparínu a antitrombínu bol opísaný koncom 70. rokov minulého storočia Rozenbergom a Lamom [11] a Lindhalom et al [12], ktorí odhalili závislosť inaktivácie trombínu a faktora Xa na dĺžke molekuly heparínu. Klasický nefrakcionovaný heparín (UFH) je heterogénnou zmesou polysacharidových reťazcov s priemernou molekulovou hmotnosťou 15 000 D (3 000–30 000 D) a reťazcami o dĺžke 45 monosacharidov; 1/3 reťazcov obsahuje vysoko-afinitnú pentasacharidovú sekvenciu. Špecifická väzba heparínu na lyzínové miesto antitrombínu (AT) vedie ku konformačným zmenám jeho reaktívneho centra. Antitrombín rýchlo a ireverzibilne inaktivuje trombín a ďalšie koagulačné enzýmy (F Xa, F IXa, F XIa a F XIIa, a dokonca aj F VIIa). Pre inaktiváciu F Xa stačí väzba pentasacharidu na AT, zatiaľ čo pre inhibíciu trombínu je okrem väzby pentasacharidovej sekvencie potrebné aj premostenie medzi trombínom a AT pomocou heparínových reťazcov dlhších ako 18 monosacharidov [13].
UFH je vysoko účinné antikoagulans, má však viacero nevýhodných vlastností. Má nízku bioavalabilitu (30 %) a krátky biologický polčas závislý na dávke (30–150 min). Jeho väzba na plazmatické proteíny, vrátane doštičkového faktora 4 (PF4) a bunky (endotel, makrofágy) zapríčiňuje variabilitu jeho antikoagulačného účinku a u niektorých pacientov je príčinou fenoménu „rezistencie na heparín“ [13]. K biologickým limitáciám heparínu patrí imunologicky podmienená heparínom-indukovaná trombocytopénia (HIT), osteoporóza ako výsledok heparínovej supresie osteoblastov a aktivácie osteoklastov a kožné alergické reakcie. Liečba heparínom, tak ako aj inými antikoagulanciami, prináša so sebou aj riziko krvácavých komplikácií.
Vývoj nízkomolekulových heparínov (LMWH) v 80. rokoch minulého storočia vychádzal z pozorovaní dobrej účinnosti heparínu po jeho podkožnej aplikácii s predpokladanou rezorbciou kratších reťazcov [14], ako aj z pozorovania, že LMWH majú podstatne nižší anti‑IIa účinok v porovnaní s anti‑Xa pôsobením. V experimentoch na zvieratách bol významným pozorovaním nižší výskyt krvácavých komplikácií, ako má UFH pri rovnakom antitrombotickom efekte [15].
Nízkomolekulové heparíny pripravované z UFH chemickou alebo enzymatickou depolymerizáciou, majú molekulovú hmotnosť 4 000–5 000 D s priemerným obsahom 15 monosacharidov v reťazci. Rovnako ako UFH aj LMWH inhibujú koaguláciu nepriamo, prostredníctvom interakcie s antitrombínom, pričom ich antikoagulačný efekt zabezpečuje vysoko-afinitná pentasacharidová sekvencia. Menší rozsah inaktivácie trombínu vyplýva z neschopnosti malých fragmentov viazať sa súčasne na antitrombín aj trombín, pričom inaktivácia faktora Xa je rovnako účinná ako s veľkými molekulami heparínu.
LMWH majú oproti UFH mnohé výhody:
- vysokú bioavailabilitu (80–98 %) po s.c. aplikácii
- lepšie predvídateľnú odpoveď a dlhšíbiologický polčas (4–5 hod) v dôsledku podstatne nižšej väzby LMWH na iné proteíny a bunky
- monitorovanie liečby nie je nutné
- nižší výskyt krvácavých komplikácií
- možnosť účinnej a pritom bezpečnej ambulantnej a domácej tromboprofylaxie a liečby VTE
V súčasnosti sú dostupné viaceré typy LMWH, ktorých farmakokinetický a antitrombotický profil sa mierne líši v dôsledku rôznych metód depolymerizácie molekúl. Napriek tomu sa všetky LMWH považujú za účinné a bezpečné lieky na prevenciu a liečbu VTE, so širokým využitím v chirurgických aj internistických odboroch, vrátane liečby pacientov s akútnym koronárnym syndrómom [13,16]. Nevýhodou LMWH je ich inkompletná neutralizácia protamínom. Riziko nežiadúcich účinkov klasického heparínu je pri použití LMWH podstatne redukované, ale nie je úplne eliminované (osteoporóza, alergické reakcie a heparínom indukovaná trombocytopénia). Z parenterálneho podávania vyplývajú ďalšie limitácie týkajúce sa compliance pacienta, najmä pri potrebe neohraničenej, resp. celoživotnej tromboprofylaxie.
Heparínom-indukovaná trombocytopénia predstavuje závažnú komplikáciu liečby heparínom, ktorá sa objavuje na 5.–14. deň liečby a je podmienená heparín-dependentnými protilátkami (najčastejšie IgG) namierenými proti komplexu heparín/PF4. Väzba komplexov IgG/heparín/PF4 na trombocyty spôsobuje ich aktiváciu a masívnu agregáciu s klinickými prejavmi život, prípadne končatinu ohrozujúcich arteriálnych a venóznych trombóz. Incidencia HIT je 3–7,5 % pri liečbe UFH, riziko sa zvyšuje s dĺžkou a stupňom sulfatácie heparínových reťazcov [17]. Napriek nízkej incidencii HIT pri liečbe LMWH (0,5 %) stále širšie použitie týchto liekov spôsobuje, že sa s touto komplikáciou stretávame stále častejšie. Pri terapeutickom použití UFH je medzi 4. a 14. dňom liečby potrebné monitorovanie počtu trombocytov ob deň, pri tromboprofylaxii a použití LMWH raz za 3 dni [1]. Typickým prejavom HIT je pokles počtu trombocytov o viac ako 50 % východiskovej hodnoty, výskyt novej trombózy v priebehu liečby heparínom a úprava trombocytov po jeho vynechaní, preto je prvou zásadou liečby HIT zastavenie akejkoľvek heparinoterapie. Vzhľadom na skutočnosť, že až 53 % chorých vyvinie trombózu aj po vysadení heparínu, odôvodňuje naliehavú potrebu alternatívnej antikoagulačnej liečby (lepirudín argatroban, danaparoid sodný), kumaríny sú kontraindikované, pokiaľ počet trombocytov nie je normalizovaný (hrozí riziko trombózy pre deficit inhibítorov proteínu C a S). LMWH majú až 100% skríženú reaktivitu s protilátkami séra pacientov s HIT, čo vylučuje možnosť ich použitia v liečbe tejto komplikácie [18].
Selektívne anti‑Xa antitrombotiká
Poznatky o mechanizme pôsobenia a výhodách LMWH boli dôležitým východiskom pre vývoj ďalšej generácieantitrombotík so selektívnym anti‑Xaúčinkom. V súčasnosti existujú viaceré selektívne antitrombotiká s anti‑Xa účinkom, ktoré inhibujú F Xa nepriamo prostredníctvom väzby na antitrombín (fondaparinux, idraparinux) alebo priamo blokujú aktívne miesto F Xa a jeho interakcie so substrátmi (tab. 1). Do skupiny priamych inhibítorov F Xa patrí parenterálny prípravok DX-9065a a orálne lieky rivaroxaban, apixaban, betrixaban, razaxaban, LY-517717, BMS-56247 a DU-176b.
Fondaparinux
Fondaparinux (Glaxo Smith Kline) je prvý biosyntetický selektívny inhibítor F Xa, registrovaný pre klinické použitie od roku 2001 [19]. Zloženie fondaparinuxu vychádza z chemickej štruktúry prirodzeného pentasacharidu prítomného v heparíne a v LMWH, pričom odlišná sulfatácia ešte viac potencuje jeho vysokú afinitu ku antitrombínu. Molekula fondaparinuxu je príliš malá na premostenie AT a trombínu, preto neinhibuje trombín, ale inaktiváciou F Xa brzdí generáciu trombínu. Komplex fondaparinux/AT sa kovalentne viaže na F Xa, z tejto väzby sa fondaparinux uvoľňuje a reutilizuje v inhibícii ďalšieho F Xa. Výhodami fondaparinuxu sú:
- vysoká bioavailabilita (100%) a predvídateľný antikoagulačný účinok
- liek nie je metabolizovaný a vylučuje sa obličkami v nezmenenej forme
- neviaže sa na plazmatické proteíny a bunky
- dlhý biologický polčas(17–21 hod) umožňuje aplikáciu lieku v 24hodinovom intervale
- nie sú známe žiadne liekové interakcie
- neprechádza placentou
- v terapeutických dávkach neovplyvňuje koagulačné testy, liečbu nie je potrebné monitorovať
Profylaktická dávka fondaparinuxu je 2,5 mg a terapeutická dávka pri VT a PE je 7,5 mg. U pacientov s poškodením obličiek je potrebná adjustácia dávky a liek by sa nemal používať u chorých s renálnym zlyhaním. Nedávno sa v literatúre objavili ojedinelé správy o použití fondaparinuxu počas dialýzy. Problémom je však kumulácia lieku medzi dialýzami, preto sa liek musí rezervovať len pre pacientov, ktorí potrebujú antikoagulačnú liečbu aj v období medzi dialýzou [20]. V Európe je fondaparinux registrovaný pre liečbu VTE a PE, prevenciu VTE v internej medicíne, brušnej a ortopedickej chirurgii (totálna artroplastika kolena a bedra a fraktúra femuru), pričom po operácii fraktúry femuru je registrovaný pre prolongovanú tromboprofylaxiu v trvaní 25–35 dní. V prevencii VTE v ortopedickej chirurgii sa prvá dávka fondaparinux podá najskôr za ≥ 6 hod po uzavretí rany pri potvrdenej hemostáze. Incidencia veľkého krvácania pri pooperačnej tromboprofylaxii je 2,8 % [20]. Fondaparinux nemá špecifické antidótum. V prípade krvácania a nutnosti urgentnej reoperácie sa výhoda dlhšieho biologického polčasu fondaparinuxu stáva nevýhodou. Pri krvácaní je nutné okamžite prerušiť ďalšiu aplikáciu lieku, hľadať lokálnu príčinu krvácania a zabezpečiť chirurgickú hemostázu. Čiastočný hemostatický účinok možno očakávať od podania r-F VIIa. V prípade nutnosti reoperácie je nutné zvážiť jej urgentnosť, opakovaná intervencia je však možná najskôr za 24 hod, prípadne až za 36 hod po poslednej aplikácii lieku. Pri nutnosti skoršej reoperácie sa odporúča podať r-F VIIa v dávke 90 μg/kg [21,22].
Syntetický pentasacharid nespôsobuje tvorbu protilátok a nereaguje so sérom pacientov s HIT a ani neaktivuje trombocyty v prítomnosti HIT protilátok (tab. 2) [23,24]. V literatúre sa objavili správy o úspešnom použití fondaparinuxu vo viac ako 40 prípadoch HIT [25,26]. Pri nedostupnosti alternatívnych antikoagulancií sme fondaparinux úspešne použili (dávka 7,5 mg počas 14 dní) aj na našom pracovisku u pacientky so sérologicky potvrdenou HIT a hlbokou žilovou trombózou (obr. 3) [27]. Fondaparinux však nie je zahrnutý do skupiny liekov odporúčaných pre liečbu HIT a jeho použitie pri zlyhaní alebo nedostupnosti alternatívnej liečby HIT spočíva na individuálnom rozhodnutí a zodpovednosti lekára [18]. V roku 2007 bol publikovaný prvý prípad syndrómu trombocytopénie s trombózou po liečbe pentasacharidom [28]. Keďže išlo o jediný dokumentovaný prípad HIT na viac ako 1,04 miliónov použití fondaparinuxu do roku 2006 (riziko < 1 : 1,105–106) a zatiaľ nebola stanovená jednoznačná kauzálna súvislosť medzi liečbou fondaparinuxom a HIT, FDA ani EMEA pri liečbe fondaparinuxom nenariadili potrebu monitorovanie trombocytov.
Obr. 3. HIT s trombotickými komplikáciami u 79- ročnej pacientky po ortopedickej operácii – liečba HIT fondaparinuxom. 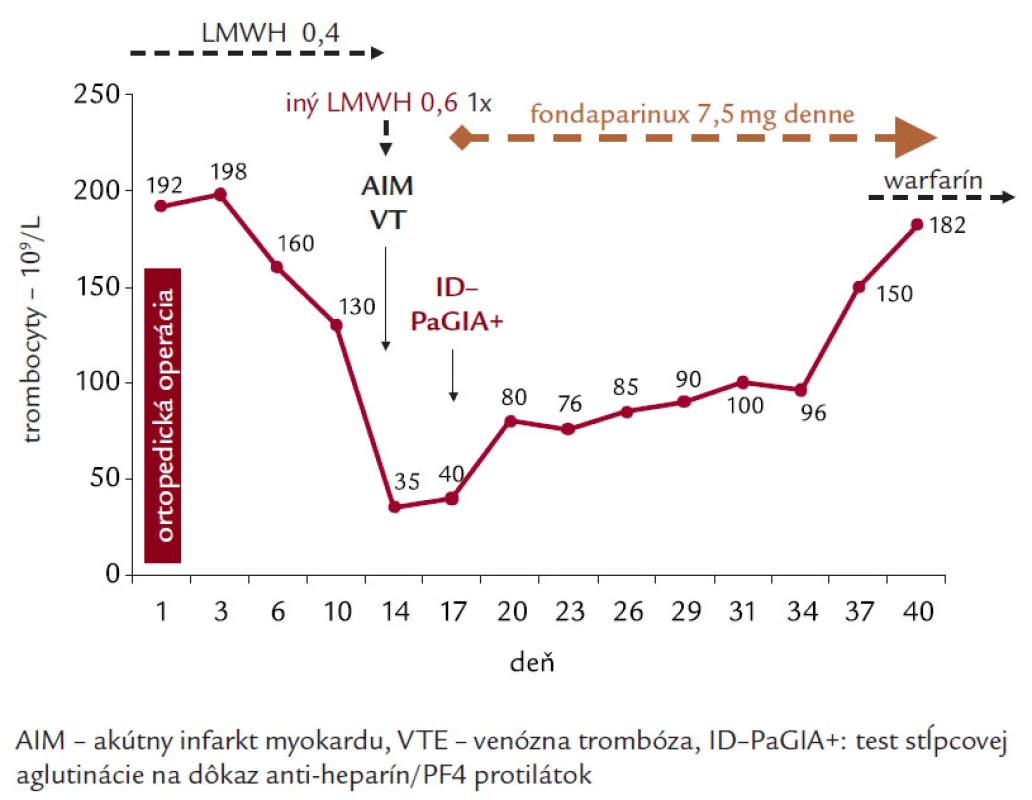
Idraparinux
Idraparinux (Sanofi-Aventis/Organon) je parenterálny, viac sulfátovaný derivát fondaparinuxu, ktorý s vysokou afinitou viaže AT, čo spôsobuje, že jeho biologický polčas sa takmer rovná T1/2 antitrombínu a umožňuje pohodlnú s.c. aplikáciu lieku 1krát týždenne. V II. fáze klinických skúšok, porovnávajúcich efekt liečby idraparinuxom a warfarínom počas 12 týždňov, sa pri dávke 2,5 mg idraparinuxu pozoroval nižší výskyt krvácavých komplikácií ako pri použití warfarínu [29]. Nevýhodou lieku, podobne ako pri fondaparinuxe, je absencia antidóta, komplikujúca situáciu v prípadoch traumy a potreby urgentnej chirurgie. V III. fáze klinických skúšok „van Gogh“ a „Amadeus“ sa sledoval farmakokinetický profil idraparinuxu pri dávke 2,5 mg a u jedincov s renálnym poškodením (kreatinínová klírens < 30 ml/kg/hod) po iniciálnej dávke 2,5 mg a pri udržiavacej dávke 1,5 mg. Výhodné vlastnosti idraparinuxu – rýchly nástup účinku a dlhotrvajúci antikoagulačný efekt – predstavujú sľubné východisko pre ďalší liek vo vývoji, idrabiotaparinux, reverzibilnú biotinylovanú formu indraparinuxu [30].
Priame inhibítory faktora Xa
Rivaroxaban (Xarelto®, Bayer), derivát oxazolidinonu, je prvý orálny selektívny priamy inhibítor F Xa, ktorý sa viaže priamo na aktívne miesto F Xa (Ki 0,4 nM). Inhibuje F Xa voľný, viazaný na fibrín aj protrombinázovú aktivitu. Liek má vysokú biologickú dostupnosť (80 %), rýchly nástup účinku a predvídateľnú farmakokinetiku a farmakodynamiku. Biologický polčas rivaroxabanu je 5–9 hod, u starších jedincov 11–13 hod. Užíva sa vo fixnej dávke 10 mg denne, bez potreby adjustácie podľa hmotnosti pacienta a bez potreby laboratórneho monitorovania. Rivaroxaban môžu užívať aj pacienti liečení acetylsalicylovou kyselinou, nesteroidnými antireumatikami, LMWH a clopidogrelom. Na základe rozsiahlych klinických skúšok v súbore viac ako 12 500 pacientov podrobujúcich sa ortopedickým operáciám bol liek registrovaný pre tromboprofylaxiu po totálnej artroplastike bedrového (THR) a kolenného kĺbu (THR). Štúdie RECORD1 (rivaroxaban 10 mg vs enoxaparín 40 mg podávané 35 ± 4 dní) a RECORD2 (rivaroxaban 10 mg 35 ± 4 dní vs enoxaparín 40 mg 12 ± 2 dní) potvrdili signifikantne vyšší efekt rivaroxabanu v prevencii VTE u pacientov po THR [31,32]. Podobne ďalšie dve štúdie vykonané u pacientov po TKR, RECORD3 (rivaroxaban 10 mg 12 ± 2 dní vs enoxaparín 40 mg 12 ± 2 dní) a RECORD4 (rivaroxaban 10 mg 12 ± 2 dní vs enoxaparín 2krát 30 mg 12 ± 2 dní) potvrdili superioritu rivaroxabanu oproti LMWH v redukcii výskytu celkového aj symptomatického VTE, pri porovnateľne nízkom riziku celkových a veľkých krvácavých komplikácií [33,34]. V súčasnosti prebieha III. fáza klinických skúšok v prevencii VTE v internej medicíne (štúdia MAGELLAN, rivaroxaban vs enoxaparín), v prevencii mozgových príhod pri fibrilácii predsiení (štúdia ROCKETAF, rivaroxaban vs warfarín), v liečbe venóznej trombózy a pľúcnej embólie (EINSTEIN, rivaroxaban 20 mg vs štandardná liečba) a II. fáza klinických skúšok u pacientov s akútnym koronárnym syndrómom (ATLAS, rivaroxaban ako doplnok štandardnej liečby – aspirín a clopidogrel).
Apixaban (Bristol-Myers Squibb) je ďalší potentný selektívny, reverzibilný orálny inhibítor F Xa, ktorý má významný antitrombotický efekt a priaznivé farmakologické vlastnosti. V súčasnosti sa vyhodnocujú výsledky II. a III. fázy klinických skúšok s liečbou VTE, zahrňujúcich takmer 25 000 pacientov. Prebiehajú aj skúšky u viac ako 20 000 pacientov s akútnym koronárnym syndrómom a pri prevencii mozgových príhod u pacientov s nevalvulárnou fibriláciou predsiení. Tento liek je najbližšie ku registrácii pre klinické použitie [35].
Betrixaban (Portola Pharmaceuticals), Razaxaban (Bristol-Myers Squibb) a LY517717 (Lilly) sú ďalšie tri orálne selektívne priame anti‑Xa inhibítory, ktoré boli v klinických skúškach porovnávané s enoxaparínom u ortopedických pacientov podrobujúcim sa náhradám kĺbov s porovnateľným výsledným efektom a priaznivým profilom z hľadiska rizika krvácania [36,37]. Ambíciou betrixabanu je aj prevencia VTE a mozgových príhod pri fibrilácii predsiení.
DX-9065a je nepeptidický arginínový derivát na parenterálnu aplikáciu, ktorý sa reverzibilne viaže na aktívne miesto F Xa. Biologický polčas lieku je 45 min po i.v. aplikácii. Priaznivé výsledky I. fázy klinických štúdií u pacientov s koronárnym syndrómom aj II. fázy v randomizovanej štúdii u pacientov s perkutánnou koronárnou intervenciou, kde sa liek porovnával s heparínom, ukazujú, že DX-9065a by mohol byť dobrou alternatívou heparínu. V súčasnosti sa očakávajú výsledky III. fázy klinických štúdií [7].
Ďalšie antikoagulanciá vedúce k inhibícii tvorby F Xa
V širšom slova zmysle, i keď nepriamo, aktiváciu faktora Xa brzdia aj látky inhibujúce predchádzajúce stupne koagulačnej kaskády:
Iniciálnu fázu koagulácie inhibujú rekombinantný TFPI (tissue factor pathway inhibitor – tifacogin), ktorý inhibuje komplex TF/F VIIa [38], ďalej Faktor VIIai – inaktivovaná forma F VIIa, ktorá slúži ako kompetitívny inhibítor tkanivovej cesty aktivácie F IX a F X, a nakoniec NAPc2, rekombinantná forma antikoagulačného proteínu, pôvodne izolovaného z Ancylostoma caninum, ktorá sa viaže na nekatalytické miesta F X a F Xa, inhibuje F VIIa v komplexe TF/F VIIa, a má teda podobný účinok ako TFPI. Výsledky klinického skúšania prvých 2 prípravkov nesplnili očakávania, a preto boli ďalšie klinické skúšky zastavené [39,40]. Sĺubné sú však výsledky II. fázy klinických skúšok s NAPc2 u pacientov s artroplastikou kolena a v súčasnosti sa vyhodnocujú výsledky skúšok u pacientov s koronárnym syndrómom [7].
Fázu propagácie, ktorá bezprostredne vyúsťuje do aktivácie F Xa, potláčajú inhibítory F IXa a modulátory inhibičného systému proteínu C.
K inhibítorom F IXa patria dva parenterálne prípravky: F IXai s blokovaným aktívnym miestom, ktorý vytesňuje F IXa z inkorporácie do vnútorného tenázového komplexu [41] a monoklonálne protilátky proti F IX/F IXa, ktoré inhibujú aktiváciu F IXa faktorom F Xia [42]. TPP-889 je orálny inhibítor F IXa. Žiaden z vyššie uvedených liekov však nedospel ani do II. fázy klinického skúšania [7].
Modulátory inhibičného systému proteínu C, plazmatický proteín C – Ceprotin (Baxter) a aktivovaný proteín C – drotrecogin α – Xigris (Lilly) podporujú inaktiváciu kofaktorov koagulácie – F VIIIa a F Va, esenciálnych pre propagačnú fázu aktivácie hemostázy. Tieto lieky sa uplatňujú predovšetkým v prevencii a liečbe diseminovanej intravaskulárnej koagulácie a multiorgánového zlyhania pri sepse. Pri ťažkých septických stavoch sa preferuje podanie už aktivovaného proteínu C, nakoľko in vivo môže byť trombomodulínový mechanizmus aktivácie menej funkčný v dôsledku poškodenia endotelu [43,44].
Solubilný trombomodulín (sTM) je rekombinantný analóg extracelulárnej domény trombomodulínu (TM), ktorý podobne ako s membránou viazaný TM viaže trombín a konvertuje ho z prokoagulačného enzýmu na účinný aktivátor proteínu C, a teda prostriedok antikoagulácie. Biologický polčas sTM je 2–3 dni. Po priaznivých výsledkoch II. fázy klinických skúšok u pacientov s DIC [45] a pri prevencii VTE u pacientov s artroplastikou bedrového kĺbu [46] sa očakáva III. fáza klinických skúšok na porovnanie sTM s inými formami tromboprofylaxie, napr. LMWH.
Záver
V súčasnosti je pre klinické použitie registrovaný nepriamy selektívny anti‑Xa inhibítor fondaparinux (Arixtra) a od roku 2008 prvý orálny priamy inhibítor F Xa rivaroxaban (Xarelto), ako aj niekoľko liekov nepriamo potláčajúcich generáciu F Xa (modulátory systému proteínu C). Keďže rivaroxaban bol registrovaný len pre tromboprofylaxiu po výmene bedrových a kolenných kĺbov, a podobne je to aj pri nedávno registrovanom priamom inhibítore trombínu (dabigatran) [47], znamená to, že podstatná časť tromboprofylaxie a liečby arteriálnej a venóznej trombózy ostáva na pleciach klasických antikoagulancií, LMWH a parenterálnych priamych inhibítorov trombínu (lepirudin, argatroban). Pokračuje však vývoj radu nových anti‑Xa preparátov, niektoré sú v štádiu klinických skúšok, a už čoskoro sa očakáva registrácia ďalších liekov, ako sú apixaban a idrabiotaparinux. Ďalej pokračuje aj intenzívne štúdium mechanizmov zrážania krvi a vzájomných interakcií koagulačných enzýmov, ktoré by malo zodpovedať otázku optimálneho cieľového enzýmu alebo stupňa koagulačného mechanizmu pre zásah nových, ideálnych antikoagulancií s optimálnym stupňom účinnosti a bezpečnosti.
Doručeno do redakce: 18. 2. 2009
doc. MUDr. Angelika Bátorová, Ph.D.
www.fnspba.sk
e‑mail: batorova@hotmail.com
Zdroje
1. Rosendaal FE, Van Hylcama Vlieg A, Doggen JM. Venous thrombosis in elderly. J Thromb Haemost 2007; 5 (Suppl 1): 310–317.
2. Silverstein MD, Heit JA, Mohr DN et al. Trends in the incidence of deep venous thrombosis and pulmonary embolism: a 25 year population‑based study. Arch Intern Med 1998; 158 : 585–593.
3. Heit JA. Venous thromboembolism: disease burden, outcomes and risk factors. J Thromb Haemost 2005; 3 : 1611–1617.
4. Stein PD, Hull RD, Kayali F et al. Venous thromboembolism according to age; impact of an aging population. Arch Intern Med 2004; 164 : 2260–2263.
5. Davie EW. Biochemical and molecular aspects of the coagulation cascade. Thromb Haemost 1995; 75 : 1–6.
6. Hoffman M, Monroe DM. III A cell - -based model of hemostasis. Thromb Haemost 2001; 85 : 958–965.
7. Weitz JI, Bates SM. New anticoagulants. J Thromb Haemost 2005; 3 : 1843–1853.
8. Ansell J. Faxtor Xa or thrombin: is factor Xa a better target? J Thromb Haemost 2007; 5: (Suppl 1): 60–64.
9. Weitz JI. Factor Xa or thrombin: Is thrombin a better target? J Thromb Haemost 2007; 5 (Suppl 1): 65–67.
10. Abilgaard U. Highly purified antithrombin III with heparin cofactor activity prepared by disc electrophoresis. Scand J Clin Lab Invest 1968; 21 : 89–91.
11. Rosenberg RD, Lam L. Corelations between structure and function of heparin. Proc Natl Acad Sci USA, 1979; 76 : 1218–1222.
12. Lindahl U, Backtrom G, Hook M et al. Structure and antithrombin‑binding site of heparin. Proc Natl Acad Sci USA 1979; 76 : 3198–3202.
13. Hirsh J. Low molecular weight heparins. 4th ed. Hamilton: BC Decker Inc 2007.
14. Johnson EA, Kirkwood TB, Stirling Y et al. Four heparin preparations: anti‑Xa potentiating effect of heparin after subcutaneous injection. Thromb Haemost 1976; 35 : 586–591.
15. Carter CJ, Kelton JG, Hirsh J et al. The relationship between the hemorrhagic and antithrombotic properties of low molecular weight heparin in rabbits. Blood 1982; 59 : 1239–1245.
16. Weitz JI. Low molecular-weight heparins. N Engl J Med 1997; 337 : 688–698.
17. Warkentin TE, Levine MN, Hirsh J et al. Heparin‑induced thrombocytopenia in patients treated with low-molecular weigh heparin or unfractionated heparin. N Eng J Med 1995; 3232 : 1330–1335.
18. Warkentin TE, Greinacher A. Heparin‑induced thrombocytopenia. Recognition, treatment and prevention. Chest 2004; 126 (Suppl 3): 311–337.
19. Hirsh J. Fondaparinux. Hamilton: BC Decker Inc 2007.
20. Kalicki RM, Aregger F, Alberio L et al. Use of the pentasaccharide fondaparinux as an anticoagulant during haemodialysis. Thrombosis Haemost 2007; 98 : 1200–1207.
21. Bijstervald NR, Moons AH, Boeckhold SM et al. Ability of recombinant factor VIIa to reverse the anticoagulant effect of the pentasacharide fondaparinux in healthy volunters. Circulation 2002; 106 : 2550 – 2554.
22. Turpie AGG, Eriksson BI, Bauer KA et al. Fondaparinux. J Am Acad Ortop Surg 2004; 12 : 371–375.
23. Savi P, Chong BH, Greinacher A et al. Effect of fondaparinux on platelet activation in the presence of heparin. Blood 2005; 105 : 139–144.
24. Warkentin TE. HIT. Lessons learned. Pathophysiol Haemos Thromb 2006; 1–2 : 50–57.
25. Harenberg J, Jorg I, Fenyvesi T. Treatment of heparin‑induced thrombocytopenia with fondaparinux. Haematologica 2004; 89 : 1017–1018.
26. Efird L. Fondaparinux for thromboembolic treatment and prophylaxis of heparin‑induced thrombocytopenia. Ann Pharmacother 2006; 40 : 1383–1387.
27. Bátorová A, Skraková M, Labancová Aet al. Manažment heparínom-indukovanej trombocytopénie. Interná medicína 2006; 10 : 31.
28. Warkentin TE, Maurer BT, Aster RH et al. Heparin‑induced thrombocytopenia associated with fondaparinux. N Engl J Med 2007; 356 : 2653–2654.
29. Weitz JI, Hirsh J, Samama M. New anticoagulant drugs. Chest 2004; 126 (Suppl 3): 265–285.
30. Veyrat-Follet C, Vivier N, Trellu M et al. The pharmacokinetics of idraparinux, a long acting indirect factor xa inhibitor: population pharmacokinetic analysis from Phase III clinical trials. J Thromb Haemost 2009; Epub ahead of print.
31. Eriksson BI, Borris LC, Friedman RJ et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358 : 2765–2775.
32. Kakkar AK, Brenner B, Dahl OE et al. Extended duration rivaroxaban versus short‑term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomised controlled trial. Lancet 2008; 372 : 31–39.
33. Lassen MR, Ageno W, Borris LC et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008; 358 : 2776–2786.
34. Abrams PJ, Emerson CR. Rivaroxaban, a novel direct oral anti Xa inhibitor. Pharmacotherapy 2009; 29 : 167–181.
35. Carreiro J, Ansell J Apixaban, an oral direct Factor Xa inhibitor: awaiting the verdict. Expert Opin Investig Drugs 2008; 17 : 1937–1945.
36. Turpie AG, Bauer KA, Davidson BL et al. EXPERT Study Group. A randomized evaluation of betrixaban, an oral factor X inhibitor, for prevention of thromboembolic events after total knee replacement (EXPERT). Thromb Haemost 2009; 101 : 68–76.
37. Agnelli G, Haas S, Ginsberg JS at al. A phase II study of the oral factor Xa inhibitor LY517717 for the prevention of venous thromboembolism after hip or knee replacement. J Thromb Haemost 2007; 5 : 746–753.
38. Abraham E, Reinhart K, Opal S et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomised control trial. JAMA 2003; 290 : 238 – 247.
39. Golino P, Ragni M, Cirillo P et al. Antithrombotic effects of recombinant human, active site-blocked factor VIIa in a rabbit model of recurrent and arterial thrombosis. Circulation Res 1998; 82 : 39–46.
40. Jang Y, Guzman LA, Lincoff AM et al. Influence of blockade at specific levels of the coagulation cascade on restenosis in a rabbit atherosclerotic femoral artery injury model. Circulation 1995; 92 : 3041–3050.
41. Benedict CR, Ryan J, Wolitzky B et al. Active-site blocked factor IXa prevents intravascular thrombus formation in the coronary vasculature without inhibiting extravascular coagulation in a canine thrombosis model. J Clin Invest 1991; 88 : 1760–1765.
42. Fuererstein GZ, Toomey JR, Valocik R et al. An inhibitory anti‑factor IX antibody effectively reduces thrombus formation in a rat model of venous thrombosis. Thromb Haemost 1999; 92 : 1443–1450.
43. White B, Livingstone W, Murphy C et al. An open label study of the adjuvant hemostatic support with protein C replacement in purpura fulminans‑associated menongococcaemia. Blood 2000; 96 : 3719–3724.
44. Bernard GR, Vincent JL, Laterre PF et al. Efficacy and safety of recombinant activated protein C for severe sepsis. N J Engl Med 2001; 344 : 699–709.
45. Aoki Y, Ohishi R, Takei R et al. Effects of recombinant human soluble thrombomodulin (rhs-TM) on a rat model of disseminated intravascular coagulation with decreased levels of plasma antithrombin III. Thromb Haemost 1994; 71 : 452–455.
46. Kaeron C, Comp P, Douketis JD et al. A dose‑response study of recombinant human soluble thrombomodulin (ART-123) for prevention of venous thromboembolism sfter unilateral total hip replacement. J Thromb Haemost 2003; 1 (Suppl 1): OC330.
47. Baetz BE, Spinler SA. Dabigatran etexilate: an oral direct thrombin inhibitor for prophylaxis and treatment of thromboembolic diseases. Pharmacotherapy 2008; 28 : 1354–1373.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek RecenzeČlánek Sborník abstrakt
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Transplantace autologních kmenových buněk kostní dřeně u pacientů s chronickou kritickou končetinovou ischemií a diabetickou nohou
- Záchrana ischemickej končatiny terapeutickou angiogenézou
- Užití adultních humánních kmenových buněk kostní dřeně při terapii míšního poranění
- Naše první zkušenosti s transplantací autologních kmenových buněk kostní dřeně v léčbě pakloubů, opožděného hojení zlomenin a defektních zlomenin dlouhých kostí
- Profylaxe tromboembolické nemoci ve vnitřním lékařství
- Prevence žilního tromboembolizmu v chirurgii, laparoskopické chirurgii, urologii
- Prevence žilní tromboembolické nemoci v ortopedii a traumatologii
- Antitrombotická profylaxe v těhotenství
- Profylaxe venózního tromboembolizmu v gynekologii
- Profylaxe a léčba tromboembolické nemoci v onkologii
- Trombotické komplikace u dětí s onkologickým onemocněním
- Léčba trombózy u dětí pomocí kontinuální intravenózní infuze – možná alternativa k subkutánnímu podání tam, kde je třeba
- Operace srdce jako závažný zásah do koagulačního stavu pacienta
- Péče o pacienty s nemocí chladových protilátek, kryoglobulinemií a kryofibrinogenemií před kardiochirurgickými zákroky
- Trombofilní stavy: význam pro prevenci a léčbu žilního tromboembolizmu
- Antifosfolipidový syndrom v roce 2009
- Metabolické a aktivační děje v krevních destičkách a možnosti jejich inhibice
- Úloha kaválních filtrů v prevenci plicní embolie
- Příprava pacientů s antikoagulační léčbou k invazivním zákrokům
- Krvácivé komplikace antikoagulační léčby
- Laboratorní postup při nálezu trombocytopenie
- Pokroky v antitrombotickej liečbe – antitrombotiká s anti‑Xa účinkom
- Molekulární metody v diagnostice trombofilních stavů
- Prvé angiologické pracovisko (PAP) – 35. výročie vzniku prvého klinického angiologického pracoviska v Slovenskej republike
- Recenze
- Sborník abstrakt
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Laboratorní postup při nálezu trombocytopenie
- Péče o pacienty s nemocí chladových protilátek, kryoglobulinemií a kryofibrinogenemií před kardiochirurgickými zákroky
- Prevence žilní tromboembolické nemoci v ortopedii a traumatologii
- Antitrombotická profylaxe v těhotenství
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





