-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Heparinem indukovaná trombocytopenie
Heparin induced thrombocytopenia
Heparin induced thrombocytopenia (HIT) represents a very serious complication of heparin therapy associated with high morbidity and/or mortality. HIT is caused by generation of antibodies against macromolecular complexes of heparin/platelet factor 4 resulting in activation of platelets, monocytes, endothelium and neutrophils with subsequent high thrombin generation and induction of a hypercoagulable state. Therapy with heparins must be interrupted and alternative non-heparin antithrombotics must be introduced. The diagnosis of HIT is based on clinical findings namely the so called 4T score and laboratory tests. Immunological tests have a high negative predictive value in excluding HIT. In positive cases, the diagnosis must be confirmed by functional tests. Novel developments in the therapy of HIT include the introduction of the new direct oral anticoagulants.
Keywords:
heparin induced thrombocytopenia – thrombosis – non-heparin anticoagulants – direct oral anticoagulants – DOACs
Autoři: J. Novotný; M. Penka
Působiště autorů: Oddělení klinické hematologie, FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 1, p. 9-15.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd20219Souhrn
Heparinem indukovaná trombocytopenie (HIT) představuje velmi závažnou komplikaci léčby hepariny se zvýšenou morbiditou a/nebo mortalitou. HIT je způsobena tvorbou protilátek proti makromolekulárním komplexům heparin/destičkový faktor 4 s rezultující aktivací trombocytů, monocytů, endotelu i neutrofilů, vedoucí ke zvýšené generaci trombinu s následným hyperkoagulačním stavem. Je zde nutno vysadit terapii hepariny a většinou zavést léčbu alternativními neheparinovými antitrombotiky. Diagnóza spočívá v klinické rozvaze za pomoci tzv. 4T skóre a v aplikaci imunologických a funkčních testů. Imunologické testy v případě negativity s velkou jistotou vylučují HIT (výrazná negativní výpovědní hodnota), v případě pozitivity je nutno diagnózu potvrdit funkčními testy. Novinkou v terapii HIT je možnost zavést léčbu přímými perorálními antikoagulancii.
Klíčová slova:
heparinem indukovaná trombocytopenie – trombóza – neheparinová antitrombotika – přímá perorální antikoagulancia – DOACs
ÚVOD
Heparinem indukovaná trombocytopenie (HIT) přichází v klinice ve dvou formách označovaných jako HIT I a HIT II.
U HIT I jde o přímý proagregační efekt heparinů, nejvýrazněji patrný u vysokomolekulárních frakcí. Trombocytopenie u HIT I je mírná, destičky neklesají pod 100×109/l, je patrná od prvého dne podávání heparinů (zvláště nefrakcionovaných – dále UFH), spontánně se upravuje přes pokračující aplikaci heparinů a není spojena s hyperkoagulací. Syndrom HIT I lze detekovat až u 30 % pacientů léčených UFH [1].
HIT II. typu (dále HIT) se vyskytuje u cca 0,5–5 % pacientů léčených hepariny a vzniká jako imunologická reakce proti makromolekulárním komplexům heparin/destičkový faktor 4 (H/PF4), u nesenzibilizovaných nemocných lze HIT detekovat zpravidla od 5. dne nasazení léčby hepariny [2]. Destičky klesají většinou pod 100×109/l a/nebo o 30–50 % výchozí hodnoty. U senzibilizovaných nemocných s přítomností protilátek proti H/PF4 se HIT manifestuje od 1. dne aplikace heparinu, stačí i proplachy kanyly heparinem, dokonce i heparinem potažené kanyly [3]. Klinická a laboratorní charakteristika HIT I a HIT II je uvedena v tab. 1.
Tab. 1. Klinická a laboratorní charakteristika HIT. 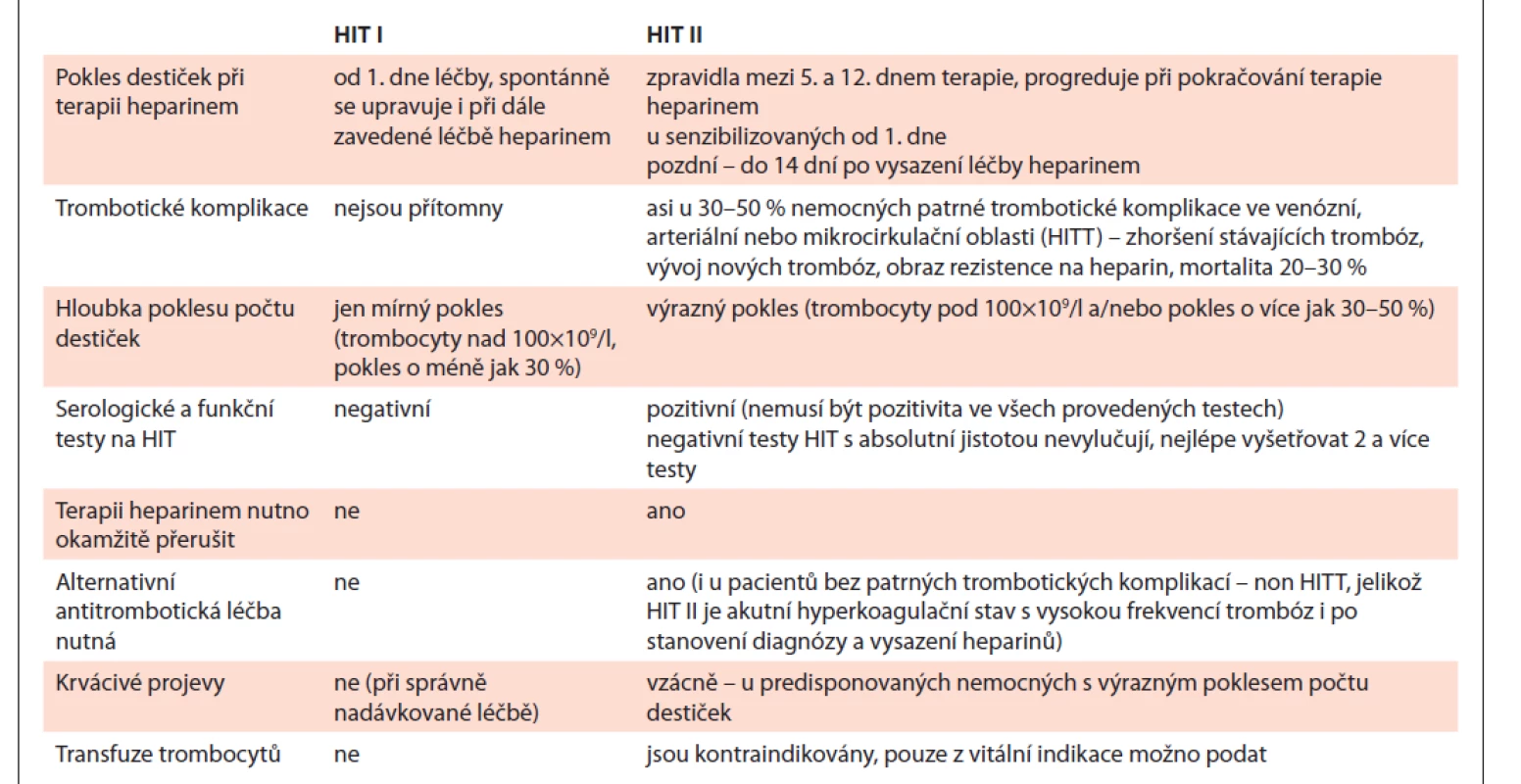
HIT – heparinem indukovaná trombocytopenie, HITT – HIT asociovaná s trombózou U řady nemocných detekujeme HIT protilátky bez další klinické konsekvence nebo je přítomna pouze trombocytopenie, avšak u 30–60 % pacientů je přítomen hyperkoagulační stav s možností vzniku trombózy kdekoli v arteriálním či venózním řečišti – hovoříme o HIT asociované s trombózou (HITT) [3]. Nejčastější je venózní tromboembolie následovaná periferními arteriálními ischemiemi, které mohou vyústit ve ztráty končetin. Méně často lze u nemocných s HIT pozorovat venózní cerebrovaskulární trombózu, venózní nekrózu akrálních částí končetin (často v kombinaci s léčbou kumariny), apoplexii nadledvin či syndrom diseminované intravaskulární koagulopatie (DIC; až u 5–10 % nemocných). Vzácně vidíme heparinové nekrózy v místě aplikace heparinu, někdy i na místech vzdálených od lokalizace vpichu heparinu [3].
Etiopatogeneze hyperkoagulačního stavu syndromu HIT je komplexní a není do všech podrobností známa [4]. Klinický význam mají hlavně IgG protilátky proti komplexům H/PF4. Vzácně lze prokázat protilátky proti komplexům heparinu s jinými makromolekulami – uvádí se např. IL8, beta-trombomodulin, neutrophil-activating peptide 2 (NAP2). Patofyziologický význam protilátek proti komplexům heparinu s jinými makromolekulami je nejasný [5].
Trombocyty jsou aktivovány vazbou komplexů IgG/H/PF4 na jejich FcgammaRIIa receptory, navíc jsou aktivovány i endotelie, monocyty a neutrofily. Důsledkem aktivace těchto buněčných populací je zvýšená generace trombinu s rezultujícím hyperkoagulačním stavem. Velký význam v etiopatogenezi hyperkoagulace HIT spočívá i v generaci neutrofilní extracelulární pasti, tzv. NETózy (neutrophil extracellular traps) [6]. Monocyty i endotelie exprimují na svém povrchu tkáňový faktor (TF) [7].
Generace HIT protilátek vykazuje jisté zvláštnosti – chybí zde anamnestická reakce u nemocných, u nichž došlo k sérokonverzi přítomnosti HIT protilátek, k níž dochází po cca 40–100 dnech od prezentace HIT (negativní serologické i funkční testy) [8]. K sérokonverzi může dokonce paradoxně dojít i u pacientů, u nichž nebyly hepariny vysazeny, souběžně u nich dochází k restituci počtu destiček [9].
Krvácivé komplikace HIT jsou vzácné, avšak mohou být závažné. Nejčastěji je vídáme u nemocných s preexistujícími poruchami hemostázy, s těžšími defekty funkce jater nebo ledvin, u pacientů po kardiochirurgických výkonech nebo u nemocných se syndromem DIC.
V etiopatogenezi HIT je důležitý i typ základního souboru nemocných – např. po kardiochirurgických výkonech generuje HIT protilátky až 50 % pacientů, přičemž HITT se rozvine pouze u cca 1 % těchto nemocných. U pacientů po ortopedických operacích detekujeme HIT protilátky u cca 14 %, avšak klinický HITT lze prokázat až u 30 % těchto pacientů [10]. Byl však popsán soubor 3 515 nemocných po ortopedických výkonech, kdy HITT byl detekován pouze u 0,03 % pacientů [11].
HIT v těhotenství je naštěstí vzácná (pod 0,1 %), jako alternativní antikoagulans se zde doporučuje fondaparinux [12]
HIT u dialyzovaných nemocných je vzácná a je zde nutno podávat alternativní neheparinová antitrombotika v podobě argatrobanu nebo bivalirudinu či provést citrátovou nebo peritoneální dialýzu [13,14].
DIAGNOSTIKA
Diagnóza syndromu HIT může být velmi obtížná, neboť hepariny často podáváme u nemocných s jinými příčinami trombocytopenie (např. sepse, velké operační výkony, kardiochirurgické zákroky). Opíráme se zde o klinický obraz a laboratorní testy.
Klinicky se v rámci předtestové pravděpodobnosti HIT používá ponejvíce tzv. „4T skóre“, méně často novější „HEP skóre“, u pacientů po kardiochirurgických výkonech se uvádí tzv. „Lillo-Le Louët skóre“, avšak je nutno vyhodnotit jeho spolehlivost v prospektivních studiích [15,16]. Prediktivní hodnota 4T skóre byla vyhodnocena jako velmi dobrá [17]. 4T skóre je uvedeno v tab. 2.
Tab. 2. „4T“ skóre. 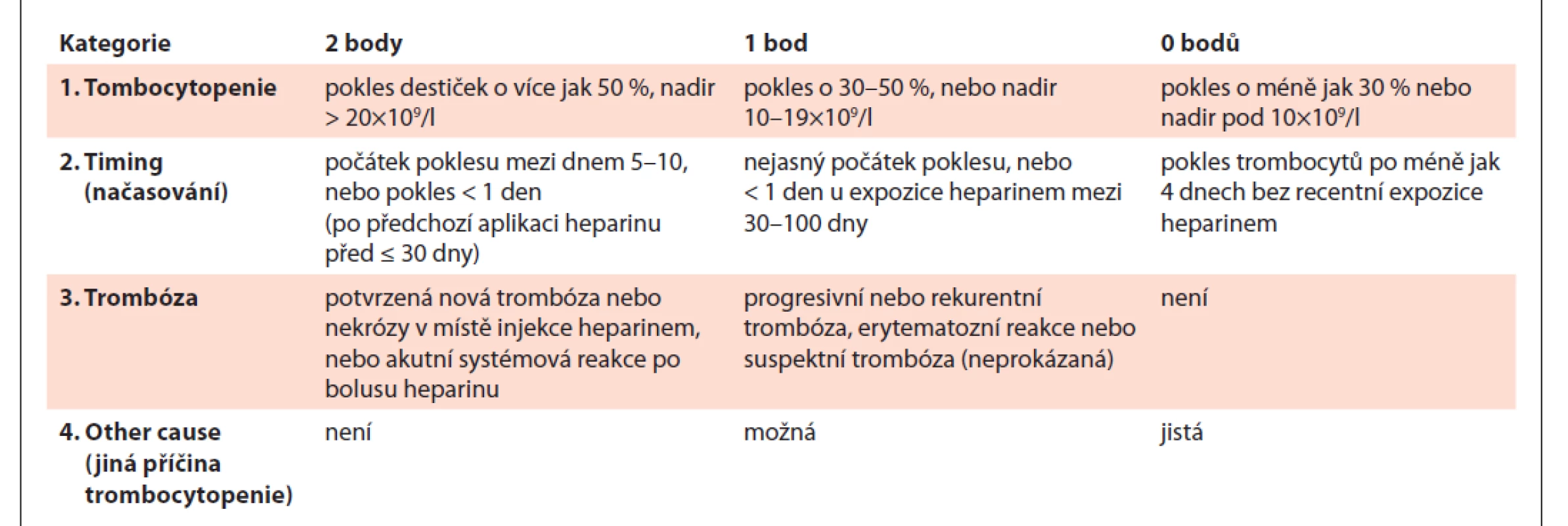
> 6 bodů – vysoká pravděpodobnost HIT, 4–5 bodů – střední pravděpodobnost HIT, ≤ 3 body – nízká pravděpodobnost HIT Laboratorně jsou k dispozici serologické (imunologické) testy a testy funkční.
Sérologické testy
Serologické testy mají většinou vysokou senzitivitu, ale nízkou specifitu – detekují i nepatogenní IgA a IgM protilátky. Specifita těchto testů se zvýší při zaměření pouze na IgG protilátky.
Nejužívanějším serologickým testem je stanovení pomocí ELISA detekce (HIT ELISA). Důležité je zde stanovení optické denzity (OD). Většina autorů vyjadřuje jako pozitivní OD nad 0,3–0,4 v závislosti na užitých reagenciích. OD nad 1,4 je spojena s cca 50% pozitivitou serotonin release assay (SRA), při zvýšení specifity OD však klesá senzitivita [18].
Rychlou orientační metodou je stanovení pomocí Diamed testu – aglutinace kuliček potažených komplexy H/PF4 sloupcovou aglutinací (PaGIA test – particle gel immunoassay). Význam tohoto testu zhruba odpovídá ELISA vyšetření [19].
Nové serologické testy jsou chemoluminiscenční testy Hemosil Acustar HIT Ab a specifičtější Hemosil Acustar HIT IgG, prováděné i na koagulometru ACL [20]. Výhodou je možnost automatického stanovení i v sériích.
Lateral flow immunoassays (LFIA) jsou založené na principu kapilárního proudění.
Funkční testy
U funkčních testů je nutno si uvědomit, že reaktivita dárcovských trombocytů je různá, testy je třeba provádět s trombocyty se známou citlivostí a/nebo s trombocyty získanými od několika dárců. Zlatým standardem funkčních testů je SRA s radioaktivně značeným serotoninem [21]. Pozitivní výsledek je uvolnění serotoninu nad 20 %. Nevýhodou je nutnost pracovat s radioaktivním materiálem. Byly proto vyvinuty metody neradioaktivního stanovení SRA pomocí HPLC (high performance liquid chromatography) [22], nevýhodou je možnost tohoto stanovení pouze v několika málo laboratořích. Vysoká koncentrace heparinu inhibuje reakci SRA.
Agregační testy mají vysokou specifitu, ale nízkou senzitivitu (cca 50 %). Senzitivita agregací se zvýší při vyšetření na multikanálovém agregometru – HIMEA (heparin induced multiple electrode aggregometry). Výhodou je zde stanovení agregace z plné krve [23].
HIPA test dle Greinachera (heparin induced platelet agglutination/aggregation/activation) s promytými destičkami hodnotí zákal odečítaný proti tmavému pozadí v reakčních jamkách. Autoři udávají vysokou senzitivitu i specifitu, nevýhodou je subjektivní hodnocení (odečet hodnocen vizuálně).
Novou možností detekce funkční reaktivity destiček je průtoková cytometrie. Stanovujeme zde jednak uvolnění mikropartikulí, vazbu anexinu V a/nebo vazbu P selektinu na povrch trombocytů (CD62P), eventuálně aktivaci GP IIb/IIIa (PAC-1) [24]. Komerční test „HIT Alert kit“ vyhodnocuje diagnostiku HIT do 2 h a jeho spolehlivost se blíží SRA.
Výzkumnou metodou je vyšetření na lumiagregometru v podobě měření uvolnění ATP [25]. Byly popsány funkční testy zcitlivělé podáním exogenního PF4 [26–28]. Laboratorní testy v přehledu podává tab. 3.
Tab. 3. Laboratorní diagnostika HIT. 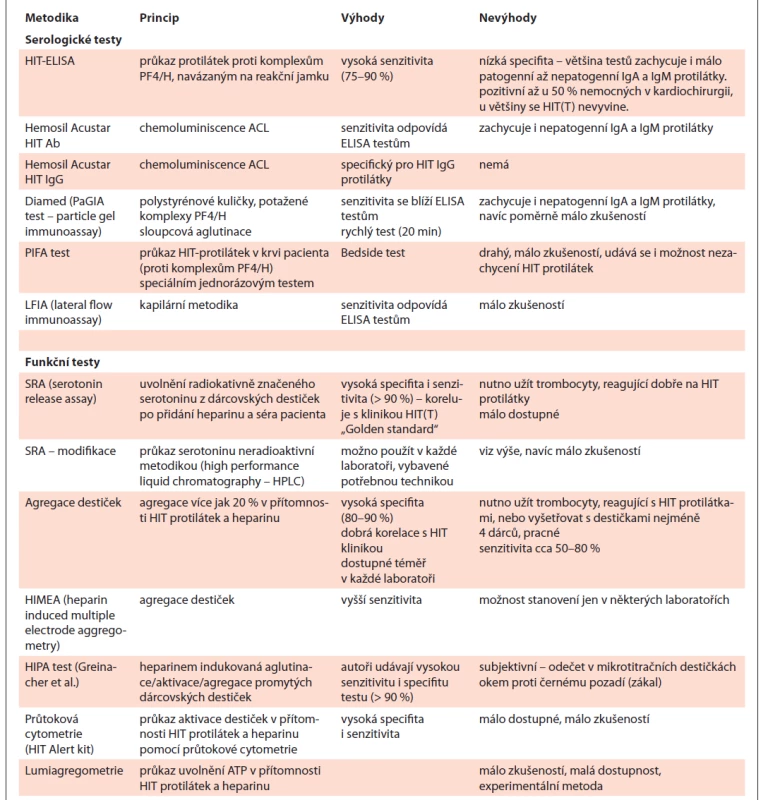
HIT – heparinem indukovaná trombocytopenie Problémem dneška je „overdiagnosis“ HIT, jelikož ELISA testy zachycují i nepatogenní protilátky IgA a IgM. Následkem falešně pozitivní diagnózy HIT je zvýšené riziko závažných krvácení a v neposlední řadě i vyšší ekonomická náročnost léčby [29].
Mnoho pacientů s antifosfolipidovým syndromem (APS) vykazuje falešně pozitivní testy na HIT protilátky, tyto protilátky však reagují se samotným PF4 bez heparinu. Tato reakce není na rozdíl od pravých HIT protilátek inhibována vysokou koncentrací heparinu. Pacienti s APS však mohou generovat i pravé HIT protilátky [30].
Typický průběh HIT – pokles trombocytů od 5. dne podávání heparinu o 50 % s nadirem nad 20×109/l vídáme u většiny pacientů. Cca 5 % nemocných vykazuje pokles destiček až 14 dní po vysazení heparinu s velmi pomalou restitucí. Jsou zaznamenáni i nemocní s HIT bez předchozí aplikace heparinu [31,32]. Typickým nálezem u pozdní manifestace HIT a u HIT bez heparinu jsou hyperimunní protilátky reagující i bez přidaného heparinu – autoimunní HIT. Generace hyperimunních protilátek zodpovědných za HIT bez předchozí aplikace heparinu byla popsána u pacientů po ortopedických výkonech a/nebo u sepse. Svou roli zde asi hrají glykosaminoglykany, uvolněné operačním zákrokem, a/nebo glykosaminoglykany bakterií [33,34]. Hyperimunní HIT protilátky reagují pravděpodobně s komplexy PF4 s chondroitin sulfátem na povrchu destiček [35]. Vzácně byla zaznamenána generace HIT protilátek s reaktivní trombocytózou u pacientů s heparinovou alergickou reakcí [36].
U pacientů s kardiopulmonálním bypassem byly popsány protilátky proti komplexům protamin/heparin indukující aktivaci destiček, zvláště u diabetických nemocných léčených protamin inzulinem [37].
LÉČBA
V terapii syndromu HIT se uplatňují neheparinové medikamenty – přímé inhibitory trombinu bivalidurin a argatroban, dále danaparoid (Orgaran), fondaparinux a nyní se diskutují indikace přímých inhibitorů trombinu a faktoru Xa – direct oral anticoagulants (DOACs). I po vysazení heparinu perzistuje hyperkoagulační stav se zvýšenou generací trombinu.
Nevýhodou aplikace přímých inhibitorů trombinu v podobě podání bivalirudinu nebo argatrobanu je nutnost jejich aplikace kontinuální intravenózní infuzí s nutností monitorování testem APTT, který je málo spolehlivý a zvláště u nemocných s DIC a/nebo se závažnou hepatopatií vede k poddávkování těchto léčiv. Spolehlivějším testem k monitoraci je zde ekarinový čas (ECT), který se však ve většině laboratoří neprovádí. Další nevýhodou je neexistence specifického antidota [38].
V německy mluvících zemích se k terapii HIT užívá danaparoid (směs heparinoidů dermatan sulfátu, heparan sulfátu a chondroitin sulfátu), popisuje se zde inhibice tvorby komplexů H/PF4. Danaparoid vykazuje asi 10% zkříženou reaktivitu s hepariny in vitro, in vivo je však zkřížená reaktivita velmi vzácná [38].
Byly publikovány malé soubory nemocných léčených fondaparinuxem (Arixtra) s dobrými výsledky, avšak vzácně byly popsány HIT asociované s fondaparinuxem [39–41]. Frekvence HIT indukované fondaparinuxem se odhaduje na cca 0,1 %. Jsou popsány i kazuistiky selhání alternativní léčby fondaparinuxem [42], někteří autoři proto pochybují o potenci fondaparinuxu léčit závažný hyperkoagulační stav vygenerovaný HIT protilátkami. Výhodou fondaparinuxu je chybějící interference se stanovením INR, což usnadní přechod léčby HIT na kumariny. Kumariny nasazujeme po vzestupu počtu destiček nad 150×109/l.
Diskutovanou problematikou léčby HIT v poslední době je možnost podání DOACs (direct oral anticoagulants). Linkins et al. publikovali multicentrickou, prospektivní studii u pacientů se suspektní nebo konfirmovanou HIT. Zařazeni byli pacienti s 4T skóre nad 4 body, konfirmaci HIT v podobě SRA vykázalo 12 nemocných. 22 nemocných dostalo rivaroxaban 15 mg 2× denně do restituce počtu destiček s následující dávkou 20 mg denně po dobu jednoho měsíce. U jednoho pacienta došlo k amputaci DK přes normalizaci počtu destiček. Žádný z pacientů nevykazoval novou trombotickou příhodu a/nebo větší krvácení. Autoři uzavírají, že rivaroxaban je bezpečnou a efektivní léčebnou modalitou u nemocných s konfirmovanou HIT [43]. Další publikace užití DOACs u HIT vesměs udávají úspěšnou terapeutickou efektivnost této terapie, doba trvání této léčby však není jasná [44–47].
U refrakterních závažných forem HIT byl popsán promptní efekt léčby vysokodávkovanými intravenozními imunoglobuliny (IVIg). IVIg inhibují aktivaci trombocytů HIT protilátkami [48].
Podání trombocytárních koncentrátů preventivně při poklesu destiček pod 20×109/l je kontraindikováno pro reálnou možnost potenciace trombotických projevů. Trombocyty je možné podat pouze z vitální indikace při závažném krvácení a/nebo před invazivními výkony.
Před urgentními výkony v kardiopulmonálním bypassu byla k redukci koncentrace HIT protilátek užita plazmaferéza s dobrým efektem, dovolující intraoperační aplikaci UFH. V pooperačním období byla však podána alternativní neheparinová antitrombotika [49,50].
V ČR jsou dostupná neheparinová antitrombotika argatroban, fondaparinux a DOACs.
Cuker uvádí manifestaci HIT v několika fázích (tab. 4). Terapeutický přístup se pak odvíjí dle aktuální fáze HIT [51].
Tab. 4. Fáze HIT [51]. ![Fáze HIT [51].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ddfe04f03ba1c0ae4b55e6c1c12fe786.png)
HIT – heparinem indukovaná trombocytopenie Warkentin a Andersonová publikovali článek zabývající se přístupem k pacientům s anamnézou HIT [52]. Sdělení se týká situací, kdy je indikováno podání UFH a/nebo nízce molekulárního heparinu (LMWH) u nemocných s kardiochirurgickými intervencemi (cardiopulmonary bypass – CPB), vaskulárních chirurgií nebo u chronicky dialyzovaných pacientů. V případě negativity funkčních testů lze u CPB jednorázově podat heparin s neutralizací protaminem a pooperačním podáním neheparinových antitrombotik. Jsou-li pozitivní funkční testy, je indikováno podání heparinu s inhibicí trombocytů Iloprostem a/nebo s terapeutickou plazmaferézou s následným podáním neheparinových antikoagulancií. Riziko rekurence HIT při podání heparinů udávají v cca 5 %. U hemodialyzovaných pacientů doporučují indikaci neheparinových antitrombotik a heparin v případě sérokonverze testů na HIT [52].
ZÁVĚR
Závěrem lze konstatovat, že HIT je velmi závažnou komplikací léčby hepariny se zvýšenou morbiditou a/nebo mortalitou. HIT je způsobena tvorbou protilátek proti makromolekulárním komplexům heparin/PF4 s rezultující aktivací destiček, monocytů, endotelu i neutrofilů, vedoucí ke zvýšené generaci trombinu s následným hyperkoagulačním stavem. Je zde nutno vysadit terapii hepariny a většinou zavést léčbu alternativními neheparinovými antitrombotiky. Diagnóza spočívá v klinické rozvaze za pomoci tzv. 4T skóre a v aplikaci imunologických a funkčních testů. Imunologické testy v případě negativity s velkou jistotou vylučují HIT (výrazná negativní výpovědní hodnota), v případě pozitivity je nutno diagnózu konfirmovat funkčními testy. Novinkou v terapii HIT je možnost zavést léčbu pomocí DOACs, zvláště rivaroxabanem.
Podíl autorů na přípravě rukopisu
Novotný J vypracoval manuskript, Penka M provedl revizi rukopisu
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 19. 6. 2020.
Přijato po recenzi dne 21. 7. 2020.
MUDr. Jan Novotný, Ph.D.
Oddělení klinické hematologie
FN Brno
Jihlavská 20, 625 00 Brno
e-mail: jan.novotny@fnbrno.cz
Zdroje
1. Greinacher A. Antigen generation in HIT: the nonimmunologic and the immunologic type are closely linked in their pathogenesis. Thromb Hemost. 1995; 21 : 106–116.
2. Khandelwal S, Arepaly GM. Immune pathogenesis of HIT. Thromb Haemost. 2016; 116 : 792–798.
3. Warkentin TE. Clinical picture of HIT and its differentiation from non-HIT thrombocytopenia. Thromb Haemost. 2016; 116 : 813–822.
4. Onwuemene O, Arepally GM. HIT: Research and clinical updates. Hematology. 2016 : 262–268.
5. Amiral J. Antigens involved in HIT. Semin Hematol. 1999; 36 : 7–11.
6. Perdomo J, Leung HH, Ahmadi Z, et al. Neutrophil activation and NETosis are the major drivers of thrombosis in HIT. Nature Communications. 2019; 10 : 1322.
7. Madeeva D, Cines DB, Poncz M, et al. Role of monocytes and endothelial cells in HIT. Thromb Haemost. 2016; 116 : 806–812.
8. Staibano P, Arnold DM, Bowdish DM, et al. The unique immunological features of HIT. Br J Haematol. 2017; 177 : 198–207.
9. Shih A, Sheppard JAI, Warkentin TE. Platelet count recovery and seroconversion in immune HIT despite continuation of heparin. Thromb Haemost. 2017; 117 : 1868–1874.
10. Warkentin TE, Sheppard JA, Horsewood P, et al. Impact of the patient population on the risk for HIT. Blood. 2000; 96 : 1703–1708.
11. Cralk JD, Cobb AG. HIT following hip and knee arthoplasty. Br J Haematol. 2013; 161 : 255–256.
12. Mauermann E, Vökt C, Tsakiris DA, et al. HIT in pregnancy: an interdisciplinary challenge – a case report and literature review. Int J Obstet Anesth. 2015; 24 : 79–82.
13. Gameiro J, Jorge S, Lopes JA. Hemodialysis related HIT. Case series and literature review. Nefrologia. 2018; 38 : 551–557.
14. Chang JJ, Parikh CR. When heparin causes thrombosis: signifikance, recognition and management of HIT in dialysis patients. Semin Dialys. 2006; 19 : 297–304.
15. Cuker A, Arepally G, Crowther MA, et al. The HIT expert probability (HEP) score: a novel pre-test probability model for HIT based on broad expert opinion. J Thromb Haemost. 2010; 8 : 2642–2650.
16. Lillo-Le Louët A, Boutourie P, Alhenc-Gelas M, et al. Diagnostic score for HIT after cardiopulmonary bypass. J Thromb Haemost. 2004; 2 : 1882–1888.
17. Cuker A, Gimotty PA, Crowther MA, et al. Predictive value of the 4Ts scoring system for HIT: a systematic review and meta-analysis. Blood. 2012; 120 : 4160–4167.
18. Nagler M, Bakchoul T. Clinical and laboratory tests for the diagnosis of HIT. Thromb Haemost. 2016; 116 : 823–834.
19. Sun L, Gimmoty PA, Lakshmanan S, et al. Diagnostic accuracy of rapid immunoassays for HIT. Thromb Haemost. 2016; 115 : 1044–1055.
20. Nagler M, Cuker A. Profile of Instrumentation Laboratory Hemosil Acustar HIT-Ab assay for diagnosis of HIT. Expert Rev Molec Diagnostics. 2017; 17 : 419–426.
21. Arepally GM. HIT. Blood. 2017; 129 : 2864–2872.
22. Sono-Koree NK, Crist RA, Frank EL, et al. A high-performance liquid chromatography method for the SRA is equivalent to the radioactive method. Int J Lab Hem. 2016; 38 : 72–80.
23. Favarolo EJ, McCaughan G, Pasalic L. Clinical and laboratory diagnosis of HIT: an update. Pathology. 2017; 49 : 3476–3455.
24. Karényi A, Debreceni IB, Oláh Z, et al. Evaluation of flow cytometric HIT assays in relation to an IgG-specific immunoassay and clinical outcome. Clin Cytometry. 2017; 92B: 390–397.
25. Guarino ML, Massimi I, Mardente S, et al. New platelet functional method for identification of pathogenic antibodies in HIT patients. Platelets. 2017; 28 : 728–730.
26. Padmanabhan A, Jones CG, Curtis BR, et al. A novel PF4-dependent platelet activation assay identifies patients likely to have HITT. Chest. 2016; 150 : 506–515.
27. Padmanabhan A, Jones CG, Bougie DW, et al. A modified PF4-dependent, CD62p expression assay selectively detecst serotonin-releasing antibodies in patients suspected of HIT. Thromb Haemost. 2015; 114 : 1322–1323.
28. Vayne C, Guery EA, Kizlik-Masson C, et al. Beneficial effect of exogenous PF4 for detecting pathogenic HIT antibodies. Br J Haematol 2017; 179 : 811–819.
29. Harada MY, Hoang DM, Zaw AA, et al. Overtreatment of HIT in the surgical ICU. Crit Care Med. 2017; 45 : 28–34.
30. Warkentin TE. Antiphospholipid and anti-PF4 antibodies: an association affecting anti-PF4/heparin assay analysis. J Thromb Haemost. 2009; 7 : 1067–1069.
31. Olah Z, Kerenyi A, Kappelmayer J, et al. Rapid-onset HIT without previous heparin exposure. Platelets. 2012; 23 : 495–498.
32. Poudel DR, Ghimire S, Dhital R, et al, Warkentin TE. Spontaneous HIT syndrome post-knee replacement surgery with delayed recovery of thrombocytopenia: a case report and literature review. Platelets. 2017; 28 : 614–620.
33. Krauel K, Weber C, Brandt S, et al. PF4 binding to lipid A of gram-negative bacteria exposes PF4/H-like epitopes. Blood. 2012; 120 : 3345–3352.
34. Migita K, Asano T, Sato S, Motokawa S. Induction of anti-PF4/heparin antibodies after arthroplasty for rheumatic diseases. Fukushima J Med Sci. 2018; 64 : 1–7.
35. Warkentin TE, Greinacher A. Management of HIT. Curr Opin Hematol. 2016; 23 : 462–470.
36. Folwaczny EK, Stürmer KM. Atypische HIT – „heparinallergie“ mit thrombocytose. Chirurg. 1999; 70 : 588–594.
37. Bakchoul T, Jouni R, Warkentin TE. Protamine (heparin) -induced thrombocytopenia. A review of the serological and clinical features associated with anti-protamine/heparin antibodies. J Thrombos Haemost. 2016; 14 : 1685–1695.
38. Bakchoul T. An update on HIT: diagnosis and treatment. Expert Opin Drug Safety. 2016; 15 : 787–797.
39. Kuo KH, Kovacs MJ. Fondaparinux: a potential new therapy for HIT. Hematol. 2005; 10 : 271–275.
40. Snodgrass MN, Shields J, Rai H. Efficacy and safety of fondaparinux in patients with suspected HIT. Clin Appl Thromb Hemost. 2016; 22 : 712–717.
41. Warkentin TE, Mauer BT, Aster RH, et al. HIT associated with fondaparinux. N Engl J Med. 2007; 356 : 2653.
42. Miranda AC, Donovan JL, Tran MT, et al. A case of unsuccesful treatment of HIT with fondaparinux. J Thromb Thrombolys. 2012; 33 : 133–135.
43. Linkins LA, Warkentin TE, Pai M, et al. Rivaroxaban for treatment of suspected or confirmed HIT study. J Thrombos Haemost. 2016; 14 : 1206–1210.
44. Skelley JW, Kyle JA, Roberts RA. Novel oral anticoagulants for HIT. J Thromb Thrombolysis. 2016; 42 : 172–178.
45. Casan JML, Grigoriadis G, Chan N, et al. Rivaroxaban in treatment of refractory HIT. BMJ Case Reports; publikováno elektronicky 12. srpna 2016. DOI: 10.1136/bcr -2016-216110.
46. Tran PN, Tran MH. Emerging role of DOACs in the management of HIT. Clin Appl Thromb Hemost. 2018; 24 : 201–209.
47. Warkentin TE, Pai M, Linkins LA. DOACs for treatment of HIT: update of Hamilton experience and literature review. Blood. 2017; 130 : 1104–1113.
48. Padmanabhan A, Jones CG, Pechauer SM, et al. IVIg for treatment of severe refractory HIT. Chest. 2017; 152 : 478–485.
49. Salter BS, Weiner MM, Trinh MA, et al. HIT: a comprehensive clinical review. J Am Col Cardiol 2016; 67 : 2519–2532.
50. Cho JH, Parilla M, Treml A, et al. Plasma exchange for HIT in patients on extracorporeal circuits: a challenging case and survey of the field. J Clin Apher. 2019; 34 : 64–72.
51. Cuker A. Management of the multiple phases of HIT. Thromb Haemost. 2016; 118 : 835–842.
52. Warkentin TE, Anderson JA. How I treat patients with a history of HIT. Blood. 2016; 128 : 348–359.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2021 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- ZMĚNY V IMUNITNÍM SYSTÉMU U NELÉČENÝCH NEMOCNÝCH S CHRONICKOU LYMFOCYTÁRNÍ LEUKEMIÍ – ČÁST 2: NESPECIFICKÁ IMUNITA.
-
Doc. MUDr. Miroslav Tomíška, CSc.,
slaví sedmdesáté životní jubileum - Zemřel profesor Jan Evangelista Dyr
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
- Jaké dávky inhibitorů tyrozinkináz jsou v léčbě pacientů s chronickou myeloidní leukemií optimální?
- EDITORIAL
- Von Willebrandova choroba – porovnanie dvoch metód analýzy multimérov von Willebrandovho faktora
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Bolesti svalů jako vzácný autoimunitní projev při monoklonální IgM gamapatii – popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů
- Inhibítory faktora VIII – Výsledky imunotolerančnej indukcie v Národnom hemofi lickom centre a nové možnosti a prvé skúsenosti s liečbou bišpecifi ckou protilátkou (emicizumab) u pacientov s inhibítormi na Slovensku
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 3., rok 2021
- Heparinem indukovaná trombocytopenie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Heparinem indukovaná trombocytopenie
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



