-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
Novel molecules used in the targeted treatment of acute myeloid leukaemia – adverse reactions, treatment complications and signifi cant drug interactions
Although the incidence of acute myeloid leukaemia is on the rise, there has been no radical improvement in its treatment in recent decades and the prognosis of patients is improving only gradually. Drugs for the treatment of acute myeloid leukaemia that have appeared in the past few years and that represent so-called targeted therapy have been responsible for this improvement. This article focuses on an overview of the basic pharmacological properties of new drugs used in the treatment of acute myeloid leukaemia, especially their mechanism of action, their most common adverse reactions and their management or drug interactions from the perspective of the clinical pharmacist.
Keywords:
acute myeloid leukaemia – midostaurin – gilteritinib – ivosidenib – enasidenib – venetoclax – gemtuzumab ozogamicin – glasdegib – Drug interactions – Adverse reactions – clinical pharmacy
Autoři: J. Vedrová 1; Z. Ráčil 1,2
Působiště autorů: Ústav hematologie a krevní transfuze, Praha 1; LF MU, Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 1, p. 16-27.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd202116Ač je akutní myeloidní leukemie onemocnění s rostoucí incidencí, v posledních desetiletích nedošlo v její léčbě k radikálnímu posunu k lepšímu a prognóza pacientů se zlepšuje pouze pozvolna. V posledních několika letech se však v terapii akutní myeloidní leukemie objevují léčiva, která reprezentují tzv. cílenou léčbu a mají jistou zásluhu na zlepšení. Článek je zaměřen na přehled základních farmakologických vlastností nových léčiv používaných v terapii akutní myeloidní leukemie, zejména na mechanizmus účinku, nejčastější nežádoucí účinky a jejich management či lékové interakce z pohledu klinického farmaceuta.
Souhrn
Ač je akutní myeloidní leukemie onemocnění s rostoucí incidencí, v posledních desetiletích nedošlo v její léčbě k radikálnímu posunu k lepšímu a prognóza pacientů se zlepšuje pouze pozvolna. V posledních několika letech se však v terapii akutní myeloidní leukemie objevují léčiva, která reprezentují tzv. cílenou léčbu a mají jistou zásluhu na zlepšení. Článek je zaměřen na přehled základních farmakologických vlastností nových léčiv používaných v terapii akutní myeloidní leukemie, zejména na mechanizmus účinku, nejčastější nežádoucí účinky a jejich management či lékové interakce z pohledu klinického farmaceuta.
Klíčová slova:
akutní myeloidní leukemie – midostaurin – gilteritinib – ivosidenib – enasidenib – venetoklax – gemtuzumab ozogamicin – glasdegib – lékové interakce – nežádoucí účinky – klinická farmacie
ÚVOD
Na poli léčby akutní myeloidní leukemie (AML) se v posledních několika letech objevují nové molekuly s výrazným dopadem na prognózu onemocnění [1]. Tato cílená terapie je reprezentována jak malými molekulami, tak i látkami na bázi monoklonálních protilátek. Některé z nich (např. gilteritinib, midostaurin, venetoklax) jsou v ČR registrovány velmi krátce či zažívají renesanci (gemtuzumab ozogamicin), s některými je obchodováno ještě málo, jiné na svoje uvedení na český trh teprve čekají (např. ivosidenib) a setkáváme se s nimi pouze v rámci klinických hodnocení (KH) či specifických léčebných programů.
Zařazení nového léčiva do standardní terapie s sebou vždy přináší úvodní nejistotu při osvojování si nových zkušeností. Než se z nového léčiva stane běžně používané, je třeba si novou léčbu „osahat“. Následující text je proto zaměřen na základní popis jednotlivých léčiv – mechanizmus účinku, nejčastější nežádoucí účinky (NÚ) a jejich management, lékové interakce (LIA) a další čistě praktické informace, které lze použít při běžné péči o pacienty s AML podstupující léčbu s některým z nově dostupných léčivých přípravků (LP).
LÉKOVÉ INTERAKCE
Úvod do problematiky
Pod pojmem lékové interakce označujeme situaci, kdy při současném podávání dvou nebo více léčiv dojde ke změně účinku některého z nich (v pozitivním či negativním smyslu). LIA mohou být příčinou toxicity či nežádoucích účinků léčiv nebo vedou k selhání léčby [2]. LIA popisované v tomto článku jsou omezeny na farmakokinetické (PK) LIA na úrovni metabolizmu zprostředkované cytochromem P450 (CYP450).
LIA na tomto enzymatickém systému mohou probíhat formou inhibice či indukce. Zjednodušeně řečeno inhibice vede k zablokování (útlumu) metabolické cesty, snížení odbourávání a ke kumulaci daného substrátu v organizmu. V případě indukce dochází naopak ke zvýšení enzymatické aktivity a tím ke zrychlení metabolizmu léčiva, což (většinou) vede k nepredikovatelnému poklesu plazmatické hladiny, která může zapříčinit snížení účinku až selhání léčby [3]. Pro zhodnocení míry klinické významnosti LIA zde hrají velkou roli senzitivita daného substrátu, míra inhibice/indukce (silná, středně silná, reverzibilní, …), další metabolické cesty, poločas eliminace jednotlivých léčiv, aj. – taková diskuze je však nad rámec tohoto sdělení. Vždy je vhodné konzultovat danou situaci s klinickým farmaceutem.
Nejčastější nežádoucí účinky, lékové interakce a komplikace při terapii novými molekulami v léčbě akutní myeloidní leukemie
S výjimkou gemtuzumab ozogamicinu a venetoklaxu se u všech níže popsaných léčiv setkáváme se společným NÚ v podobě prodloužení QTc intervalu s následným rizikem vzniku maligních arytmií. Pro vypořádání se s tímto rizikem je před začátkem terapie nutné (vedle monitorace EKG a iontové homeostázy) zhodnotit souběžnou léčbu, redukovat/eliminovat léčiva s prokázaným potenciálem k prodloužení QTc intervalu či je nahradit vhodnou alternativou. Do standardní „výbavy“ pacientů s AML (resp. s hematologickou malignitou) totiž patří fluorochinolony, azolová antimykotika, antidepresiva (zde zejména escitalopram/citalopram) a antiemetika ze skupiny antagonistů serotoninových 5HT3 receptorů („setrony“) – skupiny léčiv, jejichž potenciál k prodloužení QTc je nezanedbatelný (tab. 1).
Tab. 1. Přehled léčiv prodlužujících QTc interval – zaměřeno na léčiva používaná v hematoonkologii, upraveno dle [21]. ![Přehled léčiv prodlužujících QTc interval – zaměřeno na léčiva
používaná v hematoonkologii, upraveno dle [21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/8d2244499079533747e26b505b819bc6.png)
třída 1 – léčiva se známým rizikem vzniku Torsade de pointes (TdP), třída 2 – léčiva s možným rizikem vzniku TdP, třída 3 – léčiva s podmíněným rizikem vzniku TdP, kdy k arytmii může dojít jen v přítomnosti dalších rizikových faktorů Azolová antimykotika („azoly“) jsou také léčiva s vysokým interakčním potenciálem. Řadí se do skupiny středně silných / silných inhibitorů CYP3A4 a některé, jako např. itrakonazol a posakonazol, zároveň inhibují i P-glykoprotein (P-gp, efluxní pumpa); oba tyto systémy se ve velké míře podílejí na metabolizaci daných léčiv, a významně tak ovlivňují jejich koncentrace, potažmo toxicitu. Úpravy dávek při souběžné léčbě azoly jsou popsány v tabulkách u jednotlivých léčiv, tab. 2 pak nabízí přehled inhibitorů/induktorů CYP450 používaných v hematoonkologii.
Tab. 2. Přehled inhibitorů a induktorů CYP450/P-gp – zaměřeno na léčiva používaná v hematoonkologii. 
Mezi závažné komplikace, které vyžadují časnou akci, patří diferenciační syndrom (DS). Původně byl popisován pouze při léčbě akutní promyelocytární leukemie kyselinou all-trans-retinovou (ATRA) a oxidem arzenitým, nově se s ním setkáváme i při podání gilteritinibu a ivosidenibu, resp. enasidenibu [4]. DS je spojen s rychlou proliferací a diferenciací myeloidních buněk a může být život ohrožující nebo vést k úmrtí, pokud není léčen. Příznaky a klinické nálezy u DS zahrnují horečku, dyspnoi, pleurální výpotek, perikardiální výpotek, plicní edém, hypotenzi, rychlý přírůstek hmotnosti, periferní otok, hepatální, renální a multiorgánové selhání [4].
U gilteritinibu se DS objevuje 2–75 dnů po zahájení léčby, u ivosidenibu je to 1.–90. den. U obou přípravků pak byl pozorován se souběžnou leukocytózou nebo bez ní [4,5].
Existuje-li podezření na DS, je nutné zahájit podávání kortikosteroidů (KS) a hemodynamickou monitoraci. Podává se dexametazon 10 mg (nebo ekvivalent) perorálně/intravenózně každých 12 h s postupným vysazováním při ústupu symptomů (min. však po 3 dnech od ústupu symptomů – prevence rekurence DS při brzkém vysazení KS). Pokud přetrvávají závažné známky a/nebo příznaky DS > 48 h od podání kortikoidů, doporučuje se přerušit léčbu gilteritinibem, resp. ivosidenibem, a znovu ji zahájit při zlepšení na stupeň ≤ 2. Přerušení ovšem nemusí přinést promptní ústup symptomů a zlepšení stavu pacienta, neboť gilteritinib i ivosidenib mají dlouhý biologický poločas (113, resp. 96 h).
Při souběžné neinfekční leukocytóze lze dle klinické situace přidat do terapie hydroxyureu, eventuálně lze provést leukaferézu.
NOVÉ MOLEKULY V LÉČBĚ AKUTNÍ MYELOIDNÍ LEUKEMIE
FLT3 inhibitory
FLT3 (FMS-like tyrozin kináza-3) je receptorová tyrozinkináza s vysokou mírou exprese v hematopetických a progenitorových buňkách. Mutace (nejčastěji ITD – vnitřní tandemová duplikace) se vyskytuje přibližně u 40 % AML (zejména u nemocných s normálním karyotypem). Přítomnost FLT3 ITD mutace je spojena s nepříznivou prognózou a vysokým rizikem relapsu [6]. Zařazení FLT3 inhibitorů do standardní péče je tedy vysoce žádoucí. Prvními registrovanými zástupci pro léčbu AML na našem trhu jsou midostaurin a gilteritinib.
Midostaurin
Zástupce první generace multikinázových inhibitorů. Inhibuje signalizaci FLT3 receptoru a indukuje zastavení buněčného cyklu a apoptózu leukemických buněk exprimujících FLT3 ITD nebo TKD (mutace v tyrozin kinázové doméně) mutantní receptory nebo zvýšeně exprimující FLT3 nemutovanou formu tohoto receptoru. Údaje in vitro ukazují, že midostaurin inhibuje KIT receptory (wild-type, D816V), kde interferuje se signalizací zprostředkovanou aberantní KIT D816V a inhibuje proliferaci žírných buněk, jejich přežití a uvolňování histaminu. Kromě toho midostaurin inhibuje několik dalších receptorových tyrozinkináz (PDGFR, VEGFR2) a dále i enzym PKC (proteinkináza C). Vazbou na katalytické domény těchto kináz inhibuje mitogenní signalizaci příslušných růstových faktorů v buňkách, což vede k zastavení růstu.
Po podání je metabolizován (via CYP3A4) na dva aktivní metabolity (CGP52421, CGP62221), přičemž metabolit CGP62221 je stejně potentní jako mateřská látka a účinnost druhého metabolitu CGP52421 je přibližně 10× menší [7,8].
Jako nejčastější NÚ je popisována nauzea a zvracení. V rámci prevence tohoto stavu je vhodné podávat midostaurin s jídlem, u senzitivních pacientů zahájit preemptivní podávání prokinetik, při zhoršení lze přidat olanzapin v dávce 5 mg (max. 3–5 dnů). Důležitá je zde role setronů, resp. snaha o jejich redukci z důvodu rizika prolongace QTc intervalu. Vhodné je ukončit jejich podávání již den předem, v případě refrakterního zvracení volit co nejnižší dávku (granisetron 1 mg / palonosetron 0,25 mg).
Významným – ovšem ne častým – NÚ je plicní toxicita (pneumonitida, intersticiální plicní nemoc), která byla popisována v rámci KH jak při podání v monoterapii, tak i v kombinaci s chemoterapií. Doporučuje se monitorace plicních funkcí a u nemocných s respiračními příznaky provést HRCT plic. U intersticiálního plicního procesu je pak nutné léčbu midostaurinem přerušit. V případě méně závažného stavu je vhodné zvážit benefit/risk přerušení léčby (snaha vyhnout se nadbytečnému vysazení); v případě velmi závažných infiltrátů a plicního procesu lze přerušit podávání midostaurinu do výsledku bronchoalveolární laváže (BAL) či odpovědi na antimikrobiální léčbu.
Metabolizace probíhá téměř výlučně cestou CYP3A4, je tedy nezbytné vyhnout se společnému podání se silnými inhibitory. Při nutnosti podávání antimykotické profylaxe lze za zvýšené monitorace použít posakonazol (středně silný/silný inhibitor CYP3A4). Během několikaměsíční klinické praxe na našem pracovišti jsme nezaznamenali vyšší míru incidence projevů toxicity při současné aplikaci obou léčiv. Další možnou variantu pak představuje isavukonazol (menší míra inhibice CYP3A4; oproti ostatním azolům dávkově a koncentračně závislé zkrácení QTc; zde ovšem hraje roli „finanční toxicita“ a jeho úhrada pouze v terapii invazivní aspergilózy a/nebo mukormykózy), event. pak podání mikafunginu, který CYP450 neovlivňuje vůbec. Shrnutí a další informace obsahuje tab. 3.
Tab. 3. Midostaurin shrnutí. 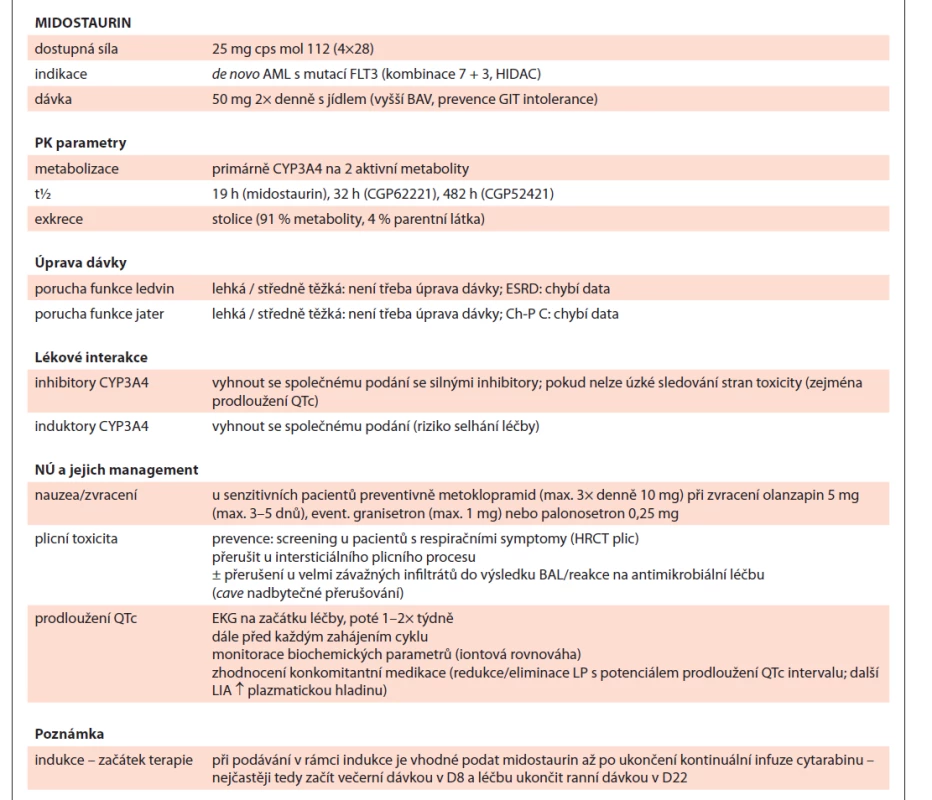
AML – akutní myeloidní leukemie, HIDAC – vysokodávkovaný cytosin-arabinosid, BAV – biologická dostupnost, GIT – gastrointestinální trakt, PK – farmakokinetika, ESDR – konečné stadium onemocnění ledvin, Ch-P C – Child-Pugh klasifi kace – stadium C, NÚ – nežádoucí účinek, HRCT – výpočetní tomografi e s vysokým prostorovým rozlišením, BAL – bronchoalveolární laváž, LP – léčivý přípravek, LIA – lékové interakce, D8/D22 – označení dne podání Gilteritinib
Gilteritinib fumarát je inhibitor FLT3 a AXL. Inhibuje signalizaci a proliferaci zprostředkovanou receptorem FLT3 v buňkách exprimujících mutace FLT3-ITD i TKD a navozuje apoptózu v leukemických buňkách exprimujících FLT3-ITD.
Co stojí za povšimnutí je jeho dlouhý poločas eliminace – 113 h, tzn. že k úplnému vyloučení z organizmu dochází za cca 24 dní. Tuto PK vlastnost musíme vzít v potaz při řešení LIA či NÚ – odeznění symptomů nelze očekávat promptně, ale musíme počítat s určitým časovým odstupem.
Jeho primární metabolizaci zajišťuje CYP3A4. Pokud nelze použít alternativu a je potřeba souběžné podání se silnými inhibitory CYP3A4, doporučuje se pouze úzké sledování stran toxicity bez úpravy dávky. Toxicita se nejčastěji projevuje zvýšením jaterních testů (ALT, AST) či prodloužením QTc intervalu. Ve výjimečných případech (1 %) byly popsány posteriorní reverzibilní encefalopatický syndrom (PRES) či pankreatitida (4 %). Jak již bylo zmíněno výše, léčbu komplikuje DS, který se objevuje až u 3 % pacientů [4,9]. Shrnutí a další informace obsahuje tab. 4.
Tab. 4. Gilteritinib shrnutí. 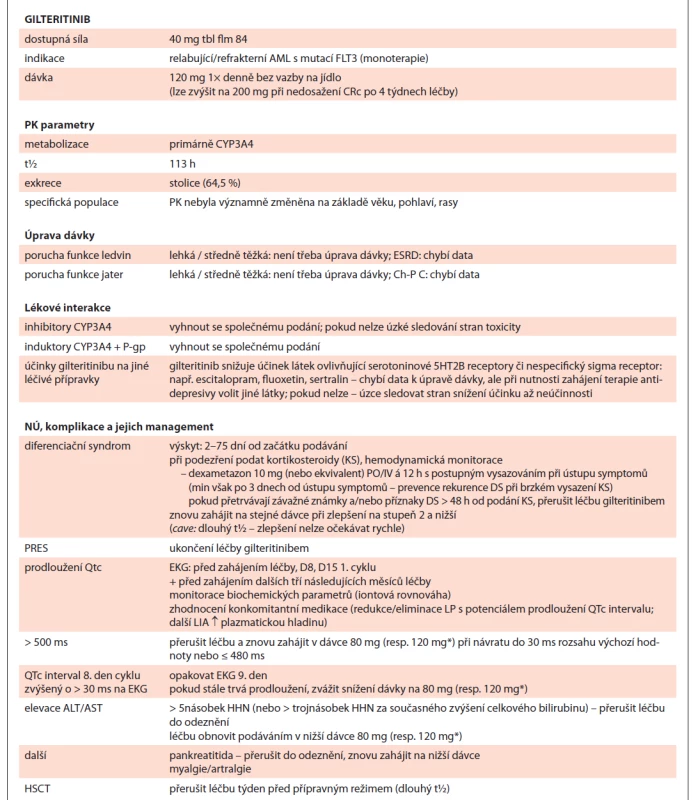
* snížení ze 120 mg na 80 mg nebo z 200 mg na 120 mg
AML – akutní myeloidní leukemie, CRc – kompozitní kompletní remise, PK – farmakokinetika, ESDR – konečné stadium onemocnění ledvin, Ch-P C – Child-Pugh klasifi kace – stadium C, NÚ – nežádoucí účinek, KS – kortikosteroidy, DS – diferenciační syndrom, PRES – posteriorní reverzibilní encefalopatický syndrom, D8/D15 – označení dne podání, LP – léčivý přípravek, LIA – lékové interakce, HHN – horní hranice normy, HSCT – transplantace buněk krvetvorbyGemtuzumab ozogamicin
Gemtuzumab ozogamicin (GO) je konjugát protilátka–léčivo (ADC) složený z monoklonální protilátky cílené proti CD33 kovalentně vázané na cytotoxickou látku N-acetyl-gama-kalicheamicin.
Gemtuzumab (humanizovaná protilátka imunoglobulinu) se specificky váže na antigen CD33 nacházející se na povrchu myeloidních leukemických blastů a nezralých zdravých buněk myelomonocytární linie, ale nikoli na povrchu zdravých hematopoetických kmenových buněk.
Malá molekula N-acetyl-gama-kalicheamicin je cytotoxický semisyntetický přírodní produkt.
Protinádorová aktivita GO vychází z vazby ADC na nádorové buňky exprimující CD33, následné internalizace komplexu ADC–CD33, uvolnění a aktivace N-acetyl-gama-kalicheamicin dimetylhydrazidu uvnitř buněk. Aktivace cytotoxické molekuly indukuje dvouřetězcové zlomy DNA, což následně vyvolává zástavu buněčného cyklu a apoptickou buněčnou smrt.
Na odstranění kalicheamicinu se podílí rozsáhlá metabolizace především neenzymatickou redukcí disulfidických skupin. Aktivita (cytotoxicita) výsledných metabolitů by poté měla být výrazně zmírněná. Díky této neenzymatické cestě je tudíž nepravděpodobné, že by souběžné podávání GO s inhibitory nebo induktory enzymů metabolizujících léčiva cytochromu CYP450, event. dalších, změnilo jeho expozici. Nejčastěji popisované NÚ při léčbě GO byly trombocytopenie, neutropenie, hepatotoxicita, vč. VOD/SOS.
U pacientů s iniciálním počtem leukocytů ≥ 25–30×109/l se jako prevence vzniku syndromu z nádorového rozpadu (TLS) doporučuje snížit před podáním přípravku počet leukocytů cytoredukcí – hydroxyureou či nízkými dávkami cytarabinu, eventuálně leukaferézou [10–12]. Shrnutí informací je v tab. 5.
Tab. 5. Gemtuzumab ozogamicin shrnutí. 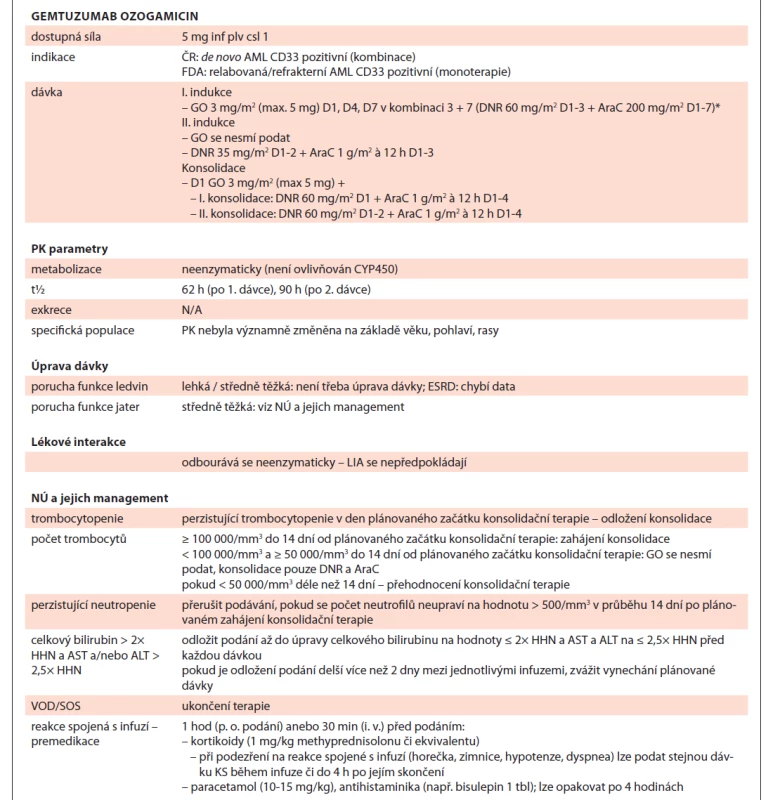
* pokud se u pac.s hyperleukocytární AML použije k leukoredukci AraC s hydroxyureou nebo bez ní, uplatňuje se v rámci indukce upravený harmonogram podávání – D1 hydroxyurea (dle lokálních SOP); AraC D1-7; DNR D3-5; GO D3, D6, D9
AML – akutní myeloidní leukemie, FDA – Úřad pro kontrolu potravin a léčiv (US), GO – gemtuzumab ozogamicin, D1, D4, … – označení dne podání, DNR – daunorubicin, AraC cytarabin, PK – farmakokinetika, N/A – není aplikovatelné, ESDR – konečné stadium onemocnění ledvin, NÚ – nežádoucí účinek, LIA – lékové interakce, HHN – horní hranice normy, VOS/SOS – veno-okluzivní choroba jater / sinusoidální obstrukční syndrom, KS – kortikosteroidyVenetoklax
Venetoklax je silný selektivní inhibitor antiapoptotického proteinu BCL-2 (B-cell lymphoma-2). Nadměrná exprese BCL-2 byla prokázána v buňkách CLL i AML, kde zprostředkovává přežití nádorových buněk. Je také spojován s relapsem a s rezistencí na chemoterapii. Venetoklax se v BCL-2 váže přímo na doménu BH3, odkud vytěsní proapoptotické proteiny obsahující BH3, což vede k zahájení procesu permeabilizace vnější mitochondriální membrány, aktivaci kaspázy a programované buněčné smrti [13,14]. Do rodiny BLC-2 antiapoptotických proteinů se krom BCL-2 řadí také BCLX a MCL1. MCL1 patří k proteinům, které mohou potencovat rezistenci na venetoklax. Přidání hypometylačních látek, antracyklinů nebo cytarabinu způsobí down-regulaci MCL1, a dochází tak k synergistickému působení s venetoklaxem [15].
Z důvodu povahy dané samotným onemocněním se setkáváme s rozdílným dávkováním při terapii CLL/SLL a AML (zejména v úvodní fázi titrace).
Venetoklax není výjimkou, i u něj se setkáváme s primárním metabolizmem cestou CYP3A4 a uplatňuje se jako substrát (i inhibitor) P-gp. Tzn. je nutná redukce dávky při podávání se silnými inhibitory obou systémů. Zejména to platí při podávání s posakonazolem, kdy je doporučeno snížit dávku z důvodu duální inhibice až na 70 mg/den. Pro snížení rizika TLS je doporučeno začít s léčbou až při poklesu leukocytů pod 25×109/l. Při použití venetoklaxu v rámci kombinované terapie se více vyskytuje hematologická toxicita (neutropenie, trombocytopenie) [13,14]. Další informace a shrnutí viz tab. 6.
Tab. 6. Venetoklax shrnutí. 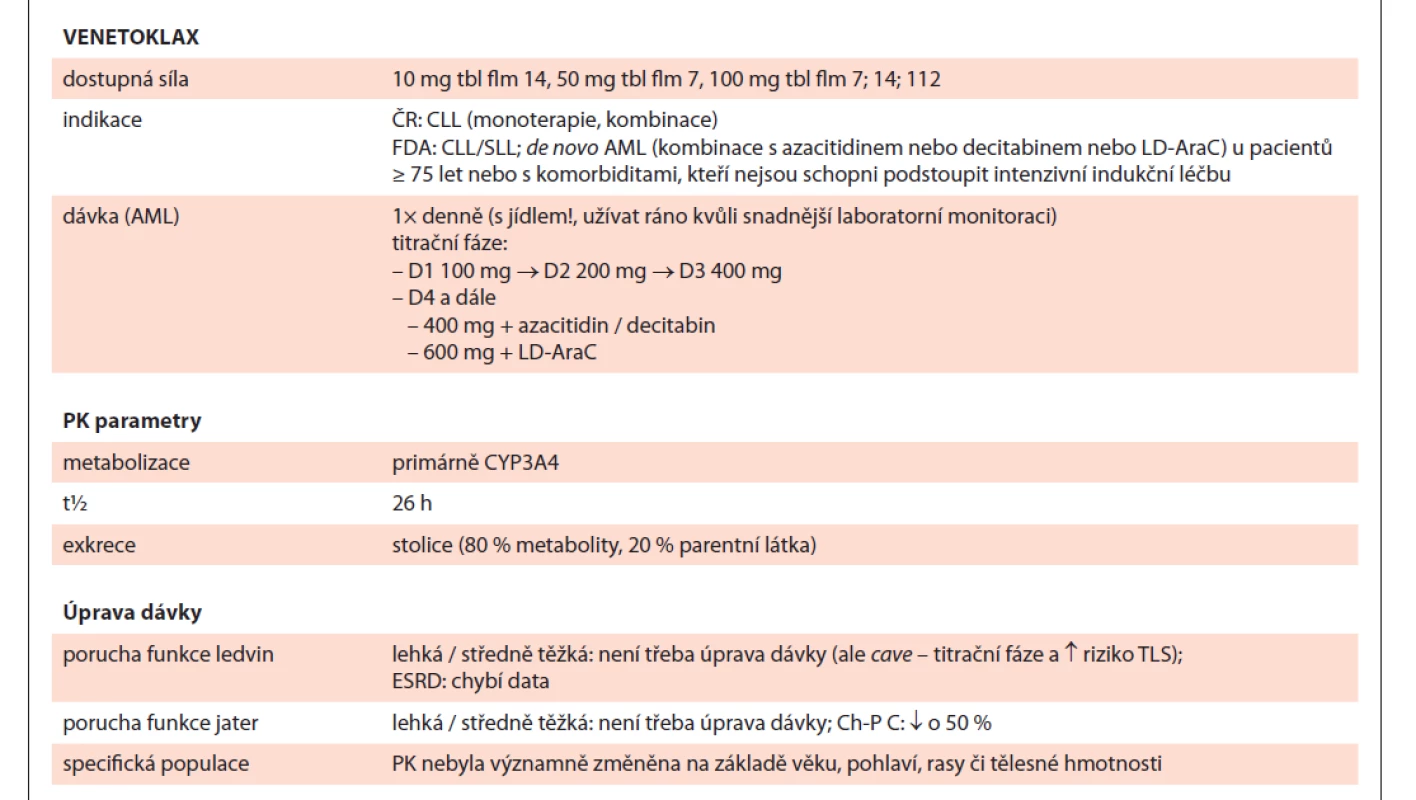
FDA – Úřad pro kontrolu potravin a léčiv (US), CLL/SLL – chronická lymfocytární leukemie/malobuněčný lymfatický lymfom, AML – akutní myeloidní leukemie, LD-AraC – nízkodávkovaný cytarabin, D1, etc – označení dne podání (den 1, etc.), PK – farmakokinetika, TLS – syndrom nádorového rozpadu, ESDR – konečné stadium onemocnění ledvin, Ch-P C – Child-Pugh klasifi kace – stadium C Tab. 6 – pokračování. Venetoklax shrnutí. 
* resp. dle t½ daného inhibitoru (většina azolů cca 30 h, tzn. úplné vyloučení do 6 dnů)
D1, etc – označení dne podání (den 1, etc.), P-gp – P-glykoprotein, BRCP – breast cancer resistance protein, NÚ – nežádoucí účinek, G-CSF – faktor stimulující granulocytární kolonieIvosidenib
Ivosidenib je inhibitorem mutantního enzymu isocitrát-dehydrogenázy 1 (IDH1). Inhibice IDH1 vede ke snížení hladiny 2-hydroxyglutarátu (2-HG) a indukuje myeloidní diferenciaci in vitro a in vivo na myších xenograftových modelech. V krevních vzorcích získaných od pacientů s AML s IDH1 mutací ivosidenib snížil hladinu 2-HG ex-vivo, snížil počet blastů a zvýšil procentuální podíl zralých myeloidních buněk.
Ivosidenib se odbourává pomocí CYP3A4, při souběžném podání s inhibitory se dávka snižuje na polovinu. Za povšimnutí stojí jeho působení jako induktoru CYP3A4 a CYP2C9. Významnými substráty těchto enzymů jsou flukonazol, vorikonazol či warfarin. Když není možné se souběžné terapii vyhnout, je zásadní monitorovat účinek pro možné riziko selhání antimykotické léčby či snížení účinku warfarinu [16,5].
Dlouhý poločas eliminace opět představuje výzvu při zvládnutí NÚ a dalších komplikací, jakými jsou prodloužení QTc intervalu, DS (19–25 % pacientů) či neinfekční leukocytózy (36–38 % pacientů), kdy podaná symptomatická léčba nemusí přinést rychlé zlepšení a časné odeznění příznaků. Další informace a shrnutí viz tab. 7.
Tab. 7. Ivosidenib shrnutí. 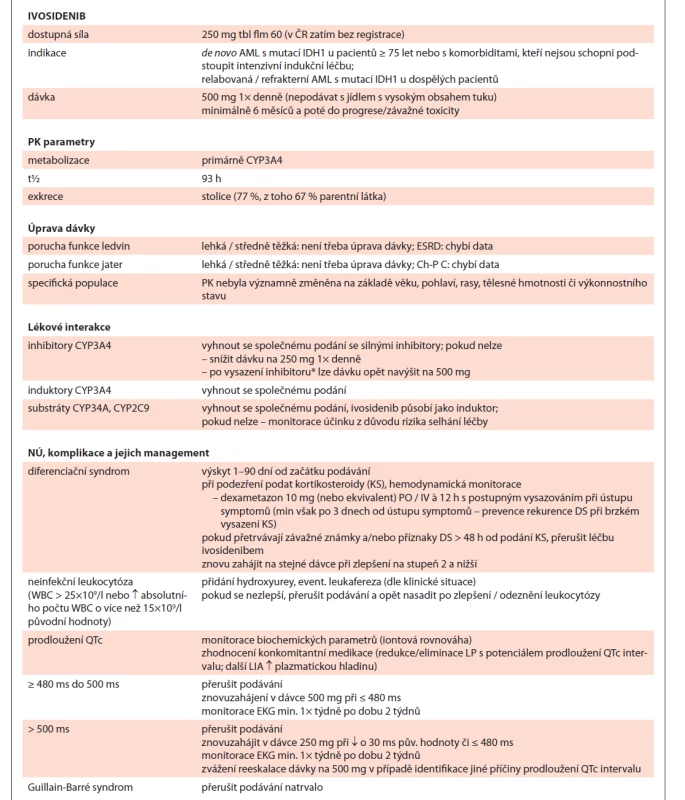
* resp dle t½ daného inhibitoru (většina azolů cca 30 h, tzn. úplné vyloučení do 6 dnů)
AML – akutní myeloidní leukemie, IDH – izocitrát-dehydrogenáza, PK – farmakokinetika, ESDR – konečné stadium onemocnění ledvin, Ch-P C – Child-Pugh klasifi kace – stadium C, NÚ – nežádoucí účinek, DS – diferenciační syndrom, WBC – počet leukocytů, LIA – lékové interakceEnasidenib
Na žádost držitele rozhodnutí o registraci byl v prosinci 2019 stažen z evropského trhu. Jedná se o inhibitor mutantního enzymu izocitrát-dehydrogenázy 2 (IDH2) s indikací pro relabovanou/refrakterní AML s IDH2 mutací. Farmakologický profil má velmi podobný s ivosidenibem – rozdílem je chybějící NÚ v podobě prodloužení QTc intervalu, naopak se vyznačuje hepatální toxicitou (hyperbilirubinemie). Stejně jako u IDH1 inhibitoru patří k výrazným komplikacím léčby DS či neinfekční leukocytóza [17,18].
Glasdegib
Evropská léková agentura schválila použití glasdegibu na konci dubna 2020. Jde o inhibitor signální transdukční dráhy Hedgehog (Hh), který se váže na transmembránový protein Smoothened (SMO). Tato vazba vede ke snížení aktivity transkripčního faktoru onkogenu souvisejícího s gliomem (GLI) a downstream signalizace. Pro udržení populace leukemických kmenových buněk je vyžadována signalizace dráhy Hh; navázáním glasdegibu na SMO a inhibicí SMO se tedy snižují hladiny GLI1 v buňkách AML a leukemického iniciačního potenciálu buněk AML. Signalizace dráhy Hh je rovněž zapojena do rezistence k chemoterapii a cílené terapii. V preklinickém modelu AML glasdegib v kombinaci s LD-AraC inhiboval růst tumoru ve větší míře než glasdegib či nízkodávkovaný cytarabin samotný. Mechanizmus účinku této kombinace však není zcela objasněn.
Primární metabolizmus glasdegibu zajišťuje CYP3A4 a sám se uplatňuje jako substrát (i inhibitor) P-gp či inhibitor BRCP. Při souběžném podání s inhibitory CYP3A4 se doporučuje opatrnost a úzké sledování toxicity, oproti tomu při podání s induktory je zapotřebí zvýšit dávku (dle tolerance pacienta). Před prvním podáním je nutné provést EKG a stanovit hladinu kreatinkinázy (CK) a kreatininu, neboť jako hlavní NÚ se objevuje prodloužení QTc intervalu a svalové poškození. Dále se lze při podání glasdegibu setkat s GIT toxicitou v podobě nechutenství, snížené chuti k jídlu či dysgeuzie. Hematologická toxicita je pak nejčastěji vyjádřena anemií, trombocytopenií a neutropenií (vč. febrilní) [19,20]. Shrnutí informací obsahuje tab. 8.
Tab. 8. Glasdegib shrnutí. 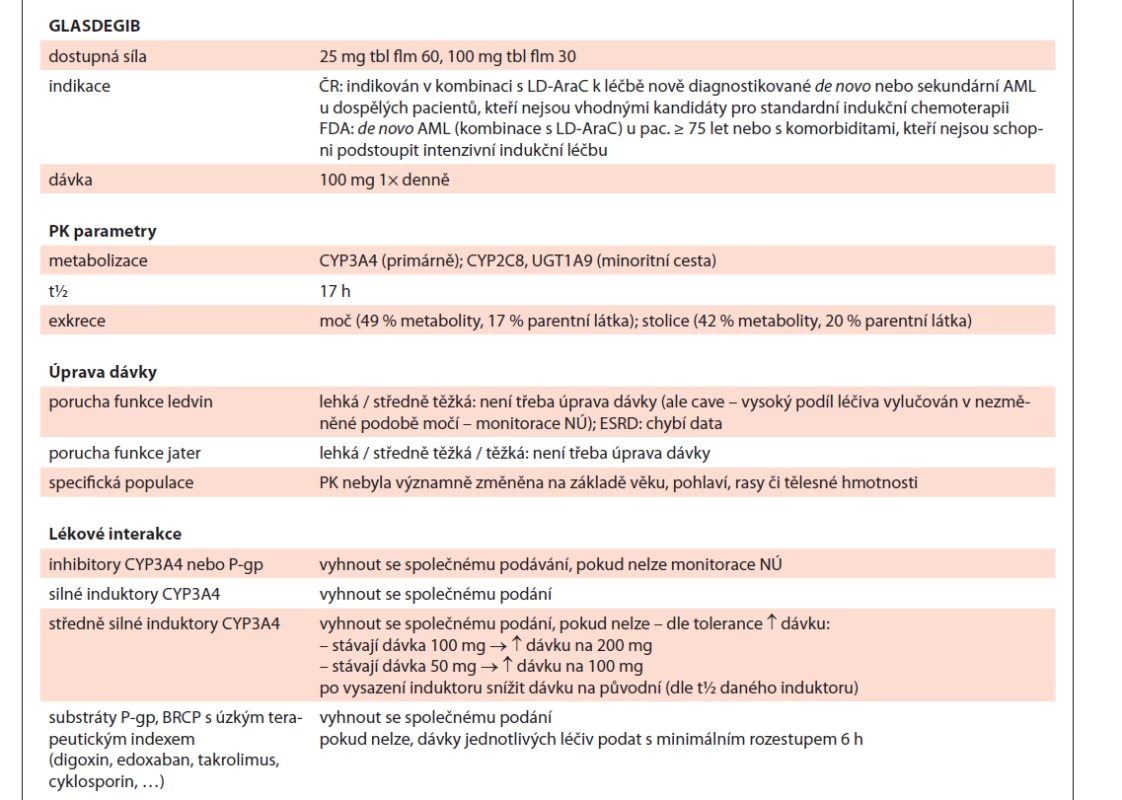
LD-AraC – nízkodávkovaný cytarabin, AML – akutní myeloidní leukemie, FDA – Úřad pro kontrolu potravin a léčiv (US), PK – farmakokinetika, NÚ – nežádoucí účinek, ESDR – konečné stadium onemocnění ledvin, P-gp – P-glykoprotein, BRCP – breast cancer resistance protein, LIA – lékové interakce, CK – kreatinkináza, HHN – horní hranice normy Tab. 8 – pokračování. Glasdegib shrnutí. 
NÚ – nežádoucí účinek, LIA – lékové interakce ZÁVĚR
Nová léčiva představují nové výzvy a zvyšují nároky na lékaře a další zdravotníky. Proto je zásadní komplexní znalost každého léčivého přípravku, který je nově zařazen do běžné klinické praxe. Je nutné získat povědomí o tom, jak předvídat, zmírňovat a řešit běžné komplikace či správně postupovat při zvládání závažných projevů toxicity, určování klinické významnosti lékových interakcí atd. V záplavě informací může důležitá informace často zapadnout; do procesu zavádění nové léčby je proto nutné zapojení všech členů multidisciplinárního týmu (lékař, sestra, klinický farmaceut). Jen díky vzájemné spolupráci lze zvyšovat bezpečnost a účinnost podávané léčby, a minimalizovat tak nežádoucí dopady na pacienta i zdravotnický systém.
ZKRATKY
ADC – konjugát protilátka-léčivo
ALT – alaninaminotransferáza
AML – akutní myeloidní leukemie
AraC – cytosin-arabinosid, cytarabin
AST – aspartátaminotransferáza
ATRA – kyselina all-trans-retinová
BAV – biologická dostupnost (bioavailability)
BRCP – efluxní transportér, protein lékové rezistence (breast cancer resistance protein)
CK – kreatinkináza
CLL/SLL – chronická lymfocytární leukemie/malobuněčný lymfatický lymfom
CYP450 – cytochrom P450
D1 – označení dne podání (den 1, etc.)
DRN – daunorubicin
DS – diferenciační syndrom
EKG – elektrokardiogram
ESRD – konečné stadium onemocnění ledvin (end-stage renal disease)
FDA – Úřad pro kontrolu potravin a léčiv (Food and Drug Administration)
G-CSF – faktor stimulující granulocytární kolonie (granulocyte colony stimulating factor)
GO – gemtuzumab ozogamicin
HIDAC – vysokodávkovaný cytosin-arabinosid (high-dose cytosine arabinoside)
HRCT – výpočetní tomografie s vysokým prostorovým rozlišením (high resolution computed tomography)
HSCT – transplantace krvetvorných buněk (haematopoietic stem cell transplantation)
Ch-P C – hodnocení tíže jaterního onemocnění dle Child-Pugh klasifikace
IDH – izocitrát-dehydrogenáza
KH – klinické hodnocení
KS – kortikosteroidy
LD-AraC – nízkodávkovaný cytosin-arabinosid (low-dose cytosine arabinoside)
LIA – lékové interakce
LP – léčivý přípravek
NÚ – nežádoucí účinek
PDGFR – receptor pro destičkový růstový faktor
P-gp – P-glykoprotein
PK – farmakokinetika
PRES – posteriorní reverzibilní encefalopatický syndrom
SPC – souhrn údajů o přípravku
t½ – terminální poločas eliminace
VEGFR2 – receptor typu 2 vaskulárního endoteliálního růstového faktoru
VOD/SOS – veno-okluzivní choroba jater/sinusoidální obstrukční syndrom (veno-occlusive disease / sinusoidal obstruction syndrome)
WBC – počet leukocytů (white blood count)
PODÍL AUTORŮ NA RUKOPISU
JV příprava rukopisu; ZR revize, úprava, doplnění rukopisu.
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 22. 6. 2020.
Přijato po recenzi dne 3. 8. 2020.
Mgr. Jana Vedrová
Oddělení klinické farmacie
Ústav hematologie a krevní transfuze
U Nemocnice 2094/1
128 20 Praha 2
e-mail: jana.vedrova@uhkt.cz
Zdroje
1. Doubek M, Mayer J, ed. Postupy diagnostiky a léčby leukemií a jejich infekčních komplikací u dospělých pacientů: doporučení České leukemické skupiny – pro život (CELL). 2., přeprac. vyd. Brno: Česká leukemická skupina – pro život, 2013. ISBN 978-80-260-4744-5.
2. Květina J, Grundmann M. Farmakologické interakce. Klin Farmakol Farmacie. 2003; 1 : 17–21.
3. Dostálek M, Janoštíková E, Juřica J, a kol. Farmakokinetika. Praha: Grada, 2006. ISBN 80-247-1464-7.
4. Souhrn údajů o přípravku, Státní ústav pro kontrolu léčiv, Databáze léků, Xospata, https: //www.ema.europa.eu/en/documents/ product-information/xospata-epar-product-information_cs.pdf, [online], cit 25. 05. 2020.
5. tibsovo.com, Full Prescribing Information, https: //www.tibsovopro.com/pdf/prescribinginformation.pdf, [online], cit 31. 05. 2020.
6. Čerňan M, Szotkowski T. Moderní léčba akutní myeloidní leukemie. Transfuze Hematol Dnes. 2017; 23 (1): 16–28.
7. Souhrn údajů o přípravku, Státní ústav pro kontrolu léčiv, Databáze léků, Rydapt, https: //www.ema.europa.eu/en/documents/product-information/rydapt-epar-product-information_cs.pdf, [online], cit 25. 05. 2020.
8. UpToDate, Midostaurin: Drug information, Topic 112991 Version 72.0, https: //www.uptodate.com/contents/midostaurin-drug - informati-on?search=midostaurin&source=panel_search_result&selectedTitle=1~14&usage_type=panel&kp_tab=drug_general&display_rank=1, [online], cit 31. 05. 2020.
9. UpToDate, Gilteritinib: Drug information, Topic 119861 Version 41.0, https: //www.uptodate.com/contents/gilteritinib-drug-informati-on?search=gilteritinib&source=panel_search_result&selectedTitle=1~7&usage_type=panel& kp_tab=drug_general&display_rank=1, [online], cit 31. 05. 2020.
10. Souhrn údajů o přípravku, Státní ústav pro kontrolu léčiv, Databáze léků, Mylotarg, https: //www.ema.europa.eu/en/documents/ product-information/mylotarg-epar-product-information_cs.pdf, [online], cit 25. 05. 2020.
11. UpToDate, Gemtuzumab ozogamicin: Drug information, Topic 8968 Version 156.0, https: //www.uptodate.com/contents/gemtuzumab-ozogamicin-drug-informati-on?search=gemtuzumab%20ozogamicin&source=panel_search_result&selectedTitle=1~22&usage_type=panel&kp_tab=drug_general&display_rank=1, [online], cit 31. 05. 2020.
12. Mylotarg.com, Full Prescribing Information, http: //labeling.pfizer.com/ShowLabeling.aspx?id=9548, [online], cit 31. 05. 2020.
13. Souhrn údajů o přípravku, Státní ústav pro kontrolu léčiv, Databáze léků, Venclyxto, https: //www.ema.europa.eu/en/documents/product-information/venclyxto-epar-product-information_cs.pdf, [online], cit 25. 05. 2020.
14. Venclexta.com, Full Prescribing Information, https: //www.rxabbvie.com/pdf/venclexta.pdf, [online], cit 31. 05. 2020.
15. Wei AH, Strickland SA, Hou JZ, et al. Venetoclax combined with low-dose cytarabine for pre-viously untreated patients with acute myeloid leukemia: Results from a Phase Ib/II Study. J Clin Oncol. 2019; 37 (15): 1277–1284.
16. UpToDate, Ivosidenib: Drug information, Topic 118520 Version 42.0, https: //www.uptodate.com/contents/ivosidenib-drug-informati-on?search=ivosidenib&source=panel_ search_result&selectedTitle=1~17&usage_type=panel&kp_tab=drug_general&display_rank=1, [online], cit 31. 05. 2020.
17. idhifapro.com, Full Prescribing Information, https: //media2.celgene.com/content/ uploads/idhifa-pi.pdf, [online], cit 31. 05. 2020.
18. UpToDate, Enasidenib: Drug information, Topic 114206 Version 42.0, https: //www.uptodate.com/contents/enasidenib-drug-informati-on?search=enasidenib&source=panel_ search_result&selectedTitle=1~12&usage_type=panel&kp_tab=drug_general&display_rank=11, [online], cit 31. 05. 2020.
19. Souhrn údajů o přípravku, Státní ústav pro kontrolu léčiv, Databáze léků, Daurismo, https: //www.ema.europa.eu/en/documents/ product-information/daurismo-epar-product-infomartion_cs.pdf, [online], cit 10. 07. 2020.
20. Daurismo.com, Full Prescribing Information, http: //labeling.pfizer.com/ShowLabeling.aspx?id=11336, cit 31. 05. 2020.
21. Prokeš M, Suchopár J. Prodloužení intervalu QT způsobené léky. Med Praxi. 2014; 11 (1): 34–39.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2021 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- ZMĚNY V IMUNITNÍM SYSTÉMU U NELÉČENÝCH NEMOCNÝCH S CHRONICKOU LYMFOCYTÁRNÍ LEUKEMIÍ – ČÁST 2: NESPECIFICKÁ IMUNITA.
-
Doc. MUDr. Miroslav Tomíška, CSc.,
slaví sedmdesáté životní jubileum - Zemřel profesor Jan Evangelista Dyr
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
- Jaké dávky inhibitorů tyrozinkináz jsou v léčbě pacientů s chronickou myeloidní leukemií optimální?
- EDITORIAL
- Von Willebrandova choroba – porovnanie dvoch metód analýzy multimérov von Willebrandovho faktora
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Bolesti svalů jako vzácný autoimunitní projev při monoklonální IgM gamapatii – popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů
- Inhibítory faktora VIII – Výsledky imunotolerančnej indukcie v Národnom hemofi lickom centre a nové možnosti a prvé skúsenosti s liečbou bišpecifi ckou protilátkou (emicizumab) u pacientov s inhibítormi na Slovensku
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 3., rok 2021
- Heparinem indukovaná trombocytopenie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Heparinem indukovaná trombocytopenie
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



