-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi
Tyrosine kinase inhibitor discontinuation in chronic myeloid leukaemia patients in both clinical trials and daily clinical practice
The introduction of tyrosine kinase inhibitors into clinical practice led to dramatic improvement of chronic myeloid leukaemia patient prognosis. The life expectancy of newly diagnosed chronic myeloid leukaemia patients is almost the same as that of the general population, a unique feature not only in haematology but also in oncology per se. However, in the case of many patients this is offset by the need for long-term, lifelong pharmacotherapy with all its negative consequences such as side effects, economic burden and pregnancy planning restriction. Adverse events may negatively affect patient quality of life, restrict routine daily activities and serious events associated especially with second and third generation tyrosine kinase inhibitors may even prove life-threatening. Depending on the TKI selected, 30-50% of patients achieve a deep molecular response. In individuals with stable deep molecular response, tyrosine kinase inhibitor discontinuation and subsequent treatment-free remission maintenance have become the new goal of CML treatment. Although treatment-free remission may be associated with some drawbacks such as withdrawal syndrome and a degree of late relapse risk, it definitely represents a relatively safe alternative to long-term therapy and is now proceeding from clinical trials into daily clinical practice. This article summarizes comprehensively clinical trials focused on treatment-free remission in CML patients, including their implications for daily clinical practice and potential consequences of tyrosine kinase inhibitors cessation.
Autoři: P. Čičátková; D. Žáčková
Působiště autorů: Interní hematologická a onkologická klinika, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity, Brno
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 4, p. 279-291.
Kategorie: Souhrnné/edukační práce
Souhrn
Zavedení inhibitorů tyrozinkináz dramaticky zlepšilo prognózu pacientů s chronickou myeloidní leukemií. Očekávaná délka života pacientů při nově diagnostikovaném onemocnění se již téměř neliší od délky života zdravé populace, což je zcela unikátní nejen napříč hematologií, ale i celou onkologií. To je však pro mnohé pacienty vykoupeno nutností trvalé, celoživotní farmakoterapie se všemi jejími negativními důsledky v podobě nežádoucích účinků, ekonomické zátěže a omezení při plánování gravidit. Zejména nežádoucí účinky mohou výrazně negativně ovlivnit kvalitu života pacientů, limitovat je v běžných denních činnostech a v případě závažných nežádoucích účinků, především TKI vyšších generací, i ohrozit na životě. V závislosti na zvoleném TKI dosáhne 30–50 % pacientů hluboké molekulární odpovědi a pro jedince se stabilní hlubokou molekulární odpovědí se novým léčebným cílem stalo vysazení TKI s následným udržením remise bez nutnosti terapie. Přestože i remise bez nutnosti terapie může mít svoje stinné stránky v podobě syndromu z vysazení a nejistoty stran případného pozdního návratu onemocnění, představuje poměrně bezpečnou alternativu dlouhodobé terapie a postupně se přesouvá z klinických studií také do rutinní praxe. V tomto článku jsou komplexně shrnuty studie zaměřené na vysazování TKI u pacientů s CML včetně jejich dopadů na klinickou praxi a možných rizik plynoucích z vysazení TKI.
Úvod
Chronická myeloidní leukemie (CML) je myeloproliferativní onemocnění definované přítomností filadelfského chromozomu (Philadelphia chromosome, Ph1) [1] a fúzního genu BCR-ABL1 rezultujícího v konstitutivně aktivovanou tyrozinkinázu Bcr-Abl1 [2]. Přítomnost potenciálního léčebného cíle vedla k vývoji prvního specifického inhibitoru tyrozinkináz (tyrosine kinase inhibitor, TKI) imatinibu a k jeho rychlému uvedení do klinické praxe v roce 2001. To bylo následováno významným zlepšením prognózy pacientů s CML [3] s celkovým přežitím dosahujícím po deseti letech léčby 83,3 % [4] a předpokládanou délkou života téměř shodnou s délkou života zdravé populace [5]. Po imatinibu byly do klinické praxe uvedeny TKI druhé (dasatinib, nilotinib a bosutinib) a třetí generace (ponatinib), které představují další účinnou alternativu jak pro pacienty rezistentní nebo netolerující imatinib, tak (v případě nilotinibu, dasatinibu a bosutinibu) i pro pacienty v první linii [6–12]. Vzhledem ke stabilní evropské roční incidenci CML 0,8–1,1 nemocných na 100 000 obyvatel se při zlepšující se prognóze pacientů odhaduje nárůst prevalence o 10 % za rok a do roku 2050 se v Evropě očekává více než 400 000 nemocných s CML [13]. S léčbou, která je pro většinu pacientů celoživotní, jsou spojena negativa jak z hlediska kvality života pacientů, tak z pohledu ekonomické zátěže zdravotnických systémů [14, 15]. Stejně jako se vyvíjejí možnosti terapie CML [16], mění se i cíle léčby. Zcela nepodkročitelné je nyní nejen dosažení kompletní hematologické odpovědi (complete hematological response, CHR, tj. normalizace krevního obrazu) a kompletní cytogenetické odpovědi (complete cytogenetic response, CCyR, tj. nepřítomnost Ph pozitivních buněk při konvenční cytogenetické analýze), ale především odpovědi na molekulární úrovni, tzv. velké molekulární odpovědi (major molecular response, MMR, tj. pokles hladiny BCR-ABL1 transkriptů ≤ 0,1 % vzhledem k mezinárodní škále – International Scale, IS). Se zavedením TKI vyšších generací je u stále většího počtu pacientů nastolena i tzv. hluboká molekulární odpověď (deep molecular response, DMR, tj. hladina transkriptů BCR-ABL1 ≤ 0,01 % ve vztahu k IS). Dříve užívaný termín kompletní molekulární odpověď (complete molecular response, CMR, tj. nedetekovatelné BCR-ABL1 transkripty při moleulárně biologickém vyšetření) je dnes na rozdíl od pojmu nedetekovatelná minimální zbytková nemoc (undetectable minimal residual disease, UMRD, tj. nedetekovatelné BCR-ABL1 transkripty při molekulárně biologickém vyšetření) považován za obsoletní. Dosažení DMR je důležitým předpokladem pro koncept remise bez nutnosti terapie (treatment-free remission, TFR), což zdůrazňují i recentně publikovaná doporučení Evropské leukemické sítě (European LeukemiaNet, ELN) 2020 [17], a týká se 30–50 % pacientů v závislosti na typu užívaného TKI [6, 8]. Myšlenka vysadit terapii u pacientů s CML se zrodila již před zavedením TKI do klinické praxe, v éře interferonu alfa (INFα), kdy nejčastějším důvodem byly nezvladatelné nežádoucí účinky (NÚ) [18, 19]. U části pacientů však bylo přerušení terapie INFα motivováno dosažením UMRD a velká část z nich TFR také udržela, což se označovalo pojmem operational cure a ukazují to i zkušenosti z českých center [20]. Následně byla provedena řada klinických studií i kontrolovaných vysazení TKI v rutinní praxi, které prověřily schůdnost a bezpečnost tohoto postupu [21–45] a jejichž ucelený přehled nabídlo před časem i české písemnictví [46]. Snaha o dosažení TFR se cestou doporučení odborných skupin a expertů postupně přesouvá do klinické praxe a pravděpodobně se brzy stane novým cílem léčby pacientů s CML, analogicky jako je tomu u jiných onkologických onemocnění, u kterých je časově ohraničená terapie s cílem navození remise běžným standardem.
Důvody k vysazení TKI
Nežádoucí účinky jsou jednou z hlavních motivací pro ukončování léčby TKI. Dělíme je do 3 základních kategorií. První zahrnuje NÚ vyskytující se na počátku terapie, někdy až stupně závažnosti 3–4 podle CTCAE (Common Terminology Criteria for Adverse Events). Vyžadují adekvátní terapii, často včetně přechodného odnětí léku. V úplné vysazení terapie vyústí asi u 10 % pacientů. Druhou skupinu představují NÚ spíše nízkého stupně, které se také obvykle objevují v prvních měsících terapie, ale často přetrvávají dlouhodobě a přechází do chronicity. Alterují kvalitu života a mohou také ovlivnit compliance pacientů [47]. Snížená adherence pacientů k léčbě je přitom faktor silně asociovaný se ztrátou CCyR [48]. Příkladem takového NÚ je únava doprovázející terapii imatinibem, která postihuje více než 80 % takto léčených pacientů [14]. Těžká únava je až v 60 % případů spojena s dalšími příznaky, jako jsou bolesti kloubů a svalů či křeče, což dále negativně ovlivňuje kvalitu života pacientů [49]. Třetí skupinou, týkající se zejména TKI vyšších generací, jsou NÚ závažné až život ohrožující [47], například arteriální cévní uzávěry při terapii nilotinibem [6] a ponatinibem [12] nebo pleurální výpotky komplikující terapii dasatinibem [8]. Etiologie NÚ není zcela jasná, předpokládá se off-target efekt TKI na jiné kinázy než Bcr-Abl1 [47].
Dalším důvodem k ukončení či přerušení terapie TKI je zajištění bezpečných gravidit a vývoje zdravého plodu. Přestože většina těhotenství, probíhajících při současné terapii TKI, skončí narozením zdravého novorozence, existuje zde riziko závažných malformací plodu. Proto nelze užívání TKI u těhotných žen doporučit a je nutné alespoň dočasné přerušení terapie [50].
Důležitou roli hrají i ekonomické aspekty. Cena roční léčby pro jednoho CML pacienta se ve většině evropských zemí pohybuje mezi 30 000 a 40 000 eur [51] a v případě ponatinibu se může vyšplhat až nad 120 000 eur [15]. S použitím generik bude ekonomická náročnost sice nižší, ale při celoživotním užívání TKI zůstane finanční zátěž i tak značná. Ekonomická stránka byla hodnocena i v rámci několika klinických studií zaměřených na proveditelnost a bezpečnost vysazení TKI. Ve studii STIM (STop IMatinib trial) byla úspora za imatinib po jeho vysazení odhadnuta na 4 miliony eur [22]. Ve studii EURO-SKI (EUROpe Stop TKI) se uspořilo více než 20 milionů eur i po odečtení nákladů na přídatné návštěvy a molekulární vyšetření, prováděná častěji než při trvalé léčbě [25]. Během prvních 12 měsíců studie DESTINY (De-Escalation and Stopping Treatment with Imatinib, Nilotinib or sprYcel), kdy se dávka TKI snížila na polovinu standardního dávkování, bylo uspořeno více než 2 250 000 eur, a náklady tak klesly zhruba o polovinu předpokládané ceny [27]. Snížení ekonomické zátěže pro zdravotnictví je tedy při úspěšném vysazení TKI významné.
V neposlední řadě je při zvažování vysazení TKI nutné zohlednit přání samotných pacientů, kteří však nemusí ukončení léčby vždy preferovat. Jak ukázal průzkum Goldberga et al. [52], třetina oslovených pacientů si vysazení TKI nepřála. Nejčastějším důvodem byl strach z návratu onemocnění (58 % pacientů). Naopak vysazení TKI by uvítalo 42 % dotázaných. Podobné výsledky přinesla i práce Breccia et al. [53]. V dotazníkovém šetření, kterého se účastnilo více než 1 100 pacientů, 49 % z nich odpovědělo, že si nepřejí odnětí TKI ze strachu z návratu onemocnění. Výsledky některých dalších průzkumů jsou však odlišné. Příkladem je dotazníkové šetření u 888 čínských pacientů, z nichž si léčbu alespoň částečně hradilo 83 %. Právě náklady na léčbu byly nejčastějším důvodem požadavku na vysazení terapie, které si přálo více než 80 % pacientů. Vysazení TKI častěji preferovali pacienti mladší a ti s vyšší spoluúčastí [54].
Nejvýznamnější klinické studie vysazující převážně imatinib
Přerušení terapie imatinibem se nejprve realizovalo u jednotlivých případů nebo velmi malých souborů pacientů, a to zejména na vrub NÚ nebo plánování gravidit [55, 56].
První systematické vysazení se odehrálo v rámci francouzské studie pro pacienty s CML v chronické fázi (chronic phase, CP), kteří dosáhli stabilní CCyR s UMRD trvající minimálně po dobu 2 let. Bylo zahrnuto 12 pacientů, u nichž byl medián trvání UMRD před vysazením imatinibu 32 měsíců a medián délky terapie imatinibem 45 měsíců. Molekulární rekurence byla definována jako jakákoliv pozitivita BCR-ABL1 transkriptu měřená pomocí kvantitativní polymerázové řetězové reakce (real-time quantitative polymerase chain reaction, RT-RQ-PCR) a prokázaná ve dvou po sobě jdoucích měřeních. K tomu došlo celkem u 6 pacientů (50 %), u všech během prvních 5 měsíců po ukončení terapie imatinibem. Zbývajících šest pacientů setrvávalo v UMRD i po 18 měsících od ukončení terapie TKI [21]. Výsledek této studie inicioval provedení dalších studií na větších souborech pacientů. Klíčovou se stala již zmíněná prospektivní studie STIM. Zúčastnilo se jí celkem 100 pacientů s UMRD trvající minimálně 2 roky. K molekulární rekurenci, definované jako pozitivita PCR konfirmovaná druhým odběrem, došlo u 61 pacientů. Z nich 57 znovu začalo užívat imatinib a 55 dosáhlo druhé UMRD. Znovuzahájení terapie odmítli 3 pacienti, jeden nezahájil terapii z důvodu léčby jiného nádorového onemocnění. Většina molekulárních rekurencí proběhla během prvních 6 měsíců, ale byly zaznamenány i 3 pozdní rekurence (v 18., 20. a 22. měsíci od vysazení terapie). Přežití bez molekulární rekurence bylo 43 % v 6 měsících a 38 % v 60 měsících od vysazení TKI. V mediánu sledování 77 měsíců nedošlo u žádného pacienta k progresi do akcelerované fáze (accelerated phase, AP) nebo blastického zvratu (blast crisis, BC) ani ke ztrátě hematologické odpovědi [23]. Paralelně se studií STIM probíhala australská studie TWISTER. V té participovalo 40 pacientů s CML v CP s UMRD trvající po dobu 2 let. V době analýzy byla molekulární rekurence, definovaná jako ztráta UMRD ve 2 po sobě jdoucích odběrech nebo izolovaná ztráta MMR zaznamenaná celkem u 18 pacientů (45 %) a u většiny z nich se objevila v prvních 6 měsících. Žádná ztráta UMRD se neobjevila po 27. měsíci od vysazení imatinibu. Odhadovaná pravděpodobnost dosažení TFR ve 24 měsících od vysazení TKI byla 47 %. K progresi do AP nebo BC ani ke ztrátě CHR nedošlo u žádného pacienta [24]. V obou těchto studiích byla molekulární rekurence shodně definována jako pozitivita BCR-ABL1 transkriptu s citlivostí detekce 0,001 % vzhledem k IS ve dvou po sobě jdoucích vyšetřeních. Rousselot et al. v rámci studie A-STIM (According to STop IMatinib) zvolili nové, volnější kritérium pro molekulární rekurenci v podobě ztráty MMR. Do studie bylo zahrnuto 80 pacientů s dlouhodobou UMRD. U 52 % pacientů byla UMRD nestabilní a docházelo k fluktuaci hladiny BCR-ABL1 transkriptů, tj. k detekci transkriptu v jednom nebo více odběrech. Celkem 29 pacientů ztratilo MMR v mediánu 4 měsíců od vysazení TKI. Kumulativní incidence TFR byla odhadována na 64 % ve 12 i 24 měsících a 61 % ve 36 měsících od vysazení imatinibu. U žádného pacienta nedošlo ke ztrátě CHR a všichni pacienti po obnovení terapie imatinibem znovu dosáhli MMR. Progrese do BC byla zaznamenána u 1 pacientky. Ta ztratila MMR po 10 měsících od vysazení léku, byla u ní obnovena terapie imatinibem a po 4 měsících znovu nastolena i MMR. Za 8,5 měsíce poté byl u pacientky diagnostikován BC, pro který byla úspěšně léčena nilotinibem a chemoterapií (po selhání dasatinibu) a rovněž alogenní transplantací periferních kmenových buněk od nepříbuzného dárce. Žádná ze vstupních charakteristik pacientky ji nedefinovala jako vysoce rizikovou stran přerušení imatinibu a progrese do BC nemusela s odnětím léku přímo souviset. Z výsledků studie A-STIM vyplynulo, že ztráta MMR je bezpečným milníkem pro znovuzahájení terapie TKI po jeho vysazení [25].
Dosud největší vysazovací studií, ve které bylo po vzoru studie A-STIM zvolena pro obnovení terapie TKI právě ztráta MMR, byla panevropská multicentrická prospektivní studie EURO-SKI, do které se zapojilo celkem 61 hematologických center z 11 evropských zemí. Participovalo i všech 6 center v České republice, ve kterých bylo celkem zařazeno 64 pacientů, a ČR se tak stala jedním z nejaktivnějších účastníků studie napříč Evropou. Vstoupit do této studie mohli pacienti užívající jakýkoliv TKI v první nebo druhé linii po předchozí intoleranci, a to po dobu minimálně 3 let s trváním DMR minimálně 1 rok. Vstupní kritéria tak byla méně přísná než u předchozích studií a umožnila posoudit bezpečnost a proveditelnost vysazení TKI na velkém souboru pacientů. Zařazeno bylo celkem 758 pacientů, z nichž 94 % užívalo imatinib, 4 % nilotinib, 2 % dasatinib. V současnosti je k dispozici interim analýza provedená po dosažení 6měsíčního přežití bez molekulárního relapsu u 200 pacientů. V TFR bylo 61 % v 6 měsících a 50 % ve 24 měsících. Molekulární rekurence, respektive ztráta MMR, se u 80 % relabujících pacientů objevila v prvních 6 měsících po vysazení TKI. U žádného pacienta nedošlo ke ztrátě CHR ani k progresi do AP nebo BC. V průběhu sledování zemřelo 10 pacientů (2 %), přičemž u žádného z nich příčina smrti nesouvisela s CML. Po obnovení terapie TKI bylo znovu dosaženo MMR u 86 % pacientů [26].
Odlišný design než všechny výše uvedené projekty měla britská studie DESTINY. Od ostatních se lišila tím, že dávka TKI byla nejprve na dobu 12 měsíců zredukována na polovinu standardní dávky (fáze de-eskalace) a až v případě setrvání v MMR byl následně TKI vysazen. Studie se zúčastnilo celkem 174 pacientů, z toho 49 v MMR kohortě, se stabilní MMR po dobu minimálně 12 měsíců, a 125 v MR4 kohortě, se stabilní MR4 (tj. hladina BCR-ABL1 transkriptů ≤ 0,01 % vztaženo k IS) po dobu 12 měsíců. Imatinib užívalo 85 % pacientů, nilotinib 9 % pacientů a dasatinib 6 % pacientů s mediánem délky terapie TKI 6,9 roku. V průběhu dvanáctiměsíční fáze deeskalace léčebnou odpověď ztratilo pouze 12 pacientů (7 %). Všichni tito pacienti užívali imatinib a molekulární rekurence (definována jako první z 2 po sobě následujících hodnot hladiny transkriptů BCR-ABL1 > 0,1 %) byla signifikantně méně častá v MR4 kohortě (3 pacienti vs. 9 pacientů v MMR kohortě). Stejně tak čas do relapsu byl signifikantně kratší v MMR kohortě (medián 4,4 měsíce vs. 8,7 měsíce v MR4 skupině). Během deeskalační fáze nedošlo u žádného pacienta k progresi do AP nebo BC a ani ztrátě CCyR. Deeskalace se ukázala jako bezpečná a s dostatečným potenciálem ke kontrole onemocnění a navíc vedla u pacientů obou skupin ke zmírnění NÚ [27]. Podle výsledků finální analýzy studie DESTINY byla četnost molekulárních rekurencí v MR4,0 kohortě nízká i ve fázi úplného odnětí léku a přežití bez molekulární rekurence ve 36 měsících dosáhlo v této skupině 72 %. Počet molekulárních rekurencí byl signifikantně vyšší v MMR kohortě (p < 0,001), kde bylo bez molekulární rekurence ve 36 měsících pouze 36 % pacientů. Žádná rekurence se neobjevila po 24 měsících od vstupu do studie. U pacientů, u kterých k molekulární rekurenci došlo, byla obnovena terapie jejich původním TKI v plné dávce (s výjimkou 6, kteří si přáli buď opětovné užívání TKI oddálit, nebo se přikláněli k nižší než plné dávce). Všichni pacienti obnovili MMR do 5 měsíců od zahájení terapie. Dva pacienti v průběhu studie zemřeli, ale ani u jednoho z nich nebyla příčinou úmrtí CML. Jeden pacient současně s molekulární odpovědí ztratil také CHR, která však byla promptně obnovena po navrácení terapie [28].
Proveditelnost a bezpečnost vysazení imatinibu potvrdily i následující studie: ISAV (Imatinib Suspension and Validation) – TFR 50,9 % ve 24 měsících od vysazení TKI, většina rekurencí se objevila v prvních 9 měsících [29]; KID (Korean Imatinib Discontinuation) – TFR 62,2 % ve 12 měsících od vysazení, 58,5 % ve 24 měsících, medián do ztráty MMR byl 3,3 měsíce [30]; JALSG-STIM213 (Japan Adult Leukemia Study Group – STop IMatinib 213) – TFR 67,6 % ve 12 měsících od vysazení TKI, odhadovaná TFR ve 36 měsících 64,6 %, většina rekurencí se vyskytla během prvních 12 měsíců [31]; STIM2 (STop IMatinib 2) – TFR 52 % v 6 měsících od vysazení, 50 % ve 24 měsících od vysazení [32].
Nejvýznamnější klinické studie vysazující inhibitory tyrozinkináz vyšších generací
Rezistence na imatinib nebo jeho nesnášenlivost jsou běžným jevem a pouze 48,3 % pacientů užívajících lék v první linii pokračuje v léčbě i 10 let od zahájení terapie [4]. V klinické praxi se tak běžně setkáváme s nilotinibem v první i v druhé linii a s dasatinibem nebo bosutinibem ve druhé a dalších liniích. Poté, co se odnětí imatinibu opakovaně ukázalo jako možné a bezpečné, byla pozornost upřena i na vysazování TKI vyšších generací.
Jednou z prvních studií, zaměřených na TKI 2. generace, byla studie STOP 2G-TKI (STOP Second Generation – Tyrosine Kinase Inhibitors). Zahrnuti byli pacienti užívající nilotinib nebo dasatinib v první i dalších liniích a minimální doba užívání TKI u těchto pacientů byla 3 roky se stabilní molekulární odpovědí na úrovni MR4,5 (tj. hladina BCR-ABL1 ≤ 0,0032 % vztaženo k IS) trvající nejméně 2 roky. Analýza byla provedena poté, co 60 pacientů dosáhlo minimální délky sledování 12 měsíců. Molekulární rekurence (definovaná jako ztráta MMR) byla zaznamenána u 26 pacientů (43,3 %). Medián času do rekurence byl 4 měsíce. TFR ve 12 měsících dosáhlo 63,3 %, ve 48 měsících pak 53,6 % pacientů. I v této studii byla pozorována fluktuace BCR-ABL1 v jednom i více měřeních, aniž by došlo k molekulární rekurenci onemocnění (jak bylo zmíněno u studie A-STIM). Nedošlo k žádné progresi do AP nebo BC a všichni pacienti s molekulární rekurencí po znovuzahájení terapie TKI obnovili MMR i MR4.5 [33]. Další studií byla japonská studie DADI (Dasatinib DIscontinuation). Zúčastnilo se jí 88 pacientů, kteří užívali dasatinib ve druhé linii po předchozí terapii imatinibem a kteří na této terapii dosáhli DMR. Celkem 63 pacientů, kteří udrželi MR4.0 i během rok trvající terapie dasatinibem (tzv. preregistrační fáze), postoupilo do vysazovací fáze. Zbývajících 25 pacientů pokračovalo v užívání dasatinibu a u žádného z nich nedošlo k progresi do AP nebo BC. Z pacientů, kteří dasatinib vysadili, byla u 33 diagnostikována molekulární rekurence během prvních 7 měsíců od vysazení. Podíl TFR v 6 měsících byl 49 %, ve 12 měsících 48 % a ve 36 měsících 44,4 %. Pouze u 2 pacientů se vyvinula molekulární rekurence po 1 roce od vysazení, konkrétně v 18. a 21. měsíci [34]. Japonskou studií byl i projekt nazvaný D-STOP. Vstoupit do studie mohli pacienti léčení jakýmkoliv TKI, kteří po potvrzení molekulární odpovědi na úrovni MR4.0 užívali již v rámci studie dasatinib po dobu dalších dvou let jako konsolidační terapii. Celkem bylo zařazeno 60 pacientů, z nichž 54 udrželo stabilní MR4.0 a vstoupilo do vysazovací fáze. Medián sledování v době analýzy byl 16 měsíců a během této doby se molekulární rekurence objevila u 20 z nich. Odhadovaný podíl TFR ve 12 měsících byl 62,9 %. U většiny pacientů byla rekurence zaznamenána v průběhu prvních 6 měsíců a všichni tito pacienti zůstali citliví vůči působení dasatinibu s obnovením MMR během 6 měsíců od opětovného zahájení terapie. Nejpozdější molekulární rekurence byla zaznamenána v 7. měsíci od vysazení TKI a u žádného pacienta nedošlo ke ztrátě hematologické ani kompletní cytogenetické odpovědi [35]. Studie DASFREE se zúčastnili pacienti užívající dasatinib minimálně po dobu 2 let, kteří dosáhli MR4.5 trvající nejméně 1 rok. Z 84 zařazených jich 37 (44 %) užívalo dasatinib v 1. linii a 47 (56 %) v liniích následujících (53 % pro rezistenci na jiný TKI, 38 % pro intoleranci, u ostatních nebyl důvod převedení na dasatinib specifikován). TFR ve 12 měsících dosáhlo 48 % (z pacientů léčených dasatinibem v první linii 54 %, z pacientů netolerujících předchozí TKI 50 % a z pacientů rezistentních na předchozí terapii TKI 40 %) a ve 24 měsících 46 % pacientů (pro pacienty léčené dasatinibem v první linii 51 %, pro pacienty léčené dasatinibem v dalších liniích 42 %). Medián času do ztráty MMR byl 4 měsíce, nejpozdější rekurence se objevila ve 39. měsíci od přerušení terapie dasatinibem [36].
Nilotinib figuroval v japonské studii Nilst (Stop Nilotinib Trial). Zúčastnili se pacienti, kteří na léčbě imatinibem nebo nilotinibem dosáhli molekulární odpovědi MR4.5. Následně užívaný nilotinib byl po 2 letech terapie a současně při setrvání v MR4,5 vysazen. Milníkem pro znovuzahájení terapie byla ztráta MR4.5. Z celkem 112 pacientů tuto odpověď po dobu 2 let udrželo 90 a nilotinib skutečně vysadilo 87 pacientů. Ve 12 i 36 měsících byla pravděpodobnost setrvání v TFR shodně 60,9 %. Z 34 pacientů s molekulární rekurencí (ve všech případech v prvních 6 měsících od vysazení) jich 33 znovu zahájilo terapii nilotinibem a všichni obnovili MR4.5 [37]. Ve studii ENESTfreedom (Evaluating Nilotinib Efficacy and Safety in Clinical Trials – Freedom) participovali pacienti, kteří byli minimálně 2 roky léčeni nilotinibem v první linii a dosáhli stabilní molekulární odpovědi MR4.5. Po následné dvanáctiměsíční konsolidaci nilotinibem mohli vstoupit do vysazovací fáze, opět pokud udrželi stabilní MR4.5. Z celkového počtu 215 pacientů jich léčbu přerušilo 190. Ve 48 týdnech od vysazení bylo v TFR 51,6 % pacientů, v 96 týdnech potom 48,9 % pacientů. Většina molekulárních rekurencí se objevila do 24 týdnů od vysazení. Pozdní relapsy se vyskytly v 54, 78, 92 a 120 týdnech od ukončení terapie [38]. U žádného pacienta nedošlo k progresi do AP nebo BC, ale u jednoho nemocného byla po ztrátě MMR detekována mutace F359V. Vzhledem k malému počtu kopií v předchozích vzorcích nelze zjistit, zda již mutace existovala před vysazením nilotinibu. Po opětovném zahájení terapie nilotinibem byla sice MMR obnovena, ale následně znovu ztracena a pacient byl vyřazen ze studie [39]. V průběhu studie zemřelo celkem 8 pacientů, všichni z jiných příčin než CML [38]. Studie ENESTop umožňovala vstoupit pacientům se stabilní MR4.5, kteří užívali nilotinib déle než 2 roky po předchozí terapii imatinibem. Tito pacienti následně užívali nilotinib po dobu dalšího roku, a pokud udrželi stabilní MR4.5, mohli vstoupit do vysazovací fáze. Ze 126 pacientů, kteří lék finálně vysadili, dosáhlo na TFR ve 48 týdnech 58 % a v 96 týdnech 53 %. Z 56 pacientů, kteří obnovili terapii nilotinibem, jich 55 znovu dosáhlo MMR nebo lepší odpovědi. U žádného pacienta nedošlo k progresi do AP ani BC [40]. Konsolidace nilotinibem byla také součástí studie STAT2 (Switch to Tasigna 2 trial). Celkem do ní vstoupilo 96 pacientů (50 prvotně léčeno imatinibem – podskupina 1, 40 nilotinibem po předchozí léčbě imatinibem – podskupina 2 a 6 pacientů vstupně užívalo jinou terapii – podskupina 3). Do fáze vysazení dospělo celkem 78 pacientů (40 v první, 33 ve druhé a 5 ve třetí podskupině). Molekulární rekurence byla definována jako ztráta MMR nebo konfirmovaná ztráta MR4.5. Ve 12 měsících od vysazení nilotinibu TFR dosáhlo 67,9 % pacientů (62,5 % v první a 69,7 % ve druhé podskupině). Podíl pacientů v TFR ve 2 a 3 letech od vysazení byl identický 62,8 %. K molekulární rekurenci došlo během prvních 6 měsíců u 25 pacientů, u zbývajících 4 pak mezi 16. a 20. měsícem od vysazení. U všech 29 pacientů byla obnovena terapie nilotinibem a MR4.5 promptně dosáhlo 25 z nich, zbývající 4 pacienti pak terapii nilotinibem v různém odstupu od jeho navrácení znovu přerušili. Důvody zahrnovaly pacientovo přání, exantém jako NÚ nilotinibu a narůstající hladinu BCR-ABL1 transkriptů. Nebyla zaznamenána žádná progrese do AP ani BC. V průběhu studie nezemřel žádný pacient [41]. Stěžejní údaje o jednotlivých studiích jsou shrnuty v tabulce 1.
Tab. 1. Přehled studií zaměřených na vysazení TKI 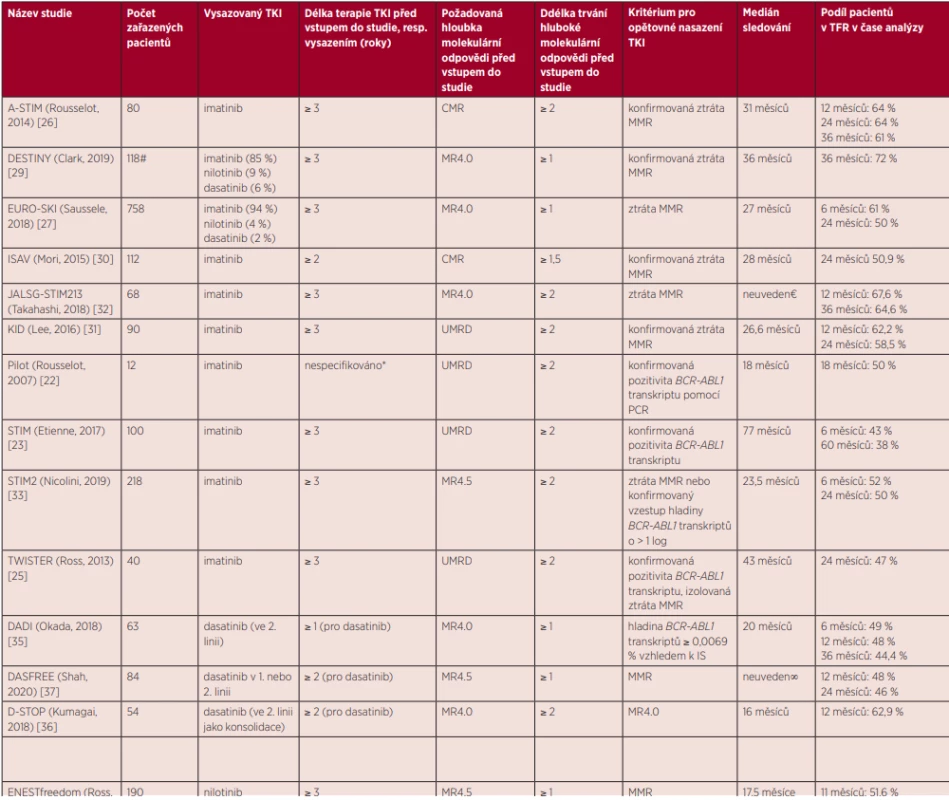

TKI – inhibitory tyrozinkinázy (tyrosine kinase inhibitors); CML – chronická myeloidní leukemie; UMRD – nedetekovatelná zbytková nemoc (undetectable residual disease); PCR – polymerázová řetězová reakce, (polymerase chain reaction); CMR – kompletní molekulární odpověď (complete molecular response); IS – mezinárodní škála (international scale MMR – major molecular response, velká molekulární odpověď, pokles hladiny BCR-ABL1 transkriptů ≤ 0,1 % vztaženo k IS; MR4.0 – pokles hladiny BCR-ABL1 transkriptů ≤ 0,01 % vztaženo k IS; MR4.5 – pokles hladiny BCR-ABL1 transkriptů ≤ 0,0032 % vztaženo k IS * 2 roky po dosažení UMRD
# celkem 174 pacientů, zbývající byli v MMR kohortě nebo se neúčastnili vysazovací fáze
€ všichni pacienti sledováni déle než 36 měsíců
¥ ve 2. linii po imatinibu
∞ všichni pacienti sledováni déle než 2 rokyVysazování TKI v klinické praxi
Vysazování TKI, ač bylo doposud soustředěno převážně do klinických studií, postupně nachází své místo i v běžné klinické praxi díky dostatečnému množství důkazů o jeho proveditelnosti a bezpečnosti. Možnost kontrolovaného vysazení je již zohledněna nejen v nových doporučeních ELN 2020 [17], ale také v amerických doporučeních NCCN (National Comprehensive Cancer Network) [57], doporučeních ESMO (European Society for Medical Oncology) [47], doporučeních francouzské pracovní skupiny French Chronic Myeloid Leukemia Study Group [58] a doporučeních některých expertů [59, 60]. Podmínky pro vysazení nilotinibu jsou také specifikovány přímo v SPC Tasigny (nilotinibu) [61]. Jednotlivá doporučení jsou souhrnně uvedena v tabulce 2. Byť se kritéria v jednotlivých zdrojích mírně rozcházejí, na délku předchozí terapie a udržení stabilní hluboké molekulární odpovědi je kladen důraz jako na nejzásadnější parametry pro úspěšné dosažení TFR.
Tab. 2. Kritéria pro výběr pacientů vhodných k vysazení TKI 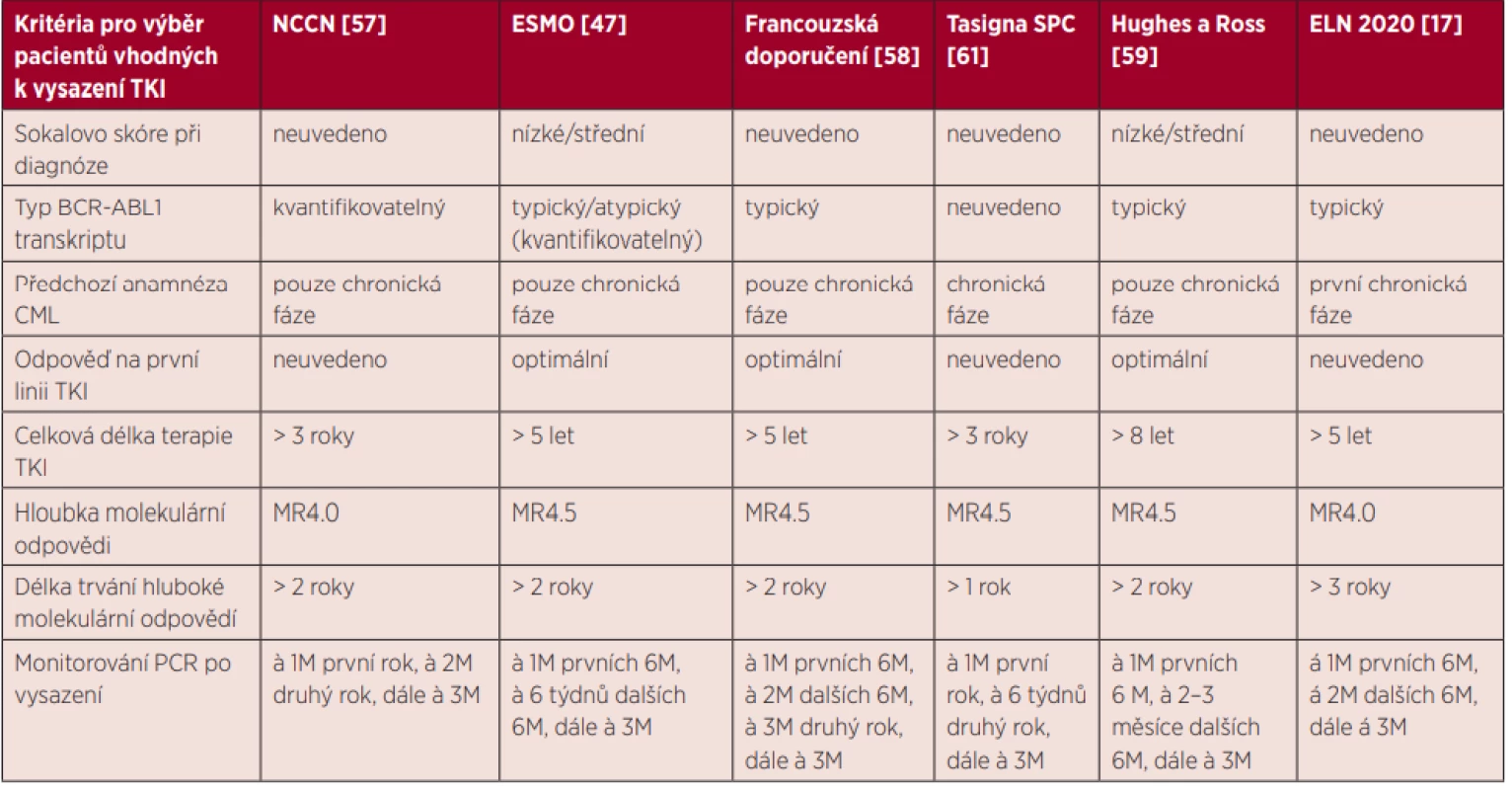
TFR – treatment-free remission, remise bez nutnosti terapie; NCCN – National Comprehensive Cancer Network; ESMO – European Society for Medical Oncology; ELN – Eropean Leukemia Net; CML – chronická myeloidní leukemie; TKI – tyrosine kinase inhibitors, inhibitory tyrozinkinázy; PCR – polymerase chain reaction, polymerázová řetězová reakce; MR4.0 – pokles hladiny BCR-ABL1 transkriptů ≤ 0,01 % vztaženo k IS; MR4.5 – pokles hladiny BCR-ABL1 transkriptů ≤ 0,0032 % vztaženo k IS V odborné literatuře nalezneme již i zprávy o vysazování TKI v rámci každodenní praxe. V retrospektivní analýze provedené v Japonsku byl imatinib vysazen u 50 pacientů z více než 3 200 imatinibem léčených. Ze 43 analyzovaných došlo k molekulární rekurenci u 19 pacientů (44 %). U žádného nedošlo ke ztrátě CHR ani CCyR. Terapie byla obnovena u 17 z nich s efektem dosažení nejméně MMR. Zbylí 2 pacienti zůstali nadále bez léčby s molekulární odpovědí blízko nebo na úrovni MMR. Přežití bez molekulární rekurence v 5 letech bylo odhadnuto na 47 % [42]. Recentní výsledky přináší celonárodní španělská studie, v rámci níž byly vysazovány všechny TKI v různých liniích léčby. Terapie byla přerušena celkem u 236 pacientů s mediánem sledování 21,5 měsíce. Kumulativní incidence molekulární rekurence byla 20 % v 6 měsících, 26 % v 1 roce a 33 % ve 3 letech. Nejpozdější ztráta MMR byla zaznamenána v 30. měsíci od přerušení terapie. Jeden pacient se vrátil k terapii TKI ve 44. měsíci od vysazení pro nárůst hladiny BCR-ABL1 transkriptů o ≥ 1 logaritmus ve 2 po sobě jdoucích vyšetřeních. Pravděpodobnost setrvání v TFR po 1 roce a po 4 letech od vysazení byla 72,5 %, resp. 64 %. Všichni pacienti udrželi CHR a u žádného nedošlo k progresi do AP nebo BC. Navíc se v této studii ukázalo, že po vysazení imatinibu došlo k signifikantnímu nárůstu hladiny hemoglobinu a cholesterolu. Nárůst hemoglobinu by mohl mít i klinický dopad vzhledem k tomu, že nejčastějším nežádoucím účinkem ovlivňujícím kvalitu života pacientů s CML je chronická únava. Naproti tomu vysazení nilotinibu nevedlo k žádným laboratorním změnám. Ostatní TKI byly vysazeny jen u malého počtu pacientů, a tedy k případným odchylkám se nelze vyjádřit [43]. Další práce reflektující každodenní praxi pochází od italských autorů a popisuje vysazení TKI u 293 pacientů. Imatinib užívalo 72 % z nich, ostatní byli léčeni TKI 2. generace. Ve 12 měsících dosáhlo TFR 69 % pacientů (68 % ve skupině pacientů užívajících imatinib, 73 % ve skupině pacientů užívajících TKI 2. generace). Nebyl žádný signifikantní rozdíl mezi pacienty na terapii imatinibem v 1. linii a pacienty, kteří užívali imatinib v dalších liniích. Stejně tak se neprokázal signifikantní rozdíl mezi pacienty s anamnézou rezistence na TKI a ostatními pacienty. Léčba byla obnovena celkem u 114 pacientů (39 %), a to v mediánu 6 měsíců od vysazení. Poslední ztráta TFR byla zaznamenána ve 105. měsíci od přerušení terapie. Žádná progrese do AP nebo BC nebyla pozorována a zemřelo celkem 9 pacientů, ale u žádného z nich nebyla shledána souvislost úmrtí s CML [44].
Faktory predisponující k úspěšnému vysazení TKI
Zdrojem pro molekulární rekurenci jsou leukemické kmenové buňky perzistující u pacientů s CML i po mnohaleté terapii imatinibem. Množství těchto buněk je o 1–2 logaritmy pod možností detekce běžně prováděných PCR vyšetření [62]. Jejich přetrvávání v kostní dřeni je způsobeno vnitřní rezistencí leukemických kmenových buněk vůči aktivitě TKI [63]. Přítomnost BCR-ABL1 fúzního genu byla prokázána u pacientů s CML po alogenní transplantaci a také u zdravých jedinců, neznamená tedy vždy aktivitu onemocnění [64, 65]. Důvody, proč se u některých pacientů podaří udržet remisi bez nutnosti terapie a u některých pacientů naopak dojde k molekulární rekurenci, nejsou stále přesvědčivě objasněny. Nicméně snaha o jejich odhalení hrála důležitou roli ve většině dříve zmíněných studií. Problematice predikce úspěšné TFR se věnovala již francouzská pilotní studie, kde ale vzhledem k malému počtu pacientů nebyl žádný faktor spojený se setrváním v TFR po vysazení imatinibu identifikován [21]. Nejčastěji analyzovanými faktory ve studiích byly: Sokalovo skóre v době diagnózy, věk v době diagnózy nebo v době vysazení, pohlaví, předchozí terapie INFα, předchozí rezistence na TKI nebo jejich nesnášenlivost, délka užívání TKI, čas k dosažení a délka trvání DMR, hladina BCR-ABL1 transkriptů měřená vysoce citlivými molekulárně biologickými vyšetřovacími metodami a počet T-lymfocytů a NK buněk v periferní krvi. Jako prediktivní faktory pro úspěšnou TFR byly s největším průnikem mezi jednotlivými studiemi pozorovány: délka předchozí terapie TKI [23, 26, 28, 30, 32, 36, 43, 44], délka setrvání v DMR před vysazením TKI [25, 31, 43] a negativní výsledek při využití senzitivnějších technik měření množství BCR-ABL1 transkriptů v době vysazení [28, 29, 31]. V řadě studií byl pozorován pozitivní význam předchozí terapie INFα [23–26, 29, 31, 33, 34, 37, 41, 43]. Ve vztahu k TFR se také slibně jeví průkaz vyššího počtu NK buněk a naopak nižšího počtu CD4+ T-lymfocytů a γδ+ lymfocytů (ve studii DADI hodnoceno v průběhu jednoleté preregistrační fáze, ve studii D-STOP v závěru dvouleté konsolidace dasatinibem) [34, 35]. I redukce dávky předcházející úplnému vysazení TKI se zdá být účinnější než náhlé odnětí léku, jak je vidět z výsledků studie DESTINY [28]. Ukázalo se také, že individuální dynamika hladin BCR-ABL1 transkriptů při snižování dávky TKI je slibným prediktorem pro molekulární rekurenci po vysazení TKI [66]. V některých studiích vysazujících TKI ve druhé linii léčby byla shledána rezistence na úvodní TKI faktorem častěji asociovaným s molekulární rekurencí po ukončení léčby [33, 34].
I po předchozí molekulární rekurenci po odnětí TKI je však možno docílit alespoň u některých pacientů opětovného nastolení setrvalé TFR. Do studie RE-STIM bylo zahrnuto celkem 60 pacientů užívajících jak imatinib, tak i TKI 2. generace pro molekulární rekurenci onemocnění po předchozím vysazení léčby. Ve 2. TFR bylo ve 12, 24 a 36 měsících od druhého vysazení 48 %, 42 % a 35 % pacientů. Nebyla zaznamenána žádná progrese do AP ani BC. Ukázalo se, že setrvání v TFR bylo signifikantně ovlivněno dynamikou hladiny BCR-ABL1 transkriptů po prvním vysazení TKI. Mezi pacienty, kteří setrvali v DMR po dobu 3 měsíců po prvním vysazení, jich v TFR ve 24 měsících po 2. vysazení setrvávalo 72 % v porovnání s 36 % z pacientů, kteří po prvním vysazení DMR ztratili již v průběhu 3 měsíců [45].
Negativní dopady vysazení TKI
Jako velmi zajímavý, i když ne zcela očekávaný jev provázející ukončení léčby TKI, se ukázal tzv. syndrom z vysazení. Projevuje se v prvních měsících po odnětí léku jako bolesti kloubů, kostí a svalů nebo exantém. Právě vzhledem k neočekávanosti výskytu takových symptomů jim nebyla v prvních vysazovacích studiích věnována dostatečná pozornost. Poprvé byl jev popsán v rámci subanalýzy studie EURO-SKI. Z 50 pacientů byly u 15 (30 %) pozorovány muskuloskeletální potíže, které se začaly objevovat v rozmezí 1–6 týdnů po vysazení imatinibu. Bolest byla lokalizována v různých částech těla: v ramenou, kyčlích i dalších kloubech horních a dolních končetin. Čtyři pacienti měli předchozí anamnézu kloubně-svalových potíží. Signifikantní laboratorní odchylky se u těchto pacientů neprokázaly. Přestože byly tyto příznaky stupně závažnosti 1–2 podle CTCAE, v případě stupně 2 již omezovaly pacienty v běžných denních aktivitách. U sedmi pacientů se syndrom z vysazení zvládl běžně dostupnými analgetiky, u pěti příznaky vyústily v podávání kortikosteroidů s efektem rychlé regrese potíží. U jednoho z nich se však po snížení dávky potíže vrátily. V tomto malém souboru pacientů nebyl rozdíl ve výskytu molekulární rekurence u pacientů se syndromem z vysazení v porovnání s pacienty bez něj [67]. Syndrom z vysazení byl následně analyzován i v dalších studiích, kde se vyskytoval u 10–40 % pacientů [27, 29–31, 36, 37, 39, 41, 43]. Mechanismus jeho vzniku není přesně objasněn, avšak zvažuje se podíl zvýšené aktivity tyrozinkináz c-kit a PDGFR, které jsou imatinibem také blokovány [68]. Imatinib vede přes tyto kinázy ke snížení počtu osteoklastů a naopak zvýšení počtu osteoblastů. Dlouhodobá terapie imatinibem tak ovlivňuje kostní metabolismus a vede ke zvýšení objemu kostí [68]. Na definitivní vysvětlení, jak a proč u některých pacientů tento syndrom vzniká, si budeme muset počkat do výsledků dalších analýz.
Dalším negativním dopadem vysazení TKI je riziko molekulární rekurence, a to zejména rekurence pozdní. Přestože nejčastěji dochází k molekulární rekurenci v prvních 6 měsících od odnětí léku, může k nárůstu BCR-ABL1 transkriptů dojít kdykoliv a byla pozorována rekurence i více než 8 let po ukončení terapie TKI [44]. Ještě daleko závažnější než rekurence molekulární, která je dobře zvládnutelná opětovným nasazením TKI, je návrat onemocnění na cytogenetické či hematologické úrovni nebo dokonce progrese do AP či BC. V odborné literatuře byly dosud popsány dva případy progrese do BC. Jeden se objevil ve studii A-STIM, byl zmíněn výše a jeho vztah k vysazení TKI je nejasný [25]. Druhým případem je recentně popsaný BC u 67leté pacientky. CML jí byla diagnostikována v roce 2006 a na terapii dasatinibem v první linii dosáhla MMR a následně i MR4.5, a to i přes pro výskyt pleurálních výpotků redukovanou dávku dasatinibu. Ten byl po více než pětiletém trvání DMR vysazen s následným pravidelným monitorováním molekulární odpovědi i kontrolami krevního obrazu. Za 16 měsíců však došlo k náhlé progresi do BC klinicky se projevujícím bolestmi břicha, nočním pocením, tvorbou hematomů a únavou. Vyšetření kostní dřeně prokázalo lymfoblastický zvrat CML. Pacientka byla zahrnuta do klinické studie a léčena blinatumomabem v kombinaci s ponatinibem a podle kontrolního vyšetření kostní dřeně v den 14 od zahájení léčby dosáhla CHR i MMR. U pacientky nic nenasvědčovalo progresi do BC při předchozích kontrolách ani při vysazení dasatinibu a důvody k rozvoji BC jsou stále nejasné [69]. Pro minimalizaci těchto rizik jsou pravidelné kontroly a molekulárně biologické monitorování nezbytné celoživotně i po přerušení terapie TKI.
Závěr
TKI již byly celosvětově vysazeny u více než 3 000 pacientů s CML ať už v četných klinických studiích nebo v každodenní praxi. Ukázalo se, že kontrolované vysazení TKI je možné, a to u pacientů užívajících jak imatinib, tak TKI 2. generace, a podaří se zhruba u 50 % pacientů se stabilní dlouhodobou DMR v případě prvního odnětí léku, resp. u 30 % v případě druhého pokusu o TFR. Nad tyto výsledky vyčnívají závěry studie DESTINY, která se od ostatních studií odlišuje i svým designem. Léčba TKI zde byla na rozdíl od ostatních studií ukončena až po předchozí dvanáctiměsíční redukci dávky léku na polovinu standardní dávky. Přesný mechanismus, jakým předchozí snížení dávky zvyšuje pravděpodobnost dosažení TFR, není znám, ale zvažuje se postupný vstup perzistujících leukemických kmenových buněk do buněčného cyklu či zlepšení protinádorové imunitní odpovědi organismu proti leukemickým buňkám [28]. Výbornými výsledky studie DESTINY se inspirovala i připravovaná česká celonárodní akademická studie HALF, registrovaná na stránkách ClinicalTrials.gov pod číslem NCT04147533. Vysazování TKI je v této studii koncipováno ještě sofistikovaněji přes dvoustupňovou redukci, kdy pacienti užívají prvních 6 měsíců polovinu standardní dávky a dalších 6 měsíců tutéž redukovanou dávku obden. Studie HALF mimo jiné těží i z kvalitní centralizované péče o pacienty s CML, která je v ČR soustředěna do 8 vysoce specializovaných hematoonkologických center.
Přestože prozatím neznáme patogenezi úspěšné TFR, otevírá vysazení TKI novou perspektivu pacientům s CML se stabilní DMR a možná v budoucnu i výsledky ambiciózní studie HALF přispějí k odhalení faktorů predisponujících k úspěšnému vysazení TKI.
Podíl autorů na přípravě rukopisu
PČ – příprava první verze rukopisu, úprava do finální verze
DŽ – korekce rukopisu, schválení finální verze
Čestné prohlášení
PČ prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. DŽ poskytla konzultační služby společnosti Angelini, přednášela na edukačním sympoziu společnosti Angelini a satelitním sympoziu společnosti Bristol-Myers Squibb a zúčastnila se odborné akce s podporou společnosti Bristol-Myers Squibb.
Poděkování
Práce byla realizována za podpory Grantu pro specifický výzkum LF MU pod grantovým číslem MUNI/A/1395/2019.
Do redakce doručeno dne 25. 3. 2020.
Přijato po recenzi dne 25. 5. 2020.
MUDr. Daniela Žáčková, Ph.D.
Interní hematologická a onkologická klinika
Fakultní nemocnice Brno
Jihlavská 340/20
625 00 Brno
e-mail: zackova.daniela@fnbrno.cz
Zdroje
1. Nowell PC, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science. 1960;142 : 1497.
2. Shtivelman E, Lifshitz B, Gale RP, Canaani E. Fused transccript of abl and bcr genes in chronic myelogenous leukaemia. Nature. 1985;315(8):550–554.
3. Kantarjian H, O´Brien S, Jabbour E, et al. Improved survival in chronic myeloid leukemia since the introduction of imatinib therapy: a single-institution historical experience. Blood. 2012;119(9):1981–1987.
4. Hochhaus A, Larson RA, Guilhot F, et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia. Engl J Med. 2017;379(10):917–927.
5. Bower H, Björkholm M, Dickman PW, et al. Life expectancy of patients with chronic myeloid leukemia approaches the life expectancy of the general population. J Clin Oncol. 2016;34(24):2851–2857.
6. Hochhaus A, Saglio G, Hughes TP, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. Leukemia. 2016;30(5):1044–1054.
7. Kantarjian HM, Giles F, Gattermann N, et al. Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome-positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood. 2007;110(10):3540–3546.
8. Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-year study results of DASISION: the dasatinib versus imatinib study in treat-ment-naïve chronic myeloid leukemia patients trial. J Clin Oncol. 2016;34(20):2333–2340.
9. Hochhaus A, Kantarjian HM, Baccarani M, et al. Dasatinib induces notable hematologic and cytogenetic response in chronic-phase chronic myeloid leukemia after failure of imatinib therapy. Blood. 2007;109(6):2303–2309.
10. Cortes JE, Gabacorti-Passerini C, Deininger MW, et al. Bosutinib versus imatinib for newly diagnosed chronic myeloid leukemia: results from the randomized BFORE trial. J Clin Oncol. 2018;36(3):231–239.
11. Cortes JE, Kantarjian HM, Brümmendorf TH, et al. Safety and efficacy of bosutinib (SKI-606) in chronic phase Philadelphia chromosome-positive chronic myeloid leukemia patients with resistance or intolerance to imatinib. Blood. 2011;118(17):4567–4576.
12. Cortes JE, Kim DW, Pinila-Ibraz J, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial. Blood. 2018;132(4):393–404.
13. Hoffman V, Baccarani M, Hasford J, et al. The EUTOS population-based registry: incidence and clinical characteristics of 2904 CML patients in 20 European countries. Leukemia. 2015;29(6):1136–1143.
14. Efficace F, Baccarani M, Breccia M, et al. Health-related quality of life in chronic myeloid leukemia patients receiving long-term therapy with imatinib compared with the general population. Blood. 2011;118(17):4554–4560.
15. Experts in chronic myeloid leukemia. The price of drugs for chronic myeloid leukemia (CML) is a reflection of the unsustainable prices of cancer drugs: from the perspective of a large group of CML experts. Blood. 2013;121(22):4439–4442.
16. Faber E, Indrák K. Vývoj léčby chronické myeloidní leukemie v posledních 25 letech. Transfuze Hematol Dnes. 2019;25(1):118–124.
17. Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020;34(4):966–984.
18. Mahon FX, Delbrel X, Cony-Makhoul P, et al. Follow-up of complete cytogenetic remission in patients with chronic myeloid leukemia after cessation of interferon alfa. J Clin Oncol. 2002;20(1):214–220.
19. Kantarjian HM, O´Brien S, Cortes JE, et al. Complete cytogenetic and molecular response to interferon-alpha-based therapy for chronic myelogenous leukemia are associated with excellent long-term prognosis. Cancer. 2003;97(4):1033–1041.
20. Faber E, Kuba A, Zapletalová J, et al. Operational cures after interferon-alpha in patients with chronic myeloid leukemia in Central and Northern Moravia. J Interferon Cytokine Res. 2012;32(5):230–234.
21. Rousselot P, Hughet F, Rea D, et al. Imatinib mesylate discontinuation in patients with chronic myelogenous leukemia in complete molecular remission for more than 2 years. Blood. 2007;109(1):58–60.
22. Mahon FX, Rea D, Guilhot J, et al. Discontinuation of imatinib in patients with chronic myeloid leukemia who have maintained complete molecular response: update results of the STIM study. Blood. 2011;118(21):603.
23. Etienne G, Guilhot J, Rea D, et al. Long-term follow-up of the french STop IMatinib (STIM1) study in patients with chronic myeloid leukemia. J Clin Oncol. 2017;35(3):298–305.
24. Ross DM, Branford S, Seymour JF, et al. Safety and efficacy of imatinib cessation for CML patients with stable undetectable minimal residual disease: results from the TWISTER study. Blood. 2013;122(4):515–522.
25. Rouselot P, Charbonnier A, Cony-Makhoul P, et al. Loss of major molecular response as a trigger for restarting tyrosine kinase inhibitor therapy in patients with chronic-phase chronic myelogenous leukemia who have stopped imatinib after durable undetectable disease. J Clin Oncol. 2014;32(5):424–430.
26. Saussele S, Richter J, Guilhot J, et al. Discontinuation of tyrosine kinase inhibitor therapy in chronic myeloid leukaemia (EURO-SKI): a prespecified interim analysis of a prospective, multicentre, non-randomised, trial. Lancet Oncol. 2018;19(6):747–757.
27. Clark RE, Polydoros F, Apperley JF, et al. De-escalation of tyrosine kinase inhibitor dose in patients with chronic myeloid leukaemia with stable major molecular response (DESTINY): an interim analysis of a non-randomised, phase 2 trial. Lancet Haematol. 2017;4(7):e310–e316.
28. Clark R, Polydoros F, Apperley J, et al. De-escalation of tyrosine kinase inhibitor therapy before complete treatment discontinuation in patients with chronic myeloid leukaemia (DESTINY): a non-randomised, phase 2 trial. Lancet Haematol. 2019;6(7):e375–e383.
29. Mori S, le Coutre P, Abruzzese E, et al. Imatinib Suspension and Validation (ISAV) study: reults at 24 months. Blood. 2015;126(23):2775.
30. Lee SE, Choi SY, Song HY, et al. Imatinib withdrawal syndrome and longer duration of imatinib have a close association with a lower molecular relapse after treatment discontinuation: the KID study. Haematologica. 2016;101(6):717–723.
31. Takahashi N, Tauchi T, Kitamura K, et al. Deeper molecular response is a predictive factor for treatment-free remission after imatinib discontinuation in patients with chronic phase chronic myeloid leukemia: the JALSG-STIM213 study. Int J Hematol. 2018;107(2):185–193.
32. Nicolini FE, Dulucq S, Boureau L, et al. Evaluation of residual disease and TKI duration are critical predictive factors for molecular recur-rence after stopping imatinib first-line in chronic phase CML patients. Clin Cancer Res. 2019;25(22):6606–6613.
33. Rea D, Nicolini FE, Tuliez M, et al. Discontinuation of dasatinib or nilotinib in chronic myeloid leukemia: interim analysis of the STOP 2G-TKI study. Blood. 2017;129(7):846–854.
34. Okada M, Imagava J, Tanaka H. Final 3-year results of the dasatinib discontinuation trial in patients with chronic myeloid leukemia who received dasatinib as a second-line treatment. Clin Lymphoma Myeloma Leuk. 2018;18(5):353–360.
35. Kumagai T, Nakaseko Ch, Nishiwaki K, et al. Dasatinib cessation after deep molecular response exceeding 2 years and natural killer cells transition during dasatinib consolidation. Cancer Sci. 2018;109(1):182–192.
36. Shah NP, García-Gutiérrez V, Jiménez-Velasco A, et al. Dasatinib discontinuation in patients with chronic-phase chronic myeloid leukemia and stable deep molecular response: the DASFREE study. Leuk Lymphoma. 2020;61(3):650–659.
37. Nagafuji K, Matsumura I, Shimose T, et al. Cessation of nilotinib in patients with chronic myelogenous leukemia who have maintained deep molecular responses for 2 years: a multicenter phase 2 trial, stop nilotinib (NILSt). Int J Hematol. 2019;110(6):675–682.
8. Ross DM, Masszi T, Gómez Casares MT, et al. Durable treatment-free remission in patients with chronic myeloid leukemia in chronic phase following frontline nilotinib: 96 weeks update of the ENESTfreedom. J Cancer Res Clin Oncol. 2018;144(5):945–954.
39. Hochhaus A, Masszi T, Giles FJ, et al. Treatment-free remission fol-lowing frontline nilotinib in patients with chronic myeloid leukemia in chronic phase: results from the ENESTfredom study. Leukemia. 2017;31 : 1525–1531.
40. Mahon FX, Boquimpani C, Kim DW, et al. Treatment-free remision after second-line nilotinib treatment in patients with chronic myeloid leukemia in chronic phase: results from a single-group, phase 2, open-label study. Ann Intern Med. 2018;168(7):461–470.
41. Takahashi N, Nishiwaki K, Nakaseko Ch, et al. Treatment-free remission after two-year consolidation therapy with nilotinib in patients with chronic myeloid leukemia: STAT2 trial in Japan. Haematologica. 2018;103(11):1835–1842.
42. Takahashi N, Kyo T, Maeda Y, et al. Discontinuation of imatinib in Japanese patients with chronic myeloid leukemia. Haematologica. 2012;97(6):903–906.
43. Hernández-Boluda JC, Pereire A, Pastor-Galán I, et al. Feasibility of treatment discontinuation in chronic myeloid leukemia in clinical practice: results from nationwide series of 236 patients. Blood Cancer J. 2018;8(10):91–98.
44. Fava C, Rege-Cambrin G, Dogliotti I, et al. Observational study of chronic myeloid leukemia Italian patients who discontinued tyrosine kinase inhibitors in clinical practice. Heaematologica. 2019;104(8):1589–1596.
45. Legros L, Nicolini FE, Etienne G, et al. Second tyrosine kinase inhibitor discontinuation attempt in patients with chronic myeloid leukemia. Cancer. 2017;123(22):4403–4410.
46. Šrámek J, Karas M, Lysák D, Jindra P. Možnost ukončení terapie tyrozin-kinázovými inhibitory u nemocných s chronickou myeloidní leukemií a koncept „treatment-free remission“. Transfuze Hematol Dnes. 2017;23(4):192–198.
47. Hochhaus A, Saussele S, Rosti G, et al. Chronic myeloid leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl_4):iv41–iv51.
48. Ibrahim AR, Eliasson L, Apperley JF, et al. Poor adherence is the main reason for loss of CCyR and imatinib failure for CML patients on long term therapy. Blood. 2011;117(14):3733–3736.
49. Efficace F, Baccarani M, Breccia M, et al. Chronic fatigue is the most important factor limiting health-related quality of life of chronic myeloid leukemia patients treated with imatinib. Leukemia. 2013;27(7):1511–1519.
50. Apperley J. CML in pregnancy and childhood. Best Pract Res Clin Haematol. 2009;22(3):455–474.
51. Saussele S, Richter J, Hochhaus, Mahon FX. The concept of treat-ment-free remission in chronic myeloid leukemia. Leukemia. 2016;30(8):1638–1647.
52. Goldberg S, Hamarman S. Patient with chronic myelogenous leukemia may not want to discontinue tyrosine kinase inhibitor therapy. Blood. 2015;126(23):1584.
53. Breccia M, Efficace F, Sica S, et al. Adherence and future discontinuation of tyrosine kinase inhibitors in chronic phase chronic myeloid leukemia. A patient-basedsurvey on 1133 patients. Leuk Res. 2015;39(10):1055–1059.
54. Jiang Q, Liu ZCh, Zhang SX, Li J. Age and cost are associated with patient preference for stopping tyrosine kinase inhibitor therapy in chronic myeloid leukemia. Blood. 2015;26(23):1585.
55. Cortes J, O´Brien S, Kantarjian H. Discontinuation of imatinib therapy afterachieving a molecular response. Blood. 2004;104(7):2204–2205.
56. Mauro MJ, Druker BJ, Maziarz RT. Divergent clinical outcome in two CML patients who discontinued imatinib therapy after achieving a molecular remission. Leuk Res. 2004;28 Suppl 1:S71–S73.
57. NCCN Practice Guidelines in Oncology (NCCN Guidelines) Chronic myeloid leukemia Version 2 2020 – September 25, 2019. National comprehensive cancer network [online] [poslední revize 25.9.2019; citováno dne 25.9.2019]. Dostupné na http://www.nccn.org.
58. Rea D, Ame S, Berger M, et al. Discontinuation of tyrosine kinase inhibitors in chronic myeloid leukemia: recommendations for clinical practice from the french chronic myeloid leukemia study group. Cancer. 2018;124(14):2956–2963.
59. Hughes TP, Ross DM. Moving treatment-free remission into mainstream clinical practise in CML. Blood. 2016;128(1):17–23.
60. Baccarani M, Aruzzesse E, Accurso V, et al. Managing chronic myeloid leukemia for treatment-free remission: a proposal from GINEMA CML WP. Blood Adv. 2019;3(24):4280–4290.
61. European medicines agency. European union agencies network, [online] [poslední revize 6.5.2019; citováno dne 12.11.2019]. Dostupné na https://www.ema.europa.eu/.
62. Ross MD, Branford S, Seymour JF, et al. Patients with chronic myeloid leukemia who maintain a complete molecular response after stopping imatinib treatment have evidence of persistant leukemia by DNA PCR. Leukemia. 2010;24(10):1719–1724.
63. Corbin AS, Agarwal A, Loriaux M, et al. Human chronic myeloid leukemia stem cells are insensitive to imatinib despite inhibition of BCR-ABL activity. J Clin Invest. 2011;121(1):396–409.
64. Kaeda J, O´Shea D, Szydlo RM, et al. Serial measurement of BCR-ABL transcripts in the peripheral blood after allogeneic stem cell transplantation for chronic myeloid leukemia: an attempt to define patients who may not require further therapy. Blood. 2006;107(10):4171–4176.
65. Bose S, Deininger M, Gora-Tybor J, et al. The presence of typical and atypical BCR-ABL fusion genes in leukocytes of normal individuals: biologic significance and implications for the assessment of minimal residual disease. Blood. 1998;92(9):3362–3367.
66. Gottschalk A, Glauche I, Cicconi S, et al. Molecular monitoring during dose reduction predictsrecurrence after TKI cessation in CML. Blood. 2020;135(10):766–769.
67. Richter J, Söderlund S, Lübking A, et al. Musculosceletal pain in patients with chronic myeloid leukemia after discontinuation of imatinib: atyrosine kinase inhibitor withdrawal syndrome? J Clin Oncol. 2014;32(25):2821–2823.
68. Vandyke K, Fitter S, Dewar AL, et al. Dysregulation of bone remodeling by imatinib mesylate. Blood. 2010;115(4):766–774.
69. Alfayez M, Carpentier GR, Jabbour E, et al. Sudden blastic transformation in treatment-free remission chronic myeloid leukaemia. Br J Haematol. 2019;187(4):543–545.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Léčba Erdheimovy-Chesterovy choroby
- Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi
- Cílený rozklad obtížně inhibovatelných proteinů způsobujících maligní hematologická onemocnění pomocí dvoufunkčních molekul využívajících polyubikvitinaci a rozklad v proteazomech
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností
- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Dědičná trombocytopenie na podkladě patogenní varianty genu MYH9 diagnostikovaná u dospělé ženy
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Dopisy redakci
- Dopisy redakci
- Za pani profesorkou MUDr. Adrienou Sakalovou, DrSc.
- Zemřela MUDr. Zdeňka Vorlová, CSc.
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Léčba Erdheimovy-Chesterovy choroby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



