-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností
Necrobiotic xanthogranuloma associated with monoclonal gammopathy: case report and overview of therapeutic options
Necrobiotic xanthogranuloma is an uncommon non-Langerhans cell histiocytosis involving skin and extra cutaneous tissues. Necrobiotic xanthogranuloma is most frequently associated with MGUS, myeloma and may also occur in other lymphoproliferative disorders. Its pathogenesis remains unclear. Necrobiotic xanthogranuloma is usually a chronic and slowly progressive disease. Several treatments have been proposed and have yielded variable results. The aim of this case report and systematic review is to summarize all reported treatments of necrobiotic xanthogranuloma of the skin, with or without underlying malignant conditions. Treatment options include corticosteroids, thalidomide, high-dose intravenous immunoglobulins (IVIG), chlorambucil, cyclophosphamide, fludarabine, rituximab, melphalan, infliximab, cladribine, laser therapy, radiotherapy and other possibilities. The treatment options are at most only partially effective; the best response is achieved with IVIG therapy. In our case, treatment with cyclophosphamide, dexamethasone and bortesomib did not lead to any significant response. We then used IVIG and electron beam irradiation achieving a partial response and stabilization of this rare disease..
Keywords:
necrobiotic xanthogranuloma
Autoři: Z. Král 1; M. Krejčí 1; J. Kynclová 2; Z. Řehák 3; R. Koukalová 3; Š. Skorkovská 4; L. Pour 1; Z. Adam 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Patologický ústav LF MU a FN BRNO 2; Oddělení nukleární medicíny, MOU Brno 3; Oční klinika NeoVize Brno 4
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 4, p. 310-319.
Kategorie: Kazuistika
Souhrn
Nekrobiotický xantogranulom je vzácná „non-Langerhans cell“ histiocytóza postihující kůži, ale i další tkáně. Nekrobiotický xantogranulom je nejčastěji asociován s monoklonální gamapatií (MGUS), případně s mnohočetným myelomem, může se též vyskytnout u dalších lymfoproliferativních chorob. Etiopatogeneze není známa. Morfy nekrobiotického xantogranulomu obvykle v průběhu času pomalu progredují. V terapii byly popsány četné léčebné postupy: alkylační cytostatika, kortikoidy, imidy, antimetabolity, kladribin, rituximab, infliximab, radioterapie a další. S výjimkou léčby nitrožilními imunoglobuliny (IVIG), kdy se léčebná odpověď dostavila u většiny pacientů, bylo léčebných odpovědí v případě jiných alternativ dosaženo pouze u části popsaných případů. Námi popsaný pacient byl léčen kombinací cyklofosfamidu, dexametazonu a bortezomibu, tato léčba neovlivnila ani koncentraci monoklonálního imunoglobulinu, ani kožní morfy. Pro další léčbu jsme zvolili IVIG a následně ozáření svazkem elektronů, u pacienta došlo k parciální remisi a stabilizaci onemocnění.
Klíčová slova:
nekrobiotický xantogranulom
Úvod
Xantom je specifické označení pro žlutou či oranžovo-žlutavou kožní plochu, obvykle mírně vyvýšenou nad kožní povrch, s ostrou hranicí oproti nepoškozené pokožce. Xantomy postihují nejčastěji oblasti očních víček, ale také flexorové části končetin a trupu. Mohou být průvodním znakem hyperlipoproteinemie, ale existují také normolipemické formy. Xantogranulom je označení pro žlutou či žlutooranžovou tkáň, která tvoří kožní uzlíky (granulomy) a může výjimečně i ulcerovat (nekrobiotický xantogranulom). V histopatologickém obraze plochých xantomů dominují makrofágy (histiocyty) naplněné tukovými kapénkami, kromě pěnitých histiocytů s tukovými inkluzemi jsou obvykle přítomny také zánětlivé buňky (lymfocyty, plazmocyty) a obrovské mnohojaderné Toutonovy buňky, někdy i krystaly cholesterolu a v případě nekrobiotického xantogranulomu i mapovité oblasti nekrobiózy kolagenu [1, 2]. V rámci skupiny xantomatózních a xantogranulomatózních nemocí se v literatuře nejčastěji uvádějí následující jednotky:
V dospělosti vzniklý periokulární xantogranulom bez průkazu další choroby.
V dospělosti vzniklý periokulární xantogranulom spojený s imunitní dysfunkcí typu astmatu. Je charakterizovaný současným výskytem obou těchto projevů.
V dospělosti vzniklý nekrobiotický xantogranulom – morfologicky je podobný jako výše uvedené jednotky, ale je provázený dalšími patologickými projevy – nejčastěji přítomností monoklonální gamapatie typu IgG kappa, nebo přítomností jiné lymfoproliferace.
Juvenilní xantogranulom – postihuje většinou mladé jedince, výjimečně i dospělé. Tato nemoc má jak kožní, tak i mimokožní projevy.
Erdheimova-Chesterova choroba: obvykle se systémovým postižením, typicky v 60 % případů, včetně postižení CNS.
Společnými histopatologickými rysy této skupiny onemocnění jsou: proliferace, akumulace a tvorba ložisek sestávajících z pěnitých histiocytů a obrovských Toutonových buněk. Jde o histiocyty, které obsahují fagocytované lipidy, a proto při klasickém barvení tvoří struktury, kterým se říká pěnité buňky (foamy cells); zánětlivé a fibrotické projevy v okolí patologických ložisek, občas i nekrotické.
Tyto dva znaky jsou společné, ale jinak se jednotlivé případy proliferace fagocytujících histiocytů liší mírou agresivity, místem výskytu a přítomností či nepřítomností klinických projevů. Jejich spektrum obsahuje velmi odlišné formy, od klinicky nezatěžujících kožních ložisek charakteru papul, přes infiltráty v měkkých tkáních až po vícečetné infiltráty některých orgánů hlavně u mladých pacientů, které již způsobují klinické příznaky. V některých případech se jedná o formy generalizované, postihující, podobně jako histiocytóza z Langerhansových buněk, centrální nervový systém (CNS), a to především hypotalamus a hypofýzu.
Rozdíly v uvedených jednotkách jsou spíše ve formě klinické manifestace než v morfologii. Možná proto se tyto názvy neodrazily ve WHO klasifikaci krevních (tedy i histiocytárních) nemocí, která uvádí pouze jednotku diseminovaný juvenilní xantogranulom a pod tento termín shrnuje jako synonyma další jednotky, které mají podobný morfologický vzhled (v typických případech pěnité histiocyty s tukovými inkluzemi). V některých případech byla prokazatelná klonalita histiocytů, v jiných ne [3, 4]. Oproti této sjednocující nomenklatuře WHO klasifikace krevních nemocí je terminologie dermatologické odborné literatury velmi pestrá (xantogranulom, eruptivní xantogranulom, nekrobiotický xantogranulom, xanthoma disseminatum, papulární xantom, generalizovaný eruptivní histiocytom, progresivní nodulární histiocytom, benigní cefalická histiocytóza nebo eruptivní histiocytóza), což jistě souvisí se vzácností těchto onemocnění. Z hlediska výskytu solitárních ložisek u dospělých převládají nejčastěji kožní ložiska kolem očí, jak ilustrujeme obrázky víček jedné naší pacientky s xantogranulomem (obr. 1 a 2). Zajímavé je, že často se popisují současně s výskytem periokulárních xantogranulomů další nemoci, které signalizují dysfunkci imunitního systému, z autoimunitních chorob je to astma a z lymfoproliferativních chorob je to například monoklonální gamapatie nejistého významu (MGUS) nebo mnohočetný myelom [5].
Obr. 1. Xantogranulom v oblasti víček 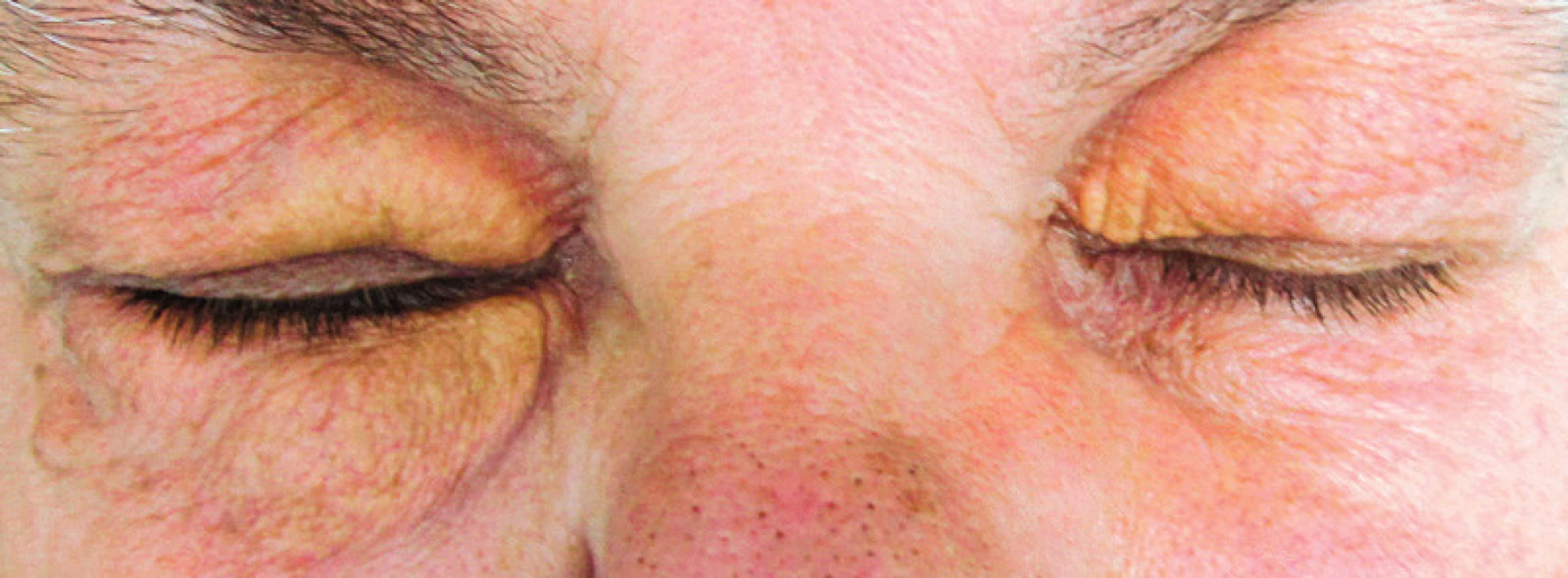
Obr. 2. Xantogranulom v oblasti víček 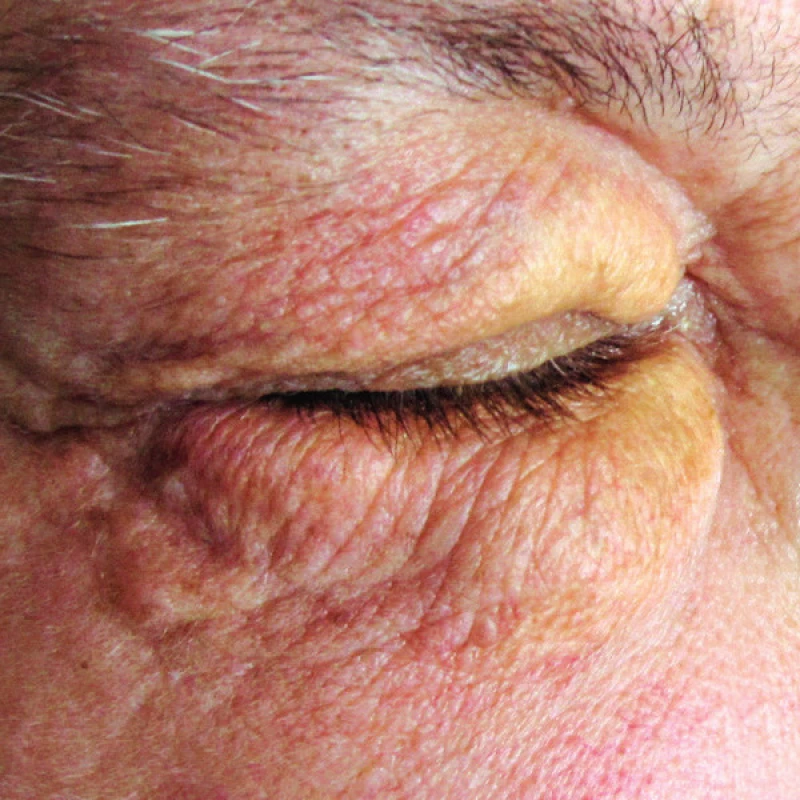
Popis pacienta s nekrobiotickým xantogranulomem a monoklonální gamapatií
Muž, narozený v roce 1951, přišel poprvé v roce 2006 na naši hematoonkologickou ambulanci pro nález již několik let trvající difuzní plošné normolipemické xantomatózy, současně byla u něho zjištěna monoklonální gamapatie typu IgG kappa. Žluté vystupující xantomatózní plochy postihovaly víčka, krk, flexorové části končetin, laterární stěnu trupu, jak ilustrují obrázky 3–5. Lipidy, tedy cholesterol i triglyceridy, byly zcela v mezích fyziologických hodnot. Z ložiska xantomu byla odebrána histologie. Vzorek byl v roce 2006 hodnocen na dvou pracovištích s následujícím výsledkem: „část kůže s normálně utvářenou epidermis, v dermis byly mezi kolagenními pentlicemi především perivaskulárně lokalizované pěnité histiocytární elementy“. Histologický nález tedy odpovídal plochému xantomu. Po průkazu monoklonálního imunoglobulinu (MIg) byl histopatologický nález později přehodnocen na nekrobiotický xantogranulom, tedy jednotku, pro kterou jsou typická ložiska pěnitých buněk typu xantogranulomu a dále přítomnost MIg typu IgG kappa. Pacient vstupně v roce 2006 kromě kožních nálezů neměl žádné další zásadní zdravotní obtíže, neměl teploty ani váhový úbytek, parametry krevního obrazu a výsledky základních laboratorních biochemických vyšetření byly v normě, u pacienta nebyly vstupně přítomny žádné další komorbidity či komplikující interní onemocnění.
Obr. 3. Žluté zbarvení kůže na trupu: podkladem této barevné morfy je xantogranulom popsaného pacienta 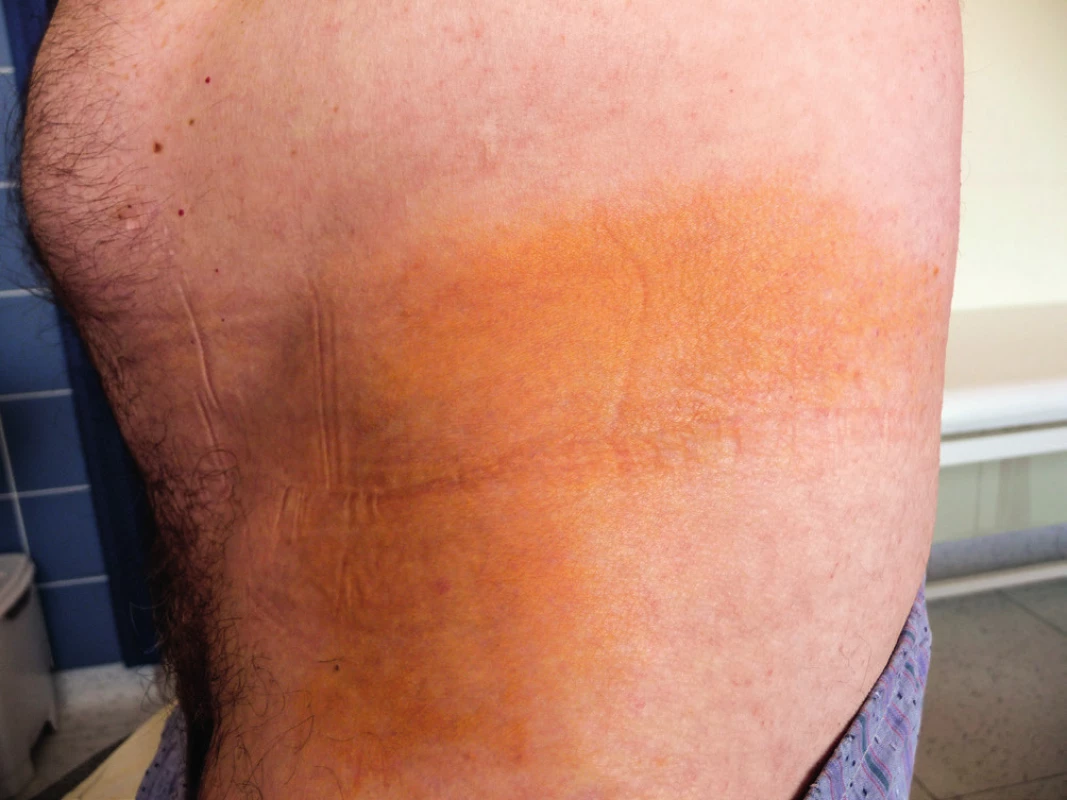
Obr. 4. Žluté zbarvení kůže v zadní řase axily na podkladě xantogranulomu 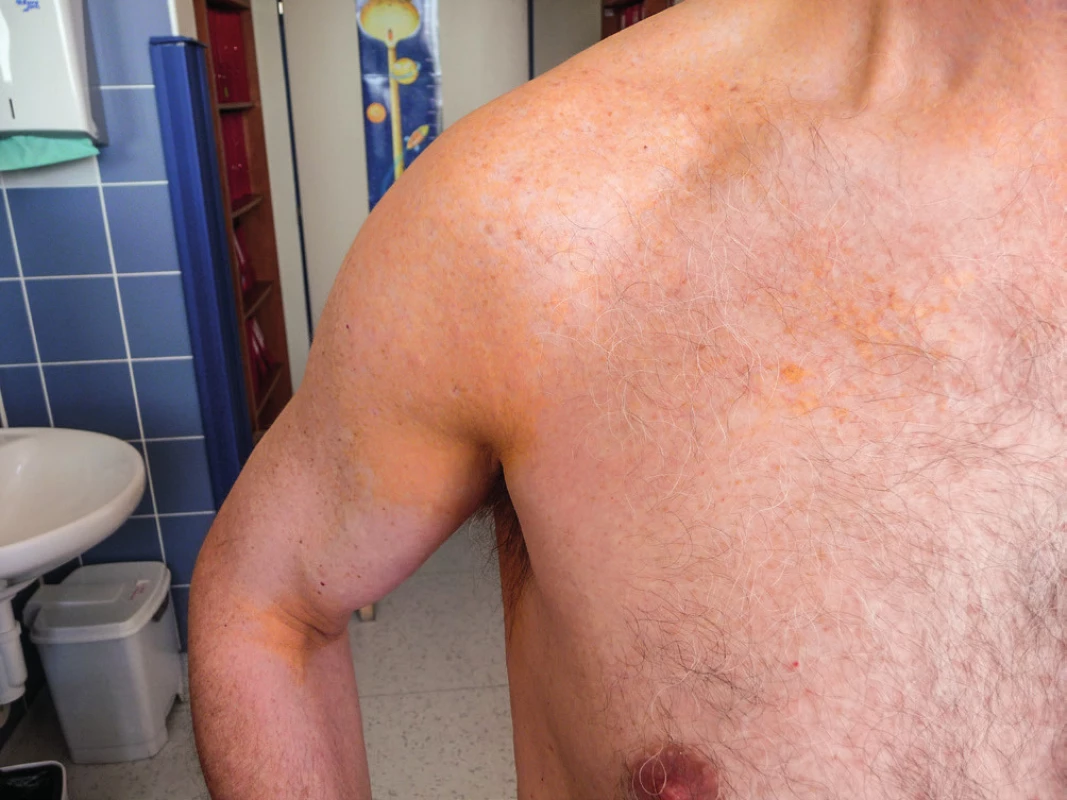
Obr. 5. Žluté zbarvení kůže v oblasti ramene na podkladě xantogranulomu 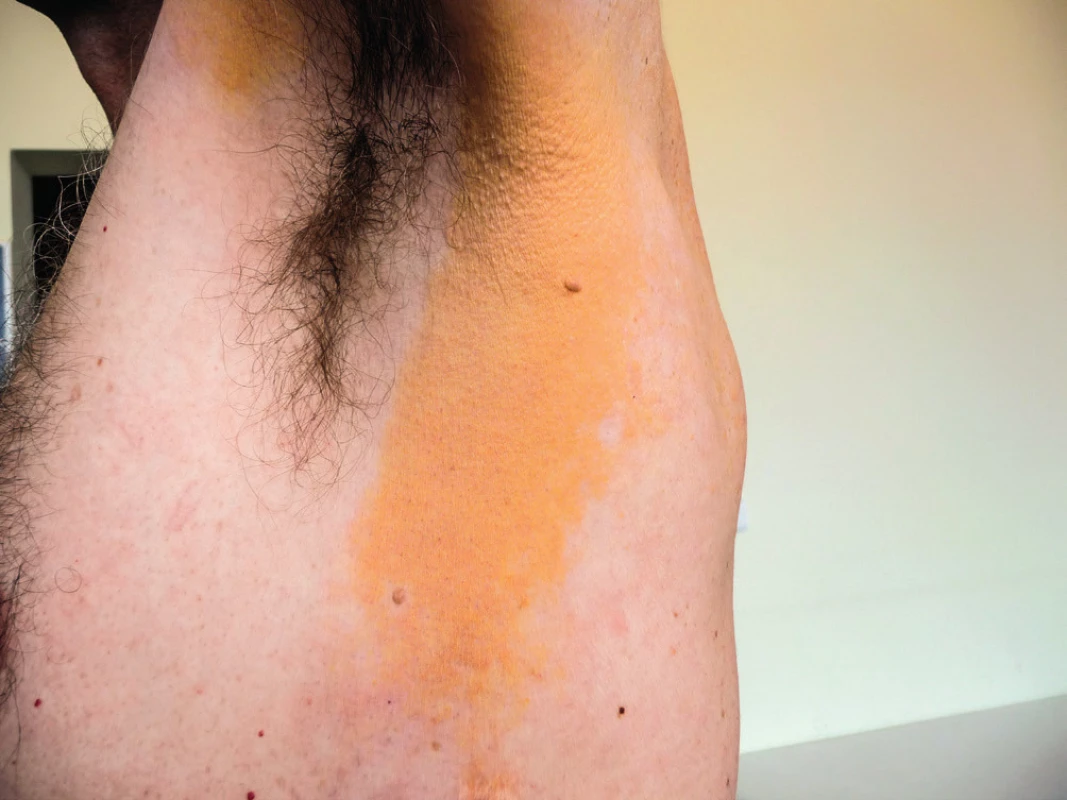
Vstupní koncentrace MIg typu IgG kappa v séru v roce 2006 byla 11,2 g/l. Při histologickém hodnocení válečku kostní dřeně (trepanobiopsie) bylo zjištěno jen mírné zvýšení počtu plazmocytů na 5–9 % ze všech jaderných elementů. Pole barvení lambda a kappa řetězců v plazmocytech se jednalo o klonální plazmocelulární populaci. V rámci standardního postupu při diferenciálně diagnostickém vyšetření monoklonální gamapatie bylo provedeno rentgenové vyšetření skeletu, které neprokázalo osteolytická ložiska. Kostní denzitometrie neprokázala osteoporózu. Dále bylo provedeno PET/CT vyšetření (pozitronová emisní tomografie spolu s počítačovou tomografií) s průkazem zvýšené akumulace radioaktivně značené glukózy ve 4 lymfatických uzlinách parakaválně. Jejich velikost byla stanovena na 23 mm. Klasické sérologické vyšetření neprokázalo žádnou infekci, nebyla zjištěna ani sarkoidóza. K vyloučení možného lymfoproliferativního onemocnění byla v prosinci 2006 provedena probatorní laparotomie a odběr uzlin na histologii. Při prvním čtení nebyla v morfologickém obraze prokázána malignita. Podle histopatologického vyšetření folikulární struktura lymfatické uzliny byla zachována, ale převážně v interfolikulárních prostorech a také na obvodu folikulů byly přítomny četné nevelké nekazeifikující granulomy z epiteloidních buněk. Plazmatické buňky byly přítomny v obvyklé lokalizaci a kvantitě a byly polyklonální. Speciální barvení na acidorezistentní tyčinky, plísně i bakterie bylo negativní. Infekční etiologie tedy nebyla potvrzena. Při kontrolních zobrazovacích vyšetřeních v průběhu následujících let tato izolovaná retroperitoneální lymfadenopatie zůstávala stabilní a stacionární. V roce 2014 jsme požádali o druhé vyšetření vzorků zvětšených lymfatických uzlin získaných při laparotomii v roce 2006, tedy před 8 lety. Bylo vysloveno podezření na Hodgkinův lymfom s lymfocytární predominancí, ale nález nebyl zcela jednoznačný.
Proto bylo v následujících letech toto lokalizované uzlinové postižení sledováno pomocí PET/CT zobrazení. Z pohledu roku 2020 je zvětšení uzlin nadále stacionární, od roku 2006 do roku 2020 nedošlo k zásadní změně či progresi této retroperitoneální lymfadenopatie. Proto nebyla provedena další laparotomie k potvrzení či vyloučení diagnózy Hodgkinova lymfomu.
Vzhledem k progresivně se zvětšujícím plochám xantomů, které nemocného obtěžovaly stálým svěděním a pocitem napětí až bolestivosti v postižených oblastech, a vzhledem ke spekulacím v odborné literatuře o souvislosti mezi monoklonální gamapatií a kožním postižením typu plochých xantomů či xantogranulomů, jsme v březnu 2009 provedli další trepanobiopsii. Zde bylo popsáno místy 10 % plazmocytů, exprimujících lehké řetězce kappa, čili 10 % klonálních plazmocytů. Oproti první trepanobiopsii tedy nepatrné navýšení počtu plazmocytů, ale již byl naplněn počet potřebný pro diagnózu asymptomatického mnohočetného myelomu. Koncentrace MIg IgG kappa v roce 2009 byla 11,7 g/l, tedy stacionární. Proto jsme v roce 2009 podali chemoterapii ve standardním složení cyklofosfamid, bortezomib, dexametazon s cílem potlačit proliferaci plazmocytů a s ní podle literatury velmi pravděpodobně související kožní projevy nekrobiotického xantogranulomu. Byly podány celkem 4 cykly, v dalším podávání nebylo pokračováno, protože v průběhu 4 měsíců nedošlo ani k signifikantní změně koncentrace MIg, ani ke změně kožních xantogranulomových ploch, nebylo dosaženo léčebné odpovědi.
Vzhledem k neúspěchu této léčby jsme pacienta dále jen sledovali, pacient sám si další terapii nepřál. V roce 2020 je koncentrace MIg v séru prakticky stejná jako v roce 2006 a kolísá v úzkém rozmezí 10–11 g/l, nedošlo tedy v průběhu 14 let k signifikantnímu nárůstu MIg. Hladiny cholesterolu a triglyceridů byly opakovaně v normě, u pacienta přetrvává prakticky stacionární mírná retroperitoneální lymfadenopatie, klinicky asymptomatická.
Ale morfy nekrobiotického xantogranulomu se v průběhu času sice pomalu, ale neustále rozšiřovaly a to jak na trupu, tak na horních končetinách.
V posledních dvou letech (2019–2020) si pacient začal nově stěžovat na tlakové bolesti v oblasti lýtek. Palpačně zde byla hmatná podkožní indurace v místech, kde podle PET/CT zobrazení je zvýšená aktivita. Pro tyto tlakové nepříjemné bolesti v oblasti lýtek v místě kožních a podkožních infiltrátů při diagnóze xantogranulomu již pacient chtěl léčbu s nadějí na ústup těchto potíží.
Vývoj těchto patologických ložisek v oblasti lýtek ilustruje obrázek 6 (nález při PET/CT zobrazení z roku 2017). Další vývoj nálezu xantogranulomu v oblasti lýtek u tohoto pacienta při různých formách PET/CT zobrazení z roku 2019 ilustrují obrázky 7–9. Koncem roku 2019 byla provedena biopsie ložiska na lýtku a histologicky byl potvrzen opět nekrobiotický xantogranulom (obr. 10).
Obr. 6. PET/CT zobrazení dolních končetin s vyznačeným xantogranulomem z roku 2017 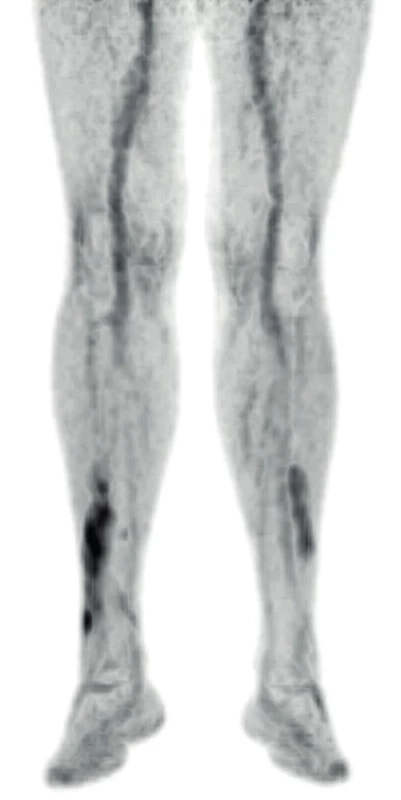
Obr. 7. PET/CT zobrazení dolních končetin pacienta s xantogranulomem z roku 2019 – část 1 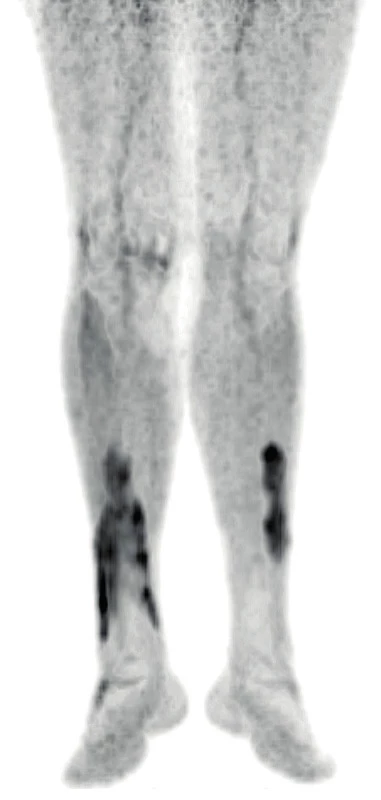
Obr. 8. PET/CT zobrazení dolních končetin pacienta s xantogranulomem z roku 2019 – část 2 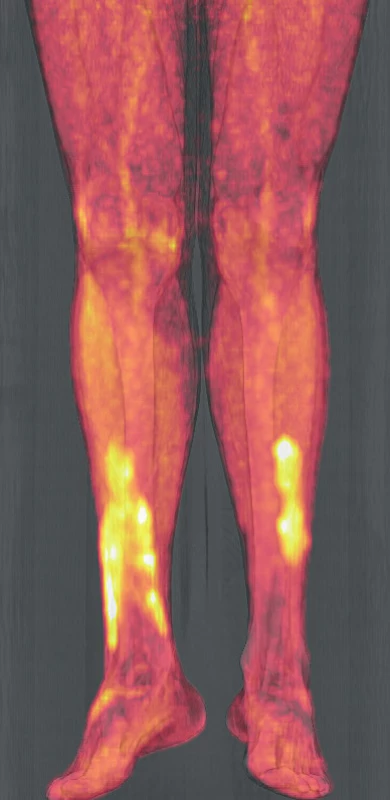
Obr. 9. PET/CT zobrazení dolních končetin pacienta s xantogranulomem z roku 2019 – část 3 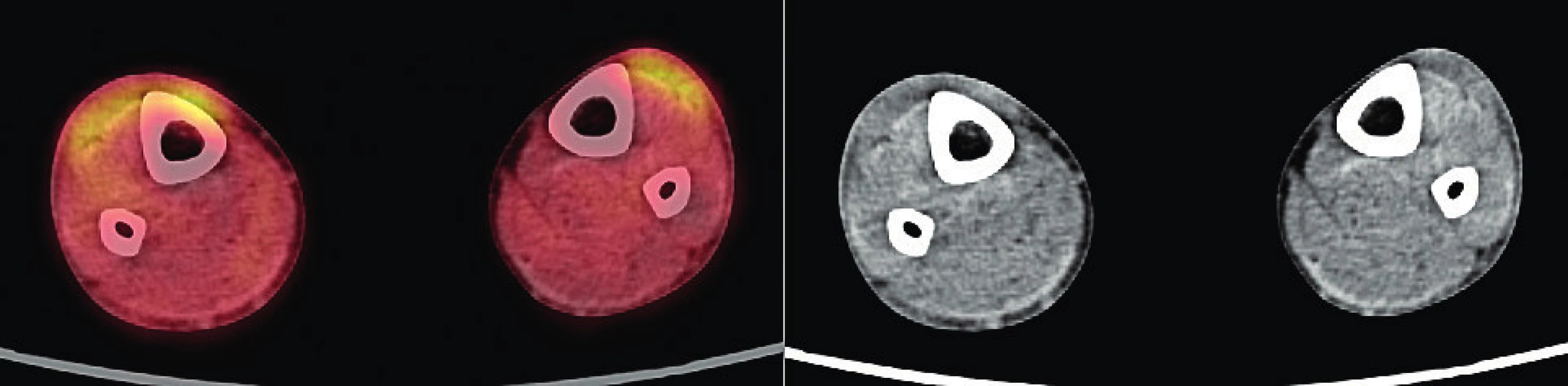
Obr. 10. Nekrobiotický xantogranulom – histopatologický obraz 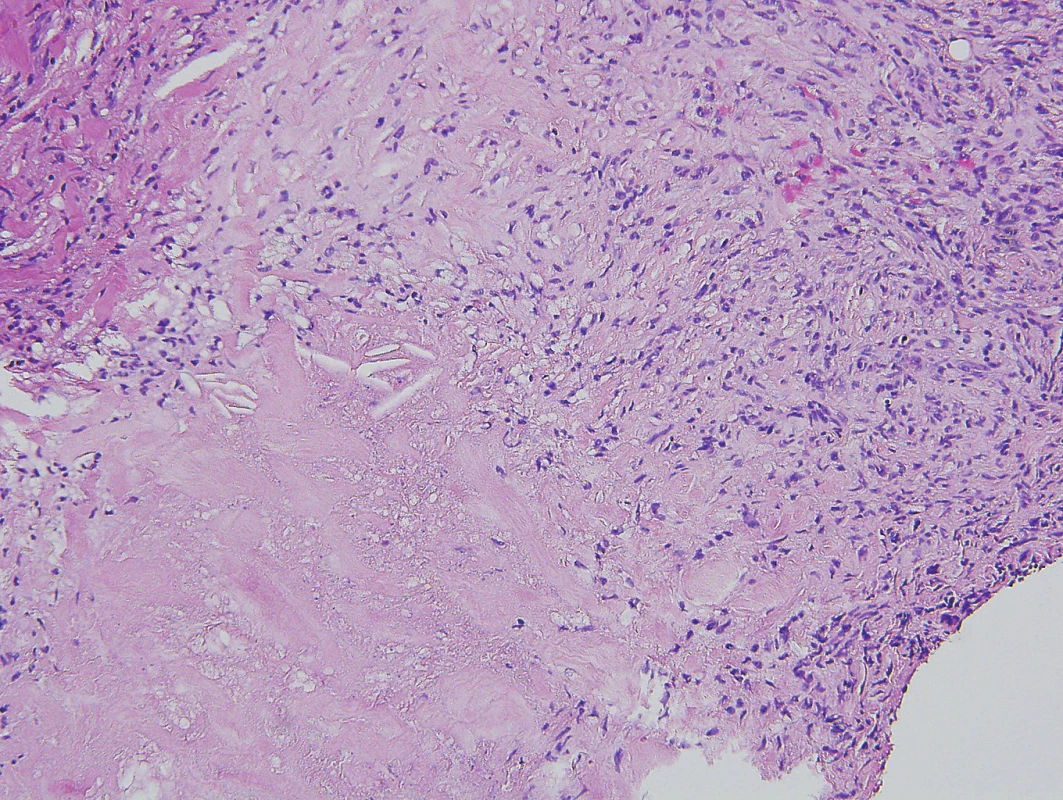
Navíc oproti předchozím vyšetřením bylo provedeno vyšetření mutací genu BRAF a MEK, která bývá často pozitivní u Erdheimovy-Chesterovy nemoci, a ty byly v tomto případně negativní. Pro další léčbu jsme zvolili farmakologické dávky imunoglobulinů 2 g/kg aplikované v měsíčních intervalech v kombinaci s radioterapií na ložiska xantogranulomu na dolních končetinách (DKK). Tato léčba dosáhla parciální regrese patologických infiltrátů v oblasti lýtek, nicméně barevné plochy na kůži zůstávají při léčbě nitrožilními imunoglobuliny beze změny.
Diskuse
Nekrobiotický xantogranulom – charakteristika nemoci
Nekrobiotický xantogranulom byl popsán poprvé v roce 1980 jako jednotka obsahující v periokulárních kožních morfách pěnité histiocyty, obrovské Toutonovy buňky a oblasti nekrobiózy kolagenu a dále je typický průkaz monoklonální gamapatie nejistého významu (MGUS) či mnohočetného myelomu [6]. Je to vzácná, postupně progredující histiocytóza, pro niž jsou charakteristické mnohočetné indurované nažloutlé až oranžové kožní a podkožní papuly a noduly, které se postupně šíří do okolí a tvoří větší plaky, postihující dermis a podkožní tkáň. Někdy mohou být provázené ulceracemi, teleangiektaziemi, atrofickými změnami a svěděním kůže. Často se objevují v periorbitální krajině. Velmi často jsou asociovány s monoklonální gamapatií IgG kappa (65 %), méně často IgG lambda (35 %). Dále byly prokázány asociace s nehodgkinskými lymfomy, Hodgkinovým lymfomem, Waldenströmovou makroglobulinemií, AL-amyloidózou a myelodysplastickým syndromem. V některých popsaných případech sice nebylo odhaleno žádné hematologické onemocnění, ale je otázka, zda bylo dostatečně intenzivně po něm pátráno, protože klinicky zřetelná manifestace maligní krevní nemoci může následovat až po vzniku nekrobiotického xantogranulomu [7].
Laboratorní vyšetření kromě vyšetření na přítomnost MIg nejsou obvykle diagnosticky přínosná, změny při ostatních laboratorních vyšetřeních jsou nespecifické [3–5].
Nekrobiotický xantogranulom postihuje stejně obě pohlaví a nejčastěji se manifestuje v 5. až v 6. životní dekádě. Jak již bylo řečeno, nejčastější klinická manifestace je v oblasti víček. Periorbitální kožní léze mohou být jednostranné i oboustranné s postižením obou víček a rozvojem blefaroptózy. Ložiska nekrobiotického xantogranulomu mohou postihovat přilehlé oční struktury a šířit se do hlubších částí očnice s postižením zrakových funkcí ve smyslu mlhavého vidění, diplopie a tranzitorních poruch vidění. Dále mohou způsobovat protruzi očního bulbu, strabismus v důsledku omezení motility oka, a další oční postižení (skleritida, keratitida, iritida a konjunktivitida) s potenciálně závažným vlivem na zrakové funkce. Studie s použitím diagnostických zobrazovacích metod prokazují abnormální měkkou masu v orbitě, zmnožení orbitálního tuku, rozšíření okohybných svalů a také možné postižení slzné žlázy. V případě očních příznaků je doporučováno vyšetření histologické z biopsie kůže periorbitální oblasti. V přítomnosti dalších orbitálních příznaků je vhodné vyšetření očnice pomocí CT zobrazení či provedení magnetické rezonance (MR). Na periokulární manifestaci nekrobiotického xantogranulomu je třeba nahlížet jako na potenciálně oku nebezpečné onemocnění, které může v některých případech vést k jizvení, lagoftalmu a trvalé slepotě. V tomto našem textu popisovaný pacient měl sice také xantomy na víčkách, ale nevedly svojí velikostí k deformaci víček.
Nekrobiotický xantogranulom se vyskytuje společně s MGUS či mnohočetným myelomem [8]. Není však jasné, zda MIg je vyvolávajícím činitelem, nebo zda příčinou je alterace imunity těchto pacientů při monoklonální gamapatii, která pak umožňuje rozvoj patologických kožních morf. V poslední přehledové publikaci z roku 2020 bylo analyzováno 235 pacientů s nekrobiotickým xantogranulomem. Monoklonální imunoglobulin byl nalezen u 82 % případů. Maligní onemocnění bylo prokázáno u 25 %, nejčastější byl myelom (14 %). Kožní projevy, typické plaky a papuly či noduly oranžové barvy, mělo 60,4 % osob, nejčastěji v oblasti očních víček (59 %) [3].
Přehled léčebných možností u nekrobiotického xantogranulomu
Glukokortikoidy
V přehledu 26 pacientů léčených lokální aplikací glukokortikoidů pouze u dvou došlo k výraznému zlepšení, častější byly komplikace po lokální aplikaci. A stejně tak systémově podávané steroidy v monoterapii vedly jen výjimečně k trvalejší léčebné odpovědi. Pouze po vysokých dávkách dexametazonu s následující udržovací léčbou prednisonem se podařilo docílit částečně léčebné odpovědi, tato léčba byla však spojena s četnými nežádoucími účinky [4].
Imunomodulační léky
Thalidomid a lenalidomid byly testovány v monoterapii nebo v kombinaci s dexametazonem a vedly u některých pacientů k léčebné odpovědi. Vzhledem ke vzácnosti výskytu nekrobiotického xantogranulomu se jednalo o popisy jednotlivých případů. Není jasné, jak dlouho po ukončení léčby bude přetrvávat léčená odpověď. Šest potvrzujících publikací u takto vzácné nemoci je dostačující k tomu, abychom tuto léčbu u konkrétního pacienta případně zvažovali [9–14].
Terapie intravenózními imunoglobuliny
Léčivé přípravky nitrožilních imunoglobulinů typu IgG (IVIG) obsahují polyklonální imunoglobulin typu IgG od tisíců dárců. První rozpoznanou indikací IVIG byly závažné infekce a později preventivní pravidelné podávání u pacientů s vrozeným imunodeficitem, nebo například imunodeficitem získaným při mnohočetném myelomu. Existuje řada dalších terapeutických indikací IVIG, jejichž výčet je nad rámec této publikace. Při dlouhodobé substituci IVIG se podává obvykle 0,2 g/kg ve 3–4týdenních intervalech.
Skutečnost, že zatímco substituce fyziologických dávek IVIG vede k posílení imunity, tak aplikace vysokých dávek, obvykle 2 g/kg hmotnosti pacienta, podávané v průběhu 2–5 dní, způsobuje imunosupresi či imunomodulaci, byla rozpoznána a publikována v roce 1981 u dítěte s imunitní trombocytopenií. Tehdy podávání IVIG vedlo ke vzestupu počtu trombocytů. Od té doby se začala testovat léčba IVIG u některých autoimunitních a autoinflamatorních poruch. Léčba IVIG může vést k rychlému poklesu prozánětlivých cytokinů a ke zmírnění projevů zánětu, a to i u autoimunitních procesů zcela rezistentních na léčbu glukokortikoidy [15, 16].
První publikace, věnující se léčbě nekrobiotického xantogranulomu aplikací IVIG, je z roku 2010. Pacient s monoklonální gamapatií byl léčen steroidy, psoralenem a UV zářením, chlorochinolonem, hydroxychlorochinem, cyklosporinem bez zásadního přínosu. Byla u něj provedena i extrakorporální fotoforéza bez efektu. Pak teprve bylo přistoupeno k léčbě IVIG v dávce 0,5 g/kg/den, 4 dny po sobě, tedy IVIG 2 g/kg na jeden léčebný cyklus. Interval mezi cykly byl 4 týdny. Po první aplikaci IVIG došlo ke změknutí indurací a uvolnění postižené kůže. V průběhu léčby kožní plaky kontinuálně zmenšovaly svoji tloušťku podle sonografického měření a infiltráty bledly. Po 4 měsících došlo k téměř úplné regresi. Následně byly intervaly aplikací IVIG prodlouženy na 6 týdnů. Po 11 cyklech byly léčebné intervaly dále prodlouženy na 8 měsíců [17]. Následovaly další publikace popisující léčbu jednoho, maximálně dvou pacientů nitrožilními imunoglobuliny s pozitivním výsledkem. Celkem bylo popsáno 9 případů léčených IVIG s pozitivním efektem, v jednom případě byla léčba kombinována s ozářením paprskem elektronů [18–24].
Kladribin
Kladribin je lék, který je velmi účinný při léčbě histiocytózy z Langerhansových buněk, ale i u dalších typů histiocytóz. V literatuře je několik publikací popisujících úspěšné použití kladribinu u juvenilního xantogranulomu [25–28]. Efekt kladribinu se také popisuje při léčbě xantogranulomu, ale opět jen ve formě popisů případů, protože jde o velmi vzácné diagnózy. Pouze dvě publikace popisují použití kladribinu při léčbě nekrobiotického xantogranulomu. V první práci byl popsán ústup morf nekrobiotického xantogranulomu, ale léčbu bylo nutno přerušit pro pancytopenii [29]. V druhém případě byl kladribin použit pro léčbu xantogranulomových morf u pacienta s mnohočetným myelomem, rezistentním na lenalidomid a dexametazon, v tomto případě došlo ke zlepšení a částečné regresi kožního nálezu [30].
Alkylační cytostatika
Dříve byla testována také alkylační cytostatika, nejvíce chlorambucil. Počet léčebných odpovědí nebyl velký [30–33], stejně jako po dalším alkylačním cytostatiku cyklofosfamidu [34–38] a melfalanu [39–42]. Alkylační cytostatika v monoterapii dosahovala parciální léčebné odpovědi u necelých 30 % léčených.
Antimetabolity
Nejvíce byl testován metotrexát a v několik popsaných případech vedl ke klinickému zlepšení. Azathioprin byl zkoušen jen v jednom případě bez efektu [43–45].
Léčba ovlivňující cytokiny
Existuje jen jedna práce popisující účinek infliximabu u pacienta rezistentního vůči jiným pokusům o léčebné ovlivnění [46]. Jinak žádná práce testující například anakinru či jiný lék zasahující do cytokinové sítě nebyla zatím publikována.
Radioterapie
Celkem u 9 případů je popsáno použití radioterapie. U pěti z nich se popisuje částečné zlepšení. Ve dvou případech, kdy byla radioterapie kombinována se medikamentózní léčbou, také došlo ke zlepšení. V případě ozařování v oblasti oka je vždy nutno mít na zřeteli riziko možného poškození zraku. Proto novější práce používají radioterapii s pomocí svazku elektronů [47].
PUVA
Léčba ultrafialovým spektrem s aplikací psoralenu je další léčebnou alternativou. V případě nekrobiotického xantogranulomu existuje jedna publikace, které popisuje léčebnou odpověď [48]. U našeho pacienta jsme ji také testovali. Tím že chodil na ozařování ultrafialovým světlem, tak jeho kůže zhnědla a oranžové morfy byly méně nápadné, ale co do rozsahu se nezmenšily.
Rituximab
Použití rituximabu u nekrobiotického xantogranulomu je popsáno ve třech případech, jenže ve dvou se jednalo o souběh s IgG4 releated disease, což je nemoc, která obvykle na rituximab dobře reaguje. Ve třetím případě se jednalo o pacienta, jehož xantogranulomové ložisko obsahovalo poměrně hodně CD20 pozitivních lymfocytů [49–51].
Závěr
Popsali jsme vývoj plošných xantomů a nekrobiotického xantogranulomu v průběhu 14 let u našeho pacienta s monoklonální gamapatií a retroperitonální lymfadenopatií. Monoklonální gamapatie u toho nemocného se biologicky chová jako MGUS, i když jednou počet plazmocytů v kostní dřeni hraničně splnil kritéria mnohočetného myelomu [52–54]. U retroperitonální lymfadenopatie se morfologové neshodli v klasifikaci, jedno pracoviště hodnotilo lymfadenopatii jako nespecifické zánětlivé změny a druhé jako suspektní nodulární, lymfocytárně predominantní Hodgkinův lymfom. Vzhledem k tomu, že tato lymfadenopatie byla v průběhu let stacionární, nebylo přikročeno k další biopsii.
Kožní morfy se u nemocného v průběhu času postupně zvětšovaly a rozšiřovaly, zatímco koncentrace MIg IgG kappa je dlouhodobě stabilní, kolem 10 g/l.
Z léčebných alternativ s nadějí na ovlivnění kožního postižení při xantogranulomu jsme testovali kombinaci cyklofosfamidu, bortezomibu a dexametazonu, tato však byla bez efektu. V roce 2019 došlo k progresi kožního nálezu, objevily se xantogranulomové masy v podkoží obou lýtek, velmi dobře zřetelné při PET/CT vyšetření.
Po kombinované léčbě farmakologickými dávkami IVIG a radioterapii došlo k parciální remisi a stabilizaci stavu. Tento popis případu u našeho nemocného s nekrobiotickým xantogranulomem demonstruje velmi vzácné kožní onemocnění sdružené s monoklonální gamapatií, jeho charakteristiku a přehled léčebných možností.
Podíl autorů na přípravě rukopisu
KZ, AZ – příprava rukopisu
KM, KJ, ŘZ, KR, SŠ, PL – korekce a revize rukopisu, doplnění obrazové dokumentace
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 3. 2. 2020.
Přijato po recenzi dne 25. 5. 2020.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: adam.zdenek@fnbrno.cz
Zdroje
- Plank L. Diagnostická patológia non-Langerhansových histiocytóz. Vnitř Lék. 2010;56 : 2S39–2S63.
- Stork J, Kodetová D, Vosmík F, et al. Necrobiotic xanthogranuloma presenting as a solitary tumor. Am J Dermatopathol. 2000;22 : 453–456.
- Nelson CA, Zhong CS, Hashemi DA, et al. Multicenter cross-sectional study and systematic review of necrobiotic xanthogranuloma with proposed diagnostic criteria. JAMA Dermatol. 2020; publikováno elektronicky 15. ledna 2020. DOI 10.1001/jamadermatol.2019.4221.
- Miguel D, Lukacs J, Illing T, et al. Treatment of necrobiotic xanthogranuloma – a systematic review. J Eur Acad Dermatol Venerol. 2017;31 : 221–235.
- Kerstetter J, Wang J. Adult orbital xanthogranulomatous disease: A review with emphasis on etiology, systemic associations, diagnostic tools, and treatment. Dermatol Clin. 2015;33 : 457–463.
- Kossard S, Winkelmann RK. Necrobiotic xanthogranuloma with paraproteinemia. J Am Acad Dermatol. 1980;3 : 257–270.
- Reeder, CB, Connolly, SM, Winkelmann, RK. The evolution of Hodgkin‘s disease and necrobiotic xanthogranuloma syndrome. Mayo Clin Proc. 1991;66 : 1222–1224.
- Wruhs M, Feldmann R, Sawetz I, et al. Necrobiotic xanthogranuloma in a patient with multiple myeloma. Case Rep Dermatol. 2016;8 : 350–353.
- Mello RB, Vale EC. Necrobiotic xanthogranuloma associated with smoldering multiple myeloma: satisfactory response to cyclophosphamide, dexamethasone, and thalidomide. An Bras Dermatol. 2019;94 : 337–340.
- Mahendran P, Wee J, Chong H, et al. Necrobiotic xanthogranuloma treated with lenalidomide. Clin Exp Dermatol. 2018;43 : 345–347.
- Dholaria BR, Cappel M, Roy V. Necrobiotic xanthogranuloma associated with monoclonal gammopathy: successful treatment with lenalidomide and dexamethasone. Ann Hematol. 2016;95 : 671–672.
- Ghani S, Al Ustwani O, Khalid B, et al. Periorbital necrobiotic xanthogranuloma treated successfully with novel multiple myeloma therapy. Clin Adv Hematol Oncol. 2013;11 : 678–680.
- Efebera Y, Blanchard E, Allam C, et al. Complete response to thalidomide and dexamethasone in a patient with necrobiotic xanthogranuloma associated with monoclonal gammopathy: a case report and review of the literature. Clin Lymphoma Myeloma Leuk. 2011;11 : 298–302.
- Silapunt S, Chon SY. Generalized necrobiotic xanthogranuloma successfully treated with lenalidomide. J Drugs Dermatol. 2010;9 : 273–276.
- Nagelkerke SQ, Kuijpers TW. Immunomodulation by IVIg and the role of Fc-gamma receptors: classic mechanisms of action after all? Front Immunol. 2015;5 : 674–678.
- Gelfand EW. Intravenous immune globulin in autoimmune and inflam-matory diseases. N Engl J Med. 2012;367 : 2015–2025.
- Hallermann C, Tittelbach J, Norgauer J, et al. Successful treatment of necrobiotic xanthogranuloma with intravenous immunoglobulin. Arch Dermatol. 2010;146 : 957–960.
- Rubinstein A, Wolf DJ, Granstein RD. Successful treatment of necrobiotic xanthogranuloma with intravenous immunoglobulin. J Cutan Med Surg. 2013;17 : 347–350.
- Goyal A, O‘Leary D, Vercellotti G, et al. Intravenous immunoglobulin for treatment of necrobiotic xanthogranuloma. Dermatol Ther. 2019;32:e12744.
- Olson RM, Harrison AR, Maltry A, et al. Periorbital necrobiotic xanthogranuloma successfully treated with intravenous immunoglobulin. Case Rep Ophthalmol. 2018;17(9):70–75.
- Lukács J, Goetze S, Elsner P. Periocular necrobiotic xanthogranuloma successfully treated with intravenous immunoglobulin. Acta Derm Venerol. 2017;97 : 754–755.
- Nambudiri VE, McLaughlin C, Lo TC, et al. Successful multimodality treatment of recalcitrant necrobiotic xanthogranuloma using electron beam radiation and intravenous immunoglobulin. Clin Exp Dermatol. 2016;41 : 179–182.
- Pedrosa AF, Ferreira O, Calistru A, et al. Necrobiotic xanthogranuloma with giant cell hepatitis, successfully treated with intravenous immunoglobulins. Dermatol Ther. 2015;28 : 68–70.
- Liszewski W, Wisniewski JD, Safah H, et al. Treatment of refraktory necrobiotic xanthogranulomas with extracorporeal photopheresis and intravenous immunoglobulin. Dermatol Ther. 2014;27 : 268–271.
- Yamada K, Yasui M, Sawada A, et al. Severe persistent bone marrow failure following therapy with 2-chlorodeoxyadenosine for relaps-ing juvenile xanthogranuloma of the brain. Pediatr Blood Cancer. 2012;58 : 300–302.
- Blouin P, Yvert M, Arbion F, et al. Juvenile xanthogranuloma with hematological dysfunction treated with 2CDA-AraC. Pediatr Blood Cancer. 2010;55 : 757–760.
- Maintz L, Wenzel J, Irnich M, et al. T. Successful treatment of systemic juvenile xanthogranulomatosis with cytarabine and 2-chlorodeoxyadenosine: case report and review of the literature. Br J Dermatol. 2017;176 : 481–487.
- Rajendra B, Duncan A, Parslew R, et al. Successful treatment of central nervous system juvenile xanthogranulomatosis with cladribine. Pediatr Blood Cancer. 2009;52 : 413–415.
- Sutton L, Sutton S, Sutton M. Treatment of necrobiotic xanthogranuloma with 2-chlorodeoxyadenosine. Skin Med. 2013;11 : 121–123.
- Reddy VC, Salomão DR, Garrity JA, et al. Periorbital and ocular necrobiotic xanthogranuloma leading to perforation. Arch Ophtalmol. 2010;128 : 1493–1494.
- Ryan E, Warren LJ, Szabo F, et al. Necrobiotic xanthogranuloma: response to chlorambucil. Australas J Dermatol. 2012;53:e23–e25.
- Torabian SZ, Fazel N, Knuttle R, et al. Necrobiotic xanthogranuloma treated with chlorambucil. Dermatol Online J. 2006;12 : 11–12.
- Machado S, Alves R, Lima M, et al. Cutaneous necrobiotic xanthogranuloma successfully treated with low dose chlorambucil. Eur J Dermatol. 2001;11 : 458–562.
- Wells J, Gillespie R, Zardawi I. Case of recalcitrant necrobiotic xanthogranuloma. Australas J Dermatol. 2004;45 : 213–215.
- Meyer S, Landthaler M, Hohenleutner S. Long-term course of necrobiotic xanthogranuloma with ocular involvement. Hautarzt. 2006;57 : 144–149.
- Meyer S, Szeimies RM, Landthaler M, et al. Cyclophosphamide-dexamethasone pulsed therapy for treatment of recalcitrant necrobiotic xanthogranuloma with paraproteinemia and ocular involvement. Br J Dermatol. 2005;153 : 443–445.
- Flann S, Wain EM, Halpern S, et al. Necrobiotic xanthogranuloma with paraproteinaemia. Clin Exp Dermatol. 2006;31 : 248–251.
- Khan IJ, Azam NA, Sullivan SC, et al. Necrobiotic xanthogranuloma successfully treated with a combination of dexamethasone and oral cyclophosphamide. Can J Ophthalmol. 2009;44 : 335–336.
- Saeki H, Tomita M, Kai H, et al. Necrobiotic xanthogranuloma with paraproteinemia successfully treated with melphalan, prednisolone and skin graft. J Dermatol. 2007;34 : 795–797.
- Ziemer M, Wedding U, Sander CS, Elsner P. Necrobiotic xanthogranuloma-rapid progression under treatment with melphalan. Eur J Dermatol. 2005;15 : 363–365.
- Criado PR, Vasconcellos C, Pegas JR, et al. Necrobiotic xanthogranuloma with lambda paraproteinemia: case report of successful treatment with melphalan and prednisone. J Dermatolog Treat. 2002;13 : 87–89.
- Valente NY. Necrobiotic xanthogranuloma with lambda paraproteinemia: case report of successful treatment with melphalan and prednisone. J Dermatolog Treat. 2002;13 : 87–89.
- Cavallazzi R, Hirani A, Vasu TS, et al. Clinical manifestations and treatment of adult-onset asthma and periocular xanthogranuloma. Can Respir J. 2009;16 : 159–162.
- Hayden A, Wilson DJ, Rosenbaum JT. Management of orbital xanthogranuloma with methotrexate. Br J Ophthalmol. 2001;91 : 434–436.
- Parmley VC, George DP, Fannin LA. Juvenile xanthogranuloma of the iris in an adult. Arch Ophthalmol. 1998;116 : 377–379.
- Kraft J, Lynde C, Lynde C. Nekrobiotic xanthogranulom responding to infliximab. J Am Acad Dermatol. 2004;52 : 59–60.
- Char DH, LeBoitPE, Ljung BM, et al. Radiotherapy for ocular necrobiotic xanthogranuloma. Arch Ophthalmol. 1987;105 : 174–175.
- Al-Niaimi FA, Dawn G, Cox NH. Necrobiotic xanthogranuloma with-out paraproteinaemia: marked improvement with psoralen ultraviolet A treatment. Clin Exp Dermatol. 2010;35 : 275–277.
- Asproudis I, Kanari M, Ntountas I, et al. Successful treatment with rituximab of IgG4-related disease coexisting with adult-onset asthma and periocular xanthogranuloma. Rheumatol Int. 2020;40 : 671–677.
- Pomponio G, Olivari D, Mattioli M, et al. A sustained clinical response after single course of rituximab as first-line monotherapy in adult-onset asthma and periocular xanthogranulomas syndrome associated with IgG4-related disease: A case report. Medicine (Baltimore). 2018;97(26):e11143.
- Sagiv O, Thakar SD, Morrell G, et al. Rituximab monotherapy is effective in treating orbital necrobiotic xanthogranuloma. Ophthalmic Plast Reconstr Surg. 2018;34:e24–e27.
- Pika T, Minařík J, Lochman P, et al. Sérové hladiny volných lehkých řetězců imunoglobulinu u monoklonální gamapatie nejistého významu a jejich přínos pro stratifikaci a sledování. Transfuze Hematol Dnes. 2011;17 : 177–181.
- Maisnar V, Hájek R. Změny v diagnostických kritériích a kritériích léčebné odpovědi u mnohočetného myelomu. Transfuze Hematol Dnes. 2008;14 : 119–123.
- Adam Z, Straub J, Ščudla, V. Doporučení České myelomové skupiny (CMG) pro zajištění časné diagnostiky mnohočetného myelomu v podmínkách ambulantní klinické praxe. Transfuze Hematol Dnes. 2008;14 : 93–94.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Léčba Erdheimovy-Chesterovy choroby
- Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi
- Cílený rozklad obtížně inhibovatelných proteinů způsobujících maligní hematologická onemocnění pomocí dvoufunkčních molekul využívajících polyubikvitinaci a rozklad v proteazomech
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností
- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Dědičná trombocytopenie na podkladě patogenní varianty genu MYH9 diagnostikovaná u dospělé ženy
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Dopisy redakci
- Dopisy redakci
- Za pani profesorkou MUDr. Adrienou Sakalovou, DrSc.
- Zemřela MUDr. Zdeňka Vorlová, CSc.
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stillova nemoc – vzácné autoinflamatorní onemocnění dospělých: popis případu a přehled léčebných možností
- Odporúčania pre skríning, diagnostiku, profylaxiu a liečbu hepatitíd u hematoonkologických pacientov – odporúčania CELL
- Současná role alogenní transplantace krvetvorby v léčbě akutní myeloidní leukemie
- Léčba Erdheimovy-Chesterovy choroby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



