-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKlinické a biologické prognostické faktory u maligních lymfomů
Clinical and biological prognostic factors in malignant lymphomas
Malignant lymphomas represent a clinically, biologically and genetically varied group of neoplasms. Moreover, the last decade has provided modern haemato-oncology with numerous novel biologically active drugs that have extended therapeutic options and changed our patients’ lives. The era of personalized medicine places new demands on physicians’ decision-making processes. A confident prediction of the patient’s outlook is now an indispensable tool for selecting treatment strategy. Predictive tools, or predictive factors, hand in hand with changes in therapy, have undergone dramatic development. Previous clinical schemes and prognostic indices postulated in the era prior to the introduction of immunotherapy and intensive treatment protocols have limited information value today. Novel prognostic factors are better at reflecting the nature of tumours themselves, allowing estimation of chemo-immunotherapy effectiveness and take into consideration the immune interaction between a tumour and the patient’s organism. Modern molecular cytogenetic and immunohistochemical methods yield important additional prognostic information. The article aims at providing a review of currently used predictive tools, from traditional scores to novel findings in the field of tumour cytogenetics and immunogenomics.
Key words:
lymphoma, prognosis, rituximab, immunotherapy, cytogenetics, immunogenomics
Autoři: V. Procházka 1
; M. Jarošová 1; Z. Prouzová 2; M. Geierová 2; T. Papajík 1; K. Indrák 1
Působiště autorů: Hemato-onkologická klinika Fakultní nemocnice Olomouc a Lékařské fakulty Univerzity Palackého v Olomouci, 2Ústav klinické a molekulární patologie Fakultní nemocnice Olomouc a Lékařské fakulty Univerzity Palackého v Olomouci 1
Vyšlo v časopise: Transfuze Hematol. dnes,19, 2013, No. 2, p. 76-87.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Maligní lymfomy představují klinicky, biologicky a geneticky velmi pestrou skupinu neoplazií. Poslední dekáda navíc přinesla do moderní hemato-onkologie řadu nových biologicky aktivních léčiv, která rozšířila terapeutické možnosti a změnila osud nemocných. Éra personalizované medicíny klade na rozhodovací proces lékaře nové nároky. Kvalifikovaná předpověď osudu nemocných je nyní nezbytným nástrojem volby léčebné strategie. Prediktivní nástroje – tedy prognostické faktory, prodělaly ruku v ruce s vývojem terapie dramatický rozvoj. Původní klinická schémata a prognostické indexy postulovaná v éře před zavedením imunoterapie a intenzivních protokolů léčby mají v dnešní době limitovanou výpovědní schopnost. Nové prognostické faktory více reflektují povahu samotného nádoru, umožňují odhadnout efektivitu chemoimunoterapie a zohledňují imunitní interakci mezi nádorem a organismem pacienta. Použití moderních molekulárně-cytogenetických a imunohistochemických metod přináší mnoho důležitých přídatných prognostických informací. Cílem sdělení je poskytnout přehled současně používaných prediktivních nástrojů od klasických skórovacích systémů až po nové poznatky na poli cytogenetiky a imunogenomiky nádorů.
Klíčová slova:
lymfom, prognóza, rituximab, imunoterapie, imunogenomika, cytogenetikaÚvod
Moderní historii tvorby prognostických schémat iniciovala v březnu 1974 publikace kolektivu autorů pod vedením Clary Bloomfield v časopise Cancer - „Multivariate analysis of prognostic factors in the non-Hodgkin´s malignant lymphomas“ (1). Metodologie této práce a její výsledky předurčily vývoj prognostického skórování dlouho dopředu. Prognostické systémy prodělaly za poslední více než čtyři dekády dramatický rozvoj – od klinických parametrů, přes objevení řady cytogenetických, biochemických a histopatologických skóre. Poznání vlastností nádoru, jeho biologie a metabolismu nám umožňuje nejen předvídat odpovědi na konkrétní léčbu, ale především vede k poznání nádoru samotného a jeho interakce s makroorganismem pacienta. Trendem poslední doby je syntéza obrovského množství informací do jednoduchých a při tom robustních skórovacích systémů, které jsou specifické pro jednotlivé klinicko-patologické jednotky.
Klinické prognostické faktory a skóre
Klinickými prognostickými faktory (PF) rozumíme takové proměnné, které jsou jednoduše měřitelné v rutinní klinické praxi – jde zejména o věk, rozsah onemocnění (klinické stadium), postižení mimouzlinových lokalit, stav tělesné kondice nemocného resp. jeho komorbidity, případně vyšetření jednoduchých laboratorních parametrů jako je hladina laktát-dehydrogenázy či hladina hemoglobinu. Klinické PF byly dlouhá léta základem pro tvorbu prognostických skóre, protože jde o snadno dostupná data.
1. Předrituximabová éra
Společným rysem prognostických skóre vytvořených před érou biologické léčby je, že byly primárně postulovány pro predikci celkového přežití. Historicky prvním široce používaným systémem, který byl původně vyvinut pro nemocné s agresivními lymfomy, je Mezinárodní prognostický index (International Prognostic Index, IPI) (2). Kolektiv kolem Margaret Shippové postuloval systém, který rozčleňuje nemocné do čtyř rizikových tříd s rozdílným celkovým přežitím a je úspěšně používán dodnes (3).
Odlišná biologická povaha indolentních lymfomů vedla k nutnosti tvorby systému vhodného pro nemocné s folikulárním lymfomem. Systém nazvaný FLIPI lépe reflektoval rozsah onemocnění zařazením hodnocení počtu postižených uzlinových lokalit a nepřímo hodnotil i postižení kostní dřeně hladinou hemoglobinu (4). Výpovědní hodnota FLIPI byla potvrzena i u jiných indolentních lymfomů jako například u lymfomů marginální zóny (5). Zavedení principů nové WHO klasifikace lymfoidních malignit do praxe vedlo k vydělení významné skupiny mantle cell lymfomu řazeného dříve chybně mezi indolentní neoplazie. Specifický index pro tuto jednotku (MCL international prognostic index, MIPI) zahrnul i počet lymfocytů a prokázal superioritu nad indexy IPI a FLIPI u nemocných s pokročilým MCL (6). Snaha o hledání odlišných prognostických a léčebných postupů u nemocných s periferními T-buněčnými lymfomy vedla k postulaci indexu PIT (Prognostic Index for PTCL-NOS), který oproti IPI zahrnuje i postižení kostní dřeně (7). Srovnání nejčastěji požívaných skóre je uvedeno v tabulce 1.
Tab. 1. Srovnání prognostických skóre postulovaných před érou biologické léčby. 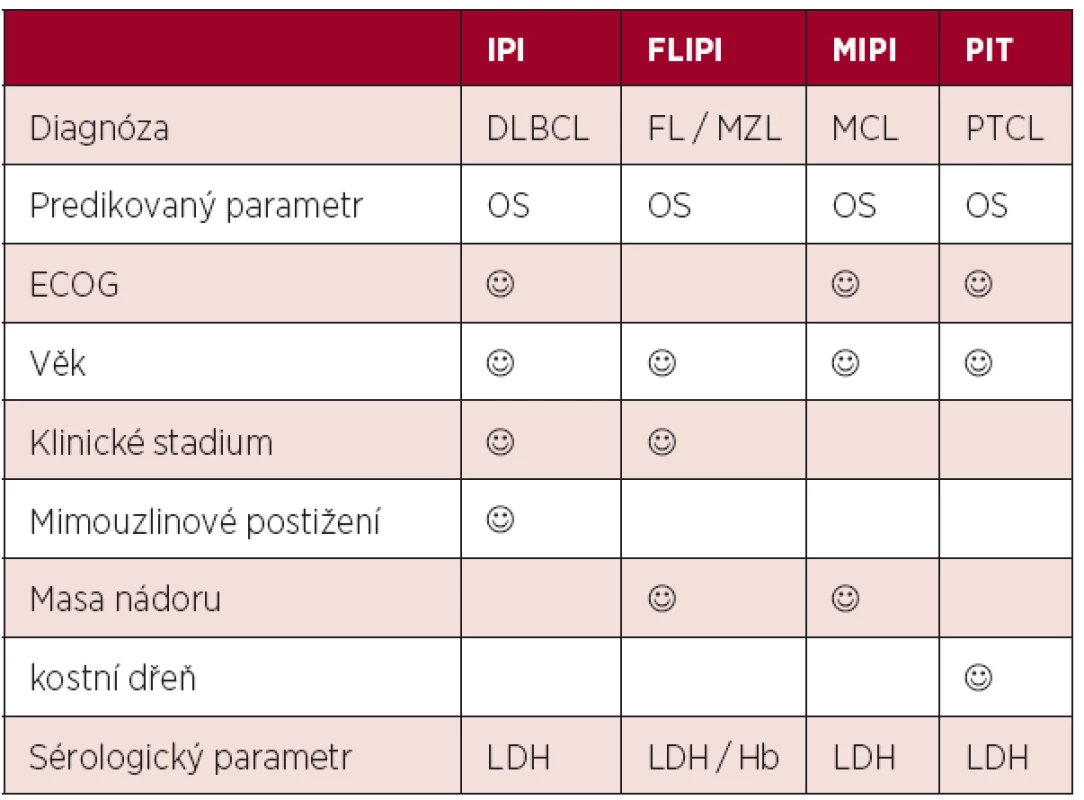
Legenda: IPI (mezinárodní prognostický index), FLIPI (mezinárodní prognostický index pro folikulární lymfom), MIPI (mezinárodní prognostický index pro mantle cell lymfom), DLBCL (difuzní B-velkobuněčný lymfom), FL (folikulární lymfom), MZL (lymfom marginální zóny), PTCL (periferní T-buněčný lymfom), ECOG (stav tělesné kondice), LDH (hladina laktát-dehydrogenázy), Hb (hemoglobin) 2. Moderní éra biologické léčby
Zavedení moderní cílené léčby vedlo k významnému zlepšení osudu nemocných. Výpovědní hodnota původních proměnných i celých skóre byla oslabena a bylo nutné je modifikovat. Nejčastějším metodickým postupem při tvorbě nových skóre byla kultivace starších systémů – přepočítáním jednotlivých prognostických skupin jak v případě revidovaného IPI (R-IPI), nebo přidáním proměnných, které vykazují lepší výpovědní hodnotu. V případě FLIPI se jednalo o zařazení hladiny beta-2-mikroglobulinu a jiné hodnocení masy nádoru, v případě MIPI byl zaveden parametr proliferační aktivity buněk (Ki-67). Nové varianty byly pak nazvány jako FLIPI-2, respektive bMIPI (5, 8). Významným parametrem v hodnocení prognózy u DLBCL a PTCL se ukazuje být absolutní počet lymfocytů (Absolute Lymphocyte Count, ALC (9). Kombinací ALC a revidovaného IPI vznikl robustní index ALC/R-IPI, který v případě nemocných s DLBCL predikuje jejich osud daleko přesněji než IPI (10). Srovnání nejčastěji požívaných skóre v éře biologické léčby je uvedeno v tabulce 2.
Tab. 2. Srovnání prognostických skóre postulovaných v éře biologické léčby. 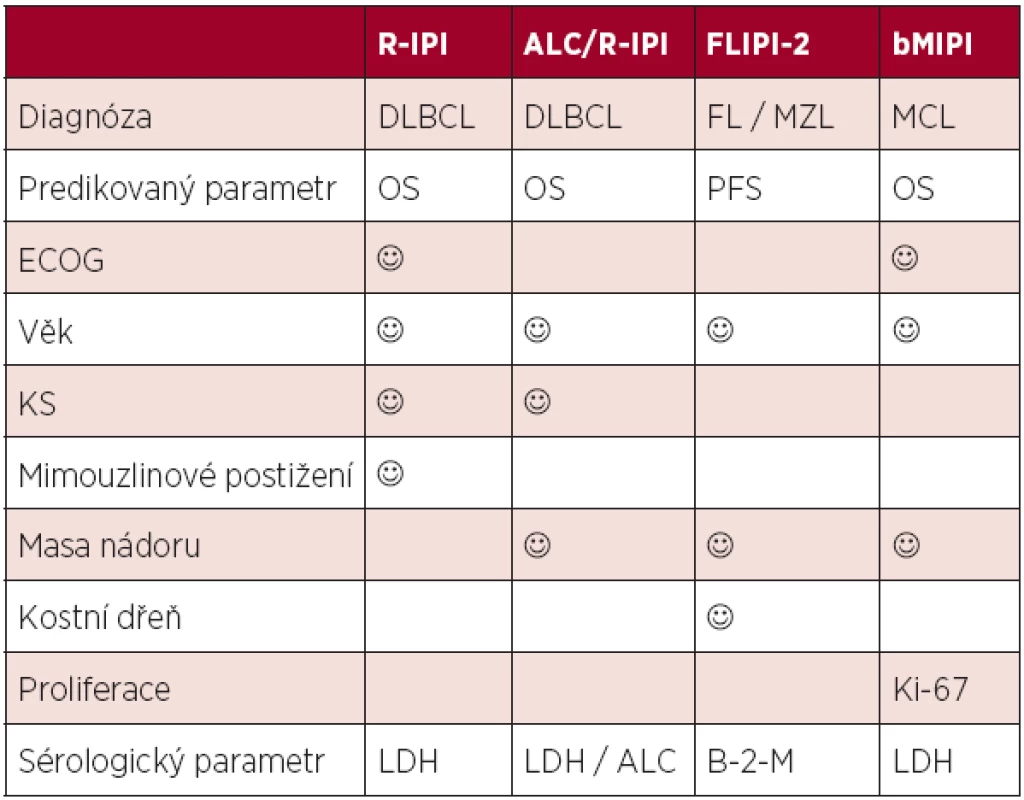
Legenda: IPI (mezinárodní prognostický index), FLIPI (mezinárodní prognostický index pro folikulární lymfom), MIPI (mezinárodní prognostický index pro mantle cell lymfom), DLBCL (difuzní B-velkobuněčný lymfom), FL (folikulární lymfom), MCL (lymfom plášťové zóny), MZL (lymfom marginální zóny), ECOG (stav tělesné kondice), LDH (hladina laktát-dehydrogenázy), Hb (hemoglobin), ALC (absolutní počet lymfocytů), B-2-M (beta-2-mikroglobulin) Biologické prognostické faktory
1. Molekulárně-cytogenetické prognostické faktory
Difuzní velkobuněčný lymfom (DLBCL)
Patogeneze difuzního velkobuněčného lymfomu (DLBCL), nejčastějšího typu nehodgkinských lymfomů (NHL), představuje mnohastupňový proces zahrnující kumulaci řady genetických a epigenetických změn, které ve svém důsledku vedou k selekci maligního klonu. Genetické změny pozorované u DLBCL představují nejen mutace na úrovni genů, ale i chromozomové aberace jako jsou translokace, delece, inzerce nebo amplifikace. Cytogenetické studie odhalily vysoké procento výskytu chromozomových změn. Translokace se vyskytují až u 50 % nemocných, nebalancované chromozomové změny až u 67 % nemocných. Snaha o vysvětlení obrovské genetické heterogenity vedla vědecké týmy k aplikaci nejmodernějších metod molekulární biologie. Expresní profilování (11, 12) potvrdilo existenci dvou, později tří expresně rozdílných podskupin DLBCL (13). Byla definována podskupina označená GCB (germinal centre B cell) DLBCL, podskupina ABC (activated B cell) DLBCL a podskupina primárního mediastinálního lymfomu (PMBL). Odlišení těchto tří podskupin je velmi významné z hlediska prognózy nemocných (13). V běžné klinické praxi je velkým přínosem pro určení prognostických podskupin molekulární cytogenetika. Na základě výsledků metody arrayCGH bylo zjištěno, že ABC podtyp DLBCL je spojen s trizomií chromozomu 3 nebo zmnožením 3q nebo chromozomu 18q a delecí na chromozomu 6q21-22. Podtyp GCB má nejčastěji zmnožení genetického materiálu na dlouhých ramenech chromozomu 12q12 a PMBL má nejčastěji zmnožení genetického materiálu krátkých ramen chromozomu 9 (9p) (14).
Kromě nebalancovaných změn se u DLBCL vyskytují i translokace. Translokace t(14;18)(q32;q21), která vede k deregulaci BCL2 genu je častá (45 %) u nemocných zařazených do podskupiny GCB, ale je také nalézána u nemocných s PMBL (18 %) (15, 16). Další nenáhodnou genetickou změnou u nemocných s DLBCL je amplifikace chromozomu 2p zahrnující gen REL. Vyskytuje se u 16 % GCB a ve 25 % u PMBL, ale nebyla pozorována u ABC podskupiny (14, 16). Amplifikovaná oblast chromozomu 2p zahrnuje nejen gen REL, ale v dané oblasti je lokalizován i onkogen BCL11A. Bylo pozorováno (17), že BCL11A je koamplifikován s REL u B buněčných NHL, ale jeho role u DLBCL nebyla zatím definována.
Častou chromozomovou změnou vyskytující se ve vysoké frekvenci u ABC i GCB podskupiny je delece na dlouhých ramenech chromozomu 6 [del(6q)] (14). Delece 6q je obecně považována za sekundární změnu u NHL. V některých případech se však jedná o samostatnou změnu, která je u některých NHL považována za změnu s primární patogenetickou rolí (18, 19). Delece zahrnující oblast 6q21 je spojena s nepříznivou prognózou (20). Jedním z kandidátních genů deletované oblasti je gen B lymphocyte-induced maturation protein 1 - BLIMP1, který kóduje transkripční represor důležitý pro terminální diferenciaci buněk GC do plasmatických buněk (21).
Stejně jako kandidátní transkripční represor BLIMP1 na chromozomu 6, je dalším z kandidátních genů, podílejících se na diferenciaci B-buněk do plasmatických buněk gen BCL6, lokalizovaný na chromozomu 3q27. GCB podskupina DLBCL exprimuje BCL6 mRNA na významně vyšší hladině než u podskupiny ABC (11). BCL6 je deregulovaný chromozomovými translokacemi asi u 20 % DLBCL případů, ale zvýšená exprese BCL6 není u GCB podskupiny pouze výsledkem translokace. Mezi cílové geny BCL6 patří geny jako cyclin D2, MIP-1 nebo p27kip1.
PMBL je podle WHO klasifikace samostatnou podjednotkou agresivních NHL. Nejčastější chromozomovou změnou je zmnožení oblasti 9p, ve které je lokalizován gen JAK2. Vyskytuje se až u 75 % pacientů. Až u 38 % nemocných s PMBL se může vyskytovat kryptická translokace zahrnující gen CIITA, lokalizovaný na chromozomu 16p13.13, který působí jako pozitivní regulátor transkripce MHC II (major histocompatibility complex II) proteinů. Bylo zjištěno, že CIITA je promiskuitní gen fúzující s různými geny a vznik těchto fúzí ovlivňuje přežití nemocných s PMBL. Výsledkem takové fúze je snížená exprese povrchových HLA II a naopak nadměrná exprese ligandu receptoru programované buněčné smrti (programmed cell death ligandu - PDL1 a PDL2), které ovlivňují protinádorovou imunitní odpověď (22).
Mantle cell lymphoma (MCL)
Ačkoliv je genetickým markerem MCL translokace t(11;14)(q13;32), byly objeveny další patogenetické změny, které pomáhají vysvětlit heterogenitu MCL. Nálezy případů, které morfologicky a imunofenotypicky odpovídající MCL, avšak bez prokázané translokace t(11;14), reprezentují variantní formu tohoto onemocnění. Jejich existence byla potvrzena i čipovými studiemi. Tyto případy jsou stejné jako cyklin D1 pozitivní MCL a vykazují nadměrnou expresi buď cyklinu D2 nebo D3, které mohou nahradit nadměrnou expresi cyklinu D1 (23, 24). Byly však pozorovány i další translokace zahrnující gen BCL6 (3q27) nebo MYC locus (8q24) u MCL s agresivním klinickým průběhem. Nedávné studie metodou komparativní genomové hybridizace (arrayCGH) potvrdily výskyt nenáhodných přídatných ztrát a zmnožení chromozomů (25, 26). Byly pozorovány ztráty celých chromozomů Y, 13, 9, a 18, a zmnožení chromozomů 3 a 12. Zmnožení oblasti 3q, ztráty 9q, trizomie 12, komplexní změny a mutace TP53 jsou spojeny s nepříznivým klinickým průběhem (27-29). Nedávno provedené expresní analýzy ukázaly, že nadměrná exprese transkripčního faktoru SOX11 může být použita jako diagnostický marker MCL. Gen SOX11 je lokalizovaný na chromozomu 2p25 a patří do skupiny transkripčních faktorů, které se vážou k DNA a indukují velké konformační změny pro vazby dalších transkripčních faktorů. Bylo pozorováno, že zvýšená exprese SOX11 je spojena s agresivnější formou MCL, zatím co chybění exprese bylo pozorováno u indolentních forem MCL. Příčiny abnormální exprese nejsou zcela vysvětleny, ale mohou souviset s epigenetickou modifikací histonů (30, 31).
Folikulární lymfom (FL)
FL je geneticky charakterizován translokací t(14;18)(q32;q21) a přestavbou genu BCL2. Ačkoliv je tato translokace nalezena u 80–90 % FL, je také pozorována u 30 % DLBCL, a někdy i u lymfomu z malých lymfocytů (SLL). Vzácně se u FL vyskytuje variantní translokace s geny pro lehké řetězce kappa a lambda (IGK nebo IGL), t(2;18)(p12;q21) nebo t(18;22)(q21;q11.2), přičemž není stále zcela jasné, zda případy s variantní translokací mají stejný klinický průběh jako t(14;18) (32).
Translokace t(14;18) vede ke spojení genu IGH na chromozomu 14q32 s BCL-2 genem na chromozomu 18q21 během časného vývoje B buněk a jeho výsledkem je nadměrná exprese BCL2 proteinu, která vede k inhibici programované buněčné smrti a prodloužení přežití buněk (33-35). Translokace t(14;18) je často spojena s řadou sekundárních chromozomových aberací včetně komplexního karyotypu se změnami chromozomu: +X, add(1)(p36), 1q21, del(6q), +7, del(10)(q22–24), +12q, del(17p), +18 (36-40). Transformace nebo „progrese“ FL s nepříznivou prognózou je spojena se sekundárními změnami chromozomů 17p (TP53), 9p21 (CDNK2A), nebo 8q24 (MYC) (40–42).
2. Histopatologické prognostické faktory
Difuzní velkobuněčný lymfom (DLBCL)
Difuzní velkobuněčný B-lymfom (DLBCL) je histologicky charakterizován difuzní infiltrací lymfatických uzlin lymfoidními elementy různého typu, z nichž jsou odvozeny jednotlivé histologické varianty (WHO 2008) (43). Nejčastější je varianta centroblastická, kde dominují centroblasty s variabilní příměsí imuno-blastů. Méně častá je varianta imunoblastická (> 90 % imunoblastů v nádorové populaci), anaplastická a jiné. Imunohistochemicky nádorové buňky exprimují pan-B markery (CD19, CD20, CD22, CD79a), znak CD30 je přítomen především u anaplastické varianty DLBCL, CD5 je přítomen v 10 % případů. Pozitivita CD10, BCL6 a IRF4/MUM1 je variabilní.
Imunohistochemické markery spjaté s prognózou DLBCL
Dle celosvětově používané Klasifikace nádorů hemopoézy a lymfoidních tkání Světové zdravotnické organizace (WHO Classification of Tumours of Hematopoietic and Lymphoid Tissues) jsou znaky BCL2, IRF4/MUM1, cyklin D2, cyklin D3 spojeny s nepříznivou prognózou, na rozdíl od BCL6, CD10 a LMO2, jejichž exprese nádorovými buňkami je prognosticky příznivější (43). Důležitým imunohistochemickým markerem je BCL2, jehož zvýšená exprese (> 75 % nádorových buněk) je asociována s vyšší rezistencí na chemoterapii a horší prognózou. Koexprese BCL-2 a onkogenu C-MYC se označuje jako tzv. „double hit“ a vyděluje nemocné s mimořádně nepříznivou prognózou a rezistencí na terapii (44). Přítomnost vysoké proliferační aktivity měřené indexem Ki-67 je z prognostického hlediska sporná a jednotlivé práce se v hodnocení jejího prognostického významu značně liší.
GCB / non-GCB subtyp a jejich prognostický význam
Vzhledem k tomu, že expresní profilování genů (GEP) není možné v důsledku enormní technické náročnosti rutinně provozovat, je snaha nahradit GEP metodami využívající principy běžné imunohistochemie, které si kladou za cíl co nejtěsnější korelaci s výsledky GEP. Z hlediska imunofenotypu se dle WHO (2008) DLBCL dělí do 2 prognosticky odlišných skupin: germinal centre-like (GCB) a non-germinal centre-like (non-GCB). Doposud nejrozšířenější imunohistochemickou metodou v rámci diagnostiky DLBCL subtypů je algoritmus dle Hansové (45), který spočívá v detekci CD10 (v případě pozitivity nasvědčuje GCB subtypu), s následnou detekcí BCL6 (v případě negativity nasvědčuje non-GCB subtypu) a dále IRF4/MUM1 (obr. 1). Nevýhodou této metody je, že byla vyvinuta v éře před přidáním rituximabu k chemoterapii, což v současnosti, kdy je rituximab běžně používán a ovlivňuje biologickou povahu nádorového onemocnění, podstatně mění její výpovědní sílu. Klasifikace dle tohoto algoritmu je nyní dle mnoha studií zcela nekompatibilní s GEP a její prognostický význam se ztrácí, přesto je ale i nadále používána.
Obr. 1. Rozdělení subtypů DLBCL pomocí IHC: algoritmus dle Hansové (44). 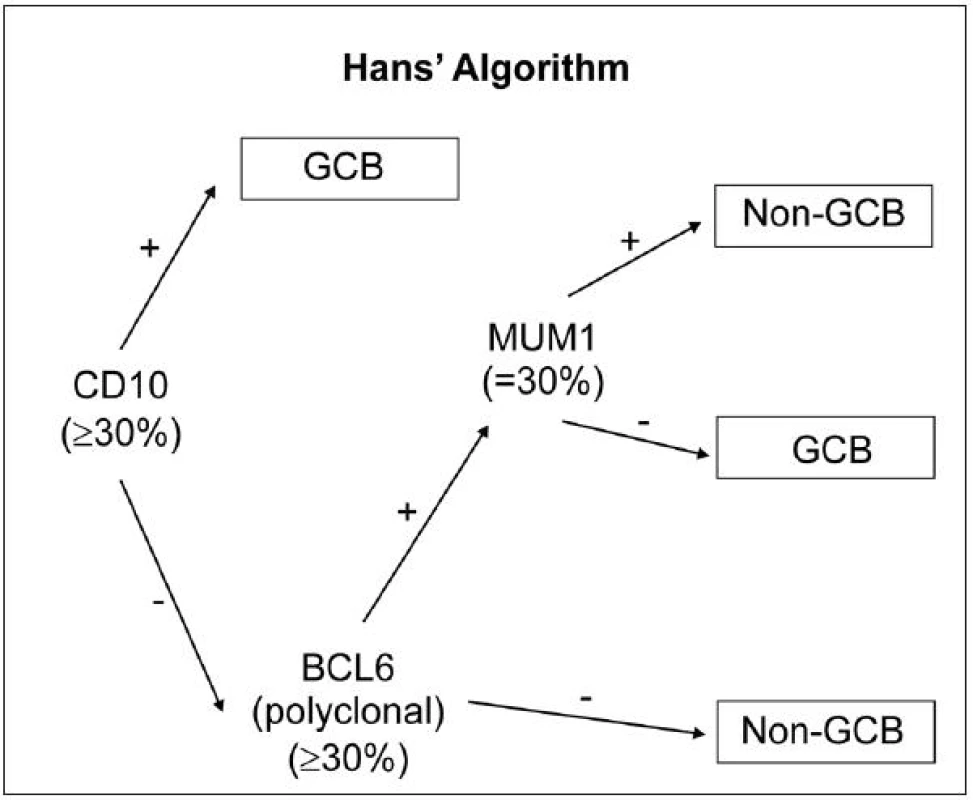
Méně často užívaným, avšak algoritmem podobným postupu dle Hansové, je metoda od kolektivu autorů Choi et al. (46), kteří použili navíc další proteiny (GCET a FOXP1). Přesnější se dle některých studií (47) zdá být skórovací metoda „Tally“ od kolektivu Meyer et al. (48) která vykazovala ve srovnání s uvedenými metodami vyšší kompatibilitu s GEP. Velmi dobrých výsledků v korelaci s GEP dosáhli v roce 2012 autoři Visco et al. (49), kteří ve své rozsáhlé studii na souboru pacientů léčených R-CHOP použili markery CD10, GCET1, FOXP1, BCL6 (obr. 2) a vytvořili algoritmy (za použití 3 nebo 4 markerů), u kterých byla shoda výsledku s GEP až v 92,8 %.
Obr. 2. Rozdělení subtypů DLBCL pomocí IHC: algoritmus dle Visco-Young (48). 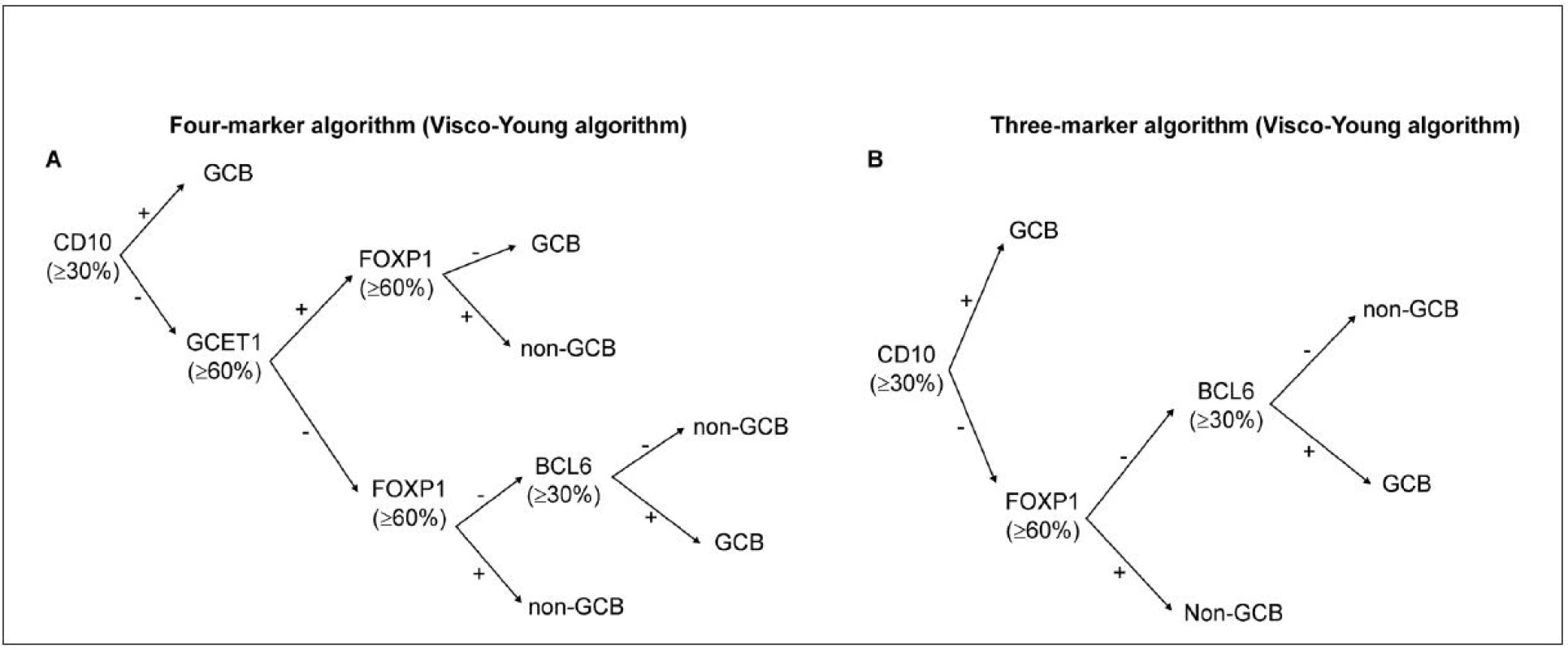
Obecně platí, že subtyp GCB a s ním spojené markery CD10, BCL6, GCET1 a LMO2 je spjat s lepší prognózou (signifikantně delší celkové přežití) než non-GCB subtyp, pro který je charakteristická pozitivita markerů IRF4/MUM1 a FOXP1. Ukazuje se, že FOXP1 pozitivních případů je signifikantně vyšší počet u non-GCB subtypu, dále že pozitivně koreluje s expresí BCL2 a u extranodální varianty DLBCL je spojen s horší prognózou (50). Nutno však dodat, že protilátky FOXP1, GCET1 a LMO2 zatím nejsou běžně v praxi používány, což je spojeno s možnými nesrovnalostmi v interpretaci výsledků, avšak jejich význam je nesporný.
Prognostický význam morfologických variant DLBCL
Fakt, že i v moderní době dosti opomíjená morfologie lymfomu může mít prognostický význam, prokázala v roce 2010 práce, pocházející od kolektivu autorů Ott et al. (51), která se na 949 pacientech léčených režimem R-CHOP zabývala prognostickým významem morfologie DLBCL se srovnání s dosud používaným algoritmem dle Hansové. Ve výsledcích překvapivě nebyl shledán téměř žádný prognostický význam imunohistochemických markerů CD5, CD10, BCL2, BCL6, HLA-DR, IRF4/MUM1 a ani algoritmu dle Hansové jako celku. Naopak, prognosticky významným faktorem je dělení DLBCL dle morfologie, kdy imunoblastická varianta DLBCL byla shledána jako faktor signifikantně zhoršující prognózu pacientů. Přesto však dle autorů hraje rozdělení na GCB a non-GCB subtyp významnou roli právě díky rozdílným molekulárním vlastnostem obou subtypů a možnosti vývoje cílené terapie.
Lymfom z buněk plášťové zóny (MCL)
MCL je histologicky tvořen monomorfní populací malých až středně velkých buněk s nepravidelnou karyomembránou, které mohou být uspořádány difuzně, méně často vágně nodulárně nebo mohou být omezeny pouze na oblast plášťové zóny (MCL in situ). Centroblasty a imunoblasty jsou ojedinělé. Zhruba 10–15 % případů MCL zaujímají blastoidní varianty, které jsou prognosticky méně příznivé (52). Tyto vznikají buď de novo, nebo progresí z běžného typu MCL a dělí se na variantu klasickou a pleomorfní. Klasická blastoidní varianta je složena z buněk připomínajících lymfoblasty, s vysokou mitotickou aktivitou (více než 10/10 HPF), místy bývá přítomen obraz hvězdného nebe. Pleomorfní blastoidní varianta je tvořena heterogenní buněčnou populací rovněž se zvýšenou mitotickou aktivitou. Morfologicky může připomínat DLBCL.
Imunohistochemicky jsou v nádorových buňkách MCL pozitivní markery CD5, pan-B markery (CD19, CD20, CD79a), CD43, BCL2 a téměř všechny případy exprimují i cyklin D1. V případě cyklin D1 negativity bývá přítomna aberantní exprese cyklinu D2 nebo D3. CD10 je obvykle negativní, popsány však byly i svízelné případy s pozitivitou CD10 a/nebo negativitou CD5.
Proliferační aktivita měřená indexem Ki-67 se ve většině případů pohybuje okolo 30–40 % nádorových buněk, u blastoidních variant však bývá velmi vysoká. Vysoká proliferační aktivita sama o sobě (cut off 40 % nebo 60 %) patří mezi prognosticky nepříznivé faktory. Mezi další imunohistochemicky detekovatelné znaky spojené s horší prognózou patří mutace proteinu p53 a p16.
Pro stanovení diagnózy MCL je rovněž nutný genetický průkaz translokace a t(11;14)(q13;q32), která je spojena s overexpresí cyklinu D1. Bohužel existují i případy MCL bez této translokace a bez imunohistochemického průkazu pozitivity cyklinu D1, které ale mají genetický profil obdobný jako klasické cyklin D1 pozitivní MCL a které nutí současnou diagnostiku posunout se o krok dál. Tento problém z podstatné části řeší objev transkripčního faktoru SOX11, který je exprimován u více než 90 % MCL včetně cyklin D1 negativních případů (53). Pozitivita SOX11 je dále pozorována u Burkittova lymfomu (cca 30 % případů), vlasatobuněčné leukemie a v některých nezralých lymfocytárních neoplaziích. Negativní bývá u většiny zralých B - i T-lymfomů, což je v rámci diferenciální diagnostiky důležité. Absence či nízká exprese SOX11 u MCL bývá spojena s indolentním průběhem tohoto lymfomu (54).
Folikulární lymfom (FL)
U folikulárního lymfomu dominuje převážně folikulární či nodulární uspořádání buněk vzhledu centrocytů a centroblastů. Parciální difuzní uspořádání bývá rovněž přítomno, ovšem s predominancí centrocytů. Pokud jsou v nálezu přítomny difuzní okrsky sestávající z velkých buněk blastického vzhledu, musíme odlišit transformaci v DLBCL.
Imunohistochemicky nádorové buňky exprimují pan-B markery (CD19, CD20, CD22, CD79a), dále BCL2, BCL6 a CD10. Markery CD5 a CD43 jsou obyčejně negativní.
Grading dle WHO (2008)
Histopatologický grading FL je důležitým prediktivním faktorem, ovlivňujícím prognózu pacientů (55). Rozlišujeme low-grade FL (grade 1 a 2) a high grade FL (grade 3). K rozlišení slouží stanovení absolutního počtu centroblastů v zorném poli při zvětšení 400x (HPF) v 10 nádorových foliklech. Ve výsledku 0–5 centroblastů/1 HPF je pokládáno za grade 1, 6–15 centroblastů/1 HPF je grade 2 a více než 15 centroblastů/1 HPF spadá pod grade 3. Dle přítomnosti centrocytů se grade 3 dále ještě dělí na grade 3A, kde jsou centrocyty v nádorových foliklech ještě přítomny a grade 3B, kde jsou nádorové folikly složeny téměř výhradně z blastických buněk (centroblastů, imunoblastů) a centrocyty zde chybí.
Proliferační index většinou koreluje s histologickým stupněm, ale existuje i podskupina morfologicky low-grade FL s vysokým proliferačním indexem Ki67 a s agresivnějším chováním, které odpovídá FL grade 3.
Další prognostické faktory FL
Výraznou roli, související s biologickým chováním a prognózou nádorového onemocnění, hraje nádorové mikroprostředí. Toto mikroprostředí je složeno z buněk imunitního systému, které interagují s buňkami nádoru na mnoha různých úrovních. Jednou z nich je interakce receptoru „programované buněčné smrti“ (Programmed-death, PD-1), který se běžně nachází na aktivovaných T - i B-lymfocytech či makrofázích, se svými ligandy (PD-L1, PD-L2), které jsou exprimovány nádorovými buňkami. Tato interakce má převážně inhibiční potenciál a je jedním z faktorů, které zajišťují nádorovým buňkám rezistenci před přirozenými imunitními mechanismy. Studie, jejíž autoři se věnovali přítomnosti a počtu PD-1 pozitivních T helper lymfocytů v nádorové tkáni u pacientů s nově diagnostikovaným folikulárním lymfomem prokázala, že počet těchto PD-1 pozitivních lymfocytů je prognosticky signifikantní (56). Konkrétně jde o množství PD-1 pozitivních lymfocytů nad 35,6 / 1 HPF, které je spjato s horší prognózou. PD-1 pozitivní T-helper lymfocyty byly stanoveny jako nezávislý prognostický rizikový faktor pro celkové přežití pacientů.
3. Solubilní prognostické faktory
Solubilní markery představují perspektivní prognostické faktory, protože jsou snadno vyšetřitelné, reprodukovatelné a technicky a cenově se jedná o nenáročná vyšetření. Limitem je nutnost stanovení optimálního dělícího bodu (cut off), tj. konkrétní hodnoty markeru s nejvyšší specificitou a senzitivitou pro predikovanou událost (relaps, úmrtí). Při aplikaci konkrétního solubilního faktoru na naši populaci musíme mít vždy na mysli, zda byl konkrétní faktor validován u stejné diagnózy a se stejnou hodnotou cut off.
Největšího rozšíření a validace v éře biologické léčby doznaly faktory reflektující velikost nádorové masy (beta-2-mikroglobulin) (4, 57–59), velikost proliferační frakce buněk (sérová thymidinkináza) (60, 61), postižení seróz (CA-125) (62) a nově také parametr korelující nejen s masou nádoru, ale také se stavem protinádorové imunity pacienta (solubilní IL-2 receptor) (63). Výše uvedené markery korelují s řadou klinických parametrů (stadium, masa nádoru) i výsledky konvenčních prognostických skóre a mají u konkrétních lymfomů nezávislý prediktivní význam. Role solubilních faktorů v éře biologické léčby je shrnuta v tabulce 3.
Tab. 3. Prognostický význam solubilních markerů v éře biologické léčby. 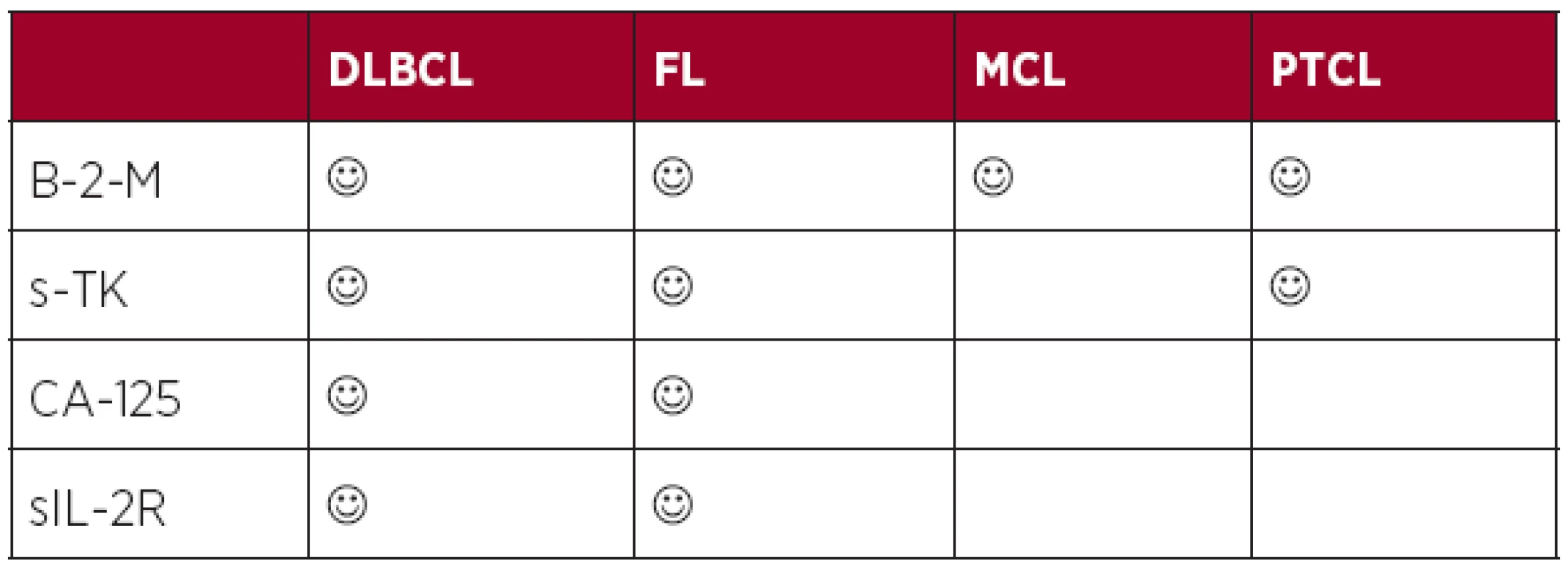
Legenda: DLBCL (difuzní B-velkobuněčný lymfom), FL (folikulární lymfom), MCL (lymfom plášťové zóny), PTCL (periferní T-buněčný lymfom), B-2-M (beta-2-mikroglobulin), s-TK (sérová thymidin kináza), sIL-2R (solubilní receptor pro interleukin-2) 4. Význam imunogenomiky a absolutního počtu lymfocytů
Polymorfismus Fc receptorů
Protilátkami zprostředkovaná buněčná cytotoxicita (Antibody-dependent cell cytotoxicity, ADCC) je zprostředkována efektorovými buňkami imunitního systému poté, co je navázán Fc fragment opsonizující protilátky (například rituximabu) nízkoafinitním receptorem pro imunoglobulin (FcγR). Rozlišujeme tři třídy imunoglobulinových receptorů: FcγRI, FcγRII, FcγRIII. Z uvedených subtypů má pro ADCC význam FcγRIIa (CD 32), který je exprimován na makrofázích a granulocytech a zejména pak FcγRIIIa (CD 16), který je přítomen na makrofázích a NK lymfocytech. Geny kódující Fc receptory jsou lokalizovány na 1. chromozomu a vykazují funkční alelický polymorfismus vedoucí k strukturní a tedy i funkční různorodosti kódovaných proteinů (receptorů). Nejvíce studovanou alelickou variantou je dimorfismus genu FCGR3A, kódující na pozici 158 aminokyselinu fenylalanin (FcγRIIIa-158F) nebo valin (FcγRIIIa-158V). Bylo prokázáno, že homozygotní forma FcγRIIIa obsahující valin, je schopna vázat molekulu IgG1 mnohem silněji než forma s fenylalaninem, což ve svém důsledku vede k větší degranulaci a tedy silnějšímu cytotoxickému účinku NK buněk (64).
Význam polymorfismu Fc receptorů v klinických studiích
Vztah mezi polymorfismem genu FCGR3A a léčebnou odpovědí na rituximab byl studován u pacientů s indolentními i agresivními lymfomy, a to jak v případě monoterapie anti-CD20 protilátkou, tak při použití chemoimunoterapie.
Guillaume Cartron s kolektivem (65) sledovali vztah mezi polymorfismem FCGR3A genu a léčebnou odpovědí na primoléčbu rituimabem u pacientů s folikulárním lymfomem. Pacienti s homozygotní formou FcγRIIIa-158V dosahovali signifikantně více kompletních i molekulárních remisí. Nezávislý prognostický vliv V/V homozygocie na dosažení léčebné odpovědi byl potvrzen i multivariantní analýzou.
Podrobnější analýzu faktorů podílejících se na aktivitě ADCC provedli Weng s kolektivem (66) na souboru 87 pacientů s folikulárním lymfomem. Kromě přínosu polymorfismu genů FCGR3A a FCGR2A byla na izolovaných nádorových buňkách studována i in vitro aktivita ADCC. Buněčná cytotoxicita byla vyšetřována pomocí radioizotopické metody – měřením uvolnění izotopu chromu (51Cr) ze značených nádorových buněk. Nebyl nalezen vztah mezi in vitro aktivitou ADCC a kvalitou léčebné odpovědi nemocných, případně mezi ADCC a expresí CD 20 molekuly na lymfomových buňkách. Vliv polymorfismu genů FCGR3A na kvalitu dosažené molekulární remise byl testován na souboru 34 nově diagnostikovaných nemocných s folikulárním lymfomem léčených prognosticky stratifikovanou chemoimunoterapií. Nebyl sice nalezen rozdíl mezi jednotlivými podskupinami co do četnosti dosažené molekulární remise, nicméně je zajímavé, že nemocní s homozygotní formou FcgammaRIIIa 158 F/F měli při diagnóze signifikantně vyšší FLIPI skóre než heterozygoti F/V a homozygoti FcgammaRIIIa 158 V/V (67). Recentně byl prokázán skupinou SWOG význam polymorfismu genů FCGR3A na celkové přežití nemocných s FL (SWOG). Tato práce však byla rozporována pro nejednotnost léčebných režimů a nedostatky ve statistické analýze (68).
Význam absolutního počtu lymfocytů u pacientů s agresivními lymfomy
Bezprostřední vliv na prognózu nemocných nemá pouze schopnost jejich cytotoxických buněk eradikovat nádorový klon, ale důležitou roli hraje také prostý absolutní počet lymfocytů při diagnóze.
Yasuhiro Oki a kolegové (69) zkoumali vyvážený soubor 221 nemocných s primodiagnostikovaným difuzním velkobuněčným B lymfomem léčených chemoterapií CHOP (n = 102) a R-CHOP (n = 119). Dospěli k závěru, že nízký počet lymfocytů při diagnóze (< 1,0x109/l) je nezávislý negativní prognostický faktor pro dobu do progrese nemoci i pro celkové přežití. Rituximab významně zlepšil prognózu právě ve skupině s lymfopenií. Nemocní s lymfopenií se navíc statisticky významně lišili ve vstupních parametrech rozsahu nemoci – častěji měli pokročilou chorobu, vyšší hladinu LDH, extranodální postižení lymfomem a tudíž i vyšší IPI.
Populaci 97 relabovaných, konvenčně léčených nemocných s DLBCL zkoumala skupina Luise F. Porraty (70). Multivariantní analýza prognostických faktorů přinesla řadu překvapení. Zatímco pro interval do progrese nemoci měl prediktivní význam počet lymfocytů (≥ 1,0 x 109/l), hodnota IPI v době relapsu, hladina LDH, provedení autologní transplantace a podání platinového salvážového režimu, délka celkového přežití byla predikovatelná pouze pomocí hodnoty počtu lymfocytů a LDH.
Tyto práce napovídají, že lymfocyty mají klíčovou úlohu jak v kontrole expanze tumoru při diagnóze, tak se významně podílejí svými cytotoxickými mechanismy na účinnosti chemoimunoterapie.
Závěr
Stanovení prognózy nemocného s maligním lymfomem představuje díky novým poznatkům stále přesnější cíl. Spolu s měnícími se léčebnými postupy a zlepšováním osudu nemocných je nezbytné pružně reagovat i novými prognostickými schématy. Cílem hematologa by měla být snaha o co nejpřesnější odhad vývoje onemocnění. Validní predikce nám umožní efektivní, riziku – uzpůsobenou terapii, která může zvrátit nepříznivý osud vysoce rizikových pacientů a na druhé straně umožní poskytnout méně intenzivní a toxickou terapii nízce rizikovým nemocným.
V běžné praxi se jako nejužitečnější jeví aplikace lymfom-specifického skóre doplněného o vyšetření jednoduchých histopatologických znaků a hladin běžně dostupných solubilních markerů. Metody cytogenetiky a molekulární biologie přinášejí zásadní poznatky o původu a biologii nádorové buňky a mají v řadě případů zásadní prognostický význam. Jejich použití je však omezeno technickou a finanční náročností a jejich vyhodnocení klade značné odborné nároky na molekulárně cytogenetický a klinický tým a je tedy limitováno na velká centra.
Jako perspektivní se jeví výzkum imunitní surveillance pacienta, která je klíčová pro kontrolu růstu tumoru i pro účinnost chemoterapie. V éře léčby monoklonálními protilátkami rozhoduje správná „kooperace“ exogenní protilátky a cytotoxických mechanismů nemocného o léčebném výsledku více, než kdykoliv dříve. Je možné, že vrozené dispozice nemocného (polymorfismy genů) povedou v budoucnu k tvorbě genom-specifických prediktivních a léčebných postupů, které budou reflektovat nejen genetickou různorodost nádorových buněk, ale také různorodost našich nemocných.
Tato práce byla podpořena výzkumným záměrem MŠMT - MSM 6198959205, grantem MZČR IGA NT 11103 a interním grantem LF UP LF-2013-004. Podpořeno MZ ČR – RVO (FNOL, IČ: 00098892)
Doručeno do redakce: 7. 1. 2012
Přijato po recenzi: 8. 4. 2013
MUDr. Vít Procházka, Ph.D.
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: vit.prochazka@fnol.cz
Zdroje
1. Bloomfield CD, Goldman A, Dick F, et al. Multivariate analysis of prognostic factors in the non-Hodgkin‘s malignant lymphomas. Cancer 1974; 33 : 870-9.
2. A predictive model for aggressive non-Hodgkin‘s lymphoma. The International Non-Hodgkin‘s Lymphoma Prognostic Factors Project. N Engl J Med 1993; 329 : 987-94.
3. Ziepert M, Hasenclever D, Kuhnt E, et al. Standard International Prognostic Index Remains a Valid Predictor of Outcome for Patients With Aggressive CD20+ B-Cell Lymphoma in the Rituximab Era. Journal of Clinical Oncology 2010; 28 : 2373-2380.
4. Solal-Céligny P, Roy P, Colombat P, et al. Follicular lymphoma international prognostic index. Blood. 2004; 104 : 1258-65.
5. Heilgeist A, McClanahan F, Ho AD, et al. Prognostic value of the Follicular Lymphoma International Prognostic Index score in marginal zone lymphoma: An analysis of clinical presentation and outcome in 144 patients. Cancer 2013; 119 : 99-106.
6. Hoster E, Dreyling M, Klapper W, et al. on behalf of German Low Grade Lymphoma Study Group (GLSG) and European Mantle Cell Lymphoma Network. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood 2008; 111 : 558-65.
7. Gallamini A, Stelitano C, Calvi R, et al. Intergruppo Italiano Linfomi. Peripheral T-cell lymphoma unspecified (PTCL-U): a new prognostic model from a retrospective multicentric clinical study. Blood 2004; 103 : 2474-9.
8. Sehn LH, Berry B, Chhanabhai M, et al. The revised International Prognostic Index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. Blood 2007; 109 : 1857–1861.
9. Oki Y, Yamamoto K, Kato H, et al. Low absolute lymphocyte count is a poor prognostic marker in patients with diffuse large B-cell lymphoma and suggests patients’ survival benefit from rituximab. Eur J Haematol 2008; 81 : 448-453.
10. Cox MC, Nofroni I, Ruco L, et al. Low absolute lymphocyte count is a poor prognostic factor in diffuse-large-B-cell-lymphoma. Leuk Lymphoma 2008; 49 : 1745-1751.
11. Alizadeh AA, Eisen MB, Davis RE, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature 2000; 403 : 503–11.
12. Rosenwald A, Wright G, Chan WC, et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma. N Engl J Med 2002; 346 : 1937–47.
13. Staudt LM, Dave S. The biology of human lymphoid malignancies revealed by gene expression profiling. Adv Immunol 2005; 87 : 163-208.
14. Bea S, Zettl A, Wright G, et al; Lymphoma/Leukemia Molecular Profiling Project. Diffuse large B-cell lymphoma subgroups have distinct genetic profiles that influence tumor biology and improve gene-expression-based survival prediction. Blood 2005; 106 : 3183-90
15. Huang JZ, Sanger WG, Greiner TC, et al. The t(14;18) defines a unique subset of diffuse large B-cell lymphoma with a germinal center B-cell gene expression profile. Blood 2002; 99 : 2285-2290.
16. Rosenwald A, Wright G, Chan WC, et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large B-cell lymphoma. NEJM 2002; 346 : 1937-1947.
17. Satterwhite E, Sonoki T, Willis TG, et al. The BCL11 gene family: involvement of BCL11A in lymphoid malignancies. Blood 2001; 98 : 3413-3420.
18. Offit K, Jhanwar SC, Ladanyi M, et al. Cytogenetic analysis of 434 consecutively ascertained specimens of non-Hodgkin‘s lymphoma: correlations between recurrent aberrations, histology, and exposure to cytotoxic treatment. Genes Chromosomes Cancer 1991; 3 : 189.
19. Bosga-Bouwer AG, Kok K, Booman M, et al. Array comparative genomic hybridization reveals a very high frequency of deletions of the long arm ofchromosome 6 in testicular lymphoma. Genes Chrom Cancer 2006; 45 : 976-81.
20. Offit K, Lo CF, Louie DC, et al. Rearrangement of the bcl-6 gene as a prognostic marker in diffuse large-cell lymphoma. N Engl J Med 1994; 331 : 74–80.
21. Pasqualucci L, Compagno M, Houldsworth J, et al. Inactivation of the PRDM1/BLIMP1 gene in diffuse large B cell lymphoma. JEM 2006; 203 : 315-317.
22. Steidl Ch, Shah SP, Woolcock BW, et al. MHC class II transactivator CIITA is a recurrent gene fusion partner in lymphoid cancers. Nature 2011; 471 : 377-383.
23. Fu K, Weisenburger DD, Greiner TC, et al. Cyclin D1-negative mantle cell lymphoma: a clinicopathologic study based on gene expression profiling. Blood 2005; 106 : 4315–21.
24. Yatabe Y, Suzuki R, Tobinai K, et al. Significance of cyclin D1 overexpression for the diagnosis of mantle cell lymphoma: a clinicopathologic comparison of cyclin D1-positive MCL and cyclin D1-negative MCL-like B-cell lymphoma. Blood 2000; 95 : 2253–61.
25. Bea S, Campo E. Secondary genomic alterations in non-Hodgkin’s lymphomas: tumor-specific profiles with impact on clinical behavior. Haematologica 2008; 93 : 641–5.
26. Vater I, Wagner F, Kreuz M, et al. GeneChip analyses point to novel pathogenetic mechanisms in mantle cell lymphoma. Br J Haematol 2009; 144 : 317–31.
27. Rubio-Moscardo F, Climent J, Siebert R, et al. Mantle-cell lymphoma genotypes identified with CGH to BAC microarrays define a leukemic subgroup of disease and predict patient outcome. Blood 2005; 105 : 4445–54.
28. Salaverria I, Zettl A, Bea S, et al. Specific secondary genetic alterations in mantle cell lymphoma provide prognostic information independent of the gene expressionbased proliferation signature. J Clin Oncol 2007; 25 : 1216–22.
29. Sander S, Bullinger L, Leupolt E, et al. Genomic aberrations in mantle cell lymphoma detected by interphase fluorescence in situ hybridization. Incidence and clinicopathological correlations. Haematologica 2008; 93 : 680–7.
30. Fernandez V, Salamero O, Espinet B, et al. Genomic and gene expression profiling defines indolent forms of mantle cell lymphoma. Cancer Res 2010; 70 : 1408–1418.
31. Vegliante MC, Royo C, Palomero J, et al. Epigenetic Activation of SOX11 in Lymphoid Neoplasms by Histone Modifications. PLoS One 2011; 6(6):e21382. doi: 10.1371/journal.pone.0021382.
32. Johansson B, Mertens F, Mitelman F. Cytogenetic evolution patterns in non-Hodgkin’s lymphoma. Blood 1995; 86 : 3905–14.
33. Tsujimoto Y, Finger LR, Yunis J, et al. Cloning of the chromosome breakpoint of neoplastic B cells with the t(14;18) chromosome translocation. Science 1984; 226 : 1097–9.
34. Zinkel S, Gross A, Yang E. BCL2 family in DNA damage and cell cycle control. Cell Death Differ 2006; 13 : 1351–9.
35. Letai AG. Diagnosing and exploiting cancer’s addiction to blocks in apoptosis. Nat Rev Cancer 2008; 8 : 121–32.
36. Dave BJ, Hess MM, Pickering DL, et al. Rearrangements of chromosome band 1p36 in non-Hodgkin’s lymphoma. Clin Cancer Res 1999; 5 : 1401–9.
37. d’Amore F, Chan E, Iqbal J, et al. Clonal evolution in t(14;18)-positive follicular lymphoma, evidence for multiple common pathways, and frequent parallel clonal evolution. Clin Cancer Res 2008; 14 : 7180–7.
38. Hoglund M, Sehn L, Connors JM, et al. Identification of cytogenetic subgroups and karyotypic pathways of clonal evolution in follicular lymphomas. Genes Chromosomes Cancer 2004; 39 : 195–204.
39. Tilly H, Rossi A, Stamatoullas A, et al. Prognostic value of chromosomal abnormalities in follicular lymphoma. Blood 1994; 84 : 1043–9.
40. Schwaenen C, Viardot A, Berger H, et al. Microarray-based genomic profiling reveals novel genomic aberrations in follicular lymphoma which associate with patient survival and gene expression status. Genes Chromosomes Cancer 2009; 48 : 39–54.
41. Bosga-Bouwer AG, Haralambieva E, Booman M, et al. BCL6 alternative translocation breakpoint cluster region associated with follicular lymphoma grade 3B. Genes Chromosomes Cancer 2005; 44 : 301–4.
42. Christie L, Kernohan N, Levison D, et al. C-MYC translocation in t(14;18) positive follicular lymphoma at presentation: an adverse prognostic indicator? Leuk Lymphoma 2008; 49 : 470–6.
43. Stein H, Warnke RA, Chan WC, et al. Diffuse large B-cell lymphoma, not otherwise specified. In: Swerdlow SH, Campo E, Harris NL. WHO Classification of Tumours of Hematopoietic and Lymphoid Tissues. 4th Edition. IARC: Lyon, 2008; 233-237.
44. Friedberg JW. Double-hit diffuse large B-cell lymphoma. J Clin Oncol. 2012; 30 : 3439-43.
45. Hans CP, Weisenburger DD, Greiner TC, et al. Confirmation of the molecular classification of difuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood 2004; 103 : 275-282.
46. Choi WW, Weisenburger DD, Greiner TC, et al. A new immunostain algorithm classifies diffuse large B-cell lymphoma into molecular subtypes with high accuracy. Clin Cancer Res 2009; 15 : 5494-5502
47. Hill BT, Sweetenham J. Clinical implications of the molecular subtypes of diffuse large B-cell lymphoma. Leuk Lymphoma 2012; 53(5): 763-769.
48. Meyer PN, Fu K, Greiner TC, et al. Immunohistochemical methods for predicting cell of origin and survival in patiens with diffuse large B-cell lymphoma treated with rituximab. J Clin Oncol 2011; 29 : 200-207.
49. Visco C, Li Y, Xu-Monette ZY et al. Comprehensive gene expression profiling and immunohistochemical studies support application of immunophenotypic algorithm for molecular subtype classification in diffuse large B-cell lymphoma: a report from the International DLBCL Rituximab-CHOP Consortium Program Study. Leukemia 2012; 26 : 2103-2113.
50. Yu B, Zhou X, Li B et al. FOXP1 expression and its clinicopathologic significance in nodal and extranodal diffuse large B-cell lymphoma. Ann Hematol 2011; 90 : 701-708.
51. Ott G, Ziepert M, Klapper W et al. Immunoblastic morfology but not the immunohistochemical GCB/nonGCB classifier predicts outcome in difuse large B-cell lymphoma in the RICOVER-60 trial of the DSHNHL. Blood 2010; 116 : 4916-4925.
52. Ioachim HL, Medeiros LJ. Mantle cell lymphoma. In: Ioachim HL, Medeiros LJ. Lymph Node Pathology. 4th Edition. Lippincott Williams & Wilkins: Philadelphia, 2009; 407-422.
53. Xu W, Li J. SOX11 expression in mantle cell lymphoma. Leuk Lymphoma 2010; 51(11): 1962-1967.
54. Vose JM. Mantle cell lymphoma: 2012 update on diagnosis, risk-stratification, and clinical management. Am J Hematol 2012; 604-609.
55. Harris NL, Swerdlow SH, Ott G. Follicular lymphoma. In: Swerdlow SH, Campo E, Harris NL. WHO Classification of Tumours of Hematopoietic and Lymphoid Tissues. 4th Edition. IARC: Lyon, 2008; 233-237.
56. Richendollar BG, Pohlman B, Elson P, Hsi ED. Follicular programmed death 1-positive lymphocytes in the tumor microenvironment are an independent prognostic factor in follicular lymphoma. Human Pathol 2011; 42 : 552-557.
57. Romaguera JE, Fayad LE, Feng L, et al. Ten-year follow-up after intense chemoimmunotherapy with Rituximab-HyperCVAD alternating with Rituximab-high dose methotrexate/cytarabine (R-MA) and without stem cell transplantation in patients with untreated aggressive mantle cell lymphoma. Br J Haematol. 2010; 150 : 200-8.
58. Milanovic N, Matkovic S, Ristic D, et al. Significance of tumor burden, vascular endothelial growth factor, lactate dehydrogenase and beta-2 microglobulin serum levels in advanced diffuse large B cell lymphoma. J BUON 2012; 17 : 497-501.
59. Sibon D, Fournier M, Brière J, et al. Long-Term Outcome of Adults With Systemic Anaplastic Large-Cell Lymphoma Treated Within the Groupe d‘Etude des Lymphomes de l‘Adulte Trials. J Clin Oncol 2012; 30 : 3939-46
60. Procházka V, Faber E, Raida L et al. High baseline serum thymidine kinase 1 level predicts unfavorable outcome in patients with follicular lymphoma. Leuk Lymphoma 2012 Jul; 53 : 1306-10.
61. Suzuki K, Terui Y, Nakano K, et al. High thymidine kinase activity is a strong predictive factor for poor prognosis in peripheral T-cell lymphoma treated with cyclophosphamide, adriamycin, vincristine and prednisone. Leuk Lymphoma 2012; 53 : 849-54.
62. Procházka V, Faber E, Raida L, Kapitáňová Z, Langová K, Indrák K, Papajík T Int J Hematol 2012; 96(1): 58–64. High serum carbohydrate antigen-125 (CA-125) level predicts poor outcome in patients with follicularlymphoma independently of the FLIPI score.
63. Goto N, Tsurumi H, Goto H, et al. Serum soluble interleukin-2 receptor (sIL-2R) level is associated with the outcome of patients with diffuse large B cell lymphoma treated with R-CHOP regimens. Ann Hematol. 2012; 91 : 705-14.
64. Dall´Ozzo S, Tarta S, Paintaud G, et al. Rituximab-dependent cytotoxicity by natural killer cells: infuence of FCGR3A polymorphism on the concentration-effect relationship. Cancer research 2004; 64 : 4664-4669.
65. Cartron G, Dacheux L, Salles G, et al. Therapeutic activity of humanized anti-CD20 monoclonal antibody and polymorphism in IgG Fc receptor FcγRIIIa gene. Blood 2002; 99 : 754-757.
66. Weng WK, Levy R. Two immunoglobulin G fragment C receptor polymorphisms independently predict response to rituximab in patients with follicular lymphoma. Journal Clin Oncol 2003; 21 : 3940-3947.
67. Prochazka V, Papajik T, Gazdova J, et al. FcγRIIIA receptor genotype does not influence an outcome in patients with follicular lymphoma treated with risk-adapted immunochemotherapy. Neoplasma 2011; 58(3): 263-70.
68. Persky DO, Dornan D, Goldman BH, et al. Fc gamma receptor 3a genotype predicts overall survival in follicular lymphoma patients treated onSWOG trials with combined monoclonal antibody plus chemotherapy but not chemotherapy alone. Haematologica 2012; 97 : 937-42.
69. Oki Y, Yamamoto K, Kato H, Kuwatsuka Y, et al. Low absolute lymphocyte count is a poor prognostic marker in patients with diffuse large B-cell lymphoma and suggests patients‘ survival benefit from rituximab. Eur J Haematol 2008 : 81(6): 448-53.
70. Porrata LF, Ristow K, Habermann TM, et al. Absolute lymphocyte count at the time of first relapse predicts survival in patients with diffuse large B-cell lymphoma. Am J Hematol 2008; 84(2): 93-97.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2013 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Diagnostika a léčba hemofilie
- XXVII. Olomoucké hematologické dny s mezinárodní účastí
- Clinical aspects and pathogenesis of congenital dyserythropoietic anemias: from morphology to molecular approach
- New autoimmune diseases after cord blood transplantation: a retrospective study of EUROCORD and the Autoimmune DiseaseWorking Party of the European Group for Blood and Marrow Transplantation
- Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique
- Safety and efficacy of eltrombopag for treatment of chronic immune thrombocytopenia: results of the long-term, open-label EXTEND study
- Extramedullary relapse of acute myeloid leukemia following allogeneic hematopoietic stem cell transplantation: incidence, risk factors and outcomes
- Characteristics and outcome of early-onset, severe forms of Wiskott-Aldrich syndrome
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Klinické a biologické prognostické faktory u maligních lymfomů
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
-
Standardy péče o nemocné s hemofilií
1. revize, vydání 2012
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
- Diagnostika a léčba hemofilie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



