-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMá stoletý stařík inzulin budoucnost?
Vyšlo v časopise: Svět praktické medicíny, 3, 2022, č. 1, s. 34-38
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Příznaky cukrovky, stejně jako její praktickou neléčitelnost popsali již v antice. Ze starého Říma nám dokonce zbyl i její správný název – diabetes mellitus. Všichni to vědí, ale přece jenom připomeňme, že v překladu to znamená „úplavice cukrová“. Takto antičtí lékaři pojmenovali nemoc, jejímiž hlavními projevy byla neuhasitelná žízeň, velký objem sladké moči (ano, ochutnávali moč pacientů), slabost, hubnutí a celkové chřadnutí organismu, které v krátké době vedlo ke smrti. Trvalo dvě tisíciletí, než díky pokrokům vědy a medicínského výzkumu bylo objeveno, že cukrovku lze léčit výtažkem ze slinivky břišní. Brzo poté byl objeven inzulin, jehož absolutní nebo relativní nedostatek způsobuje diabetes. Krátce nato (z dnešního pohledu v neuvěřitelné době několika měsíců) byl použit k léčbě psů s cukrovkou. 11. 1. 1922 byl po první dávce inzulinu zachráněn první lidský život.
Lidská paměť nepřesahuje dobu jedné až dvou generací. Tedy co se přihodilo před více než 20–40 roky, je vnímáno v populaci jako dávná historie nebo jako pohádky stařečků a stařenek. Sama o sobě tato skutečnost není nijak důležitá, vlastně tak trochu přispívá k pokroku lidstva. Asi je ale tak trochu důvodem vzniku památníků, pamětních dnů a připomenutí výročí událostí, které skutečně změnily historii. Jsme přesvědčeni, že protože se „ohlazují“ ostré obrysy vzpomínek, je správné stále připomínat, jak bychom žili, kdyby…
Trocha historických reminiscencí
První začátky léčby inzulinem byly krušné. Musel být podáván v injekcích (čemuž jsme se nevyhnuli do současnosti, i když se stále hledají i jiné cesty aplikace). Ale protože nebylo v té době možné molekulu získat jinak než ze slinivek hospodářských zvířat (skot a vepři), nebylo možné výtažek s obsahem inzulinu zbavit důkladně příměsí a nebylo možné molekuly inzulinu nijak upravit, byla léčba inzulinem v minulosti (a to ještě nedávné) něco jako rituál: 3–4× denně si nemocný nabrousil hrot injekční jehly, 20 minut vyvařil se skleněnou stříkačkou (aby zabránil přenosu infekce), pak si poměrně bolestivě aplikoval ze současného pohledu přibližnou dávku. Inzulin ale zbavil nemocné tíživých příznaků a zachraňoval jim život.
Nutnost aplikace nejméně třikrát denně vyplývala ze skutečnosti, že získaný animální inzulin se vstřebával ze subkutánního depa rychle, jeho poločas v krvi pak byl přibližně stejný jako u lidského inzulinu – 5–10 minut. Celkem logickým požadavkem pacientů bylo vytvoření takového typu inzulinu, který by udržel svou účinnost nejméně jeden den, což by vedlo k omezení počtu aplikací.
V té době ale nikdo neznal fyziologickou křivku sekrece inzulinu. Je vlastně logická – bazální sekrece, potřebná k udržení normálně fungujícího energetického metabolismu, a postprandiální – nutná ke zpracování potravou přijatých sacharidů a současně zamezující exkurzím postprandiální glykemie. Vyvinuté dlouhodobě účinné inzuliny, které výrazně zlepšovaly compliance pacientů (v 70. letech v Československu pod názvem DEP, INTERDEP a SUPERDEP), vedly ve své podstatě ke zhoršení kompenzace na jedné straně a na straně druhé k fixaci nutnosti rozvrhnout příjem sacharidů přibližně ve stejném množství do nejméně šesti jídel denně. Dlouhodobým zavádějícím memem, který zaplevelil názory na racionální diabetickou dietu, byla nutnost poskytnutí/požití druhé večeře i u pacientů, kteří nebyli léčeni inzulinem (ani glibenklamidem). Na důrazné požadavky hospitalizovaných si pamatujeme dobře.
Dalším významným krokem byl objev laboratorní metody, kterou bylo možné stanovit koncentraci inzulinu v plazmě (1958, Solomon Berson a Rosalyn Yalowová, poprvé využit princip radioimunoeseje). Krok za krokem byla navržena, otestována a do praxe zavedena koncepce intenzivní inzulinové terapie (IIT). Jejími úhelnými kameny byla:
1. aplikace inzulinu ve schématu bazál/bolus (Obr. 1) (bazální inzulin s prodlouženým účinkem suploval bazální sekreci, stejně jako bolusové dávky napodobovaly sekreci postprandiální),
2. selfmonitoring,
3. edukace,
4. kontrola výsledku glykovaným hemoglobinem.1
Obr. 1. Znázornění účinku inzulinu v režimu bolusů (zeleně) a bazálního inzulinu (modře) ve schématu intenzivní terapie inzulinem. 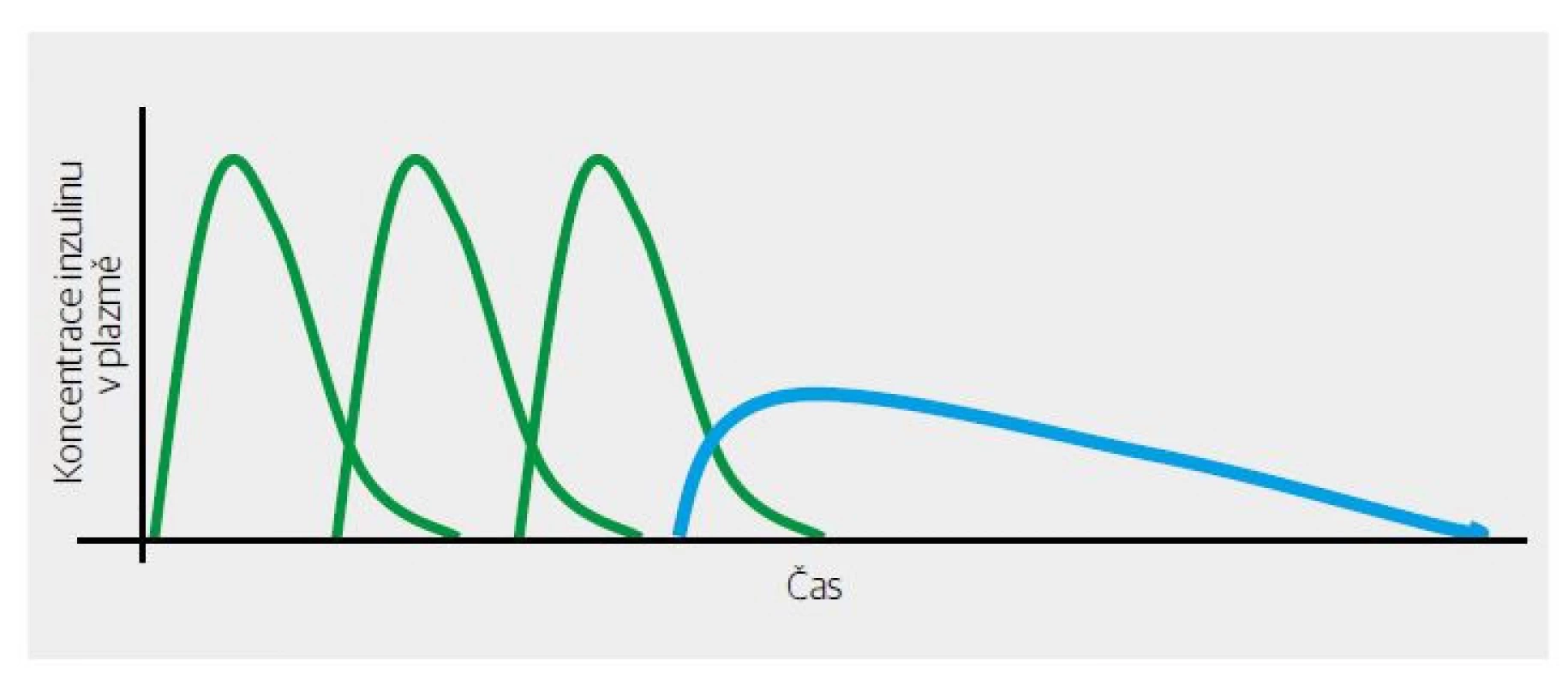
Koncepce IIT existovala, byla vytvářena paralelně s tím, jak se zlepšovaly možnosti purifikace extraktu obsahujícího inzulin z animálních pankreatů (jeden z autorů si dobře pamatuje, jakým pokrokem byly české PUR inzuliny a jakým snížením rizika lokálních reakcí bylo zavedení tzv. MC inzulinů). Navíc byly vytvořeny bifazické směsi (premixovaná směs krátkodobě a střednědobě účinného inzulinu), díky nimž nebylo nutné „míchat“ inzuliny pacientem ve stříkačce postupným natahováním. Některé údaje z té doby však říkají, že variabilita dávek inzulinu byla až 20–30 % (nepřesnost nataženého množství, nepřesnost vlastní aplikace…).
Medicína existuje pro pacienty, na což se začasto zapomíná. Pokud si vymyslíme cokoliv dobrého a nemocní to nepřijmou, pak jsme to dobře nevymysleli. I když koncepce IIT je svým způsobem dokonalá, protože je na jejím principu postavena i současná léčba diabetu 1. typu, nebyla by realizovatelná, pokud by se nepodařilo vyvinout inzulinové aplikátory známé jako inzulinová pera. Jednoduché ovládání, přesné dávkování, bezpečnost a prakticky nebolestivý vpich byly základními předpoklady, na nichž byla postavena compliance pacientů s tímto léčebným režimem. Nicméně vědecké průkazy potvrzující, že IIT zlepšuje kompenzaci a skrze tento efekt snižuje riziko zejména specifických komplikací (dlouhodobě i makrovaskulárních), přinesla zlomová studie DCCT2 a její prodloužení EDIC3. DCCT, krom potvrzení přínosu IIT, jako první prokázala, že platí logický předpoklad – těsná kompenzace diabetu je smysluplným počinem. Tak trochu to můžeme ze současného pohledu vnímat jako otevření cest pro vývoj nových postupů s cílem bezpečně normalizovat metabolickou odchylku, jíž se diabetes manifestuje.
Zlatá éra inzulinu
Zdálo se, že k ideálnímu stavu chybělo jenom mít k dispozici místo animálního humánní inzulin. Jedním z přízemních praktických důvodů byla i skutečnost, že křivka rostoucí spotřeby inzulinu projikovaná do budoucnosti se odpojila od reálných zdrojů (z poražených hospodářských zvířat). Biosyntézou, která ve své době byla ekvivalentem zázraku, bylo zažehnáno nebezpečí „inzulinové bídy“. Opět je třeba připomenout – nedostupnost inzulinu by znamenala v současnosti prakticky okamžitou smrt přibližně 80–100 tisíc osob pouze v České republice!
Průmyslová syntéza inzulinu měla i celkem nečekané dopady – například společnost Novo Nordisk prodala malou flotilu svých zaoceánských lodí, které ji (byvše vybaveny velkými mrazáky) umožňovaly v minulosti převážet z Jižní Ameriky do Evropy hluboce zmražený substrát coby surovinu, z níž byl získáván inzulin.
Medicína a technologický pokrok dosáhly dalšího stupně předpokládané dokonalosti: humánní inzulin vyráběný v neomezeném množství, koncepce intenzivní inzulinové terapie, bezpečné a přesné aplikátory a přesný selfmonitoring. Přesto, jak se záhy ukázalo, dokonalost byla jenom zdánlivá. Což si můžeme připomenout jako průvodní jev všech uskutečněných tužeb lidstva – s mírnou nadsázkou: nejhorší situace nastane, když se naplní sny o dokonalosti. Lidé zapomenou na klady, které jim přinesl pokrok, a jsou hluboce rozčarováni a nespokojeni s tím, že vidí ty „zásadní“ nedostatky, které pokrok ještě nevyřešil.
Analoga inzulinu – krok do budoucnosti
Realizace nápadů hraničících s genialitou bývá nevzácně zatížena překvapivými objevy. Až teprve jejich překonání vede k tolik očekávanému pokroku. Zvídavá mysl přemýšlivých výzkumníků neusnula na vavřínech (tak si to autoři textu představují) a zeptala se: Jestliže můžeme vyrobit humánní inzulin uměle, co kdybychom vyrobili lepší než lidský inzulin? Totiž ani humánní inzulin nedovedl zásadním způsobem přiblížit farmakodynamiku subkutánně aplikovaného „krystalického“ inzulinu byť jen vzdáleně parametrům inzulinu secernovaného do portálního oběhu (a to již vůbec nezmiňujeme, že po průtoku játry se utilizuje přibližně 50 % endogenního inzulinu – čemuž se subkutánní podání ani vzdáleně nemůže blížit).
Jistě, okolnosti vzniku inzulinových analog byly ve skutečnosti jiné, ale výsledek je dobře znám. První rychle účinkující analog inzulinu – lispro – byl na světě (Obr. 2). Výrazně se zkrátila doba nutná k dosažení vrcholného účinku, což dalo podnět k tezi (jak se následně ukázalo velmi eufemistické), že lze aplikovat těsně před jídlem. Pro pacienty to bylo ale velkým posunem v kvalitě života – nemusí myslet půl hodiny před jídlem na aplikaci inzulinu, nehledě na to, že oddálení jídla z jakéhokoliv důvodu výrazně zvyšovalo riziko hypoglykemie. A s trochou aproximace bylo v některých situacích možné aplikovat bolus až po jídle (výhoda v situacích, kdy se nedá odhadnout, kolik sacharidů nemocný požije – kupříkladu jsme této vlastnosti plně využívali na jednotce intenzivní metabolické péče při převádění z kompletní parenterální výživy na perorální příjem u diabetiků).
Obr. 2. Obecný rozdíl mezi farmakodynamikou/kinetikou krystalického humánního inzulinu (zeleně) a krátkodobě působícího inzulinového analoga (červeně). Bazální inzulin je znázorněn modře. 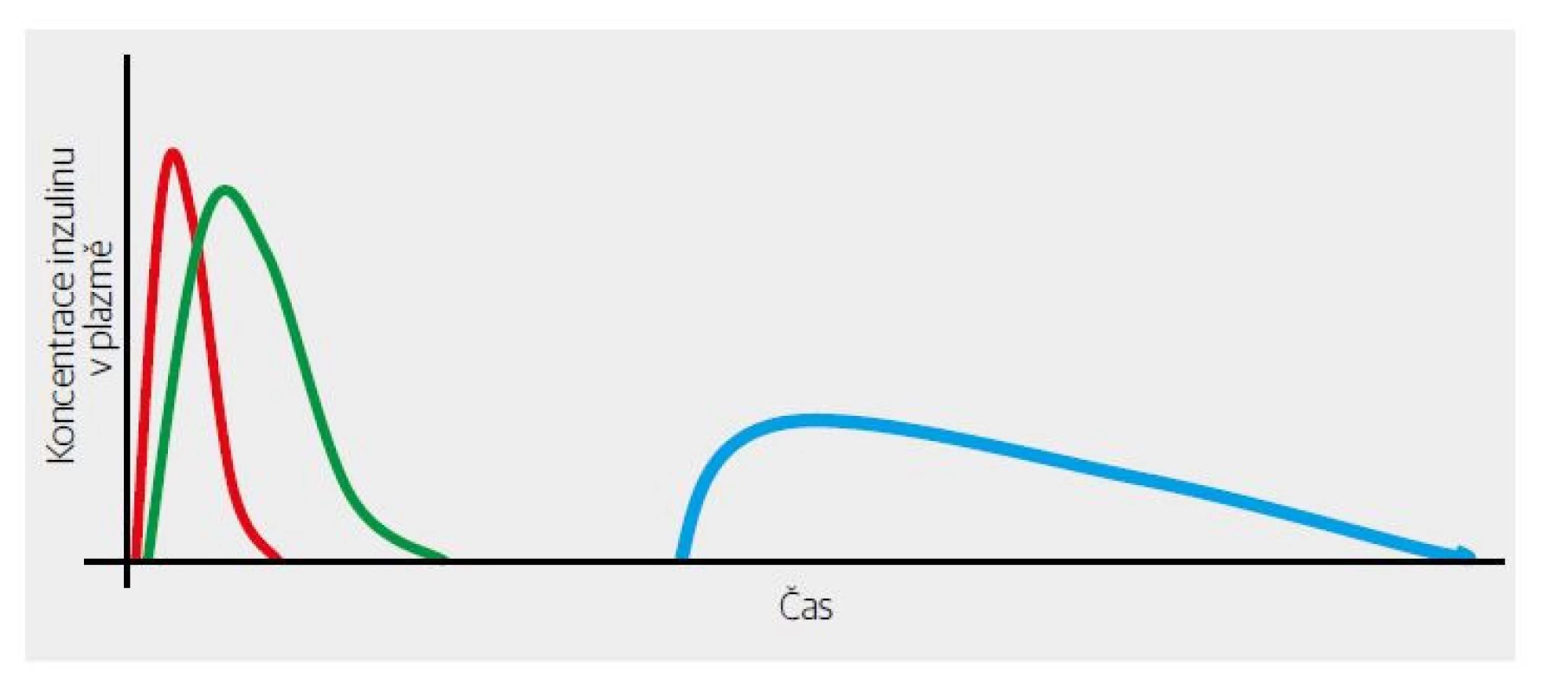
První výsledky RCT (randomizovaná kontrolovaná studie) byly nadějné – inzulin významně snížil postprandiální peak glykemie. Trochu rozčarováním byla skutečnost, že se nezlepšil glykovaný hemoglobin. Pro pochopení je třeba připomenout, že v té době převažoval NPH inzulin jako „noční“, tedy bazální. Ten ale zdaleka „netáhnul“ 24 hodin denně. Vymizení jeho účinku v druhé polovině dne, a zejména v pozdních odpoledních hodinách před večeří bylo vykryté dostatečně dlouhým účinkem k velkým jídlům aplikovaného bolusu „krystalického“ inzulinu, který účinkoval okolo 6 hodin (Obr. 1, 3). Provizorním řešením bylo doporučení aplikace NPH inzulinu i ráno (Obr. 4). Půvab předpokládané dokonalosti krátkodobě účinkujícího inzulinového analoga se tak setřel. Na druhé straně byl asi jedním z podnětů, které vedly k vývoji dlouhodobě účinných bazálních analog inzulinu (Obr. 5). Ty pro změnu změnily koncepci léčby diabetu 2. typu.
Obr. 3. Schematické zobrazení důvodu nutnosti aplikace dvou denních dávek NPH inzulinu při použití krátkodobě účinného inzulinového analoga. 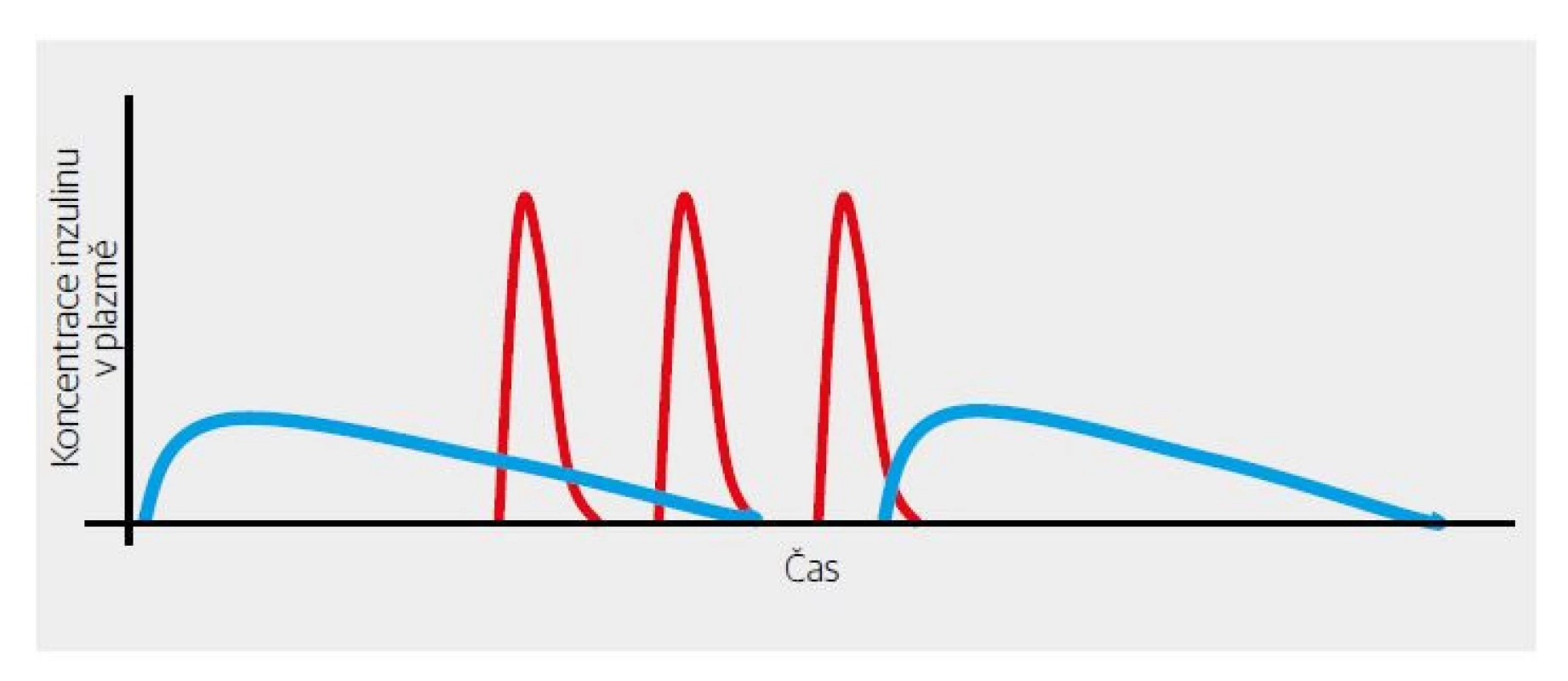
Obr. 4. Dostatečné substituce bazální sekrece inzulinu při využití krátkodobě účinných analog bylo možné dosáhnout pouze rozložením NPH inzulinu do dvou denních dávek. 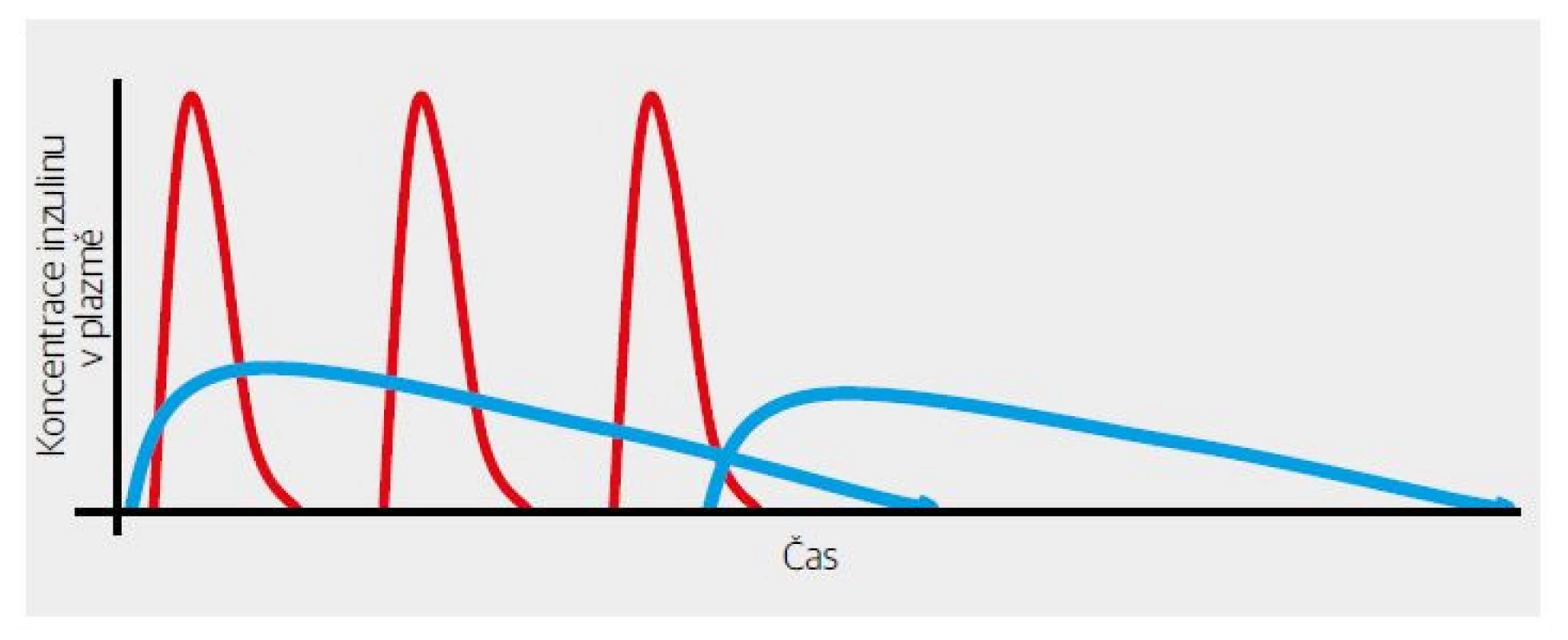
Obr. 5. Znázornění vykrytí chybějící bazální sekrece inzulinu využitím dlouhodobého a stabilního účinku bazálních analog. 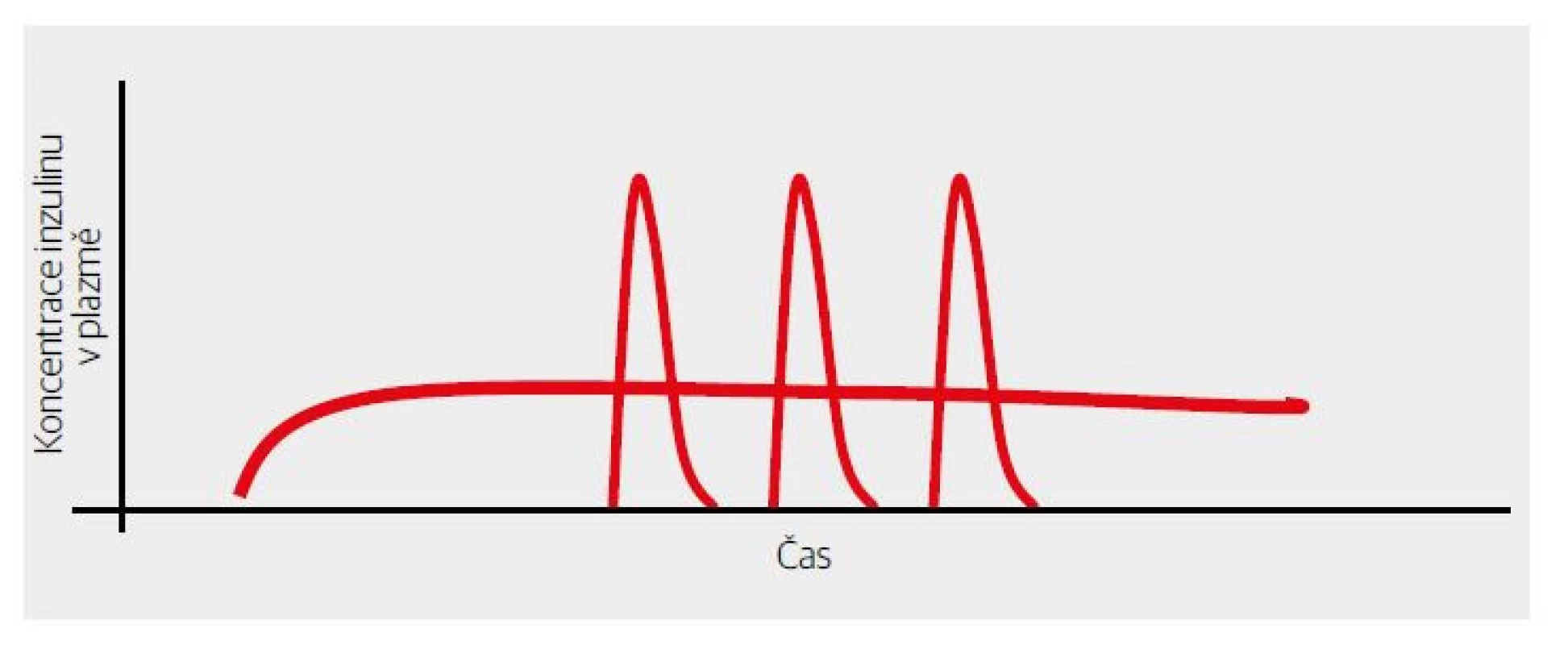
Hlavním hrdinou byl inzulin glargin. Jeho účinek přetrvával po celých 24 hodin. Prémií pak bylo snížení variability účinku a bezvrcholový průběh. Výsledkem bylo neuvěřitelné snížení rizika hypoglykemie. Dlužno však podotknout, že vykrytí celých 24 hodin bylo podmíněno dostatečně velkou dávkou inzulinu glargin (vyjádřeno v jednotkách/kg tělesné hmotnosti). V rozmezí nižších dávek se doba dostatečného efektu mírně zkracovala.
Jestliže IIT změnila základy terapie diabetu 1. typu, studie TTT (Treat to Target) změnila koncepci léčby diabetu 2. typu (což se týkalo celé koncepce terapie, nejen léčby inzulinem).4 Pacienti s diabetem 2. typu mají po delší dobu průběhu nemoci dostatečnou sekreci inzulinu, ale většinou současně významnou inzulinovou rezistenci. Jejím klinickým korelátem je typicky zvýšená glykemie nalačno. Do doby studie TTT byl obvyklý postup léčby inzulinem takovýto: inzulin jako ultimum refugium v situaci, kdy přetrvává nedostatečná kompenzace diabetu i přes vyčerpání možností změn v životosprávě a přes plné využití potenciálu terapie perorálními antidiabetiky. Lékař předepsal dávku, pacient oddaně poslechl. A takto se měnila dávka inzulinu při kontrolách. Možná důvodná obava z nespolupráce vedla k názoru, že pacient si sám měnit dávku inzulinu nesmí (naprostý opak situace při IIT, kdy pacient naopak upravuje sám dávkování inzulinu). Výsledky studie TTT řekly, že nejlepší první krok u většiny nemocných s diabetem 2. typu, kteří potřebují inzulin, je tzv. noční (bed time insulin, nověji bazální inzulin) inzulin (před spaním aplikovaný inzulin glargin). Současně postulovaly nový princip terapie diabetu 2. typu inzulinem: edukovaný pacient si sám titruje dávku inzulinu k dosažení cílové glykemie nalačno na základě selfmonitoringu. Do jisté míry tedy uvolňuje režim pacienta, „činí život flexibilnějším“, což je obzvláště potřebné při vědomí rostoucí nestability okolního světa.
Studie 4T pak prokázala (jako bazální analog byl použit inzulin detemir), že tento režim vede ke snížení rizika hypoglykemie a nejmenšímu vzestupu hmotnosti v porovnání s premixovanými inzuliny nebo s režimem postaveným pouze na bolusovém inzulinu před jídly.5
Po celou jednu generaci pak byla koncepce bazálního inzulinu cizelována, rozvíjena (režim bazál plus – doplnění o jednu dávku krátkodobě účinného analoga) a vylepšována.
Zdálo se, že si vybojovala „své místo na slunci“. A jak to tak bývá, člověk opojený úspěchy chce více a více. Ono požadované „více“ přinesla studie ORIGIN. Jak moc více, posuďte sami. Studie testovala hypotézu, která byla odvozena z menších klinických prací, které naznačovaly možnost, že včasná léčba inzulinem může zpomalit progresi diabetu (i oddálit přechod z prediabetu do diabetu). Současně v téže době rezonovala celou diabetologií myšlenka, že by důsledné zlepšení kompenzace k „normě“ mohlo být tím svatým grálem prevence kardiovaskulárních komplikací. Dovolíme si připomenout, že v tehdejší době nebyly jednoznačné důkazy, jež by dovolovaly potvrdit, který ze dvou názorů je správný. Jedni tvrdili, že inzulin je proaterogení (pro což důkazy existují), proto jej máme používat u diabetiků 2. typu pouze jako nouzové východisko. Druzí zastávali názor, že zlepšení kompenzace inzulinem sníží riziko kardiovaskulárních komplikací tak, že násobně převýší jeho případné proaterogení efekty. Zpětně se nám zdá, že asi nejrozumnější byla skupina těch, kterým to bylo jedno a používali kvalitní inzulin k ještě kvalitnější a bezpečné léčbě pacientů.
Velká studie (doposud největší RCT provedená s inzuliny, přes 12 000 osob) velmi zjednodušeně řekla toto: Léčba inzulinovým analogem glargin je bezpečná, nezvyšuje riziko kardiovaskulárních komplikací ani riziko vzniku malignit. Mírně až hraničně snižuje počet nových případů diabetu (téměř 12 % účastníků studie bylo ve fázi prediabetu).
Současný zlatý standard inzulinoterapie
Publikací výsledků studie ORIGIN se uzavřela cesta k novému etalonu léčby diabetu – racionální preference využití potenciálu analog s „vylepšenými“ vlastnostmi. U dlouhodobě účinných analog vyrovnaný (bezvrcholový) průběh nejméně 24 hodin s minimální variabilitou. Důsledkem bylo snížení rizika hypoglykemie a převedení zodpovědnosti za určení ideální dávky na pacienta (titrace, jejímž základem byla edukace). Poslední představitelé skupiny bazálních analog ještě dále zlepšují uvedené parametry (inzulin degludek a inzulin glargin 300). Kromě bezpečnosti pak „druhá“ generace bazálních analog inzulinu přinesla nebývalý komfort pro pacienty – inzulin degludek mohou aplikovat kdykoliv během dne (v případě, že pacient omylem zapomene dávku aplikovat, je menší riziko rychlého nástupu klinicky závažné hyperglykemie). Inzulin glargin 300 pak mohou aplikovat v rozmezí 6 hodin (jaká to úleva – dovedete si představit, že v běžném cvalu večera si museli vždy například přesně ve 22.00 aplikovat inzulin?).
U krátkodobě účinných analog se k inzulinu lispro přidal inzulin aspart a inzulin glulisin. Recentně pak byla zejména zkrácena doba nástupu a vrcholícího účinku od podání – inzulin fiasp, jehož vlastnosti víceméně dovolují aplikaci těsně před jídlem, tedy myšleno „s prvním soustem“ (podle SPC doslova: Fiasp je inzulin podávaný subkutánně v čase jídla [nejdříve 2 minuty před začátkem jídla]s možností podání nejdéle do 20 minut od začátku jídla – také je vám to naprosto jasné?). V souvislosti s „ultrarychlým“ inzulinovým analogem je třeba připomenout, že původní nadšení ze skutečnosti, že první analoga krátce působící je možné aplikovat těsně před jídlem, se ukázalo být spíše výsledkem toužebného očekávání ideálu podporovaného chytrým marketingem než odrazem reálné farmakodynamiky. V léčbě diabetiků 1. typu se stává fiasp standardem terapie různými podtypy inzulinových pump, které jsou často propojeny do zpětnovazebného okruhu se senzory. U diabetiků 2. typu pak můžeme volit mezi různými režimy (bazální analog, preprandiální inzulin, klasické premixované inzuliny). Nově pak nahrazuje režim bazal plus fixní kombinace inzulinu degludek s inzulinem fiasp. Z klinického pohledu jsou pro významnou část pacientů ideální fixní kombinace s agonisty receptoru pro GLP-1 (inzulin degludek s liraglutidem nebo inzulin glargin s lixisenatidem).
Výdobytky technického a technologického pokroku pro aplikaci inzulinu
Není třeba „vyvařovat“ injekce, protože inzulin lze dopravit do těla buď v jednorázových předplněných aplikátorech (inzulinová pera, která jsou skutečně jako trochu obéznější propisky, využívají složitě vyvinutých jehliček, jejichž vpich není vůbec cítit), anebo pomocí tzv. inzulinové pumpy – režim kontinuální subkutánní infuze inzulinu (CSII). Nově jsou propojeny se senzory, které monitorují kontinuálně glykemii a podle této hladiny upravují potřebnou dávku inzulinu. Jsou zabezpečeny četnými bezpečnostními pojistkami, takže ve výsledku lze bezpečně dosáhnout glykemie odpovídající zdravému člověku. V pokročilé fázi vývoje jsou i tzv. duální pumpy, které umožňují dávkovat jak inzulin, tak i glukagon.6 Pokroky v aplikaci technických a technologických úspěchů vedly po dlouhé době ke skutečně razantní úpravě „standardů“ terapie diabetu 1. typu, které publikovala ADA/EASD v polovině roku 2021.7
Budoucnost klepe na dveře
Který ze směrů dalšího vývoje inzulinu bude natolik přínosný, že bude dominovat v terapii inzulinem, je něco jako věštění z koule. Nové pokroky totiž častokrát vedou k objevu nejen nových skutečností, ale i k objevu nových překážek. Připomínkou budiž dva osudy zprvu nadějných objevů/postupů.
Pramlintid je analog amylinu.8, 9 Je stále registrován (a snad i občas používán) v USA. Jeho přínosem mělo být zejména zpomalení vyprazdňování žaludku s následným vylepšením účinku prandiálního bolusu krátkodobě účinného inzulinu.8 V době, kdy byla registrace pramlintidu na dohled, mu neseriózně podrazil nohy inzulin lispro. Bez nežádoucích účinků (bez nevolností) dokázal pozitivně ovlivnit postprandiální glykemii, snad i příznivěji. Rozdíl v ovlivnění hmotnosti nebyl pak významný.
Hlavní roli v druhé víceméně cimrmanovské slepé uličce hrálo využití al ternativních cest aplikace. Inhalační inzulin prokazoval také rychlejší nástup účinku, a opět mu do zad vpadl inzulin lispro. Navíc se objevilo nebezpečí (u rizikových podskupin pacientů) vzniku tumorů. K dosažení účinného efektu bylo nutno aplikovat vdechnutím stovky jednotek inzulinu (a tomuto množství byl vystaven epitel bronchiálního stromu a alveolů). Úplně mimo jsou praktické otázky, jako například: Jaký má vliv katar dýchacích cest na vstřebávání? Kolik bude stát terapie, když je třeba takové množství inzulinu?
Nicméně i jiné cesty aplikace jsou neustále testovány. Ideálem by bylo podávání per os (inzulin se dostane vrátnicovým oběhem přímo k místu svého primárního fyziologického efektu) nebo z hlediska jednoduchosti inzulin aplikovaný přes sliznici dutiny ústní.
Vedle slepých a nadějných cest jsou již některé „zázraky“ budoucnosti mezi námi. Snad nejblíže registraci je inzulin, který lze aplikovat jednou týdně (IcoDeg).10 Neznáme sice přesně zámysly výrobce, ale jeho fixní kombinace například se semaglutidem by zřejmě mohla nastolit nový etalon. Ve vzdálenější budoucnosti se rýsují obrysy „chytrého inzulinu“ (smart), jehož účinek by se v čase po aplikaci proměňoval tak, že by vždy koreloval s aktuální glykemií, byl by tedy glukózo-dependentní.11
Závěr
Sto let je dlouhá doba, léčba inzulinem se proměnila k nepoznání. Stále však u nemocných zůstává zachráncem života. V České republice je v současnosti životně závislých na léčbě inzulinem okolo 200 000 osob.
Samozřejmě, ani v současnosti není život závisející na inzulinu takový, jako má zdravý člověk. Ale od prvního podání inzulinu, prvního zachráněného života, medicína prošla neuvěřitelným pokrokem. Možná za dalších sto let bude zase někdo jiný vzpomínat, jaké to bylo v době, kdy se bez inzulinu nedalo žít, protože medicína bude umět vyřešit i dnes zdánlivě nemožné – jak přemluvit organismus, aby si sám nahradil produkci inzulinu, kterou z důvodu cukrovky ztratil.
Text byl připraven s podporou Diabetické asociace České republiky, z. s.
NPH inzulin
NPH inzulin (isophan, Neutral Protamin Hagedorn) patří mezi humánní inzuliny s prodlouženou dobou účinku (depotní inzuliny). Prodloužení jejich účinku proti krátkodobým inzulinům je dosaženo změnou fyzikálních a chemických vlastností přípravku, snížením rozpustnosti a zpomalením vstřebávání z podkoží, a to kombinací neutrálního inzulinu se zásaditou bílkovinou protaminsulfátem a malým množstvím zinku. NPH inzulin začíná účinkovat asi za 1–2 hodiny, vrcholí za 4–12 hodin a celková délka působení je 12–16 hodin. Používá se buď samostatně, nebo jako součást premixovaných inzulinů. Depotní NPH inzuliny jsou na rozdíl od čirých krátkodobých inzulinů zakalené (mléčné) a určené pouze pro podkožní (subkutánní) aplikaci. Nelze je aplikovat nitrožilně. [www.cukrovka.cz]
A jak je to vlastně s jednotkami inzulinu?
Organismus denně vytvoří 50 jednotek inzulinu. V současnosti jistě napadne zvídavé, kolik je to inzulinu vyjádřeného v jednotkách hmotnosti nebo, ještě přesněji, kolik je to vlastně molekul? Odpověď jednoduchá, z hlediska klinické medicíny je důležité vědět, co aplikované množství inzulinu dokáže, kolik molekul si pacient aplikoval, je celkem irelevantní. Protože inzulin aplikujeme pro snížení glykemie (záchranu života), a ne proto, že si odškrtneme, kolika molekulami jsme pacienta obšťastnili. Z tohoto základního důvodu je zřejmé, že je výhodné užívat tzv. mezinárodní jednotky (z angličtiny zkratka IU, dříve psáno I. U., nebo také m. j., resp. MJ). Mezinárodní jednotka (MJ) je měrná jednotka pro množství účinné látky, založená nikoli na hmotnosti, nýbrž na naměřeném biologickém působení nebo účinku. Užívá se ve farmakologii a v lékařství pro vitaminy, hormony, léky, vakcíny, krevní produkty a podobné biologické látky. Mezinárodní jednotka znamená pro každou látku jiné váhové množství, 1 MJ vitaminu A neváží stejně jako 1 MJ inzulinu. MJ pro různé látky definuje Výbor pro biologickou normalizaci Světové zdravotnické organizace (WHO). Ačkoli se mezinárodně užívají, nejsou součástí normovaných fyzikálních jednotek soustavy SI.12
Je zřejmé, že s pokrokem technologie purifikace se zvyšoval obsah aktivních molekul v jednotkovém objemu. Proto je vhodné připomenout, že jedna z původních definic IU byla tato: Jedna mezinárodní jednotka (IU) je množství inzulinu, které u králíka o hmotnosti 2 kg hladovějícího 24 hodin sníží glykemii ze 7,4 na 2,5 mmol/l. Později bylo odvozeno, že 1 MJ má stejný účinek jako 45,5 μg čistého krystalického inzulinu (1/22 mg přesně). Z tohoto důvodu je v SPC současně dostupných inzulinů vždy uvedeno, kolik IU je v objemové jednotce a kolik je to hmotnostních jednotek. Pro zvědavé slídily máme otázku: Kolik si myslíte, že potřebujete mikrogramů inzulinu detemir pro dosažení stejného efektu v porovnání s inzulinem NPH?
Nakonec, aby celá situace okolo jednotek inzulinu nebyla tak přehledně jednoduchá, si dovolíme ocitovat z jednoho SPC blíže neidentifikovatelného inzulinového analoga: „Účinnost inzulinových analog… se vyjadřuje v jednotkách, zatímco účinnost humánních inzulinů se vyjadřuje v mezinárodních jednotkách.“ Ano, pochopili jste dobře, UI je definovatelná v hmotnostních jednotkách, kdežto analoga asi v jednotkách účinnosti. Přiznejme si, z klinického pohledu je to skutečně celkem jedno. Není jednotka jako jednotka…
A protože máme v Evropě zatím volný pohyb osob, není od věci si připomenout, že kromě české zkratky MJ se běžně užívá i zkratka IU z anglického international unit, v němčině zkratka IE z Internationale Einheit a ve francouzštině UI z unité internationale.
prof. MUDr. Milan Kvapil, CSc., MBA
Geriatrická interní klinika 2. LF UK a FN Motol, Praha
MUDr. Lucie Břízová
Geriatrická interní klinika 2. LF UK a FN Motol, Praha
MUDr. Martina Nováková
Geriatrická interní klinika 2. LF UK a FN Motol, Praha
Zdroje
1. Andĕl M, Slabochová Z, Dryáková M, Andĕlová K, Vondra K, Bartoš V. Všeobecné zásady intenzifikované konvenční terapie cukrovky I. typu inzulinem. Vnitř Lék. 1987;33(6):475–85.
2. Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329 : 977–86.
3. DCCT/EDIC Research Group. The diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years: overview. Diabetes Care 2014;37(1):9–16.
4. Riddle MC, et al. The Treat-to-Target Trial. Diabetes Care 2003;26 : 3080–3086.
5. Holman RR, et al. Three-year efficacy of complex insulin regimens in type 2 diabetes. N Engl J Med 2009;361 : 1736–47.
6. Rylander D Jr. Glucagon in the artificial pancreas: supply and marketing challenges. J Diabetes Sci Technol 2015;9(1):52–5.
7. Holt RIG, et al. The management of type 1 diabetes in adults. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2021;44 : 2589–2625.
8. Hay DL, Chen S, Lutz TA, Parkes DG, Roth JD. Amylin: pharmacology, physiology, and clinical potential. Pharmacol Rev 2015;67(3):564–600.
9. https://en.wikipedia.org/wiki/Pramlintide.
10. Nishimura E, Pridal L, Glendorf T, Hansen BF, Hubálek F, Kjeldsen T, Kristensen NR, Lützen A, Lyby K, Madsen P, Pedersen TÅ, Ribel-Madsen R, Stidsen CE, Haahr H. Molecular and pharmacological characterization of insulin icodec: a new basal insulin analog designed for once-weekly dosing. BMJ Open Diabetes Res Care 2021;9(1):e002301.
11. Rege NK, Phillips NFB, Weiss MA. Development of glucose-responsive ‚smart‘ insulin systems. Curr Opin Endocrinol Diabetes Obes 2017;24(4):267–278.
12. https://cs.wikipedia.org/wiki/Mezinárodní_jednotka.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2022 Číslo 1- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- Úvodní slovo
- Pomáháme váhavým pacientům činit zdravá rozhodnutí o COVID-19
- Komentář k článku Pomáháme váhavým pacientům činit zdravá rozhodnutí o COVID-19
- Komentář k článku Pomáháme váhavým pacientům činit zdravá rozhodnutí o COVID-19
- Diagnóza prediabetu: prospěšná, nebo problematická?
- Komentář k článku Diagnóza prediabetu: prospěšná, nebo problematická?
- Diabetes mellitus a pandemie COVID-19
- Horší prognóza a vyšší úmrtnost u špatně kompenzovaných pacientů s diabetem v době pandemie COVID-19
- Má stoletý stařík inzulin budoucnost?
- Zjednodušení intenzifikované léčby biosimilárním inzulinem u starších pacientů
- Využití intermitentně skenované kontinuální monitorace glukózy v ambulantní praxi
- Hybridní systémy v léčbě a kontrole diabetu v období pandemie
- Využití empagliflozinu u kardiorenálního syndromu
- Inhibitory SGLT2 a chronické onemocnění ledvin
- Novější antidiabetika z pohledu nefrologa: zaměřeno na dapagliflozin
- Docentka Alena Šmahelová: Zhoršení kompenzace jde velmi často na konto toho, že ji pacient psychicky a mentálně nezvládá
- Dulaglutid v léčbě obézních diabetiků 2. typu
- Ambulantní předoperační příprava diabetika
- Dyslipidemie a diabetes
- Léčba obezity liraglutidem – praktické zkušenosti
- Používání přípravku Saxenda je u pacientů s tyreopatií bezpečné
- Diabetes a značení potravin Nutri-Score
- Terapie budoucnosti – mRNA technologie nejen jako prevence proti infekčním nemocem
- Lékový profil: Ryaltris
- Nové registrace na evropském poli
- Interpretace nejčastějších močových nálezů
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lékový profil: Ryaltris
- Interpretace nejčastějších močových nálezů
- Používání přípravku Saxenda je u pacientů s tyreopatií bezpečné
- Léčba obezity liraglutidem – praktické zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



