-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTerapie budoucnosti – mRNA technologie nejen jako prevence proti infekčním nemocem
Vyšlo v časopise: Svět praktické medicíny, 3, 2022, č. 1, s. 86-88
Kategorie: Medicína ve světě: aktuality
Redakčně zpracovala Jindra Moravcová
Souhrn
Rychlé pokroky v medicíně a vědě přinášejí mnoho změn a novinek v oblasti terapií a léčiv, a mění tak dosavadní možnosti léčby mnoha onemocnění. Asociace inovativního farmaceutického průmyslu zahájila edukační projekt Terapie budoucnosti, jehož cílem je seznamovat odbornou i laickou veřejnost s novými terapeutickými postupy a možnostmi, které se v blízké budoucnosti stanou běžně dostupnou realitou. V rámci tohoto projektu pokračuje ve spolupráci s ČLS JEP přednáškový cyklus pro odbornou veřejnost Nové léčebné principy a terapie. Další přednáška z tohoto cyklu byla věnována mRNA technologiím.
V rámci projektu pokračuje ve spolupráci s ČLS JEP přednáškový cyklus pro odbornou veřejnost Nové léčebné principy a terapie. Další přednáška z tohoto cyklu byla věnována mRNA technologiím. Jejich potenciál zdůraznil hned v úvodu přednášky Mgr. Jakub Dvořáček, LL.M., MHA, výkonný ředitel Asociace inovativního farmaceutického průmyslu (AIFP): „Máme mRNA technologie spojené především s očkováním proti onemocnění COVID-19, ale záběr těchto technologií je mnohem širší a jejich používání má velkou budoucnost. Není to jen technologie vhodná k prevenci a léčbě infekčních nemocí, ale bude se moci používat i u léčby nádorů a dalších onemocnění.“
Jaké možnosti mRNA technologie nabízí, upřesnil MUDr. Aleš Kmínek, člen výboru České společnosti pro farmakoekonomiku a hodnocení zdravotnických technologií: „Technologie mRNA používá informaci obsaženou v RNA k navození imunitní odpovědi příjemce. Tato informace vyvolává řetězec pochodů, na jehož konci dojde u příjemce ke tvorbě proteinu, který stimuluje imunitní systém k odpovědi na stejný nebo obdobný protein obsažený v infekčním patogenu anebo v patologické buňce. Vakcínu mRNA tak bude možné použít jak ke klasické vakcinaci coby prevenci, tak i jako léčbu, kde využíváme schopnosti spustit imunitní reakci proti definovanému antigenu. Příkladem může být antigen přítomný na povrchu nádorové buňky.“
Výhody mRNA vakcín
„Zjednodušený pohled na mechanismus účinku vakcinace říká, že jejím vlivem vznikají jednak protilátky a jednak cytotoxické T-lymfocyty, které kontrolují a léčí již probíhající infekci. Imunologové prominou, že se teď dopustím opravdu velkého zjednodušení, ale myslím, že je potřeba si to pořád připomínat: Protilátky mají hlavní vliv na prevenci infekce, buněčná imunita má hlavní vliv na již probíhající infekci. Mnohdy to v hustě popsaných textech a komplikovaných obrázcích vědeckých časopisů zaniká. A myslím, že je potřeba se k tomu vracet, protože to vysvětluje i mnohdy méně smysluplné debaty o významu protilátek po očkování,“ připomněl MUDr. Aleš Kmínek princip vakcinace a její společenský a ekonomický význam: „Je potřeba si neustále připomínat, že neexistuje nic, co by mělo takový vliv na snížení mortality a růst populace jako očkování. Další věc je, že vakcíny jsou ve srovnání s dalšími programy na podporu veřejného zdraví nákladově efektivní, většina vakcinačních programů má náklady nižší než 50 dolarů za jeden zachráněný život. Vakcinace je tedy po stovky let účinná a nákladově efektivní metoda, jak bojovat se zdravotními riziky.“
„Klasická vakcinace je účinná v prevenci závažných infekčních onemocnění. Jejich vývoj je však náročná záležitost, především časově. Pracuje se s živými organismy, jejich části je potřeba oslabit, vyčistit a udělat z nich preparát vhodný k podání. Nejsme často schopni reagovat na rychlý vývoj onemocnění, jenž je způsoben novými infekčními patogeny nebo patogeny, které rychle mutují. Proto je potřeba přemýšlet o nových vakcínách, jejichž vývoj může být rychlejší než u klasických vakcín.
Výzkum a vývoj mRNA vakcíny může trvat velmi krátkou dobu. Například vakcína proti mutovanému SARS-CoV-2 by mohla být připravena během několika týdnů,“ vyzdvihl MUDr. Kmínek jednu z hlavních předností mRNA vakcín.
Molekuly mRNA neovlivňují geny
Základem mRNA technologií je kyselina ribonukleová (RNA), která překládá informaci obsaženou v DNA do tvorby bílkovin. Známe tři základní druhy RNA: rRNA, která je součástí ribozomů, tRNA přenášející aminokyseliny pro tvorbu bílkovin a messenger RNA (mRNA), která přenáší genetickou informaci z DNA do ribozomů, kde se tvoří bílkoviny.
„Důležité je, že mRNA vakcína neobsahuje DNA. Objevuje se mnoho názorů, které říkají, že jde o genetickou manipulaci nebo manipulaci s genomem. Nejde o ni, protože DNA v tom prostě není. Vakcíny mRNA nevytvářejí žádné infekční částice v těle příjemce, jenom přenášejí informaci o té části patogenu, proti které je potřeba zapojit imunitní systém. Neintegrují se do genomu hostitelské buňky, takže jej neovlivňují. Mohou exprimovat proteiny in situ, aniž by musely překonávat obaly buněčného jádra, nepotřebují virový nosič,“ zdůrazňuje MUDr. Kmínek.
„Pokud používáte DNA jako terapeutickou molekulu, pak je důležité si uvědomit, že DNA musí proniknout do jádra, aby se mohla dále replikovat a aby z ní mohla vzniknout mRNA a následně protein. Výhoda mRNA spočívá v tom, že nemusí proniknout do jádra. Bariéra je tam jenom jedna, a to cytoplazmatická membrána. Takže stačí, že mRNA je dopravená do cytoplazmy, kde dojde k jejímu překladu do proteinu. A tento protein jako terapeutická molekula může udělat to, co udělat má. Další výhodou je, že neprovede žádné permanentní změny v genomu. Nenapáchá tedy žádné škody, protože genetickou informaci neupraví,“ upřesňuje Klára Granz Šašková, Ph.D., z katedry genetiky a mikrobiologie Přírodovědecké fakulty Univerzity Karlovy Praha.
Molekulu mRNA je nutné chránit
Molekulu mRNA je nutné opatřit ochranným obalem, protože nechráněná je velmi nestabilní. „Molekula mRNA v podstatě ihned podléhá hydrolýze, zejména v přítomnosti alkalických roztoků a ribonukleáz. Ty jsou všudypřítomné, například na povrchu rukou. Takže pokud mRNA chcete vyrobit, musíte to dělat za velmi přísných podmínek a pak uchovat při –80 °. Molekulu je potřeba ochránit a nějakým způsobem ji dostat do buněk,“ vysvětluje Klára Granz Šašková a popisuje blíže lipidické nanočástice, které se v dostupných vakcínách na ochranu molekul používají a zároveň slouží k doručení RNA na místo účinku. „Bez toho by mRNA do buněk zkrátka neprošla. Bavíme se o lipidových nanočásticích, které jsou velké desítky nanometrů. Umíme ty nanočástice navrhnout tak, aby přesně řídily, kde bude aktivní farmaceutická složka k dispozici. Lipidické nanočástice (LNPs) jsou momentálně nejpokročilejší nevirový systém pro doručování nukleových kyselin. Bezpečně a efektivně doručují nukleové kyseliny a umožňují tak použití genové medicíny. Jejich výhodami jsou vysoká účinnost enkapsulace (zapouzdření) nukleových kyselin a jejich ochrana, vysoká transfekce do tkání a buněk, nízká toxicita a dobrá snášenlivost.“
Koncept mRNA
Koncept mRNA vakcíny je jednoduchý a obsahuje několik kroků:
1. Identifikace cílového patogenu (např. SARS-CoV-2).
2. Identifikace cílového antigenu (např. SARS-CoV-2 spike protein, který je zodpovědný za to, že se virus naváže na lidské buňky).
3. Sekvenování genu pro cílový antigen.
4. Syntéza genu pro cílový antigen.
5. Klonování genu do plazmidové DNA (pDNA) – probíhá ex vivo, neděje se v těle příjemce, ale v laboratoři.
6. Přepis do mRNA in vitro a následné čištění – odstraňují se reakční komponenty včetně enzymů, reziduální DNA, nekompletní RNA, aberantní dvouvláknová RNA (dsRNA).
7. Dopravení mRNA do těla příjemce – molekulu mRNA je nutné doplnit ochranným obalem (kationické lipidy, polyetylenglykol, cholesterol nebo lipidické nanočástice jako v případě vakcíny proti COVID-19). Dopravení do těla příjemce probíhá jako u ostatních léků intradermálně, intramuskulárně, podkožně, nazálně, do uzlin, do sleziny, intravenózně, do nádoru.
8. Využití hostitelových mechanismů k výrobě proteinu (antigenu) podle mRNA informace. V antigen prezentující buňce se aktivují RNA senzory spouštějící reakci, na jejímž konci je vytvořený spike protein. Ten buňka prezentuje na svém povrchu společně s kostimulačními molekulami tak, aby nabídla imunitnímu systému protein vytvořený na základě RNA informace. Imunitní systém ho poznává jako něco, proti čemu by měl reagovat. Molekula mRNA stimuluje tytéž mechanismy, jako kdybychom se setkali s virem.
9. Navození buněčné a humorální imunity proti antigenu vyrobenému podle mRNA informace. Spike protein prezentovaný na povrchu dendritické (antigen prezentující) buňky spolu s kostimulačními molekulami vyvolává aktivaci naivních T-lymfocytů. Ty se diferencují na T-lymfocyty cytotoxické, pomocné, paměťové a T-lymfocyty folikulární pomocné, které aktivují B-lymfocyty k přeměně na plazmatické buňky vylučující protilátky a na B-lymfocyty paměťové.
Obr. 1. Lipidické nanočástice – mechanismus účinku. 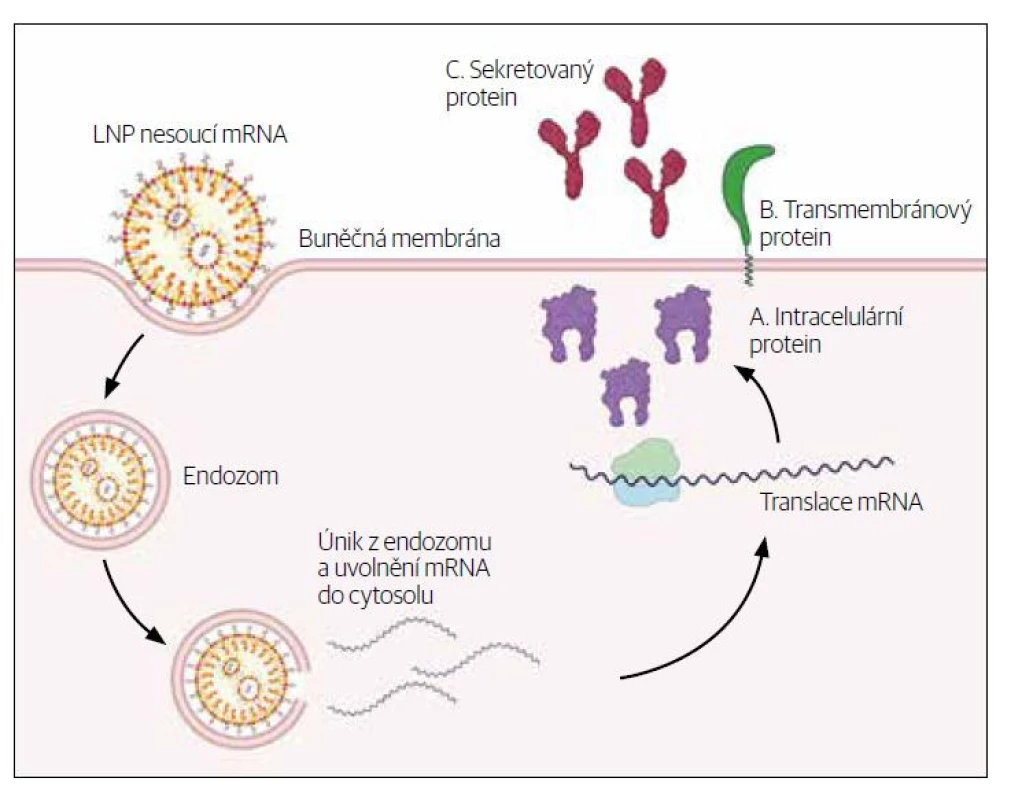
Obr. 2. Navození buněčné a humorální imunity proti antigenu vyrobenému podle mRNA informace. 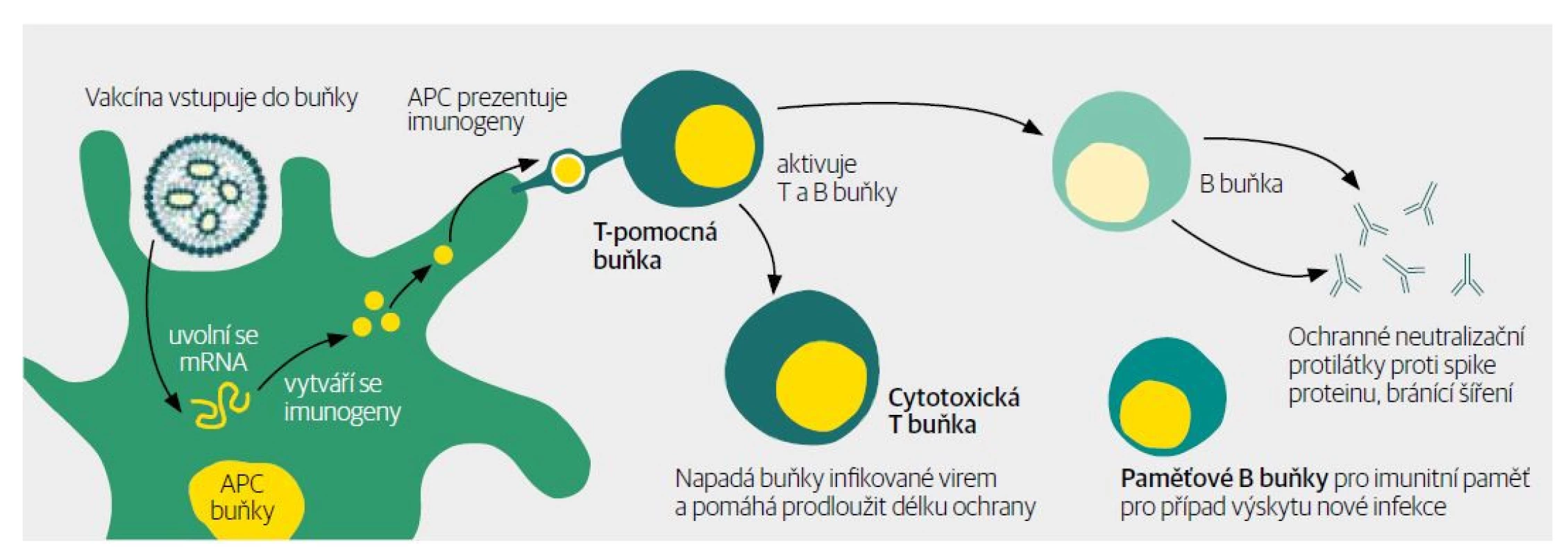
Pozn.: APC buňky – antigen prezentující buňky Výsledkem očkování mRNA vakcínou jsou cirkulující specifické protilátky proti danému antigenu, paměťové T-lymfocyty a B-lymfocyty připravené zasáhnout proti danému antigenu při opakovaném setkání.
Budoucnost mRNA technologií
Jak už bylo zmíněno, mRNA technologie bude možné využívat nejen v prevenci infekčních onemocnění. V budoucnu se uvažuje o sebereplikujících se vakcínách, které jsou založeny na upraveném genomu jednovláknových RNA virů, základem pro replikaci je tu virový nosič. Virové strukturální geny jsou nahrazeny geny pro antigen, který má vyvolat imunitní odpověď. Výhodou těchto vakcín je vysoká produkce cílového antigenu při použití velmi malého množství vakcíny. To znamená zvýšení toho žádoucího účinku při snížení potenciálních nežádoucích účinků.
Jsou vyvíjeny mRNA vakcíny i proti dalším infekčním onemocněním – chřipka, HIV, cytomegalovirus, zika, ebola, toxoplasmóza, vzteklina, malárie, RSV a jiné.
Další možností využití mRNA technologií jsou vakcíny, které mohou produkovat monoklonální protilátky in vivo. V tomto směru zatím probíhají pokusy na zvířecích modelech, ale zdá se, že by mohly fungovat a měly by uplatnění jak pro pasivní imunizaci, tak pro terapeutické účely. Teoreticky by bylo možné všechna onemocnění, u kterých se používají monoklonální protilátky (nádory, autoimunitní onemocnění), léčit pomocí mRNA technologií.
Co je ale největší oblastí zájmu, to je tvorba mRNA vakcín proti nádorovým onemocněním. „Tady bude lepší hovořit o mRNA technologii, abychom nevytvářeli dojem, že by bylo možné mRNA vakcínami očkovat jako prevenci proti těmto nádorovým onemocněním. Je potřeba si přiznat, že akcelerace toho vývoje je mimo jiné způsobena covidem. Je to takový pozitivní účinek pandemie, která tuto technologii vytáhla na výsluní,“ konstatuje MUDr. Kmínek.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2022 Číslo 1- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- Úvodní slovo
- Pomáháme váhavým pacientům činit zdravá rozhodnutí o COVID-19
- Komentář k článku Pomáháme váhavým pacientům činit zdravá rozhodnutí o COVID-19
- Komentář k článku Pomáháme váhavým pacientům činit zdravá rozhodnutí o COVID-19
- Diagnóza prediabetu: prospěšná, nebo problematická?
- Komentář k článku Diagnóza prediabetu: prospěšná, nebo problematická?
- Diabetes mellitus a pandemie COVID-19
- Horší prognóza a vyšší úmrtnost u špatně kompenzovaných pacientů s diabetem v době pandemie COVID-19
- Má stoletý stařík inzulin budoucnost?
- Zjednodušení intenzifikované léčby biosimilárním inzulinem u starších pacientů
- Využití intermitentně skenované kontinuální monitorace glukózy v ambulantní praxi
- Hybridní systémy v léčbě a kontrole diabetu v období pandemie
- Využití empagliflozinu u kardiorenálního syndromu
- Inhibitory SGLT2 a chronické onemocnění ledvin
- Novější antidiabetika z pohledu nefrologa: zaměřeno na dapagliflozin
- Docentka Alena Šmahelová: Zhoršení kompenzace jde velmi často na konto toho, že ji pacient psychicky a mentálně nezvládá
- Dulaglutid v léčbě obézních diabetiků 2. typu
- Ambulantní předoperační příprava diabetika
- Dyslipidemie a diabetes
- Léčba obezity liraglutidem – praktické zkušenosti
- Používání přípravku Saxenda je u pacientů s tyreopatií bezpečné
- Diabetes a značení potravin Nutri-Score
- Terapie budoucnosti – mRNA technologie nejen jako prevence proti infekčním nemocem
- Lékový profil: Ryaltris
- Nové registrace na evropském poli
- Interpretace nejčastějších močových nálezů
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lékový profil: Ryaltris
- Interpretace nejčastějších močových nálezů
- Používání přípravku Saxenda je u pacientů s tyreopatií bezpečné
- Léčba obezity liraglutidem – praktické zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



